- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
水稻MEP途径的前两种酶DXS和DXR在类胡萝卜素代谢中的器官特异性差异作用gydF4y2Ba栽培稻gydF4y2Ba叶子和种子gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba,文章号:gydF4y2Ba167gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
脱氧木质素5-磷酸合成酶(DXS)和脱氧木质素5-磷酸还原异构酶(DXR)是催化甲基赤藓糖醇4-磷酸(MEP)途径的前两个酶步骤,以提供类胡萝卜素的异戊二烯构建块的酶。据报道,植物DXR和DXS酶的功能因植物种类而异。在本研究中,水稻的不同作用gydF4y2BadxgydF4y2Ba而且gydF4y2BaDXRgydF4y2Ba研究类胡萝卜素代谢相关基因。gydF4y2Ba
结果gydF4y2Ba
共表达水稻种子中类胡萝卜素的积累gydF4y2BaOsDXS2gydF4y2Ba而且gydF4y2BastPACgydF4y2Ba相对于gydF4y2BastPACgydF4y2Ba与非转基因(NT)种子相比,转基因种子的高表达量为315.3倍gydF4y2BaOsDXS2gydF4y2Ba或gydF4y2BaOsDXRgydF4y2Ba对叶片和种子中类胡萝卜素和叶绿素的积累均无积极影响,表明OsDXS2是一种为种子类胡萝卜素代谢提供IPP/DMAPPs的限速酶,而OsDXR在叶片和种子中均无作用。的表达gydF4y2BaOsDXS1gydF4y2Ba,gydF4y2BaOsPSY1gydF4y2Ba,gydF4y2BaOsPSY2gydF4y2Ba,gydF4y2BaOsBCH2gydF4y2Ba叶片中叶绿素和类胡萝卜素含量减少时,基因均上调;然而,尽管水稻种子中类胡萝卜素的含量增加了315.3倍,但大多数胡萝卜素基因的表达没有显著变化。这些在叶片和种子中的非比例表达模式表明,这些代谢变化与类胡萝卜素的过度表达有关gydF4y2BaOsDXS2gydF4y2Ba,gydF4y2BaOsDXRgydF4y2Ba而且gydF4y2BastPACgydF4y2Ba对于这些代谢改变来说,转基因和中间生物合成酶的能力可能比中间生物合成基因的转录水平更重要。综上所述,我们提出了以限速酶OsDXSs、OsPSYs和OsBCHs为“水龙头”,以中间代谢产物的生物合成能力为“水箱”,以类胡萝卜素积累量为“水箱”含量的“三水龙头-水箱模型”。gydF4y2Ba
结论gydF4y2Ba
我们的研究表明,OsDXS2作为一种向种子-类胡萝卜素积累提供IPP/DMAPPs的限速酶发挥了重要作用,在没有显著的生胡萝卜素基因转录改变的情况下,水稻种子类胡萝卜素代谢可以得到很大程度的提高。最后,用“三水龙头和水箱模型”解释了水稻种子类胡萝卜素的代谢过程。gydF4y2Ba
背景gydF4y2Ba
植物萜类化合物是最多样化的次生代谢产物,参与基本功能,如光合作用(类胡萝卜素、叶绿素和苯壬基醌)、生长发育调节(细胞分裂素、赤霉素、脱落酸和独尾金内酯)、呼吸作用(泛醌),以及对环境条件作出反应的次生作用[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].此外,大量萜类化合物已广泛应用于工业或医药领域,如香料、颜料、聚合物或药物[gydF4y2Ba3.gydF4y2Ba].萜类化合物是由异戊烯焦磷酸盐(IPP, CgydF4y2Ba5gydF4y2Ba)和焦磷酸二甲基烯丙基(DMAPP, CgydF4y2Ba5gydF4y2Ba),通过质体中的甲基赤藓糖醇4-磷酸(MEP)途径和细胞质中的甲戊酸(MVA)途径[gydF4y2Ba3.gydF4y2Ba].在第一步中,丙酮酸(CgydF4y2Ba3.gydF4y2Ba)和3-磷酸甘油醛(GAP, CgydF4y2Ba3.gydF4y2Ba)从糖酵解得到的缩合成5-磷酸脱氧木质素糖(DXP, CgydF4y2Ba5gydF4y2BaDXP合成酶(DXS), DXPs随后转化为MEP (CgydF4y2Ba5gydF4y2Ba)由DXP还原异构酶(DXR) [gydF4y2Ba4gydF4y2Ba].gydF4y2Ba
植物gydF4y2BadxgydF4y2Ba而且gydF4y2BaDXRgydF4y2Ba据报道,基因在萜类代谢中起着物种或器官特异性的作用。在拟南芥中,AtDXS和AtDXR均作为速率限制酶,提高叶片类胡萝卜素和叶绿素含量[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba],但它们的功能因植物种类而异。例如,任意一种的异源表达gydF4y2BaAtDXSgydF4y2Ba或gydF4y2BaAtDXRgydF4y2Ba增加了枞烷二萜(CgydF4y2Ba20.gydF4y2Ba)gydF4y2Ba鼠尾草sclareagydF4y2Ba发根[gydF4y2Ba6gydF4y2Ba],但只有AtDXS导致叶片和根中类胡萝卜素和叶绿素含量增加gydF4y2Ba胡萝卜胡萝卜gydF4y2Ba[gydF4y2Ba7gydF4y2Ba],输入AtDXSgydF4y2Ba薰衣草花latifoliagydF4y2Ba显著提高了单萜烯含量(CgydF4y2Ba10gydF4y2Ba),但不影响类胡萝卜素和叶绿素的含量[gydF4y2Ba8gydF4y2Ba].此外,AtDXR对叶片中类胡萝卜素、叶绿素和单萜含量均无影响gydF4y2Bal . latifoliagydF4y2Ba[gydF4y2Ba9gydF4y2Ba]或胡萝卜[gydF4y2Ba7gydF4y2Ba].另一方面,过度表达gydF4y2Ba砂仁gydF4y2BaLour DXR基因(gydF4y2BaAvDXRgydF4y2Ba)或蓝藻(gydF4y2BaSynechosystisgydF4y2Basp.菌株PCC6803) DXR基因(gydF4y2BaSyDXRgydF4y2Ba)增强了烟草中类胡萝卜素和叶绿素的积累(gydF4y2Ba烟草gydF4y2Ba树叶)。类似的,烟草的两个基因gydF4y2BaNtDXR1gydF4y2Ba而且gydF4y2BaNtDXR2gydF4y2Ba也有报道提高烟草叶片中的类胡萝卜素和叶绿素含量[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].通过这种方式,DXS和DXR基因在多个植物系统中的不同作用已经被阐明,但在水稻植物中,DXS和DXR基因的作用在很大程度上仍然未知。gydF4y2Ba
DXS酶的基因家族被分为三大类。I-DXS型基团在植物叶片中叶绿素和类胡萝卜素等光合萜类化合物的生物合成中起着重要作用gydF4y2Ba拟南芥gydF4y2Ba, Medicago (gydF4y2BaMedicago truncatulagydF4y2Ba)、大米及玉米(gydF4y2Ba玉米gydF4y2Ba),而它们的基因表达则取决于光照条件[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].II-DXS族在功能性萜烯代谢物的产生中起次要的生态作用,如银杏中的银杏内酯(gydF4y2Ba银杏叶gydF4y2Ba)、挪威云杉的油树脂(gydF4y2Ba挪威云杉gydF4y2Ba)、水稻中的植物抗毒素、紫花苜蓿菌根中的类胡萝卜素,以及玉米黄粒中的类胡萝卜素[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].iii型dxs酶具有尝试性作用,特别是在gydF4y2Ba禾本科gydF4y2Ba被子植物科及少数双子叶植物[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].DXR酶在大多数植物中是由单一基因编码的,除了烟草(gydF4y2Ban .烟草gydF4y2Ba),gydF4y2Ba橡胶树取代巴西橡胶树gydF4y2Ba,及大豆(gydF4y2Ba大豆gydF4y2Ba),在植物的生长和存活中起着重要的作用[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].gydF4y2Ba
类胡萝卜素,四萜类化合物(CgydF4y2Ba40gydF4y2Ba),在光合作用和非光合作用植物组织中大量存在[gydF4y2Ba26gydF4y2Ba],也是人体必需的营养素,因为它们是维他命原A的前体[gydF4y2Ba27gydF4y2Ba].由于类胡萝卜素在水稻植物的光合绿色部分富集,而在非光合种子胚乳中缺乏[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba],一些“黄金大米”品种已经过基因工程改造,其胚乳中含有丰富的类胡萝卜素,如β-胡萝卜素[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba]以提高大米作为谷类主食的营养价值。在玉米植株中(gydF4y2Ba玉米gydF4y2Bal)、3种玉米的表达水平gydF4y2BadxgydF4y2Ba对不同器官进行基因检测,包括两个白粒和黄粒品种的成熟粒[gydF4y2Ba13gydF4y2Ba].最高水平gydF4y2BaZmDXS2gydF4y2Ba与白色籽粒相比,黄色籽粒的表达量较高gydF4y2BaZmDXS1gydF4y2Ba没有表达,和gydF4y2BaZmDXS3gydF4y2Ba在两个品种的成熟籽粒中都有表达,这表明gydF4y2BaZmDXS2gydF4y2Ba这可能是黄仁类胡萝卜素富集的重要原因。为了提高类胡萝卜素在水稻种子胚乳中的积累效率,向类胡萝卜素途径提供主要构建单元IPP/DMAPP的MEP途径已经被发布,而类胡萝卜素途径的异源表达gydF4y2BaAtDXSgydF4y2Ba已表明DXS酶的增加可能导致水稻胚乳类胡萝卜素积累的增强[gydF4y2Ba33gydF4y2Ba].然而,尽管“黄金大米”品种已经开发了多年,但还没有关于水稻MEP途径的限速酶的报道,这些酶的作用是增加异戊二烯构建块IPP/DMAPP进入类胡萝卜素代谢的通量。gydF4y2Ba
在本研究中,我们研究了水稻MEP途径的前两种酶DXS和DXR的差异作用,并确定了它们对水稻叶片和种子中类胡萝卜素代谢的影响。考虑到基因组编辑时代,我们的研究为基因组编辑的候选基因提供了有用的信息。gydF4y2Ba
结果gydF4y2Ba
水稻DXS和DXR基因的分子特征gydF4y2Ba
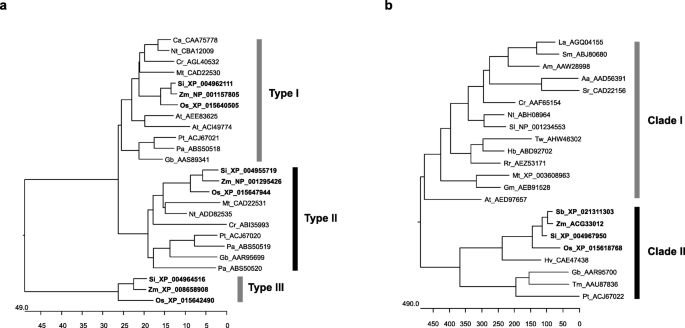
在水稻中,编码DXS蛋白的三个基因分别是Os05g33840 (XP_015640505)、Os06g05100 (XP_015642490)和Os07g09190 (XP_015647944)。预测了三种水稻的氨基酸序列gydF4y2BadxgydF4y2Ba利用植物DXS蛋白序列进行系统发育分析,将基因独立分为I型、II型和III型,分别对应于OsDXS1 (XP_015640505)、OsDXS2 (XP_015642490)和OsDXS3 (XP_015647944)(图2)。gydF4y2Ba1gydF4y2Baa).三种水稻DXSs与谷子DXS密切相关(gydF4y2BaSetaria italicagydF4y2Ba)和玉米,它们属于gydF4y2Ba禾本科gydF4y2Ba家庭。OsDXS2与ZmDXS2 (NP_001295426)序列相似度最高(87.5%),因此选择OsDXS2研究其对水稻叶片和种子类胡萝卜素代谢的影响。与其他植物中的DXR类似,水稻DXR由单拷贝基因编码gydF4y2BaOsDXRgydF4y2Ba(XP_015618768, Os01g01710),系统发育分类为植物DXR分支II,包括树木植物银杏、红豆杉和松树gydF4y2Ba禾本科gydF4y2Ba家庭种植高粱(gydF4y2Ba高粱二色的gydF4y2Ba)、玉米、谷子和大麦(gydF4y2Ba大麦芽gydF4y2Ba).另一方面,水稻DXR不属于包括草本植物在内的进化枝I(图2)。gydF4y2Ba1gydF4y2Bab). OsDXS2预测的氨基酸序列具有一个保守的硫胺素焦磷酸盐(TPP)结合核心结构域和两个参与活性位点的组氨酸和酪氨酸残基(附加文件)gydF4y2Ba1gydF4y2Ba:图S1)。此外,OsDXR具有三个高度保守的结构域,包括一个富脯氨酸结构域,两个NADPH结合位点和两个底物结合位点(附加文件)gydF4y2Ba2gydF4y2Ba:图S2)。gydF4y2Ba
植物的系统发育关系gydF4y2Ba一个gydF4y2Ba脱氧木质素5-磷酸合成酶(DXSs)和gydF4y2BabgydF4y2Ba5-磷酸脱氧木质素还原异构酶(DXRs)。植物DXSs和dxr的登录号显示为植物种的缩写:Aa,gydF4y2Ba青蒿gydF4y2Ba;点,gydF4y2Ba砂仁gydF4y2Ba阴沉的;在,gydF4y2Ba拟南芥gydF4y2Ba;钙、gydF4y2Ba甜椒gydF4y2Ba;铬、gydF4y2BaCatharanthus roseus也叫gydF4y2Ba;做的,gydF4y2Ba石斛兰药用gydF4y2Ba;Gb,gydF4y2Ba银杏叶gydF4y2Ba;通用,gydF4y2Ba大豆gydF4y2Ba;乙肝,gydF4y2Ba橡胶树取代巴西橡胶树gydF4y2Ba;高压,gydF4y2Ba大麦芽gydF4y2Ba;洛杉矶,gydF4y2Ba薰衣草花angustifoliagydF4y2Ba;太,gydF4y2BaMedicago truncatulagydF4y2Ba;元,gydF4y2Ba烟草gydF4y2Ba;操作系统,gydF4y2Ba栽培稻gydF4y2Ba;爸爸,gydF4y2Ba挪威云杉gydF4y2Ba;Pt,gydF4y2Ba松果体taedagydF4y2Ba;Rr,gydF4y2Ba罗莎玫瑰gydF4y2Ba;某人,gydF4y2Ba高粱二色的gydF4y2Ba;是的,gydF4y2BaSetaria italicagydF4y2Ba;Sl,gydF4y2Ba茄属植物lycopersicumgydF4y2Ba;Sm,gydF4y2Ba鼠尾草militorrhizagydF4y2Ba;老,gydF4y2Ba甜菊糖甙rebaudianagydF4y2Ba;Tm,gydF4y2Ba红豆杉x媒体gydF4y2Ba;Tw,gydF4y2Ba雷公藤gydF4y2Ba;Zm评选,gydF4y2Ba玉米gydF4y2Ba.他们推导出的氨基酸序列使用MegAlign程序(DNASTAR, Inc.)的ClustalV算法进行比对。II型蛋白,包括OsDXS2和支型蛋白,包括OsDXR,分别用黑色和灰色条区分,蛋白质属于gydF4y2Ba禾本科gydF4y2Ba家庭包括大米都是粗体gydF4y2Ba
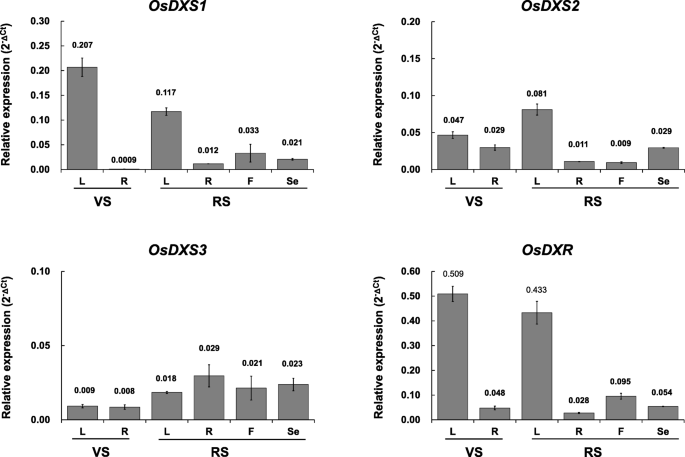
表达谱gydF4y2BaOsDXSgydF4y2Ba年代和gydF4y2BaOsDXRgydF4y2Ba在不同的组织中gydF4y2Ba
的内源性表达模式gydF4y2BaOsDXSgydF4y2Ba年代和gydF4y2BaOsDXRgydF4y2Ba在营养期的叶和根中,在繁殖期的叶、根、小花和种子中分析基因(图2)。gydF4y2Ba2gydF4y2Ba).转录水平gydF4y2BaOsDXS1gydF4y2Ba在叶片中均显著高于其他组织,提示其在光合组织中有相关作用。类似地,的表达式gydF4y2BaOsDXS2gydF4y2Ba在这两个阶段,叶片中也高于其他组织。在根的营养期,表达水平gydF4y2BaOsDXS2 OsDXS1,gydF4y2Ba而且gydF4y2BaOsDXS3gydF4y2Ba分别为0.029、0.0009、0.008。gydF4y2Ba2gydF4y2Ba)的表达水平gydF4y2BaOsDXRgydF4y2Ba根为0.048。考虑一个gydF4y2BaOsDXRgydF4y2Ba是单拷贝下游基因的gydF4y2BaOsDXSgydF4y2Ba,gydF4y2BaOsDXS2gydF4y2Ba被认为是在根中作为非光合组织的主要DXS酶发挥重要作用。相比之下,gydF4y2BaOsDXS3gydF4y2Ba在包括种子在内的大多数组织中均低水平表达。果然作为单拷贝下游基因的gydF4y2BaOsDXSgydF4y2Ba,gydF4y2BaOsDXRgydF4y2Ba在两个发育阶段的叶片中都有很强的表达,并且在所有组织中,无论在哪个发育阶段,这四种基因的表达量都最高(图2)。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
水稻脱氧木质素5-磷酸合成酶(DXS)和脱氧木质素5-磷酸还原异构酶(DXR)基因的时空表达。内源性转录水平gydF4y2BaOsDXS1gydF4y2Ba,gydF4y2BaOsDXS2gydF4y2Ba,gydF4y2BaOsDXS3gydF4y2Ba,gydF4y2BaOsDXRgydF4y2Ba利用从营养期和生殖期组织的叶(L)、根(R)和小花(F)以及开花后40天收获的种子(Se)等不同组织中分离出的总RNA进行qRT-PCR检测基因(见附加文件)gydF4y2Ba4gydF4y2Ba:表S8。在三个技术重复中测量的所有转录本水平均通过ΔCt方程计算gydF4y2BaOsUbi5gydF4y2Ba基因。结果以均数±标准误差(SE)表示gydF4y2Ba
任意一个的本构过表达gydF4y2BaOsDXS2gydF4y2Ba或gydF4y2BaOsDXRgydF4y2Ba单独或结合水稻胚乳β-胡萝卜素积累的生物强化特性gydF4y2Ba
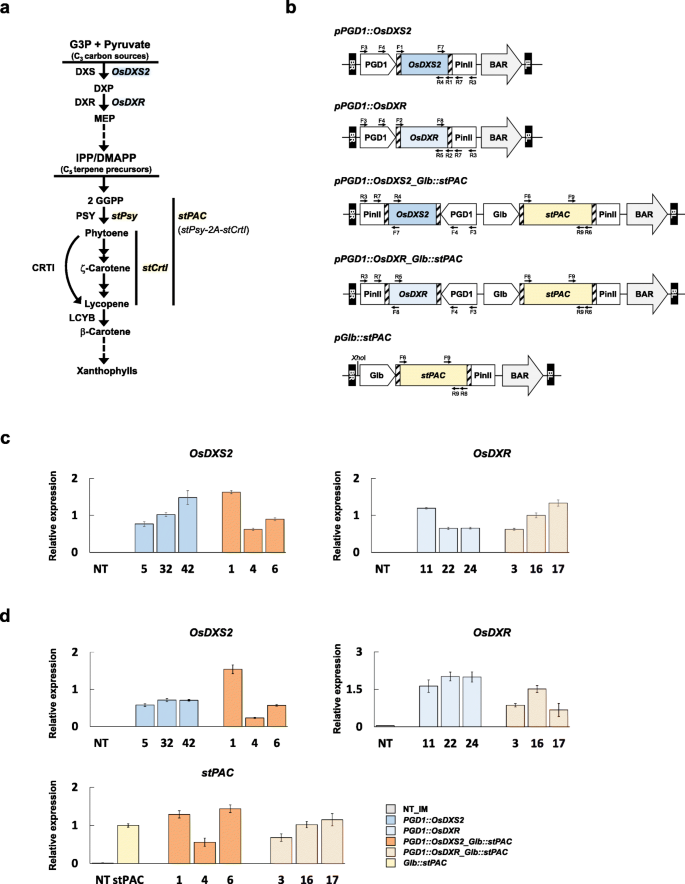
的不同作用gydF4y2BaOsDXS2gydF4y2Ba而且gydF4y2BaOsDXRgydF4y2Ba水稻叶片和种子中的类胡萝卜素代谢(图;gydF4y2Ba3.gydF4y2Ba一个),gydF4y2BaPGD1: OsDXS2gydF4y2Ba而且gydF4y2BaPGD1: OsDXRgydF4y2Ba生成了构成型过表达的向量gydF4y2BaOsDXS2gydF4y2Ba(Os07g09190)和gydF4y2BaOsDXRgydF4y2Ba(Os01g01710)(图。gydF4y2Ba3.gydF4y2Bab).他们的表情磁带gydF4y2BaPGD1: OsDXS2:: PinIIgydF4y2Ba或gydF4y2BaPGD1: OsDXR:: PinIIgydF4y2Ba,被克隆成gydF4y2BapGlb: stPACgydF4y2Ba与a共表达式的向量gydF4y2BastPACgydF4y2Ba重组基因生产β-胡萝卜素在水稻胚乳中产生gydF4y2BaPGD1: OsDXS2_Glb:: stPACgydF4y2Ba或gydF4y2BaPGD1: OsDXRgydF4y2Ba_gydF4y2BaGlb: stPACgydF4y2Ba向量,分别(图;gydF4y2Ba3.gydF4y2Bab).最后,通过考虑转基因及其在T3植株叶片中的拷贝数的整合,为4个结构各选择3个代表性株系(附加文件)gydF4y2Ba3.gydF4y2Ba:图S3)。gydF4y2Ba
类胡萝卜素途径的示意图,本研究中使用的二元载体,以及水稻植物叶片和种子中的转基因表达。gydF4y2Ba一个gydF4y2Ba水稻类胡萝卜素生物合成的内在途径CRTI,gydF4y2BaPantoea annatisgydF4y2Badesaturase;DMAPP,二磷酸二甲基烯丙基;DXP, 5-磷酸脱氧木质素;DXR, DXP还原异构酶;DXS, DXP合成酶;IPP,异戊二磷酸;GGPP,香叶基香叶基焦磷酸盐;G3P,甘油醛3-磷酸;LCYB,番茄红素β环化酶;MEP,甲基赤藓糖醇4-磷酸; OsDXR, rice DXP reductoisomerase; OsDXS2, rice DXP synthase; PSY, phytoene synthase;stCrtIgydF4y2Ba,水稻密码子优化合成基因编码gydF4y2BaPantoea CrtIgydF4y2Ba基因;gydF4y2BastPsygydF4y2Ba,水稻密码子优化合成基因gydF4y2Ba辣椒gydF4y2Ba基因编码PSY;gydF4y2BastPACgydF4y2Ba的重组基因gydF4y2BastPsygydF4y2Ba而且gydF4y2BastCrtgydF4y2Ba与gydF4y2Ba2gydF4y2Ba,这是水稻密码子优化口蹄疫病毒2A肽。gydF4y2BabgydF4y2Ba水稻转化的四向量图gydF4y2BaOsDXS2gydF4y2Ba而且gydF4y2BaOsDXRgydF4y2Ba与gydF4y2BapGlb: stPACgydF4y2Ba以前用于在水稻胚乳中产生类胡萝卜素强化性状的载体[gydF4y2Ba32gydF4y2Ba].细菌附着gydF4y2BaattBgydF4y2BaGateway克隆所需的站点用孵化框标记。BR,右边界;BL,左边框;水稻磷酸葡萄糖酸脱氢酶启动子PGD1;gydF4y2BaOsDXS2gydF4y2Ba,水稻DXP合成酶2基因;gydF4y2BaOsDXRgydF4y2Ba,水稻DXP还原异构酶基因;马铃薯蛋白酶抑制剂II基因3′区PinII;BAR, bialaphos抗性基因盒;Glb,水稻球蛋白启动子;gydF4y2BastPACgydF4y2Ba的重组基因gydF4y2BastPsy-2A-stCrtgydF4y2Ba.附加文件中用于转基因分析的载体构建、PCR和qRT-PCR的引物位置gydF4y2Ba3.gydF4y2Ba:图S3a、图3c、图3d用箭头表示,其信息列在附加文件中gydF4y2Ba4gydF4y2Ba:表S7。gydF4y2BacgydF4y2Ba转基因表达水平gydF4y2BaOsDXS2gydF4y2Ba而且gydF4y2BaOsDXRgydF4y2Ba采用qRT-PCR方法检测10日龄叶片总RNA。gydF4y2BadgydF4y2Ba转基因表达水平gydF4y2BaOsDXS2gydF4y2Ba,gydF4y2BaOsDXRgydF4y2Ba,gydF4y2BastPACgydF4y2Ba采用qRT-PCR方法检测未抛光成熟种子40 DAF的总RNA。所有结果均使用基因特异性引物对F7/R7进行gydF4y2BaOsDXS2gydF4y2Ba, F8/F7 forgydF4y2BaOsDXR,gydF4y2BaF9/R9用于gydF4y2BastPACgydF4y2Ba计算为三次重复的平均值,归一化为gydF4y2BaOsUbi5gydF4y2Ba该基因使用U5F/U5R引物对扩增。引物如图3b所示,并在附加文件中列出gydF4y2Ba4gydF4y2Ba:表S7。NT是一种非转基因野生型gydF4y2Ba栽培稻gydF4y2Bal .简历。Ilmi,不同品种的转基因植物用不同的颜色表示,如柱状图中的蓝色、浅蓝色、橙色、浅橙色和黄色,x轴标记由三个独立的转基因植物系组成gydF4y2Ba
所有转基因基因的表达均在T4代的叶片和种子中进行检测。gydF4y2Ba3.gydF4y2Bac和d).的转录水平gydF4y2BaOsDXS2gydF4y2Ba或gydF4y2BaOsDXRgydF4y2Ba在相对于NT水稻植株的两个器官中均表现出组构性过表达gydF4y2BastPACgydF4y2Ba在种子中的表达gydF4y2BaPGD1: OsDXS2_Glb:: stPACgydF4y2Ba而且gydF4y2BaPGD1: OsDXRgydF4y2Ba_gydF4y2BaGlb: stPACgydF4y2Ba这些细胞系验证了β-胡萝卜素产生途径的整合(图2)。gydF4y2Ba3.gydF4y2Bad)。gydF4y2Ba
OsDXS2和OsDXR对水稻叶片类胡萝卜素和叶绿素代谢无积极影响gydF4y2Ba
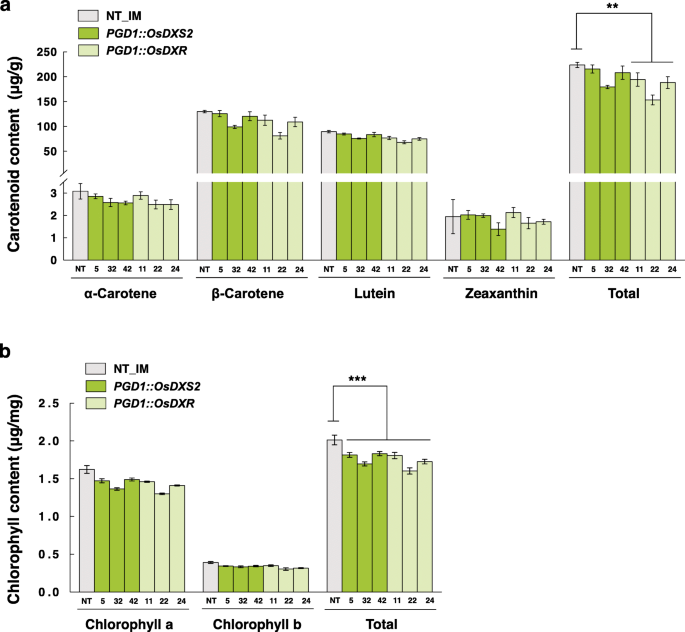
首先,我们利用高效液相色谱(HPLC)分析了T4代纯合转基因株系叶片中的类胡萝卜素和叶绿素含量,数据如表S1(附加文件)所示gydF4y2Ba4gydF4y2Ba).与对照相比,处理前后类胡萝卜素总含量略降低20%gydF4y2BaPGD1: OsDXRgydF4y2Ba符合统计学意义,且相差10%gydF4y2BaPGD1: OsDXS2gydF4y2Ba行(无花果。gydF4y2Ba4gydF4y2Baa).我们还测定了同一组织中叶绿素a和叶绿素b的含量,数据见表S2(附加文件gydF4y2Ba4gydF4y2Ba).总叶绿素含量略有下降11%gydF4y2BaPGD1: OsDXS2gydF4y2Ba行和15%的gydF4y2BaPGD1: OsDXRgydF4y2Ba行(无花果。gydF4y2Ba4gydF4y2BaB)具有统计学意义。综上所述,过表达后,类胡萝卜素和叶绿素的含量略有降低,而不是增加gydF4y2BaOsDXS2gydF4y2Ba或gydF4y2BaOsDXRgydF4y2Ba在米叶里。我们还试图确定类胡萝卜素和叶绿素的减少是否影响叶片表型,但没有观察到表型的变化,这表明OsDXS2或OsDXR过表达引起的减少对叶片表型没有显著影响。gydF4y2Ba
叶中类胡萝卜素和叶绿素的含量及组成gydF4y2BaPGD1: OsDXS2gydF4y2Ba而且gydF4y2BaPGD1: OsDXRgydF4y2Ba相对于NT植物的转基因植物。gydF4y2Ba一个gydF4y2Ba类胡萝卜素的水平通过高效液相色谱分析从三个独立的转基因植物中收获的T4叶组织确定。gydF4y2BabgydF4y2Ba叶绿素在同一叶片中的吸收gydF4y2Ba一个gydF4y2Ba用分光光度法测定。NT代表非转基因水稻(gydF4y2Ba栽培稻gydF4y2Bal .简历。Ilmi)。所有数据均以三个独立测量值的平均值±SE表示。使用双尾学生进行统计分析gydF4y2BatgydF4y2Ba-test,差异有显著性(p < 0.05)gydF4y2BapgydF4y2Ba值(* *gydF4y2BapgydF4y2Ba< 0.01和***gydF4y2BapgydF4y2Ba< 0.001)。不同品种的转基因植物用不同的颜色表示,如柱状图中的绿色和浅绿色,x轴标记由三个独立的转基因植物系组成gydF4y2Ba
与OsDXR相比,OsDXS2在水稻种子类胡萝卜素代谢中作为限速酶的器官特异性差异作用gydF4y2Ba
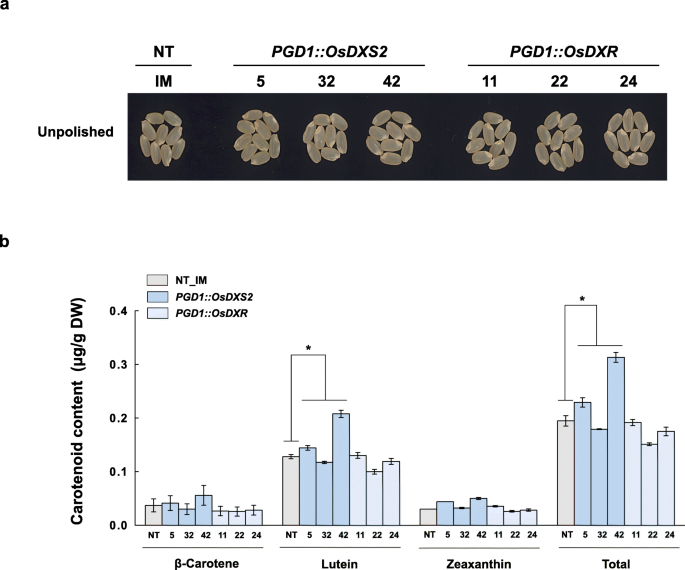
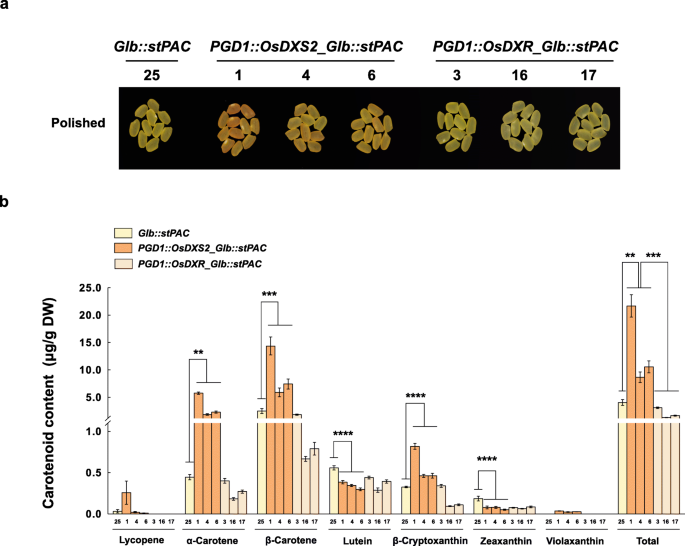
接下来,我们研究了OsDXS2或OsDXR的过表达是否影响种子类胡萝卜素代谢(图2)。gydF4y2Ba5gydF4y2Ba).与NT种子相比,虽然棕色种子没有观察到颜色或表型的变化(Fig。gydF4y2Ba5gydF4y2Baa), PGD1::OsDXS2系类胡萝卜素总含量增加26%,PGD1::OsDXR系类胡萝卜素总含量降低11%(图1)。gydF4y2Ba5gydF4y2Bab和附加文件gydF4y2Ba4gydF4y2Ba:表S3),即使变化不大,也具有统计学意义。另外,如图所示。gydF4y2Ba6gydF4y2Ba,黄色的颜色gydF4y2BaGlb: stPACgydF4y2Ba种子(gydF4y2Ba32gydF4y2Ba]的颜色在很大程度上增强为橙色gydF4y2BaPGD1: OsDXS2_Glb:: stPACgydF4y2Ba线,但仍然只是黄色的gydF4y2BaPGD1: OsDXR_Glb:: stPACgydF4y2Ba行(无花果。gydF4y2Ba6gydF4y2Baa).与gydF4y2BaGlb: stPACgydF4y2Ba种子中总类胡萝卜素含量gydF4y2BaPGD1: OsDXS2_Glb:: stPACgydF4y2Ba种子大量增加5.4倍(图;gydF4y2Ba6gydF4y2Bab).番茄红素、α-胡萝卜素和β-胡萝卜素含量分别增加8.7倍、13.1倍和5.8倍,叶黄素和玉米黄质含量分别下降0.7倍和0.4倍(附加文件)gydF4y2Ba4gydF4y2Ba:表S3)。相比之下,过度表达gydF4y2BaOsDXRgydF4y2Ba没有增强类胡萝卜素的积累gydF4y2BaPGD1: OsDXRgydF4y2Ba或gydF4y2BaPGD1: OsDXR_Glb:: stPACgydF4y2Ba种子(图。gydF4y2Ba6gydF4y2Bab),表明OsDXR与OsDXS2在促进种子类胡萝卜素代谢方面的积极作用存在差异。gydF4y2Ba
种子的颜色表型和类胡萝卜素水平gydF4y2BaPGD1: OsDXS2gydF4y2Ba而且gydF4y2BaPGD1: OsDXRgydF4y2Ba相对于NT植物的转基因植物。gydF4y2Ba一个gydF4y2Ba纯合子T4代成熟种子颜色与NT (gydF4y2Ba栽培稻gydF4y2Bal .简历。Ilmi)在开花后40天(DAF)对每个结构的三个独立转基因植物进行了抛光,因为抛光后的颜色与白色难以区分。gydF4y2BabgydF4y2Ba用高效液相色谱法测定同一种子中的类胡萝卜素水平gydF4y2Ba一个gydF4y2Ba.所有类胡萝卜素含量数据均显示为三个独立测量值的平均值±标准误差(SE)。使用双尾学生进行统计分析gydF4y2BatgydF4y2Ba以及(*gydF4y2Bap
种子的颜色表型和类胡萝卜素水平gydF4y2BaPGD1: OsDXS2_Glb:: stPACgydF4y2Ba而且gydF4y2BaPGD1: OsDXR_Glb:: stPACgydF4y2Ba相对于gydF4y2BaGlb: stPACgydF4y2Ba转基因植物。gydF4y2Ba一个gydF4y2Ba在三个独立的转基因植株中,比较了T4代纯合子成熟种子的颜色gydF4y2BastPACgydF4y2Ba开花后40天(DAF)和抛光后的水稻种子。gydF4y2BabgydF4y2Ba用高效液相色谱法测定同一种子中的类胡萝卜素水平gydF4y2Ba一个gydF4y2Ba.所有类胡萝卜素含量数据均显示为三个独立测量值的平均值±标准误差(SE)。使用双尾学生进行统计分析gydF4y2BatgydF4y2Ba以及(* *gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001和****gydF4y2BapgydF4y2Ba< 0.0001)。NT是一种非转基因野生型gydF4y2Ba栽培稻gydF4y2Bal .简历。Ilmi,不同品种的转基因植物用不同的颜色表示,如柱状图中的橙色、浅橙色和黄色,x轴标记由三个独立的转基因植物系组成gydF4y2Ba
叶黄素总量增加了6.4倍,而α-胡萝卜素和β-胡萝卜素的含量都大大增加了315.3倍gydF4y2BaPGD1: OsDXS2_Glb:: stPACgydF4y2Ba这表明,将胡萝卜素转化为叶黄素的羟基化步骤(类胡萝卜素代谢的限速步骤之一)受到严格调控,以维持水稻种子中叶黄素的基础水平。gydF4y2Ba
OsDXS2gydF4y2Ba——或者gydF4y2BaOsDXRgydF4y2Ba-介导的水稻叶片和种子中固有胡萝卜素生成基因的转录改变gydF4y2Ba
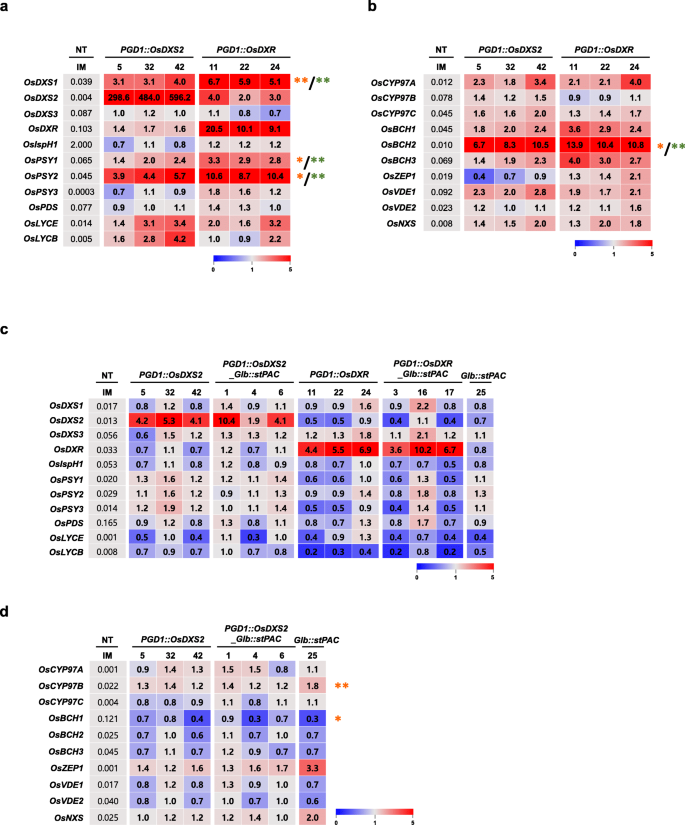
在NT和转基因植物的叶子和种子中测定了MEP、胡萝卜素和叶黄素途径中涉及的内在基因的转录水平,并使用代表折叠变化的热图图来可视化所有表达模式(图2)。gydF4y2Ba7gydF4y2Ba).表达式数据显示在附加文件中gydF4y2Ba4gydF4y2Ba:表S4-S6。如图所示。gydF4y2Ba7gydF4y2BaA和b,内源性胡萝卜素生成基因在叶片中的表达量大多增加,如热图中红色所示。这些基因的表达水平进一步统计分析使用双尾学生gydF4y2BatgydF4y2Ba-test,用橙色或绿色星号表示统计学意义(图;gydF4y2Ba7gydF4y2Baa、b).过表达DXS、PSY和BCH酶的基因表达均显著增加gydF4y2BaOsDXS2gydF4y2Ba或gydF4y2BaOsDXRgydF4y2Ba(*gydF4y2BapgydF4y2Ba< 0.05和**gydF4y2BapgydF4y2Ba< 0.01)。的水平gydF4y2BaOsDXS1gydF4y2Ba,gydF4y2BaOsPSY2,gydF4y2Ba而且gydF4y2BaOsBCH2gydF4y2Ba都增加了3.1倍到13.9倍gydF4y2BaOsDXS2gydF4y2Ba而且gydF4y2BaOsDXRgydF4y2Ba表明它们可能与水稻叶片中OsDXS2和OsDXR活性的增强有关。有趣的是,内源性的表达gydF4y2BaOsDXS1gydF4y2Ba而且gydF4y2BaOsDXS2gydF4y2Ba过表达后分别增加6.7倍和4.0倍gydF4y2BaOsDXRgydF4y2Ba,但OsDXS2活性的增强并没有引起明显的增加gydF4y2BaOsDXRgydF4y2Ba表达,即使表达了gydF4y2BaOsPSY2gydF4y2Ba过表达后,基因显著增加5.7倍gydF4y2BaOsDXS2gydF4y2Ba(无花果。gydF4y2Ba7gydF4y2Baa).这些结果说明了DXS和DXR基因在水稻叶片中的不同作用。然而,基因表达的显著增加与代谢变化不成正比,考虑到叶片中类胡萝卜素和叶绿素的数量略有减少gydF4y2BaPGD1: OsDXS2gydF4y2Ba而且gydF4y2BaPGD1: OsDXRgydF4y2Ba植物。gydF4y2Ba
类胡萝卜素生物合成基因在三个独立转基因植物叶片和种子中的表达谱gydF4y2BaOsDXS2gydF4y2Ba而且gydF4y2BaOsDXRgydF4y2Ba构造相对于非转基因(NT)和gydF4y2BastPACgydF4y2Ba植物。在10日龄叶片中,11个水稻基因的表达模式,包括5个参与MEP途径的基因和6个胡萝卜素生物合成基因(gydF4y2Ba一个gydF4y2Ba)和10个水稻叶黄素生物合成基因(gydF4y2BabgydF4y2Ba)表示为折叠变化值(2 .gydF4y2Ba−ΔΔCtgydF4y2Ba)与NT的ΔCt值进行比较,qRT-PCR数据列在附加文件中gydF4y2Ba4gydF4y2Ba:表S4。使用双尾学生进行表达水平的统计分析gydF4y2BatgydF4y2Ba以及(*gydF4y2BapgydF4y2Ba< 0.05和**gydF4y2BapgydF4y2Ba< 0.01)。的gydF4y2BatgydF4y2Ba-测试结果以橙色表示(gydF4y2Ba*gydF4y2Ba)和绿色(gydF4y2Ba*gydF4y2Ba),分别为OsDXS2和OsDXR增强的显著效果。并在开花后40 d的成熟种子(DAF)中分析了相同基因组的表达模式。11个水稻基因的表达数据,包括5个参与MEP途径的基因和6个胡萝卜素生物合成基因(gydF4y2BacgydF4y2Ba)和10个水稻叶黄素生物合成基因(gydF4y2BadgydF4y2Ba)表示为折叠变化值(2 .gydF4y2Ba——ΔΔCtgydF4y2Ba)与NT的ΔCt值进行比较,所有qRT-PCR数据均列在附加文件中gydF4y2Ba4gydF4y2Ba:表S5-S6 .使用实例NT的ΔCt值列在灰色框中,所有的折叠变化值(2gydF4y2Ba——ΔΔCtgydF4y2Ba)显示相应的热图。每个图下都有热图图的颜色键,附加文件中列出了基因和引物序列的接入号gydF4y2Ba4gydF4y2Ba表S8gydF4y2Ba
对5个转基因植物种子中MEP和胡萝卜素生物合成途径的12个基因进行了转录比较gydF4y2BaPGD1: OsDXS2gydF4y2Ba,gydF4y2BaPGD1: OsDXS2_Glb:: stPACgydF4y2Ba,gydF4y2BaPGD1: OsDXRgydF4y2Ba,gydF4y2BaPGD1: OsDXR_Glb:: stPAC,gydF4y2Ba而且gydF4y2BaGlb:: stPAC,gydF4y2Ba和NT水稻植株(图;gydF4y2Ba7gydF4y2Bac、附加文件gydF4y2Ba4gydF4y2Ba:表S5)。与叶片相比,DXSs和PSYs编码基因的表达均未因两者的过表达而显著上调gydF4y2BaOsDXS2gydF4y2Ba或gydF4y2BaOsDXRgydF4y2Ba种子略有变化,但无统计学意义gydF4y2BaPGD1: OsDXS2gydF4y2Ba而且gydF4y2BaPGD1:: OsDXR,gydF4y2Ba如热图上淡粉色和蓝色所示(图2)。gydF4y2Ba7gydF4y2Bac).参与叶黄素代谢的生物合成基因在种子中的表达分析gydF4y2BaPGD1: OsDXS2, PGD1:: OsDXS2_Glb:: stPACgydF4y2Ba而且gydF4y2BaGlb: stPACgydF4y2Ba的表达模式gydF4y2BaOsCYP97BgydF4y2Ba(p450型α-胡萝卜素羟化酶基因)和gydF4y2BaOsBCH1gydF4y2Ba(β-胡萝卜素羟化酶-1基因)分别显著上调和下调,尽管其表达仅发生2倍的变化(图2)。gydF4y2Ba7gydF4y2Bad).因此,这些表达模式的微小变化与中类胡萝卜素含量增加73.8倍和315.3倍不一致gydF4y2BaGlb: stPACgydF4y2Ba而且gydF4y2BaPGD1: OsDXS2_Glb:: stPACgydF4y2Ba与NT种子相比,差异有显著性。也就是说,类胡萝卜素积累的强烈增强在很大程度上依赖于转基因的加入,而不是内源性胡萝卜素基因表达的变化。gydF4y2Ba
总的来说,内源性胡萝卜素基因的表达受到两者的差异调节gydF4y2BaOsDXS2gydF4y2Ba或gydF4y2BaOsDXRgydF4y2Ba以器官特异性的方式过度表达,但其表达水平与随后的代谢变化之间无显著相关性。这些结果表明,类胡萝卜素积累的大幅度增强是由逐步添加的gydF4y2BaOsDXS2gydF4y2Ba而且gydF4y2BastPACgydF4y2Ba基因,但不很大程度上依赖于内在胡萝卜素基因表达的任何变化。gydF4y2Ba
讨论gydF4y2Ba
在本研究中,我们研究了水稻DXS和DXR作为MEP途径的前两种酶在水稻类胡萝卜素代谢中的差异作用。种子总类胡萝卜素含量提高了26%gydF4y2BaPGD1: OsDXS2gydF4y2Ba与NT株相比,平均增加3.4倍(最大增加5.4倍)gydF4y2BaPGD1: OsDXS2_Glb:: stPACgydF4y2Ba与gydF4y2BaGlb: stPACgydF4y2Ba线,但相比之下,减少了11%gydF4y2BaPGD1: OsDXRgydF4y2Ba行和50%在gydF4y2BaPGD1: OsDXR_Glb:: stPACgydF4y2Ba与NT植株的株系比较gydF4y2BaGlb: stPACgydF4y2Ba分别为水稻系(图;gydF4y2Ba5gydF4y2Ba和无花果。gydF4y2Ba6gydF4y2Ba).考虑到水稻胚乳中植物素的生物合成十分有限[gydF4y2Ba28gydF4y2Ba]时,类胡萝卜素的积累大大增强gydF4y2BaPGD1: OsDXS2_Glb:: stPACgydF4y2Ba表明OsDXS2作为一种向类胡萝卜素代谢提供IPP/DMAPPs的限速酶,即使在种子中总类胡萝卜素含量gydF4y2BaPGD1: OsDXS2gydF4y2Ba种子的变化很小,只增加了26%。然而,在水稻叶片中,总类胡萝卜素平均减少了10%gydF4y2BaPGD1: OsDXS2gydF4y2Ba行和20%的gydF4y2BaPGD1: OsDXRgydF4y2Ba行。此外,总叶绿素也平均减少了11%gydF4y2BaPGD1: OsDXS2gydF4y2Ba15%的人gydF4y2BaPGD1: OsDXRgydF4y2Ba与NT植物相比(图;gydF4y2Ba4gydF4y2Ba).这些结果表明,OsDXS2仅在种子类胡萝卜素代谢中起限速酶作用,而在叶片中不起限速酶作用,而OsDXR既不在叶片中也不在种子中起限速酶作用。gydF4y2Ba
在拟南芥叶片中,AtDXS和AtDXR都是产生类胡萝卜素和叶绿素的生物合成途径中的限速酶[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba],然而,植物DXS和DXR酶的不同作用也在一些植物物种中得到了一致的报道。在胡萝卜中,的过度表达gydF4y2BaAtDXRgydF4y2Ba两种组织中总类胡萝卜素含量均未增加gydF4y2BaAtDXSgydF4y2Ba过表达通过改变叶片和根系中总类胡萝卜素的表达,提高了叶片和根系中总类胡萝卜素的含量gydF4y2BaPSY1gydF4y2Ba而且gydF4y2BaPSY2gydF4y2Ba基因(gydF4y2Ba7gydF4y2Ba].在薰衣草中,过度表达gydF4y2BaAtDXSgydF4y2Ba不影响叶片中类胡萝卜素和叶绿素含量,但显著增加了挥发油单萜含量[gydF4y2Ba8gydF4y2Ba].相比之下,gydF4y2BaAtDXRgydF4y2Ba没有引起精油、类胡萝卜素或叶绿素含量的任何变化[gydF4y2Ba9gydF4y2Ba].这些研究清楚地表明,DXR酶的限速功能可能不一致,而DXS酶的限速功能可能在植物物种甚至不同组织之间有所不同。gydF4y2Ba
在本研究中,涉及MEP、胡萝卜素和叶黄素通路的水稻胡萝卜素基因的表达谱表明,它们的表达模式与水稻转基因植株叶片和种子中类胡萝卜素代谢的变化不成正比。胡萝卜素基因的表达,如gydF4y2BaOsDXS1gydF4y2Ba,gydF4y2BaOsPSY1gydF4y2Ba,gydF4y2BaOsPSY2,gydF4y2Ba而且gydF4y2BaOsBCH2,gydF4y2Ba是通过增强其中一种而上调的gydF4y2BaOsDXS2gydF4y2Ba或gydF4y2BaOsDXRgydF4y2Ba与类胡萝卜素和叶绿素含量的降低相比,大多数类胡萝卜素基因的表达只有轻微的变化,尽管种子类胡萝卜素的积累有很大的增加(图。gydF4y2Ba7gydF4y2Ba).与我们的结果相反,dxs编码基因在番茄果实和马铃薯块茎中的过表达增加了内源性psys编码基因的表达,随后导致类胡萝卜素积累的大幅增强[gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba].在胡萝卜叶和根中的类胡萝卜素代谢中也观察到了类似的结果[gydF4y2Ba7gydF4y2Ba].这些结果表明,dxs介导的类胡萝卜素和叶绿素含量的增加与叶绿素含量的增加有关gydF4y2Ba小组gydF4y2Ba基因的表达。但在水稻叶片中不存在正相关。的表达式gydF4y2BaOsPSY1gydF4y2Ba而且gydF4y2BaOsPSY2gydF4y2Ba与叶片中类胡萝卜素含量的降低相比,基因优先上调,而在水稻种子中没有改变,即使类胡萝卜素含量增加。同样,在番茄果实中,与β-胡萝卜素的增强相比,DXS-、PSY-和pds编码基因的表达优先下调[gydF4y2Ba34gydF4y2Ba],在gydF4y2BaBixa奥雷利亚纳gydF4y2BaL.,盐胁迫处理提高了类胡萝卜素含量,但生胡萝卜素基因的表达不成比例地下调[gydF4y2Ba36gydF4y2Ba].这些结果表明,内在胡萝卜素基因(如DXS-和psy -编码基因)的转录表达可能与其编码蛋白的表达水平不成正比,中间生物合成酶的蛋白质稳定性可能与速率限制酶的活性增强一样重要,以增强类胡萝卜素的积累。gydF4y2Ba
在gydF4y2Ba拟南芥gydF4y2Ba, AtDXS蛋白被报道翻译后被叶绿体生物发生6 (CLB6,一种羟基-2-甲基-丁烯基4-二磷酸还原酶)、Hsp100伴侣和几种Clp蛋白酶调控[gydF4y2Ba37gydF4y2Ba的蛋白质平衡gydF4y2Ba拟南芥gydF4y2BaPSY蛋白由Clp蛋白酶和ORANGE蛋白直接控制[gydF4y2Ba38gydF4y2Ba].在gydF4y2BaCatharanthus roseus也叫gydF4y2Ba, DXR蛋白的稳定性高度依赖Clp蛋白酶介导的降解[gydF4y2Ba39gydF4y2Ba],而PDS蛋白的酶活性在β-胡萝卜素增强的番茄果实中更稳定地维持,即使其转录物下调[gydF4y2Ba34gydF4y2Ba].同样,我们的研究表明,除了DXS和PSY等速率限制酶的增强外,种子类胡萝卜素的积累可以在不按比例上调中间生物合成基因的情况下大幅增加,这表明种子类胡萝卜素代谢可能优先由生胡萝卜素酶的稳定性或活性控制,而不是由它们的转录水平控制。gydF4y2Ba
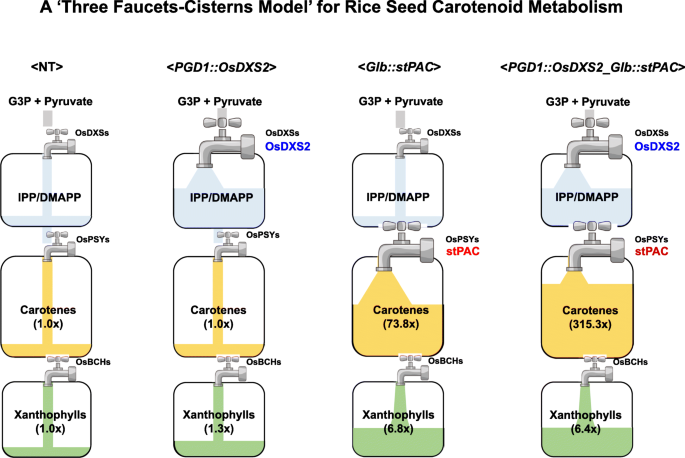
总的来说,我们提出了一个“三个水龙头和水箱模型”来描述水稻种子类胡萝卜素的代谢(图。gydF4y2Ba8gydF4y2Ba).术语“三个水龙头”表示三个速率限制步骤,涉及DXS, PSY和BCH酶,从上游到下游途径提供限制水平的前体。两个水龙头之间的中间类胡萝卜素生物合成机制被视为“蓄水池”,在我们的模型中充满了代表IPP/DMAPP、胡萝卜素和叶黄素的特定类胡萝卜素代谢物,其容量仅由活性蛋白的状态决定(图2)。gydF4y2Ba8gydF4y2Ba).通过遵循“三水龙头和水箱模型”,OsDXS2的过表达在gydF4y2BaPGD1: OsDXS2gydF4y2Ba种子可能会打开第一个“水龙头”,以增加进入第一个“水箱”的代谢通量,类胡萝卜素含量可能会略微增加(1.3倍),相当于第二个“水龙头”(水稻PSY基因)的容量,在水稻种子中保持在基础水平。的逐步相加gydF4y2BaOsDXS2gydF4y2Ba而且gydF4y2BastPACgydF4y2Ba同时打开第一个和第二个“水龙头”,增加从第一个“水箱”到第二个“水箱”的代谢流量,这些连续的代谢流可以增加蛋白质稳定性,增强“水箱”的容量,使α/β-胡萝卜素的积累大幅增强315.3倍,而“水箱”基因的表达没有任何变化。在这种情况下gydF4y2BaGlb: stPACgydF4y2Ba第二个“水龙头”(stPAC)在第一个“水龙头”没有任何增强的情况下打开,但类胡萝卜素含量增加了73.8倍。相反,在gydF4y2BaPGD1: OsDXRgydF4y2Ba在种子中,作为第一个“水箱”组成部分的OsDXR的增强并没有增加类胡萝卜素的积累,清楚地说明了“水龙头”和“水箱”之间的功能差异。换句话说,第二个“龙头”(stPAC)的增强可以增加从第一个“龙头”到第二个“龙头”的代谢通量,但“龙头”成分(OsDXR)的增加可能不会影响从上游步骤到第二个“龙头”的代谢通量,因此在水稻种子中没有观察到任何类胡萝卜素积累的增强。最后,无论添加哪一种,叶黄素的含量都逐渐增加gydF4y2BaOsDXS2gydF4y2Ba或gydF4y2BastPACgydF4y2Ba基因在水稻种子中从1.3倍增加到6.8倍,但在水稻种子中没有发现额外的增加gydF4y2BaPGD1: OsDXS2_Glb:: stPACgydF4y2Ba种子,胡萝卜素含量增加4.3倍gydF4y2BaGlb: stPACgydF4y2Ba这表明这可能是由于第三个“水龙头”的最大容量。gydF4y2Ba
结论gydF4y2Ba
本研究研究了OsDXS2和OsDXR在水稻叶片和种子类胡萝卜素代谢中的差异作用,并测定了生胡萝卜素基因的表达变化。结果表明,OsDXS2在水稻种子中为类胡萝卜素代谢提供IPP/DMAPPs,但在水稻叶片中不提供,而在叶片和种子中没有OsDXR作为速率限制酶。类胡萝卜素基因的表达谱显示基因表达变化与代谢变化之间的非成比例相关,表明类胡萝卜素中间代谢物的生物合成活性可以在不增加转录物水平的情况下得到增强。综上所述,OsDXS2和OsDXR的这些不同作用可能以水稻植物特有的模式发生,并提出了“三水龙头和水槽模型”来描述水稻种子中的类胡萝卜素代谢。本研究为水稻类胡萝卜素代谢工程的优化设计提供了参考。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
成熟的稻种(gydF4y2Ba栽培稻gydF4y2Bal .简历。在28°C光照16 h /暗8 h循环条件下,在温室土壤中发芽生长。从韩国国家农业科学研究所获得的水稻种子用于gydF4y2Ba农杆菌属gydF4y2BaDXS基因的介导转化和表达分析。在不同阶段采集器官特异性样本,用于实时定量pcr (qRT)。gydF4y2Ba
T0代转基因水稻植株先在生长室中生长,移栽到土壤中后,T1代和T2代在温室中同样条件下28℃光照循环16 h /暗循环8 h,夏季在田间种植,直到T4种子世代。所有实地研究都是在获得农村发展局(韩国)许可的情况下,根据当地立法进行的。T4种子用70%乙醇和2%次氯酸钠杀菌后,10天大的幼苗在28°C、12 h光照/12 h暗循环、70-90%相对湿度的房间中生长。以开花后40 d完全成熟(DAF)的T4种子为对照,进行qRT-PCR和代谢物分析。在脱壳(TR-200电动砻谷机,凯特,东京,日本)和抛光(珍珠抛光机,凯特)后,对种子胚乳颜色进行视觉比较。gydF4y2Ba
向量构造gydF4y2Ba
编码区域,包括的开放阅读框gydF4y2BaOsDXS2gydF4y2Ba(Os07g09190)和gydF4y2BaOsDXRgydF4y2Ba(Os01g01710),分别使用基因特异性引物对F1/R1和F2/R2从10日龄幼苗的总RNA中扩增。每个扩增子都被进一步放大使用通用gydF4y2BaattBgydF4y2Ba引物对并引入gydF4y2BapDONR221gydF4y2Ba通过Gateway®BP Clonase®II酶混合物(Invitrogen, Waltham, MA)重组载体。将得到的亚克隆与载体进行重组gydF4y2Bap600-PGD1gydF4y2Ba(首尔国立大学,韩国平昌),其中含有水稻磷酸葡萄糖酸脱氢酶1 (PGD1)启动子,用于水稻植物的本构表达,[gydF4y2Ba40gydF4y2Ba]使用Gateway®LR Clonase®II酶混合物(Invitrogen)。这就产生了gydF4y2BapPGD1: OsDXS2gydF4y2Ba而且gydF4y2BapPGD1: OsDXRgydF4y2Ba水稻转化向量(图;gydF4y2Ba1gydF4y2Bab)。gydF4y2Ba
全面介绍gydF4y2BaPGD1: OsDXS2:: PinIIgydF4y2Ba或gydF4y2BaPGD1: OsDXR:: PinIIgydF4y2Ba卡带进入PGD1启动子区域,PinII终止子区域进入gydF4y2BastPACgydF4y2Ba表达式盒,其中产生gydF4y2BaβgydF4y2Ba-胡萝卜素在水稻胚乳特异性球蛋白(Glb)启动子的控制下[gydF4y2Ba32gydF4y2Ba],分别用F3/R3引物对扩增,然后克隆到agydF4y2BapGlb: stPACgydF4y2Ba向量使用gydF4y2BaXhogydF4y2Ba我也不服输gydF4y2BapPGD1: OsDXS2_Glb:: stPACgydF4y2Ba或gydF4y2BapPGD1: OsDXR_Glb:: stPACgydF4y2Ba用于水稻转化(图;gydF4y2Ba1gydF4y2Bab).所有pcr均使用PrimeSTAR®HS DNA聚合酶(Takara,志贺,日本)进行。所有引物如图所示。gydF4y2Ba3.gydF4y2Bab及其序列列在附加文件中gydF4y2Ba4gydF4y2Ba:表S7。gydF4y2Ba
水稻转化与转化材料的选择gydF4y2Ba
对于过度表达gydF4y2BaOsDXS2gydF4y2Ba或gydF4y2BaOsDXRgydF4y2Ba,gydF4y2BapPGD1: OsDXS2gydF4y2Ba,gydF4y2BapPGD1: OsDXRgydF4y2Ba,gydF4y2BapPGD1: OsDXS2_Glb:: stPAC,gydF4y2Ba而且gydF4y2BapPGD1: OsDXR_Glb:: stPACgydF4y2Ba最后的向量,分别被引入gydF4y2Ba大肠杆菌gydF4y2Ba然后是DH5αgydF4y2Ba根癌土壤杆菌gydF4y2BaLBA4404窝藏gydF4y2BapSB1gydF4y2Ba通过三亲本交配获得质粒[gydF4y2Ba41gydF4y2Ba].与水稻成熟种子分化出的胚性愈伤组织共培养后(gydF4y2Bao .漂白亚麻纤维卷gydF4y2Bal .简历。Ilmi),假定的转基因植株是根据先前发表的方法,在生长室条件下,使用含有磷菊酯(4 mg/L)和头孢噻肟(500 mg/L)的选择培养基生成的[gydF4y2Ba42gydF4y2Ba].gydF4y2Ba
基因组DNA使用DNeasy Plant Mini Kit (Qiagen)从叶片组织中纯化,用TissueLyser II (Qiagen)研磨,并按照制造商的说明使用MightyAmp®DNA聚合酶(Takara)进行pcr扩增。首先在T0叶代用引物F4/R4对PCR筛选转基因阳性植株gydF4y2BaOsDXS2gydF4y2Ba, F4/R5为gydF4y2BaOsDXRgydF4y2Ba,和F6/R6gydF4y2BastPACgydF4y2Ba转基因产品。选择3个品系,在T3叶代进行磷酸菊酯(4mg /L)分离试验,以评估T-DNA的纯合度,然后使用相同的PCR方案进一步验证。为了检测水稻基因组中的转基因拷贝数,使用NF/NR(一种定制的探针NP,用6-羧基荧光素染料标记)进行TaqMan实时PCRgydF4y2Ba号gydF4y2Ba终结者在gydF4y2Ba酒吧gydF4y2Ba盒(gydF4y2Ba35 s::酒吧::gydF4y2Ba)和定制的VIC染料标记α-微管蛋白探针(Os11g14220),作为内部参考(Assay ID: Os03643486_s1;应用生物系统公司,福斯特城,CA)。使用TaqMan基因表达Master Mix (Applied Biosystems)进行PCR,并使用CFX Connect™Real-Time System (Bio-Rad, Richmond, CA)相对于T3纯合子代中1个拷贝的荧光测量gydF4y2BastPAC 25gydF4y2Ba米线[gydF4y2Ba32gydF4y2Ba]使用PCR条件,如前所述[gydF4y2Ba43gydF4y2Ba].在基因组DNA分析中使用的引物和探针的序列在附加文件中列出gydF4y2Ba4gydF4y2Ba:表S7。gydF4y2Ba
类胡萝卜素和叶绿素的定量gydF4y2Ba
如前所述,制备水稻植物的叶片和种子样品以提取类胡萝卜素[gydF4y2Ba43gydF4y2Ba].在高效液相色谱分析中,加入β-apo-8 ' -胡萝卜素(0.05 mL, 25 μg/mL, Sigma-Aldrich Chemical Co, St. Louis, MO)作为内标,以二氯甲烷/甲醇50:50 (v/v)溶解制备分析样品,用己烷(1.5 mL)分离成层,液氮干燥。采用YMC ODS C-30色谱柱(3 μm, 4.6 × 250 mm;采用安捷伦1100系列高效液相色谱系统(安捷伦,加州圣克拉拉),在洗脱条件下配备光电二极管阵列检测器,如前所述[gydF4y2Ba43gydF4y2Ba].番茄红素和其他化合物的色谱图分别在472 nm和450 nm处生成,包括α-胡萝卜素、(all-gydF4y2BaEgydF4y2Ba)-gydF4y2BaβgydF4y2Ba胡萝卜素,9gydF4y2BaZgydF4y2Ba-gydF4y2BaβgydF4y2Ba胡萝卜素,13gydF4y2BaZgydF4y2Ba-gydF4y2BaβgydF4y2Ba胡萝卜素,gydF4y2BaβgydF4y2Ba-隐黄质,叶黄素,紫黄质和玉米黄质。定量由类胡萝卜素标准品相对于外部标准品校准曲线的HPLC峰面积确定,这些标准品购自胡萝卜素公司(Lupsingen, Switzerland)。数量gydF4y2BaβgydF4y2Ba-胡萝卜素测定为(所有-gydF4y2BaEgydF4y2Ba)-gydF4y2BaβgydF4y2Ba胡萝卜素,9gydF4y2BaZgydF4y2Ba-gydF4y2BaβgydF4y2Ba-胡萝卜素,13gydF4y2BaZgydF4y2Ba-gydF4y2BaβgydF4y2Ba胡萝卜素。gydF4y2Ba
为了提取叶绿素,将水稻植株的新鲜叶粉10 mg与1 mL 100%甲醇混合,在70°C下摇晃(500 rpm),使用Comfort(型号5355,Eppendorf AG,汉堡,德国)恒温培养30分钟。在800度离心后gydF4y2BaggydF4y2Ba在4℃下10分钟,用分光光度计(Optizen Pop, Mecasys Co, Daejeon, Korea)在666 nm和653 nm处测量上清液的吸光度。叶绿素含量gydF4y2Ba一个gydF4y2Ba而且gydF4y2BabgydF4y2Ba均使用Wellburn公式(1994)计算。gydF4y2Ba
实时定量PCRgydF4y2Ba
在9周(营养期)和3个月(生殖期)从叶片、根和小花组织中纯化总RNA,比较其表达模式gydF4y2BaOsDXS1gydF4y2Ba,gydF4y2BaOsDXS2gydF4y2Ba,gydF4y2BaOsDXS3,gydF4y2Ba而且gydF4y2BaOsDXRgydF4y2Ba基因。还从10日龄幼苗的叶片和未处理的成熟种子40 DAF中纯化总RNA,以分析每种转基因植物中胡萝卜素基因的表达模式。冷冻粉末(100 mg)样品在PureLink®植物RNA试剂(Invitrogen)中与DNase I (Qiagen, Hilden, Germany)分离,以去除残留的基因组DNA污染。使用AccuPower®RT Premix (Bioneer, Daejeon, Korea)合成了第一个cDNA,并与SYBR Green Real-time PCR master mix (Bio-Rad)混合。所有反应均使用CFX Connect™实时系统(Bio-Rad),按照制造商的说明在以下条件下进行:95°C下3分钟的1个循环,95°C下15秒的40个循环,以及60°C下30秒的1个循环。采用基因特异性引物F7/R7对进行qRT-PCR进行转基因表达gydF4y2BaOsDXS2gydF4y2Ba, F8/R7 forgydF4y2BaOsDXRgydF4y2Ba,和F9/R9gydF4y2BastPACgydF4y2Ba,如图所示。gydF4y2Ba1gydF4y2Bab和附加文件gydF4y2Ba4gydF4y2Ba:表S7。利用基因特异性引物对22个水稻胡萝卜素发生相关基因的转录本进行了qRT-PCR检测。基因名称、登录号、引物序列和产物大小在附加文件中详细说明gydF4y2Ba4gydF4y2Ba:表S8。为了使RNA的数量归一化,所有的qRT-PCR值都相对于水稻进行计算gydF4y2Ba泛素5gydF4y2Ba该基因(Os01g22490)使用U5F/U5R引物对扩增[gydF4y2Ba44gydF4y2Ba].gydF4y2Ba
统计分析gydF4y2Ba
所有实验至少进行了3次生物重复,结果以均数±标准误差(SE)表示。两组之间任何统计学上的显著差异都是使用双尾学生来确定的gydF4y2BatgydF4y2Ba以及。一个gydF4y2BapgydF4y2Ba值< 0.05为有统计学意义。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中使用和/或分析的材料和数据集可根据合理要求从通讯作者处获得。gydF4y2Ba
缩写gydF4y2Ba
- BCH:gydF4y2Ba
-
β-胡萝卜素羟化酶gydF4y2Ba
- CYP97B:gydF4y2Ba
-
p450型胡萝卜素羟化酶基因gydF4y2Ba
- DMAPP:gydF4y2Ba
-
二甲基烯丙基焦磷酸盐gydF4y2Ba
- DXP:gydF4y2Ba
-
5-磷酸脱氧木质素gydF4y2Ba
- DXR:gydF4y2Ba
-
脱氧木质素5-磷酸还原异构酶gydF4y2Ba
- dx:gydF4y2Ba
-
脱氧木质素5-磷酸合成酶gydF4y2Ba
- Glb:gydF4y2Ba
-
一种水稻胚乳特异性球蛋白gydF4y2Ba
- IPP:gydF4y2Ba
-
异戊基焦磷酸盐gydF4y2Ba
- 议员:gydF4y2Ba
-
4-磷酸甲基赤藓糖醇gydF4y2Ba
- MVA:gydF4y2Ba
-
甲戊酸gydF4y2Ba
- PDS:gydF4y2Ba
-
一种pytoene去饱和酶gydF4y2Ba
- PGD1:gydF4y2Ba
-
水稻磷酸葡萄糖酸脱氢酶1gydF4y2Ba
- 小组:gydF4y2Ba
-
一种pytoene合成酶gydF4y2Ba
- stPAC:gydF4y2Ba
-
一个gydF4y2Ba合成植烯合成酶:2A:CrtIgydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Pichersky E, Raguso RA。为什么植物会产生这么多萜类化合物?中国生物医学工程学报,2016;29(3):344 - 344。gydF4y2Ba
- 2.gydF4y2Ba
雅崎K,有村GI,大西T。植物中的“隐藏”萜类化合物:它们的生物合成、定位和生态作用。中国生物医学工程学报,2017;32(10):1615-21。gydF4y2Ba
- 3.gydF4y2Ba
Gershenzon J, Dudareva N.萜类天然产物在自然界中的作用。中国生物化学杂志,2007;3(7):408-14。gydF4y2Ba
- 4.gydF4y2Ba
Carretero-Paulet L, Cairo A, Botella-Pavia P, Besumbes O, Campos N, Boronat A, Rodriguez-Concepcion M.通过甲基赤藓糖醇4-磷酸途径增强的通量gydF4y2Ba拟南芥gydF4y2Ba过表达脱氧木质素5-磷酸还原异构酶的植物。植物分子生物学杂志,2006;29(4):344 - 344。gydF4y2Ba
- 5.gydF4y2Ba
Estevez JM, Cantero A, Reindl A, Reichler S, Leon P. 1-脱氧- d -木酮糖-5-磷酸合酶,植物可塑性类异戊二烯生物合成的限制酶。中国生物医学工程学报,2001;26(2):339 - 339。gydF4y2Ba
- 6.gydF4y2Ba
黄志刚,李志刚,李志刚。过表达对生物活性枞烷二萜合成的影响gydF4y2BaAtDXSgydF4y2Ba或gydF4y2BaAtDXRgydF4y2Ba基因在gydF4y2Ba鼠尾草sclareagydF4y2Ba多毛的根源。植物细胞组织与器官科学,2014;19(1):1 - 7。gydF4y2Ba
- 7.gydF4y2Ba
Simpson K, Quiroz LF, Rodriguez-Concepcion M, strange CR. MEP途径前两种酶在胡萝卜类胡萝卜素和叶绿素生物合成代谢前体供应中的差异贡献(gydF4y2Ba胡萝卜胡萝卜gydF4y2Ba).前沿植物学报2016;7:1344。gydF4y2Ba
- 8.gydF4y2Ba
穆munoz - bertomeu J, arillaga I, Ros R, Segura J.上调1-脱氧-d -木酮糖-5-磷酸合酶对转基因薰衣草精油产量的影响。植物科学进展。2006;42(3):890-900。gydF4y2Ba
- 9.gydF4y2Ba
Mendoza-Poudereux I, Munoz-Bertomeu J, Arrillaga I, Segura J.脱氧木酮糖5-磷酸还原异构酶不是长穗薰衣草精油生产的速率决定酶。中国生物医学工程学报,2014;29(4):344 - 344。gydF4y2Ba
- 10.gydF4y2Ba
Hasunuma T, Takeno S, Hayashi S,仙台M,班巴T,吉村S,富泽K,福崎E,三宅cgydF4y2Ba1-Deoxy-D-xylulose-5-phosphate reductoisomerasegydF4y2Ba叶绿体中的基因有助于类异戊二烯产量的增加。中国生物工程学报,2008;26(5):519 - 524。gydF4y2Ba
- 11.gydF4y2Ba
徐杨J, Adhikari MN,刘H, H, G,詹R,魏J,陈w .鉴定和功能分析的基因编码1-deoxy-D-xylulose-5-phosphate reductoisomerase 1-deoxy-D-xylulose-5-phosphate合成酶,议员的两种酶通路,gydF4y2Ba砂仁gydF4y2Ba不悦之色。Mol生物学杂志2012;39(8):8287-96。gydF4y2Ba
- 12.gydF4y2Ba
张红,牛东,王娟,张松,杨勇,贾红,崔宏。植物光合色素、激素和膜相关二萜生成平台的构建gydF4y2Ba烟草gydF4y2Ba.中国生物医学工程学报。2015;36(11):344 - 344。gydF4y2Ba
- 13.gydF4y2Ba
Cordoba E, Porta H, Arroyo A, San Roman C, Medina L, Rodriguez-Concepcion M, Leon P.玉米中编码1-脱氧-d -木酮糖5-磷酸合成酶的三个基因的功能特征。应用物理学报,2011;36(6):2023-38。gydF4y2Ba
- 14.gydF4y2Ba
Estevez JM, Cantero A, Romero C, Kawaide H, Jimenez LF, Kuzuyama T, Seto H, Kamiya Y, Leon P. 2-C-甲基-d -赤四醇-4-磷酸通路1-脱氧木糖5-磷酸合酶基因CLA1的表达分析gydF4y2Ba拟南芥gydF4y2Ba.植物科学进展。2000;29(1):1 - 4。gydF4y2Ba
- 15.gydF4y2Ba
金斌,金苏,张玉杰。三的微分表达式gydF4y2Ba1-deoxy-D-xylulose-5-phosphate合酶gydF4y2Ba水稻中的基因。生物技术通报,2005;27(14):997-1001。gydF4y2Ba
- 16.gydF4y2Ba
杨晓明,王晓明,王晓明,等。1-脱氧-d-木酮糖5-磷酸合成酶基因的研究进展。植物学报,2002;31(3):243-54。gydF4y2Ba
- 17.gydF4y2Ba
金SM, Kuzuyama T, Chang YJ,宋ks, Kim SU. 2类识别gydF4y2Ba1-脱氧-d -木酮糖5-磷酸合成酶gydF4y2Ba而且gydF4y2Ba1-脱氧-d -木酮糖5-磷酸还原异构酶gydF4y2Ba基因gydF4y2Ba银杏叶gydF4y2Ba以及它们在胚胎培养中与银杏内酯生物合成相关的转录。中国植物科学,2006;32(3):234-40。gydF4y2Ba
- 18.gydF4y2Ba
Okada A, Shimizu T, Okada K, Kuzuyama T, Koga J, Shibuya N, Nojiri H, Yamane H.激发子诱导甲基赤藓糖醇磷酸途径激活水稻植物抗毒素生物合成。植物化学学报,2007;26(1):357 - 357。gydF4y2Ba
- 19.gydF4y2Ba
Phillips MA, Walter MH, Ralph SG, Dabrowska P, Luck K, Uros EM, Boland W, Strack D, Rodriguez-Concepcion M, Bohlmann J,等。功能鉴定和差异表达gydF4y2Ba1-脱氧-d -木酮糖5-磷酸合成酶gydF4y2Ba挪威云杉萜类树脂的诱导生成(gydF4y2Ba挪威云杉gydF4y2Ba).植物分子生物学杂志,2007;26(3):344 - 344。gydF4y2Ba
- 20.gydF4y2Ba
Floss DS, Hause B, Lange PR, Kuster H, Strack D, Walter MH. MEP途径同工基因的敲除gydF4y2Ba1-脱氧-d -木酮糖5-磷酸合成酶gydF4y2Ba抑制丛枝菌根诱导的类人素的形成,并废除菌根特异性植物标记基因的正常表达。植物学报,2008;26(2):344 - 344。gydF4y2Ba
- 21.gydF4y2Ba
cartero - paulet L, Cairo A, Talavera D, Saura A, Imperial S, rodrigrodriguez - concepcion M, Campos N, Boronat A. 1-脱氧-D-木酮糖5-磷酸合成酶样蛋白的非必需基因DXL1的功能和进化分析gydF4y2Ba拟南芥gydF4y2Ba.基因。2013;524(1):40-53。gydF4y2Ba
- 22.gydF4y2Ba
彭刚,王超,宋松,付旭,Azam M, Grierson D,徐晨gydF4y2Ba1-deoxy-d-xylulose-5-phosphate合酶gydF4y2Ba而且gydF4y2Ba八氢番茄红素合成酶gydF4y2Ba柑橘类胡萝卜素积累的基因家族。植物化学学报,2013;gydF4y2Ba
- 23.gydF4y2Ba
Budziszewski GJ, Lewis SP, Glover LW, Reineke J, Jones G, Ziemnik LS, Lonowski J, Nyfeler B, Aux G, Zhou Q,等。gydF4y2Ba拟南芥gydF4y2Ba幼苗生存所必需的基因:插入突变体的分离和分子克隆。遗传学。2001;159(4):1765 - 78。gydF4y2Ba
- 24.gydF4y2Ba
郑克杰,李俊,Dardick C,徐玉生,曹鹏,Canlas P, Phetsom J,徐旭,欧阳松,安凯,等。水稻光响应基因及其家族成员的鉴定与功能分析。公共科学学报,2008;4(8):e1000164。gydF4y2Ba
- 25.gydF4y2Ba
李文杰,李文杰,李文杰,李文杰,等。基因结构功能机制的研究进展gydF4y2BadxrgydF4y2Ba基因gydF4y2BaCymbopogon winterianusgydF4y2Ba.FEBS Open Bio. 2015; 5:325-34。gydF4y2Ba
- 26.gydF4y2Ba
Howitt CA, Pogson BJ。类胡萝卜素在种子和非绿色组织中的积累和功能。植物细胞环境。2006;29(3):435-45。gydF4y2Ba
- 27.gydF4y2Ba
黄金大米和人类营养的“黄金”作物。生物技术学报。2010;27(5):478-81。gydF4y2Ba
- 28.gydF4y2Ba
Burkhardt PK, Beyer P, Wunn J, Kloti A, Armstrong GA, Schledz M, von Lintig J, Potrykus I.转基因水稻(gydF4y2Ba栽培稻gydF4y2Ba)表达水仙的胚乳(gydF4y2Ba水仙pseudonarcissusgydF4y2Ba)植物素合成酶可积累植物素,植物素是生物合成维生素原的关键中间体。植物学报,1997;11(5):1071-8。gydF4y2Ba
- 29.gydF4y2Ba
叶霞,张娟,张娟,张晓霞,张晓霞,张晓霞。维生素原A (β -胡萝卜素)生物合成途径在水稻胚乳中的应用。科学。2000;287(5451):303 - 5。gydF4y2Ba
- 30.gydF4y2Ba
Paine JA, Shipton CA, Chaggar S, Howells RM, Kennedy MJ, Vernon G, Wright SY, Hinchliffe E, Adams JL, Silverstone AL,等。通过增加原维生素a含量来提高黄金大米的营养价值。生物技术学报。2005;23(4):482-7。gydF4y2Ba
- 31.gydF4y2Ba
河诗,梁玉生,郑海,安敏梅,徐寿,权士杰,金德华,金玉敏,金金俊。2A和IRES双电子系统在水稻胚乳类胡萝卜素生物合成中的应用。植物学报,2010;8(8):928-38。gydF4y2Ba
- 32.gydF4y2Ba
郑玉生,顾鸿科,金继科,尤明凯,林珊珊,金继科,夏夏。密码子优化对提高水稻胚乳β-胡萝卜素含量的影响。植物生物技术,2017;11:171-9。gydF4y2Ba
- 33.gydF4y2Ba
白晨,朱晨,朱晨。水稻胚乳中类胡萝卜素合成和积累的瓶颈受前体产物平衡的影响。中国生物工程学报,2016;14(1):195-205。gydF4y2Ba
- 34.gydF4y2Ba
Enfissi EM, Nogueira M, Bramley PM, Fraser PD。番茄果实类胡萝卜素形成的调控。植物学报,2017;29(4):344 - 344。gydF4y2Ba
- 35.gydF4y2Ba
Morris WL, Ducreux LJ, Hedden P, Millam S, Taylor MA。马铃薯块茎中细菌1-脱氧-d -木酮糖5-磷酸合酶基因的过表达扰乱了类异戊二烯代谢网络:对块茎生命周期控制的意义。中国机械工程学报,2006;26(12):457 - 457。gydF4y2Ba
- 36.gydF4y2Ba
桑kari M, Hridya H, Sneha P, Doss CGP, Christopher JG, Mathew J, Zayed H, Ramamoorthy S.盐胁迫诱导色素生成、抗氧化酶活性和qRT-PCR基因表达的变化gydF4y2BaBixa奥雷利亚纳gydF4y2Ba中国生物医学工程学报,2019;19(4):565-74。gydF4y2Ba
- 37.gydF4y2Ba
格瓦拉-加西亚A,圣罗曼C,阿罗约A,科尔特斯ME,德拉卢兹G-NM,莱昂pgydF4y2Ba拟南芥clb6gydF4y2Ba突变说明了甲基- d -赤藓糖醇4-磷酸通路转录后调控的重要性。植物学报。2005;17(2):628-43。gydF4y2Ba
- 38.gydF4y2Ba
Welsch R,周旭,袁宏,Alvarez D,孙涛,Schlossarek D,杨勇,沈刚,张宏,Rodriguez-Concepcion M,等。植物素合成酶是类胡萝卜素生物合成的关键酶,Clp蛋白酶和OR直接控制植物素合成酶的蛋白平衡gydF4y2Ba拟南芥gydF4y2Ba.植物学报,2018;11(1):149-62。gydF4y2Ba
- 39.gydF4y2Ba
韩敏,苏涛,朱玉玉,朱晓霞,李志刚,等。MEP抑制剂对大鼠MEP通路酶表达的影响gydF4y2BaCatharanthus roseus也叫gydF4y2Ba.公共科学图书馆,2013;8(5):e62467。gydF4y2Ba
- 40.gydF4y2Ba
朴硕,尹宁,金ys,郑明明,方伟,崔永德,金钟。转基因水稻中5个新的假定组成基因启动子的分析。中国机械工程学报,2010;29(3):344 - 344。gydF4y2Ba
- 41.gydF4y2Ba
Komari T, Hiei Y, Saito Y, Murai N, Kumashiro T.携带两个独立T- dna的载体,用于高等植物的共同转化gydF4y2Ba根癌土壤杆菌gydF4y2Ba以及分离没有选择标记的转化子。植物学报,1996;10(1):164 - 164。gydF4y2Ba
- 42.gydF4y2Ba
平荣,大田生,小ari T,熊世代,水稻高效转化(gydF4y2Ba栽培稻gydF4y2BaL.由gydF4y2Ba农杆菌属gydF4y2Ba以及T-DNA边界的序列分析。植物学报,1994;6(2):271-82。gydF4y2Ba
- 43.gydF4y2Ba
河SH,金志奎,郑ys,尤mk,林士,金志奎。水稻胚乳中玉米黄质、虾青素和辣椒红素生物合成的逐步途径工程。Metab Eng. 2019; 52:178-89。gydF4y2Ba
- 44.gydF4y2Ba
Jain M, Nijhawan A, Tyagi AK, Khurana JP。利用实时定量PCR技术研究水稻基因表达的内控基因的有效性。生物化学与生物物理学报。2006;34(2):646-51。gydF4y2Ba
致谢gydF4y2Ba
不适用。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了韩国农村发展局资助的下一代生物绿色21计划(PJ01334601和PJ01368801 to SH Ha)的资助。资助者在研究设计、数据分析和解释以及手稿撰写中没有任何作用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
SHH协调了这个项目并监督了手稿。MKY与SHH一起设计了这项研究,并撰写了手稿。YJL、YAJ和SHL构建了本研究中所有水稻转基因植株,JKK和SAB分析了类胡萝卜素和叶绿素的含量,MKY和YJL进行了所有类胡萝卜素基因的表达谱分析。所有作者均已阅读并批准最终稿。SHH为通讯作者,负责所有联系和通信。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
植物II型脱氧木糖5-磷酸合成酶(DXS)蛋白中推导出的氨基酸序列的比对。gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
植物脱氧木糖5-磷酸还原异构酶(DXR)蛋白中推导出的氨基酸序列的比对。gydF4y2Ba
附加文件3:图S3。gydF4y2Ba
基因组DNA分析,以验证转基因在水稻基因组中的整合和拷贝数。gydF4y2Ba
附加文件4:表S1。gydF4y2Ba
转基因水稻叶片中类胡萝卜素的含量和组成。gydF4y2Ba表S2。gydF4y2Ba转基因水稻叶片中的叶绿素含量。gydF4y2Ba表S3。gydF4y2Ba转基因水稻成熟种子中类胡萝卜素的含量和组成。gydF4y2Ba表S4。gydF4y2Ba水稻叶片类胡萝卜素生物合成相关结构基因的表达谱。gydF4y2Ba表S5。gydF4y2Ba水稻种子胡萝卜素生物合成中添加底物相关结构基因的表达谱。gydF4y2Ba表S6。gydF4y2Ba水稻种子叶黄素生物合成相关结构基因的表达谱。gydF4y2Ba表S7。gydF4y2Ba引物表用于载体构建和转基因分析。gydF4y2Ba表S8。gydF4y2Ba引物表用于水稻基因表达分析。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
你,M,李,Y,金,J。gydF4y2Baet al。gydF4y2Ba水稻MEP途径的前两种酶DXS和DXR在类胡萝卜素代谢中的器官特异性差异作用gydF4y2Ba栽培稻gydF4y2Ba叶子和种子。gydF4y2BaBMC植物生物学gydF4y2Ba20.gydF4y2Ba167(2020)。https://doi.org/10.1186/s12870-020-02357-9gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02357-9gydF4y2Ba
关键字gydF4y2Ba
- OsDXSgydF4y2Ba
- OsDXRgydF4y2Ba
- 速率限制步骤gydF4y2Ba
- 议员通路gydF4y2Ba
- 类胡萝卜素gydF4y2Ba
- 大米gydF4y2Ba