摘要
背景
三酰甘油(TAGs)是植物种子油的主要成分。长链酰基辅酶A合成酶(LACSs)催化合成长链酰基辅酶A,是合成TAG的主要底物之一。在拟南芥, LACS基因家族包含9个成员,其中LACS1而且LACS9在TAG生物合成中具有重叠功能。然而,关于油菜LACS蛋白功能的研究报道较少。
结果
的同词拟南芥LACS2基因(BnLACS2),在发育中的种子中高度表达,在油菜籽(芸苔属植物显著).的BnLACS2-GFP融合蛋白主要定位于内质网,TAG生物合成发生在内质网。有趣的是,过度表达BnLACS2与野生型相比,转基因油菜的含油量显著增加BnLACS2-RNAi转基因油菜植株含油量降低。此外,实时荧光定量PCR的表达数据显示,在转基因植物中,与糖酵解、脂肪酸(FA)和脂质生物合成相关的几个基因的表达也受到影响。
结论
一种长链酰基辅酶A合成酶,BnLACS2,位于内质网中被鉴定为显著.过度的BnLACS2在酵母和菜籽粕中可以增加油分含量,而BnLACS2-RNAi转基因油菜植株含油量降低。此外,BnLACS2转录增加了种子发育过程中糖酵解、FA和脂质合成相关基因的表达。这些结果表明BnLACS2是种子油生产的重要因素显著.
背景
油菜(芸苔属植物显著。L)是世界四大油料植物之一,在生产供人类食用的植物蛋白和食用油方面发挥着重要作用。此外,种子油是生物燃料和制药工业的重要原料,具有巨大的经济价值和近年来的高需求[1,2].因此,提高种子含油量对遗传育种具有重要意义,已成为油料作物研究的一个主要课题[3.,4].
植物油主要在种子成熟期积累,为种子萌发和幼苗生长提供碳和能量[5,6].种子油主要由三酰甘油(TAGs)组成,占种子重量的60%,是真核细胞中最有效的能量储存形式[7,8].鉴于TAG的重要作用,了解限制其积累的因素有助于通过基因工程提高TAG含量。在开发油籽过程中,TAG的生物合成发生在内质网(ER)中。碳水化合物和脂肪酸(FA)代谢也参与这一途径。在细胞质和质体中,己糖通过糖酵解途径转化为乙酰辅酶a,其中一部分被用作合成FA的碳源。FAs可转化为长链酰基辅酶a,是TAG生物合成的前体。许多基因编码的酶参与糖酵解,以及FA和脂质生物合成在这一途径中发挥关键作用。其中,编码长链酰基辅酶a合成酶的基因(LACS, EC 6.2.1.3)在CoA、ATP和Mg存在下催化游离FAs生成酰基辅酶a硫酯2 +.它是原核生物和真核生物FA代谢的关键过程,涉及两步反应。在第一步中,游离的FAs与ATP反应生成酰基-AMP,之后形成酰基-辅酶a硫酯键,AMP在接下来的步骤中被释放[9,10].LACSs属于AMP结合蛋白(AMPBP)超家族,主要催化合成12-20个碳的酰基辅酶a [11].以往的研究表明,lacs在几乎所有fa衍生的途径中都占有重要地位,包括脂质代谢、茉莉酸生物合成和β-氧化[12,13],以及各种微生物和哺乳动物细胞内FA的内稳态和转运[14,15,16].在硅藻Phaeodactylum tricornutum,一种较低的光合作用生物体,有5个假定的lacs (PtACSL1-5),其中只有两种能够恢复酵母双突变体的生长,促进外源FA的吸收,增强脂质积累,FAA1ΔFAA4Δ[17].这些研究为研究lacs介导的FA和不同生物体内脂质代谢提供了分子基础。
在高等植物中,lacs有几种异构体,在不同的细胞室中执行不同的生物功能[10,18,19,20.,21].在拟南芥,有九个虫胶参与FA和甘油脂代谢的基因。其中7种可以有效补充lacs缺陷酵母突变株YB525的生长表型。不能补充生长表型的两种是过氧化物异构体[13].AtLACS1而且AtLACS2定位于ER,在蜡和角质合成中具有重叠功能,具有超长链酰基辅酶A合成酶活性[22,23,24].AtLACS1而且AtLACS4在花粉被膜形成过程中表现出协同作用[25].AtLACS6而且AtLACS7参与过氧化物酶体β-氧化并成功成苗[10,26].LACS9位于叶绿体包膜上,参与酰基辅酶a的产生[21],其功能与的部分重叠LACS1而且LACS4分别在TAG生物合成和脂质从ER转运到质体的过程中起重要作用拟南芥[18,27].在其他植物中也发现了LACS同源物,如油菜籽、水稻、大豆和棉花等。一种过氧化物酶病GmACSL2从大豆可能参与种子萌发过程中FA和脂质的降解[28].向日葵HaLACS1而且HaLACS2,显示序列与拟南芥LACS9而且LACS8基因分别在种子发育过程中高水平表达,并在葵花籽油合成中发挥重要作用[29].
先前的研究表明有6种同源基因虫胶基因在显著,其中包括BnLACS2,酶活性在什么时候表达大肠杆菌[30.,31].但是,其生化特性和生理功能BnLACS2仍无特征。在这项研究中显著BnLACS2克隆了该基因,并对其在种子油脂生产中的作用进行了研究。过度的BnLACS2在油菜植株中导致油分含量的提高,而在油菜中抑制基因表达降低油分含量。研究还显示,在BnLACS2基因功能与糖酵解生理过程、FA和脂类合成有关。
结果
BnLACS2的同义词是拟南芥LACS2在油菜籽
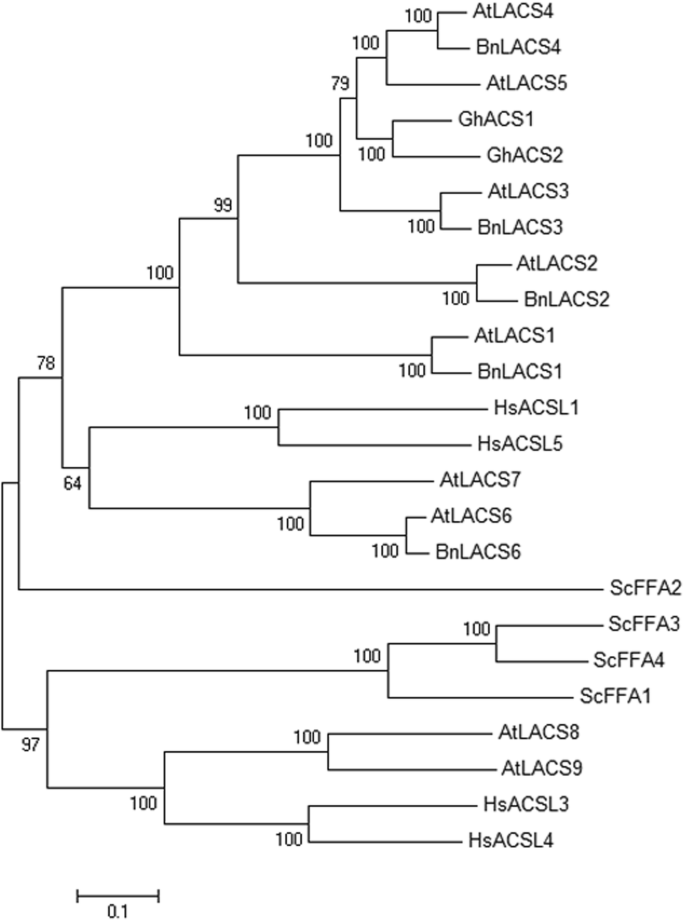
利用的蛋白质序列在LACS2 (NP_175368)作为查询探针,两个高度同源序列(BnaC05g51350D而且BnaA05g16170D)从芸苔属植物基因组数据库和推定的全长cDNA (2001 bp)BnaA05g16170D轨迹(指定为BnLACS2)克隆自中爽9号品种(补充文件1:图S1)。BnLACS2含667个氨基酸残基,理论等电点为6.07,计算分子量为74.35 kDa。序列分析显示BnLACS2具有保守的amp结合结构域,是AMPBP超家族的特征结构域。使用ScanProsite Results Viewer软件对其他LACS序列的Motif分析也发现了显著的amp结合域,这意味着该Motif对LACS具有重要的功能。氨基酸序列Bn将LACS2蛋白与来自不同物种的24条LACS序列进行比对,包括显著,陆地棉,拟南芥,酿酒酵母,而且智人.根据该氨基酸序列构建了系统发育树,结果表明,两者之间存在密切的遗传关系BnLACS2而且拟南芥LACS2,表明它们可能具有相似的功能(图。1).
LACS蛋白家族的系统发育分析。分支旁边的数字表示1000次复制的bootstrap。加入编号如下:在拟南芥LACS1 (NP_182246),在LACS2 (NP_175368),在LACS3 (NP_176622),在LACS4 (NP_194116),在LACS5 (AAM28872),在LACS6 (NP_566265),在LACS7 (NP_198112),在LACS8 (NP_178516),在LACS9 (NP_177882),Gossypium hisutum GhACS1 (ABA00144),“大酒店”ACS2 (ABA00145),显著BnLACS1 (BnaC04g51420D),BnLACS2 (BnaA05g16170D),BnLACS3 (BnaC09g11030D),BnLACS4 (BnaC01g15670D),BnLACS6 (BnaA03g29320D),智人HsACSL1 (NP_001986),海关ACSL3 (NP_976251),海关ACSL4 (NP_004449),海关ACSL5 (NP_976313),酿酒酵母ScFFA1 (NP_014962),ScFFA2 (NP_010931),ScFFA3 (NP_012257),ScFFA4 (NP_013974)。执行引导以获得每个分支的支持值
BnLACS2可以补充YB525酵母突变体
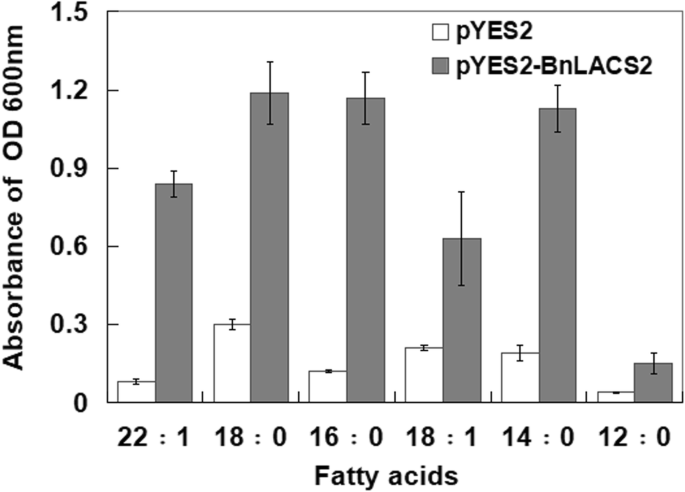
之前的研究表明BnLACS2具有体外酶活性[31];然而,它的确切功能和作用机制尚未被发现。酵母表达系统是生产重组真核蛋白的有力工具。而且,酵母细胞可以积聚油脂,这与菜籽油体类似[32].因此,酵母表达系统适合于研究脂质代谢途径中基因的功能。YB525酵母突变体缺乏酰基辅酶a合成酶活性,为评估这类酶的功能作用提供了一个独特的工具[33].拟南芥LACS2具有酶活性,可以补充缺乏lacs的YB525菌株[13].以确定是否BnLACS2在体内具有类似的活性,BnLACS2克隆到pYES2,转化到YB525。转化体以月桂酸12:0、肉豆花酸14:0、棕榈酸16:0、硬脂酸18:0、油酸18:1、芥酸22:1等多种FAs为唯一碳源的液体培养基培养。然后根据光密度(OD)评价各菌株的生长情况。如图所示。2, pYES2-的变换BnLACS2挽救YB525在含有14:0、16:0、18:0、18:1、22:1 FAs的培养基中生长缺陷,而不是12:0 FAs,即短链FA。然而,用pYES2控制载体转化的酵母细胞无法在以FAs为唯一碳源的培养基中生长。此外,酵母细胞含有pYES2-BnLACS2构象偏好使用18:0 FAs作为生长碳源。因此,BnLACS2具有酰基-辅酶a合成酶活性,底物偏好长链FAs。
表达式的分析BnLACS2在油菜不同组织和不同发育阶段
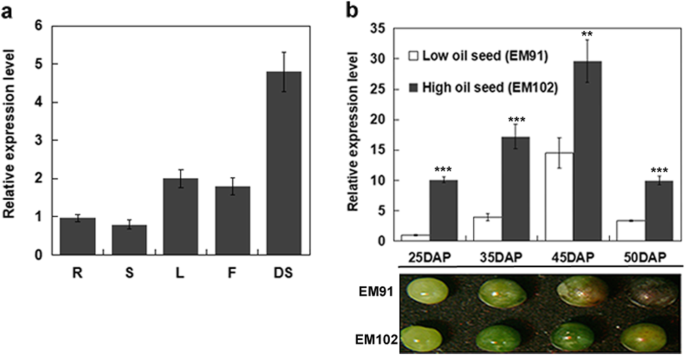
虽然BnLACS2能激活游离FA,其生理功能尚不清楚。考虑到LACS基因的组织分布可能与其功能密切相关,采用定量逆转录聚合酶链反应(qRT-PCR)检测LACS基因的表达模式BnLACS2授粉后25天,在不同的油菜籽组织中,包括根、茎、叶、花和发育中的种子(DAP)。结果表明BnLACS2该基因在所有检测的组织中都有表达,但主要在TAG被积极合成的发育种子中表达(图4)。3.a).此外,丰度存在明显差异BnLACS2高、低含油量种子在25 DAP、35 DAP、45 DAP和50 DAP之间的转录产物。无论表达是在高含油量或低含油量的种子中评估,BnLACS2在45 DAP强烈表达,这是一个阶段,TAG积累在高速率(图。3.b).根据上述转录分析结果,BnLACS2可能参与在种子发育过程中为TAG生物合成提供酰基辅酶a。
的表达模式BnLACS2.一个中存在的分析BnLACS2根(R),茎(St),叶(L),花(F),发育中的种子(DS, DAP25)。相对于从根中获得的值,表达水平被量化。b的表达模式BnLACS2低含油量(EM91)和高含油量(EM102)种子的不同发育阶段。在25 DAP、35 DAP、45 DAP和50 DAP的种子发育过程中拍照。相对于EM91 (25 DAP)的表达水平进行定量。误差条代表SD (n= 3)。EM91和EM102在每个时间点(25 DAP, 35 DAP, 45 DAP和50 DAP)的显著差异被指出(学生的t-test),如下所示:P< 0.001;**P< 0.01;*,P< 0.05
亚细胞定位BnLACS2
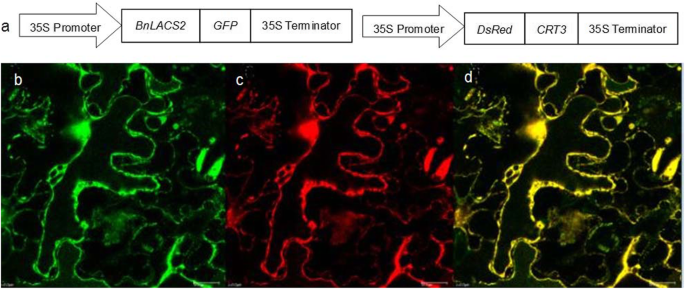
在高等植物中,不同亚细胞定位的LACS蛋白可能参与不同的代谢途径。已知ER是FA碳链延伸和脂质合成的重要位点。在LACS2同源于BnLACS2,位于ER。因此,我们推测BnLACS2也是一种内质网蛋白。为确定其定位,我们选择CRT3 (calreticulin 3, CRT3)作为ER定位标记[34]与红色荧光蛋白(DsRed)融合(图2)。4右)。Bn在CaMV 35S启动子控制下,利用pK7FWG2.0载体将LACS2表达为与绿色荧光蛋白(GFP)融合的蛋白(图3)。4左)。质粒,35 s:: BnLACS2-GFP而且35 s:: DsRed-CRT3,并转染到叶表皮细胞烟草benthamiana瞬时表达。如图所示。4b-d, GFP荧光由Bn发现LACS2-GFP融合蛋白与DsRed- crt3融合蛋白产生的DsRed荧光重叠,表明BnLACS2与CRT3共定位于ER,即TAG生物合成位点。
BnLACS2转基因酵母和油菜籽的表达与脂质和脂肪酸含量相关
表达模式及亚细胞定位分析BnLACS2提示它可能参与了种子油的生产。的功能BnLACS2首先被鉴定为酿酒酵母pep4四种空泡蛋白酶活性至少降低90%的突变体[35].用苏丹黑B染色法测定宿主酵母细胞中中性脂质的相对含量。结果表明,其吸光度值BnLACS2与空pYES2转化对照相比,-转化细胞系增加了85.7%。此外,BnLACS2过表达导致酵母产生新的磷脂成分。根据气相色谱-质谱(GC-MS)分析,异源表达BnLACS2也显著提高了总FAs的合成,尤其是两种主要的FA成分,棕榈油酸(C16:1)和油酸(C18:1)(附加文件2:图S2)。
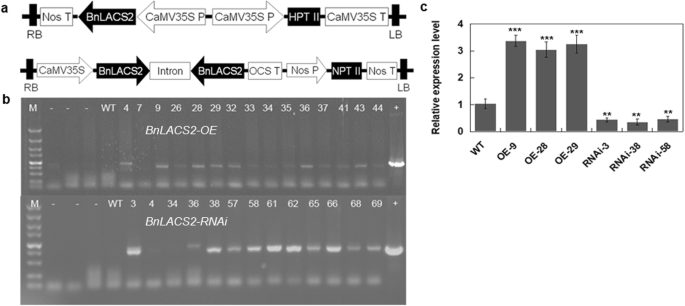
进一步确定的功能BnLACS2向量,BnLACS2超表达(OE)和BnLACS2-RNAi构建并转化到油菜籽(显著l .简历。中爽9)采用花浸法(图。5a).通过PCR初步筛选耐潮霉素或卡那霉素的油菜转化子。选取几株独立转化的T0转基因植株,培养至成熟,获得纯合子株系(图;5b).检测BnLACS2在T2转基因株系中进行qRT-PCR转录结果显示其表达水平较高BnLACS2-OE转基因植株比未转化对照植株表达量更低BnLACS2-RNAi转基因植株,与对照相比(图1)5c).表型BnLACS2oe和BnLACS2-RNAi转基因植物也进行了分析。与非转基因植株相比,转基因植株表型正常,形态变化不明显。进一步确定是否BnLACS2,我们利用近红外光谱(NIRS)结合核磁共振(NMR)对T2转基因油菜植株的种子含油量进行了分析,两种方法的结果一致。如表所示1而且2的含油量BnLACS2oe植株增加了6 - 8%,减少了3 - 6%BnLACS2-RNAi转基因植物,与野生型植物相比。气相色谱-质谱分析显示过表达BnLACS2也显著增加了C18:2、C20:0、C20:1、C22:0等长链FAs的含量。6).这些结果表明,表达BnLACS2油菜籽和酵母细胞中脂质和FAs含量增加。因此,作为一种催化游离FAs生成长链酰基辅酶的重要酶,BnLACS2在油菜籽生产中起着重要作用。
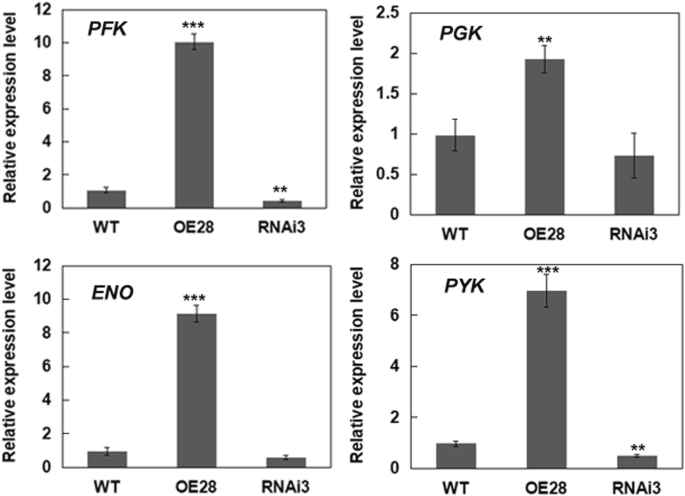
BnLACS2过表达影响种子发育过程中糖酵解相关基因的表达
的表达BnLACS2在酵母pep4能提高脂质和脂肪酸含量。进一步表征的效果BnLACS2pYES2和pYES2-蛋白在控制脂质和FA合成方面的作用BnLACS2利用双向凝胶电泳(2-DE)对转化子进行分离。结果表明,pYES2-中部分糖酵解酶表达上调BnLACS2转化株(附加文件3.而且4:图S3和表S1)。基因表达引起糖酵解酶的上调BnLACS2促使我们检测这些基因是否在BnLACS2转基因油菜籽植物。qRT-PCR分析结果显示,该菌的主要糖酵解酶基因有表达磷酸果糖激酶(PFK),磷酸甘油酸酯激酶(PGK),烯醇酶(伊诺),丙酮酸激酶(PYK)[36,37,38的数量显著增加BnLACS2-OE转基因植株中,这些基因的表达降低BnLACS2-RNAi转基因植物与非转基因植物的比较7).这一结果表明BnLACS2影响种子发育过程中糖酵解基因的表达。
高水平的BnLACS2的活性改变了种子发育过程中FA和脂质合成基因的表达
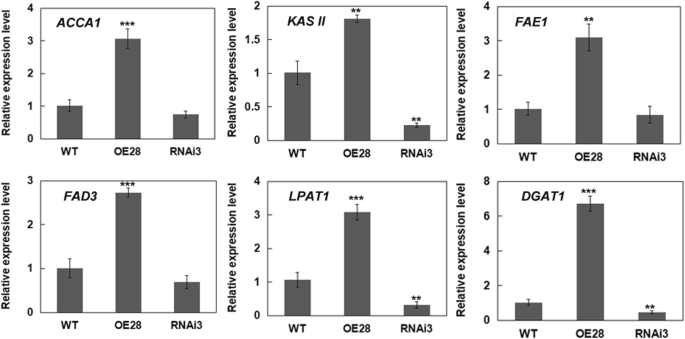
从以上结果中,我们发现对BnLACS2活性水平影响糖酵解基因表达,但其作用机制尚不清楚。进一步了解的作用BnLACS2在控制种子油脂生产的过程中,研究了种子发育过程中FA和脂质合成通路中几个代表性基因的表达水平,包括乙酰辅酶a羧化酶1(ACC1),beta-ketoacyl——(酰基载体蛋白)(ACP)合酶(内二世),脂肪酸ELONGATION1(FAE1),脂肪酸去饱和酶3(FAD3),lysophosphatidyl酰基转移酶1(LPAT1),二酰基甘油酰基转移酶1(DGAT1).在这些基因,ACC1而且KASII参与了FA缩合反应[39,40),而FAE1而且FAD3分别参与FA链延伸和去饱和反应[41,42].LPAT1而且DGAT1与脂类生物合成有关[43,44].表达谱分析表明,这些基因均显著增加BnLACS2-OE转基因植株和减少BnLACS2-RNAi转基因植物与野生型植物比较(图1)8).这些结果表明,高水平BnLACS2可改变种子发育过程中FA和脂质合成基因的表达,在种子的油脂生产中发挥重要作用,但由于LACS的其他活性变化有限(±10%),因此应与LACS的其他活性有关。
讨论
油菜是世界上主要的油料作物,在经济和农业生产中发挥着重要作用。提高油菜籽含油量具有重要的经济价值,是油菜育种的一大挑战。乳酸盐是影响FA和脂代谢的重要因素。许多LACS蛋白已经在模型植物中进行了研究,拟南芥和大米(13,45].然而,对油菜LACS蛋白功能的研究却鲜有报道。在本研究中,LACS基因BnLACS2从中双9号油菜中提取的BnLACS2编码一种LACS蛋白,可使LACS缺陷酵母株(YB525)在互补时恢复正常生长。此外,过度的BnLACS2酵母和油菜均能显著提高油脂含量。因此,BnLACS2是油菜高含油量育种的候选基因。
BnLACS2包含保守的amp结合域,这是典型的AMPBP基因超家族,在通过腺苷酸活化羧酸的过程中共享一个机制步骤[46].系统发育分析表明BnLACS2同源于拟南芥AtLACS2(无花果。1),它已被证明可以挽救lacs缺陷酵母(YB525)的生长缺陷[13].基于序列之间的同源性BnLACS2而且AtLACS2据推测,它们可能具有类似的功能。结果表明,异质表达BnLACS2也可以补充YB525酵母突变体。酵母互补试验不仅证实了长链酰基辅酶a合成酶的活性BnLACS2也显示其对底物的偏好和特异性。YB525酵母细胞经BnLACS2在含不同碳链长度(C12-C22) FAs的营养不良培养基中均能存活。结果表明,以长链FAs (C14-C22)为碳源时,与YB525相关的生长缺陷得到拯救BnLACS2表达,但不含短链FAs (C12)。这些结果表明BnLACS2具有较高的酰基辅酶a合成酶活性,在FAs对酰基辅酶a的激活中发挥重要作用。此外,BnLACS2优选地利用长链FAs作为底物(图;2),因此,BnLACS2是一个长链酰基辅酶a合成酶基因。
多项研究报道,几种植物lacs在不同组织中表现出不同的表达模式[13,20.,28,29].在我们的研究中,BnLACS2主要表达在发育中的种子中,TAG被积极合成(图1)。3.a).的进一步分析BnLACS2胚胎发育25 - 50 DAP的表达模式表明BnLACS2在45 DAP强烈表达,这是TAG以高速率积累的点(图。3.b).这些数据表明BnLACS2可能参与与种子油生产有关的代谢过程。有报道称,植物中的LACS蛋白可能定位于不同的细胞器组分,以确定LACS蛋白的功能[18,30.,47].与上述数据一致的是,亚细胞定位分析显示,gfp标记BnLACS2以及标记为dsred的ER定位标记CRT3是共同定位的,这说明BnLACS2定位于TAG生物合成位点(图2)。4).同样,一些位于ER的植物LACS蛋白也被报道在TAG生物合成中发挥作用,包括拟南芥LACS1和向日葵LACS2[27,29].因此,BnLACS2在种子发育过程中参与激活长链FAs进行脂质合成。此外,BnLACS2在叶片中表达水平较高,这与拟南芥LACS2角质生物合成[23,24].然而,功能AtLACS2在种子油的生物合成方面仍不清楚。
评估…的贡献BnLACS2在标签生产,BnLACS2oe和BnLACS2获得-RNAi转基因植株,并对其种子含油量进行分析。结果表明,转基因油菜植株过度表达BnLACS2与野生型相比,rnai介导的基因在种子中具有更高的含油量BnLACS2与野生型相比,沉默导致了更低的含油量1而且2).类似地,的表达式BnLACS2在pep4酵母显著增加脂肪和FA含量(附加文件2:图S2)。因此,这些结果表明BnLACS2参与TAG生物合成。此外,这两个BnLACS2oe和BnLACS2-RNAi转基因植株生长发育正常。因此,BnLACS2可能是提高油菜籽粒含油量的较好候选基因,且不产生负作用。
酵母蛋白的2-DE分析显示BnLACS2导致与糖酵解相关的表达谱改变(附加文件4:表S1)。在转基因油菜植株中,过表达BnLACS2也会影响糖酵解基因的表达。7).此外,糖酵解活性的增加伴随着酵母脂质含量的增加BnLACS2这可能是由于碳通量增加到FA生物合成途径。在细胞质和质体中,己糖通过糖酵解途径转化为乙酰辅酶a,其中一部分作为合成FA的碳源。这个结果表明BnLACS2也会影响脂肪酸和脂类生物合成。因此,作为……的结果,就不足为奇了BnLACS2脂质合成途径,包括ACC1,KASII,FAE1,FAD3,LPAT1,DGAT1,被上调BnLACS2转基因植物,并下调BnLACS2沉默植物(图。8).
先前的研究表明,FAs的转运涉及两个过程,包括以酰基-ACP的形式从头合成塑料FAs,然后通过硫酯酶从ACP释放,随后通过LACS作用以酰基-辅酶a的形式从质体输出;因此,为ER中TAG的组装提供酰基供体[48,49,50].因此,lacs介导质体中FA的从头合成和ER中脂质的生物合成[29,48].酰基辅酶a酯除了在TAG合成中起重要作用外,还在植物的酰基链延长反应、β-氧化等脂质代谢中起着代谢中间体的作用[45].一般认为外线粒体和过氧化物体膜上合成的酰基辅酶a用于氧化[28,51],而那些在ER中合成的则扮演着合成的角色[27].然而,酰基辅酶a在细胞内的分割仍不清楚。在这项研究中,BnLACS2以ER为靶点,这表明FAs通过质体运输并不需要LACS2。与此同时,测定了黄芪多糖的脂质和脂肪酸含量pep4对酵母突变体进行改良BnLACS2超表达;因此,建议BnLACS2有能力为TAG合成提供酰基辅酶a底物[52].为了平衡细胞质和内质网中的酰基辅酶a库,我们推测一些酰基辅酶a酯在细胞质中释放CoA的同时被输出到内质网。然后,长链FAs被LACS重新激活形成酰基辅酶a酯,如BnLACS2;因此,促进了TAG在ER中的积累。然而,它只是一种可能的功能方式,通过它,过度表达BnLACS2导致酵母和油菜籽中脂质含量增加,需要进一步研究来证实这一推论。
结论
在目前的研究中,BnLACS2的同义词拟南芥LACS2基因是决定四倍体种子含油量的重要因素。显著.BnLACS2与野生型相比,过表达提高了油菜籽含油量,而RNAi沉默降低了油菜籽含油量。此外,水平的改变Bn在转基因植物中,LACS2与糖酵解、FA和脂质合成途径的增强或减弱有关。这些结果表明BnLACS2基因是通过基因操作提高油菜籽油产量的一个潜在目标。根据我们的数据,我们推测BnLACS2水平可改变细胞不同部位的三种代谢途径,包括糖酵解、FA合成和脂质合成。然而,精确的分子机制是由BnLACS2影响这些生理过程基因表达的因素有待进一步研究。
方法
植物材料及生长状况
植物的显著(中双9号)由中国农业科学院油料作物研究所获得,在江苏大学镇江试验田种植。为了进行组织特异性表达分析,将油菜籽的根、茎、叶、花和发育中的种子收集并保存在−70°C。低(EM91)和高(EM102)油菜籽系均来自南京农业大学作物遗传与种质创新国家重点实验室。在25、35、45和50 DAP采集种子组织。烟草benthamiana在植物生长室内生长5-6周,光照时间16 h/d,调节温度的白夜周期为22/20℃。
序列的分析BnLACS2
的全长编码区域BnLACS2利用?的蛋白质序列获得AtLACS2(NP_175368)搜索芸苔属植物基因组序列数据库(http://www.genoscope.cns.fr/blat-server/cgi-bin/colza/webBlat).利用ExPASy数据库中的ProtParam工具(http://web.expasy.org/protparam/).利用国家生物技术信息中心(NCBI,http://www.ncbi.nlm.nih.gov的ScanProsite结果查看器(http://us.expasy.org/prosite/).利用NCBI和blast方法从非冗余蛋白序列数据库中检索植物LACS的氨基酸序列芸苔属植物基因组序列数据库。利用ClustalW程序对LACS同源氨基酸序列进行多重比对分析[53].系统发育分析采用MEGA 5.0软件中的Neighbor-joining算法[54].
亚细胞定位BnLACS2
使用Trizol RNA制备试剂盒(美国Invitrogen公司)从中爽9号发育中的种子中提取总RNA,按照制造商的操作规程。以1-2 μg总RNA为模板,oligo (dT)为引物,逆转录酶(Fermentas)为引物,合成第一链cDNA。基因的cDNABnLACS2引物5 ' - atgtacacaagcgggacgaac -3 '和5 ' -ACGCCAGTATCCAACAGAGG-3 '通过PCR扩增该基因,并克隆到pMD18 T质粒中。观察其亚细胞定位BnLACS2,平动融合BnLACS2-pK7FWG2.0和CRT3-pCX-DR构建并转化为根癌土壤杆菌使用Karimi等人描述的冻融法提取GV3101菌株。[55].瞬时表达的亚细胞分布35 s: BnLACS2-GFP而且35 s: DsRed-CRT3在n benthamiana使用徕卡TCS扫描共聚焦显微镜观察,如前所述[56,57].
酵母转化和互补
基因的cDNABnLACS2用引物F: 5′-ggtaccATGGCTGCAGCTGCTGATCATG-3′和R: 5′-ggatccCTAGCTCTGGACGCCTTTGCTTC-3′扩增基因,插入到多个克隆位点(Kpn I / BamH我)来生成pYES2-BnLACS2向量。重组质粒pYES2-BnLACS2, pYES2空载体通过尿嘧啶auxotrophy导入YB525酵母菌株[13,58].利用合成Dropout Medium-Uracil (SC/ura)筛选阳性重组克隆−)板中添加0.67% (w/v)缺乏氨基酸的酵母氮碱,0.077% (w/v)尿嘧啶默认混合物,2% (w/v)葡萄糖。随机选取单个菌落,在SC/ura-液体培养基中培养至对数生长期。收集细胞,在3 - 5ml SC/ura中孵育−2%半乳糖液体培养基4小时。将细胞浓度调整至均匀后,将30 μL培养物移至3 ml SC/ura上−以2%半乳糖+ 98 μM不同FAs为唯一碳源,分别为:12:0月桂酸、14:0肉豆花酸、16:0软脂酸、18:0硬脂酸、18:1油酸和22:1芥酸溶解在0.1%的Triton X-100中。培养物在30℃下培养84 h。利用分光光度计根据600 nm处的吸光度估算酵母细胞的生长。
酵母中脂质和FAs的分析pep4
重组载体pYES2-BnLACS2,pYES2对照转化为pep4,一个蛋白酶缺失的突变株。阳性酵母单克隆的筛选及诱导BnLACS2蛋白与上述方法一致。酵母细胞浓度根据600 nm处的光密度调整为相同浓度。如Thakur等人所述[59],取等量的酵母悬液离心收集细胞,0.3%苏丹黑B染色检测中性脂质含量。采用Bligh和Dyer所述的氯仿和甲醇法从酵母细胞中提取脂质[60].采用20 × 20 cm硅胶60F254铝板(Merck, Germany)进行二维薄层色谱(2D-TLC)。第一维溶剂为氯仿/甲醇/水(65:30:2.5,v/v),第二维溶剂为氯仿/甲醇/醋酸/水(80:12:15:4,v/v)。按照Guan等人的描述,用显色试剂染色检测极性脂质[61].
FAs按照Brandenburg等人的方法进行甲基化[62].GC-MS分析前,在提取的脂质样品中加入10 μl甲基十七烷酸(10 μg/μl, Sigma-Aldrich, USA)作为内标。采用配备30 m × 0.25 mm BPX 70熔硅毛细管柱的GC-MS测定FA轮廓(SGE, Austin, TX, USA),如前所述[63].根据不同的保留时间对不同种类的FA进行鉴定后,用内标法对FA进行定量。
蛋白质组学分析pep4转化的酵母菌株BnLACS2基因
pYES2-诱导后BnLACS2和pYES2载体,提取总蛋白pep4如Isola等人所述,使用基于Tris缓冲的方案。[64].蛋白质浓度是用Bradford法测定的[65].按照Ding等人的描述进行2-DE。[66,只做了一些小改动。蛋白样品在17 cm pH值3-10的线性凝胶条(Bio-Rad)中分离。等电聚焦程序分别设置为250、500和2000 V, 1小时,然后设置为8000 V, 5.6万Vh。平衡后进行二次元十二烷基硫酸钠聚丙烯酰胺凝胶电泳,使用考马斯亮蓝R-250(0.1%)染色显示凝胶,并使用SanMaker 9700XL仪器(Bio-Rad)扫描。使用PDQuest软件(Bio-Rad)进行图像分析和凝胶内消解,如Ding等人所述[67].
统计上有显著变化的点(学生的t以及,P< 0.05)高于2倍阈值时,选择使用UltrafleXtreme MALDI TOF/TOF仪器(Bruker Daltonics, Billerica, MA, USA)进行质谱分析。在正离子反射模式下获取大量数据。在NCBI非冗余(nr)数据库中,使用吉祥物软件(http://www.matrixscience.com).检索参数为:分类、菌类;胰蛋白酶;一个遗漏乳沟是允许的;固定的修改,carbamidoethyl;dioxidation变量修改;肽耐受性,±0.2 Da;肽电荷是1+。蛋白质评分> 65被认为是显著的(P< 0.05)。
转基因油菜籽一代
为了生成CaMV 35s驱动的结构,全长编码区域BnLACS2使用引物5 ' -ggtaccATGGCTGCACTGCTGATCATG-3 '和5 ' -ggatccCTAGCTCTGGACGCCTTTGCTTC-3 '扩增。产生的碎片被消化BamH我而且Kpn我,然后插入到pCAMBIA1300-35S-Nos载体的相同位点。构建BnLACS2-RNAi质粒,部分片段BnLACS2使用2对引物进行扩增:5 ' -ctcgagCAGCTATTTAGTGAGGCTGTGAA-3 ', 5 ' -ggtaccGGAAGTGTCTTATCCGAGT-3 '和5 ' -tctagaCAGCTATTTAGTGAGGCTGTGAA-3 ', 5 ' -ggatccGGAAGTGCTGTCTTATCCGAGT-3 '。产生的碎片被消化Xho我,Kpn我而且Xba我,BamH我分别插入pKANNIBAL载体的相同位点。重组质粒经酶切不是我片段被插入pART27。所有质粒均经酶切和DNA测序验证。
的BnLACS2oe和BnLACS2-RNAi结构被引入农菌株GV3101,然后用于转化。用花浸法对油菜植株进行转化[68].从转化植株上收获种子,并筛选假定的转化人。积极的BnLACS2首先在含湿霉素(100 μg/mL)或卡那霉素(50 μg/mL)的培养基上筛选-OE或-RNAi转基因植株,然后使用附加文件中提供的引物进行PCR和RT-PCR5:表S2)。
转基因油菜含油量及FAs的测定
采用近红外光谱(NIRS)和核磁共振(NMR)测定种子含油量,如Bellincontro等人所述[69].中爽9和独立T2收集同一生育期的转基因株系,测定3个重复的含油量。采用气相色谱-质谱法测定FA含量,如上所述。
实时荧光定量PCR分析
Wang等人使用SYBR®PremixExTaq™II (TaKaRa, Japan)对第一链cDNA进行qRT-PCR。[70].优化qRT-PCR条件后,标准曲线扩增效率在90%以上,Ct值范围为20.9 ~ 29.3,所有熔体曲线均为单个特定峰。将目的基因的相对表达量归一化为的表达数据BnACTIN2使用2——∆∆CT方法(71].所有qrt - pcr均在3个重复中进行。用于qRT-PCR分析的引物列在附加文件中6:表S3。
数据和材料的可用性
在当前研究中使用和/或分析的数据集可以根据合理的要求从相应的作者获得。
缩写
- ACC1:
-
乙酰辅酶a羧化酶1
- CRT:
-
Calreticulin
- DGAT1:
-
二酰基甘油酰基转移酶1
- 伊诺:
-
烯醇酶
- 呃:
-
内质网
- FAD3:
-
脂肪酸去饱和酶3
- FAE1:
-
脂肪酸ELONGATION1
- FAs:
-
脂肪酸
- G3P:
-
glycerol-3-phosphate
- KASII:
-
-酮酰-[酰基载体蛋白](ACP)合成酶
- LACSs:
-
长链酰基辅酶A合成酶
- LPAT1:
-
lysophosphatidyl酰基转移酶1
- PFK:
-
phosphofructo激酶
- PGK:
-
磷酸甘油酸酯激酶
- PYK:
-
丙酮酸激酶
- 标签:
-
甘油三酯
参考文献
郑高,朴DH。以菜籽油为原料批量(一段和两段)生产生物柴油。中国生物科技。2006;131:668-79。
Kraljić K, Brkan V, Škevin D, Srček VG, Radošević K.菜籽油的一种具有生物活性的酚类化合物——卡洛尔二聚体。脂质。2019;54:189 - 200。
谭浩,杨旭,张峰,郑旭,曲超,穆杰,等。通过条件表达提高菜籽油产量甘蓝型油菜而且LEC1-LIKE在发展中种子。植物杂志。2011;156:1577 - 88。
刘杰,郝伟,刘杰,范森,赵伟,邓磊,等。一种新的嵌合线粒体基因对多倍体油菜籽粒含油量的细胞质效应(芸苔属植物显著).摩尔。2019;12:582-6。
Cahoon EB, Shockey JM, Dietrich CR, Gidda SK, Mullen RT, Dyer JM。为工业和营养原料的可持续生产设计油籽:解决脂肪酸通量的瓶颈。植物学报。2007;10:326 - 331。
Kelly AA, Quettier AL, Shaw E, Eastmond PJ。储油动员对种子萌发和幼苗建立具有重要作用,但不是必需的拟南芥.植物杂志。2011;157:866 - 75。
Nasri N, Tlili N, Ben Ammar K, Khaldi A, Fady B, Triki S.高生育酚和三酰甘油含量松果体pineal .种子。国际食品营养学报。2009;60:161-9。
McFie PJ, Banman SL, Kary S, Stone SJ。小鼠二酰基甘油酰基转移酶-2 (DGAT2)可以催化三酰基甘油的合成,促进脂滴的形成,而不依赖于其定位于内质网。生物化学学报。2011;286:28235-46。
Groot PH, Scholte HR, Hülsmann WC。脂肪酸活化:特异性、定位和功能。Adv油脂Res. 1976; 14:75-126。
H, De Bellis L, Hayashi Y, Nito K, Kato A, Hayashi M等。a的分子特性拟南芥酰基辅酶:定位于乙醛糖体膜上的一种合成酶。植物杂志。2002;130:2019-26。
Soupene, Kuypers FA。哺乳动物长链酰基辅酶a合成酶。Exp Biol Med (Maywood)。2008; 233:507-21。
刘志强,刘志强,刘志强,等。酰基辅酶a合成酶6在大脑中丰富神经保护-3脂肪酸DHA。中国科学院学报2018;115:12525-30。
Shockey JM,富尔达MS,浏览JA。拟南芥含有9个参与脂肪酸和甘油脂代谢的长链酰基辅酶a合成酶基因。植物杂志。2002;129:1710-22。
高峰,杨晓峰,付楠,胡勇,欧阳勇,清凯。长链酰基辅酶a合成酶在脂肪酸吸收转运中的作用。中华医学杂志2016;31:62-4。
李H, Melton EM, Quackenbush S, DiRusso CC, Black PN。长链酰基辅酶a合成酶的机理研究Faa1p从酿酒酵母.生物物理学报,2000,21(3):393 - 393。
Melton EM, Cerny RL, DiRusso CC, Black PN。过表达人脂肪酸转运蛋白2/极长链酰基辅酶a合成酶1 (FATP2 / Acsvl1)揭示了外源脂肪酸贩运的不同模式。中国生物医学工程学报。2013;33(5):433 - 436。
郭欣,姜明,万鑫,胡超,龚宇。硅藻中5种长链酰基辅酶a合成酶的鉴定及生化特性研究Phaeodactylum tricornutum.植物生理化学。2014;74:33-41。
Jessen D, Roth C, Wiermer M, Fulda M.长链酰基辅酶a合成酶的两种活性参与了内质网和质体之间的脂质运输拟南芥.植物杂志。2015;167:351 - 66。
Grevengoed TJ, Klett EL, Coleman RA。酰基辅酶a的代谢和分配。2014; 34:1-30。
张春林,毛凯,周立军,王gl,张雅丽,李元英,等。苹果长链酰基辅酶a合成酶的全基因组鉴定及不同胁迫下的表达分析。植物生理化学。2018;132:320-32。
Schnurr JA, Shockey JM, de Boer GJ, Browse JA。从叶绿体输出脂肪酸。一种主要的塑料酰基辅酶a合成酶的分子特征拟南芥.植物杂志。2002;129:1700-9。
Schnurr J, Shockey J, Browse J.乙酰辅酶a合成酶编码的LACS2是正常角质层发育所必需的拟南芥.植物细胞。2004;16:629-42。
Lü S, Song T, Kosma DK, Parsons EP, Rowland O, Jenks MA。拟南芥CER8编码长链酰基coa SYNTHETASE 1 (LACS1),与LACS2在植物蜡质和角质合成中功能重叠。植物j . 2009; 59:553 - 64。
王志强,刘志强,刘志强,等。器官融合与角质层功能缺损的关系lacs1 lacs2双突变体的拟南芥.足底。2010;231:1089 - 100。
张志强,张志强,张志强,等。张志强,张志强,张志强,等。结合的活动LACS1而且LACS4是否需要适当的花粉层形成拟南芥.植物j . 2011; 68:715-26。
张海燕,张海燕,张海燕。过氧化物酶体酰基辅酶A合成酶活性对水稻幼苗生长发育的影响拟南芥.植物细胞。2004;16:394 - 405。
Zhao L, Katavic V, Li F, Haughn GW, Kunst L.插入突变分析显示长链酰基辅酶a合成酶1 (LACS1),但不LACS8,功能上与LACS9在拟南芥籽油生物合成。植物j . 2010; 64:1048-58。
于丽,谭旭,蒋斌,孙旭,顾胜,韩涛,等。一种过氧化物酶体长链酰基辅酶A合成酶大豆参与脂质降解。《公共科学图书馆•综合》。2014;9:e100144。
aznarar - moreno JA, Venegas Calerón M, Martínez-Force E, Garcés R, Mullen R, Gidda SK等。向日葵(向日葵长链酰基辅酶a合成酶在种子发育过程中高水平表达。杂志。2014;150:363 - 73。
黄晓燕,王晓燕,王晓燕,等。一种新型植物酰基辅酶a合成酶的合成及其在脂肪组织中的表达芸苔属植物显著L.植物化学。2001;47:717 - 726。
富尔达M,亨氏E,沃尔特FP。芸苔属植物显著编码脂肪酰基辅酶a合成酶的cdna。植物化学。1997;33:911 - 922。
黄志宏,张志刚,张志刚,等。海藻合成三酰甘油的体内重组研究酿酒酵母.Microbiol前面。2016;7:70。
何欣,陈国强,康圣,麦基安。萝藦含有一种酰基辅酶a合成酶,优先激活蓖麻油酸酯生成辅酶a硫酯。脂质。2007;42:931-8。
李军,陈朝辉,张志强,张志强,等。植物天然免疫受体EFR生物发生所需的特异性ER质量控制成分。中国科学(d辑)2009;
Zubenko GS Park FJ Jones EW。的PEP4位点突变酿酒酵母阻断两个液泡水解酶成熟的最后一步。中国科学院学报1983;80:510-4。
李锐,邱智,王旭,龚鹏,徐强,余秋波,等。Pooled CRISPR/Cas9揭示了塑料磷酸甘油酸激酶在碳固定和代谢中的冗余作用。植物j . 2019; 98:1078 - 89。
王晓东,刘文华,刘文华,等。糖酵解和戊糖磷酸氧化途径的通量模型芸苔属植物显著胚胎。生物化学。2003;278:29442-53。
Andriotis VM, Kruger NJ, Pike MJ, Smith AM。发育中的塑料糖酵解拟南芥胚胎。新植醇。2010;185:649 - 62。
J . Kronenberger, Wuillème S, M . Miquel,等。多功能乙酰辅酶a羧化酶1是极长链脂肪酸延伸和胚胎发育所必需的拟南芥.植物j . 2003; 33:75 - 86。
黄光裕,黄光裕,黄光裕,黄光裕。β -酮酰[酰基载体蛋白]合酶组分的鉴定和分子特性拟南芥线粒体脂肪酸合酶。生物化学。2004;279:8242-51。
张志强,张志强,张志强,等。脂肪酸伸长1在胚胎及血管组织中的表达调控芸苔属植物显著.植物化学学报。2015;24(3):393 - 393。
Lou Y, Schwender J, Shanklin J. FAD2和FAD3去饱和酶形成异二聚体,促进体内代谢通道。生物化学学报。2014;29:17996 - 8007。
张志强,张志强。藻类的全基因组鉴定与进化分析LPAT利用生物信息学方法研究TAG生物合成的相关基因。Mol biool rep 2014; 41:8319-32。
陈国强,陈国强,陈国强,陈国强。重组蛋白的纯化及性质芸苔属植物显著二酰基甘油酰基转移酶1。2月。2015;589:773-8。
李志强,李志强,李志强,等。水稻种子脂质合成与酰基辅酶a合成酶的关系。脂质。2003;38:881-4。
Babbitt PC, Kenyon GL, Martin BM, Charest H, Slyvestre M, Scholten JD,等。4-氯苯甲酸脱卤酶的起源:酰基:腺苷连接酶、烯酰辅酶a水合酶/异构酶和酰基辅酶a硫酯酶家族的氨基酸序列同源性分析。生物化学,1992;31:5594 - 604。
王小丽,李小波。的GhACS1该基因编码一种酰基辅酶a合成酶,在棉花花药早期发育中对正常小孢子发生至关重要。植物j . 2009; 57:473 - 86。
徐勇,贺力克,李东,潘X,米耶科娃斯卡,陈刚,等。长链酰基辅酶a合成酶和二酰基甘油酰基转移酶对底物的偏好有助于α-亚麻酸对亚麻籽油的富集。j . 2018; 475:1473 - 89。
谭晓林,黄强,谭荣康,吴玲,李晓峰。脂肪酰基-酰基载体蛋白硫酯酶基因(BnFatB)芸苔属植物显著林俊杰。2015;17:987-97。
乙酰辅酶A的生成增强与绿藻中甘油三酯积累增加有关小球藻desiccata.中国生物医学工程学报。2015;66:3725-35。
Kerner J, Minkler PE, Lesnefsky EJ, Hoppel CL。棕榈酸灌注工作大鼠心脏脂肪酸链延长:线粒体乙酰辅酶a是链延长的两个碳单元的来源。生物化学学报。2014;29(3):393 - 393。
王鹏,李志强,李志强。三磷酸腺苷C阻碍了甘油脂和胆固醇酯的从头合成,但不能将脂肪酸循环转化为磷脂:酰基辅酶a功能分离池的证据。j . 1997; 324:529-34。
希金斯·DG,汤普森·JD,吉布森·TJ。使用CLUSTAL进行多序列比对。方法Enzymol。1996;266:383 - 402。
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5:使用最大似然、进化距离和最大简约方法的分子进化遗传学分析。中国生物医学杂志2011;28:2731-9。
刘志强,刘志强,刘志强农杆菌属介导植物转换。植物学报,2002;7:393 - 393。
伍德·CC,彼得里·JR,施雷斯塔·P,曼苏尔·MP,尼科尔斯·PD, Green AG,等。利用可互换设计原则快速组装多步骤重组通路的叶基分析。植物学报;2009;7:914 - 924。
陈森,宋库曼P,刘军,王gl .一种用于基因克隆和功能基因组学的多功能零背景t载体系统。植物杂志。2009;150:1111-21。
Gietz RD, Schiestl RH。利用LiAc/SS载体DNA/PEG法进行高效转化的冷冻感受态酵母细胞。Nat Protoc。在内。一共2007;
Thakur MS, Prapulla SG, Karanth NG。用苏丹黑b酶染色酵母细胞吸光度测定细胞内脂质。1989;11:252-4。
Bligh EG, Dyer WJ。一种快速提取和纯化总脂质的方法。生物化学物理。1959;37:911-7。
关铮,田乙,香膏A,金精psychrophilum梭状芽胞杆菌,厌氧嗜冷菌。生物物理学报,2003,19(3):393 - 397。
J, Blomqvist J, Pickova J, Bonturi N, Sandgren M, Passoth V.Lipomyces starkeyi在pH调节的分批补料培养中。酵母。2016;33:451 - 62。
穆杰,谭浩,郑强,付峰,梁勇,张杰,等。叶子叶1是人体脂肪酸生物合成的关键调节因子拟南芥.植物杂志。2008;148:1042-54。
李志强,李志强,李志强,等。黑色微殖民真菌蛋白表达谱的2-DE分析方法。真菌医学杂志。2011;115:971-7。
一种利用蛋白质-染料结合原理来快速、灵敏地定量蛋白质微克量的方法。学生物化学肛门。1976;72:248-54。
丁丽莲,杨日日,杨国霞,曹军,李萍,周勇镰刀菌素graminearum.足底。2016;243:719-31。
丁兰林,李敏,李萍,曹军。小麦幼穗对小麦抗病性的比较蛋白质组学分析镰刀菌素graminearum感染。植物学报。2017;39:271。
花浸渍法:一种农杆菌介导转化的简易方法拟南芥.植物j . 1998; 16:735-43。
王晓峰,李晓峰,李晓峰,等。近红外光谱-声光可调滤光片法测定完整橄榄果实中油脂累积量。中国食品科学。2013;33(3):393 - 393。
王益康,李亚丽,傅志玲,黄强,岳小刚,王勇,等。转录组分析芸苔属植物显著缺蜡突变体揭示了叶片蜡生物合成的动态调控与碱性五半胱氨酸6有关。国际农业生物学报2019;21:1228-34。
Livak KJ, Schmittgen TD。利用实时荧光定量PCR和2——∆∆CTT方法。方法。2001;25:402-8。
确认
感谢陕西省杂交油菜研究中心陈文杰进行了气相色谱-质谱分析。我们感谢约克大学生物系新型农产品中心(CNAP)的伊恩·格雷厄姆和托尼·拉尔森对实验设计的宝贵建议。
资金
国家重点研发计划项目(2016YFD0101900、2016YFD0100305)和国家自然科学基金项目(31471527、31271760)资助。资助机构没有在本研究和相关数据的设计、分析或解释中发挥任何作用。
作者信息
从属关系
贡献
X-LT构思和设计研究。S-LG、F-GZ - Z-YM和L-ND进行了实验。J-L、M-L和ZW贡献了新的试剂或分析工具。L-ND和S-LG分析数据。L-ND和X-LT撰写了手稿。所有作者阅读并批准稿件。
相应的作者
道德声明
伦理认可和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格《自然》对出版的地图和机构附属关系中的管辖权要求保持中立。
补充信息
附加文件1:图S1。
全长cDNA和推断的氨基酸序列BnLACS2.外显子用黑线和红线表示。
附加文件2:图S2。
的表达BnLACS2提高了酵母中脂质(a)和FAs (b)含量.pYES2和pYES2-的中性脂质BnLACS2转化体用苏丹黑B染色,分别在580 nm处测定吸光度(左)。2D-TLC检测极性脂质(右)。圆形表示pYES2-诱导的磷脂BnLACS2转化株。误差条表示SD (n= 3)。pYES2与pYES2-BnLACS2转换器显示(学生的t以及):* * *,P< 0.001;**P< 0.01;*,P< 0.05。
附加文件3:图S3。
pYES2-总蛋白的2-DE图谱BnLACS2(a)和pYES2转化子(b)。图中显示了三个生物重复的代表性图像。图像中的箭头显示了pYES2-中13个差异表达蛋白的可重复性和显著性改变BnLACS2相比之下,pYES2。
附加文件4:表S1。
差异表达蛋白点的蛋白特性。
附加文件5:表S2。
用于转基因植物检测的引物序列。
附加文件6:表S3。
用于实时定量PCR的引物序列。
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许不受限制地在任何媒体上使用、分发和复制,前提是您要适当地注明原作者和来源,提供创作共用许可的链接,并说明是否进行了更改。知识共享公共领域转让豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
叮,LN。,Gu, SL., Zhu, FG.et al。长链酰基辅酶a合成酶2参与种子油的生产芸苔属植物显著.BMC植物杂志20.21(2020)。https://doi.org/10.1186/s12870-020-2240-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-2240-x
关键字
- BnLACS2
- 石油的内容
- 糖酵解
- 脂肪酸
- 脂质
- 油菜籽(芸苔属植物显著)