抽象的
背景
新四倍体水稻是在同源四倍体水稻基础上发展起来的一种新种质,具有强大的生物学和产量潜力,具有商业应用价值。穗长是水稻穗型结构的组成部分,对水稻高产有重要作用。然而,在新四倍体水稻中,有关长穗与杂种优势或杂种优势相关的信息很少。
结果
在本研究中,我们开发了一种新四倍体水稻品系,Huaduo 8(H8),长穗和窝藏广泛的兼容性基因花粉和胚囊的生育能力。所有由H8产生的杂种生成显著高亲产量优势和显示类似H8长圆锥花序。RNA-SEQ分析共4013,7050,6787和6195的差异表达基因唯一属于S检测出1具体而具体(Degfu-SP)分别与叶,护套,主穗轴和两根杂种中的小穗相关联。这些Degfu-SP,279和89个基因参与激酶和合成酶,而714个克隆基因,例如GW8.,OsGA20ox1,Ghd8,GW6a,LP1.被鉴定和通过qRT-PCR验证。共有2925个QTL已知间隔,平均每间隔1〜100个基因,在两个杂交进行检测。其中,109的产量相关的QTL均与水稻的七大性状相关。此外,1393非附加DEGS,包括766上调和627下调,在这两种杂种进行检测。重要的是,相比于他们的父母通过定量RT-PCR两个杂种幼穗检测与穗关联的八位上调的基因。重测序分析,描绘了LP.(一个基因控制长穗)H8的序列来自许多其他新四倍体水稻不同,最二倍体和四倍体线。在定量RT-PCR结果显示,LP.在穗发育的极幼阶段,杂种的穗数比亲本上调。
结论
这些结果表明H8可以克服由胚囊囊和花粉无菌基因座引起的梭菌特异性自动传递杂交水稻无菌性。值得注意的是,H8的长圆锥显得占优势现象,并在产量杂种中发挥了重要作用,这是一种复杂的分子机制。新四倍体水稻是一种有用的种质,可以获得高产多倍体水稻。
背景
大米是世界上最重要的谷物之一。1].杂交水稻占中国总稻田的50%以上,含量优势约为10-20%的近亲品种[2].然而,随着世界人口的不断增加和环境的逐渐恶化,粮食安全已成为一个重大挑战,特别是在亚洲和非洲[3.,4].在过去的几年里,水稻生产处于停滞状态,由于作物和其他生物和非生物因素的激化。因此,这是极为重要,开发的高产水稻品种对各种生物和非生物胁迫抗性。
同源四倍体水稻是利用秋水仙碱对二倍体水稻进行染色体加倍而获得的有用种质。同源四倍体水稻亚种间杂交种具有强大的生物学和产量潜力,可能成为未来水稻育种的新途径[5,6,7].然而,低结实是在商业层面利用同源四倍体水稻的主要障碍[8,9,10,11,12,13].多倍体固本˚F1花粉育性基因座的相互作用,这会导致减数分裂异常和产生四倍体水稻杂种高花粉不育,可以通过双花粉育性的基因中性来克服(San和某人n) [14,15].因此,如何培育育性正常的四倍体水稻新品系,克服F1杂交种是使用四倍体米的关键步骤。经过多年的不懈努力,我们的研究小组通过连续几代选择性育种和交叉成功开发了一种新的“自动四倍体稻米”。新的“自身四倍体稻米”显示出高生育率(> 80%)和高杂种杂交时与具有低生育率的自身四倍体稻米越过[16,17,18].此外,F2和F3.种群也显示出高的生育能力和稳定的形态特征,如neo-拟南芥[16,18,19].新的“同源四倍体水稻”不是一个异源四倍体水稻;然而,其染色体行为接近正常,这有助于高生育率和携带这种来自同源四倍体水稻不同的特定DNA突变。因此,我们定义了新的“同源四倍体水稻”作为新四倍体[16].
基于rna序列的转录组数据使我们能够理解与水稻非生物胁迫和花粉发育相关的差异表达基因的作用[20.,21].近年来,利用RNA-Seq技术,在了解二倍体和同源四倍体水稻花粉发育过程中基因的表达模式方面取得了重大进展[12,13,22].此外,RNA-seq在植物遗传变异研究中也得到了广泛的应用。与不同组织杂种优势相关的基因表达谱的复杂性已在多种植物中得到揭示,如水稻[16,17,23,24],烟草[25)、小麦(26,27],油菜籽[28和玉米[29].分析了杂交水稻及其亲本在不同发育阶段不同组织中的转录组多样性,并在水稻中鉴定出与杂种优势相关的特异性差异表达基因[16,17,23,30.,31.,32.].
作为水稻穗建筑的一部分,穗的长度是大米的重要农产性特征,这显着影响了水稻产量。已识别或克隆与二倍体藻穗架构相关的许多基因,例如OsSPL18[33.],IPA1/OsSPL14[34.],Ghd7[35.],DEP1[36.],LP.[37.],Gn1a[38.],GW8./OsSPL16[39.),而SPL.[40].OsSPL18基因结构和表达模式与GW8./OsSPL16和它调节的表达水平DEP1[33.].IPA1/OsSPL14是由OsmiR156[34.),而DST.通过控制表达模式来提高粮食产量Gn1a/OsCKX2[41.].焦枯穗肥(FZP)是一个主要的负调控因子采用树脂/APO2并确定了从圆锥花序分枝到小穗形成的转变[42.].然而,有关新四倍体和同源四倍体水稻长穗的资料很少。
在本研究中,我们报道了一种新四倍体长穗水稻的选育过程1不育。本研究旨在评价新四倍体水稻与不同同源四倍体水稻杂交的杂种优势,并利用基于rna序列的转录组和重测序分析杂种优势的分子特征。并通过qRT-PCR验证了重要基因的表达模式。本研究将为多倍体水稻育种提供新的种质资源,并有助于我们了解水稻杂种优势和长穗相关基因表达的变化1杂交种和他们的父母。
结果
长穗新四倍体水稻的发育及其基因型1花粉不育基因位点
为了提高新四倍体水稻的穗长indic自身传递一包米线,灵云4x,平均长穗和窝藏平均值为27.65厘米年代5n被用作母体与交叉粳稻同源四倍体水稻系,L202-4x,平均穗长24.25 cm,可藏年代5n在2004年,。F1世代连续自交,直到F16, 2013年形成穗长30 cm,结实率60%的株系(F17).我们连续种植该株系,并从F18到F20.几代人。开发了一个具有35厘米长的主穗的新四倍型米线,于2015年开发并命名为“Huaduo 8”(图S1一种;数字S1c)。Huaduo 8(H8)表现出与窄分布的主要和次要分枝长穗(图1;数字S1b),在F中表现出高稳定性3.到F5几代人像新四倍体一样拟南芥(图S1c)。
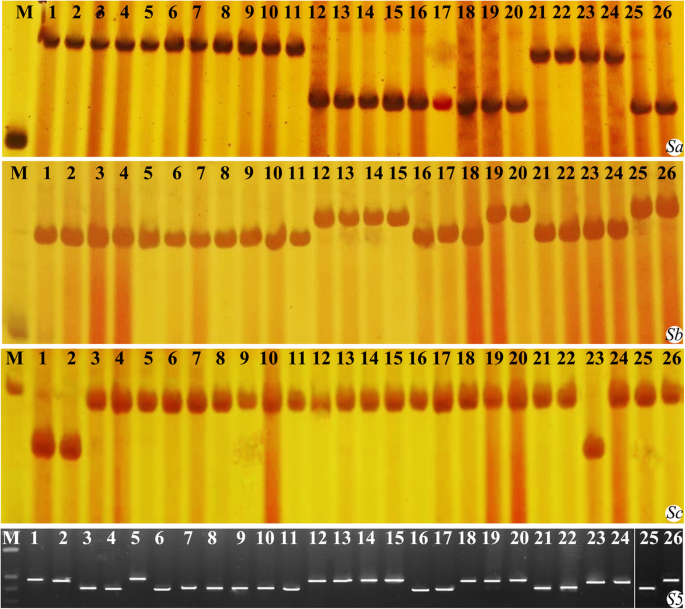
因为我们之前的研究表明,在F1花粉不育基因座,Sa,某人和Sc在同源四倍体水稻杂种不育起到关键作用,H8的基因型和其他亲本系的年代,sb,S-c利用紧密相连的分子标记检测基因座。结果表明,H8和其他亲本在3个位点上有不同的等位基因,说明杂种在这些位点上表现出不同的花粉不育性位点互作。此外,所有材料的基因型年代5轨迹,使用中也检测到年代5功能分子标记和结果表明H8和13其他父母包含在内年代5n基因(图。2;额外的文件1:图S2;额外的文件2:表S1)。这些结果表明H8是新四倍体米的宽容性种质。
亲本花粉不育位点的基因型(Sa,某人和Sc),S5轨迹检测由分子标记。第一张图片显示了在基因型Sa轨迹,其次是(从上到下)某人,Sc和S5轨迹。M表示DNA阶梯,列1-4表示对照品种(典型)indic和粳稻而5-26系表明新四倍体/同源四倍体水稻系(见附加文件中的材料名称)2:表S1)。泳道25和26 S5从另一个凝胶取
长穗新四倍体水稻杂种优势分析
在这里,共有14个杂交种,其中9个杂交种是由H8与同源四倍体水稻株系(即4粳稻和五个indic与其他高育性新四倍体水稻株系杂交获得的5个株系(70.63%)2:表S2)。对于穗长,六种杂种显示出阳性显着高母杂种优势(HPH),T49×H8描绘了最高HPH。值得注意的是,显示长圆锥和T49×H8的所有混合动力车呈现最大的穗长度,即37.61厘米(附加文件1:图S1b和S1c;额外的文件2:表S3)。产量和产量构成因素均有显著改善,特别是结实率、单株籽粒产量和单株结实粒数。各性状中,结实率平均值均高于77.04%,单株籽粒产量均高于26.50 g,单株灌浆粒数均高于650粒2:表S3)。
除单株穗数外,其他性状均表现为显著正的中亲本杂种优势,单株粒数和千粒重均表现为显著正的中亲本杂种优势。三个F1杂交种在重要农艺性状上表现良好,其中T45 × H8除千粒重性状外,其他性状的HPH和MPH均呈极显著正,T419 × H8除单株穗数外,其他性状的HPH和MPH均呈极显著正。T49 × H8除单株穗数和结实率外,其他性状的HPH均为显著正,穗长、单株结实粒数和单株产量等重要性状的HPH和MPH均最高2:表S2)。与同源四倍体水稻相比,新四倍体水稻与H8杂交产生的杂交种在结实率、单株产量和单株结实粒数等产量相关性状上均有显著提高(附加文件)2:表S3)。
Among the 14 hybrids, we selected two hybrids, T485 × H8 and H1 × H8, to analyze F1转录组分析与产量相关的杂种优势。T485为同源四倍体低育性水稻(33.35%),H1为新四倍体高育性水稻(65.3%)。2个杂交种在结实率、单株籽粒产量、千粒重和单株结实粒数等重要产量性状上均表现出较高的MPH和HPH。2个杂交种的产量均显著高于亲本2:表S3)。此外,结实是高F中2H1×H8,平均为71.35%。有趣的是,除了穗长度之外的所有特征中,H1×H8显示出比T485×H8更好的性能(表1).
F1混血儿和他们的父母
超过5.64亿的干净读数从两个F1包括T485 × H8和H1 × H8及其亲本的8个组织的rna测序(附加文件2我们将这些clean reads与Nipponbare参考基因组(MSU 7.0)进行比对,平均得到95.11%注释的参考基因组转录本和66.23%的唯一mapping reads。相关系数均在0.8以上,表明杂种与亲本的3个转录组生物学重复之间存在显著相关。我们使用8对引物对32份样本进行qRT-PCR验证,结果表明8个基因的差异表达水平与转录组数据一致(附加文件)1:图S3)。聚类分析表明,F1更接近于H1中的那些(额外文件1图S4),说明与其他亲本T485相比,H1对杂种高育性和产量相关性状的贡献很大。
检测不同组织和基因本体学(GO)富集分析的差异表达基因(DEGS)
A total of 150,377 DEGs, including 76,926 from H1 × H8 and 73,451 from T485 × H8, were detected from eight tissues, i.e. flag leaf, leaf sheath, main panicle axis and spikelet of two hybrids and their parents before flowering and 5 days after flowering, respectively. The DEGs were ranged from 857 to 8489 between two parents and F1(附加文件2:表S5, S6)。
与F唯一关联的特定的deg1杂种与亲本(DEGFu-sp)比较,能较好地阐述杂种与亲本之间的表型变异1杂种及其亲本[16,23];所以我们专注于DEGFu-SP来检测与杂种优势的基因。总之,24045 DEGFu-SP基因在两个杂种进行鉴定。间DEGFu-SP,4013,7050,6787和6195分别特异性地与剑叶,叶鞘,主穗轴和小穗在两个杂交(表相关联2;额外的文件2:表S7)。
基因本体论(GO)富集分析显示,开花前和开花后5天,8个组织基因的显著功能分类存在显著差异(附文件)1:图S5;附加文件2:表S8A-C)。我们确定了在所述生物过程类别151点突出而言,在分子功能类别61,并与DEGFu-SP八个组织相关的细胞成分类别55个突出术语(表3.).因为两个F1混合动力车(i.e. T485 × H8 and H1 × H8) were developed using neo-tetraploid rice line with long panicle to analyze the yield-related heterosis, we focused on the specific common genes from DEGFu-sp and their prominent functional categories. A total of 280 DEGFu-sp with specific common elements, in which 20 prominent GO categories, such as GO:0045449 (regulation of transcription), GO:0060255 (regulation of macromolecule metabolic process), and GO:0003700 (transcription factor activity), were detected in the leaf sheath of both hybrids that was collected 5 days after flowering. In total, 196 DEGFu-sp with specific common elements, in which 21 prominent GO categories, including GO: 0043687 (post-translational protein modification), GO: 0006464 (protein modification process), GO: 0043412 (macromolecule modification), were identified in main panicle axis of both hybrids 5 days after flowering (Additional file2:表S8d)。
KEGG分析结果显示,在两个杂种中分别有19条和44条与DEGFu-sp相关的通路。总的来说,在这两个杂种中有15个途径是常见的,包括淀粉和蔗糖代谢、光合作用、植物-病原体相互作用和光合生物中的碳固定(补充文件)2:表S8e)。
不同组织中与杂种优势相关基因的功能分析
由于杂种优势涉及水稻杂交种的所有生物学性状,其中最重要的性状是籽粒产量和抗性,我们分析了蛋白激酶、淀粉生物合成等激酶和合成酶相关基因及其相关基因[23,43.].在DEGFu-sp到两个杂种的基因中,分别有279和89个基因与激酶和合成酶有关(附加文件)3.:表S9A,S9B;表10se和10sf)。其中与激酶相关的279个基因,15个基因被注释为受体蛋白激酶和164蛋白激酶,例如S-LOCUS凝集素蛋白激酶家族蛋白和奥斯卡38-奥波克受体样蛋白激酶(附加文件3.:表S9a)。在89个注释为合酶的基因中,有16个编码为纤维素合酶,10个编码为ATP合酶,7个编码为磷酸合酶(附加文件)3.:表S9B)。此外,22个基因编码NBS-LRR抗病蛋白或LRR受体样蛋白激酶和76个的转录因子(TF)在DEGFu-SP二者杂交进行检测(附加文件3.:表S9c, 9d)。其中21个基因与超级杂交二倍体水稻LYP9不同[23] 11与f的相同1杂交(T449 × H1) [17],其中71个转录因子与超级杂交二倍体水稻LYP9 [23]和29个与F相同1杂交(T449 × H1) [17].此外,我们还与克隆基因的数据进行比较(https://funricegenes.github.io/),以及总共714个共同克隆的基因在两个杂交的DEGFu-SP的基因进行检测(附加文件3.:表S9E;表10SE和10SF).这些基因可以分成四组,包括形态性状相关的基因(至少38个基因),生理性状相关的基因(至少33个基因),抗性或耐受性相关的基因(至少66个基因)(附加文件3.表S9e)和其他基因(577个基因)。在形态性状相关基因中,一些重要性状相关基因,如粒数(Gn1a)和半矮化(sd1)被检测到。在与生理特征相关的基因中,还发现了四个与饮食质量相关的基因。在抗旱相关基因中,鉴定出5个抗白叶枯病基因、9个抗稻瘟病基因、5个耐寒基因、10个耐旱基因和9个耐盐基因3.:表S9E)。然后,我们将两种杂种的Degfu-SP基因与二倍体杂交水稻中的杂种相关的基因进行比较[44.,并检测重要基因,包括NAL1,qGW8,OsGA20ox1,Ghd8,GW6a,LP1.,EUI1,i-sd-1 (t)(细长的最上节间),sd1,OsGA20ox2和qSD1-2(dee-geo-woo-gen矮),Hd3a和英国《金融时报》(抽穗期),DEP1,DN1,QPE9-1和QNGR9.(圆锥花序密集),OsWRKY71.
已知数量性状位点中DEGFu-sp的定位
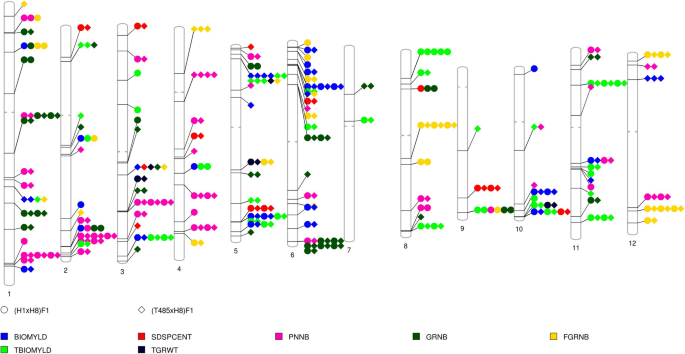
利用DEGFu-sp对2个杂交种进行qtl定位,共定位8216个水稻qtl,包含236个性状(项)。http://qtaro.abr.affrc.go.jp/),分析产量相关qtl。共鉴定出2925个qtl区间,平均每个区间有1~100个基因,其中975个qtl在两个杂交种中均存在3.:表S10a,10b)。在DEGFU-SP相关QTL中,109种水稻产量相关的QTL与七种特征相关,包括总生物质产率,生物质产量,填充晶粒的数量,数量的总晶粒,圆锥数量,种子组和1000粒重量,被检测到。许多QTL的特征在于,包括种子集(AQCB017,AQCB018,AQG011,AQBK050,AQBK049,AQBK050,AQED063,CQAS35和CQB14),1000粒重量(AQAI071,AQAI076和CQB16)以及填充颗粒的数量(AQCY010,AQCY030,AQCY041,AQCY055,AQCY061,AQCY089,AQCY100,AQCY109,AQCY111和AQCY115)(图。3.;额外的文件3.:表S10b, S10c)。共检测到15、9、10、7、11、22、1、7、2、7、10和8个常见qtl,分别位于第1、2、3、4、5、6、8、9、10、11和12号染色体上(图)。3.).我们检查了普通QTL相关的DEGFU-SP的功能注释,其中一些在DEGFU-SP和QTL之间显示了潜在关联,例如关系JMJ706(LOC_Os10g42690, H3K9 demethylase),OsClpB-m(LOC_Os02g08490SPASE)和AQCB018,AQED063分别用于种子组。α淀粉酶(LOC_Os05g32710)和CQB16为千粒重OsLpa1(LOC_Os02g574001)和AQGI200的总生物量。
此外,我们比较了两架F的DEGFu-SP相关的QTL数据1混合动力车of neo-tetraploid rice T449 × H1 [17]和T452 × H3 [16].目前和以往研究共发现48个qtl,其中与千粒重相关的有2个(AQAI071和CQB16),与结实率相关的有3个(AQGH011、AQGH028和CQB14),与穗数相关的有13个(加文件)1:图S6;额外的文件3.:表S10d)。然后,我们将DEGFu-sp (DGHPU)相关qtl数据与超级杂交二倍体水稻lyyp9 [23共检测到57个不同的qtl,其中4个与结实率相关的qtl (AQGH011、AQGH028、AQCB017和AQED063), 15个与生物量相关的qtl, 14个与穗数相关的qtl, 24个与粒数相关的qtl3.:表S10C)。
非加性基因在F1混合动力车
DEGFu-sp可分为加性基因和非加性基因两种类型,分别由来自双亲的每个等位基因贡献,且偏离中亲本值[16,23].结果表明,2个杂交种共检测到1393个非加性DEGs,其中766个表达上调,627个表达下调,其中166个表达上调,362个表达下调,516个表达下调,349个表达下调,其中166个表达上调,362个表达下调,516个表达下调,349个表达下调4;额外的文件4:表S11a, b)。我们将所有的非加性基因与水稻克隆基因数据进行了比较,发现13个基因具有已知的功能。在766个非加性上调基因中,有4个非加性上调基因,其中2个基因为非加性上调。LOC_Os05g51610,LOC_Os12g05709,LOC_Os09g11490和loc_os11g28184.在这两个杂交受精前叶被发现是共同的。二十九个基因在受精前主穗轴,21被确定在受精后小穗,一个旗叶后在两种杂交体,分别受精(附加文件后,检测受精,10和在叶鞘和主穗轴5个共同基因4:表S11c,d)。
值得注意的是,H1 × H8 (F1杂种)表现出比T485×H8更好的性能,因此我们将与杂交种中的克隆基因重叠的非添加性Degs进行比较,并检测到七个(LOC_Os02g12350,loc_os03g17350.,LOC_Os10g42750,LOC_Os08g41940,LOC_Os10g03400,LOC_Os04g46940和LOC_Os04g57830)和两个基因(LOC_Os03g06654和loc_os03g43990.),分别与H1 × H8和T485 × H8特异性相关。此外,两个基因,即。loc_os12g18360.(Pi-ta),LOC_Os03g51970(生长调节因子),其通过调节Osa-miR396,发现在两个杂种中是常见的(附加文件4:表S11c,d)。
大穗新四倍体水稻的全基因组DNA变异
大穗新四倍体水稻(H8)和短穗新四倍体水稻(H1)共检测到2082268个SNPs和InDels,其中H8中检测到82319个同源突变体,涉及15146个基因。我们将所有突变基因与水稻的功能特征基因进行了比较,发现257个基因在水稻中具有已知的功能(附加文件)4:表S12a)。与同源四倍体水稻(T485)相比,大穗新四倍体水稻(H8)共检测到2953864个SNPs和InDels。与T485相比,H8共检测到131,112个与24,777个基因相关的同源突变体,其中有191个基因在水稻中具有已知功能(附加文件)4:表S12B)。在H8中检测到总共59个特定的突变基因,包括大穗基因LP.(LOC_Os02g15950),LPA1(LOC_Os03g13400),61年矮(LOC_Os01g52050),矮10(LOC_Os01g54270),纤维素合酶催化亚基A4(LOC_Os01g54620,OsCesA4),LAX穗肥(LOC_Os01g61480)(附加文件4:表S12c)。此外,H8在HD1.与H1相比,而H1在NAL1与Nipponbare参考基因组相比。T485在OsGA20ox1相比于H8。与水稻穗架构十二特定突变基因在H8还查明,包括OSCLPC2.,OSCLPC3.,LPL3,OSGLP8-12,SP1(OsNPF4.1),OsERF71,OsHSP1,OsHSP17.7,spl5(SF3b3;0sSL5),SPL35和SPL3(OsEDR1;OsACDR1;OsMAPKKK1).
为了检查在LP基因的DNA变体中,我们分析了132个不同水稻品系的重测序数据,包括67个新四倍体(包括姊妹系),36四倍体和二倍体29水稻品系。结果显示,在H8的LP基因的DNA变异系数不同于大多数其他新四倍体,二,四倍体水稻品系的(附加文件1:图S7)。对亲本H8、H1和T485的LP基因DNA序列进行Sanger测序验证,结果与重测序数据一致。
由于在三个父母,H1,T485和H8中检测到许多DNA序列变异,我们专注于DEGFU-SP的基因变化。总共33个基因显示DNA序列变异(附加文件4:表S13a),包括3TE,13个抗性或耐受基因,10和19基因分别与生理和形态特征有关(附加文件4:表S13b)。
大穗穗粒子穗长度与粒径相关的常量分析
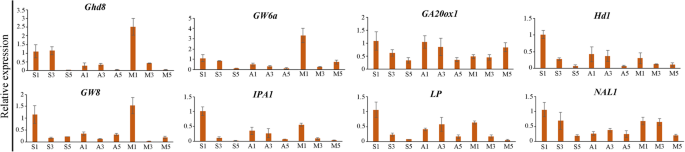
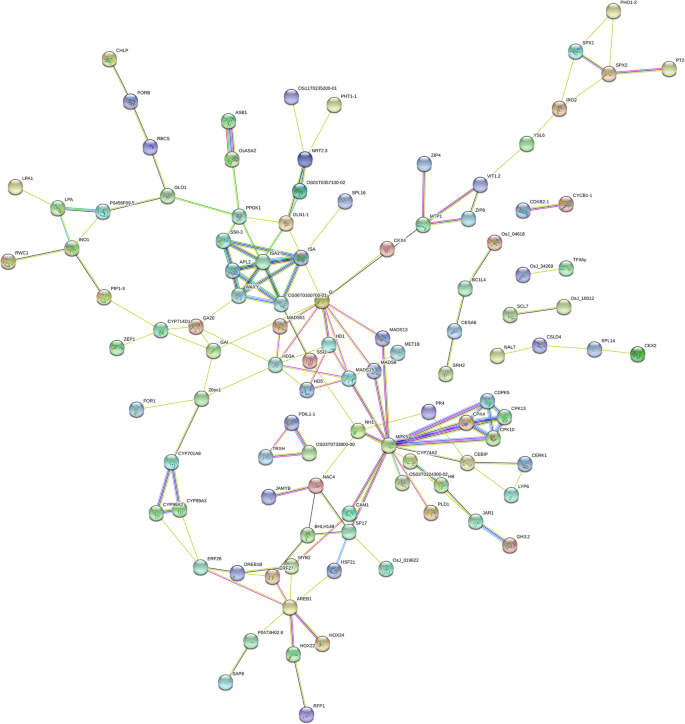
为了检查度和重要基因与穗长和穗粒数在neo-tetraploid饭大圆锥花序,RNA-seq来分析全球H1基因表达式非常年轻的圆锥花序×H8 vs H1(短圆锥花序),H8 vs H1, T485×H8 vs T485,和vs T485 H8。与亲本相比,2个杂交种幼穗中共检测到8个与穗相关的上调基因,包括OsMADS3,OsMADS6(mfo1),MADS58,Gn1a,OSCLPC2.,OsLG1,MULTI-FLORET SPIKELET1和LAX穗肥.与穗长、穗粒数和杂种优势相关的8个基因的表达模式LP.,Ghd8,NAL1,GW6a,IPA1,GA20ox1,HD1.和GW8.,采用qRT-PCR对穗部发育的不同阶段进行检测。结果表明,这8个基因在穗发育期H1 × H8相对于H8表达上调LP.在幼穗中,与双亲相比,H1 × H8表达上调(图2)。4).上述八个基因的预测蛋白质 - 蛋白质 - 蛋白质 - 蛋白质相互作用分析和133个克隆基因彼此相互作用(图。5;额外的文件4:表S14系列)。此外,还对H1 × H8的穗长分离率进行了研究2一代,穗的平均长度为24.61厘米,非常接近两个父母的平均长度(24.69厘米)。有12个植物,良长的茎比H8的较长,19个具有比H1更短的韧皮,最短14厘米。平均种子设定在F中为71.51%2这表明大多数植物在下一代保持了较高的结实率。
与杂种优势相关的8个基因的表达水平1混合动力车。S1:1 cm panicle length of F1杂交(H1 × H8);S3:杂种穗长5cm1(H1×H8);穗长15厘米1杂交(H1 × H8);A1: 1 cm panicle length of H8; A3: 5 cm panicle length of H8; A5: 15 cm panicle length of H8; M1: 1 cm panicle length of H1; M3: 5 cm panicle length of H1; M5: 15 cm panicle length of H1. T485, H1and H8 indicate Huanghuazhan-4x, Huaduo 1 and Huaduo 8, respectively
讨论
在新四倍体长穗是一个广泛的兼容性种质和很多重要的基因与高杂种优势相关的
杂交无菌不仅存在于梭原二倍体稻杂种中,而且还存在于自身四倍体稻米杂交体中,这是由F的等位基因相互作用引起的1不育基因位点,其中包括Sa,某人和Sc,它们的中性等位基因有潜力克服杂种不育[14,15,17,45.,46.].在本研究中,紧密联系的分子标记与Sa,某人和Sc基因座中使用的三个位点,其类似于E249检测Huaduo 8(H8)的基因型,窝藏SA-N和Sb-n在Sa和某人与E25和T45相似,其中含有Sc-n在Sc轨迹。14个杂交种,其中H8与indic四倍体水稻和4与粳稻四倍体水稻,表现出较高的结实率和杂种优势,如花多1号和花多3号[16,17].这些结果表明H8含有花粉无菌基因座的中性基因。此外,基因型在年代5对亚种间杂种胚囊不育的基因座进行检测年代5功能分子标记物和H8年代5n基因以及(在中性等位基因年代5轨迹)。有趣的是,几乎所有的植物都表现出高结实率2和下一代。据此推测H8是一种新的广交新四倍体水稻,将为多倍体水稻育种提供宝贵的种质资源。
具有长穗的新四倍体稻米具有高杂化活力,并且在新四倍体稻杂交体中也检测到许多与二倍体稻的杂种优势源的许多重要基因,包括OsGA20ox2,qSD1-2,Hd3a,DEP1,和QGW8 [36.].转录因子(TF),作为重要调控基因,影响杂交水稻的表型[23].有趣的是,在新四倍体水稻的两个杂交后代中,大多数表达模式不同的转录因子与二倍体水稻杂交后代的转录因子存在差异[23].此外,我们还检测到许多与NBS-LRR抗病蛋白相关的DEGFu-sp,其中大部分也与二倍体水稻杂交种的DEGFu-sp不同[23].非加性基因对植物表型显着影响,并在水稻或自身四倍体稻杂种中检测到[16,17,23].在这里,共鉴定了1393个非加性DEGs。激酶和合酶,如蛋白激酶和淀粉合酶,在杂种优势表现中起重要作用[23,43.].我们发现了很多参与激酶和合成酶的基因,KEGG分析结果揭示了一个重要的途径,即淀粉和蔗糖代谢,这与基因检测结果一致。这些结果表明,新四倍体水稻杂种优势有许多重要的基因参与,这为破解多倍体水稻杂种优势的潜在机制提供了非常有用的种质资源。
许多产量相关的QTL在新四倍体米中有助于高杂种优势
水稻杂种优势的分子机制非常复杂,在二倍体杂交水稻中已经检测到许多功能基因或qtl。利用基因芯片对超级杂交水稻LYP9的基因表达谱进行了研究,发现该基因仅属于F1混合比父母,和在能量代谢和运输的类别被富集。此外,杂交和父母(DGHP)之间2673组差异表达的基因进行了映射到3128点的QTL和53被唯一地属于杂交和父母(DGHPU)之间差异表达的基因,其被分为9类和209个性状在水稻基因组[23].许多经济价值,包括Hd3a,qGL3,OsmiR156h,LAX2,并在两系杂交稻相关的产量相关性状的非加性基因,鉴定[47.].超级杂交稻WFYT025共检测到22个产量相关QTL,其中粒数QTL 15个,粒重QTL 61000个,单株产量QTL 1个,对粒数杂种优势贡献较大。48.].90%以上的DEGFu-sp基因在不同发育阶段(减数分裂时期的花药和旗叶、花期前期的旗叶、叶鞘、花药和子房、旗叶、在1019个与产量相关的qtl和26个性状上进行了定位[17].
本研究共检测到2925个qtl,每间隔1~100个,其中975个qtl在两个杂交组合中相同,其中与水稻产量相关的qtl 109个。其中,50个qtl与本研究在2个新四倍体杂交水稻(花井县74-4x ×花多3和T449 ×花多1)中检测到的qtl一致[16,17],如千粒重两粒(AQAI071、CQB16),结实率三粒(AQGH011、AQGH028、CQB14)。有趣的是,一些重要的基因相关qtl,如JMJ706,OsClpB-m,α淀粉酶和OsLpa1在两个新四倍体杂交水稻中也发现了26个特异qtl。推测新四倍体水稻杂种优势的分子机制是复杂的。影响新四倍体水稻杂种表型并产生高杂种优势的遗传因子至少有5个,包括主要功能基因、qtl、TFs、NBS-LRR和表观遗传相关基因。
与穗长相关的上调和突变基因可能与新四倍体水稻H8的长穗有关
穗长有较大的遗传变异indic和粳稻在大米。一般来说,粳稻与...相比有短穗和致密的尖刺indic,其特征是圆锥花序较长,小穗稀疏[49.,50.].穗长由大米中的主要和次要QTL控制[51.[据报道,已经报道了超过253例胰穗长的QTL和基因,分布在12条染色体上52.,53.,54.].一个主要的水稻产量QTL,DEP1,经鉴定,其通过加强分生组织活性减少花序节间的长度[增加每穗粒数36.].大穗突变基因,LP.,可以显著增加穗大小,编码F-box蛋白可与大米互动SKP1样蛋白[37.].
在本研究中,我们检测到8个基因,包括OsMADS3,osmads6(mfo1),mads58,Gn1a”,OsClpC2”,OsLG1,MULTI-FLORET SPIKELET1和LAX穗肥,参与穗型结构,在F1与父母相比。在这些基因中,Gn1a控制填充的晶粒[38.];OsLG1受管制的水稻的闭合穗状性状[55.].实际上,H8是一种新四倍体水稻,具有大而封闭的穗型性状,这两个基因的上调表达模式,Gn1a和OsLG1在穗部发育中起重要作用。此外,我们还检测到一些大穗相关基因的DNA变异,如大穗基因、LP..
结论
在这里,我们开发了一种新四倍体稻米Huoduo8,具有长圆锥形,可以克服自动化米的杂交杂交无菌性。Huaduo 8用不同的自身传递和新四倍体稻米交叉时产生高杂种。我们在Huaduo 8产生的两种杂种中检测到与激酶和合成酶和975 degfu-sp相关qtl相关的368个degfu-sp基因。总共八个基因,包括突变等位基因LP.,与水稻穗型结构相关,在非常幼嫩的穗中表现出上调表达模式。本研究为多倍体水稻高产育种提供了有益的种质资源,并对新四倍体水稻杂种优势的分子机制进行了深入的研究。总体而言,新四倍体水稻杂种优势的分子调控机制非常复杂,未来的研究应集中在杂种优势相关基因的功能特性上。
方法
与大穗一个新四倍体杂种优势的评价
本研究中使用的材料由九个自身四倍体和五种新四倍倍乳稻脂排列,其与长穗,Huaduo 8(H8)的新四倍体稻米交叉,以开发14个杂种(附加文件)2:表S1)。所有的父母和他们的f1在自然条件下,在华南农业大学(SCAU)实验农场(广州23ol6 n,113o8e)在两个生长的季节中,即季节(7月20日至11月30日)和初季(2018年2月25日至7月15日)。除了L202-4X,杰克逊-4X和LUXIONG 97-4X之外,所有的线条都由Yuanqing Li教授提供,在本研究中使用的是我们的研究小组并正在从上几年中使用[5,6,7,10,16,18].多倍体水稻品系的凭证标本已经沉积到我们的实验室,但没有任何可公开获得的植物标本。我们并没有在这项研究中使用的野生植物,并根据国家和地方立法中,不需要特定的权限来收集这些植物。
所有f的共有15个植物1混合动力车和他们的父母从外地的在成熟的中间部分收获。农艺性状,包括穗长(PL,厘米),植物高度(PH,厘米),有效数,每株植物圆锥花序(NP)的,每株植物的饱满粒(FG / P),千粒重(GWT,克),根据我们以前的研究单株(GY,G),和结实(SS%)产量进行选择和测量[16].为了检测F1花粉不育基因座,Sa,某人和Sc和AT.S5胚囊不育位点,分子标记。本研究采用紧密相连的分子标记对已知位点的基因型进行检测,包括一个SNP标记(G02-148)Sa位点,2个标记(A07-55和A07-130)某人位点,1个标记(P24-85.7)Sc位点,1个标记(S5-t1)检测中性基因(年代5n)在S5轨迹(附加文件2:表S15) [45.,46.].
我们分析了两个季节3个重复的杂种优势。各性状采用SPSS 16.0软件进行单因素方差分析,显著性水平分别为0.05和0.01。中亲本杂种优势和高亲本杂种优势的确定公式如下:MPH = (F1-MP)/MP × 100%, HPH = (F1-HP)/HP × 100%,其中MP为双亲的平均性能,F1是第一代(混合)的性能,和HP是最好的亲本的性能。
具有大穗和其他亲本的新四倍体水稻的全基因组DNA变异
采集H8、黄花zhan-4x (T485)和花多1 (H1)的幼叶,置于−80℃保存,用于DNA分离。利用改良的CTAB法从每个幼叶组织中提取基因组DNA [56.].全基因组重新排序的任务是由生物标记技术(北京,中国)对Illumina Hiseq平台进行的。根据预先描述的标准Illumina协议进行该方法[57.].
利用FastQC软件对测序原始reads的质量进行评价,筛选得到的高质量reads使用BWA软件与Nipponbare参考基因组(MSU7)进行比对。利用GATK软件检测基因组变异(InDels和SNPs) (https://www.broadinstitute.org/gatk/guide/best-practices.php).利用SnpEff软件对参考基因组GFF3文件进行InDels和SNPs注释。根据多态性位点的不同,将基因snp和InDels分为CDS(编码序列)、UTR(非翻译区域)和内含子。编码序列的snp分为同义snp和非同义snp。
RNA提取,cDNA文库施工和RNA-SEQ
在受精前和开花后5 d,采集花期旗叶、叶鞘、主穗轴(包括轴和所有分枝,但不包括小穗)和小穗(不包括花药)8个组织1杂种(T485 × H8和H1 × H8)及其亲本(附加文件1:图S8;额外的文件2:表S1)。Moreover, the young panicles with a length of less 0.5 cm were also collected from the two hybrids and their parents. All the samples were collected in three biological replications and kept at − 80 °C for RNA extraction.
基于所述TRlzol试剂的手动指令(Life technologies公司,加利福尼亚州,美国)从各样品的总RNA提取,并且如先前所述制备文库[16].采用Nanodrop 1000分光光度计和1%琼脂糖凝胶对样品的质量和数量进行评价。使用安捷伦2100生物分析仪(安捷伦技术公司,美国)来估计数量和RNA完整性浓度。采用NEBNext Poly (A) mRNA磁性提取模块提取mRNA。将纯化和富集的mRNA分解成约200 nt的短RNA插入,获得第一链和第二链cDNA。将双链cDNA进行末端修复/dA-tail和适配器连接。采用agcourtampure XP beads (Beckman Coulter, Inc.)提取相应片段,进行PCR扩增。然后,利用Illumina HiSeq™2500测序平台对cDNA文库进行测序[16,18].
如前所述,Perl脚本消除了低质量读取[16].过滤后的洁净读取用Tophat2software和Bowtie2 [映射到日本晴参照基因组(IRGSP-1.0 pseudomolecule / MSU7)58.].进一步检查对齐的数据以消除潜在的重复读。Cufflinks软件用于评估基因表达模式的片段每千碱基的转录本每百万片段(FPKM) [59.].
F的差异表达基因(DEGS)1采用DESeq法对其父母进行评价。其次,F1S及其父母估计基于FPKM值的比率。为了计算显着差异,应用了错误的发现率(FDR)控制方法来检测P-在各种调查中的价值。本研究选取FDR显著性评分< 0.01且绝对倍变值≥2的基因进行进一步分析[16,18].
使用AgriGO工具(http://bioinfo.cau.edu.cn/agriGO/)和途径分析由植物基因浓缩分析工具包进行(http://structuralbiology.cau.edu.cn/Plantgsea /)。使用群集3.0软件执行群集分析。使用字符串软件进行预测的蛋白质 - 蛋白质相互作用分析(http://www.string-db.org/).Venny软件用于检测不同样品和组织中的重叠的差异表达基因(http://bioinfogp.cnb.csic.es/tools/venny/) [14].
DEGFu-SP映射到水稻的QTL
MSU水稻基因组注释项目Release 6.1上具有物理位置的水稻QTL数据来源于Gramene (ftp://ftp.gramene.org/pub/gramene/archives/qtl/) [60.].利用MSU水稻基因组注释项目(Additional file)的基因坐标,将DEGFu-sp定位到7个与产量相关的qtl上,包括总生物量(TBIOMYLD)、生物量(BIOMYLD)、满粒数(FGRNB)、粒数(GRNB)、穗数(PNNB)、结实率(SDSPCENT)和千粒重(TGRWT)4:表S16)(http://qtaro.abr.affrc.go.jp/) [17,23].
中存在
总共30度的视角,随机从8个组织的转录组数据中选择通过qRT-PCR用引物8,验证RNA-SEQ数据。Moreover, we designed another eight primers to observe the expression patterns of eight genes during development of panicle, including 1 cm, 5 cm and 15 cm long panicles (Additional file4:表S15)。The Transcriptor First Strand cDNA Synthesis Kit (Roche) was used to obtain first-strand cDNA from approximately 1 μg of extracted RNA as described previously [16].每个反应的组成为正向和反向引物10 μM、Bio-RAD通用SYBR Green supermix (Bio-RAD) 10 μL和cDNA 2 μL,每个qRT-PCR反应的最终体积为20 μL。PCR反应程序为95℃变性30 s,扩增40个循环(95℃5 s, 60℃30 s)。我们利用水稻肌动蛋白基因作为内控基因,所有反应都在3个重复中执行。2——ΔΔCT方法用于估计相对表达模式[61.].
可用性数据和材料
所有支持稿件结论的数据集都提供在主要稿件(数字和表格),附加文件中,并在公开的存储库(NCBI)中存放。RNA-SEQ和重新排序数据可从NCBI获得,下请访问PRJNA576043(https://www.ncbi.nlm.nih.gov/bioproject/prjna576043.).
缩写
- DEGFu-SP:
-
属于F的特异性和差异表达基因1与亲本比较的杂种
- 可见:
-
差异表达基因
- HPH:
-
高父杂种优势
- 迈:
-
中期母杂种优势
- TFs:
-
转录因子
参考文献
- 1.
Kohnaki Me,Kiani G,Nematzadeh G. F的水稻恢复系中的形态特征之间的关系3.使用多元分析生成。国际生物医学杂志2017;5(4):160-3。
- 2.
程胜,庄建勇,范媛媛,杜建华,曹丽丽。杂交水稻的研究与发展:中国的超级驯化。安机器人。2007;100:959 - 66。
- 3.
Godfray HCJ, Beddington JR, Crute IR, Haddad L, Lawrence D, Muir JF, Pretty J, Robinson S, Thomas SM, Toulmin C.粮食安全:养活90亿人的挑战。科学。2010;327:812-8。
- 4.
Sasson A.非洲粮食安全:一个紧迫的全球挑战。农业粮食安全。2012;1:1-16。
- 5。
Shahid MQ,Liu G,Li J,Naeem M,刘X.二倍体和自身四倍体稻米农艺性状的杂优异和基因作用研究。Acta Agric Scand Sect B土壤植物SCI。2011; 61:23-32。
- 6。
沙hid MQ, Xu H, Lin S, Chen Z, Naeem M, Li Y, Liu X.同源四倍体水稻产量和其他数量性状的遗传分析及杂种优势研究。植物学报。2012;44(1):237-46。
- 7。
吴九,胡c,沙希德Mq,gu h,zeng y,liu x,lu y。遗传多样化和自身传递稻遗传多样化分析。Springer Plus。2013; 2:1-12。
- 8。
他J,Shahid MQ,Chen Z,Chen X,Liu X,Lu Y.异常PMC微管状分布图案和染色体行为导致梭菌特异性自动四倍体稻杂种的低花粉生育率。植物系统中的Evol。2011; 291:257-65。
- 9。
朱军,胡海峰,吴建军,刘旭,沙希德MQ。同源四倍体水稻系的DNA变异与胚囊育性。土耳其J农业。2019;43:554-68。
- 10.
沙hid MQ,孙军,魏超,张鹏,刘欣。同源四倍体水稻不同生育期胚囊异常和花粉育性的研究。植物学报。2010;42(1):7-19。
- 11.
Shahid MQ,Li Y,Saleem MF,Naeem M,Wei C,Liu X.含有自身传递物和二倍体水稻基因型的产量和产量组分(indic和粳稻)在早期和晚期播种。作物科学,2013;7(5):632-41。
- 12.
吴军,沙hid MQ,郭华,尹伟,陈志,王磊,刘旭,卢勇。同源四倍体和二倍体水稻花粉发育的细胞学和转录组学比较分析。植物天线转换开关。2014;27:181 - 96。
- 13。
陈磊,陈志刚,王磊,刘小霞。同源四倍体水稻花粉败育相关减数分裂和糖代谢突变基因的细胞学和转录组分析。中国生物医学工程学报。2018;293(6):1407-20。
- 14。
吴军,沙希德MQ,陈磊,陈智,王磊,刘旭,卢玉玲1花粉不育基因位点的互动,增加减数分裂异常和同源四倍体水稻花粉败育。植物理性。2015; 169(4):2700-17。
- 15.
吴俊,陈立,沙希德MQ,陈米,董Q,李茹,徐X,刘X.普遍互动Sa和某人该位点在同源四倍体水稻减数分裂过程中引起花粉的高不育性和基因表达突变,可被双中性基因克服。大米。2017;10:49。
- 16。
关键词:水稻,新四倍体,转录组分析,育性,杂种优势Sci众议员2017;7:40139。
- 17。
陈蕾,袁媛,吴Ĵ,陈Z,王升,沙希德MQ,刘X.碳水化合物的代谢和生育有关的基因的高表达水平的同源四倍体水稻杂种优势促进窝藏双中性的基因。米。2019; 12:34。
- 18。
北X,Shahid MQ,Wu J,Chen Z,Wang L,Liu X.重新测序和转录组分析显示肾脏倍细稻米富含DNA变异和生育型基因的差异表达。Plos一个。2019; 14(4):E0214953.1-23。
- 19。
yu z,haage k,Streit Ve,gierl a,ruiz ra。大量的四倍体拟南芥通过快速策略产生的株系表明新四倍体在连续世代中具有很高的稳定性。Theor apply Genet. 2009; 118:1107-19。
- 20。
关键词:水稻,雄性不育系,花粉发育,基因表达栽培稻l .)。BMC植物BIOL。2016; 16:175。
- 21。
傅C,王F,刘,刘D,李杰,朱米,廖y,刘z,黄鹤,zeng x等。转录组分析揭示了在精英稻雄性无菌线中的高温依赖性灌注潜入的新见解。前植物SCI。2017; 8:112。
- 22。
Li X, Yu H, Jiao Y, Shahid MQ, Wu J, Liu X. genetic polymorphism and methylome and transcriptome analyses revealed multiple factors associated with low pollen育性。《公共科学图书馆•综合》。2018;13:。
- 23.
魏刚,陶莹,刘刚,陈超,罗瑞霞,甘泉,曾辉,陆志,韩艳,等。超级杂交水稻的转录组分析LYP9和它的父母。中国科学(d辑:地球科学)2009;106(19):7695-701。
- 24.
香卡R,尔吉A,在不同水稻品种耆那M.转录分析提供新的见解干燥和盐胁迫应答。SCI代表2016; 6:23719。
- 25.
田呒,聂Q,李Z,张健,刘毅,龙Y,王Z,王刚,刘R.转录组分析揭示超显性打尼古丁杂种优势的关键作用烟草L. BMC植物生物学。2018; 18:48。
- 26.
菲塔朵A,箭牌C,亨利RJ。基因表达对小麦硬度的影响。《公共科学图书馆•综合》。2016;11 (10):e0164746。
- 27.
刘勇,高胜,唐勇,龚军,张欣,王勇,张磊,孙锐,张强,陈智,等。小麦粳麦8号杂种幼苗和穗组织的转录组分析揭示了杂种优势相关基因。足底。2018;247(6):1307 - 132。
- 28。
沈勇,孙胜,华胜,沈恩,叶灿,蔡东,Timko MP,朱强,范磊。异源多倍体杂种优势的转录和表观遗传变化分析芸苔属植物显著揭示了小rna的关键作用。工厂j . 2017, 91(5): 874 - 93。
- 29。
(马军,张丹,曹勇,王丽,李军,Lubberstedt T,王涛,李艳,李华。不同种植密度下玉米杂种优势相关基因的研究进展)玉米l .)。J Exp Bot. 2018;69(21): 5077-87。
- 30.
黄勇,张磊,张健,袁冬,徐超,李昕,周东,王胜,张强。水稻9198特异ESTs基因表达的微阵列分析及其杂种优势和多态性。植物学报。2006;62:579-91。
- 31.
翟R,冯Y,王H,詹X,沉X,吴W,张勇,陈d,戴政,杨Z,等人。通过RNA SEQ稻根杂种优势转录组分析。BMC基因组学。2013; 14:19。
- 32.
黄艾兹,张Sy,Ge L,王L.稻杂交种和父母的基因组转录组谱。int j mol sci。2014; 15:20833-45。
- 33.
袁浩,秦鹏,胡丽,詹淑娟,王双峰,高鹏,李娟,金美美,徐志勇,高强,等。OsSPL18控制水稻的粒重和粒数。基因组学杂志2019;46:41-51。
- 34.
焦y,王y,薛d,王继,燕m,刘g,东g,zeng d,lu z,zhu x等。规范OsSPL14通过OsmiR156在米中定义理想的植物建筑。NAT Genet。2010; 42:541-4。
- 35.
薛W,兴Y,翁X,赵Y,唐W,王磊,周H,宇S,徐C,李X等。自然变异Ghd7是水稻抽穗期和产量潜力的重要调节因子。Nat麝猫。2008;40:761-7。
- 36.
黄x,钱q,刘z,孙h,他,罗d,xia g,楚c,李j,富x。自然变化DEP1基因座提高水稻籽粒产量。Nat麝猫。2009;41:494-7。
- 37。
李敏,唐东,王凯,吴晓霞,陆丽,于华,顾敏,严超,程志明。F-box基因的突变圆锥花序大改良水稻穗型结构,提高水稻产量。生物技术学报2011;9(9):1002-13。
- 38。
Ashikari M, Sakakibara H, Lin S, Yamamoto T, Takashi T, Nishimura A, Angeles ER, Qian Q, Kitano H, Matsuoka M.细胞分裂素氧化酶调节水稻产量。科学。2005;309:741-5。
- 39。
王胜,吴科,袁强,刘旭,刘志林,曾锐,朱华,董刚,钱强,等。控制晶粒尺寸、形状和质量OsSPL16在大米。Nat麝猫。2012;44:950-4。
- 40.
王L,Sun S,Jin J,Fu D,Yang X,Weng X,Xu C,Li X,Xiao J,Zhang Q.植物生殖分支的协调调节。Proc Natl Acad Sci U S A. 2015; 112:15504-9。
- 41.
李胜,赵斌,袁东,段敏,唐磊,王波,刘旭,张军,王军,等。水稻锌指蛋白DST通过调控提高粮食产量Gn1a / OsCKX2表达。Proc Natl Acad Sci U S A. 2013; 110:3167-72。
- 42.
白x,黄y,毛d,温米,张l,兴y。监管作用FZP在穗分支和水稻小穗形成的确定。SCI代表2016; 6:19022。
- 43。
刘丹,李少林,王丽娜,李强,崔永军,戴晓东,赵志林,陈超,李建新,刘志林。克隆及表达分析SiCDPK4,一个与杂种优势有关的基因谷子[(Setaria Italica.(L.)P. Beauv。)]。J工厂增长调节。2019; 38:513-22。
- 44。
杨黄X,年代,龚J,赵问,冯Q,詹Q,赵Y,李W,程B,夏J, et al。水稻产量性状杂种优势的基因组结构。大自然。2016;537:629-33。
- 45。
Shahid MQ, Chen F, Li H, Wang S, Chen P, Lin S, Liu X, Lu Y.双中性基因,SA-N和Sb-n,对水稻花粉育性,克服indic×粳稻杂种不育性。作物科学。2013;53:164 - 76。
- 46。
他J,Shahid MQ,Li Y,Gu H,Cheng X,Liu X,Lu Y. F的等位基因互动1花粉不育基因座和染色体异常的行为在亚种间同源四倍体水稻杂种引起花粉败育。J Exp Bot。2011; 62:4433-45。
- 47.
张L,Yu H,MA B,Liu G,Wang J,Wang J,Gao R,Li J,Liu J,Xu J等。自然串联阵列减轻了表观遗传镇压IPA1从而生产出高产水稻。Nat Commun。2017;8:14789。
- 48.
陈蕾,卞JM,石SL,宇JF,Khanzada H,Wassan GM,朱CL,罗X,佟S,杨XR,彭XS,勇S,郁QY,他XP,傅JR,陈XR,胡LF,欧阳LJ,他HH。遗传分析使用RNA-SEQ一个超级杂交稻WFYT025组合的晶粒数的杂种优势。米。2018; 11:37。
- 49.
左松,康辉,李强,陈智,张勇,刘伟,王刚,陈辉,潘欣。国际水稻核心库品种穗部性状控制基因的全基因组关联分析及其育种利用。中国水稻科学。2014;28:649-58。
- 50。
Megersa A, Lee D, Park J, Koh HJ。水稻上穗疏松突变体的遗传定位。植物育种技术。2015;3(4):366-75。
- 51。
刘涛,李玲,张艳,徐超,李旭,邢勇。水稻产量、穗长和小穗密度的数量性状位点比较。J麝猫。2011;90:377 - 82。
- 52。
马拉地人B,古利里亚S,莫哈帕特拉T, Parsad R, Mariappan N, Kurungara VK, Atwal SS, Prabhu KV, Singh NK, Singh AK。水稻新株型重组自交系产量及相关性状基因组新区域的QTL分析(栽培稻l .)。BMC Plant Biol. 2012;12:137。
- 53.
姚晓燕,李强,刘杰,姜克勤,杨少林,王继勇,徐志军。不同环境下水稻株高和穗长性状qtl分析中国农业科学。2015;48:407-14。
- 54.
张玲,王静,王静,王玲,马波,曾玲,齐勇,李强,何哲。小麦数量性状位点分析与精细定位qPL6水稻穗长位点。Theor Appl Genet. 2015; 128:1151-61。
- 55.
Ishii T, Numaguchi K, Miura K, Yoshida K, Thanh PT, Htun TM, Yamasaki M, Komeda N, Matsumoto T, Terauchi R,等。OsLG1调节驯养稻米的封闭穗状性质。NAT Genet。2013; 45:462-5。
- 56.
Cota-Sanchez JH, Remarchuk K, Ubayasena K.用适合于植物标本室标本和黏液植物组织的CTAB方法提取现成的DNA。植物学报2006;24:161-7。
- 57.
白华,曹勇,全建,董磊,李铮,朱勇,朱玲,董智,李丹Foxtail小米.《公共科学图书馆•综合》。2013;8 (9):e73514。
- 58.
Kim D, Pertea G, Trapnell C, Pimentel H, Kelley R, Salzberg SL. TopHat2:在插入、缺失和基因融合中转录组的精确比对。基因组医学杂志。2013;14 (4):R36。
- 59.
Trapnell C,Williams Ba,Pertea G,Mortazavi A,Kwan G,Van Baren MJ,Salzberg SL,Wold BJ,RNA-SEQ的成绩单组件和定量揭示了细胞分化期间未经发布的转录物和同种型切换。NAT BIOTECHNOL。2010; 28:511-5。
- 60.
Youens-Clark K,Buckler E,Casstevens T,Chen C,Declerck G,Derwent P,Dharmawardhana P,Jaiswal P,Kersy P,Karthikeyan As等。GrameNe Database 2010年:更新和扩展。核酸RES。2011; 39:D1085-94。
- 61.
Livak KJ, Schmittgen TD。利用实时荧光定量PCR技术分析相关基因表达数据——ΔΔCT方法。方法。2001; 25:402-8。
确认
作者感谢李元庆教授捐赠L202-4x, Jackson-4x和Luxiang 97-4x。我们也感谢余淑红女士和其他实验室成员的帮助。
资金
这项工作得到了广州科技关键程序XD刘(201707020015),国家自然科学基金(国家自然科学基金委)XD(31571625),广东省的关键领域R & D项目(2018 b020202012)和中国国家自然科学基金(国家自然科学基金委)mq(31850410472)。资助方不参与研究的设计、数据的收集、分析和解释以及手稿的撰写。
作者信息
隶属关系
贡献
XDL构思和设计了实验。Maag,MQS和XDL写了这篇论文。MAAG,CL,JHL,RXC,MQS,HY,XDL和JWW进行实验并分析了数据。XDL开发了新四倍体和自身移植米饭。所有作者都阅读并批准了稿件的最终版本。
相应的作者
伦理宣言
伦理批准和同意参与
研究中使用的植物样本不是从国家公园或自然保护区采集的。根据国家和地方立法,收集这些植物不需要特别的许可。我们确认,这符合国家指南,在这个特殊情况下不需要正式的伦理批准。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:图S1A。
花多8号的育种程序。图印地花多1号(H1)、花多8号(H8)的穗部和穗部的穗部1混合动力车。图就是S1c亲本和F1与花多8号(H8)杂交产生的杂种。图S2亲本在花粉不育位点的基因型原始图像(Sa,某人和Sc),S5轨迹检测由分子标记。图S3qRT-PCR验证转录组数据的质量。图S4基于转录组数据对所有表达基因进行层次聚类分析。图S5利用基因本体论富集分析检测了两个杂交种开花前和开花后5天8个组织中基因的显著功能类别。图S67个常见产量相关qtl在2个水稻品种中的分布1杂交,T449 × H1 [17]和T452 × H3 [16,与本研究检测到的与degfu -sp相关的qtl进行比较。图S7Huaduo 8的LP基因DNA变异的聚类分析。图S8用于rna测序分析的样本。
附加文件2:表S1。
起源和在花粉不育基因座同源四倍体和新四倍体水稻基因型,Sa,某人,Sc和胚囊育性基因(S5)和它们的农艺性状。表S2。F中中亲和高亲优势的手段1在2017年和2018年的两个季节。表S3。农艺性状分析方法1在2017年和2018年的两个赛季。表S4a.父母,杂种,组织和发展阶段的代码和名称。表S4b.干净总结从两架F转录组数据的读取1杂种(H1 × H8和T485 × H8)及其亲本。表S5与F相关的差异表达基因1杂交种与旗帜叶,叶子,小穗和主穗轴的父母相比。表S6差异表达与父母在旗叶,叶鞘,小穗和主穗轴相关的基因。表S7差异表达基因的基因ID与f相关的差异表达基因1相比于父母和特定(DEGFu-SP),以旗叶,叶鞘,小穗和主穗轴。表S8A开花前和开花后5天,8个组织基因的功能分类显著1hybrid (H1 × H8) by Gene ontology (GO) enrichment analysis.表S8B.开花前和开花后5天,8个组织基因的功能分类显著1通过基因本体(GO)富集分析(T485 × H8)。表S8C.通过基因本体论(GO)富集分析,列出杂交种基因的功能分类。表S8D.通过基因本体论(GO)富集分析基因的常见突出功能性分类。表S8E.DEGFu-sp对两个杂种的KEGG通路分析。
附加文件3:表S9a中
常规基因在杂交种中的DEGFU-SP中与激酶相关联。表S9B.DEGFu-sp中与合成酶相关的共同基因与两个杂种相关。表S9C.与NBS-LRR抗病性蛋白或相关联的共同基因LRR受体样在DEGFu-SP蛋白激酶到两个杂种。表S9D.与转录因子在DEGFu-SP这两个杂交相关的共同基因。表S9E.与重要农艺性状相关的已知基因从DEGFu-SP这两个杂交检测。表S10a在歼所有DEGFu-SP相关的QTL的名称1(H1 × H8和T485 × H8)。表S10b关键词:产量相关qtl1(H1 × H8和T485 × H8)。表S10cF的Degfu-SP相关常见QTL的名称1(H1 × H8和T485 × H8)。表S10d四个f中的DEGFU-SP相关常见QTL的名称1混合动力车(H1×H8 T485×H8、T449×H1和T452×H3)。表S10eDEGFu-sp重要基因的命名及差异表达1杂交(H1×H8)。表S10f名称和在F中重要DEGFu-SP基因差异表达1hybrid (T485 × H8).
附加文件4:表S11a中,B
F的DEGFU-SP-非添加剂的基因ID1混合动力车。表S11c,维degfu -sp-非加性基因与F1混合动力车。表S12a与H8中的Degfu-Sp克隆和突变基因检测到的重叠基因与H1相比。表S12b与T485相比,H8中degfu -sp克隆和突变基因检测到重叠基因。表S12c与H1和T485相比,degfu -sp克隆的重叠基因和H8中所有常见突变基因均被检测到。表S13a与H1和T485相比,在H8中检测到DEGFu-sp与突变基因的重叠。表S13b重叠基因从DEGFu-SP,在H8突变体和克隆的基因相比,H1和T485检测。表S14DEGFu-sp克隆基因的蛋白互作预测分析。表S15用于PCR和QRT-PCR的引物列表.表S167个产量相关QTL的名称。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Ghaleb,M.A.A.,李,C.,沙希德,M.Q.et al。杂种优势的分析,并与长穗宽兼容新四倍体稻线下面分子调节机制。BMC植物BIOL.20,83(2020)。https://doi.org/10.1186/s12870-020-2291-z
收到了:
接受:
发表:
关键字
- 米 (栽培稻l .)
- Neo-tetraploid大米
- 混合活力
- 圆锥花序
- 转录组