摘要
背景
玉米(玉米是一种主要的谷物作物,美国占全球产量的40%以上。玉米叶蚜[CLA;Rhopalosiphum麦迪是玉米和其他单子叶作物的一种重要的经济害虫。除了喂养损害外,共轭亚油酸还充当导致玉米发生毁灭性疾病的病毒的载体。我们之前已经证明,玉米自交系Mp708是通过传统植物育种开发的,对CLA具有更高的抗性。然而,导致CLA对Mp708抗性的转录组变异尚未被研究。
结果
在本研究中,我们在转录组(mRNA-seq)和挥发性混合水平上对比了抗药Mp708基因型对易感Tx601基因型的防御反应。我们的研究结果表明,与Tx601植物相比,Mp708植物在应对CLA侵害时存在更大的转录组重构。这些转录组标记表明激素途径的激活,并以构成和诱导的方式调节倍半萜和萜类合成酶。转录组分析表明,抗性基因型Mp708在蚜虫侵染前后对乙烯和茉莉酸途径具有明显的调控作用。最后,我们的研究结果也强调了Mp708和Tx601植物挥发性有机化合物(VOCs)的组成性生产的重要性,可能有助于玉米的直接和/或间接防御反应。
结论
本研究进一步了解防御信令网络在MP708对CLA抵抗力中的作用。
背景
玉米(玉米L.)是世界上种植的最重要的谷物作物之一。此外,玉米是许多国家的重要主食,并在许多发展中国家提供超过45亿人的食物卡路里的至少30%的食物卡路里[1]. 因此,任何对玉米生产产生负面影响的压力,例如,植物病害和虫害的爆发都是危险的,可能会对粮食安全产生连锁效应。玉米受到大量昆虫的攻击,这些昆虫在地面和地下都吃[2].
蚜虫是吸吮虫害的虫害,显着影响作物产量损失[3.,4].间接地,蚜虫也通过植物病毒疾病造成植物损伤[5].玉米叶蚜;马氏罗非鱼(惠誉)]是玉米上最常见的SAP昆虫害虫[2,6].包括共轭亚油酸在内的蚜虫,利用它们口器中的管状茎从维管组织中取食[3.,7,8].除了直接造成产量损失外,食用共轭亚油酸还是玉米矮花叶病毒和玉米叶斑病病毒等病毒的载体[9,10].此外,CLA喂养会用蜜露(蚜虫的消化废物)覆盖玉米植物,在植物上留下粘性沉积物并引起霉菌,从而扰乱和/或降低光合效率[11].
我们之前已经证明,玉米自交系Mp708是由抗虫的Mp704和敏感的Tx601植物杂交而成的,它提供了更高的抗CLA [12,13,14,15].CLA的摄食触发了mir1.玉米抗虫半胱氨酸蛋白酶(Mir1-CP)防御蛋白[13,14].此外,叶面取食CLA可迅速触发远端地下积累mir1.通过一个未知的机制[13,14].在其他系统中记录了对叶面虫害的根源与根部射击的与源的化合物的运输已记录在其他系统中[15,16].例如,绿色桃蚜虫(myzus persicae.)喂拟南芥叶子诱导表达5脂氧合酶(LOX5)ROOTS的转录物[16].LOX5,编码9-LOX和/或在根中合成的依赖lox5的产物可能通过维管系统转移到芽中,并增强了蚜虫的定植[16,17].也有研究表明,CLA叶面取食后,根系中Mir1-CP的积累增强了对根食食草动物的抗性[14].此外,我们已经证明,组成升高的12-氧 - 植物酸(OPDA),茉莉酸(JA)生物合成途径中间体,有助于增强胼ins植物中的CLA抗性[18,19].然而,遗传和药理学分析指出,OPDA介导对CLA的抗性与JA途径无关[18].此外,OPDA还调控乙烯(ET)生物合成和受体基因的表达,这些基因在调控中起重要作用mir1.在提供对CLA的抵抗力方面的表达[13,18].
除了直接防御(例如玉米中的mir1 - cp介导的防御),植物也激活间接防御,其中包括各种植物挥发物,涉及植物、昆虫和掠食性昆虫之间的三营养相互作用[20.].植物挥发性有机化合物(VOC)主要由萜类化合物,脂肪酸衍生物,苯基丙醇和苯丙酮组成[21].这些间接防御可以是本质上的构成型或诱导。例如,组成型或草本病变诱导的水杨酸甲酯(MESA)吸引捕食性昆虫对其宿主植物,这有助于减少食草猎物[22,23].例如,通过大豆蚜虫喂养(蚜虫甘氨酸)以大豆(大豆蛋白)诱导吸引掠食性甲虫的MESA,Coccinella septempunctata.,到宿主植物,从而限制蚜虫增殖[23].此外,其中一些VOCs作为空气信号,可能激活植物内或邻近植物中未受损区域的后续昆虫食草性防御反应[24,25,26].
在这项研究中,我们结合转录组学和挥发分分析揭示了Tx601和Mp708植物在CLA侵害前后叶片和根中早期防御机制的调节。我们的研究结果表明,抗性Mp708基因型独特地激活了不同的途径,参与了蚜虫侵害前后的植物防御机制,可能有助于抗CLA。而Tx601敏感基因型在蚜虫侵染前或侵染后对CLA的防御通路的调节并没有增强。最后,对未受蚜虫侵害的植株进行挥发性分析表明,抗CLA的Mp708基因型与敏感的Tx601基因型相比,释放的挥发性有机化合物水平较低。VOC数据和转录组变化表明,Mp708基因型可能更适合于激活CLA喂养后的防御。
结果
玉米转录组对CLA侵扰的反应
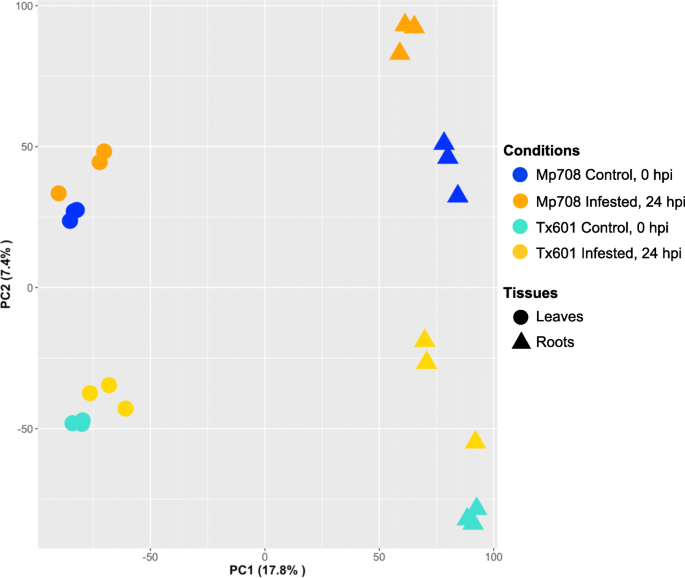
RNA-SEQ用于鉴定响应于敏感和抗性玉米基因型的蚜虫饲喂的转录组变化。在玉米参考基因组上进行读取映射(V4;www.phytozome.org),表明在八种条件中的至少一种中表达了38,897个基因。进行38,897个基因的主要成分分析(PCA),PC1占变差的17.8%,通过组织分离转录om,PC2占所述差异的7.4%,通过基因型和处理分离转录ome(图。1).以两种方式研究差异表达:(i)对于两种基因型之间的每次时间点(0和24小时,HPI)和(II)之间的每个基因型。用显着表达差异定义差异表达基因(DEG)(P < 0.05)和至少两倍于相应对照组的变化:24 hpi与0 hpi,或基因型:Mp708与Tx601。总共有25180个独特的基因差异表达。其中,CLA侵染后Mp708叶片和根系中分别有3964和8074个基因差异表达,Tx601叶片和根系中分别有3463和7305个基因差异表达。表中总结了每次比较的DEG重新分配1.
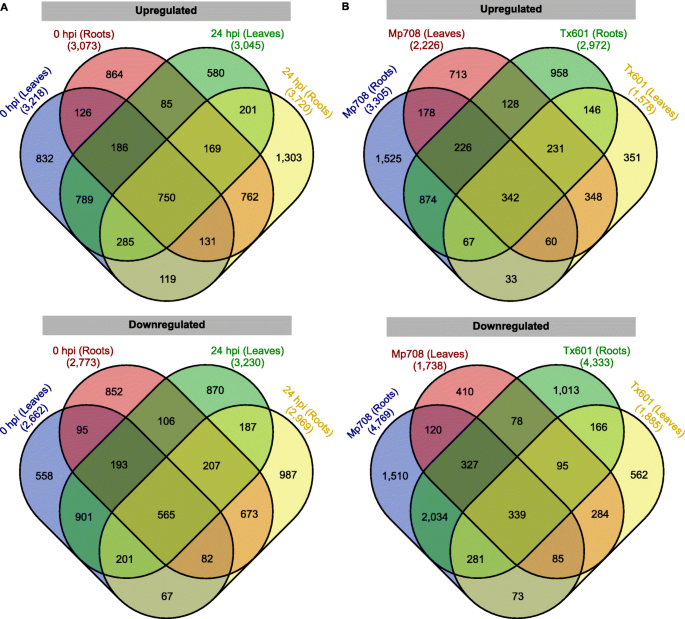
在蚜虫24小时后,数千个基因在其表达水平中变化。在25,180℃之间,分别在根和叶中通常上调1509和981(图。2a).另一方面,2981和803分别在根和叶中普遍下调(图2)。2一种)。侵扰后溃疡或下调的比例受到玉米基因型的影响(表1).在未血液植物中,在MP708叶中上调3218(54.7%)的5880℃,而在CLA侵袭后24小时将上调6275℃的3045(48.5%)叶(表1).对于根组织,分别在TX601未捕获和侵染的根部上调3073(52.5%)和3720个基因(表1).此外,还监测了每个基因型组织中上调或下调的基因数量。在Mp708的叶片和根中有86个基因表达上调,而在Mp708的叶片和根中有876个基因表达下调。2b)。
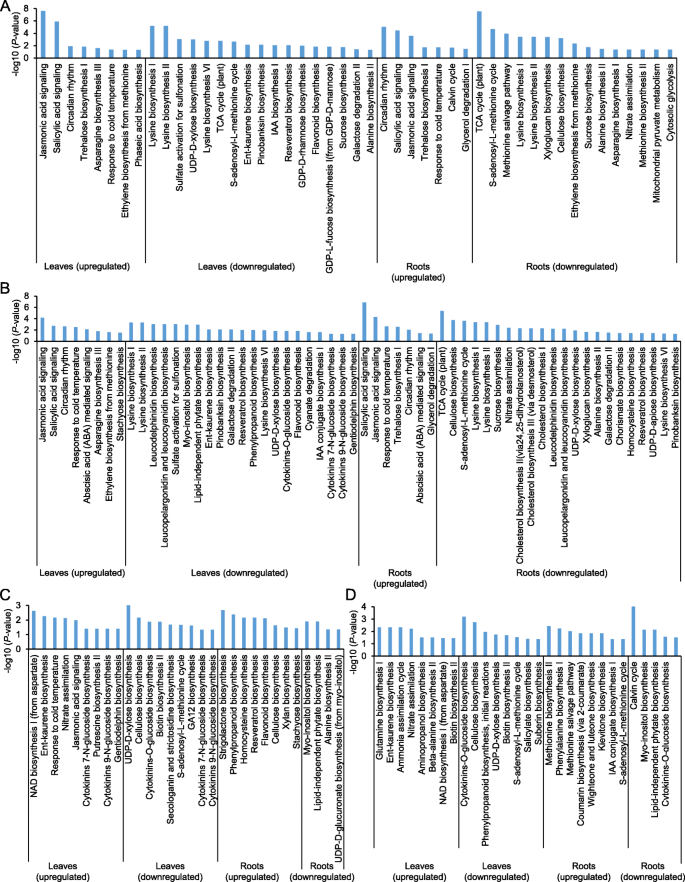
为了进一步了解不同的植物防御途径在响应CLA侵害中的作用,研究了上调或下调基因中的途径富集。CLA侵染24 h后,两种基因型叶片中上调的基因均与JA信号、SA信号或蛋氨酸乙烯生物合成相关(图2)。3.然而,与脱落酸(ABA)信号传导相关的基因仅在Tx601基因型中富集(图1)。3.b)。对于下面的组织进行类似的观察结果:SA信号,JA信号传导,对寒温的反应是在两个基因型中CLA侵扰后上调的功能的一部分(图。3.A和B)。此外,在CLA侵扰后仅发现ABA介导的信号功能富集于TX601根(图。3.b).“类黄酮生物合成”或“赖氨酸生物合成”是两种基因型叶片中下调的途径之一(图2)。3.然而,在Mp708叶片中,“蔗糖生物合成”或生长素生物合成“IAA生物合成I”通路被下调(图7)。3.a)和细胞分裂素生物合成途径(“细胞分裂素7- n-葡萄糖苷生物合成”,“细胞分裂素9- n-葡萄糖苷生物合成”或“细胞分裂素- o -葡萄糖苷生物合成”或“苯丙素生物合成”是Tx601叶片中下调的部分途径(图)。3.b).根中常见的下调途径与“赖氨酸生物合成I和II”、“三羧酸循环”、“纤维素生物合成”或“硝酸盐同化”有关。有趣的是,Mp708根中“蛋氨酸回收途径”、“蛋氨酸生物合成乙烯”途径下调。Tx601根特异性下调的途径与胆固醇生物合成(“胆固醇生物合成I”、“胆固醇生物合成II”、“胆固醇生物合成III”)或udp - d -木糖生物合成有关(图1)。3.b)。
通过比较两种基因型未受侵染的植物的数据,Mp708叶片中下调的基因与“纤维素生物合成”、“细胞分裂素生物合成”或“生物素生物合成”有关,而上调的基因与“JA信号”和“硝酸盐同化”等功能有关(图)。3.C)。在MP708中下调的基因与TX601相比24 HPI的叶子涉及细胞素生物合成途径(细胞素蛋白-O-葡糖苷生物合成)或纤维素生物合成。有趣的是,与TX601的MP708中的上调基因与TX601在24hPI叶中富含硝酸盐同化(图。3.d)。
两种基因型的根转录组比较表明,Mp708植物根中下调的基因与富集“肌醇生物合成”的功能有关,“丙氨酸生物合成II”或“不依赖脂质的植酸生物合成”,而上调基因在“独角兽内酯生物合成”、“苯丙素生物合成”或“类黄酮生物合成”中功能丰富。CLA侵染后,Mp708根中下调基因具有与“Calvin循环”、“细胞分裂素- o -糖苷生物合成”相关的功能,上调基因具有与“蛋氨酸生物合成II”、“苯丙氨酸生物合成I”或“蛋氨酸回收途径”相关的功能(图)。3.c和d)。
基因共表达簇对基因型或组织具有特异性
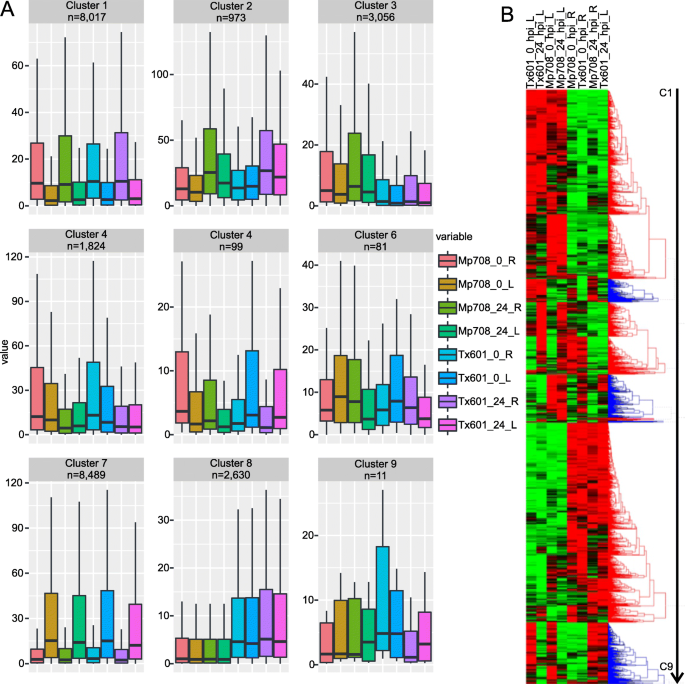
在25,180非冗余DEG上进行分层聚类分析,其相似度最小,以建立设置为0.834的簇,这是Pearson相关性P- 发现 - 阈值为0.01,并发现九个共表达簇:C1(簇1)至C9(图。4).每个集群的基因数量从11个(C9)到8489个(C7)(图2)。4).两种簇由特异性在未血液和侵染的根或叶子中表达的基因组成:C1(8017基因;在根组织中表达的基因)和C7(8489;在叶组织中表达的基因)。两个簇由基因组成,特别是在MP708根或TX601根和叶子中提升:C3(3056个基因在MP708中上调)和C8(2630个基因在TX601中上调)。C4(1,824)由在未血液型条件下上调的基因组成。三种剩余簇(C5,99基因; C6,81基因;和C9,11基因)由所有条件中具有瞬时表达模式的基因组成(图。4).
防御机制的激活是针对每个基因型的特异性
我们鉴定了3056个基因在Mp708基因型的根组织中特异表达(C3,图。4).mir1.(Zm00001d036542)中发现部分C3,并在叶面感染CLA的植物根系中上调(补充表1).作为C3的一部分的基因的功能被注释为“Metalotheine 2b”(Zm00001d048611)、“低温及盐反应蛋白”(Zm00001d024778),“休眠/生长素相关的家庭蛋白质”(ZM00001D032422)和“亚甲基四氢叶酸还原酶家族蛋白”(ZM00001D029853).此外,PLAC8家族蛋白的一个成员(ZM00001D039776发现了C3的一部分,并在从CLA侵染植物获得的MP708根中上调。基因本体富集分析表明,C3中的共表达基因富含“转移酶复合物”,“磷脂酰肌醇3-激酶复合物”,“PAS络合物”,“真空膜”或“储液”(细胞组分)(补充表2).KEGG通路分析显示JA生物合成和信号通路、“乙烯介导信号”或“硫胺素生物合成”基因富集(补充表)2).
在TX601植物(C8)中特异性上调的2630个基因中,具有较高累积表达水平的基因被注释为“PHE氨裂解酶1”(ZM00001D017274),“B12D蛋白质”(ZM00001D037275),“低温和盐响应蛋白家庭”(ZM00001D008200.)或“钙调蛋白,11”(ZM00001D005895).Kegg浓缩分析显示,作为“β-丙氨酸生物合成II”,“NAD生物合成I”,“泛酸生物合成I / II”或“股胞内酮信号”(补充表2).
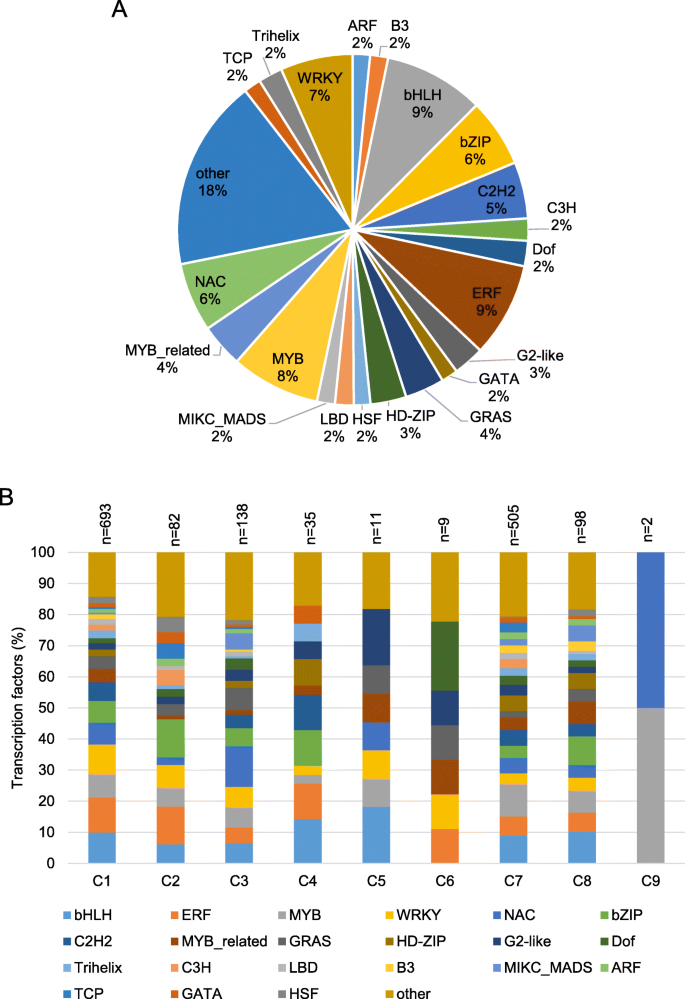
转录因子的重分配在不同表达簇中是不相等的
转录因子(TFS)在调节植物对昆虫草食病和不同类别的TFS可以差异调节这些响应时发挥至关重要的作用27].在我们的数据集中,共发现1573个TFs存在差异表达(补充表)3.).大部分TFS是C1(693 TFS; 44%)和C7(505 TFS; 32.1%)的一部分(补充表3.). 在TFs中,最具代表性的家族是bHLH(145 TFs)、ERF(137 TFs)、MYB(129 TFs)和WRKY(105 TFs)(图。5一种)。进一步重新分解C3(138 TFS)中的TFS,NAC(18 TFS)表示TFS的比例较高,然后是GRAS(10 TFS),BHLH(9 TFS),MYB(9 TFS)和WRKY(9 TFS)(图。5b).在C8中,98个deg为TFs,包括10个bHLH, 9个bZIP, 7个MYB和7个MYB相关(图2)。5B;补充表3.).
参与植物激素生物合成的基因被蚜虫喂养调节
为了识别受感染植物激素反应的特征,我们根据它们在激素途径中的功能筛选基因(图。6;补充表4).
茉莉酸
JA Biosynthesis以α-亚麻酸(18:3)开始,其是脂氧酶(LOX)酶的基材。这液态氧玉米基因家族含有13个LOX编码基因座(Zmlox1-13) [28].此外,根据它们含氧化α-亚麻酸,9-脂氧基酶和13-脂氧基酶,将LOX酶细分为两组。有七种9-脂氧基酶(ZmLOX1, 2,3,4,5,6,12)和613-脂氧基(ZmLOX7, 8,9,10,11,13)在玉米中。13-脂氧基是JA生产的第一步,而9-脂氧基酶的产物仍然可以对昆虫草食病的防御功能[29].
在13中液态氧注释基因中,有7个差异表达,编码9-脂加氧酶:Zm00001d033623(ZMLOX3.),Zm00001d042540(Zmlox2.) 和Zm00001d042541(ZMLOX1.),Zm00001d033624(ZMLOX4.),Zm00001d025524(ZMLOX7.),ZM00001D003533.(ZMLOX8.),ZM00001D002000(ZMLOX6.).其中,有3个基因在Mp708叶片中表达上调(ZMLOX4.,ZMLOX7.和ZMLOX8.),其中2个在Tx601叶片中上调(ZMLOX4.和ZMLOX8.)(补充表4).ZMLOX6.在两种基因型的根和叶片中下调编码“含有平台/ LH2结构域脂氧合酶”蛋白质“。两者在MP708根和叶中下调(ZMLOX1.和Zmlox2.).一个是在两个品种的叶子上上调(ZMLOX8.).在13-脂氧基酶中,一个基因座Zm00001d053675(ZMLOX10.)在Mp708和Tx601根中分别上调和下调。ZM00001D013493(ZMLOX5.)仅在TX601根中诱导(图。6;补充表4).
联烯氧化物合成酶(AOS)催化下一个酶促逐步朝向JA生产[30.].玉米中有六个规定的AOS编码基因座,其中只有两个在我们的数据集中显示出显着的表达式。一个基因座(Aosa;ZM00001D002592.)CLA诱导玉米基因型的根部,一个基因座(AOSB;Zm00001d028282)由于CLA侵染,在两个品系的叶片中的表达都降低。丙二烯氧化物环化酶(AOC)和氧磷二烯酸还原酶(OPR)催化JA生产所需的另外两种酶反应[31.].玉米有两个AOC编码位点,其中一个位点的表达水平不受CLA的影响,而第二个位点的AOC编码位点在所有组织和品系中的表达均降低。在玉米基因组中发现了8个推测的OPR编码位点,其中5个位点受到CLA侵害的影响。一个轨迹(ophd.)在根中没有表达,但在两种基因型的叶片中都有诱导表达。第二个OPR基因座的表达(oprb.)在两种基因型的根中下调,而在叶组织中相对不变。
拟南芥的另一个JA相关基因是JAR1,哪种Ja与异氨酸缀合,并通过养蛋白诱导[32.].有趣的是,JAR1还已被证明缀合JA至ACC(乙烯生物合成中的中间体)[32.].在玉米中报告了五个推定的JAR1编码基因座(ZmJAR1a,b和ZmJAR2a-c) [33.],虽然只是ZmJAR1a,ZmJAR1b,Zmjar2a.在我们的数据集中有重要表达。ZmJAR1c(Zm00001d011377) 和ZmJAR1d(ZM00001D039345)在TX601叶中诱导,在MP708和TX601根中的两种组织中不变;ZmJAR1a(ZM00001D008957.)在TX601叶中表达了表达,并且在CLA侵扰后在MP708和TX601根中诱导(图。6;补充表4).
12- oxo-phytodienocator(OPDA)
在8个OPDA注释基因中(opr.),五个差异表达:opr1.(Zm00001d044908),opr2.(Zm00001d044906),opr4.(ZM00001D011097.),OPR5.(ZM00001D003584) 和opr6.(Zm00001d040842).opr6.在24 HPI的两种基因型中都上调。opr2.在Tx601叶片中,在24 hpi时上调,而opr1.和opr4.Tx601和Mp708叶片24 hpi表达下调。此外,opr4.仅在Mp708和Tx601根和Mp708叶片中表达下调(图2)。6;补充表4).
乙烯
乙烯生物合成始于蛋氨酸,经SAM合成酶(SAM)转化为s -腺苷- l-蛋氨酸(SAM) [34.].此外,SAM通过ACC合成酶(ACS)转化为1-氨基环丙烷-1-羧酸(ACC)。ACS还产生MTA(甲基硫腺苷),它通过Yang循环回收回SAM [34.].然后ACC氧化酶(ACO)从ACC中产生乙烯。玉米有5个编码ACS酶的基因座(ACSa:ZM00001D002592.,ACSB:Zm00001d026060,ACSC:Zm00001d033862,ACSD:ZM00001D039487,ACSE:Zm00001d045479),所有这些都表达了我们的数据集。只有两个基因(ACSA.和ACSC.)差异表达,两者在两种基因型的叶子中诱导24 HPI和表达ACSC.在Mp708根中降低(补充表4).
玉米中有13个假定的ACO编码位点[35.其中七个在我们的数据集中显示出显着的表达式变化。五四个ACO.在MP708和TX601植物的叶片中上调,两种基因型的根部上调两种(ACOa和ACOi)在两种根基因型中,有两种表达下调(ACOb和ACOf).但是,一个基因(ACOd)在Tx601和Mp708根中分别上调和下调(补充表4).
乙烯生物合成的另一个重要部分是开始底物SAM的再生,通过阳循环[34.].该循环具有六个酶促步骤,以SAM合成酶(SAMS)的产生结束[34.].在我们的数据集中,五个基因座进行差异表达,并且所有人都在CLA侵扰后的两个基因型的根源中减少了表达(补充表4).同样,拟南芥中的EIN2是乙烯信号转导所必需的[36.].一份Zmein2.(ZM00001D013492)在TX601中显示出与叶子和根部的0和24 HPI的MP708相比增加了TX601的表达。同样,另一个成员艾因基因家族(ZM00001D013492)表现出相同的表达模式。EIN3和EIL1是拟南芥乙烯信号传导的必需TFs,ERF1是EIN3在拟南芥中的直接靶点[37.].ERF1是ERF(乙烯反应因子)的一部分,其是含有大量AP2 / EFR结构域的TF。在注释的ERF / AP2 TF中,在两个时间点之间差异表达13。三个在MP708中的24 HPI专门上调(ZM00001D006169,ZM00001D006170和Zm00001d003884), 9个基因型和组织均上调(Zm00001d017592,Zm00001d002618,ZM00001D036003,ZM00001D002025,ZM00001D021207,ZM00001D021208,Zm00001d002762,Zm00001d031673,ZM00001D025281).只有一个基因(Zm00001d016262)在MP708叶和TX601根中在24 HPI下进行下调。
水杨酸
SA的生物合成被连接到两个不同的途径:异chorismate (IC)途径和苯丙氨酸解氨酶(PAL)途径[38.,39.].在涉及SA途径的基因中,在我们的数据集中差异化(补充表4).只有一个基因(ICS2.,ZM00001D020220)在我们的数据集中有差异表达,并在Mp708根中上调。Mp708根中编码“PHE裂解酶1/2”的基因在蚜虫攻击后下调(ZM00001D051161,Zm00001d033286,ZM00001D051166,ZM00001D017274),TX601 ROOTS(Zm00001d033286,ZM00001D051161)、Mp708和Tx601叶子(ZM00001D051166,ZM00001D003015,ZM00001D003016).在编码“甲酯酶”的五℃中,仅在TX601根中仅升高三个,并且在MP708根和TX601根和叶中下调两种。在CLA侵扰后的两个基因型的叶片中,在两种基因型的叶片中上调,编码“UDP-糖基转移酶”潜在地连接到SA的糖基化,而在所有条件下下调一个(图。6;补充表4).
蚜虫未染色的易感玉米基因型具有升高的萜烯水平升高
萜类化合物是由包括萜类合成酶(TPS)在内的几种酶合成的,是植物与环境相互作用的组成部分[40].在我们的数据集中,11TPS蚜虫侵染后差异表达:TPS1,TPS2,TPS3,TPS5,TPS7,TPS8,TPS10,TPS11,TPS17,TPS23和TPS26(补充表格5).TPS5和TPS23与其他组相比,Mp708的CLA未侵染叶片中的表达上调TPS在CLA未侵略的TX601叶中上调的基因。
为了确定敏感玉米(Tx601)和抗性玉米(Mp708)基因型在CLA侵害前的挥发性有机化合物(VOCs)和萜类化合物的变化,在推挽系统中收集释放的植物挥发物8 h,并用GC-MS分析。表格2总结了GC-MS鉴定的15 VOC的结果。在两个基因型中差异发出八个VOC,并在TX601基因型中以较高的丰度释放,但MP708基因型不存在六个VOC。在MP708基因型中不存在的六个VOC中,五个是挥发性倍半萜(α-ylangene,Germacrene D,(E)-β-法呢烯,α-倍疣和δ-起角丁烯),以及一种芳族化合物3-己酮 -1-乙酸盐。两种基因型中存在两种化合物Linalool(单萜)和(E)-4,8-二甲基纳-1,3,7-三烯(或DMNT;倍二萜),但在TX601植物中显着富集(表2;补充图。1).
讨论
玉米自交系,MP708,为昆虫害虫的各种饲养公会提供抵抗力[13,41.,42.].本研究提出的结果和我们以前的研究[13,14,18证明了激活Mp708对不同害虫的防御需要不同的途径。例如,在Mp708中,ET和JA的联合作用需要提供mir1 - cp介导的对咀嚼昆虫的防御,而CLA喂养诱导的表达mir1.在Mp708基因型中独立于JA途径,仅依赖于ET途径[13,43.,44.].此外,OPDA在ET通路上游起激活作用mir1.玉米对CLA的依赖防御[18].在目前的研究中,与TX601植物相比,在MP701植物中,在MP708和CLA侵染可能参与MP708的抗性后,在MP708基因型中,在MP708中发现了较高数量的上调的可上调的次数。
Mp708基因型特异性的转录组反应
在玉米防御机制工具箱中,Mir1-CP被认为是响应CLA攻击的关键防御蛋白[13,14].CLA诱导叶面摄食mir1.不仅在侵染部位表达,而且在根的上部表达,ET在调控中起核心作用mir1.[13].本研究进一步证实了这一点mir1.基因功能富集分析预测ET在调控mir1..我们也发现了南汽共表达TF家族基因的比例最高(18个)mir1..NACs是植物特异性的转录因子,已有多项研究表明,大量的NACs可以被ET调控。例如,ANAC074 (AT4G28530)被报道结合ET响应基因的启动子和胁迫响应基因[45.].在番茄中,至少有一个n基因受编码Et受体的基因突变的影响[46.].微阵列分析显示,约三分之一n通过施加1-氨基环丙烷-1-羧酸盐,ET的直接前体来调节基因[47.].在拟南芥中,突变EIN2(乙烯INSENTIVE 2)阻止了诱导NAC092./atnac2 / oresara1.(ORE1)在盐条件下的表达[48.].在这里,两种基因与之共同mir1.(C3)编码蛋白质,注释与低温/盐相关的功能。
CLA侵扰前后植物型途径参与的基因的调节
植物激素在调节植物对吸汁蚜虫的防御中起关键作用[3.,4,8,49.].在这里,我们研究了在抗性和易感基因型中的CLA侵袭的CLA侵袭中涉及植物激素生物合成所涉及的基因的转录组响应。与来自未血液的TX601基因型的叶片相比,与JA生物合成相关的基因在抗抗性MP708基因型的抗腐烂的叶片中升高。这与我们之前的观察结果一致,即MP708植物在昆虫草本食草之前具有组成型JA的升高水平[13,50.]. CLA侵染后,抗性Mp708基因型叶片中JA相关的植物防御机制被激活。OPDA是JA生物合成的中间产物,它本身也可以作为一种信号化合物,值得注意的是,OPDA已被证明影响胼胝质的形成,并有助于增强Mp708对CLA的抗性[18].虽然MP708植物升高了JA的水平,但是遗传分析表明OPDA介导对CLA的抗性与JA途径无关[18].Tx601基因型中上调的基因也与植物防御机制有关,但这些机制并不能阻止CLA侵染引起的广泛损害。有趣的是,我们发现受cla侵染的Tx601叶片中有更高表达的四糖水苏糖生物合成相关基因。在植物中,蚜虫摄食诱导的海藻糖(一种非还原性α,α-1,1-连锁葡萄糖二糖)的积累增强了对蚜虫的抗性[51.,52.].水苏糖可以增加韧皮部的渗透压,干扰蚜虫获取汁液,这可能是玉米对蚜虫的一种防御机制[53.]. 然而,一些蚜虫已经发展出一种策略来克服这种渗透障碍[54.],领先于减少这种防御机制的力量。
除茉莉酸外,水杨酸还参与植物防御信号传导,并对取食韧皮部的昆虫提供抗性[4,8,55.].我们以前的工作和本作中提出的数据一致认为,在MP708植物上的CLA喂养显着诱导了所涉及综合作用的基因的表达,然而,药理学研究证实了这一点mir1.- 对CLA的依赖性防御从SA途径脱离[13].类似地,一些研究表明,蚜虫喂养诱导的SA和/或SA相关基因表达的积累出现为对蚜虫的广义植物反应,但对于控制宿主植物的蚜虫侵染并不重要[56.,57.,58.,59.].总的来说,这项研究中的数据重申,Mp708的及时转录重编程导致激活一个强大的防御机制,以对抗CLA入侵。
其他防御机制的参与
与MP708基因型相比,CLA易感TX601基因型具有显着更高的倍二萜类化合物含量。已经证明了萜类化合物,Sesquiterpenoids和相关VOC涉及对食草或病原体的间接植物防御机制。这里,富含倍二萜化合物在易感TX601基因型的未血液叶中富集。我们的转录组学研究显示了几个TPS除了用于两种基因型中,基因在24 HPI下进行了下调,除了TPS5和TPS23.两个都TPS5和TPS23在抗蚜基因Mp708的叶片中显著上调。在玉米中,诱导TPS23通过控制(E)-β-石竹烯的排放,发现与食草动物天敌的吸引有关[60.].然而,TPS23在被CLA侵染后Mp708叶片中表达显著下调,而在被Tx601侵染的植株(根和叶)和Mp708侵染植株的根中不表达。TPS2和TPS3与Linalool合成相关的,先前已鉴定在CLA侵扰后在B73植物中诱导[61.然而,在TX601植物中,两种基因都显着下调,表明蚜虫攻击后LINALOOL合成途径的灭活。以前,表明草食动物易感肌肉(茄属植物carolinense)植物具有更高的组成型挥发性排放,但在虫害后挥发物诱导较弱[62.].同样,Tx601基因型中本构性挥发物排放的增加似乎并不会转化为CLA喂养诱发挥发物的相应增加。虽然研究表明寄生在玉米上的鳞翅目幼虫上的黄蜂的吸引力,表现出了对倍半萜混合物的偏好,这种混合物中既有结构性挥发物,也有草食动物诱导的挥发物[63.[同样上可能是组成型发射的挥发物可以用食草食草诱导的植物挥发物拮抗作用,以减弱天然敌人的吸引力。或者,与迅速安装适当的防御(例如,MiR1-CP,植物防御途径)的MP708植物不同,CLA易感TX601植物未能引起直接防御机制可能发出组成型挥发物以吸引天敌。但是,在易感宿主中,昆虫也能够抑制有效的间接防御[64.].统称,考虑到很多TPS在抗性MP708基因型中CLA侵扰后显着上调基因,我们假设MP708植物表现出CLA饲喂诱导的挥发物的诱导诱导诱导,从而显着吸引了更多的捕食性昆虫。
结论
在蚜虫侵害前后,敏感和抗性玉米基因型在转录组和挥发分水平上发生了改变。在转录水平上,抗性Mp708植物在CLA草食后有更有效的响应。在CLA侵染之前和之后,抗性Mp708植株中编码植物激素生物合成所需的几种蛋白和可能与激素信号传导相关的转录因子的基因均上调。这些数据表明,抗性玉米基因型对植物激素途径和VOCs具有较好的调控,可能导致抗CLA能力增强。
方法
植物栽培和蚜虫繁殖
玉米叶蚜和玉米植株的种植方式与前面描述的一样[13,18].在V2-V3发育阶段(〜2周)使用实验的MP708和TX601植物[65.]并在3.8厘米×21.0cm的塑料锥锥(Hummert International,Mo)中生长。在V2-V3阶段,玉米植物的第二个真叶用10个成人CLA感染。CLA-侵染的叶片是夹子笼,并收集组织24 HPI。CLA未血液的样品在0 HPI作为对照植物收集。用每次重复组合三个样品形成的三种重复感染了九种植物。对于根收集,从土壤中小心地除去植物,并如前所述收集的根样本[13,14].
RNA提取和RNA-SEQ库构建和测序
玉米根和叶组织(80-100毫克)使用2010年Geno /Grinder®(Spex Sampleprep,NJ,USA)在1400次中划分为40秒- 1在液氮的存在下。随后,使用Qiagen RNeasy Plant Mini Kit从均质组织中提取总RNA。采用Nanodrop 2000c分光光度计(Thermo Scientific TM)定量提取的总RNA。然后,利用mRNA-seq标准TruSeq协议,在Illumina HiSeq 2500 (University of Minnesota Genomics Center)上构建RNA-seq文库。RNA-seq文库以50 bp的配对端进行测序,平均每个文库有2000万reads。
RNA-SEQ库分析
采用FASTQC对RNA-seq文库进行质量检查[66.]和Phred评分低于20和长度低于45碱基对的reads用Trimmomatic v0.39去除[67.].然后,修剪后的reads被映射到玉米参考基因组v4 (https://////phytozome.jgi.doe.gov/pz/portal.html#!bulk?org=org_zmays.)与tophat2 [68.]使用以下参数:1不匹配(-N 1),0拼接不匹配(0),唯一映射读取(-g 1-m)。修剪和映射的输出统计信息总结在补充表中6.使用Cufflinks v2.2.1进行转录本重建,参数如下:仅对参考注释进行量化(−G)、多读正确(−u)和碎片偏误正确(−b)。差异表达基因用Cuffdiff 2.2.1进行分析。用以下参数识别deg:P ≤ 5% and false discovery rate |log2(侵染/ contol)| ≥ log2[2]. 基因本体(GO)用麦泽明分析(http://128.206.234.22:8080/80/80/8080/80/80/80/8080/80/84.),使用引用注释作为模板。使用层次聚类Explorer 3.5软件进行层次聚类(http://www.cs.umd.edu/hcil/hce/hce3.html),用全连杆法和皮尔逊相关系数。建立聚类的最小相似度设置为0.834,即在P-value阈值为0.01。用ggplot包在R中进行了主成分分析。
玉米挥发性物质的收集与分析
使用推拉系统收集从TX601和MP708植物中组成的VOC的VOC进行收集[69.].每一种基因型V3阶段的8株植物被封闭在单独的玻璃室中(直径20厘米,高度30厘米),置于特氟龙断头台式底座上,以排除来自土壤的气味污染。用活性炭净化的空气以2l min的速度进入每个室- 1并且通过以1 L min的速率从每个腔室中拉出空气来收集从植物发出的挥发物- 1在含有HayeSepQ的挥发性过滤器捕集器上(美国西格玛·奥尔德里奇)。收集挥发物12小时 在180度的恒定光照下 μmol M- 2年代- 1.用150μl二氯甲烷和5μl壬酸乙酯洗脱挥发性过滤器捕集物(80ngμl-1)作为内部标准。将一微升洗脱样品注入安捷伦6890气相色谱仪和5973质谱仪,无分注射器保持在250 摄氏度。进样后,柱(Rxi®-1 女士,30岁 m、 0.25 毫米内径,0.25 μm膜厚;Restek,美国)维持在40 2摄氏度 分钟后,温度升高10 °C/min,直到达到190 摄氏度,然后是12度 °C/min,直到达到280 摄氏度。通过将质谱和保留时间与公布的数据(NIST14质谱库)进行比较,确定目标化合物,其> ChemStation(安捷伦,美国)提供90%的保真度。所有化合物均按照乙酸壬酯标准进行定量。
可用性数据和材料
在当前研究的测序过程中生成的原始数据集可在BioProject: PRJNA661336获得,并可在以下链接获得:https://dataview.ncbi.nlm.nih.gov/object/prjna661336?reviewer=3m1u79lr3svuom44fqnfasv4kn.
缩写
- 克拉:
-
玉米叶蚜虫
- 度:
-
差异表达基因
- 等:
-
乙烯
- 一汽:
-
降粘虫
- 舰队指挥官:
-
折叠变化
- FDR:
-
假发现率
- 气相:
-
气相色谱分析-质谱法
- 去:
-
基因本体论
- 现病史:
-
感染后数小时
- 是:
-
茉莉酸
- 液态氧:
-
脂氧合酶
- OPDA:
-
12-oxo-phytodienoic酸
- 山:
-
水杨酸
- TF:
-
转录因子
- TPS:
-
萜烯合酶
- VOCS:
-
挥发性有机化合物
参考
- 1.
养活世界的庄稼玉米在全球粮食安全中所发挥作用的过去的成功和未来的挑战。食物秒。2011;3:307。
- 2.
Meihls Ln,Kaur H,Jander G.玉米防御对抗昆虫食草动物的自然变化。冷泉Harb Symp量子Biol。2012; 77:269-83。
- 3.
Nalam V,Louis J,Shah J.植物防御对抗蚜虫,害虫ExtraDinaire。植物SCI。2019; 279:96-107。
- 4。
mics:破解植物对吸汁害虫防御的“经济学”方法的交集。植物生态学报。2020;56:153-61。
- 5。
肯尼迪JS,Day MF,Eastop VF。蚜虫作为植物病毒载体的概要。伦敦:英联邦昆虫学研究所;1962年。
- 6。
Bing JW,Guthrie WD,Dicke FF,Obrycki JJ。玉米叶蚜苗期取食(同翅目:蚜科):对玉米植株发育的影响。经济与环境杂志。1991;84(2):625–32.
- 7。
路易J,辛格五世,沙阿J。拟南芥- 互动。拟南芥书。2012; 10:E0159。
- 8.
路易斯J,Shah J.拟南芥桃蚜互动:塑造对饲料蚜虫的对植物防御的理解。前植物SCI。2013; 4:213。
- 9.
Thongmeearkom P,Ford Re,Jedlinski H.玉米矮状马赛克病毒菌株的蚜虫传播。植物疗法。1976; 66:332-5。
- 10.
所以Y-S,Ji HC,Brewbaker JL。玉米叶蚜抗性(Rhopalosiphum麦迪惠誉)在热带玉米(玉米l .)。Euphytica。2010; 172:373-81。
- 11.
Carena MJ,Glogoza P.玉米对玉米叶蚜虫的抗性:综述。梅迪卡。2004; 49(4):241-54。
- 12.
王志强,王志强。玉米Mp708种质系的选育。作物科学。1990;30:757。
- 13.
王志强,王志强,王志强,等。乙烯有助于玉米虫抵抗1- 针对韧皮液吸吮玉米叶蚜虫的玉米防御。植物理性。2015; 169(1):313-24。
- 14。
Varsani S,Basu S,Williams WP,Felton GW,Luthe DS,Louis J.玉米的载体通信有助于防御昆虫。植物sig表现。2016; 11(8):E1212800。
- 15.
Baldwin IT, Schmelz EA, Ohnmeiss TE。伤诱导的根和茎中茉莉酸池的变化与诱导的烟碱合成有关Nicotiana sylvestris.spegazzini和。J Chem Ecol. 1994; 20:2139-57。
- 16。
Nalam VJ,KeereTaweep J,Sarowar S,Shah J.根系衍生的奥寡糖促进蚜虫性能拟南芥叶。植物细胞。2012;24:1643-53。
- 17。
Louis J,Shah J.植物防御对抗蚜虫:PAD4信号通知Nexus。J Exp Bot。2015; 66:449-54。
- 18。
Varsani S,Grover S,Zhou S,Koch Kg,Huang P-C,Kolomiets MV等。12- oxo-phytodienoic acid作为玉米叶蚜虫的玉米防御调节剂。植物理性。2019; 179(4):1402-15。
- 19.
Grover S,Varsani S,Kolomiets MV,Louis J.玉米防御Elicitor,12- oxo-植物生酸,延长蚜虫延期。Comm Stoct Biol。2020; 13(1):63-6。
- 20
费尔顿GW, Tumlinson JH。植物-昆虫对话:植物-昆虫界面上复杂的相互作用。植物学报。2008;11(4):457-63。
- 21
Dudareva N,Pichersky E,Gershenzon J.植物挥发物的生物化学。植物理性。2004; 135(4):1893-902。
- 22
Rodriguez-Saona C,Kaplan I,Braasch J,Chinnasamy D,Williams L. Precalyous节肢动物对水杨酸甲酯的场响应:蔓越莓中的荟萃分析和案例研究。Biol con。2011; 59(2):294-303。
- 23。
朱家,公园克。水杨酸甲酯,大豆蚜虫诱导的植物挥发性对捕食者有吸引力Coccinella septempunctata..acta Chem Ecol. 2005;31(8): 1733-46。
- 24。
刚刚出生,卧着tcj,琼斯th,stenhagen g,loughrin jh,tumlinson jh。来自甜菜羊虫口腔分泌物的植物挥发物的引诱者。科学。1997年; 276(5314):945-9。
- 25。
Karban R,Baldwin I,Baxter KJ,Laue G,Felton G.植物之间的沟通:野生烟草植物中的抗性跟随邻近的Sagebrush。oecologia。2000; 125:66-71。
- 26。
Frost CJ、Mescher MC、Dervinis C、Davis JM、Carlson JE、De Moraes CM。绿叶挥发性顺-3-己烯基醋酸酯引发杂交杨树防御基因和代谢产物。新植物醇。2008;180(3):722–34.
- 27。
辛格kb,foley rc,oñate-sánchezl.植物防御和压力反应中的转录因子。CurrOp植物BIOL。2002; 5:430-6。
- 28。
Ogunola,Hawkins LK,Mylroie E,Kolomiets MV,Borrego E,Tang JD,Williams WP,Warburton ML。玉米脂氧基酶基因系列与黄曲霉毒素累积抗性的表征。Plos一个。2017; 12(7):E0181265。
- 29。
黄志强,王志强,王志强,等。9-脂氧合酶在玉米抗昆虫食草性中的作用。植物学报。2018;13(1):4709-23。
- 30.
穆勒MJ。参与茉莉酸生物合成的酶。physiol植物。1997年; 100(3):653-63。
- 31.
Stenzel I,Hause B,Maucher H,Pitzschke A,Miersch O,Ziegler J,等。伤口反应和血管束特异性生成伤口信号中番茄酸盐的联烯氧化物环依赖性。工厂J. 2003; 33(3):577-89。
- 32.
Staswick Pe,Tiryaki I. oxylipin信号茉莉酸被酶活性,将其与拟南芥中的异氨酸缀合。植物细胞。2004; 16(8):2117-27。
- 33.
Borrego EJ, Kolomiets MV。玉米茉莉酸酯类化合物的合成及其功能。植物。2016;5(4):41。
- 34.
王klc,李h,伊克塞尔Jr。乙烯生物合成和信号网络。植物电池2002; 14(SUP):S131-S151。
- 35.
1-氨基环丙烷-1-羧酸氧化酶(ACO):产生植物激素乙烯的酶。植物学报。2019;10:695。
- 36.
李波,马米,冯y,李h,王y,ma y等。拟南芥中乙烯信号传导的EIN2定向转化调节。细胞。2015; 163(3):670-83。
- 37.
Dolgikh VA, Pukhovaya EM, Zemlyanskaya EV。塑造乙烯反应:EIN3/EIL1转录因子的作用。植物学报,2019;
- 38。
dempsey da,vlot ac,wildermuth mc,klessig df。水杨酸生物合成和代谢。拟南芥书。2011; 9:E0156。
- 39。
Lefevere H,Bauters L,Gheysen G.植物中的水杨酸生物合成。前植物SCI。2020; 11:338。
- 40.
Chen F,Tholl D,Bohlmann J,Pichersky E.植物中萜烯合成酶的系列:在整个王国中高度多样化的专业代谢的中等大小的基因系列。工厂J1111; 66(1):212-29。
- 41.
Pechan T,Ye L,Chang Ym,Mitra A,Lin L,Davis FM,Williams WP,Luthe DS。独特的33kd半胱氨酸蛋白酶响应于玉米基因型的幼虫饲喂抗秋季蚯蚓和其他鳞翅目的幼虫。植物细胞。2000; 12(7):1031-40。
- 42.
鳃ta,sandoya g,威廉姆斯p,luthe ds。在鳞翅目型玉米基因型中对西玉米根虫的下场抵抗。j econ entomol。2011; 104(1):299-307。
- 43
Harfouche Al,Shivaji R,optoringr,Williams PW,Luthe DS。乙烯信号传导介导玉米防御反应对昆虫草食草。Mol植物微生物相互作用。2006; 19:189-99。
- 44
Ankala A,Luthe DS,Williams WP,Wilkinson JR。乙烯和茉莉酸信号传导途径在玉米防御蛋白MiR1-CP表达中的整合。Mol植物微生物相互作用。2009; 22:1555-64。
- 45
王他徐J L, Y,杨k .转录因子ANAC074结合NRS1, NRS2或MybSt1元素除了NACRS调节基因的表达。国际分子生物学杂志。2018;19:3271。
- 46
王志强,王志强,王志强,等。转录组和精选代谢产物分析揭示了乙烯在番茄果实发育过程中的多个控制点。植物细胞。2005;17(11):2954 - 65。
- 47。
NAC基因:拟南芥中激素信号转导的时间特异性调节因子。植物学报。2010;5(7):907-10。
- 48。
何学军,穆瑞林,曹卫华,张志刚,张建生,陈世勇。AtNAC2是乙烯和生长素信号通路下游的转录因子,参与盐胁迫反应和侧根发育。植物j . 2005; 44(6): 903 - 16。
- 49。
Erb M,Meldau S,Howe GA.植物激素在昆虫特异性植物反应中的作用。趋势植物科学。2012;17(5):250–9.
- 50。
Shivaji R,Camas A,Ankala A,Engelerth J,Tumlinson JH,Williams WP,Wilkinson JR,Luthe DS。常规警报的植物:在毛虫玉米中提高茉莉酸和茉莉蛋白诱导的转录物。J Chem Ecol。2010; 36:179-91。
- 51。
辛格v,路易斯j,ayre bg,里斯jc,shah J.海藻糖磷酸合成酶11.- 依赖海藻糖新陈代谢促进拟南芥防御植物喂养昆虫myzus persicae..工厂J1111; 67(1):94-104。
- 52.
黄志强,王志强,王志强,等。桃蚜对番茄生长的影响。植物学报。2012;7(6):605-7。
- 53.
De Schepper V,De Swaef T,Bauweraerts I,Steppe K. Phloem Transport:机制和控制综述。J Exp Bot。2013; 64(16):4839-50。
- 54.
道格拉斯AE。动物取食韧皮汁:问题与解决。中国农业科学。2006;57(4):747-54。
- 55.
Züst T, Agrawal AA。植物抗蚜机理与进化。Nat植物。2016;2:1-9。
- 56.
莫兰PJ,汤普森GA。与植物防途径有关的拟南芥蚜虫的分子反应。植物理性。2001; 125:1074-85。
- 57.
Mewis I,Appel HM,Hom A,Raina R,Schultz JC。主要信号通路调节拟南芥葡萄糖苷酸的积累,并对植物喂养和咀嚼昆虫的反应。植物理性。2005; 138:1149-62。
- 58.
Pegadaraju v,knepper c,reese Jc,Shah J.早产衰老调节Arabidopsis Thaliana帕佩4基因与防御韧皮部喂养的绿桃蚜虫有关。植物杂志。2005;139:1927-34。
- 59.
Grover S,Agpawa E,Sarath G,Sattler Se,Louis J.植物激素的相互作用促进了对蚜虫的高粱耐受性。植物mol biol。2020;https://doi.org/10.1007/s11103-020-01083-y.
- 60。
Capra E,Colombi C,De Poli P,Nocito FF,Cocucci M,Vecchietti A等。蛋白质分析和TPS23不同玉米系响应茉莉酸甲酯治疗的诱导Diabrotica Virgifera.侵扰。植物生理学。2015;175:68–77.
- 61。
Tzin V,Fernandez-Pozo N,Richter A,Schmelz Ea,Schoettner M,SchäferM等。对蚜虫喂养的动态玉米反应被转录组和代谢组测定的时间序列揭示。植物理性。2015; 169(3):1727-43。
- 62。
Kariyat RR,Mauck Ke,De Moraes Cm,Stephenson AG,Mescher MC。近亲繁殖改变了挥发性信号传导表型并影响了辣根中的三级疏水性相互作用(茄属植物carolinensel .)。生态。2012;15(4):301 - 9。
- 63。
Fontana A,举办M,Fantaye Ca,Turlings Tc,Degenhardt J,Gershenzon J.组成型和草食性诱导的玉米蛋黄蛋白酶的吸引力对寄生黄蜂Cotesia marginiventris(Cresson)。J Chem Ecol。2011; 37(6):582-91。
- 64.
贝德JC,穆塞尔RO,费尔顿GW,吉隆坡科思。毛虫的草食和唾液酶降低了昆虫的转录水平Medicago truncatula编码Terpenoid生物合成中早期酶的基因。植物mol biol。2006; 60(4):519-31。
- 65.
ritchie jt,singh u,godwin dc,bowen wt。谷物生长,发展和产量。不明白。选项农业产品。DONDRECHT:SPRINGER;1998. p。79-98。
- 66.
高通量序列数据的质量控制工具。2010;可以在网上http://www.bioinformatics.babraham.ac.uk/projects/fastqc
- 67
Trimmomatic:用于Illumina序列数据的灵活微调器。生物信息学。2014;30(15):2114 - 20。
- 68
Kim D,Pertea G,Trapnell C,Pimentel H,Kelley R,Salzberg SL。TOPHAT2:在存在插入,缺失和基因融合的情况下,转录om的精确对准。基因组Biol。2013; 14:R36。
- 69
Ray S,Helms Am,Matulis Nl,Davidson-Lowe E,Grisales W,Ali JG。草食性效应器反应中的不对称性:毛虫Frass效应器降低了后续食草动物的性能。J Chem Ecol。2020; 46(1):76-83。
致谢
感谢Saumik Basu为温室和实验室援助。我们还感谢明尼苏达大学基因组学中心进行RNA测序。
资金
这项工作得到了内布拉斯加州农业实验站的部分支持,该实验站的资金来自哈奇法案(Accession # 1007272)、美国农业部国家食品和农业研究所和美国国家科学基金会职业基金IOS-1845588给JL。NP和GS由USDA-ARS CRIS项目3042-21000-034-00D资助。JGA实验室的工作得到了usd - nifa # 2018-67013-27402的资助。
作者信息
隶属关系
贡献
JL构思和设计了研究;LP执行了计算分析;SV收集样品并进行RNA提取物;SR进行了VOC实验;JGA监督VOCS量化和分析;GS,NP和DSL有助于方法开发,试剂和数据分析;WPW开发了该研究中使用的玉米基因型;LP,NP,GS,JL与所有作者的贡献写了这篇文章。作者阅读并批准了最终手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人没有申报利益冲突。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:补充表1
:DEGS表达水平和簇基因链接。
附加文件2:补充表2
:聚类基因功能富集。
附加文件3:补充表3
:TFS表达水平。
附加文件4:补充表4
:参与激素途径的基因的DEGs表达水平。
补充文件5:补充表5
: TPS基因的DEGs表达水平。
补充文件6:补充表6
:修剪和映射输出。
附加文件7:补充图1
:挥发性有机物(VOCs)的主成分分析(PCA)。Mp708和Tx601分别用蓝色和绿松石表示。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Pingault,L.,Varsani,S.,Palmer,N。等等。与玉米叶蚜虫对玉米防御相关的转录组和挥发性签名。BMC植物BIOL.21,138(2021)。https://doi.org/10.1186/s12870-021-02910-0.
收到了:
接受:
发表:
关键词
- 玉米叶蚜虫
- 玉米
- 植物激素
- RNA-SEQ.
- 挥发性有机化合物