- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发布:gydF4y2Ba
动态转录组分析识别与种子中脂肪酸生物合成相关的基因gydF4y2Baprunus pedinculata.gydF4y2Ba颇gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba21.gydF4y2Ba文章编号:gydF4y2Ba152.gydF4y2Ba(gydF4y2Ba2021.gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
prunus pedinculata.gydF4y2BaPall,落叶灌木gydF4y2Ba菊花gydF4y2Ba亚因子gydF4y2Ba蔷薇科gydF4y2Ba是一种新型的沙漠油料树种。它在我国西部和北方种植,用于固沙治沙,历史悠久。此外,种子gydF4y2Bap . pedunculatagydF4y2Ba丰富的油,尤其是单一饱和脂肪酸和多不饱和脂肪酸。然而,关于种子发育过程中的油积累的分子机制很少gydF4y2Bap . pedunculatagydF4y2Ba.gydF4y2Ba
结果gydF4y2Ba
种子的gydF4y2Bap . pedunculatagydF4y2Ba获得开花(DAF)之后的10,18,24,31,39,45,59和73天的三种独立植物,评价油组合物。结果表明,油酸是成熟种子中的主要类型的油含量(在73DAF下的10dFaF的32.724%至72.06%)。接下来,发育种子的转录组测序为第一个转录组的988.795万高质量的读取和三位一体组装326,271基因gydF4y2Bap . pedunculatagydF4y2Ba.之后gydF4y2Ba组装gydF4y2Ba转录组由Busco评估,完整性为85.9%,我们确定了195,342,109,850和121,897gydF4y2Bap . pedunculatagydF4y2Ba基因分别与NR、GO和KEGG通路数据库进行了比对。然后,我们预测了23229种可能的转录组蛋白,鉴定了1917种信号肽和5512种跨膜相关蛋白。在种子发育过程中,共检测到91,362个基因(平均FPKM > 5),相关分析表明,种子可能发育3个阶段:早期(10 ~ 24DAF)、中期(31 ~ 45DAF)和晚期(59 ~ 73DAF)。接下来,我们分析了发育中的种子中的差异表达基因(DEGs)。有趣的是,与10DAF相比,deg的数量从18DAF的4406增加到73DAF的27623。在基因注释的基础上,我们分别鉴定了与脂肪酸生物合成、脂类生物合成、油体和转录因子相关的753、33、8和645个deg。值得注意的是,gydF4y2BaGPATgydF4y2Ba,gydF4y2BaDGD1gydF4y2Ba,gydF4y2BaLACS2gydF4y2Ba,gydF4y2BaUBC.gydF4y2Ba和gydF4y2Ba里诺gydF4y2Ba在早期发展阶段表达了高度表达,gydF4y2Baω6-FAD.gydF4y2Ba,gydF4y2Ba悲伤的gydF4y2Ba,gydF4y2Ba机场核心计划gydF4y2Ba,gydF4y2BaACCAgydF4y2Ba和gydF4y2BaAHG1gydF4y2Ba在发育中期高度表达,gydF4y2BaLACS6gydF4y2Ba,gydF4y2BaDGD1gydF4y2Ba,gydF4y2BaACAT1.gydF4y2Ba,gydF4y2BaAGPAT.gydF4y2Ba,gydF4y2BaWSD1gydF4y2Ba,gydF4y2BaEGY2gydF4y2Ba并在晚期开发阶段高度表达oleosin基因。gydF4y2Ba
结论gydF4y2Ba
这是第一次研究发展种子转录组gydF4y2Bap . pedunculatagydF4y2Ba我们的发现将为未来的研究提供有价值的资源。更重要的是,它将提高我们对石油聚集的分子机制的认识gydF4y2Bap . pedunculatagydF4y2Ba.gydF4y2Ba
背景gydF4y2Ba
prunus pedinculata.gydF4y2BaPALL(gydF4y2Bap . pedunculatagydF4y2Ba),属于落叶灌木gydF4y2Ba菊花gydF4y2Ba亚因子gydF4y2Ba蔷薇科gydF4y2Ba,是一种新型的沙漠含油树,也称为野生樱桃,杏仁用茎和毛茸茸的樱桃[gydF4y2Ba1gydF4y2Ba].这种罕见和濒危的野生树种自然地分布在中国西北地区干旱和半干旱地区的山区和沙漠地区。由于其强大的适应性,疾病和抗性,抗旱性,抗旱性,根系制造和长期生存期,gydF4y2Bap . pedunculatagydF4y2Ba历史悠久地在中国西部和中国北部进行沙子固定和沙漠控制[gydF4y2Ba2gydF4y2Ba].此外,gydF4y2Bap . pedunculatagydF4y2Ba种子富含蛋白质和油脂。种子中单不饱和脂肪酸含量为69.11%,多不饱和脂肪酸含量为28.77%gydF4y2Bap . pedunculatagydF4y2Ba[gydF4y2Ba3.gydF4y2Ba].然而,还有很多事情是未知的gydF4y2Bap . pedunculatagydF4y2Ba和他们的种子。gydF4y2Ba
植物产油过程包括4个步骤,1)脂肪酸从头合成,2)酰基延伸和编辑,3)三酰基甘油(TAG)组装和4)油滴形成[gydF4y2Ba4gydF4y2Ba].据报道,据报道了几种途径,基因和蛋白质参与了油形成过程。例如,脂肪酸的合成是局部化的,而标签分子的组装发生在塑体外部,并且与油体相关[gydF4y2Ba5gydF4y2Ba].脂肪酸的组装在ACP(酰基载体蛋白)上发生通过四个反应的循环,该反应将酰基链伸长2个碳,并且总共需要7个循环以形成饱和16碳酰基-ACP [gydF4y2Ba6gydF4y2Ba].脂肪酸亚型含量由FATA(酰基-ACP硫酯酶A)、FATB(酰基-ACP硫酯酶B)、18:0-ACP去饱和酶(SAD)和KASII (β-酮酰基ACP合酶II)活性决定[gydF4y2Ba6gydF4y2Ba].虽然大幅度是关于从体塑性的游离脂肪酸产物的运输中未知的,但涉及外层体积封套上的LAC(长链酰基-CoA合成酶)可以在形成ACY-COA的形成中起作用,这是甘油脂的基材集会 [gydF4y2Ba4gydF4y2Ba].据报道,新合成的脂肪酸对磷脂酰胆碱的酯化在血液包封通过LPCAT(酰基-COA:溶血磷脂酰胆碱酰基转移酶)中发生酯化。gydF4y2Ba7gydF4y2Ba].来自G-3-P-P-P(甘油-3-磷酸)的标签组装涉及一些关键酶,包括GPAT(甘油-3-磷酸酰酰基转移酶),LPAAT(透磷酸磷酸酰酰转移酶),PAP(磷脂酸磷酸酶)和DGAT(二酰基甘油)酰基转移酶)[gydF4y2Ba8gydF4y2Ba].转录因子(TFs) WRI1 (ethylene-responsive transcription factor WRI1) and LEC1 (nuclear transcription factor Y subunit B-9) has been reported to control the expression of more than 15 enzymes (e.g., pyruvate dehydrogenase), which are required for the synthesis of fatty acid and the determination of the oil content in plant seeds [9gydF4y2Ba,gydF4y2Ba10.gydF4y2Ba].gydF4y2Ba
转录组测序已经使鉴定参与种子发育及其与植物种子含油量的关联的基因成为可能。Fei利用转录组测序对种子发育的五个阶段gydF4y2Ba花椒gydF4y2Ba并确定与脂肪酸合成相关的20个基因,例如gydF4y2Ba谕知gydF4y2Ba,gydF4y2BaECRgydF4y2Ba和gydF4y2BaSAD1gydF4y2Ba[gydF4y2Ba11.gydF4y2Ba].阿卜杜拉对正在发育的种子进行转录组测序gydF4y2BaCamelina SativagydF4y2Ba并确定参与三酰基甘油生物合成和积累的7932个基因[gydF4y2Ba12.gydF4y2Ba].冯汇编了转录本gydF4y2Ba杜仲gydF4y2Ba报告了参与脂肪酸生物合成的65个基因,包括gydF4y2Ba法格gydF4y2Ba(3-氧代酰基-ACP还原酶),gydF4y2BaKASIIgydF4y2Ba和gydF4y2Ba薄巴gydF4y2Ba(烯酰- acp还原酶I) [gydF4y2Ba13.gydF4y2Ba].杨报告了124个基因(例如,gydF4y2Bagmabi3b.gydF4y2Ba,gydF4y2BaGmNFYAgydF4y2Ba,gydF4y2BaGmFAD2-1BgydF4y2Ba),通过分析正在发育的大豆种子的动态转录组,可能影响大豆油含量[gydF4y2Ba14.gydF4y2Ba].Li分析了正在发育的牡丹种子的从头转录组,鉴定了388个基因(例如,gydF4y2Ba悲伤的gydF4y2Ba,gydF4y2BaFAD2.gydF4y2Ba,gydF4y2BaFAD8.gydF4y2Ba),可能参与从头生成脂肪酸和TAG生物合成[gydF4y2Ba15.gydF4y2Ba].此外,王确定了与脂肪酸代谢途径,63个基因和与不饱和脂肪酸生物合成相关的脂肪酸代谢途径的35个基因和35个蛋白质,以及115个基因和与ALA(α-亚麻酸)代谢相关的24种蛋白质树牡丹种子[gydF4y2Ba16.gydF4y2Ba].Kim通过分析紫苏种子和叶的转录组,鉴定了540个紫苏基因,这些基因参与了所有已知的紫苏脂脂代谢途径gydF4y2Ba白苏子gydF4y2Ba[gydF4y2Ba17.gydF4y2Ba].然而,关于基因的变化很少,它们与种子发育过程中的脂肪酸合成少gydF4y2Bap . pedunculatagydF4y2Ba种子。gydF4y2Ba
在本研究中,我们检查了七种脂肪酸亚型的油含量gydF4y2Bap . pedunculatagydF4y2Ba八个发育阶段的种子,并进行转录组测序。我们组装了转录组gydF4y2Bap . pedunculatagydF4y2Ba种子并向他们注释。然后,在种子发育期间鉴定差异表达基因(DEG),并且它们可能与脂肪酸合成有关。加权基因共表达网络分析(WGCNA)揭示了种子发育特定时间点的关键基因,并且定量RT-PCR确认了种子开发和油积累中涉及的关键基因的表达变化gydF4y2Bap . pedunculatagydF4y2Ba种子。这是第一次研究转录组gydF4y2Bap . pedunculatagydF4y2Ba本文的研究将为今后的相关研究提供有价值的资源gydF4y2Bap . pedunculatagydF4y2Ba.该研究的产出将改善我们对种子发展的理解,并为植物中的油积累提供分子基础。gydF4y2Ba
结果gydF4y2Ba
发展种子油含量的动态变化gydF4y2Baprunus pedinculata.gydF4y2Ba
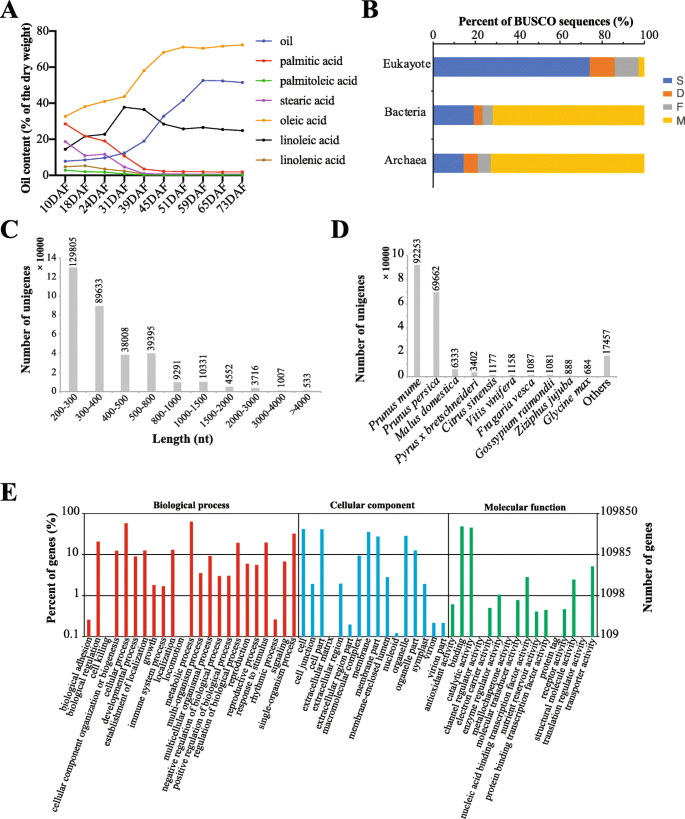
种子的gydF4y2Bap . pedunculatagydF4y2Ba分别为10、18 24、31、39、45、59和73 DAF。然后,使用气相色谱分析,我们评估了含油量(图。gydF4y2Ba1gydF4y2Baa),包括油,棕榈酸,棕榈酰酸,硬脂酸,油酸,亚油酸和亚麻酸。值得注意的是,油酸是主要的油含量,并且在种子发育过程中逐渐增加,从32.724%(10dFaf)至72.060%(73dAF)。亚油酸和油的组成分别达到31(37.74%)和59(52.62%)DAF。虽然59DAF后,油含量保持〜50%。在种子发育过程中降低了包括棕榈酸,棕榈酸,硬脂酸和亚麻酸的其他油含量。该信息提供了理解培养种子中的油含量的基础gydF4y2Bap . pedunculatagydF4y2Ba.gydF4y2Ba
种子发育中的含油量gydF4y2Bap . pedunculatagydF4y2Ba并概述组装的转录组。gydF4y2Ba一个gydF4y2Ba不同油型在种子发育中的比例gydF4y2Bap . pedunculatagydF4y2Ba10、18、24、31、39、45、59和73 DAF。显示标准方差的误差条太小,无法在图中看到。gydF4y2BabgydF4y2Ba使用BUSCO对组装好的转录组进行评估。S:完整的单份BUSCOs;D:完整复制的BUSCOs;F:分散的车身;M:失踪的车身。gydF4y2BacgydF4y2Ba组装基因的长度分布gydF4y2Bap . pedunculatagydF4y2Ba种子。gydF4y2BadgydF4y2Ba在NR映射结果中与不同物种对齐的基因数。gydF4y2BaegydF4y2Ba对组装的基因进行GO注释gydF4y2Ba
转录组测序和DE Novo集装箱gydF4y2Ba
研究基因的变化,探讨显影种子中的分子机制gydF4y2Bap . pedunculatagydF4y2Ba,我们对上述所有样本进行转录组测序,使用3个生物重复。最初,在数据清理后,转录组测序产生了98879.5万个高质量reads,平均为4120万个reads(表)gydF4y2Ba1gydF4y2Ba).然后,我们随机选择了从三个重复的一个样本进行De Novo分析。三位一体组装了来自326,271个基因的总共402,741个转录物(表gydF4y2Ba1gydF4y2Ba).计算组装好的转录组的GC含量为40.55%,N10、N20和N50分别为2333、1542、552(表2)gydF4y2Ba1gydF4y2Ba).为显影种子组装的总碱gydF4y2Bap . pedunculatagydF4y2Ba为205.66 M, CD-HIT在组装的转录组中鉴定出198113个聚类(表gydF4y2Ba1gydF4y2Ba)[gydF4y2Ba18.gydF4y2Ba].接下来,我们选择了作为Unigene数据集的最长的成绩单,并使用Busco评估组装的未完成的完整性[gydF4y2Ba19.gydF4y2Ba].数字gydF4y2Ba1gydF4y2BaB显示组装的转录组与真核生物序列相比,古菌和细菌序列更相似。我们在255个BUSCOs中鉴定了219个(85.9%)完整BUSCOs,包括189个(74.1%)完整的单拷贝和30个(11.8%)完整的重复BUSCOs。所组装的转录组长度分布显示,93.83%的组装的unigenes长度在200 ~ 1000 nt之间,533个(0.16%)unigenes长度在4000 nt以上(图1)。gydF4y2Ba1gydF4y2Bac)。gydF4y2Ba
转录组注释gydF4y2Ba
接下来,我们注释了组装的种子转录组(326,271 unigenes)gydF4y2Bap . pedunculatagydF4y2Ba使用多个工具和数据库。首先,转录组与NCBI非冗余(NR)对齐,我们发现195,342,unigenes映射。NR映射结果表明,组装unigenes的前两个击中物种是gydF4y2Ba李春万gydF4y2Ba(92,253 unigenes)和gydF4y2BaPrunus PersicagydF4y2Ba(69,662 unigenes)(图。gydF4y2Ba1gydF4y2Bad)。其次,我们确定了与基因本体(GO)数据库对齐的109,850个unigenes。GO注释显示,分别参与了“细胞过程”,“代谢过程”和“单生体过程”的生物过程中参与了132,608,118,239和80,695个unigenes(图。gydF4y2Ba1gydF4y2Bae)。我们还分别鉴定了与“细胞”和“细胞部位”相关的65,847和64,407个unigenes(图。gydF4y2Ba1gydF4y2Bae),这可能与脂肪酸合成有关。第三,我们使用KEGG PATHWAY数据库向组装的转录组进行注释,并找到121,897个unigenes对齐。它表明,26,474,14,804和2834个未分别参与了“代谢途径”(KOO1100),“次生代谢物”(KOO1110)和“植物激素信号转导”(KO04075)的“生物合成”的途径。gydF4y2Ba
然后,使用三特特ate进一步注释组装的显影种子转录组gydF4y2Bap . pedunculatagydF4y2Ba.在组装的转录组中,RNAMMER预测了16个编码核糖体rna的ungenes。接下来,我们使用TransDecoder预测了由组装的转录组产生的23229种可能的蛋白质。我们发现有18,002(77.58%)和16,120(69.40%)的可能蛋白分别与UniProt/SwissProt和Pfam数据库对齐。从可能的蛋白中,SignalP和TmHMM分别鉴定出了1917个信号肽和5512个跨膜相关蛋白。gydF4y2Ba
基因表达谱及差异表达分析gydF4y2Ba
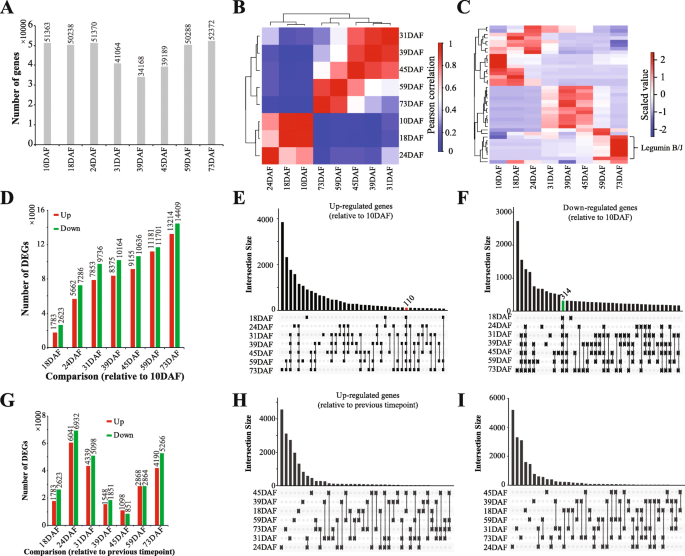
接下来,我们使用Bowtie2将clean reads与组装的unigenes进行比对,并使用RSEM方法分析所有样本的基因表达[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21.gydF4y2Ba].我们使用FPKM(每千克/千克映射的次数读数)方法,用于将基因表达的方法标准化,并在每个样品中过滤低表达基因(平均FPKM <5)。结果,对于显影种子,我们鉴定了总共91,362个基因,其中51,363,50,238,51,370,41,064,34,168,39,189,50,288和52,372分布在10ddaf,18daf,24daf,31daf,39daf,45ddaf,59daf和73daf分别(图。gydF4y2Ba2gydF4y2Baa).接下来我们使用基因表达谱分析样本之间的相关性。数字gydF4y2Ba2gydF4y2Bab透露了种子发展gydF4y2Bap . pedunculatagydF4y2Ba可分为三个阶段 - 早期(10〜24个DAF),中间(31〜45 DAF)和晚期(59〜73个DAF)。有趣的是,高表达的基因(前10名)gydF4y2Bap . pedunculatagydF4y2Ba发育中的种子证实了这三个发育阶段(图。gydF4y2Ba2gydF4y2Bac)。在高表达的基因中,我们发现编码富含脯氨酸的细胞壁蛋白的基因,所述种子(10DAF和18个DAF),编码特异于早期显影种子(10〜24个DAF)的基因,以及编码乳糜蛋白的基因特异于晚期显影种子的蛋白质(31〜73个DAF)。gydF4y2Ba
基因表达谱和差异表达分析。gydF4y2Ba一个gydF4y2Ba鉴定的基因数量gydF4y2Bap . pedunculatagydF4y2Ba种子在每个发育阶段。gydF4y2BabgydF4y2Ba基于基因表达谱的样品的Pearson相关性。gydF4y2BacgydF4y2Ba基于基因表达谱的样品分层聚类分析。gydF4y2BadgydF4y2Ba在发育中的种子中鉴定的deg数gydF4y2Bap . pedunculatagydF4y2Ba而10 daf。gydF4y2BaegydF4y2Ba培养种子中上调基因的比较gydF4y2Bap . pedunculatagydF4y2Ba而10 daf。(F)种子发育中下调基因的比较gydF4y2Bap . pedunculatagydF4y2Ba而10 daf。gydF4y2BaggydF4y2Ba在发育中的种子中鉴定的deg数gydF4y2Bap . pedunculatagydF4y2Ba与之前的时间点相比。gydF4y2BahgydF4y2Ba培养种子中上调基因的比较gydF4y2Bap . pedunculatagydF4y2Ba与之前的时间点相比。gydF4y2Ba我gydF4y2Ba显影种子中的下调基因的比较gydF4y2Bap . pedunculatagydF4y2Ba与以前的时间点相比gydF4y2Ba
接下来,我们在显影种子中鉴定了DegsgydF4y2Bap . pedunculatagydF4y2Ba.使用10DAF作为控制,其他样本中识别的DEG的数量(附加文件gydF4y2Ba1gydF4y2Ba)可以在图1中看到。gydF4y2Ba2gydF4y2Bad.有趣的是,在种子发育过程中,DEGs的数量有所增加,从18DAF的4406个DEGs增加到73DAF的27623个DEGs。值得注意的是,在发育的种子中比较了DEGsgydF4y2Bap . pedunculatagydF4y2Ba透露110个上调(图。gydF4y2Ba2gydF4y2Bae)和314下调(图。gydF4y2Ba2gydF4y2BaF)与10DAF相比,通过所有时间点共享基因。接下来,与先前的时间点相比,我们分析了显影种子中的果酒。数字gydF4y2Ba2gydF4y2Bag显示24DAF对18DAF中发现的deg最多,其次是73DAF对59DAF和31DAF对24DAF。将发育中种子中鉴定到的DEGs相对于之前的时间点进行比较,也证实了在这些时间点鉴定到的DEGs大部分都是上调的,没有一个被鉴定到上调(图1)。gydF4y2Ba2gydF4y2Bah)或下调(图。gydF4y2Ba2gydF4y2Bai)在种子发展期间。gydF4y2Ba
脂肪酸相关基因gydF4y2Ba
基于显影种子转录组的基因注释gydF4y2Bap . pedunculatagydF4y2Ba,分别鉴定出与脂肪酸生物合成、脂类生物合成、油体和转录因子相关的基因1246、51、9和2490个(表)gydF4y2Ba2gydF4y2Ba).在种子发展期间,我们分别鉴定了与脂肪酸生物合成,脂质生物合成,油体和TFS相关的753,33,8和645次(表gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
脂肪酸相关途径gydF4y2Ba
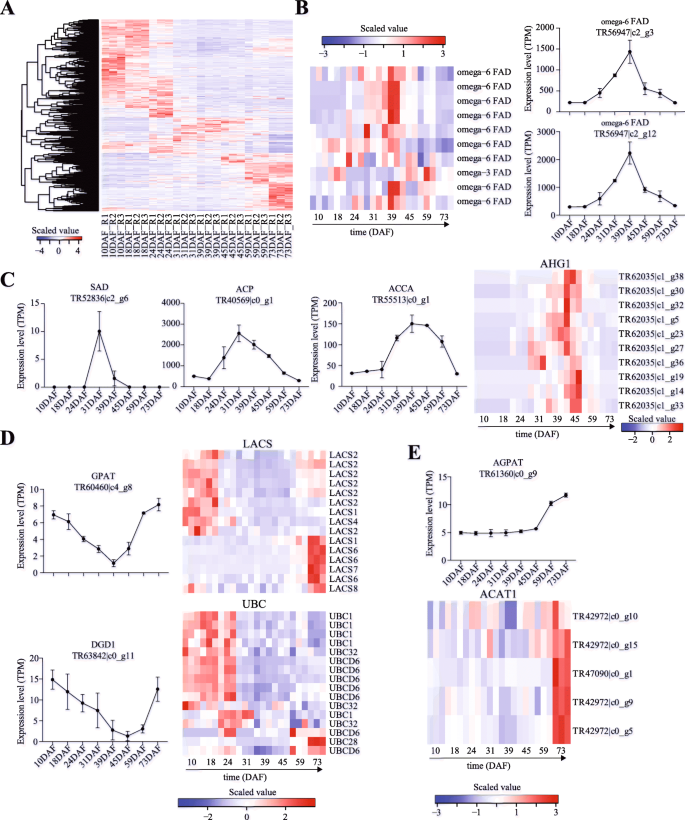
在种子发育的过程中gydF4y2Bap . pedunculatagydF4y2Ba我们确定了753次(附加文件)gydF4y2Ba2gydF4y2Ba)涉及24个脂肪酸途径/生物过程,包括脂肪酸代谢(ko01212)、不饱和脂肪酸生物合成(ko01040)、脂肪酸生物合成(ko00061)和脂肪酸转运(GO:0015908)。每个途径/生物过程所识别的deg的数量可在附加文件中找到gydF4y2Ba3.gydF4y2Ba我们使用了热图(图。gydF4y2Ba3.gydF4y2Baa)在种子发育期间显示这些753基因的表达水平。有趣的是,在种子发育过程中,高表达的脂肪酸相关基因变化。因此,我们检查了Degs编码的表达gydF4y2BafgydF4y2Ba(脂肪酸desaturase),gydF4y2BaSAD6.gydF4y2Ba(硬脂酰-(酰基载体蛋白质)9-desaturase 6),gydF4y2Ba机场核心计划gydF4y2Ba(酰基载体蛋白1),gydF4y2BaACCAgydF4y2Ba(乙酰辅酶A羧化酶羧转移酶亚基),gydF4y2Ba虫胶gydF4y2Ba(长链酰基辅酶a合成酶)gydF4y2BaACAT1.gydF4y2Ba(乙酰辅酶乙酰乙酰转移酶,胞嘧棒1),gydF4y2BaDGD1gydF4y2Ba(二甲酰基二酰基甘油合酶1),gydF4y2BaGPATgydF4y2Ba(甘油-3-磷酸酰基转移酶),gydF4y2BaAGPAT.gydF4y2Ba(1-酰基-Sn-甘油-3-磷酸酰基转移酶1),gydF4y2BaAHG1gydF4y2Ba(可能蛋白磷酸酶2C 75)和gydF4y2BaUBC.gydF4y2Ba(泛素结合酶)。根据它们在种子发育过程中的表达模式,这些基因可分为三组。第一组deg包括gydF4y2BafgydF4y2Ba,gydF4y2BaSAD6.gydF4y2Ba,gydF4y2BaACCAgydF4y2Ba和gydF4y2Ba机场核心计划gydF4y2Ba,在种子发育的中期达到顶峰gydF4y2Bap . pedunculatagydF4y2Ba(图。gydF4y2Ba3.gydF4y2Bab,c)。有趣的是,我们发现编码Omega-6的基因在39DAF达到峰值,并且ω-3 FAD基因在59DAF(图3的左图)达到尖峰。gydF4y2Ba3.gydF4y2Bab).编码ω -6 FAD的高表达基因中排名前两位的分别是TR56947|c2_g3和TR56947|c2_g12 (Fig右图)。gydF4y2Ba3.gydF4y2Bab)。这gydF4y2BaSAD6.gydF4y2Ba显示可检测到31dAF和39daf(图。gydF4y2Ba3.gydF4y2Bac)和gydF4y2Ba机场核心计划gydF4y2Ba(TR40569|c0_g1)在31DAF达到峰值(图3)。gydF4y2Ba3.gydF4y2Bac)第二组包括gydF4y2BaGPATgydF4y2Ba,gydF4y2BaDGD1gydF4y2Ba,gydF4y2Ba虫胶gydF4y2Ba和gydF4y2BaUBC.gydF4y2Ba,在种子发育的早期和晚期均有高表达(图。gydF4y2Ba3.gydF4y2Bad).有趣的是,我们发现gydF4y2BaLACS2sgydF4y2Ba早期高表达,而其他gydF4y2Ba虫胶gydF4y2Ba(例如。,gydF4y2BaLACS6gydF4y2Ba,gydF4y2BaLACS7gydF4y2Ba和gydF4y2BaLACS8gydF4y2Ba)在种子发育后期过表达。就像gydF4y2Ba虫胶gydF4y2Ba的基因,gydF4y2BaUBC1 / UBC6.gydF4y2Ba和gydF4y2BaUBC28.gydF4y2Ba分别在早期和晚期过表达。gydF4y2Ba3.gydF4y2Bad).第三组包括gydF4y2BaAGPAT.gydF4y2Ba和gydF4y2BaACAT1.gydF4y2Ba在种子发育后期高度表达的基因(图。gydF4y2Ba3.gydF4y2Bae)。表达gydF4y2BaAGPAT.gydF4y2Ba和gydF4y2BaACAT1.gydF4y2Ba开始分别在45ddaf和73daf增加。gydF4y2Ba
脂质生物合成gydF4y2Ba
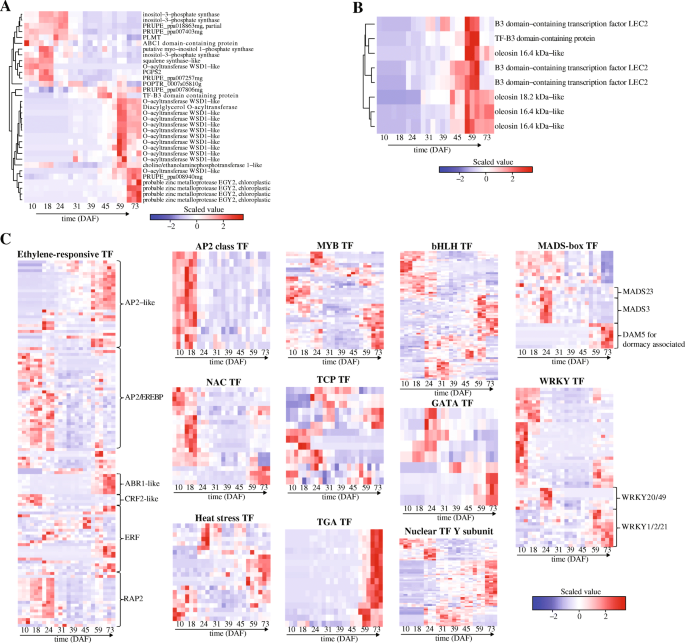
在参与脂质生物合成的55个基因中,在种子发育过程中差异表达33个基因gydF4y2Bap . pedunculatagydF4y2Ba(附加文件gydF4y2Ba4gydF4y2Ba).有趣的是,它们在种子发展期间的表达模式类似于gydF4y2BaG3P.gydF4y2Ba,gydF4y2BaGPATgydF4y2Ba,gydF4y2Ba虫胶gydF4y2Ba和gydF4y2BaUBC.gydF4y2Ba(图。gydF4y2Ba4gydF4y2Ba一种)。我们发现了gydF4y2Ba里诺gydF4y2BaS(肌醇-3-磷酸合酶)高度表达在编码在45dFAF的达到含TF-B3结构域的蛋白质的早期和基因(图。gydF4y2Ba4gydF4y2Baa).而另外两组deg在种子发育后期高表达,如o -酰基转移酶WSD1-like基因,在59DAF达到峰值gydF4y2BaEGY2sgydF4y2Ba,其峰值为73DAF。gydF4y2Ba
油体生物合成gydF4y2Ba
种子油脂生物合成过程中有九个基因(GO:0010344)gydF4y2Bap . pedunculatagydF4y2Ba(桌子gydF4y2Ba2gydF4y2Ba)我们确定了在种子开发期间差异表达的其中8个(附加文件gydF4y2Ba5gydF4y2Ba).有趣的是,在45DAF后发现它们的表达增加并在59DAF达到尖峰(图。gydF4y2Ba4gydF4y2Bab).进一步,我们发现DEGs编码gydF4y2BaLEC2gydF4y2Ba含tf和TF-B3结构域的蛋白在59DAF高表达,编码油酸蛋白的DEGs在73DAF高表达。gydF4y2Ba
转录因子gydF4y2Ba
接下来,我们希望了解TF基因的表达变化及其与种子发育过程中的油含量的关系。如表所示gydF4y2Ba2gydF4y2Ba,共有2490个TFS注释gydF4y2Bap . pedunculatagydF4y2Ba645个在种子发育过程中有差异表达(附加文件)gydF4y2Ba1gydF4y2Ba).其中AP2-like/ER(乙烯响应)126例,AP2-like/ER(乙烯响应)12例gydF4y2BaAP2.gydF4y2Ba,8gydF4y2Ba盖塔gydF4y2Ba,26gydF4y2BaMADS-boxgydF4y2Ba,42gydF4y2BaMYBgydF4y2Ba20.gydF4y2BangydF4y2Ba,13gydF4y2BaTCPgydF4y2Ba,15gydF4y2Ba矫正性大动脉转位gydF4y2Ba,50gydF4y2Ba怀疑gydF4y2Ba78.gydF4y2BabHLHgydF4y2Ba,确定了21个热应激和59个核y子单元tfs(附加文件gydF4y2Ba1gydF4y2Ba).值得注意的是,最重要的是gydF4y2BaAP2S.gydF4y2BaTGA转录因子在种子发育的早期高度表达,而TGA转录因子在种子发育的后期高度表达。gydF4y2Ba4gydF4y2Bac)。我们还发现,ER TF亚型可以在种子发育的不同阶段起作用(图。gydF4y2Ba4gydF4y2Bac).如AP2/EREBP、CRF2-like、RAP2、ER等可能在初始阶段起作用;AP2-like、ABR1-like、ER在种子发育后期发挥作用。就像gydF4y2Ba呃gydF4y2Ba,gydF4y2BangydF4y2Ba,gydF4y2Ba怀疑gydF4y2Ba在早期和晚期阶段过表达(图。gydF4y2Ba4gydF4y2Bac).此外,还发现一些TF亚型在种子发育的整个过程中发挥作用,如gydF4y2BaMYBgydF4y2Ba,gydF4y2BaTCPgydF4y2Ba,gydF4y2Ba盖塔gydF4y2Ba,gydF4y2BabHLHgydF4y2Ba,热应力,核TF y亚基和疯子箱(图。gydF4y2Ba4gydF4y2Bac)。值得注意的是gydF4y2BaMADS-boxgydF4y2Ba- - - - - -gydF4y2BaMADS23gydF4y2Ba和gydF4y2BaMADS3gydF4y2Ba在24daf达到尖顶gydF4y2Ba达5.gydF4y2Ba相关的休眠gydF4y2BaMADS-boxgydF4y2Ba在59DAF和73DAF处达到峰值。gydF4y2Ba4gydF4y2Bac)。gydF4y2BaWRKY20gydF4y2Ba和gydF4y2BaWRKY49gydF4y2Ba在24DAF上有过表达,而编码gydF4y2BaWRKY1gydF4y2Ba,gydF4y2BaWRKY2gydF4y2Ba和gydF4y2BaWRKY21gydF4y2Ba在种子发育后期高度表达(图。gydF4y2Ba4gydF4y2Bac)。gydF4y2Ba
加权基因共表达网络分析gydF4y2Ba
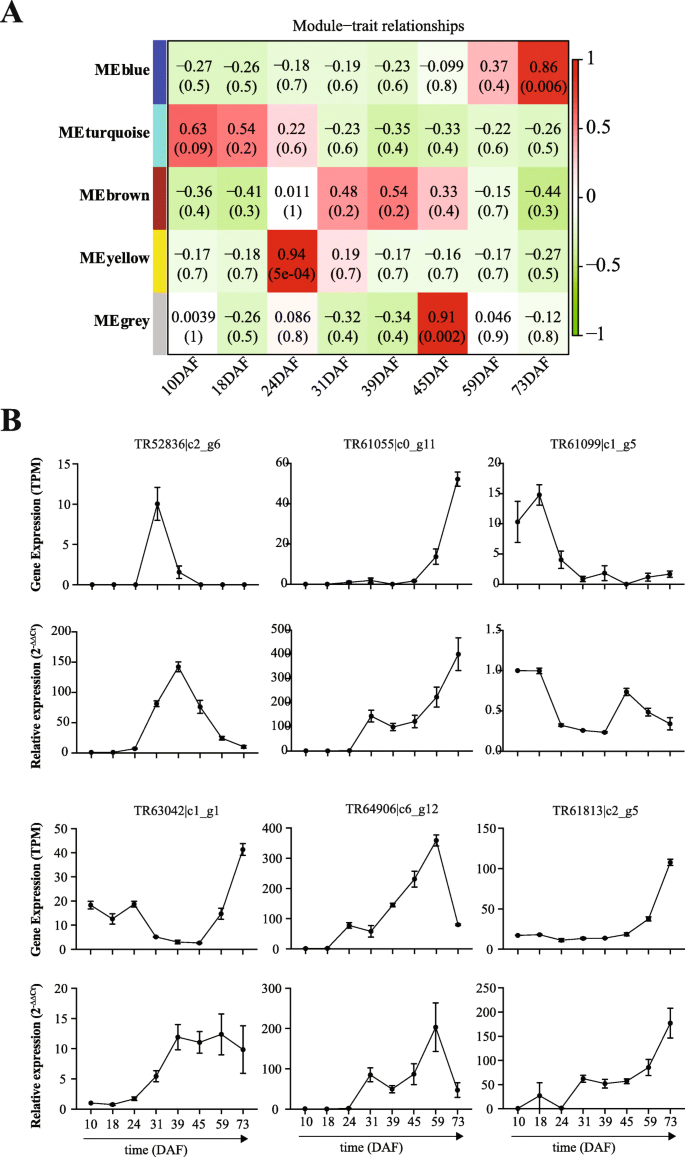
进一步研究DEGS与种子中的油含量之间的关联gydF4y2Bap . pedunculatagydF4y2Ba,我们进行加权基因共表达网络分析(WGCNA)。结果,我们鉴定了来自蓝色,棕色,灰色,绿松石和黄色模块的450,133,6,743和103基因(图。gydF4y2Ba5gydF4y2Ba一个额外的文件gydF4y2Ba6gydF4y2Ba).值得注意的是,蓝色模块基因与种子发育后期和种子含油量有关gydF4y2Bap . pedunculatagydF4y2Ba.在蓝色模块基因中,有420个与油共表达,如gydF4y2BaACOX1gydF4y2Ba(酰coa氧化酶1),gydF4y2BaACOX4gydF4y2Ba,gydF4y2BaLACS6gydF4y2Ba、油酸苷、o -酰基转移酶wsd1样和各种转录因子(如ap2样ER、TGA)。有趣的是,其他脂肪酸类型,包括棕榈酸、棕榈油酸、硬脂酸、油酸、亚油酸和亚麻酸,被发现与绿松石模块基因相关(附加文件gydF4y2Ba6gydF4y2Ba),在种子发育的早期阶段是显着的。另外,我们发现了gydF4y2BaOmega-3 FADgydF4y2Ba基因在73DAF与油共表达gydF4y2BaSAD6.gydF4y2Ba基因与该基因显着相关gydF4y2Baω- 6时尚gydF4y2Ba中型种子发展阶段的基因gydF4y2Bap . pedunculatagydF4y2Ba.gydF4y2Ba
脂肪酸生物合成途径gydF4y2Bap . pedunculatagydF4y2Ba种子gydF4y2Ba
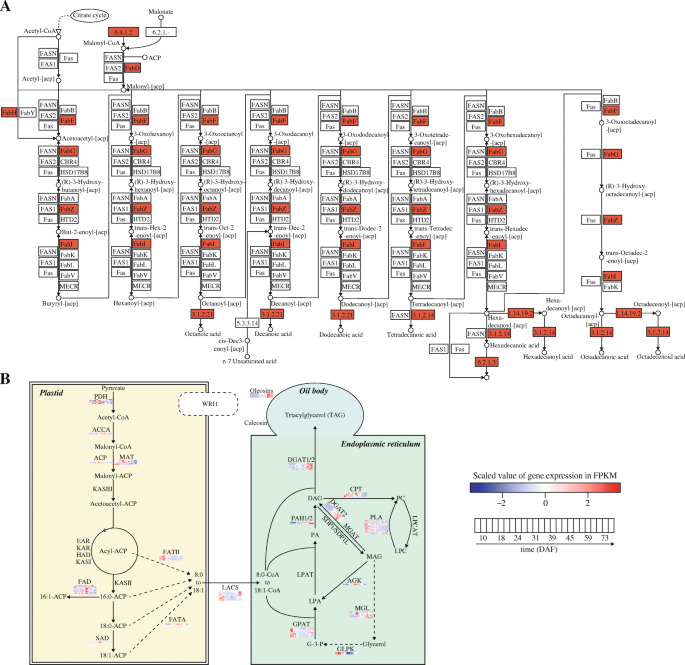
提出涉及脂肪酸生物合成中的适当途径在显影种子中gydF4y2Bap . pedunculatagydF4y2Ba,我们首先突出了基于Kegg途径注释的一般脂肪酸生物合成途径中的egs(图。gydF4y2Ba6gydF4y2Baa).本研究发现了脂肪酸生物合成的一些关键基因,包括6.4.1.2 (acetyl-CoA carboxyylase,gydF4y2BaACACAgydF4y2Ba),3.1.2.14(脂肪酰基-ACP硫酸酶B,gydF4y2BaFATBgydF4y2Ba),3.1.2.21(中链酰基 - 乙酰丙烯蛋白]水解酶,gydF4y2BaMCH.gydF4y2Ba), 1.14.19.2(酰基-[酰基载体蛋白]去饱和酶,gydF4y2BaFab2.gydF4y2Ba),6.2.1.3(长链酰基-CoA合成酶,gydF4y2BaACSL.gydF4y2Ba),gydF4y2BaFabd.gydF4y2Ba,gydF4y2BaFabf.gydF4y2Ba,gydF4y2BaFabh.gydF4y2Ba,gydF4y2Ba薄巴gydF4y2Ba,gydF4y2Ba法格gydF4y2Ba和gydF4y2BaFabZgydF4y2Ba.它们的产物要么是底物、中间产物,要么是重要的酶。接下来,我们提出了在质体和内质网中脂肪酸合成的工作模型(图。gydF4y2Ba6gydF4y2Bab).除了以上所述的基因外,我们还发现了与脂肪酸生物合成相关的额外重要基因。例如,gydF4y2BaPDH.gydF4y2Ba(丙酮酸脱氢酶复合物),参与丙酮酸向乙酰辅酶a的整体转化,在24DAF和31DAF的种子中被发现高表达(附加文件gydF4y2Ba1gydF4y2Ba).来自这个模型的其他一些基因也被发现在发育中的种子中有差异表达gydF4y2Bap . pedunculatagydF4y2Ba,如gydF4y2Ba垫gydF4y2Ba(丙二酰辅酶a -酰基载体蛋白转酰酶),gydF4y2BaFATBgydF4y2Ba,gydF4y2BaDGATgydF4y2Ba,gydF4y2Ba多环芳烃gydF4y2Ba(磷脂酸phosphohydrolase),gydF4y2BaCPT.gydF4y2Ba(甘油二酯cholinephosphotransferase),gydF4y2BaplgydF4y2Ba(磷脂酶),gydF4y2BaAGK.gydF4y2Ba(酰基甘油激酶)和gydF4y2BaGLPK.gydF4y2Ba(甘油激酶)。然而,有些基因喜欢gydF4y2BakasigydF4y2Ba(酮酰基-ACP合成酶I),gydF4y2BaKASIIgydF4y2Ba(ketoacyl-ACP合酶II),gydF4y2BaKASIIIgydF4y2Ba(酮酰基-ACP合成酶III),gydF4y2BaWRIgydF4y2Ba,gydF4y2BaLPCATgydF4y2Ba(lysophosphatidylcholine酰基转移酶),gydF4y2BaSDPgydF4y2Ba(sugar-dependent蛋白质)和gydF4y2BaLPATgydF4y2Ba(酰基CoA:酰基甘油-3-磷酸酰基转移酶)未在显影种子中检测到gydF4y2Bap . pedunculatagydF4y2Ba.他们缺席的原因需要探索进一步的实验。gydF4y2Ba
提出脂肪酸生物合成途径gydF4y2Bap . pedunculatagydF4y2Ba种子。gydF4y2Ba一个gydF4y2Ba基于KEGG通路注释的脂肪酸生物合成通路概述。红色的块表示在种子发育过程中差异表达的基因gydF4y2Bap . pedunculatagydF4y2Ba.gydF4y2BabgydF4y2Ba脂肪酸和TAG生物合成相关基因的工作模型gydF4y2Bap . pedunculatagydF4y2Ba.热图代表了种子发育过程中基因的表达水平(比例值)gydF4y2Bap . pedunculatagydF4y2Ba.2-Diacylglycerol DAG: 1;PA:磷脂酸;摘要:lysophosphatidic酸;G-3-P: glycerol-3-phosphate;PC:磷脂酰胆碱;LPC:溶血磷脂酰胆碱、甘油;玛格:monoacylglycerol;丙酮酸脱氢酶复合物;ACCA:乙酰辅酶A羧化酶羧转移酶亚基α; ACP: acyl carrier protein; MAT: malonyl-CoA-acyl carrier protein transacylase; KAS: ketoacyl-ACP synthase; EAR: enoyl-ACP reductase; KAR: ketoacyl-ACP reductase; HAD: hydroxyacyl-ACP dehydrase; FAD: fatty acid desaturase; SAD: 18:0-ACP desaturase; FATB: acyl-ACP thioesterase B; FATA: acyl-ACP thioesterase A; DGAT: diacylglycerol acyltransferase; PAH: phosphatidic acid phosphohydrolase; LPAT: acyl-CoA:acylglycerol-3-phosphate acyltransferase; GPAT: glycerol-3-phosphate acyltransferase; CPT: diacylglycerol cholinephosphotransferase; MGAT: monoacylglycerol acyltransferase; SDP: suger-dependent protein; AGK: acylglycerol kinase; MGL: acylglycerol lipase; GLPK: glycerol kinase; PLA: phospholipase; LPCAT: lysophosphatidylcholine acyltransferase
中存在gydF4y2Ba
然后,我们进行定量实时PCR以验证种子发展过程中的基因表达变化gydF4y2Bap . pedunculatagydF4y2Ba.随机选取6个基因(TR52836|c2_g6、TR61055|c0_g11、TR61099|c1_g5、TR61813|c2_g5、TR63042|c1_g1、TR64906|c6_g12),以18S rRNA作为内参。引物可以在附加文件中访问gydF4y2Ba7gydF4y2Ba在种子发育的每个时间点对每个基因进行九次反应。相对归一化表达(RNE)用于显示样品中所有基因的表达(相对于10DAF)。结果,我们发现所有六种基因的表达模式由RNA-SEQ和QRT-PCR达成一致(图。gydF4y2Ba5gydF4y2Bab)。值得注意的是,TR61055 | CO_G11(转录因子TGA2),TR63042 | C1_G1(MYB转录因子3)和TR61813 | C2_G5(长链酰基-COA合成酶6,gydF4y2BaLACS6gydF4y2Ba通过QRT-PCR在晚籽发育阶段和TR61099 | C1_G5的高表达(脂肪酰基-ACP硫酸酶B,gydF4y2BaFATBgydF4y2Ba)在种子发育早期得到验证(图。gydF4y2Ba5gydF4y2Bab)。根据测序和QRT-PCR结果,我们发现在59DAF达到峰值的Tr64906 | C6_G12(B3结构域的转录因子LEC2)。TR52836 | C2_G6(硬脂酰基 - 乙酰丙烯蛋白] 9-去饱和酶6,gydF4y2BaSAD6.gydF4y2Ba)在31DAF高表达,qRT-PCR在39DAF高表达(图。gydF4y2Ba5gydF4y2Bab)和两个时间点定义为中种开发阶段。通过转录组测序和QRT-PCR的基因表达模式的高吻合揭示了本研究中鉴定的基因可能在开发和油含量中具有功能性gydF4y2Bap . pedunculatagydF4y2Ba种子。gydF4y2Ba
讨论gydF4y2Ba
种子油含量是一种新的重要特征gydF4y2Bap . pedunculatagydF4y2Ba然而,关于涉及石油合成的油积累和基因的分子基础知之甚少gydF4y2Bap . pedunculatagydF4y2Ba种子,可能是由于其基因组序列的缺失。在这里,我们组装了转录组gydF4y2Bap . pedunculatagydF4y2Ba研究了种子8个发育点的动态基因图谱。摘要研究了不同脂肪酸类型(油酸、棕榈酸、棕榈烯酸、硬脂酸、油酸、亚油酸和亚麻酸)在种子发育过程中的含量gydF4y2Bap . pedunculatagydF4y2Ba(图。gydF4y2Ba1gydF4y2Ba一种)。三种主要脂肪酸类型是成熟种子的油,油酸和亚油酸gydF4y2Bap . pedunculatagydF4y2Ba.有趣的是,油酸被显示为最高类型gydF4y2Bap . pedunculatagydF4y2Ba籽,比例类似于茶花和橄榄油[gydF4y2Ba22.gydF4y2Ba,gydF4y2Ba23.gydF4y2Ba].种子发育过程中棕榈酸,棕榈酸,硬脂酸和亚麻酸的降低可能与高表达有联系gydF4y2BaLACS2gydF4y2Ba在早期的发展阶段gydF4y2Bap . pedunculatagydF4y2Ba种子(图。gydF4y2Ba1gydF4y2Ba无花果。gydF4y2Ba3.gydF4y2Bad)。gydF4y2Ba拟南芥gydF4y2BaLACS2酶更倾向于使用棕榈酸和棕榈烯酸作为底物形成角质或角质层蜡[gydF4y2Ba24.gydF4y2Ba].gydF4y2Ba
根据基因表达谱,种子发展gydF4y2Bap . pedunculatagydF4y2Ba可以分为三个阶段(图。gydF4y2Ba2gydF4y2Bab,c)。我们观察了编码的基因gydF4y2BaGPATgydF4y2Ba,gydF4y2BaDGD1gydF4y2Ba,gydF4y2BaLACS2gydF4y2Ba,gydF4y2BaUBC.gydF4y2Ba,gydF4y2Ba里诺gydF4y2Ba和多个TFS(例如,gydF4y2BaAP2 / EREBP呃gydF4y2Ba,gydF4y2BaCRF2样gydF4y2Ba,gydF4y2BaRAP2gydF4y2Ba,gydF4y2BaAP2.gydF4y2Ba,gydF4y2BangydF4y2Ba,gydF4y2BaMYBgydF4y2Ba,gydF4y2BaMADS-boxgydF4y2Ba,gydF4y2Ba怀疑gydF4y2Ba)在种子发育早期(10 ~ 24DAF)高表达(图。gydF4y2Ba3.gydF4y2BaD,图。gydF4y2Ba4gydF4y2Baa,c)。GPAT表现出SN-1酰基转移酶活性,具有高特异性的酰基-COA,具有触发储存脂质的生物合成的潜力,并在肯尼迪途径中发挥枢轴作用,从G-3-P和酰基的标签的DE Novo组装COA和甘油脂生物合成[gydF4y2Ba25.gydF4y2Ba].通过GPAT和LPAT酰化G-3-P,得到磷脂酸,然后通过DGAT(二酰基甘油酰基转移酶)(二酰基甘油酰基转移酶)来水解磷脂酸以形成二酰基甘油。gydF4y2Ba17.gydF4y2Ba].UBC酶是油籽植物幼苗早期发育过程中脂肪酸β氧化所必需的[gydF4y2Ba26.gydF4y2Ba].这些基因在早期发育阶段的高表达可能导致脂肪酸生物合成在随后的过程中的积累有助于。gydF4y2Ba
在种子发育中期(31〜45ddaf)中,我们确定了gydF4y2Baω6-FAD.gydF4y2Ba,gydF4y2Ba悲伤的gydF4y2Ba,gydF4y2Ba机场核心计划gydF4y2Ba,gydF4y2BaACCAgydF4y2Ba,gydF4y2BaAHG1gydF4y2Ba一些TF(如TCP、热应激、bHLH、核TF Y亚基)基因高表达(图。gydF4y2Ba3.gydF4y2Ba,无花果。gydF4y2Ba4gydF4y2Ba).ACCA是第一个参与质体中脂肪酸合成途径的酶,调节碳向脂肪酸的通量[gydF4y2Ba4gydF4y2Ba].虽然脂肪酸的组装通常在ACP上发生在每次伸长2个碳氮链的4个反应的循环中[gydF4y2Ba6gydF4y2Ba].这gydF4y2BafgydF4y2Ba一些油料植物的种子发育和脂肪酸生物合成相关的基因已经被描述,包括gydF4y2Ba花椒gydF4y2Ba[gydF4y2Ba11.gydF4y2Ba],gydF4y2BaCamelina SativagydF4y2Ba[gydF4y2Ba12.gydF4y2Ba],gydF4y2BaLinum Usitatissimum.gydF4y2Ba[gydF4y2Ba27.gydF4y2Ba],gydF4y2Ba杜仲gydF4y2Ba[gydF4y2Ba13.gydF4y2Ba],gydF4y2Ba甘氨酸最大gydF4y2Ba[gydF4y2Ba14.gydF4y2Ba),gydF4y2Ba芍药属部分gydF4y2Ba[gydF4y2Ba16.gydF4y2Ba].gydF4y2BaFAD2.gydF4y2Ba和gydF4y2BaFAD3.gydF4y2Ba在ER(内质网)中催化从PC-18:1至PC-18:2附着于Phosphatidylcholine(PC)的脂肪酸的去饱和度(gydF4y2BaFAD2.gydF4y2Ba)从PC-18:2到PC-18:3(gydF4y2BaFAD3.gydF4y2Ba)[gydF4y2Ba28.gydF4y2Ba,gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].gydF4y2BaFAD6.gydF4y2Ba具有16:3和18:3的生物合成中的第二双键的可能性,这是植物膜的重要组成部分,以及通过Ferredoxin酯化至半乳糖,亚砜和磷脂酰甘油酯化的脂肪酸的作用[gydF4y2Ba31.gydF4y2Ba].据报道,硬脂酸转化为油酸(最高含量)gydF4y2Bap . pedunculatagydF4y2Ba种子)gydF4y2Ba悲伤的gydF4y2Ba,这是种子中脂肪酸比例的调节因子之一[gydF4y2Ba4gydF4y2Ba].而AHG是种子萌发过程中脱落酸反应的负调控因子[gydF4y2Ba32.gydF4y2Ba].关键调控基因在种子发育中期的高表达可能预示着种子的贮藏和脂肪酸含量的测定。gydF4y2Ba
接下来,我们将讨论在种子发育后期(59 ~ 73DAF)发现的高表达基因,如gydF4y2BaLACS6gydF4y2Ba,gydF4y2BaDGD1gydF4y2Ba,gydF4y2BaACAT1.gydF4y2Ba,gydF4y2BaAGPAT.gydF4y2Ba,gydF4y2BaWSD1gydF4y2Ba,gydF4y2BaEGY2gydF4y2Ba和油蛋白(图。gydF4y2Ba3.gydF4y2Ba,无花果。gydF4y2Ba4gydF4y2Ba).使用腭,棕榈酸盐,油脂和LiNoLeate作为底物,LACS6具有激活长链脂肪酸,用于合成细胞脂质和通过β-氧化的降解[gydF4y2Ba33.gydF4y2Ba,gydF4y2Ba34.gydF4y2Ba].DGD1特异于α-糖苷键,并参与合成二酰基甘油的半乳糖脂,其特异性局部局部化在囊体膜中[gydF4y2Ba35.gydF4y2Ba,gydF4y2Ba36.gydF4y2Ba].过度表达gydF4y2BaACAT1.gydF4y2Ba,COA生物合成酶已被证明导致拟南芥中的油含量增加[gydF4y2Ba37.gydF4y2Ba].AGPAT是原核甘油-3-磷酸途径的塑性酶,其通过在SN-2的位置掺入酰基部分将溶血磷脂酸转化为磷脂酸。gydF4y2Ba38.gydF4y2Ba].据报道,O-酰基转移酶WSD1,主要的蜡酯合酶合成酶参与植物中的耐旱性[gydF4y2Ba39.gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].在亚麻荠种子中gydF4y2BaWSD1gydF4y2Ba在种子发育早期上调,与种子含油量相关[gydF4y2Ba12.gydF4y2Ba].Oleosin是参与油体生物发生和TAG/胞质油体界面稳定的主要蛋白[gydF4y2Ba41.gydF4y2Ba].在植物中的种子发育期间已经显示出oleosin基因的表达被上调,例如gydF4y2BaCamelina SativagydF4y2Ba[gydF4y2Ba12.gydF4y2Ba)大豆(gydF4y2Ba14.gydF4y2Ba],gydF4y2Ba芍药属部分gydF4y2Ba[gydF4y2Ba15.gydF4y2Ba),gydF4y2Ba白苏子gydF4y2Ba[gydF4y2Ba17.gydF4y2Ba].总的来说,这些基因已被证明参与脂肪酸生物合成,然而它们在油积累中的功能gydF4y2Bap . pedunculatagydF4y2Ba种子仍然不清楚。与这些研究一起,这些基因的高表达支持它们在种子发育和脂肪酸生物合成期间发挥关键作用gydF4y2Bap . pedunculatagydF4y2Ba一世。gydF4y2Ba
脂肪酸的生物合成是一个涉及多种酶和分子的复杂过程。它是植物质体中产生膜和脂质的基础[gydF4y2Ba13.gydF4y2Ba].提出了一种适合于脂肪酸生物合成相关基因的工作模式gydF4y2Bap . pedunculatagydF4y2Ba(图。gydF4y2Ba6gydF4y2Bab)。来自该方法的一些关键基因被鉴别在显影种子中鉴定出差异表达gydF4y2Bap . pedunculatagydF4y2Ba.然而,我们错过了一些已知的重要调节因素,据报道参与脂肪酸生物合成,例如gydF4y2BakasigydF4y2Ba ~ 3gydF4y2Ba[gydF4y2Ba13.gydF4y2Ba],gydF4y2BaWRI1.gydF4y2Ba[gydF4y2Ba9gydF4y2Ba),gydF4y2BaLPATgydF4y2Ba[gydF4y2Ba17.gydF4y2Ba].他们的缺席可能有一些解释,包括1)De Novo装配方法或注释方法错过了这些基因;2)转录组测序未检测到它们;3)他们没有在种子中表达gydF4y2Bap . pedunculatagydF4y2Ba.未来的研究需要进行以完成脂肪酸生物合成的工作模型gydF4y2Bap . pedunculatagydF4y2Ba.此外,我们鉴定了一些可能参与脂肪酸生物合成的TFSgydF4y2Bap . pedunculatagydF4y2Ba,但油气成藏过程中的调控机制尚不清楚。今后还需进一步研究其在脂肪酸生物合成中的作用gydF4y2Bap . pedunculatagydF4y2Ba.gydF4y2Ba
结论gydF4y2Ba
总之,我们组装了第一个转录组,用于显影种子(八个时间点)gydF4y2Bap . pedunculatagydF4y2Ba.总共报告了326,271个unigenes的402,741种成绩单,GC比率为40.55%。转录组的注释分别显示了109,850和121,897个unigenes,分别与Go和Kegg路径数据库对齐。我们还预测了23,229种可能由此产生的蛋白质gydF4y2Bap . pedunculatagydF4y2Ba种子转录组,其中与脂肪酸生物合成,脂质生物合成,油体和TFS相关的1246,51,9和2.490。我们在培养的种子中表达了91,362个基因,表达了5岁以上的FPKMgydF4y2Bap . pedunculatagydF4y2Ba并确定了48,788次。与10DAF相比,在种子开发期间,从18dAF中的4406次,在73DAF中的4406中显示了DEG的数量。我们发现,分别与脂肪酸生物合成,脂质生物合成,油体和TFS相关的753,33,8和645摄氏度。gydF4y2BaGPATgydF4y2Ba,gydF4y2BaDGD1gydF4y2Ba,gydF4y2BaLACS2gydF4y2Ba,gydF4y2BaUBC.gydF4y2Ba和gydF4y2Ba里诺gydF4y2Ba在种子发育早期高表达(10 ~ 24DAF),gydF4y2Baω6-FAD.gydF4y2Ba,gydF4y2Ba悲伤的gydF4y2Ba,gydF4y2Ba机场核心计划gydF4y2Ba,gydF4y2BaACCAgydF4y2Ba和gydF4y2BaAHG1gydF4y2Ba在中型种子开发(31〜45ddaf)时高度表达gydF4y2BaLACS6gydF4y2Ba,gydF4y2BaDGD1gydF4y2Ba,gydF4y2BaACAT1.gydF4y2Ba,gydF4y2BaAGPAT.gydF4y2Ba,gydF4y2BaWSD1gydF4y2Ba,gydF4y2BaEGY2gydF4y2Ba在种子发育后期,油酸基因大量存在。qRT-PCR证实了基因表达的变化。这是第一次研究转录组gydF4y2Bap . pedunculatagydF4y2Ba开发种子和我们的发现将为未来的研究提供有价值的资源。更重要的是,它将提高我们对石油积累的认识gydF4y2Bap . pedunculatagydF4y2Ba.gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
我们选择了三个六岁的植物gydF4y2Baprunus pedinculata.gydF4y2Ba在内蒙古育种中心的试验田中种植了褐藻。原始种子来源于中国包头市野生(110.066562,41.039184),保存在内蒙古种子博物馆,编号为“蒙边1号”。利用开花后天数(DAF)标记种子发育情况。从2019年4月10日起,我们采摘了gydF4y2Baprunus pedinculata.gydF4y2Ba在10,18,24,31,39,45,59和73 DAF中,具有三个生物重复(gydF4y2BangydF4y2Ba= 3)。在每个发育阶段,我们在每个时间点共收集约100颗种子,剥去果皮和果核。核仁在液氮中快速冷冻,在−80°C下保存,待进一步使用。由于0 DAF的胚珠难以采集,我们以10 DAF的种子作为对照。gydF4y2Ba
含油量的定量gydF4y2Ba
油含量gydF4y2Bap . pedunculatagydF4y2Ba根据制造商的协议,使用气相色谱仪(GC, Agilent 6890 N)对种子进行测定,如所述[gydF4y2Ba14.gydF4y2Ba].CP-SIL 88(Agilent技术)和氮气分别用作GC柱和载气。将初始温度设定为180℃并以6℃/ min的速率升至200℃。3分钟后,然后在10℃/ min的速率下将温度升至240。将样品用磨床在低温下研磨,然后在真空冷冻干燥器中干燥。然后,将粉末样品(100mg)在1%庚二烷酸(用内标)中稀释2mL离心管中。在每个管中加入1mL甲基化剂(2.5%,v / v,在CH 3 OH中的H 2 SO 4)后,将样品在85℃下沐浴甲基酯化1小时。我们收集了提取物,将其离心并保留上清液,然后在后面加入600μLNaCl(0.9%,W / V)和350μl正己烷。然后,将混合物以4000rpm离心10分钟,有机相气干燥。将500μl乙酸乙酯加入到干燥的甲基酯化样品中后,对它们进行GC进行油状分析。 Compared to the standard, the fatty acids were examined qualitatively and quantitatively by the peak area method. The absolute content of fatty acids was determined by the methyl ester standard. This experiment was replicated three times and average values were calculated for each oil type.
总RNA提取、文库构建及测序gydF4y2Ba
使用Trizol试剂(Invitrogen)从核仁中提取总RNA,如前所述[gydF4y2Ba42.gydF4y2Ba].用Agilent 2100 Bioanalyzer检测总RNA的质量和数量后,用等量的总RNA (1 μg)在深圳大基因文库建设。简而言之,多聚(A) mrna被磁性寡聚(dT)珠富集和拉低,并破碎成小块(~ 200bp)。然后,利用随机六聚体(N6)引物构建双链cDNA文库。5 '端磷酸、3 '端粘“A”进行末端修复后,用测序引物连接cDNA文库,构建最终RNA-Seq文库。接下来,在bgiiseq -500 RS平台上使用对端150策略对最终的库进行测序。gydF4y2Ba
De Novo组装gydF4y2Ba
我们使用Trim_galore删除低质量的读取、使用适配器的读取和原始读取中的污染读取。FASTQC (gydF4y2Bahttp://www.bioinformatics.babraham.ac.uk/projects/fastqc/gydF4y2Ba)用于评价清洁读数的质量控制。然后,如前所述,对每个时间点的干净读取进行TRINITY软件重新组装[gydF4y2Ba43.gydF4y2Ba].CD-HIT被用来评估转录本群集[gydF4y2Ba18.gydF4y2Ba].然后,我们使用Trinity提供的程序选择最长的转录本(用作unigene),并使用TransDecoder提取可能的蛋白质。为了评估组装的unigenes的完整性,我们使用BUSCO将unigenes映射到三个数据集,包括古菌、细菌和真核生物[gydF4y2Ba19.gydF4y2Ba].gydF4y2Ba
转录注释gydF4y2Ba
根据协议,我们首先使用Trinotate注释组装的转录组[gydF4y2Ba44.gydF4y2Ba].简而言之,使用E值<1E-3分别使用Blastx和Blastp分别对unigenes和可能的突出菌对准UniProt / Sprot对齐。rnammer(v1.2)[gydF4y2Ba45.gydF4y2Ba],hmmer [gydF4y2Ba46.gydF4y2Ba],signalp(v4.1)[gydF4y2Ba47.gydF4y2Ba]和TMHMM服务器(v.2.0)[gydF4y2Ba48.gydF4y2Ba]用于预测组装的单基因和可能蛋白的rRNA转录本、蛋白质结构域、信号肽和跨膜区域。然后,所有的注释都要经过Trinotate来生成一个报告。gydF4y2Ba
接下来,我们将组装的unigenes与基因和基因组(Kegg)数据库的NCBI非冗余(NR),UniProt和Kyoto百科全书对齐以获得基因本体(GO)和途径注释,如前所述[gydF4y2Ba43.gydF4y2Ba].选择匹配的unigenes(E值<1E-5)后,BLAST2GO用于检索描述生物过程(BP),细胞组分(CC)和分子功能(MF)的相关的去项目。获得酶委员会号码(EC)的未成熟,并在Kegg代谢途径数据库中搜索。组装转录组的Kegg路径注释(释放90.0)在BGI-Shizhen进行[gydF4y2Ba49.gydF4y2Ba].gydF4y2Ba
基因表达谱及差异表达分析gydF4y2Ba
我们使用Bowtie2 [gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba50.gydF4y2Ba]和RSEM(RNA-SEQ通过期望最大化)[gydF4y2Ba21.gydF4y2Ba],以将干净的reads与组装的unigenes进行比对,并分别分析每个样本的基因表达谱。采用FPKM(片段/百万reads /千碱基图谱)法进行归一化,计算每个时间点每个基因的平均FPKM。筛选低表达基因(平均FPKM < 5)后,我们使用edgeR进行差异表达分析,截断如下:log2倍变化(log2FC) > 1或<−1,变异系数(CV) < 0.7,gydF4y2Bap值gydF4y2Ba < 0.5 and false discovery rate (FDR) < 0.1 [50.gydF4y2Ba].gydF4y2Ba
功能分析gydF4y2Ba
我们利用GO和KEGG通路注释结果对差异表达基因进行功能分析。为了确定明显富集的氧化石墨烯条件和途径,我们首先计算gydF4y2Bap值gydF4y2Ba利用Fisher’s Exact Test表示富集显著性,并利用R平台中的qvalue包计算修正后的p值(如q值所示)。显著富集的GO词条和KEGG通路如下:gydF4y2Ba核反应能量gydF4y2Ba < 0.05 and non-plant associated terms/pathways were filtered.
中存在gydF4y2Ba
我们进行定量实时PCR(QRT-PCR)以验证种子发展过程中的基因表达变化gydF4y2Baprunus pedinculata.gydF4y2Ba.我们随机选择了六个基因(TR52836 | C2_G6,TR61055 | C0_G11,TR61099 | C1_G5,TR61813 | C2_G5,TR63042 | C1_G1,TR64906 | C6_G12)并使用18S rRNA作为内部控制。使用信标设计器7.9预测候选基因和控制前向前引物。在所有八个时间点(如上所述)中从种子中提取总RNA之后,使用TrueScript First-strand cDNA合成试剂盒使用总RNA的等分试卷(2mg)的总RNA(Aidlab生物科技,北京,中国)。然后,使用cDNA(1μl)与2×SYBR绿色超混合物(5μL,DBI,中国),正底漆(0.5μL),反向引物(0.5μL)一起构建QRT-PCR反应混合物(10μl)。(0.5μL)和ddh.gydF4y2Ba2gydF4y2BaO(3μl)。在协议之后,QPCR混合物在QTower 2.2 QRT-PCR热循环仪(Analytik Jena,德国)进行。然后,获得每个样品中的每个基因的CT值,并计算ΔCt。将10DAF样品用作对照,并使用相对规范化的表达计算存在其他样品中所有基因的表达水平:gydF4y2Barne.gydF4y2Ba= 2gydF4y2Ba-ΔΔctgydF4y2Ba.每个重复对每个基因进行3次反应,得到9个重复(gydF4y2BangydF4y2Ba= 9)每个基因在每个时间点。gydF4y2Ba
可用性数据和材料gydF4y2Ba
原始测序数据可以从NCBI序列读取归档(SRA)平台访问(gydF4y2Bahttp://trace.ncbi.nlm.nih.gov/Traces/sra/gydF4y2Ba)在“加入号”PRJNA684995下。gydF4y2Ba
缩写gydF4y2Ba
- DAF:gydF4y2Ba
-
几天后开花gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- TF:gydF4y2Ba
-
转录因子gydF4y2Ba
- FPKM:gydF4y2Ba
-
每千克映射每百万次映射的碎片gydF4y2Ba
- 标签:gydF4y2Ba
-
三酰基甘油gydF4y2Ba
- NR:gydF4y2Ba
-
NCBI非冗余数据库gydF4y2Ba
- DEG:gydF4y2Ba
-
差异表达基因gydF4y2Ba
参考文献gydF4y2Ba
- 1。gydF4y2Ba
李超,杨军,姚玲,秦飞,侯刚,陈斌,金玲,邓军,沈勇。长柄扁桃种子分离蛋白的特性、理化性质和功能特性。食品化学。2020;311:125888。gydF4y2Bahttps://doi.org/10.1016/j.foodchem.2019.125888.gydF4y2Ba.gydF4y2Ba
- 2。gydF4y2Ba
褚军,徐昕,张颖。长柄扁桃生物柴油的制备及性能研究。Bioresour抛光工艺。2013;134:374-6。gydF4y2Bahttps://doi.org/10.1016/j.biortech.2012.12.089gydF4y2Ba.gydF4y2Ba
- 3.gydF4y2Ba
陈高Y,李C, B,沈YH,汉族J,赵毫克。长柄扁桃籽油的抗高脂血症和抗氧化活性。食品功能。2016;7(12):5018 - 24。gydF4y2Bahttps://doi.org/10.1039/c6fo01283c.gydF4y2Ba.gydF4y2Ba
- 4.gydF4y2Ba
Bates Pd,Stymne S,Ohlrogge J.种子油合成中的生化途径。CurrOp植物BIOL。2013; 16(3):358-64。gydF4y2Bahttps://doi.org/10.1016/j.pbi.2013.02.015gydF4y2Ba.gydF4y2Ba
- 5。gydF4y2Ba
杜兰特,JB。植物中甘油三酯积累的区隔。中国生物化学杂志。2012;287(4):2288-94。gydF4y2Bahttps://doi.org/10.1074/jbc.r111.290072gydF4y2Ba.gydF4y2Ba
- 6。gydF4y2Ba
Li-Beisson Y,Shorrosh B,Beisson F,Andersson MX,Arondel V,Bates Pd,Bauds,Bird D,Debon A,Durrett TP等人。酰基脂质代谢。拟南芥书。2013; 11:E0161。gydF4y2Bahttps://doi.org/10.1199/tab.0161gydF4y2Ba.gydF4y2Ba
- 7。gydF4y2Ba
Tjellstrom h,yang z,艾伦dk,ohlrogge jb。拟南芥细胞悬浮培养的快速动力学标记:对血液脂质出口模型的影响。植物理性。2012; 158(2):601-11。gydF4y2Bahttps://doi.org/10.1104/pp.111.186122gydF4y2Ba.gydF4y2Ba
- 8。gydF4y2Ba
《高等植物脂肪代谢研究》。第十九。鳄梨-中果皮酶生物合成甘油三酯的研究。生物物理学报。1962;60(2):329-37。gydF4y2Bahttps://doi.org/10.1016/0006-3002(62)90408-0gydF4y2Ba.gydF4y2Ba
- 9。gydF4y2Ba
Cernac A,Phinning C. frinkled1编码参与拟南芥中储存复合生物合成的AP2 / eRERB结构域蛋白。工厂J. 2004; 40(4):575-85。gydF4y2Bahttps://doi.org/10.1111/j.1365-313X.2004.02235.xgydF4y2Ba.gydF4y2Ba
- 10。gydF4y2Ba
沉B,艾伦WB,Zheng P,Li C,Glassman K,Ranch J,Nubel D,Tarczynski MC。ZMLEC1和ZMWRI1的表达增加了玉米种子油生产。植物理性。2010; 153(3):980-7。gydF4y2Bahttps://doi.org/10.1104/pp.110.157537gydF4y2Ba.gydF4y2Ba
- 11.gydF4y2Ba
Fei X,Ma Y,Hu H,Wei A.转录组分析和Zanthoxylum种子脂肪酸合成中的关键基因的GC-MS分析。ind crop prod。2020; 156:112870。gydF4y2Bahttps://doi.org/10.1016/j.indcrop.2020.112870gydF4y2Ba.gydF4y2Ba
- 12.gydF4y2Ba
Abdullah HM,Akbari P,Paulose B,Schnell D,Qi W,Park Y,Pareek A,Dhkanker Op。Camelina Sativa的转录组分析鉴定涉及三酰基甘油生物合成和显影种子积累的基因。Biotechnol生物燃料。2016; 9(1):136。gydF4y2Bahttps://doi.org/10.1186/s13068-016-0555-5gydF4y2Ba.gydF4y2Ba
- 13。gydF4y2Ba
冯y,王l,fu j,wuyun t,du h,棕褐色x,zou f,李f.转录组测序发现杜仲种子中脂肪酸生物合成相关的基因。基因与基因组学2016; 38(3):275-83。gydF4y2Ba
- 14。gydF4y2Ba
杨松,苗丽,何静,张凯,李勇,盖建:大豆籽粒油脂积累的转录组动态变化。中国生物医学工程学报2019;gydF4y2Ba
- 15.gydF4y2Ba
李少森,王林林,舒秋艳,吴静,陈乐国,邵松,尹德东。牡丹(芍药组牡丹DC.)种子发育过程中脂肪酸组成及转录组分析。BMC基因组学。2015;16(1):208。gydF4y2Bahttps://doi.org/10.1186/s12864-015-1429-0gydF4y2Ba.gydF4y2Ba
- 16。gydF4y2Ba
王X,梁H,郭D,Guo L,Duan x,jia q,侯x。从树牡丹(p ostii)种子的转录组和蛋白质组学数据的综合分析显示出与油生物合成和脂肪相关的关键发育阶段和候选基因酸性代谢。Hortic Res。2019; 6(1):111。gydF4y2Bahttps://doi.org/10.1038/s41438-019-0194-7gydF4y2Ba.gydF4y2Ba
- 17。gydF4y2Ba
金虎,李克南,沈丹丹,李jh,陈国强,黄志强。3脂肪酸生物合成相关基因的转录组分析和鉴定gydF4y2Ba白苏子gydF4y2Ba(L.)var。Frutescens。BMC基因组学。2016; 17(1):474,转录组分析和紫苏Frutescens(L.)var中与ω-3脂肪酸生物合成相关的基因的鉴定。Frutescens。gydF4y2Bahttps://doi.org/10.1186/s12864-016-2805-0.gydF4y2Ba.gydF4y2Ba
- 18。gydF4y2Ba
李伟,高德泽。Cd-hit:一种用于聚类和比较大组蛋白质或核苷酸序列的快速程序。生物信息学。2006;22(13):1658 - 9。gydF4y2Bahttps://doi.org/10.1093/bioinformatics/btl158gydF4y2Ba.gydF4y2Ba
- 19。gydF4y2Ba
Seppey M,Manni M,Zdobnov Em。Busco:评估基因组组装和注释完整性。方法Mol Biol。1962年; 2019年:227-45。gydF4y2Ba
- 20。gydF4y2Ba
Langmead B, Salzberg SL.快速间隙读对齐与领结2。Nat方法。2012;9(4):357 - 9。gydF4y2Bahttps://doi.org/10.1038/nmeth.1923gydF4y2Ba.gydF4y2Ba
- 21。gydF4y2Ba
Li B,杜威CN。RSEM:具有或不具有参考基因组的RNA-SEQ数据的准确转录物定量。BMC生物信息学。2011; 12(1):323。gydF4y2Bahttps://doi.org/10.1186/1471-2105-12-323gydF4y2Ba.gydF4y2Ba
- 22。gydF4y2Ba
吴B,阮C,韩P,阮D,Xiong C,Ding J,Liu S.高油山茶叶醇的比较转录组分析揭示了高油酸积累的上游和下游多指的协调机制.gydF4y2Ba3生物技术gydF4y2Ba.2019; 9(7): 257。gydF4y2Ba
- 23。gydF4y2Ba
在果实发育过程中,油橄榄核果和种子的不饱和脂质变化及其对低温胁迫和驯化的响应。国际分子生物学杂志2016;17(11):1889。gydF4y2Ba
- 24。gydF4y2Ba
Schnurr J,Shockey J,浏览J.Racs2编码的酰基-CoA合成酶对于拟南芥的正常角质质开发至关重要。植物细胞。2004; 16(3):629-42。gydF4y2Bahttps://doi.org/10.1105/tpc.017608gydF4y2Ba.gydF4y2Ba
- 25。gydF4y2Ba
歌手SD, Chen G, Mietkiewska E, Tomasi P, Jayawardhane K, Dyer JM, Weselake RJ。拟南芥GPAT9参与细胞内甘油脂的合成,但不参与细胞表面脂质的合成。中国生物医学工程学报。2016;67(15):4627-38。gydF4y2Bahttps://doi.org/10.1093/jxb/erw242gydF4y2Ba.gydF4y2Ba
- 26.gydF4y2Ba
Theodoulou FL, Eastmond PJ。种子贮藏油分解代谢:一个给予与索取的故事。植物学报。2012;15(3):322-8。gydF4y2Bahttps://doi.org/10.1016/j.pbi.2012.03.017gydF4y2Ba.gydF4y2Ba
- 27.gydF4y2Ba
谢东,戴志强,杨志强,唐强,邓超,徐勇,王军,陈杰,赵东,张胜,张胜,苏军。基于全基因组关联分析和转录组测序的亚麻籽脂肪酸代谢候选基因的鉴定。植物科学。2019;286:98 - 107。gydF4y2Bahttps://doi.org/10.1016/j.plantsci.2019.06.004gydF4y2Ba.gydF4y2Ba
- 28.gydF4y2Ba
利用植物微粒体膜进行酰化和去饱和的溶磷脂酰胆碱的sn-1-十八烯基和sn-2-十八烯基类似物。中国生物化学杂志。1993;13(3):965-71。gydF4y2Bahttps://doi.org/10.1111/j.1432-1033.1993.tb17841.x.gydF4y2Ba.gydF4y2Ba
- 29.gydF4y2Ba
拟南芥FAD2基因编码多不饱和脂肪合成所必需的酶。植物细胞。1994;6(1):147 - 58。gydF4y2Ba
- 30。gydF4y2Ba
拟南芥α -亚麻酸盐合成缺陷突变体的研究。内质网亚麻油酰去饱和酶的生化和遗传特性。中国生物化学杂志。1993;26(22):16345-51。gydF4y2Bahttps://doi.org/10.1016/s0021-9258(19)85427-3gydF4y2Ba.gydF4y2Ba
- 31。gydF4y2Ba
拟南芥叶绿体omega - 6去饱和酶活性缺失突变体的基因鉴定。植物杂志。1994;106(4):1453 - 9。gydF4y2Bahttps://doi.org/10.1104/pp.106.4.1453gydF4y2Ba.gydF4y2Ba
- 32。gydF4y2Ba
aba -超敏萌发1编码蛋白磷酸酶2C,这是拟南芥种子脱落酸信号的重要组成部分。植物j . 2007;(6): 935 - 49。gydF4y2Bahttps://doi.org/10.1111/j.1365-313x.2007.03107.xgydF4y2Ba.gydF4y2Ba
- 33。gydF4y2Ba
Shockey JM,富尔达MS,浏览JA。拟南芥含有9个长链酰基辅酶,这是一种参与脂肪酸和甘油脂代谢的合成酶基因。植物杂志。2002;129(4):1710 - 22所示。gydF4y2Bahttps://doi.org/10.1104/pp.003269.gydF4y2Ba.gydF4y2Ba
- 34。gydF4y2Ba
拟南芥中两种长链酰基辅酶a合成酶参与过氧化物酶体β氧化。植物j . 2002; 32(1): 93 - 103。gydF4y2Bahttps://doi.org/10.1046/j.1365-313X.2002.01405.xgydF4y2Ba.gydF4y2Ba
- 35。gydF4y2Ba
拟南芥半乳脂合成与脂质转运的研究。科学。1999;284(5423):2181 - 4。gydF4y2Bahttps://doi.org/10.1126/science.284.5423.2181gydF4y2Ba.gydF4y2Ba
- 36。gydF4y2Ba
凯莉AA,Froehlich Je,Dormann P.中断两种二甲酰基二酰基甘油合酶基因DGD1和DGD2在拟南芥中揭示了半乳糖合成的另外的酶。植物细胞。2003; 15(11):2694-706。gydF4y2Bahttps://doi.org/10.1105/tpc.016675gydF4y2Ba.gydF4y2Ba
- 37。gydF4y2Ba
拟南芥中5个基因编码的9个3-酮酰基辅酶a硫代酶(KATs)和乙酰乙酰辅酶a硫代酶(ACATs)靶向过氧化物酶体或细胞质,但不靶向线粒体。植物学报。2007;63(1):97-108。gydF4y2Bahttps://doi.org/10.1007/S11103-006-9075-1.gydF4y2Ba.gydF4y2Ba
- 38。gydF4y2Ba
余波,范建平,范建平。拟南芥叶绿体溶血磷脂酸酰基转移酶的研究进展。植物生理学报。2004;45(5):503-10。gydF4y2Bahttps://doi.org/10.1093/pcp/pch064gydF4y2Ba.gydF4y2Ba
- 39。gydF4y2Ba
李Z,黄T,唐米,程b,彭y,张X.Itraq的蛋白质组学揭示了γ-氨基丁酸(GABA)在常年蠕动Bentgrass(Agrostis Stolonifera)中调节耐旱耐受的关键作用。植物理性生物化学。2019; 145:216-26。gydF4y2Bahttps://doi.org/10.1016/j.plaphy.2019.10.018gydF4y2Ba.gydF4y2Ba
- 40。gydF4y2Ba
李F,Wu X,Lam P,鸟D,Zheng H,Samuels L,Jetter R,Kunst L.蜡酯合酶/酰基 - 辅酶A的鉴定:拟南芥中茎蜡酯生物合成所需的二酰基甘油酰基转移酶WSD1。植物理性。2008; 148(1):97-107。gydF4y2Bahttps://doi.org/10.1104/pp.108.123471gydF4y2Ba.gydF4y2Ba
- 41。gydF4y2Ba
Jolivet P,Roux E,D'Andrea S,Davanture M,Negroni L,Zivy M,Chardot T.拟南芥中的油体的蛋白质组成。植物理性生物化学。2004; 42(6):501-9。gydF4y2Bahttps://doi.org/10.1016/j.plaphy.2004.04.006gydF4y2Ba.gydF4y2Ba
- 42。gydF4y2Ba
陈敏,徐瑞,季洪,格林DW, Rai A, Izumikawa K, Ishikawa H, Takahashi N, Simpson RJ。人结肠癌LIM1863细胞系释放的三种胞外囊泡亚型的转录组和长非编码RNA测序Sci众议员2016;6(1):38397。gydF4y2Bahttps://doi.org/10.1038/srep38397gydF4y2Ba.gydF4y2Ba
- 43。gydF4y2Ba
魏某,MA X,PAN L,MIAO J,FU J,BAI L,张Z,关Y,MO C,Huang H等人。Taxillusi chinensis(DC.)延迟液相传的转录体分析。gydF4y2Ba普罗斯一体gydF4y2Ba.2017; 12(1):E0169177。gydF4y2Ba
- 44。gydF4y2Ba
kobe DM, Johnson K, DiTommaso T, Tickle T, Couger MB, Payzin-Dogru D, Lee TJ, Leigh ND, Kuo TH, Davis, Bateman J, Bryant S, Guzikowski AR, Tsai SL, Coyne S, Ye WW, Freeman RM Jr, Peshkin L, Tabin CJ, Regev A, Haas BJ, Whited JL。组织定位的蝾螈新生转录组能够识别肢体再生因子。细胞众议员2017;18(3):762 - 76。gydF4y2Bahttps://doi.org/10.1016/j.celrep.2016.12.063gydF4y2Ba.gydF4y2Ba
- 45。gydF4y2Ba
Lageen K,Hallin P,Rodland EA,Stierfeldt Hh,Rognes T,Ussery DW。Rnammer:核糖体RNA基因一致且快速注释。核酸RES。2007; 35(9):3100-8。gydF4y2Bahttps://doi.org/10.1093/nar/gkm160gydF4y2Ba.gydF4y2Ba
- 46。gydF4y2Ba
Finn Rd,Clement J,Eddy SR。HMMER Web服务器:交互式序列相似性搜索。gydF4y2Ba核酸ResgydF4y2Ba.2011; 39(Web服务器问题):W29-37。gydF4y2Ba
- 47。gydF4y2Ba
Petersen Tn,Brunak S,Von Heijne G,Nielsen H. SignalP 4.0:识别跨膜区域的信号肽。NAT方法。2011; 8(10):785-6。gydF4y2Bahttps://doi.org/10.1038/nmeth.1701gydF4y2Ba.gydF4y2Ba
- 48。gydF4y2Ba
冯海因,张海峰,宋海默。用隐马尔可夫模型预测跨膜蛋白质拓扑结构:在全基因组中的应用。中华医学杂志。2001;305(3):567-80。gydF4y2Bahttps://doi.org/10.1006/jmbi.2000.4315gydF4y2Ba.gydF4y2Ba
- 49。gydF4y2Ba
Kanehisa M.了解细胞生物的起源和演变。蛋白质SCI。2019; 28(11):1947-51。gydF4y2Bahttps://doi.org/10.1002/pro.3715gydF4y2Ba.gydF4y2Ba
- 50。gydF4y2Ba
Chen M,Mithraphu S,Ramachandran M,Choi K,Khong T,Spencer A.循环无细胞RNA分析的实用性,以表征多发性骨髓瘤患者的全局转录组谱。癌症。2019; 11(6):887。gydF4y2Bahttps://doi.org/10.3390/cancers11060887gydF4y2Ba.gydF4y2Ba
确认gydF4y2Ba
我们衷心感谢成都吉宇科技有限公司李洁博士对测序的安排和对生物信息学分析的建议。gydF4y2Ba
资金gydF4y2Ba
内蒙古自然科学基金项目(no . 2019BS03019);内蒙古高等学校科研计划项目(no . NJZY20041)。关键词:岩石力学,边坡稳定性,边坡稳定性作者声明,资助机构在研究设计、数据收集和分析以及手稿准备中没有作用。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
WB和LW构思和设计了实验;WB,DA和YB进行了实验;WB,MC,JC,LW和SZ分析了数据;DA,ZL和FL执行了验证实验;WB和DA写了稿件;tw和lw修改了手稿。所有作者都读过并批准了稿件的最终版本。gydF4y2Ba
通讯作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
所描述的场研究或收集种子不需要特定许可。该地点不是以任何方式私下拥有或保护,实地研究没有涉及濒危或受保护的物种。所有的治疗方法gydF4y2Bap . pedunculatagydF4y2Ba遵守国家和机构的指导方针和法律。可以根据相应作者的请求访问种子。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明不存在利益冲突。gydF4y2Ba
附加信息gydF4y2Ba
出版商的注意事项gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1。gydF4y2Ba
差异表达的基因在显影种子中gydF4y2Bap . pedunculatagydF4y2Ba.gydF4y2Ba
附加文件2。gydF4y2Ba
与脂肪酸中的差异表达基因在显影种子中gydF4y2Bap . pedunculatagydF4y2Ba.gydF4y2Ba
附加文件3。gydF4y2Ba
脂肪酸相关通路/生物过程差异表达基因数量。gydF4y2Ba
附加文件4。gydF4y2Ba
差异表达与脂质生物合成相关的基因在显影种子中gydF4y2Bap . pedunculatagydF4y2Ba.gydF4y2Ba
附加文件5。gydF4y2Ba
差异表达与油状种子的油脂相关的基因gydF4y2Bap . pedunculatagydF4y2Ba.gydF4y2Ba
附加文件6。gydF4y2Ba
WGCNA鉴定了与油内容物的共同表达基因及其关系。gydF4y2Ba
附加文件7。gydF4y2Ba
qRT-PCR的正向和反向引物。gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
宝,W.,AO,D.,Wang,L.gydF4y2Baet al。gydF4y2Ba动态转录组分析识别与种子中脂肪酸生物合成相关的基因gydF4y2Baprunus pedinculata.gydF4y2Ba颇尔。gydF4y2BaBMC植物BIOL.gydF4y2Ba21,gydF4y2Ba152(2021)。https://doi.org/10.1186/s12870-021-02921-xgydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-021-02921-xgydF4y2Ba
关键字gydF4y2Ba
- 脂肪酸gydF4y2Ba
- 油酸gydF4y2Ba
- 油藏gydF4y2Ba
- 发展的种子gydF4y2Ba
- prunus pedinculata.gydF4y2Ba
- 转录组gydF4y2Ba