摘要
背景
更好地了解干旱胁迫下树木非结构性碳水化合物(NSC)的动态,对于阐明长期干旱导致森林衰退和树木死亡的机制至关重要。本研究旨在评估外生菌根(ECM)真菌(Suillus variegatus),以液压功能和NSC中的根,茎和叶油松不同的水分亏缺强度。我们于2019年7月10日至9月10日进行了连续对照干旱盆栽试验p .油松幼苗在80、40和20%的田间持水量下分别代表无干旱、中度干旱和重度干旱胁迫。
结果
结果表明,S.Variegatus.降低了褐飞虱的死亡率,增加了褐飞虱的高度、根生物量和叶生物量p .油松幼苗在中度和严重的干旱胁迫下。同时,光合速率,气孔导电和蒸腾率p .油松显著增加S.Variegatus.接种。此外,接种S.Variegatus.显著提高了干旱胁迫下各组织NSC浓度、可溶性糖含量和可溶性糖/淀粉比值。总的来说,接种S.Variegatus.在改善水力性能、增加NSC储存量、促进p .油松在严重干旱。
结论
因此,S.Variegatus.可以用作黄土高原干旱地区生态恢复的潜在应用菌株,特别是在p .油松林地。
背景
水分亏缺是影响世界各地植物生产力和粮食产量的最重要的环境压力之一[1,2,3.,4].在过去的几年里,全世界因干旱而导致的树木死亡都有记录[5,6],而更大的干旱导致的生态系统净生产力损失是增长的非致命性减少[7,8,9].黄土高原是世界上干旱和水土流失最严重的地区[10].在过去的30年里,油松,与外生菌根真菌(ECM)形成共生关系,在黄土高原大面积种植,以保持水土,改善生态环境[11,12,13].然而,大量的p .油松死于黄土高原的干旱。由于植物不能迁移,它们的生存在很大程度上取决于对逆境影响的耐受性和快速反应[14].因此,迫切需要开展研究,以提高生存率p .油松并增强该地区的抗旱能力。
为了减轻干旱对植物的负面影响,微生物对宿主植物的影响受到广泛关注。菌根真菌提高他们的主持人抵抗,容忍和从干旱中恢复的能力[15,16].真菌胞外菌丝能深入土壤根际,吸收大量各种营养物质,提高微量营养物质的有效性和吸收量,缓解对植物的胁迫效应[17].以往的研究表明,ECM真菌的根外菌丝向寄主植物输送水分足以决定树木幼苗的存活和死亡[18].Lehto和Zwiazek [16结果表明,ECM真菌对寄主-植物-水分关系的影响主要表现为气孔对水蒸气的导度增加,菌根的水力导度改变,以及促进渗透调节。然而,植物对接种ECM真菌的生理反应是高度可变的,并依赖于真菌的物种甚至基因型[7].
先前的研究表明p .油松能形成菌根共生关系吗Suillus,Tomentella,块茎,Handkea等。19,20.,21].同时,对该植物的真菌资源进行了研究p .油松在黄土高原的森林里发现Suillus variegatus(Swartz ex Fr.) O. Kuntze和p .油松有一个紧密的共生关系。S.Variegatus.是一种外生ECM真菌,在欧洲和亚洲部分地区的松林中广泛和常见[22,23].和S.Variegatus.能与?形成ECM共生系统抗旱性l .幼苗(24],促进幼苗的根和芽的生长[25].接种与S.Variegatus.还增加了甲壳素的含量p的抗旱性根际土壤中Mg和K的含量。然而,很少有研究明确了它的具体作用S.Variegatus.关于成长p .油松.
由于光合作用是植物获得碳的最重要的生理过程之一[26].当干旱胁迫导致光合作用减少时,树木很容易遭受碳饥饿[27].长期干旱胁迫将显著减少非结构性碳水化合物(NSC)在树木中的储存,最终导致死亡[8,28].在植物能量代谢,运输和渗透调整中发挥不同作用的NSC主要是淀粉和可溶性糖[29].淀粉是木质组织中最普遍和最丰富的贮藏碳水化合物[30.,31].当植物遭受严重干旱胁迫,导致碳水化合物缺乏时,淀粉会被大量消耗,并优先运输到生长部位。可溶性糖也在渗透调节中发挥重要作用,被认为是与耐旱性相关的重要生理指标[2,32].因此,NSC可以在碳水化合物供给和需求之间起到缓冲作用,使树木抵御干旱[33].菌根菌丝是动态的,在森林生态系统功能和二氧化碳通量中起着关键作用[34,35].然而,菌根菌丝通常会在碳水化合物的成本增加[成本18].据报道,在ECM系统中,真菌吸收的碳水化合物多达19倍,这导致了一个强大的地下碳汇[33],来自宿主树与根系正常渗出相比[36].然而,ECM对不同干旱强度下植物NSC含量的影响尚不完全清楚。
虽然有很多关于不同ECM真菌对不同植物的影响的研究,但没有关于ECM真菌对不同植物的影响的信息S.Variegatus.接种对水稻幼苗生长和NSC含量的影响p .油松在干旱条件下。本研究的假设是S.Variegatus.能形成一种紧密的共生关系吗p .油松在干旱条件下,促进幼苗生长,降低死亡率,并参与调节组织NSC含量。因此,为了验证这一假设,我们进行了为期6个月的模拟干旱室内盆栽试验。生物量和死亡率p .油松用来评价植物的生长。淀粉和可溶性糖含量及其在各组织中的比例p .油松研究NSC的动态变化。此外,利用气体交换参数解释了引起NSC变化的机理S.Variegatus.在干旱压力下。
结果
的S.Variegatus.殖民化p .油松
在收获,徵p .油松秧苗没有被定殖,所有接种的秧苗都被定殖S.Variegatus.在它们的根系中。重度干旱土壤中ECM菌落定植量最低,中度干旱土壤中ECM菌落定植量最高,分别为38%和60%。(表1).
死亡率和增长p .油松
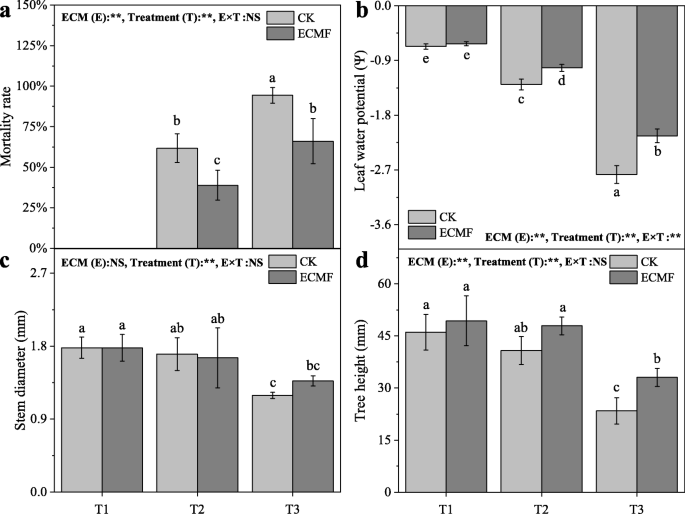
死亡率p .油松幼苗显著增加(P < 0.05) as the drought gradient increased (Fig.1A).在非干旱(T1)土壤中,所有幼苗存活。在T2、T3处理下,接种S.Variegatus.可显著减少(P < 0.05) the mortality, by 20%, compared with the mortality of non-inoculation.
叶片水势p .油松幼苗显著减少(P< 0.05),随干旱强度的增加而增加(图。1故选BS.Variegatus.可显著增加(P< 0.05)。
茎直径p .油松幼苗显著减少(P< 0.05)。1C)。在所有治疗中非接种和接种之间的幼苗的茎直径没有显着差异。像茎直径,高度p .油松幼苗显著减少(P< 0.05),但接种S.Variegatus.可显著增加(P< 0.05)。1D).随着干旱梯度的增加,幼苗茎粗和茎高呈显著下降趋势(P< 0.05)。
的根索引p .油松
干旱梯度和S.Variegatus.接种对根指数有显著影响p .油松苗(表2).结果表明,随着干旱强度的增加,除根系平均直径外,其他根系指标均呈下降趋势。的接种S.Variegatus.与CK组相比,T1处理显著增加了根系长度、表面积和根系体积。T2处理下,幼苗的根长、表面积和叉长均显著增加S.Variegatus.接种组显著高于CK组。根长和表面积显著增加S.Variegatus.在严重干旱(T3处理)下接种。
各种组织的生物量p .油松
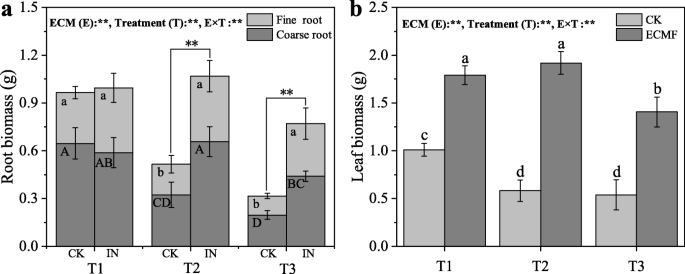
重度干旱土壤下幼苗根系和叶片生物量均低于T1和T2处理(图2)。2).的接种S.Variegatus.与CK组相比,T2、T3处理的细根生物量分别增加了116和175%(图3)。2且在T2和T3处理下,粗根生物量较CK组分别增加97和120%。因此,根系生物量显著增加(P< 0.01)后S.Variegatus.在T2和T3处理下,与未接种相比,接种率分别为106和140%。与细根生物量一样,叶片生物量也大幅增加,分别增加63、210和160%S.Variegatus.接种三种处理(图。2b)。然而,干旱和S.Variegatus.接种对茎的生物量无显著影响3.).
根和叶的含水量p .油松
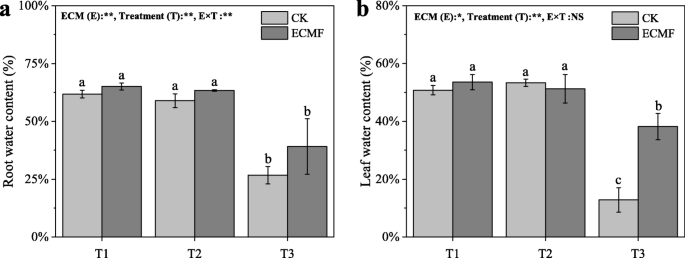
与T1和T2处理中的幼苗相比,严重干旱土壤中的幼苗具有较低的根和叶水含量(图。3.).的接种S.Variegatus.能显著提高叶片水分含量,较CK组提高216%。而茎干含水量则分别在T2和T3处理中最高和最低3.).处理后对茎干水分含量无显著影响S.Variegatus.接种。
叶气交换参数p .油松
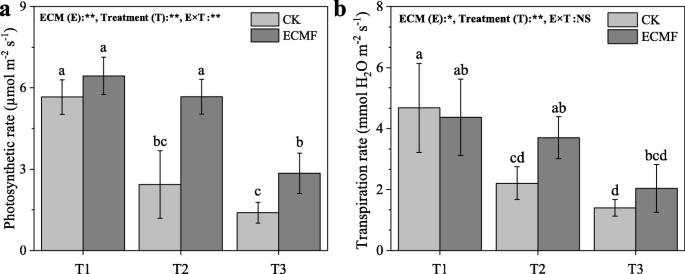
重度干旱土壤下幼苗的光合速率和蒸腾速率均低于T1和T2处理(图2)。4).的接种S.Variegatus.与CK组相比,T2和T3处理的光合速率分别提高了133和100%(图3)。4与此同时,接种S.Variegatus.与CK组相比,T2处理蒸腾速率增加了67%(图2)。4b)。
气孔导度也显著增加S.Variegatus.接种T3处理(表3.).接种ECM对细胞间CO无显著影响2浓度下,所有的治疗中。
的非结构性碳水化合物p .油松
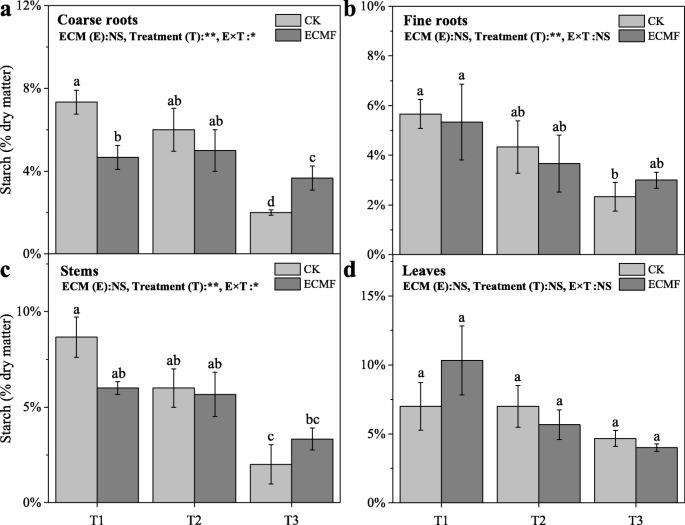
随着干旱强度的增加,幼苗各组织淀粉含量均显著降低(图2)。5).与T1和T2处理中的幼苗相比,严重干旱土壤中的幼苗组织具有较低的淀粉含量。的接种S.Variegatus.能显著提高粗根淀粉含量,较CK组提高80%(图2)。5一种)。但是,没有显着影响S.Variegatus.在所有处理下均可在其他组织上接种。
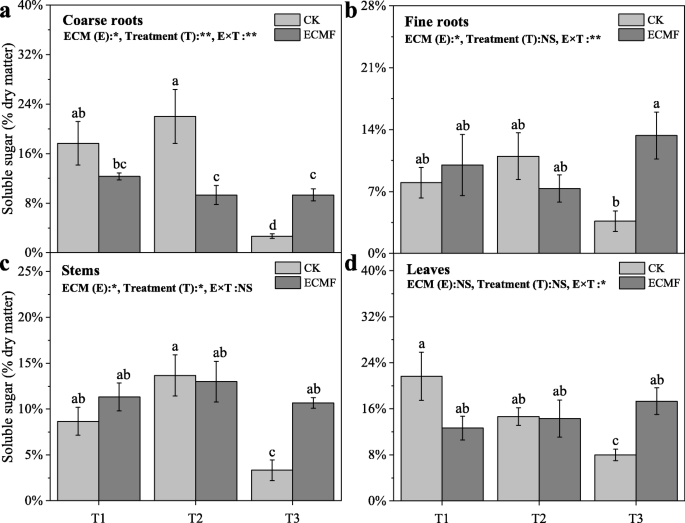
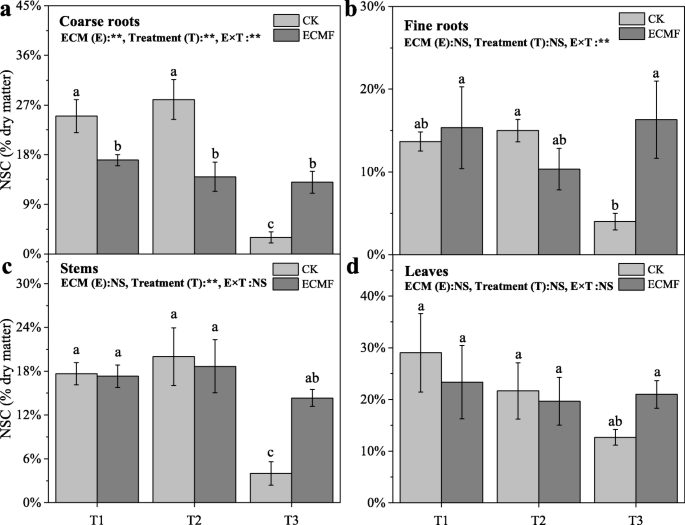
3个处理下,苗期各组织可溶性糖含量均显著降低,接种组均保持稳定。6).的接种S.Variegatus.T3处理粗根、细根、茎叶可溶性糖含量分别比未接种组提高800、550、614和113%(图2)。6).这一变化趋势与NSC含量的变化相似,非接种组幼苗各组织NSC含量均显著降低,接种组幼苗NSC含量保持稳定。的接种S.Variegatus.T3处理能显著提高粗根、细根、茎叶NSC含量,分别比CK增加333、300、250和62%(图2)。7).
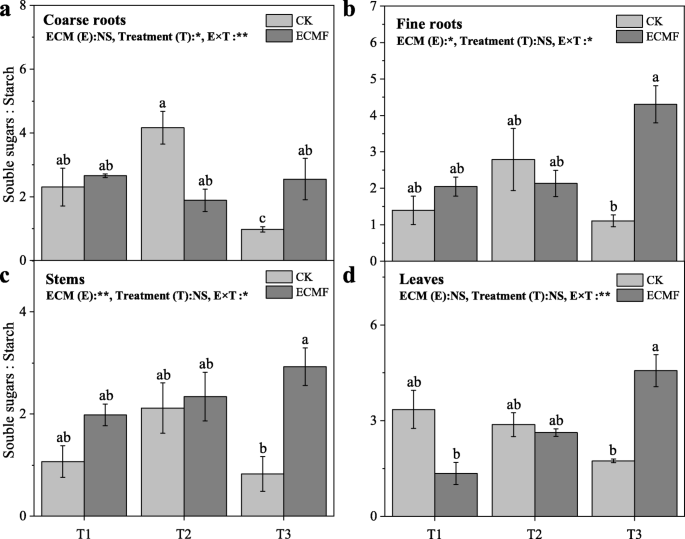
重度干旱土壤中未接种苗组织的可溶性糖/淀粉比低于T1和T2处理(图2)。8).的接种S.Variegatus.T3处理可显著提高粗根、细根、茎和叶可溶性糖/淀粉的比例。在干旱条件下,粗根中可溶性糖/淀粉的比例在整个试验过程中趋于稳定,而其他各组织中可溶性糖/淀粉的比例则趋于增加(图3)。8).
讨论
严重干旱导致植物的生产力和存活率显著下降[37,38,39].在我们的研究中p .油松在严重干旱条件下幼苗超过95%,并通过下降S.Variegatus.接种。两种机制已经提出来解释干旱导致树木死亡:液压故障和碳饥饿[40].因此,目前的实验结果表明,接种S.Variegatus.可缓解因干旱造成的水力故障和碳饥渴。本研究还表明S.Variegatus.接种可增加株高、茎粗、根(粗根和细根)生物量和叶生物量。这可能是由于ECM共生的建立增加了植物根系在土壤中的吸收面积[41,42].
植物抗旱的策略依赖于水力机制:减少水分流失,增加水分吸收[38,43].在干旱条件下,植物会显著降低叶片水势和气体交换[44,45].作为等水物种,p .油松可以降低气孔导度,并在水分有效度低的时期保持相对恒定的叶片水势[27,46,47].前人研究表明,叶片水势在−1.4 ~−1.5 MPa之间可以代表等渗树种的碳安全边际[48].在我们的研究中,叶水势的平均值p .油松在中度干旱和重度干旱条件下,对照组分别为−1.29(±0.09)MPa和−2.78(±0.15)MPa。这意味着p .油松在中度干旱条件下已经处于碳饥饿状态,而在严重干旱条件下,很容易死于严重碳饥饿。这与我们的死亡率测试结果一致。但在中度干旱和重度干旱条件下,接种组叶片水势均显著高于对照,分别维持在−1.02(±0.06)MPa和−2.14(±0.11)MPa。因此,我们发现接种S.Variegatus.可以增加叶片水势,维持一个安全范围(特别是在中度干旱条件下),从而减轻干旱造成的损害,降低树木的死亡率。与此同时,S.Variegatus.在中度和重度干旱条件下接种能显著提高植物的气孔导度、蒸腾速率和光合速率。这种影响表明……的参与S.Variegatus.在液压调节中p .油松在干旱。土壤水分较低时气孔导度高,可能是菌根系统对土壤水分的提取或根外菌丝扩大勘探区域所致[49].同时,气孔导度的增加增加了CO的吸收2,从而提高植物的光合作用速率[7,50].这样,虽然p .油松仍然受到干旱条件下的气孔导率的限制,它将产生比对照所需的更多碳水化合物,从而保持基本代谢和防御能力。一起携带,我们建议S.Variegatus.接种提高了植物的光合作用p .油松在干旱条件下,通过增加水分吸收和运输。
由于干旱压力,树木很容易遭受碳饥饿[51].以前的研究表明,严重但不适中,干旱的压力会显着影响NSC浓度[52,53,这与我们的结果相似。当p .油松遭受严重干旱时,除叶片外其他组织的淀粉含量会显著降低。由于NSC已被确定为严重干旱条件下的关键碳源[54,55,组织中淀粉浓度的降低表明淀粉储备的重新动员p .油松幼苗以满足干旱反应减少C同化时的C要求[56].叶片中淀粉含量的不显著下降可能是由于在死亡前,其含量比干旱前浓度先下降,然后上升[57].的接种S.Variegatus.与对照组相比,能显著提高各组织NSC浓度。这种现象表明S.Variegatus.可以改善NSC的存储,缓解碳饥饿p .油松在严重干旱。这可能是由于干旱条件下植物气孔导度、叶片水力调节与碳储量密切相关[58].在我们的研究中,接种S.Variegatus.可以直接提高气孔导度和叶片水势,说明幼苗可以进行更多的光合作用。虽然气孔导度的增加可能会增加水分的流失,但从我们的实验结果来看,光合作用的增加对干旱条件下的幼苗是有益的。同时,接种S.Variegatus.对幼苗NSC组成有不同的影响。这可能是由于NSC储备能够根据C源或C汇平衡的变化调整其组织浓度[59,60].一方面,接种S.Variegatus.可增加粗根中淀粉含量,在严重干旱条件下,可优先运输至植物根系生长部位,保证根系生长。另一方面,接种S.Variegatus.可提高各组织可溶性糖含量及可溶性糖/淀粉比,降低水势,维持细胞膨胀,增加水分吸收[61].因此,我们认为S.Variegatus.接种对缓解干旱引起的C饥饿具有重要作用p .油松.
结论
的接种S.Variegatus.能大大促进生长和成活率p .油松通过增加吸水和运输,并在严重干旱下改善NSC储存。一般来说,S.Variegatus.在黄土高原干旱区生态修复中,特别是在p .油松林地。
材料和方法
植物材料及生长基质
p .油松这些树是在西北农林科技大学(Northwest A&F University)林学院微生物实验室的苗圃里从种子中培育出来的。种子由陕西省林业厅林业技术推广站提供。用0.05% KMnO对种子进行表面消毒4静置30min后,用无菌水冲洗3次,45℃无菌水浸泡1h。无菌种子置于无菌纱布中,在无菌黑暗条件下培养。无菌种子在无菌纱布中在25℃无菌黑暗条件下萌发。将发芽后的种子移栽到苗盘中(每个孔50 mL),用无菌蛭石填充。每周用10毫升浓度为1/2的霍格兰溶液对种子施肥[62].2019年3月,选择180株2个月幼苗,其高度至分生组织为30±5mm,根颈直径为1±0.4 mm,移植到直径10厘米、深度10厘米的塑料花盆中,其中含有2公斤生长基质。每盆栽3苗,共60盆。幼苗在最适生长条件(环境光、24℃、RH = 70%、超适灌溉)下驯化4周。
的生长基质p .油松由土壤、沙子和蛭石(1:1:1,v/v/v)的混合物组成。土壤取自陕西省杨凌市西北农林科技大学校园苗圃表层。土壤主要养分特征为:16.15 g kg−1organic matter, 30.35 mg kg−1有效氮20.40 mg kg−1有效磷126.36 mg kg−1可用的钾。土壤被碾碎,通过一个2毫米的筛子,与彻底洗净的河沙和蛭石混合。混合料在0.11 MPa、121℃下蒸压2 h,静置1周后使用。
真菌制剂和接种
ECM真菌接种物(S.Variegatus.)保存于西北农林科技大学林学院微生物实验室。该菌株最初是从该菌的外生菌根中分离出来的p .油松在黄土高原。首次在马铃薯葡萄糖琼脂(PDA)固体培养基上培养。生长2周后,每300 ml马铃薯葡萄糖液体培养基中接种4块直径1 cm的培养基。摇瓶培养14天后(25°C, 120 rpm),用搅拌器均质真菌菌丝混合物,作为接种物。
实验设计
盆栽试验采用一种接种状态处理(接种S.Variegatus.或无菌接种)作为3个干旱强度水平(非干旱、中干旱和严重干旱)的单因素试验。当幼苗驯化期结束后,所有盆栽随机分为2个接种处理:接种S.Variegatus.无菌接种,每次30罐。外生菌根真菌接种,接种量为30 mLp .油松,而非菌根处理采用30 mL蒸压接种。然后,在温室中,在25°C、每天光照12 h的条件下,灌满水分,保持85-90%的田间持水量,连续4周。在我们之前的田间试验中,我们发现黄土高原自然干旱条件下的田间容量为20-40%。4周后,每个接种处理进行3个干旱强度的处理(T1不干旱:田间能力的80%,T2中度干旱:田间能力的40%,T3重度干旱:田间能力的20%)1),每级10罐。每天早上9点,所有的花盆都被称量并浇水,以保持水分在所需的水平。在同一温室(平均温度为25℃,平均相对湿度为70%)中种植,保持水分稳定60 d后采收。
ECM真菌
ECM真菌定植量的测定方法参照既往研究[63,稍作修改。部分细根用蒸馏水仔细洗涤,10% KOH 90℃漂白24 h,再用蒸馏水漂洗,然后用碱性h2O2加入软化5分钟。再用蒸馏水冲洗细根,加1%盐酸酸化5 min。将洗净的细根加入台班蓝染料(乳酸和甘油250 mL,台班蓝0.5 g,水500 mL),置于水浴(90℃)中30 min。然后用乳酸-甘油(1:1)在90℃下脱色30 min。在光学显微镜下按网格线交法计数定植[63,64].
叶片气体交换参数和水势
实验结束前,幼苗生长条件相同的被用于确定气体交换参数包括气孔导度(Gs),蒸腾速率(T)和光合作用速率(A)。幼苗的气体交换参数测量采用li - 6400光合作用系统(Licor Inc .)、林肯、NE、美国),光合系统参数设置如下:室面积2 cm2,参考CO2浓度为385 ppm,光环境为1000 l mol m−2年代−1使用6400-2B红/蓝LED光源。在晴朗的日子里,从上午9点到11:30,选择最年轻的完全展开的叶子进行测量。的水势(Ψ)p .油松叶片测量采用压力室法[65].
形态和生物量测定
测量完气体交换参数后,秧苗的高度和地面的直径p .油松进行测定,并计算死亡率。所有幼苗分为三个部分,用于根扫描其中的一部分,用于确定生物质的另一部分,而另一部分用于NSC含量测定。苗的一部分收获后分为两个部分(叶和根系统),把他们安置在一个透明的塑料袋,并用扫描仪根(STD1600爱普生,长滩,CA,USA)扫描它。我们测量根系统指数分别为根长,根表面积,根平均直径,根体积,根叉和根尖。通过软件WinRHIZO™扫描结果进行分析。苗另一部分采收后迅速洁净,根,茎,叶,分别收集了生物量的测定。的se tissues were dried at 75 °C for 48 h until constant weight.
非结构性碳水化合物测定
另一部分幼苗采收后分为叶、茎、粗根(> 2 mm)和细根(< 2 mm) 4部分。为了限制光合作用对幼苗NSC浓度的影响,采样时间在2 h内完成。清洗并彻底去除表面水分后,称量并测定非结构性碳水化合物含量。采集的样品在650 W微波下快速加热90 s,以防止酶促碳水化合物反应[66].然后在80°C的烤箱中烘干至恒重,并记录干重。所有干燥的组织都被磨碎,直到它们顺利通过一个40目的筛子。
NSC浓度定义为可溶性糖和淀粉含量之和。根据蒽酮法[67,68,并作了一些修改以确定NSC的内容。将精确的0.1000 g来自不同器官的样本称重并置于10ml离心管中。在离心管中加入2毫升80%乙醇溶液,80℃水浴30 min。冷却至室温后,以4800 rmin离心−110分钟。保留上清液用于测定可溶性糖含量。沉淀被保留以测定淀粉含量[67].提取重复3次。向沉淀物中加入2 mL蒸馏水,在沸水浴中凝胶化15分钟。冷却至室温后,加入2 mL 9.2 M HClO4溶液,摇匀15分钟,加入4 mL蒸馏水,混合后以4800 rpm离心−110分钟。抽吸上清液后,用2 ml 4.6 M HClO进一步提取4.收集所有上清,测定淀粉含量。糖、淀粉与蒽酮试剂反应后,在625 nm波长处用分光光度计测定溶液的吸光度。含量根据标准曲线计算,并以相对于器官干重的百分比表示。
统计分析
所有数据采用SPSS 25 (IBM®SPSS®Statistics)软件进行统计分析。采用重复测量方差分析(ANOVA)确定干旱强度和ECM真菌(S.Variegatus.)对形态、生物量、叶片气体交换参数、水势和NSC浓度的影响。方差分析前,采用levene检验对方差齐性进行检验。采用Tukey (HSD)检验确定显著性差异(P< 0.05)。
可用性数据和材料
在当前的研究中使用和/或分析的数据集可从通信作者在合理的要求。
缩写
- ECM:
-
真菌
- NSC:
-
非结构性碳水化合物
- S.Variegatus.:
-
Suillus Variegatus
- p .油松:
-
油松
- PDA:
-
土豆葡萄糖琼脂
- CK:
-
未接种ECM真菌
- ECMF:
-
ECM真菌接种
- T1:
-
死去的压力
- T2:
-
中度干旱胁迫
- T3:
-
严重的干旱胁迫
- 答:
-
光合作用速率
- g:
-
气孔导度
- 师:
-
蒸腾速率
参考
- 1.
Ganie Sa,Ahammed GJ。水稻水稻耐旱性细胞壁结构及相关基因组资源的动态。植物细胞代表。2021; 40(3):437-59。https://doi.org/10.1007/S00299-020-02649-2.
- 2.
Hessini K,MartínezJP,Gandour M,Albouchi A,Soltani A,Abdelly C.水分胁迫对生长,渗透调节,细胞壁弹性和水利用效率的影响Spartina alterniflora..环境实验机器人。2009;67(2):312-9。https://doi.org/10.1016/j.envexpbot.2009.06.010.
- 3.
富硫leonardite和腐殖酸土壤改良剂增强玉米对干旱和缺磷胁迫的耐受性(玉米l .)。Sci众议员2020;10(1):1-13。https://doi.org/10.1038/s41598-020-62669-6.
- 4.
Petrov P,Petrova A,Dimitrov I,Tashev T,Olsovska K,Brestic M等。严重土壤干旱叶片叶片叶片状,水位和细胞膜稳定性的关系。J Agron作物SCI。2018; 204(3):219-27。https://doi.org/10.1111/jac.12255.
- 5.
陈志强,陈志强,陈志强,等。干旱和热致树木死亡的全球概览揭示了森林正在出现的气候变化风险。生态学报。2010;259(4):660-84。https://doi.org/10.1016/j.foreco.2009.09.001.
- 6.
Williams AP, Allen CD, Macalady AK, Griffin D, Woodhouse CA, Meko DM,等。温度是区域森林干旱胁迫和树木死亡的一个有力驱动因素。张志强。2013;3(3):292-7。https://doi.org/10.1038/nclimate1693.
- 7.
Gehring CA, Swaty RL, Deckert RJ。菌根、干旱和宿主植物死亡率。在:约翰逊NC, Gehring C, Jansa J,编辑。土壤菌根的中介作用:爱思唯尔2017.p . 279 - 98。
- 8.
Adams HD, guardiola - claramont M, baron - gafford GA, Villegas JC, Breshears DD, Zou CB, et al.;对干旱引起的树木死亡的温度敏感性预示着在全球变化型干旱下区域死亡的增加。中国科学院院刊。2009;106(17):7063-6。https://doi.org/10.1073/pnas.0901438106.
- 9.
Williams AP, Allen CD, Millar CI, Swetnam TW, Michaelsen J, Still CJ等。美国西南部森林对日益干旱和温暖的反应。中国科学院院刊。2010;107(50):21289-94。https://doi.org/10.1073/pnas.0914211107.
- 10.
施H,从中国的黄土高原邵M.水土流失。Ĵ干旱ENVIRON。2000; 45(1):9-20。https://doi.org/10.1006/jare.1999.0618.
- 11.
周志,上官志。土壤细根垂直分布与土壤因子的关系油松卡尔。中国黄土高原的森林。土壤植物。2007;291(1 - 2):119 - 29。https://doi.org/10.1007/s11104-006-9179-z.
- 12.
郭颖,唐敏,杨建伟,杨建勇。外生菌根真菌接种油松的效果。西北林业大学学报2006;21:116-9。
- 13.
王玉强,邵马。黄土高原风蚀区土壤物理性质空间变异特征。土地退化与发展。2013;24(3):296-304。https://doi.org/10.1002/ldr.1128.
- 14.
刘安,陈树生。油菜素内酯对植物非生物胁迫的耐受性。植物生长规律。2020;39(4):1451-64。https://doi.org/10.1007/s00344-020-10098-0.
- 15.
奥格RM。水分关系、干旱和泡-丛枝菌根共生。菌根。2001;11(1):3-42。
- 16.
Lehto T, Zwiazek JJ。外生菌根与树木水分关系的研究进展。菌根。2011;21(2):71 - 90。https://doi.org/10.1007/s00572-010-0348-9.
- 17.
生物肥料和有机肥的结合对杂交玉米生长、产量、品质和代谢的影响玉米l .)。农学。2020;10(3):319。
- 18.
Smith SE, Read DJ。菌根共生关系。伦敦:学术出版社;2010.
- 19.
张辉,余辉,唐敏油松与外生菌根真菌增加植物生长和生存从衰减。新。2017;48(6):855 - 66。https://doi.org/10.1007/s11056-017-9601-9.
- 20.
关键词:外生菌根真菌,根际微生物,生物量,功能多样性油松幼苗。土壤生物学报,2010;46(1):55-61。https://doi.org/10.1016/j.ejsobi.2009.10.005.
- 21.
王强,郭立东。外生菌根群落组成油松通过ITS- rflp和ITS序列进行评估。植物学。2010;88(6):590 - 5。https://doi.org/10.1139/B10-023.
- 22.
Gumińska B, Wojewoda W. Grzyby我很喜欢。Państwowe Wydawnicto Rolnicze i Leśne: Warszawa;1985.
- 23.
1976-1988年在芬兰北部不同森林地点气候条件对大型真菌的影响。芬兰:奥卢大学;1993.
- 24.
Heinonsalo J, Buée M, Vaario L-M。与外生菌根真菌相比,根内生真菌导致苏格兰松根的形态和功能差异。植物学。2017;95(2):203 - 10。https://doi.org/10.1139/cjb-2016-0161.
- 25.
Niemi K, Julkunen-Tiitto R, Häggman H, Sarjala T. Suillus杂色穗霉(Suillus varigatus)在离体菌根形成过程中引起了苏格兰松幼苗个体多胺和类黄酮含量的显著变化。中国农业科学。2006;58(3):391-401。https://doi.org/10.1093/jxb/erl209.
- 26.
Hajihashemi S, Brestic M, Kalaji HM, Skalicky M, Noedoost F.环境污染反映在光合机构的活性上。Photosynthetica。2020;58(特刊):529 - 39。https://doi.org/10.32615/ps.2019.179.
- 27.
McDowell N, Pockman WT, Allen CD, Breshears DD, Cobb N, Kolb T,等。植物在干旱中生存和死亡的机制:为什么有些植物能存活,而另一些则会死于干旱?新植醇。2008;178(4):719 - 39。https://doi.org/10.1111/j.1469-8137.2008.02436.x.
- 28.
干旱导致树木死亡的生理机制还远未解决。新植醇。2010;186(2):274 - 81。https://doi.org/10.1111/j.1469-8137.2009.03167.x.
- 29.
了解森林树木中非结构性碳水化合物的作用-从我们可以测量到我们想知道的。新植醇。2016;211(2):386 - 403。https://doi.org/10.1111/nph.13955.
- 30.
科兹洛夫斯基TT,帕拉第SG。木本植物生理学:Elsevier;1996.
- 31.
甜樱桃多年生部分非结构性碳水化合物的分配。园艺学报(美国)。1989, 114(6): 969 - 75。
- 32.
马丁内斯JP。NaCl可以缓解聚乙二醇诱导的盐生植物的水分胁迫滨藜属halimusacta physica sinica(物理学报),2005;56(419):2421-31。https://doi.org/10.1093/jxb/eri235.
- 33.
乔木各器官NSC储量动态分析揭示了全树碳平衡框架下对地下共生体的分配。Front Forests Glob Chang. 2019;2:17。https://doi.org/10.3389/ffgc.2019.00017.
- 34.
林志刚,王志刚,王志刚,等。森林土壤CO2通量的变化及其对环境的响应。中国科学(d辑:地球科学)2007;13(8):1786-97。https://doi.org/10.1111/j.1365-2486.2007.01383.x.
- 35.
陈志强,陈志强,陈志强,等。外生菌根真菌对温度的适应及其代谢温度敏感性。中国科学(d辑:地球科学)2008,14(5):1169-80。https://doi.org/10.1111/j.1365-2486.2008.01555.x.
- 36.
Nehls U.掌握外胚性共生:碳水化合物的影响。J Exp Bot。2008; 59(5):1097-108。https://doi.org/10.1093/jxb/erm334.
- 37.
Anderegg WRL, Kane JM, Anderegg LDL。由干旱和温度胁迫引发的大面积树木死亡的后果。张志强。2013;3(1):30-6。https://doi.org/10.1038/nclimate1635.
- 38.
关键词:番茄,SlWRKY81,气孔关闭,保护细胞,一氧化氮杂志2020:1-11植物。https://doi.org/10.1111/ppl.13243.
- 39.
Brzostek ER,德拉戈尼d,施密德HP,拉赫曼AF,西姆斯d,威胜CA等。慢性干旱胁迫降低树木生长和落叶阔叶林的碳汇。通配昌生物学。2014; 20(8):2531-9。https://doi.org/10.1111/gcb.12528.
- 40.
Gattmann M, Birami B,纳达尔Sala D, Ruehr NK。干燥死亡:与树木死亡相关的生理应激阈值的时间并不因CO的高度升高而发生显著改变2.植物细胞ENVIRON。2021; 44(2):356-70。https://doi.org/10.1111/pce.13937.
- 41.
Cairney JWG。外生菌根真菌:森林土壤中从根部获取磷的共生途径。土壤植物。2011;344(1 - 2):51 - 71。https://doi.org/10.1007/S11104-011-0731-0..
- 42.
Vayssières A, Pěnčík A, Felten J, Kohler A, Ljung K, Martin F, et al.杨树的发展Laccaria二色的Ectomycorrhiza改变根毒素代谢,信号和响应。植物理性。2015; 169(1):890-902。https://doi.org/10.1104/pp.114.255620.
- 43.
Brunner I,Herzog C,Dawes Ma,Arend M,Sperisen C.树根如何回应干旱。前植物SCI。2015; 6(547):1-16。https://doi.org/10.3389/fpls.2015.00547.
- 44.
瓦西姆M,聂志峰,姚国强,哈桑M,向勇,方晓伟。露珠被叶毛吸收锦鸡儿几种:一种在干旱环境中抵御干旱的替代水获取策略。杂志。2021。https://doi.org/10.1111/ppl.13334.
- 45.
Blackman CJ, Brodribb TJ, Jordan GJ。4种温带木本植物叶片水力学与干旱胁迫的响应、恢复和存活。植物学报。2009;32(11):1584-95。https://doi.org/10.1111/j.1365-3040.2009.02023.x.
- 46.
陈志强,张震,陈林,蔡勇,张华,娄建军,等。稀疏的松果体tabuliformis间伐后30年林分的冠层蒸腾作用高于密林。森林。2020;11(1):70。https://doi.org/10.3390/f11010070.
- 47.
吴旭,唐勇,陈勇,文杰,谢勇,卢绍峰油松和沙棘在中国的黄土丘陵地区。生态另一个星球。2018;8(1):617 - 30。https://doi.org/10.1002/ece3.3639..
- 48.
Mitchell PJ,O'GRady AP,组织DT,Worldledge D,Pinkard EA。增长,气体交换和液压的协调定义了树木中的碳安全裕度,具有对比的干旱策略。树生理。2014; 34(5):443-58。https://doi.org/10.1093/treephys/tpu014.
- 49.
段旭,Neuman DS, Reiber JM, Green CD, Saxton AM, Augé RM。干旱时期菌根对水分和激素因子的影响与气孔导度的控制有关。acta botanica yunshan(云南植物研究)1996;47(10):1541-50。https://doi.org/10.1093/jxb/47.10.1541.
- 50。
Augé RM, Toler HD, Saxton AM。丛枝菌根共生在干旱条件下比充足水分条件下更能改变寄主植物的气孔导度:一项meta分析。菌根。2015;25(1):24里面。https://doi.org/10.1007/s00572-014-0585-4.
- 51。
麦克道尔NG。联系干旱、水力学、碳代谢和植被死亡率的机制。植物杂志。2011;155(3):1051 - 9。https://doi.org/10.1104/pp.110.170704.
- 52。
Wiley E, Huepenbecker S, Casper BB, Helliker BR。落叶对碳分配的影响:碳限制能减少生长有利于储存吗?树杂志。2013;33(11):1216 - 28。https://doi.org/10.1093/treephys/tpt093.
- 53。
张涛,曹颖,陈勇,刘刚。连续干旱胁迫下刺槐幼苗非结构性碳水化合物动态变化。树木。2015;29(6):1837 - 49。https://doi.org/10.1007/s00468-015-1265-5.
- 54。
Adams HD,Zeppel MJB,Anderegg WRL,Hartmann H,LandhäusserSM,组织DT等。干旱诱导树死亡率的生理机制的多种合成。NAT ECOL EVOL。2017; 1(9):1285-91。https://doi.org/10.1038/s41559-017-0248-x.
- 55.
作者简介:赵志刚,男,河北人,博士,主要从事生物医学工程研究。干旱响应策略和水力特性有助于理解植物干旱到水力失效的机理。39树杂志。2019;(6):910 - 24。https://doi.org/10.1093/treephys/tpz016.
- 56.
Martínez-vilalta J,Sala A,Asensio D,Galiano L,Hoch G,Palacio S等人。陆地植物中非结构碳水化合物的动态:全球合成。Ecol Monogr。2016; 86(4):495-516。https://doi.org/10.1002/ecm.1231.
- 57.
Adams HD,萌动MJ, Breshears DD, Barron-Gafford GA,瓜迪奥拉-克拉蒙特M,邹CB,等。非结构性叶碳水化合物动态松果体鸡蛋果在干旱诱导的树木死亡中揭示碳代谢在死亡机制中的作用。新植醇。2013;197(4):1142 - 51。https://doi.org/10.1111/nph.12102.
- 58.
Woodruff博士,Meinzer FC, Marias DE, Sevanto S, Jenkins MW, McDowell NG。将非结构性碳水化合物动力学与气体交换和叶片水力行为联系起来松果体鸡蛋果和Juniperus monosperma.新植醇。2015;206(1):411 - 21所示。https://doi.org/10.1111/nph.13170.
- 59.
吕敏,孙敏,Peñuelas J,孙军,陈旭,等。温度控制生长松果体taiwanensis沿着海拔梯度。2020年树木。。
- 60.
坎汉姆CD,科比RK,拉蒂EF,查兹登RL。乔木幼苗存活的种间和种内变异:根系分配对碳水化合物储备的影响。环境科学。1999;121(1):1 - 11。https://doi.org/10.1007/s004420050900.
- 61.
Silva EN, Ferreira-Silva SL, Viégas RA, Silveira JAG。有机和无机溶质在干旱胁迫下渗透调节中的作用麻风树植物。环境实验机器人。2010;69(3):279-85。https://doi.org/10.1016/j.envexpbot.2010.05.001.
- 62.
Hoagland Dr,Arnon Di。没有土壤种植植物的水培养方法。Circ Calif Agric Exp Stat。1950; 347(第二次编辑):32。
- 63.
Brundrett男,Bougher N,戴尔B,树丛T,Malajczuk N.工作在林业和农业菌根。在。澳大利亚国际农业研究:堪培拉;1996.
- 64.
陈志强,王志强,王志强,等。丛枝菌根真菌对植物根际真菌侵染的影响。新植醇。1980;84(3):489 - 500。https://doi.org/10.1111/j.1469-8137.1980.tb04556.x.
- 65.
霍尔布鲁克NM,伯恩斯MJ,菲尔德CB。植物木质部负压力:平衡压力技术的试验。科学。1995;270(5239):1193 - 4。https://doi.org/10.1126/science.270.5239.1193.
- 66.
关键词:移动碳库,海拔分布,空间分布松果体cembra表明瑞士林木线的生长受到下沉限制。Oikos。2002;98(3):361 - 74。https://doi.org/10.1034/j.1600-0706.2002.980301.x.
- 67.
王志强,王志强,王志强,等。盐胁迫下一氧化氮、过氧化氢和钙的相互作用藜藜麦Willd。在种子萌发阶段。植物生理生化。2020;54:657 - 64。https://doi.org/10.1016/j.plaphy.2020.07.022.
- 68.
Yemm EW, Willis AJ。用蒽酮估算植物提取物中碳水化合物的含量。j . 1954; 57(3): 508 - 14所示。https://doi.org/10.1042/bj0570508.
致谢
不适用。
资金
国家自然科学基金项目(no . 32071639, no . 31700530);国家重点研发计划项目(no . 2018YFD0600203-3)。
作者信息
从属关系
贡献
王嘉兴:方法论,概念化,写作-初稿,写作-审查-编辑。张浩强:写作-评论-编辑。京高:调查。张昱:调查。Yaqin刘:调查。唐明:监理,资金获取,项目管理。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:图S1。
的表型油松不同干旱梯度下接种ECM的影响。CK =未接种ECM真菌;ECMF = ECM真菌接种;T1 =非干旱胁迫;T2 =中度干旱胁迫;T3 =严重干旱胁迫。
附加文件2:图S2。
的殖民化油松不同干旱程度的ECM。CK =未接种ECM真菌;T1 =非干旱胁迫;T2 =中度干旱胁迫;T3 =严重干旱胁迫。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
王军,张海龙,高军。et al。外生菌根真菌(Suillus variegatus)上的生长,液压功能,和非结构性碳水化合物油松在干旱压力下。BMC植物杂志21,171(2021)。https://doi.org/10.1186/s12870-021-02945-3
收到了:
接受:
发表:
关键字
- 真菌真菌
- 油松
- 干旱胁迫
- 非结构性碳水化合物
- 森林恢复