摘要
背景
棉籽是植物油的主要来源之一。分析棉籽油脂肪酸组成及脂肪酸组成调控基因的动态变化,对于了解脂肪酸生物合成的生物学过程,从遗传上改善油品营养品质具有重要意义。
结果
在这项研究中,我们在棉籽的12个发育时间点调查了13种脂肪酸成分的动态关系(gossypium hirsutumL.)和12个时间点的产生棉籽转录。At 5–15 day post anthesis (DPA), the contents of polyunsaturated linolenic acid (C18:3n-3) and saturated stearic acid (C18:0) were higher, while linoleic acid (C18:2n-6) was mainly synthesized after 15 DPA. Using 5 DPA as a reference, 15,647 non-redundant differentially expressed genes were identified in 10–60 DPA cottonseed. Co-expression gene network analysis identified six modules containing 3275 genes significantly associated with middle-late seed developmental stages and enriched with genes related to the linoleic acid metabolic pathway and α-linolenic acid metabolism. Genes (gh_d03g0588和gh_a02g1788)编码硬脂酰-ACP去饱和酶被鉴定为基因毂,并在25 DPA显著上调。他们似乎在确定的饱和脂肪酸的比例,以不饱和脂肪酸中发挥了决定性的作用。FAD2基因(GH_A13G1850和gh_d13g2238)在25-50 DPA高度表达,最终导致棉籽中C18:2n-6含量较高。C18:3n-3的含量由5 DPA(7.44%)显著降低至25 DPA(0.11%),且与C18:3n-3的表达特征相关Gh_A09G0848和Gh_D09G0870.
结论
这些结果有助于我们理解棉籽整个发育阶段脂肪酸组分的积累模式与脂肪酸合成关键基因的表达特征之间的关系。
背景
植物油的质量和营养价值主要由其脂肪酸组合物定义。由于饱和脂肪酸(SFAs)的低冰点,具有高含量SFA的植物油将凝固,浑浊,半固化或甚至在较低温度下固化。从健康角度来看,SFA可能会增加心血管疾病的风险[1,2,3.,4].多不饱和脂肪酸(PUFAs),如亚油酸(C18:2n-6)和亚麻酸(C18:3n-3)对人体健康有益,但在一般贮藏条件下,易氧化变质[4,5,6,7].化学氢化PUFAs可以提高油脂的氧化稳定性,但不幸的是,它会产生有害的反式脂肪酸作为副产物[8,9].单不饱和脂肪酸(MUFA)油酸(C18:1n-9)是稳定的,被认为对人类健康有益[3.,8,9,10,11,12].C18:1n-9比例高的食用油,如橄榄油,由于SFAs含量低,不需要化学氢化,因此被称为“健康油”[13].
棉籽油中含有25-35%的油脂,是食用植物油的主要来源之一。其营养成分和品质备受关注。棉籽油主要脂肪酸成分为亚油酸(C18:2n-6)、棕榈酸(C16:0)、油酸(C18:1n-9)和硬脂酸(C18:0)。一般棉籽油中C18:1n-9的相对含量为~ 15%。由于其营养价值,提高C18:1n-9的相对含量是植物油脂遗传改良的主要目标之一。在高等植物中,C18:1n-9通过酰基- acp硫酯酶FATA将C18:1n-9- acp转化成C18:1n-9- acp,再通过脂肪酸去饱和酶2 (FAD2)作为底物合成棉籽油中最丰富的脂肪酸成分C18:2n-6 [14].高油酸(C18:1n-9)含量的转基因植物已经在几种作物中培育出来,例如大豆[15,16],油菜籽[17,18], 棉 [3.,10,19]和麻醉药[20.),通过减少FAD2表达。在脂肪酸组成的变化提高的营养价值,但可能有意想不到的副作用,诸如降低的总油含量或种子活力[3.,8[可能是由于种子中各种脂肪酸的天然组成,由于种子萌发和幼苗生长是必需的。种子脂肪酸的组成也与后代的自我保护和生理防御机制密切相关[3.,21].因此,深入分析棉籽油脂肪酸组分调控基因网络,对其进行基因改造,以满足人类健康和棉花植株健康的需要具有重要意义。
本研究首先研究了陆地棉种子发育过程中脂肪酸组分的动态变化。gossypium hirsutumL.)品种Xinluzao 33并在多种发育时间点产生显影种子的转录组。然后,我们分析了涉及脂肪酸生物合成的关键基因的表达谱,并使用差异表达基因进行基因网络分析(DEGS)。结果深化了我们对与脂肪酸代谢网络相关的基因的理解和棉籽脂肪酸组分的时间调节,并提供了对鉴定改善棉籽油质量的目标可能有帮助的基因表达信息。
结果
棉籽发育过程中脂肪酸的动态分布
为研究棉籽发育过程中脂肪酸组分的动态变化,采用气相色谱-质谱联用技术测定了棉籽脂肪酸组分的相对含量。共测定了12个发育时间点的13种脂肪酸组分,分为早期(5-15 DPA)、中期(20-35 DPA)和晚期(40-60 DPA) 3个阶段。在成熟棉籽中,主要脂肪酸成分为多不饱和亚油酸(C18:2n-6, 57.62%)、单不饱和油酸(C18:1n-9, 15.59%)、饱和棕榈酸(C16:0, 22.36%)和硬脂酸(C18:0, 2.31%),其他成分占总含油量的比例均小于1%。C18:2n-6的相对含量从5 DPA逐渐增加到15 DPA,在15 DPA后显著增加,在25 DPA时达到较高水平,之后趋于稳定(表2)1).在5 dPa(23.42%)中观察到C18:1N-9的最高相对含量,然后在10至15dPa种子中显着降低,再次增加15至20dPa种子,然后之后保持相对恒定,直至成熟度。饱和C16:0是成熟棉籽中的第二次脂肪酸组分,其最大相对百分比(44.23%)在15dPa观察到,从15(28.35%)至20dPa(23.45%)显着降低。C18:0具有与C16:0相似的动态变化曲线,其在15dPa观察到其最大相对含量(13.75%),然后在20dPa的速度快速降低至5.29%,最终成熟种子的2.31%。显然,似乎C16:0和C18:0主要在早期(5-15DPA)和中间(20-35dPa)的种子发育中同步累积。应当注意,在5 dPA种子中观察到最高相对含量(7.44%)亚麻酸C18:3N-3,在10dPa下降至3.12%,进一步下降至20dPa的0.55%,是其中一种至少在成熟的种子中(表1).C18:2N-6和C18:3N-3的相对含量与C18:3N-3之间存在显着的负相关性。期间棉籽的发展,肉豆蔻酸的相对含量(C14:0),棕榈油酸(C16:1),花生酸(C20:0),山嵛酸(C22:0)和二十四烷酸(C24:0)无在早期阶段观察到的比〜2%仅为2%。随着棉籽的发展,这些脂肪酸的含量从中部到晚期(20-60dPa)阶段逐渐降低,并且在成熟的种子中保持在非常低的水平(<1%)。庚二烷酸(C17:0)的相对含量不断低,甚至未在20-25dPa下检测到。反式9-十八烷烯酸(C18:1N-9 T)和全反式-9,12-十八二碳酸酸(C18:2N-6TT)仅在5-15dPa下检测(表1).
转录组分析
为了了解棉籽发育过程中脂肪酸成分的动态变化是如何调控的,我们使用rna测序(RNA-seq)生成了种子转录组谱。从12个不同发育时间点(5、10、15、20、25、30、35、40、45、50、55和60 DPA)生成RNA-seq文库并进行测序。总共生成了约5.99亿原始读取。所有样品读的平均Q30为94.04%,读的GC含量为44.66%。对原始读取进行过滤,去除低质量的读取,最终使用576,668,718个干净的读取进行比对。总体而言,93.35 ~ 96.38%的clean reads可与参考基因组进行比对,87.80 ~ 90.09%的clean reads可与参考基因组进行唯一比对S3).这些结果表明,RNA-SEQ数据是高质量的,适合于进一步的分析。
我们以5粒DPA种子作为对照,鉴定了在10-60粒DPA种子上差异表达的基因。从10 DPA到20 DPA, deg的数量从396个增加到2451个。在25、30和35 DPA三个发育中期时间点,DEGs的数量相似,在40 DPA开始增加,在55和60 DPA显著增加(图4)。S2一种)。关于上调和下调的次数的数量,在10-15dPa和40-45dPa下观察到两个过渡点。在10dPa和45-60dPa的10dPa和45-60dPa中具有更高调节的次数,但在15-40dPa下比下调的次数更高的下降(图。S2一种)。10至30 dPA的期间对于油积累至关重要。我们进一步比较了10,20和30dPA三个时间点的DEG。在20dPa与10dPa的比较组中,上调30dPa与30dPa和30dPa和30dPa,1268,1607和2517℃,分别下调430,1030和1302°。在这些DEG中,501,667和1413分别是每个比较的独特,并且113个基因在所有三种比较中显示出差异表达(图。S2b)。
棉籽发育过程中脂肪酸生物合成相关基因的表达谱
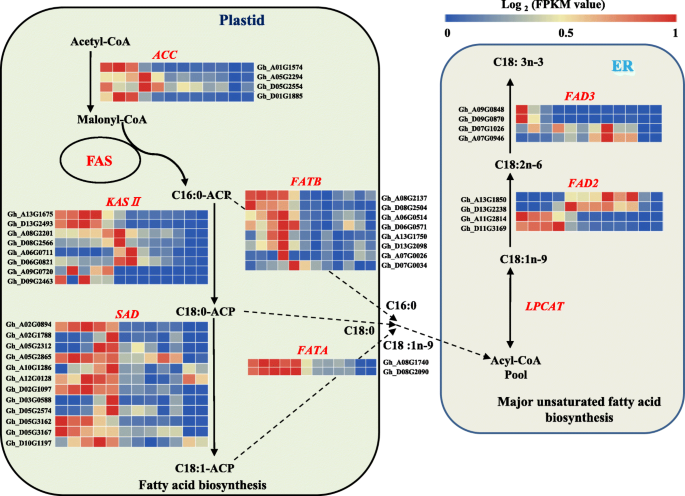
脂肪酸的从头生物合成主要发生在质体中。我们首先研究了参与脂肪酸生物合成的主要基因的表达动态(图。1).脂肪酸生物合成的第一步是通过乙酰-COA羧化酶(ACC)形成丙基辅酶,其是脂肪酸生物合成中的关键率限制酶[23,对种子脂肪酸含量的最终水平有很大的影响。棉花基因组包含两对同源基因ACC基因(Gh_A01G1574和Gh_D01G1885,Gh_A05G2294和gh_d05g2554).四个基因在发育早期至中期的表达量均高于发育后期,但两对同源基因的表达谱不同Gh_A01G1574和Gh_D01G1885主要在5-15个DPA种子中表达Gh_A05G2294和gh_d05g2554主要在20-25 DPA种子中表达。丙二酰辅酶a在脂肪酸合酶(FAS)的催化下经循环反应生成16:0碳棕榈酰- acp。β-酮酰基- acp合酶II催化16碳棕榈酰- acp向18碳硬脂酰- acp的延伸[24].棉花有四对同源基因编码β-酮酰基- acp合酶II (KASII)。他们是Gh_A13G1675和gh_d13g2493,Gh_A08G2201和gh_d08g2566.,Gh_A06G0711和Gh_D06G0821,Gh_A09G0720和Gh_D09G2463.Gh_A13G1675和gh_d13g2493主要在5-15 DPA种子中表达,Gh_A08G2201和gh_d08g2566.主要在20-25 DPA种子中表达,Gh_A06G0711和Gh_D06G0821有他们的最高表达水平在30 DPA观察。这些结果表明Gh_A13G1675和gh_d13g2493可能是棉籽中C16:0-ACP向C18:0-ACP转化的主要基因。C18:0-ACP不饱和Δ9-硬脂酰- acp去饱和酶(SAD)形成单不饱和C18:1n-9-ACP。十二个悲伤的基因(Gh_A02G0894、Gh_D02G1097、gh_d03g1788、Gh_D03G0588、gh_d05g2865、Gh_D05G3162、Gh_A10G1286、Gh_D10G1197、Gh_A05G2312、Gh_D05G2574、Gh_A12G0128和Gh_D05G3167)在棉花基因组中鉴定出来。大多数表达水平高于5-25 dpa种子,而不是30-60dPa种子,除了两对同性恋症(gh_a02g1788和gh_d03g0588,Gh_A05G2312和Gh_D05G2574),其在20-25dPa处具有高表达水平(图。1).
棉籽油积累的基因表达网络。各差异基因在相对log2 (FPKM值)上的表达模式从左到右为0 ~ 60 DPA。ACC,乙酰-CoA羧化酶基因;Fas,脂肪酸合成酶;KASIIβ-酮酰基ACP合成酶II基因;悲伤的,硬脂酰acp去饱和酶基因;FATA / B,脂肪酰基-ACP硫酸酶A / B基因;FAD2,脂肪酸去饱和酶2基因;f3,脂肪酸去饱和酶3基因;C16:0,棕榈酸;C18:0,硬脂酸;C18:1N-9,油酸;C18:2N-6,亚油酸;C18:3N-3,α-亚麻酸。该模型是根据Zhao等人的参考来修改的。(2018)[22]
在植物中,酰基- acp中的酰基可被两类酰基- acp硫酯酶FATA和FATB水解,释放出游离脂肪酸。在棉籽发育过程中,有一对同源的法达基因(gh_a08g1740和Gh_D08G2090)非常表达,特别是在5-25 dPA种子中,以及三对同源的三对FATB(Gh_A08G2137和Gh_D08G2504,Gh_A06G0514和Gh_D06G0571,GH_A13G1750和GH_D13G2098,Gh_A07G0026和Gh_D07G0034)也主要在5-25 DPA种子中表达。脂肪的特异性是大多数植物组织中饱和脂肪酸(sfa)链长和水平的主要决定因素[25].研究表明FATB对16:0-ACP表现出较高的催化效率,而FATA对油酰- acp的催化活性较高,对16:0-ACP的催化活性较低(约为FATB的75倍)[25].在棉籽早期发育阶段,表达水平KASII和法达高,导致0-15 DPA种子中的C18:0的较高积累。然而,C18:0-ACP也是合成C18:1N-9-ACP的基材。同时,表达水平FATBs显着高于法塔斯在棉籽发育期间的同样的发育阶段,特别是在15-25个DPA种子中,C16:0的积累大于C18:0的C18:0,C16:0是成熟棉籽中的主要SFA。
通过脂肪酸去饱和酶2(FAD2,C18:1N-9至C18:2N-6去饱和)和多不饱和亚麻酸(C18:3N-3)合成的主要多不饱和脂肪酸(PUFA)由C18:2N去饱和-6通过脂肪酸去饱和酶3(FAD3)。这些反应发生在内质网(ER)中。两对同种型GhFAD2(GH_A13G1850和gh_d13g2238,Gh_A11G2814和Gh_D11G3169)在发育中的棉籽中有不同的表达模式。GH_A13G1850和gh_d13g2238,命名为GhFAD2-1[26],主要表达于25-50分DPA种子,而Gh_A11G2814和Gh_D11G3169主要表达于5-20 DPA种子中。C18:2n-6的相对含量从15 DPA到25 DPA显著增加,之后保持较高水平,与高表达期重叠GH_A13G1850和gh_d13g2238,表明这两个同源性是C18:2N-6生物合成的主要贡献者,与先前的结果一致[26,27].GhFAD3用两对同源基因编码(Gh_A09G0848和Gh_D09G0870,Gh_A07G0946和Gh_D07G1026).这两对在开发棉籽中也具有不同的表达模式。Gh_A09G0848和Gh_D09G0870有在5〜15 DPA种子的相对高的表达水平,特别是在5 DPA。经过20 DPA,它们的表达水平显著降低,并且在成熟的棉子几乎检测不到。与此相反,表达Gh_A07G0946和Gh_D07G1026观察到从5至50 DPA,在40个DPA种子观察到的最高表达水平。C18:3N-3显然积累在种子发育的早期阶段,在5 DPA达到峰值(7.44%)。C18的相对含量:3N-3显著从1.16%在15 DPA降低到0.11%,在25 DPA和仍然很低之后。这些结果表明,C18的内容:在棉籽3N-3由下式确定Gh_A09G0848和Gh_D09G0870而不是Gh_A07G0946和Gh_D07G1026.
通过QRT-PCR分析确认DEGS
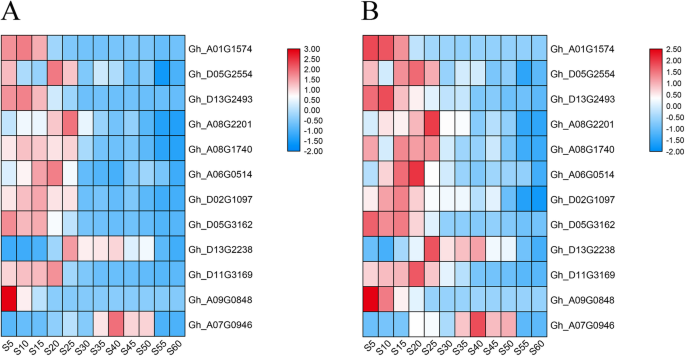
为了验证RNA-seq结果和所鉴定的DEGs,我们选择了12个与脂肪酸合成相关的基因,其中6个与脂肪酸去饱和相关,通过qRT-PCR进行验证。qRT-PCR检测所选基因的相对表达量和表达趋势与RNA-seq检测结果高度一致(图2)。2),表明高度可靠的RNA-SEQ结果。
通过RNA-seq分析确定的棉籽12个发育阶段12个选择基因的相对表达量的热图(一个)和qrt-pcr(b).所选基因包括:ACC(Gh_A01G1574和gh_d05g2554),KASII(gh_d13g2493和Gh_A08G2201),法达(gh_a08g1740),FATB(Gh_A06G0514),悲伤的(gh_d02g1097和Gh_D05G3162),FAD2(gh_d13g2238和Gh_D11G3169),FAD3(Gh_A09G0848和Gh_A07G0946).s5、S10、S15、S20、S25、S30、S35、S40、S45、S50、S55、S60分别代表5、10、15、20、25、30、35、40、45、50、55、60 DPA
基因本体分析DEGS
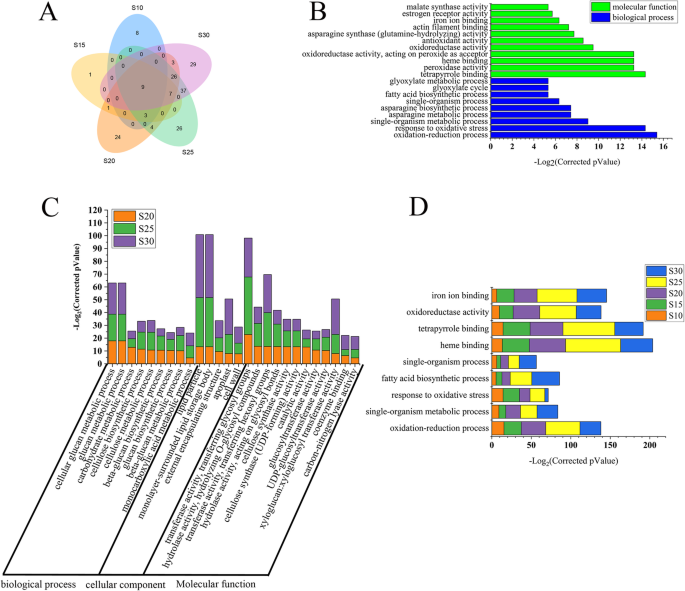
为了深入了解DEGs的生物学功能,我们利用5 DPA与其他时间点差异表达的基因进行了基因本体论(GO)分析。共鉴定出15647个非冗余DEGs,并富集308个氧化石墨烯(GO)项(见表)S4).各脂肪酸组分相对含量在5 ~ 30 DPA时变化显著,30 DPA后趋于相对稳定。在10-30 DPA中鉴定出的11645个非冗余DEGs富集了178个GO项。在10、15、20、25和30 DPA条件下,分别富集了20、21、77、112和111个氧化石墨烯,每个时间点都有8、1、24、26和29个氧化石墨烯。3.a).富集的氧化石墨烯项目数量在10和15 DPA时显著少于其他时间点(图4)。3.a, b).在10 - 30 DPA的deg中发现了9个普遍富集的氧化石墨烯(GO)项,它们与脂肪酸生物合成和氧化还原相关过程有关(图)。3.d).除了这些氧化石墨烯在所有时间点均富集外,在15 ~ 20 DPA、20 ~ 25 DPA和25 ~ 30 DPA之间分别发现1、4和37个普遍富集的氧化石墨烯(图4)。3.a)和26个Go项目通常富集在20,25和30dPa三个时间点(图。3.C,表格S5).在35-60 DPA中,有34个GO项显著富集。此外,脂肪酸合成酶活性、脂肪酸代谢和脂肪酸生物合成过程是35-60 DPA中普遍富集的氧化石墨烯项目(表)S6).
通过对不同组间的DEGs进行GO分析发现,在生物过程方面,这些DEGs主要与脂肪酸、脂类等代谢过程有关;在细胞成分方面,涉及细胞部分和细胞膜;其主要分子功能为结合、裂解和催化活性。这些结果表明,脂肪酸合成和代谢相关途径主要富集在棉籽发育早期,细胞成分和分子功能相关基因富集在棉籽发育中期。
deg的KEGG通路
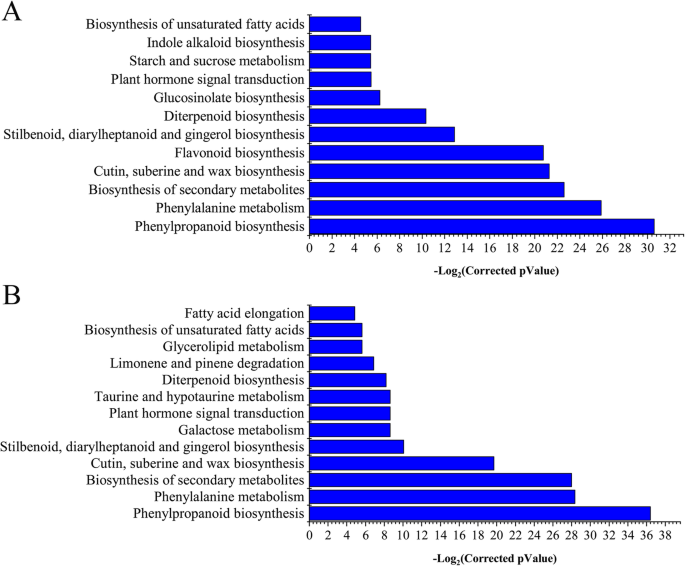
进一步通过通路分析确定DEGs的功能。在15647个10 ~ 60 DPA的非冗余DEGs中共发现122条富集的KEGG通路(表)S7).许多显着改变的途径与脂肪酸伸长率的代谢,不饱和脂肪酸的生物合成,以及与脂肪酸组分的合成有关的α-亚麻酸代谢(表S8).一般来说,C18:3n-3主要是在种子发育的早期(5 DPA左右)合成的。10 DPA富集的KEGG通路包括苯丙氨酸、丙氨酸、天冬氨酸和谷氨酸的代谢,苯丙氨酸、单萜类、硫代葡萄糖苷和角质、亚麻氨酸和蜡的生物合成。在20 DPA时,类黄酮、二萜和不饱和脂肪酸的生物合成途径富集(图。4一、表S8).FAD2(gh_d13g2238和GH_A13G1850),FAD3(Gh_A09G0848和Gh_D09G0870)是这些途径的组分(图。S3B). 25 DPA富集的途径也与不饱和脂肪酸的生物合成和脂肪酸的伸长有关(图2)。4b,表S8).在脂肪酸延伸途径的13个DEGs中,12个编码3-酮基辅酶a合成酶(图)。S3C). 30 DPA的富集途径与25 DPA的富集途径相似。我们发现在35、40、45和50 DPA棉籽中脂肪酸途径延伸量显著增加,而在60 DPA棉籽中脂肪酸降解途径显著增加(表1)S9),这可能解释为什么脂肪酸的相对含量倾向于在晚期开发阶段稳定。
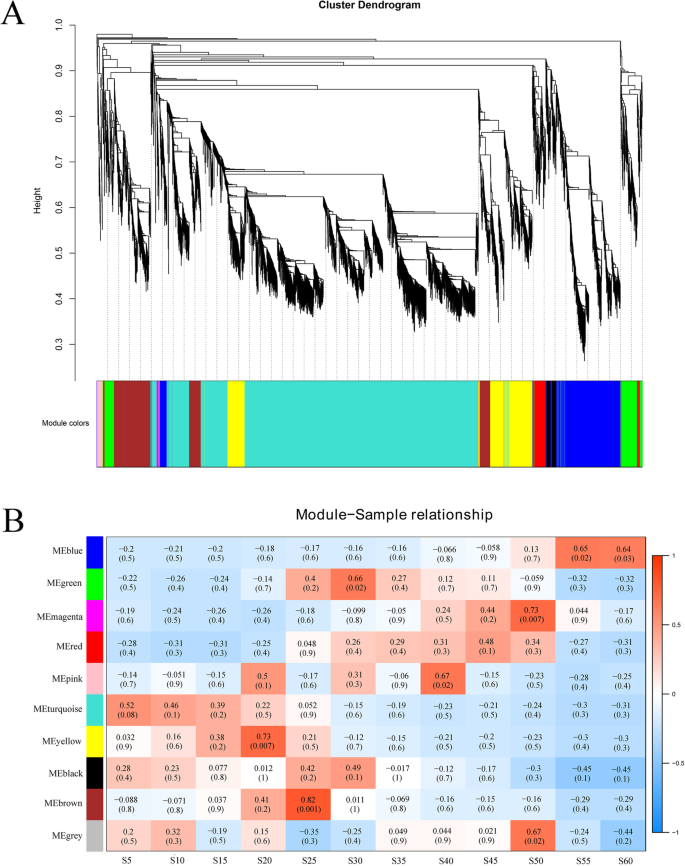
WGCNA基因网络分析
通过WGCNA分析,全面了解棉籽发育过程中调控脂肪酸合成的基因网络。利用5 DPA与其他时间点之间鉴定的15647个非冗余DEGs进行分析,共鉴定出与不同样本特异性表达谱相关的10个基因模块(图)。5a).在这10个基因模块中,有6个(黄色、棕色、绿色、粉色、品红和蓝色)与棉籽发育的中期和(或)后期显著相关,没有基因模块与棉籽发育的早期(5 - 15 DPA)显著相关,但绿松石基因模块在5 DPA时略微显著(图5)。5b).含有861个基因的黄色模块与20个DPA高度相关。brown(870个基因)模块与25dpa显著相关。绿色模块(400个基因)和粉色模块(74个基因)分别与30和40 DPA显著相关。品红模块中有33个基因与50 DPA显著相关,蓝色模块中有1037个基因与55 DPA显著相关(图)。5b).对这六个模块的3275个deg进行KEGG分析。黄、棕、粉和品红的基因模块中均富含α-亚麻酸代谢相关基因。5种DPA种子中C18:3n-3的相对含量较高(7.44%),20种DPA种子中C18:3n-3的相对含量显著降低至0.55%(表2)1),与重大下调的一致GhFAD3(Gh_A09G0848和Gh_D09G0870), 20dpa(图。1)和C18:3n-3作为茉莉酸和氧酸生产前体物质,参与茉莉酸和氧酸生物合成的α-亚麻酸代谢途径基因在20 DPA表达上调(表S10).此外,在25dPa,棕色模块也与脂肪酸代谢和生物合成途径有关;粉红色模块和蓝色模块都富含亚油酸代谢途径所涉及的基因(表S10).
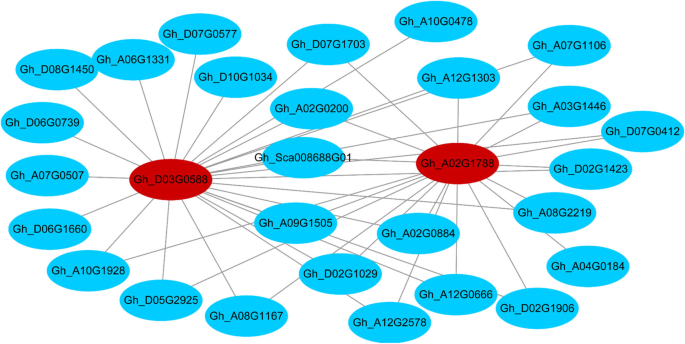
与脂肪酸合成相关的共表达基因网络和枢纽基因
根据棉籽发育期间脂肪酸相对含量的变化和基因网络分析的结果,选择黄色和棕色模块用于共表达分析以鉴定模块的轮毂基因。基于基于EIGENGENE的连接的标准(K我)值≥0.89,边权值≥0.5,则有29个基因在棕色模组中共表达。gh_d03g0588和gh_a02g1788编码SAD的基因被鉴定为棕色模块的中心基因(图。6).在25 dpa,gh_d03g0588和gh_a02g1788显著上调(图。6,表11).此时,C18:0的相对含量显着下降,表明大多数C18:0-ACP可能已被用于合成C18:1N-9-ACP,由于显着增加的表达水平悲伤的基因。然而,C18:1N-9的相对含量没有显着增加,表明C18:1N-9-ACP至C18:1N-9和最终C18:2N-6的快速去饱和和转化,在棉籽中主要不饱和脂肪酸(桌子1).
讨论
棉不仅是最重要的纤维作物,还有一个重要的石油作物。我们的研究结果表明,棉籽油中SFA的含量相对较高(超过C16:0的20%)。这意味着长期消费棉籽油可能会增加心血管疾病的发生率。在光和高温条件下容易被氧化和不稳定的PUFA也相对较高(高达60%),而C18:1N-9的含量,脂肪酸是稳定和有益的人体健康棉籽油只有15.6%,橄榄油的低于75.7%[28],油菜籽油55.9-72.0%[29], 28.0%含葵花籽油[2],芝麻油41.5%[2棕榈油42.9%,豆油中29.1%[28].因此,有效提高棉籽油中C18:1n-9的含量,对提高棉籽油的营养品质具有很大的实用价值。
了解植物脂质代谢是提高油质和油产量增加的基础。植物中储存油生产的生化途径已经充分了解。然而,调节油脂作物中脂肪酸合成和控制总油含量的因素仍然待阐明[30.,31].根据我们的研究,C16:0,C18:0和C18:3N-3主要在棉籽发育过程中在5-15 dPa中合成。C18的合成:2N-6主要发生在种子发育的中期和晚期。这些脂肪酸组分在油积累期间彼此明显相关。通常,C18:2N-6的增加伴随着其他脂肪酸组分的减少,特别是C18:3N-3,其在60dPa下从5dPa的7.44%降低至0.02%。与15 dPA,C16:0和C18:0的最高含量相比,分别在成熟的棉籽中减少了50%和近6次。C18:1N-9和C18:2N-6占成熟棉籽中所有脂肪酸成分的70%以上,是确定棉籽的总油含量的主要脂肪酸组分。
C18:1N-9含量在棉籽中的含量相当窄,棉质种质资源相当窄[32],采用常规育种方法难以培育出C18:1n-9高的棉花品种[33].了解脂肪酸合成关键基因的表达特点和功能是提高棉籽油品质的前提。编码脂肪酸合成关键酶的基因表达已被证明是组织和发育阶段特异性的[34.].我们发现,上调和下调的DEG分别主要观察到15-40dPa和45-60dPa(图。S2A),与之前在转录组测序实验中报告的结果一致[22].大部分脂肪酸组分相对含量在30 DPA后开始下降,其中含量最丰富的组分C18:2n-6在25 DPA后趋于稳定1).与此观察一致的是,在30 DPA和20 DPA比较中,下调的DEGs富集了与脂肪酸生物合成相关的氧化石墨烯项(表S12).在大豆中还报告了类似的结果[35.].通过对富集和DEG的富集和Kegg途径的分析,发现脂肪酸生物合成,脂肪酸代谢和Cutin和Cutin和Pux Biosynesis参与了棉籽的早期发育。已经提出了这一点GhFAD2当C16:0和C18:0的含量超过一定阈值时,表达增加,快速积累大量的C18:2n-6 [3.].我们发现GhFAD2较20 DPA显著增加(图2)。1).由此可见,C18:2n-6的含量从20 DPA开始显著增加,在40 DPA时达到最大值1).当底物量低于阈值时,表达水平GhFAD2被下调,并趋于相对稳定。然后,在种子中合成了长链脂肪酸成分及其衍生物,如蜡类成分。通过对棉籽发育过程中的基因表达谱分析,GhFAD3(Gh_A09G0848和Gh_D09G0870)在5 dpa高度表达,并在20 dPA下显着降低。在25 dpa进一步减少后,GhFAD3维持在30 ~ 60 DPA的极低表达水平。的表达式概况GhFAD2和GhFAD3说明这两种酶在棉籽发育过程中对脂肪酸组分的含量具有重要的调节作用。
棉花具有复杂的异源四倍体基因组,基因复制会导致功能冗余和多样化。已有研究表明,~ 30%的棉花同源基因在纤维发育过程中存在显著的A-或d偏倚[36.].我们发现在快速油累积期(10-30dPa)期间的Degs偏向于D亚基因组(表S.13).这与在Dt同源基因中发现高表达脂肪酸合成基因的结果一致[37.].基于WGCNA和共表达基因网络的分析悲伤的基因(gh_a02g1788和gh_d03g0588)编码可溶性去饱和酶,可将饱和C18:0转化为不饱和C18:1n-9 [38.鉴定为与25dPa的不饱和脂肪酸含量高度相关的候选轮毂基因。悲伤的在发育的棉籽,导致只有2-3%的C18的高活性:0在种子油在成熟,但C18:0含量可显著增加沉默的表达悲伤的基因(10].值得注意的是,最高表达水平悲伤的(gh_a02g1788和gh_d03g0588)在25dPa下,与其在显影胚珠中的优先表达一致,尤其是在25dpa [39.,40].C18:0含量从15 DPA到25 DPA的持续下降伴随着C18:1n-9含量的增加,这与结果一致悲伤的在确定饱和脂肪酸与不饱和脂肪酸的比例时起着决定性作用[38.].此外,活动悲伤的因此,基因和所以C18:1N-9含量在衰老调节,真菌感染抗性和机械损伤反应中起重要作用[39.,41.,42.,43.,44.].
由于其低比重和高能量含量,脂肪是营养物的最经济有效的存储形式。期间棉籽发展,饱和C16的相对含量:0总是在20%以上,这表明C16的重要性:在种子发育和生理活性0。C16:0是也为其它脂肪酸生物合成之后的前体。多不饱和脂肪酸不仅是细胞的主要结构成分,还能起到种子萌发的重要作用,生理活性和抗恶劣环境[3.].在种子成熟过程中,PUFAs含量逐渐增加,成熟棉籽中C18:2n-6含量超过50%。C18:3n-3也是许多其他脂类和茉莉酸(JA)通过十八烷类途径生物合成的重要底物。虽然C18:3n-3的含量从20 DPA大幅降低,但通过观察棉花花药中仅剩1-2%的C18:3n-3可育性,认为棉花中C18:3n-3合成JA的阈值要求很低[25].高水平的C18:2N-6有助于种子萌发和低温和盐条件下的早期幼苗生长[45.].棉籽中PUFA的最高含量为C18:2N-6,而不是C18:3N-3。在棉籽发育期间,C18:2N-6至C18:3N-3的比例显示在图2中。S4.棉籽中脂肪酸成分的这种积累模式不是偶然的,而是与植物自卫和保护后代机制密切相关的自然选择的结果。
结论
调查的内容之间的相关性不同脂肪酸组件和关键基因的表达模式负责脂肪酸生物合成是一个必要步骤理解脂肪酸代谢的调节和也是一个有效的方法探索的关键基因的生理意义和策略提高棉籽油品质。本研究对棉籽中脂肪酸生物合成基因表达水平的动态变化与主要脂肪酸积累之间的关系有了一定的了解,但大多数DEGs的生物学功能尚待进一步研究。
材料和方法
植物材料
棉(G. Hirsutum在石河子地区田间栽培了新陆早(L. cv .新陆早)植株。花朵在盛开的那天被贴上了标签。分别在花后5、10、15、20、25、30、35、40、45、50、55和60 d采铃。研究和收集这些样本不需要许可。从棉铃中分离出种子,置于−80℃冰箱中保存备用。采用5-60 DPA去皮种子进行脂肪酸含量测定和转录组分析。
脂肪酸分析
采用外标法测定各样品中脂肪酸组分的含量。37种已知浓度的脂肪酸甲酯(Sigma-Aldrich)用正己烷稀释2,5,10,20,40倍S1)分别用于建立C14:0,C16:0,C18:0,C18:1N-9,C18:2N-6和C18:3N-3的定量标准曲线(图。S1).将种子研磨成粉末用液氮,然后使用真空冷冻干燥器冷冻干燥。For each analysis, 1 g freeze-dried sample was transferred into glass tube, and oil was extracted using Soxtherm apparatus (Gerhadt). Then, 5 ml 0.4 M KOH-methanol and 5 ml hexane were added and mixed. The solution was transferred into vials and shaken for 30 min at 40 °C.随后使用上正己烷层进行GC-MS分析。
根据Liu et al.(2019),使用GCMS-QP2020 (Shimadzu, Japan)在70 eV的电子电离条件下,使用HP-88色谱柱(100 m × 0.2 mm)和0.2 μm的薄膜厚度进行定性和定量分析。[25].The details were as follows: after split/splitless injection at 250 °C and incubation in oven for 2 min at 40 °C, the temperature was increased to 240 °C at a rate of 4 °C/min and then held at 240 °C for 15 min. Helium was used as the carrier gas with a constant flow rate of 2 mL/min. A volume of 1.0 μL was injected and the injection mode was split with a ratio of 10:1. The ion source and interface temperature was set to 200 °C and 250 °C, respectively. The mass scan range was m/z 40–500 and the solvent delay time was set to 13 min. The quantification was carried out according to the response value of quantitative ions and the established standard curve. Each test was repeated three times, and the content of each fatty acid component was calculated as the percentage of total measured fatty acids.
RNA分离,图书馆制备和测序
使用制造商的方案之后使用Trizol试剂(Invitrogen)提取总RNA。使用Nanophotometer®分光光度计(旨在)检查RNA纯度。使用Qubit®2.0叶片(Life Technologies)中的Qubit®RNA测定试剂盒测量RNA浓度。使用具有BioAnalyzer 2100系统(Agilent)的RNA纳米6000测定试剂盒评估RNA完整性。使用Nebnext®Ultra™RNA库预备套件用于Illumina®(NEB)的3μg每样样品的总量为3μgRNA作为文库制备的输入材料。图书馆在Illumina Hiseq平台上测序。使用Hisat2 V2.0.5,配对结束清洁读数与TM-1参考基因组对齐[23]。FeatureCounts v1.5.0-p3用于将映射到每个基因的读数计数。基于基因的长度和映射到基因的读数的数量来计算每个基因的FPKM。
差异表达,基因函数注释和富集分析
采用DESeq R包(1.18.0)通过负二项分布和计算错误发现率进行差异表达分析[46.].调整后的假定值< 0.05 and (|log .2(倍数变化)|≥2被用作样品之间DEGS的识别标准。基因本体论(GO)DEGS的富集分析由GO SEQř包,其中基因长度偏倚修正实现。GO条款与修正假定值小于0.05被认为是要被显著富集。KOBAS软件用于测试DEGS的统计富集KEGG途径。
DEGs的定量RT-PCR验证
采用NCBI Primer-BLAST程序,利用目的基因的cDNA序列设计基因特异性引物(见表)S2).如Cheng等人所述进行QRT-PCR。(2020)[47.].三个独立的生物实验,每个时间点的样品进行。相对表达水平与棉遍在蛋白基因计算(Ghubi., XM_012634824)作为参考,根据Cheng等(2020)[47.].
构建deg的共表达网络
利用加权相关网络分析(WGCNA)软件包构建了不同发育阶段种子中与脂肪酸合成相关的DEGs之间的共表达网络。在模块的基础上筛选hub基因K我值和高权重值。使用Cytoscape 3.6.1绘制相关网络。
可用性数据和材料
所有基因ID和注释文件均可从CottonGen (https://www.ctongen.org.).本研究中产生或分析的所有其他数据均包含在本手稿中。
缩写
- DPA:
-
天Post-Anthesis
- C14:0:
-
肉豆蔻酸
- 0:
-
棕榈酸
- C18:0:
-
硬脂酸
- C18:1n-9:
-
油酸
- C18:2n-6:
-
亚油酸
- C18:3n-3:
-
亚麻酸
- 美国:
-
饱和脂肪酸
- 多不饱和脂肪酸:
-
多不饱和脂肪酸
- MUFA:
-
单一不饱和脂肪酸
- 呃:
-
内质网
- 是:
-
茉莉酸
- 度:
-
差异表达基因
- 存在:
-
定量实时聚合酶链反应
- RNA-SEQ:
-
RNA测序
- 走:
-
基因本体论
- KEGG:
-
京都基因和基因组百科全书
- WGCNA:
-
加权相关网络分析
- K我:
-
基于EIGENGENE的连通性
- FPKM:
-
每千碱基的片段每百万映射读取
参考
- 1.
Baum的SJ,克里斯-埃瑟顿PM,威利特WC,列支敦士登AH,鲁德尔LL,希KC等人。脂肪酸对心血管健康和疾病:全面更新。Ĵ临床碘油。2012; 6(3):216-34。https://doi.org/10.1016/j.jacl.2012.04.077.
- 2.
Orsavova J,Misurcova L,Ambrozova JV,Vicha R,MLCEK J.脂肪酸的植物油组成及其对膳食能量摄取和依赖心血管死亡率对脂肪酸饮食摄入的贡献。int j mol sci。2015; 16(6):12871-90。https://doi.org/10.3390/ijms160612871.
- 3.
刘F,赵yp,朱·赫,朱Qh,Sun J.同步沉默GhFAD2-1和ghfatb.提高高油酸棉籽油的品质。acta botanica yunnanica(云南植物研究). 2017;https://doi.org/10.1016/j.jplph.2017.06.001.
- 4.
椰子油、黄油和红花油对中度胆固醇水平升高人群血脂和脂蛋白的影响。中国医药科学(英文版);https://doi.org/10.1016/s0022 - 2275 (20) 41497 - x.
- 5。
Carvalho AG, Silva KA, Silva LO, Costa AM, Akil E, Coelho MA,等。Jussara贝瑞(Euterpe Edulis.水包油乳液是高度稳定的:水果油中天然抗氧化剂的作用。中国农业科学。2019;99(1):90-9。https://doi.org/10.1002/JSFA.9147.
- 6。
研究贮藏条件对Chemlali橄榄油品质的影响及脂肪酸烷基酯对橄榄油真实性的有效检测作用。食品化学。2015;169:289 - 96。https://doi.org/10.1016/j.foodchem.2014.07.118.
- 7。
周勇,赵伟,赖勇,张斌,张丹。食用植物油的全球现状、健康问题与展望。植物学报。2020;11:1315。https://doi.org/10.3389/fpls.2020.01315.
- 8。
Horn PJ, Sturtevant D, Chapman KD。改性棉籽油中甘油三酯的含量、组成和组织特异性分布都发生了变化。Biochimie。2014;96:28-36。https://doi.org/10.1016/j.biochi.2013.08.010.
- 9.
威尔逊射频。基因组学和生物技术在实现全球高油植物油粮食安全中的作用。石油学报。2012;61(7):357-67。https://doi.org/10.5650/jos.61.357.
- 10.
刘强,辛格SP, Green AG。发夹rna介导的转录后基因沉默产生的高硬脂和高油酸棉籽油。植物杂志。2002;129(4):1732 - 43。https://doi.org/10.1104/pp.001933.
- 11.
汤玛斯,车勇,金卡。不同脂肪酸组成植物油对高脂饮食诱导的肥胖和结肠炎症的影响。植物营养学报。2020;14(5):425-37。https://doi.org/10.4162/nrp.2020.14.5.425.
- 12.
Kinney AJ, Cahoon EB, Hitz WD。转基因作物中去饱和酶活性的调控。生物化学学报2002;30(p6): 1099-103。https://doi.org/10.1042/bst03099.
- 13.
单不饱和脂肪酸、橄榄油和健康状况:系统综述和队列研究的荟萃分析。脂质健康杂志。2014;13(1):154。https://doi.org/10.1186/1476-511X-13-154.
- 14。
Shanklin J,CAHOON EB。脂肪酸的去饱和和相关修饰。Annu Rev植物植物植物Mol Biol。1998; 49(1):611-41。https://doi.org/10.1146/annurev.arplant.49.1.611.
- 15.
Buhr t,sato s,ebrahim f,xing a,zhou y,mathiesen m等。Staswick P;汤姆克莱门特。RNA转录物的核酶终止在转基因大豆中下调种子脂肪酸基因。工厂J. 2002; 30(2):155-63。https://doi.org/10.1046/j.1365-313X.2002.01283.x.
- 16。
范AT,香农,杜兰特。突变体的组合FAD2和FAD3生产高油酸低亚麻酸大豆油的基因。中国科学(d辑:地球科学)2012;https://doi.org/10.1007/s00122-012-1849-z.
- 17。
彭强,胡勇,魏锐,张勇,管超,阮勇,等。同时沉默FAD2和FAE1.基因影响油酸和芥酸含量芸苔属植物显著种子。植物学报2010;29(4):317-25。https://doi.org/10.1007/s00299-010-0823-y.
- 18。
Miller JF,Zimmerman DC,Vick Ba。向日葵油中高油酸含量的遗传控制。农作物科学。1987; 27(5):923-6。https://doi.org/10.2135/cropsci1987.0011183X002700050019x.
- 19.
Chapman KD, Austin-Brown S, Sparace SA, Kinney AJ, Ripp KG, Pirtle IL等。转基因棉花植株籽粒油酸含量增加。石油化学学报。2001;78(9):941-7。https://doi.org/10.1007/S11746-001-0368-Y..
- 20.
曲静,毛洪志,陈伟,高树清,白银,孙玉文,等。提高种子油酸水平的无标记转麻疯树植株的开发。Biotechnol生物燃料。2012;5(1):10。https://doi.org/10.1186/1754-6834-5-10.
- 21.
赫呒,丁NZ。植物不饱和脂肪酸:在应激反应多个角色。前植物SCI。2020; 11:562785。https://doi.org/10.3389/fpls.2020.562785.
- 22.
赵y,王y,黄y,崔y,华J.基因储存网络在旱地棉中发育胚胎和脂肪酸组成中的表达谱。J植物理性。2018; 228:101-12。https://doi.org/10.1016/j.jplph.2018.06.002.
- 23.
高等植物中的乙酰辅酶a羧化酶:除禾本科植物外,大多数植物都有这种酶的原核和真核形式。植物生理学报。1996;37(2):117-22。https://doi.org/10.1093/oxfordjournals.pcp.a028920.
- 24.
Pidkowich MS, Nguyen HT, Heilmann I, Ischebeck T, Shanklin J.调节种子-酮酰基-酰基载体蛋白合酶II水平,将温和的种子油的成分转化为类似棕榈的热带油。中国科学院院刊2007;104(11):4742-7。https://doi.org/10.1073/pnas.0611141104.
- 25.
萨拉斯JJ,奥罗格JB。植物FatA和FatB酰基- acp硫酯酶底物特异性的表征。生物化学学报。2002;43(1):25-34。https://doi.org/10.1016/s0003 - 9861 (02) 00017 - 6.
- 26。
刘F,MA L,王Y,Li Y,Zhang X,Xue F,等。GhFAD2-3是陆地棉花药发育所必需的。植物学报。2019;19(1):393。https://doi.org/10.1186/s12870-019-2010-9.
- 27。
张涛,胡勇,姜伟,方磊,关旭,陈建军,等。异源四倍体棉花的测序(陆地棉- l.acc。TM-1)提供了一种用于纤维改进的资源。NAT BIOTECHNOL。2015; 33(5):531-7。https://doi.org/10.1038/nbt.3207.
- 28。
Alves AQ, da Silva VA Jr, Góes AJS, Silva MS, de Oliveira GG, Bastos IVGA, de Castro Neto AG, Alves AJ。植物油脂肪酸组成及其在伤口护理中的应用。皮肤病杂志。2019;32(8):1-8。https://doi.org/10.1097/01.ASW.0000557832.86268.64.
- 29。
链接本文:Pospišil M, Škevin D, Mustapić Z,等。近期油菜杂交种和00个品种油脂脂肪酸组成分析。中国农业科学。2007;72(3):187-93。
- 30.
杨松,苗丽,何军,张凯,李勇,盖建军。大豆籽粒油脂积累的转录组动态变化。中华医学杂志。2019;20(9):2202。https://doi.org/10.3390/ijms20092202.
- 31。
何敏,秦春霞,王旭,丁nz。植物不饱和脂肪酸:生物合成与调控。植物学报。2020;11:390。https://doi.org/10.3389/fpls.2020.00390.
- 32.
多德MK,博伊金DL,梅雷迪思WRJr;坎贝尔BT,FM Bourland,Gannaway JR,玻璃公里,距国家棉花品种试验棉籽基因型张J.脂肪酸谱。J棉SCI。2010; 14:64-73。
- 33.
Sturtevant D,Horn P,Kennedy C,Hinze L,Percy R,Chapman K.脂质代谢产物在各种Gossymium Rassications种子中:高油酸突变等位基因的分子鉴定。Planta。2017; 245(3):595-610。https://doi.org/10.1007/s00425-016-2630-3.
- 34.
Banilas G,Karampelias男,Makariti I,Kourti A,HATZOPOULOS P.橄榄DGAT2基因是发育调控的基因,具有重叠但不同的表达模式DGAT1.J Exp Bot。2011; 62(2):521-32。https://doi.org/10.1093/jxb/erq286..
- 35.
陈辉,王富武,董媛媛,王宁,孙艳萍,李晓燕,等。序列挖掘和转录谱研究大豆种子发育过程中与脂类生物合成相关的差异表达基因。植物学报。2012;12(1):122。https://doi.org/10.1186/1471-2229-12-122.
- 36.
Hovav R, Udall JA, Chaudhary B, Rapp R, Flagel L, Wendel JF。多倍体植物单细胞发育和进化过程中复制基因的分区表达。中国科学院院刊2008;105(16):6191-5。https://doi.org/10.1073/pnas.0711569105.
- 37.
Hovav R,Faigenboim-Doron A,Kadmon N,Hu G,Zhang X,Gallagher JP等人。用于显影多倍体棉种子的转录组型材。植物基因组。2015; 8:1。
- 38。
Ohlrogge JB,JG贾沃斯基。的脂肪酸合成的调节。Annu启植物生理学。1997; 48(1):109-36。https://doi.org/10.1146/annurev.arplant.48.1.109.
- 39。
尚X,程C,Ding J,Guo W.鉴别棉棉花基因家族的候选基因测定棉籽油组合物。Mol Gen Genomics。2017; 292(1):173-86。https://doi.org/10.1007/s00438-016-1265-1.
- 40.
《棉花生理学》。纽约:施普林格;2010.
- 41.
Kachroo A, Fu DQ, Havens W, Navarre D, Kachroo P, Ghabrial SA。油酸介导的途径诱导大豆的结构性防御信号,增强大豆对多种病原菌的抗性。植物与微生物学报。2008;21(5):564-75。https://doi.org/10.1094/mpmi-21-5-0564.
- 42。
江CJ,Shimono M,Maeda S,Inoue H,Mori M,Hafegawa M,等。抑制水稻脂肪酸去饱和酶基因OsSSI2提高水稻对稻瘟病和叶枯病的抗性。植物与微生物学报。2009;22(7):820-9。https://doi.org/10.1094/MPMI-22-7-0820.
- 43。
植物防御中的脂肪酸衍生信号。植物病理学杂志。2009;47(1):153-76。https://doi.org/10.1146/annurev-phyto-080508-081820.
- 44.
张Y,Maximova SN,Guiltinan MJ。硬脂酰基载体蛋白去饱和酶基因家族树巧克力的表征,Theobroma可可L.前植物SCI。2015; 6:239。
- 45.
张j,刘h,sun j,李b,zhu q,陈s等。拟南芥种子萌发期间耐盐性耐盐性和早期幼苗生长需要脂肪酸去饱和酶FAD2。Plos一个。2012; 7(1):E30355。https://doi.org/10.1371/journal.pone.0030355.
- 46.
控制错误发现率:一种实用而强大的多重检测方法。[J R Stat Soc Ser B method . 1995; 57:289-300 .]
- 47.
程晓强,张学勇,薛峰,朱胜,李永军,朱庆华,等。棉花显性雄性不育突变体的特征及转录组分析。acta botanica botanica(云南植物研究),2019;https://doi.org/10.1186/s12870-020-02522-0.
致谢
不适用。
资金
这项工作是由中国国家自然科学基金[31960369,31660353]支持。供资机构在研究和收集,分析和解释数据的设计,并以书面的稿子没有作用。
作者信息
从属关系
贡献
F L, J S和L- h Ma策划和设计了本研究。马丽红,程学强,王超,张学勇,薛峰,李永杰,李福,李俊生等进行了实验、野外调查、数据分析等。手稿由FL, L-H Ma和Q-H Zhu撰写。马立宏、程晓卿对这项工作贡献相当。所有作者阅读并批准了手稿的最终版本。
相应的作者
道德声明
相互竞争的利益
作者报告没有利息申报。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:图S1。
气相色谱-质谱法测定棉籽中主要脂肪酸甲酯的定量标准曲线及相关系数。图S2。5 - 60dpa差异表达基因的数量和分布。A, 5 - 60dpa下上调或下调的DEGs数量。维恩图显示了不同棉籽发育阶段的差异基因重叠或每个发育阶段的差异基因。图S3。Heatmap比较与棉籽发育阶段相关的比较。A,Venn图表在五个阶段显示了不同的Keggs。B和C显示了与5,10,15,20,25和30dPa的功能类别相关联的DEG。b显示与不饱和脂肪酸的生物合成相关的次数。红色代表高表达,绿色代表低表达。每行代表DEG.S5,S10,S15,S20,S25和S30分别代表5,10,15,20,25和30dPA。图S4。棉籽发育期间C18:2N-6至C18:3N-3的比例
附加文件2:表S1。
通过GC-MS为37组分脂肪酸甲酯的标准混合物的组成,保留时间和片段离子。表S2。用于qRT-PCR分析的引物。表S3。RNA-seq读取和mapping结果的统计。
附加文件3:表S4。
氧化石墨烯对15647个非冗余DEGs的富集分析
附加文件4:表S5。
分析氧化石墨烯从20DPA富集到30DPA
附加文件5:表S6。
分析氧化石墨烯从35DPA富集到60DPA
附加文件6:表S7。
KEGG富集15647种常见DEGs的分析
附加文件7:表S8。
DEGs的KEGG富集分析
附加文件8:表S9。
在35-60dPa的Kegg富集分析
附加文件9:表S10。
关键KEGG通路基因在六个模块中富集
附加文件10:表S11。
棕色模块中的候选集线器基因
附加文件11:表S12。
在对20 DPA的30 DPA的下调的DEGS GO富集分析
附加文件12:表S13。
棉花种子发育过程中同源基因偏表达的DEGs数量
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
马,L.,程,X.,王C.等等。探索在棉籽中调节脂肪酸组成的基因网络。BMC植物BIOL.21,177(2021)。https://doi.org/10.1186/s12870-021-02952-4
收到了:
接受:
发表:
关键词
- gossypium hirsutum
- 度
- 转录组分析
- 脂肪酸部件
- Co-expression网络