摘要
背景
稻田中虫害的爆发每年都会造成全球水稻产量的严重损失,预计持续的气候变暖将加剧这一威胁。尽管水稻抗病基因的筛选、克隆和导入现代品种的研究取得了重大进展,但改良的水稻抗病基因仅对咬食昆虫和取食韧皮部昆虫有效。
结果
在这项研究中,标准和改性种子盒筛选的结果始终如一地表明,先前已知的Leaffolder耐水稻品种,Quingliu也适度抵抗棕色Planthopper(BPH)。高通量RNA测序显示在侵扰位点的差异差异表达的基因(DEGS)较多,在叶片的叶片中的2720°°叶片与叶片的鞘中的瓣膜和450摄氏度在叶片中的450°C叶片以用于BPH侵扰的叶片。叶片特异性转录组揭示了通过激活茉莉酸生物合成基因和调节shikimate和苯丙醇的基因来响应Leaffolder饲料,这对于水杨酸,褪黑素,黄酮和木质素防御化合物的生物合成至关重要。鞘鞘细胞的转录组显示,清水通过诱导水杨酸响应基因和控制蜂窝信号传导级联的那些作出反应BPH侵扰。总而言之,这些基因可以在触发防御机制中发挥作用,例如细胞壁修饰和围巾形成。
结论
本研究着重介绍了一种罕见的水稻品种青柳的关键防御反应,该品种对两种不同食草动物食性组织的攻击具有抗性。青柳是采叶者,而BPHs是韧皮部者,因此青柳具有双重抗性。虽然清柳对两种害虫的防御反应存在较大差异,但苯丙素途径(更确切地说是苯丙氨酸解氨酶基因)可能是一个收敛的上游途径。然而,这种可能性需要进一步研究。这一信息对水稻品种广谱抗虫育种具有重要意义。
背景
米饭(栽培稻l)在一百多个国家的1.6亿公顷土地上种植,每年大约生产4.91亿吨精米[1].大米是世界上一半人口最重要的主食,特别是在亚洲和非洲。2].然而,昆虫害虫对全世界的稻米种植构成长期威胁[3.].有超过100种喂养昆虫害虫,其中大约20种被认为是严重影响水稻产量的主要害虫[4.].最近,频繁和广泛爆发了大米的主要虫害,包括棕色Planthopper(BPH;褐飞虱)和稻叶植物(藏红花),每年造成数亿美元的损失,并威胁粮食安全[3.那5.].害虫对水稻植株造成严重损害,因为这些害虫在温暖潮湿的肥沃稻田中茁壮成长[6.].此外,预计稻田虫害的害虫侵蚀将变得更加猖獗,在加热气候中变得更加猖獗,这增加了昆虫的代谢率和人口生长[7.].
超过50年,喷洒化学杀虫剂是管理作物害虫的主要策略[8.]. 然而,杀虫剂的滥用危害了食品安全,破坏了生态和环境的完整性,可能导致害虫的二次暴发[9.]. 因此,不同国家的决策者开始采取无害环境的虫害管理战略,尽量减少杀虫剂的使用[10.].例如,综合害虫管理(IPM)是一种长期,环保的策略,旨在通过文化实践,生物控制和抗性品种的使用组合来控制害虫[11.].关于后者,在过去几十年中,在水稻种质中筛选抗虫基因的抗虫基因,表征宿主抗性的分子机制,并将抗性基因渗入现代栽培品种[12.].迄今为止,在水稻种质中已鉴定出34个抗褐飞虱的位点,其中14个已克隆,5个已完成功能鉴定(Bph3公司那BPH14.那BPH18.那BPH26.和BPH29.),而只有不到10个基因已渗入现代水稻品种[12.那13.].
食米害虫有不同的食行会,但一般可分为咀嚼虫和刺吸虫两类[14.].咀嚼昆虫(如Leaffolders和Stew Borers)有撕下撕裂并咀嚼叶子的嘴巴,导致饲养植物的广泛机械伤害[15.].机械伤口提示茉莉酸(JA)生产和信号通路,激活氧化突发等防御机制,JA响应基因的诱导和胰蛋白酶蛋白酶抑制剂的产生,其延缓了咀嚼昆虫的饲养和生长[12.].另一方面,吸刺害虫,如飞虱和叶蝉,具有特殊的细长、锥形花柱口器,可以穿透表皮细胞的外质体空间,吸韧皮部的汁液[16.].料斗也是植物病毒的载体,导致植物的二次损害[17.].以前的研究表明,水稻植株对BPH摄食的反应诱导了水杨酸(SA)的生物合成和信号转导[18.那19.].
JA生物合成和信号传导中缺陷的突变水稻线的几项研究证实了不同的植物激素途径在他们对咀嚼和植物喂养昆虫的防御中的累积[20.].例如,JA-Biosynthetic脂氧合酶基因的敲除(氧合酶)提高水稻植物与条纹螟虫(咀嚼昆虫)的易感性,但是提高了它们对BPHS(饲喂昆虫)的抵抗力,可能是由于JA的降低和SA和过氧化氢水平增加[21.].此外,敲除冠状病毒不敏感1基因(COI1.;编码JA受体)提高水稻植物对咀嚼昆虫的易感性,但没有改变耐米阻/对BPH的敏感性,这意味着JA信令并不涉及对BPH的水稻反应[22.].Ja和Sa途径之间的拮抗串扰是一种损害具有双重抗性和刺穿吸吮昆虫的植物的因素[23.].
以前的研究一致表明,青柳(QL)水稻品种抗叶螟侵害[24.那25.那26.]. 清流是台湾本地的一个籼稻品种,其栽培记录可以追溯到1742年左右的清朝时期[27.].过去,由于其生命周期短、产量高、种子质量好,曾被大规模种植[27.].然而,鉴于清水过高且倾向于小屋,其培养最终逐步逐步逐步逐步逐步淘汰绿色革命期间开发的现代半稻品种[27.].最近,一项比较蛋白质组学研究表明,青柳在食虫前和食虫过程中,黄酮类化合物和JA生物合成相关酶的表达量高于敏感对照台中天然1号(TN1),这可能有助于青柳对咀嚼昆虫的抗性[28.].然而,响应Leaffolder草食物的Qingliu的RNA测序(RNA-SEQ)谱尚不可用。本研究的目的是(i)评估清水是否具有饲喂韧皮肌的抗性,并且(ii)突出了脑卒中患者和BPH侵染的清水中关键防御相关过程中的转录组变化。
结果
青柳对褐飞虱有中等抗性
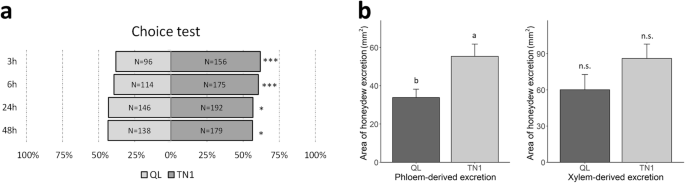
标准种子盒筛选试验(SSST)表明,Qingliu比BPH(平均伤害得分= 5.0)比两个易感品种TN1(8.3)和TNG67(7.0)(双向ANOVA和LSD测试,P.-value < 0.001)1).此外,青柳也有相同的平均伤害得分,两个中等抗性的检查:Mudgo和H105。与预期的一样,白桥湾对褐飞虱侵染高度敏感(9.0)(表1).此外,改良的种子箱筛选试验(MSST)与SSST(双向方差分析和LSD事后分析)结果一致。P.-value < 0.001)1). 这些结果表明,青柳对BPH侵染具有中等抗性。在青柳和TN1之间的选择测验中,青柳在3、6、24和48个月后的bph数低于TN1 昆虫处理方法(Z.-测试,P.-value = 0.0002, 0.0003, 0.0124, 0.0213。1一种)。
在蜜露排泄试验中,喂养Qingliu的单独的BPHs排出比在TN1上的饲料的较低体积的韧皮衍生的排泄(双向Anova,P.-value = 0.0100)(图。1b)。这表明喂养Qingliu上的BPHs缺乏对Phloem SAP的较少或低于TN1上的饲料的验料SAP进气率。此外,在Qingliu或Tn1上饲喂的单独的BPH排出相似体积的木质衍生的排泄(双向ANOVA,P.-Value = 0.1443)(图。1b)。这意味着喂食在Qingliu和Tn1上的BPH可以与木质SAP或类似的木质SAP进气速率相同的访问。
在清水的侵染部位发生比其他组织的侵扰位点发生更大的转录变化,响应莱佛尔和棕色Planthopper侵扰
为了发现清肺的分子反应可能赋予观察到的咀嚼和刺穿吸吮昆虫的双重抗性,在未血液的对照中产生叶子和鞘组织的RNA-SEQ型材,嗜肺剂 - 侵染(24小时)和BPH侵染(24 h) conditions. A total of thirty RNA-Seq samples were generated with five biological replicates in each experimental group (2 tissues × 3 conditions × 5 biological replicates). RNA-Seq produced a large number of raw reads per sample, falling within the range of 39,700,000-52,700,000 (TableS1).每次样本共36,000,000-49,200,000张清洁读数(90-93%的原始读数)通过了读取修剪和过滤步骤(表S1).At least 92.71% of the clean reads per sample were mapped to the rice reference genome with at least 89.16% of clean reads mapped to a single genomic locus, confirming the quality of the RNA-Seq samples (i.e., free of microbial contamination) (TableS1).
进行主成分分析(PCA)以评估生物复制物的同质性(图。S1). 主成分1(13.25%)在RNA-Seq样本中表现出最大的变异,所有15个叶片样本都从15个叶鞘样本中分离出来。RNA-Seq样本的第二大变异(7.66%)是由于叶鞘样本与叶片样本相比具有较高的异质性。在每个组织中,三种不同实验条件下的样本没有明显分离,这意味着两种虫害对青柳转录组变化的影响较小。然而,每个实验组的生物复制品形成了自己的集群(图。S1).
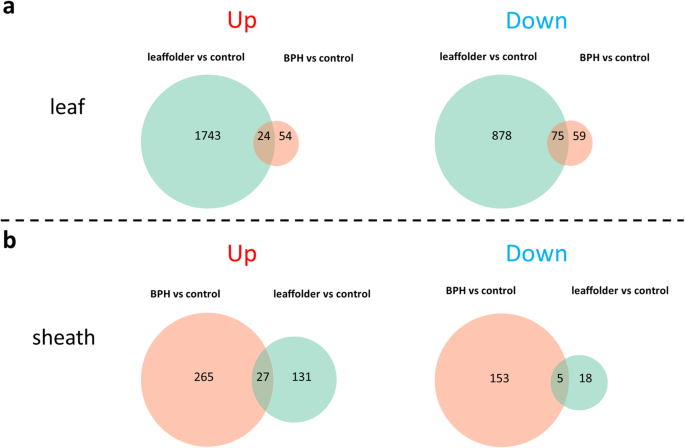
在叶面侵染24 h时,叶片中DEGs的数量(2720比181)高于叶鞘(图1)。2;桌子S2a,b)。这一发现是预期的,因为叶子是Leaffolders的侵染部位。在叶片中的叶片中,上调了1767个基因(64.96%),下调953个基因(35.04%)(图。2;桌子S2一种)。相比之下,在鞘中检测到比BPH侵染的24小时的叶片中的更多°:450 vs212°(图。2;桌子S2c, d).这也是预料之中的,因为鞘是BPH的侵染部位。鞘内DEGs中,292个基因表达上调(64.89%),158个基因表达下调(35.11%)。2;桌子S2d) 是的。此外,还发现了两种害虫共同调控的DEGs:叶片中有24个上调基因和75个下调基因,叶鞘中有27个上调基因和5个下调基因。2;桌子S2e,f)。例如,通常在叶片中常规诱导叶片(OS01G0235000,OS01G0235000,OS011109600),过氧化酶(OS03G0235000,OS0G0117800,OS05G0217700,OS05G0217700,OS05G0217700,OS03G0305400)的几种防御酶(OS03G0235000,OS011109600),Burp和含型域域(OSPA)域域(OS05G0217700)的含量(OS03G0235000,OS05G0217800)。在单独的Leaffolder和BPH侵犯(表S2e)。
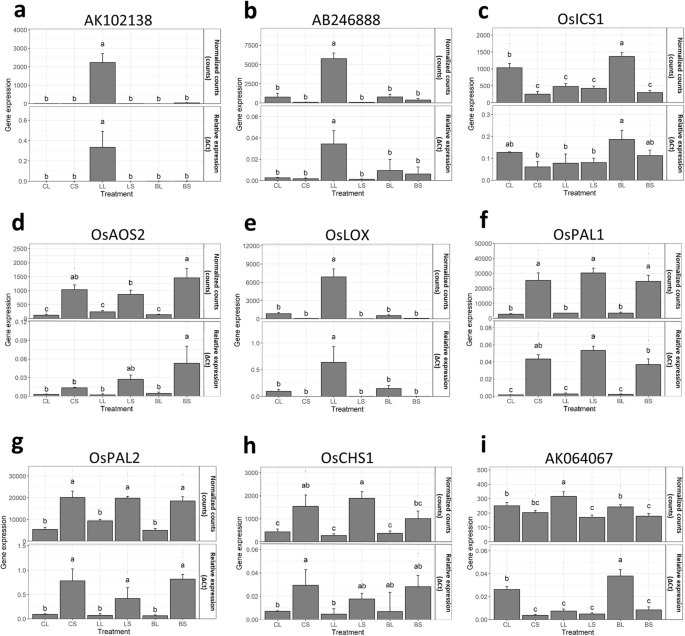
与QRT-PCR验证的九种无国防或特定样品的DEG均不符合QRT-PCR验证(图。3.).8个基因的qRT-PCR结果与RNA-Seq结果相关性较强(AK064067除外),证明生成的转录组的稳健性。
使用QRT-PCR验证九种防御或样品特异性差异表达基因。对于RNA-SEQ,在5个生物学重复中测量每个样品中基因的标准化计数(归一化计数±SD)。对于QRT-PCR,每种样品中的相对基因表达(ΔCT±SD)在四个生物学重复中测量,并用泛素基因(OS03G0234200)用作参考基因的三种技术重复。OsICS1公司 = 等容酸合酶1,OsAOS2 = allene oxide synthase 2,OsLOX = 脂氧合酶,OSPAL1. = phenylalanine ammonia-lyase 1,OSPAL2. = phenylalanine ammonia-lyase 2,oschs1.= chalcone合成酶1,AK102138 = Bowman-Birk丝氨酸蛋白酶抑制剂家族蛋白,表达,AB246888 = NADPH氧化还原酶1,AK064067 =保守假设蛋白,CL = control_leaf, CS = control_sheath, LL = leaffolder_leaf, LS = leaffolder_sheath, BL = BPH_leaf, BS=BPH_sheath。测量结果采用双向方差分析和LSD事后检验,用不同字母表示显著差异(P. < 0.05)
RNA-SEQ揭示了JA Biosynthesis和SA信号传导在清水的反应中的参与,对莱斯德尔草本和SA信号对抗棕色Planthopper侵扰
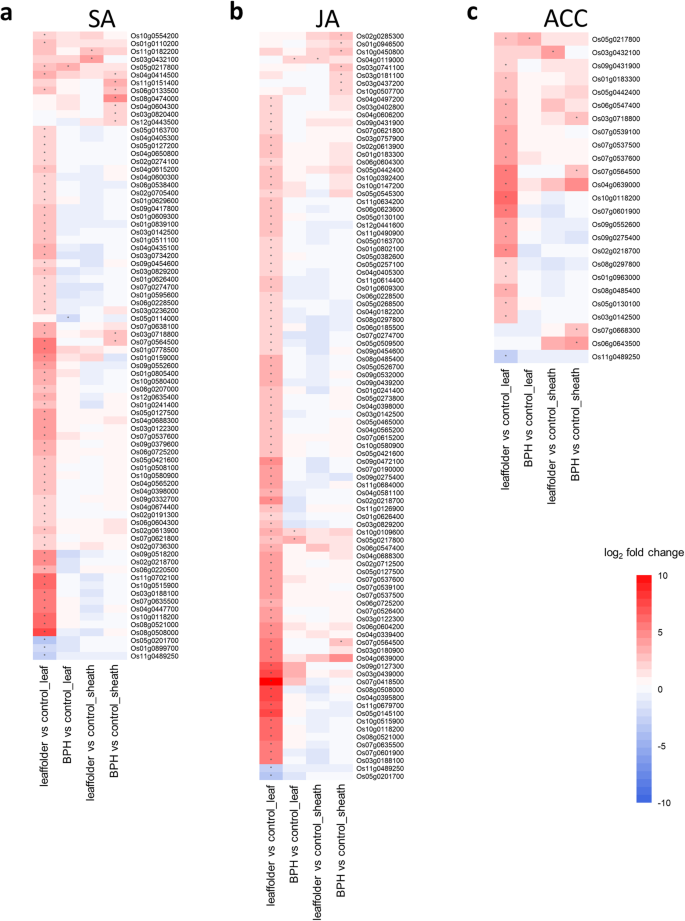
为了研究青柳对叶螟和褐飞虱侵染的防御激素,分别将青柳侵染植株上的二核苷酸多态性基因(DEGs)分别定位到798、615和183个已有报道的SA-、JA-和乙烯(ACC)应答基因上[29.].将总共80个SA-,95 JA和25个ACC响应基因映射到DEG(图。4.;桌子S3).
值得注意的是,86.3,89.5和84.0%的总映射的SA - ,JA和ACC响应基因均由叶片饲喂叶片诱导,表明这三种防毒狂暴在清水防御反应调节中的累积针对这种咀嚼昆虫(图。4.;桌子S3).鉴定了与SA反应相关的标记基因的诱导表达。这些包括异常的开花单位1OsAIM1(Os02g0274100),参与SA生物合成和两个参与SA信号通路的基因,非致病相关基因表达OsNPR1/3(Os03g667100和Os01g0194300(表S2).对于JA,虽然三个JA生物合成基因的表达上调:脂氧合酶oslox2.1 / 2.2 / 2.3(Os08g0508800, Os12g0559200, Os08g0509100),七个编码JA信号抑制因子的基因:茉莉酸zima -domain蛋白OsJAZs(Os03g0180900, Os10g0392400, Os07g0615200, Os03g0402800, Os09g0439200, Os03g0180800, Os04g0395800)也上调(表1)S2a).这说明SA的生物合成和信号转导以及JA的生物合成参与了青柳对叶螟的防御反应。
其次,在BPH侵染的鞘中分别诱导了11.3%、8.4%和16%的SA-、JA-和ACC反应基因。4.;桌子S3). 然而,两个编码JA信号抑制剂的基因,OsJAZs(Os03g0181100, Os03g0180800)S2d).这一发现表明SA信号通路参与了清柳对BPH侵染的防御反应。事实上,在bph感染的鞘中上调的9个sa响应基因中,有4个基因与转录因子(Os08g0474000)、细胞壁修饰(Os04g0604300、Os12g0443500)和脂质代谢(Os03g0718800)相关(图)。4.一种;桌子S3). 在接下来的章节中,我们将基于基因本体(GO)的丰富和MapMan注释结果来解释这些成分在清流防御反应中对BPH的相关性。
青柳植物在采食叶类植物时,激活了茉莉酸生物合成和卤化物途径的防御反应
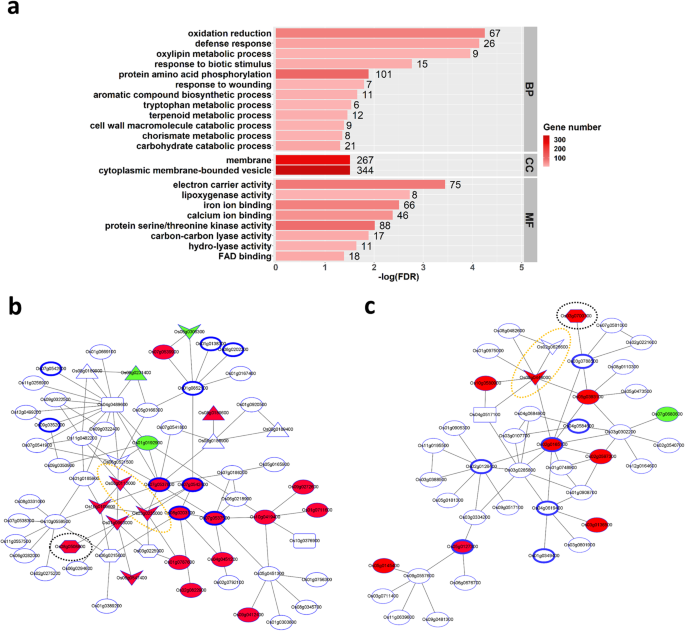
为了解青柳对叶类植物的防御反应,分别对各组织中上调和下调基因进行了GO富集分析。更多的丰富条款被发现在树叶(侵扰网站)比鞘:调节基因在树叶注释68条款,表达下调基因在叶子21条件,调节基因在鞘15条款和表达下调基因在鞘为0(表S4). 在通过手动整理GO层次树图去除相关GO术语后,将叶片中的上调基因注释为22个GO术语,将叶片中的下调基因注释为4个GO术语(主要与叶绿素生物合成有关),将叶鞘中的上调基因注释为1个GO术语(图。S2).
在Leaffolder-infested叶片中富集的上调基因的22个富含基因的阶段由12个生物学过程,2个细胞组分术语和8个分子函数术语组成(图。5.一种;桌子S4一种)。基于生物过程注释,可以推导出磷酸化级联(GO:0006468:蛋白质氨基酸磷酸化)作为对Leaffolder侵扰的早期反应。信号传导级联触发了清滑的JA生物合成和防御机制(GO:0031407:奥氧基素代谢过程,GO:0006952:防御响应,GO:0009607:对生物刺激的反应,GO:0009611:对伤害的反应)。值得注意的是,防御机制涉及通过Shikimate途径诱导参与细胞壁分解代谢的基因,芳族氨基酸(色氨酸,苯丙氨酸和酪氨酸)的生物合成,以及苯丙醇丙烷和萜类代谢产物的生产(Go:0016998:细胞壁大分子分解代谢过程,GO:0016052:碳水化合物分解代谢过程,GO:0019438:芳香化合物生物合成过程,GO:0006568:色氨酸代谢过程,GO:0046417:融合代谢过程,GO:0006721:百萜代谢过程)。
草食条件下青柳叶片主要防御机制的测定。一种富集叶叶叶片鉴定的上调基因的富集依赖于Leaffolder草食病。从生物过程(BP),细胞组分(CC)和分子功能(MF)GO类别中富集的GO术语显示为具有棒长描绘描绘基因数的富集的富集显着性和颜色强度。共用网络使用B.OS07G0542400,OS07G0537500,OS07G0537600,OS08G0203100COs02g0165100、Os05g0127300共表达叶喂食诱导的蛋白激酶基因。根据KEGG通路注释,与JA生物合成相关的基因和苯丙素通路相关的基因分别用黑色和橙色椭圆虚线表示。蓝边节点=蛋白激酶基因,箭头节点=编码过氧化物酶、苯丙氨酸解氨酶或4-香豆酸:辅酶A连接酶的基因,六角节点= JA生物合成基因,方形节点=转录因子基因,三角形节点=胚芽样蛋白基因。共表达网络上的二聚体显示为表达上调的红节点和表达下调的绿节点
为了证明磷酸化级联的作用在激活Qingliu的防御机制对Leaffolder的侵袭时,使用注释的101蛋白激酶基因进行共表达分析:0006468:蛋白氨基酸磷酸化(图。5.一种;桌子S4a).在层次= 0和互秩(MR) = 14时,共鉴定出4组蛋白激酶基因:(1)Os07g0542400、Os07g0537500、Os07g0537600、Os08g0203100;(2) Os02g0165100 Os05g0127300;(3) Os03g0773300 Os06g0602500;和(4)Os01g0664200、Os04g0514800。因此,我们将这四组共表达基因分别作为生成共表达网络的引导基因。在层次= 2和MR = 7时,前两组引导基因产生了两个具有生物学意义的共表达网络(图。5.b,c)。第一个共表达网络突出显示的上调基因编码(i)涉及JA生物合成的脂氧合酶(OS08G0508800),(ii)两种过氧化物酶(OS03G0235000,OS08G0113000),其注释为OSA01110的基因和基因组(Kegg)途径(Kegg)的三个kyoto百科全书:生物合成次级代谢物,OSA00360:苯丙氨酸代谢和OSA00940:苯丙醇丙烷生物合成(图。5.b).第二个共表达网络显示了另一个脂氧合酶(Os03g0700700)和一个4-香豆酸:辅酶a连接酶(Os08g0448000)的编码基因的诱导表达,该基因参与木质素生物合成以防御伤害(图)。5.c).值得注意的是,在共表达网络中还发现了苯丙氨酸解氨酶基因(Os02g0626600)。5.C)。
在褐色的植物植物植物的鞘植物的鞘中激活涉及细胞壁改性和脂质代谢的防御反应
为了解读清柳对BPH侵染的防御反应,我们分别对各组织中上调和下调基因进行了GO富集分析。更丰富去条款被发现在鞘(侵扰网站)比叶子:调节基因在鞘被注释44条款,表达下调基因鞘为0条件,调节基因在叶子2术语和表达下调的基因在叶子4项(表S5).在去除相互关联的GO期间之后,鞘中的上调基因被注释为12阶段,叶片中的上调基因在1阶段和叶片中的下调基因到1术语(图。S3).
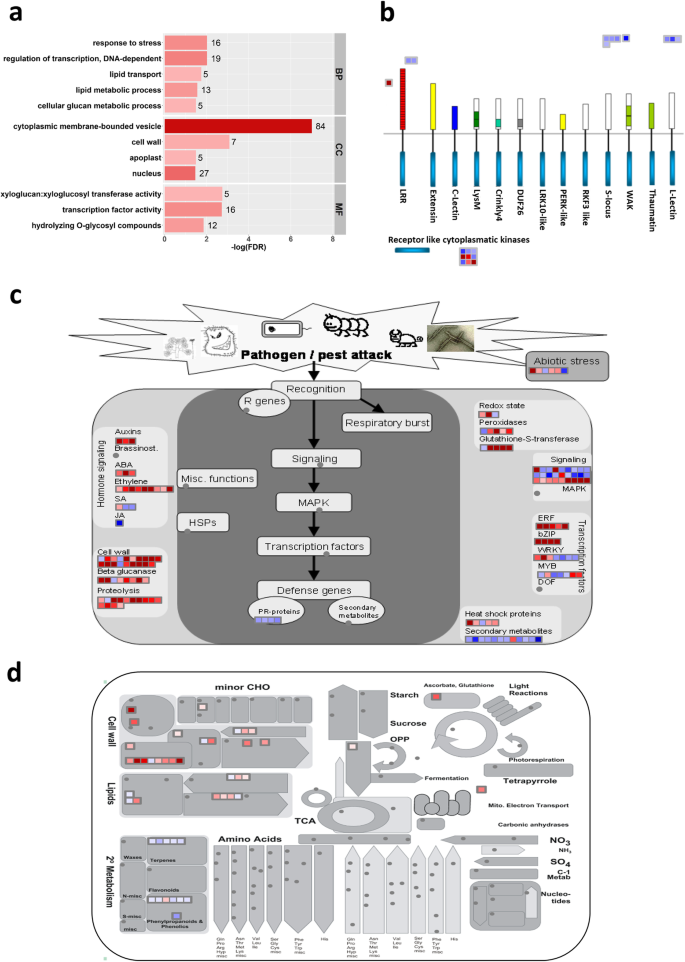
在bph感染的鞘中,12个富集的GO基因包括5个生物过程项、4个细胞组分项和3个分子功能项(图)。6.a) 是的。生物过程注释显示,青柳通过转录重编程(GO:0006355:转录调控,DNA依赖性)对BPH感染作出反应。这种转录修饰激活了调节细胞壁修饰和脂质代谢/转运的防御机制(GO:0006950:应激反应,GO:0006073:细胞葡聚糖代谢过程,GO:0006629:脂质代谢过程,GO:0006869:脂质转运)。如预期,分子功能和细胞成分注释支持上述防御反应(GO:0003700:转录因子活性,GO:0005634:细胞核,GO:0004553:水解酶活性,GO:0016762:木聚糖:木糖基转移酶活性,GO:0005618:细胞壁)(图。6.一种;桌子S5一种)。
为了验证青柳对BPH侵染的防御反应,我们将鞘中的DEGs映射到MapMan通路(图1)。6.罪犯;桌子S6).结果,编码受体激酶的十八基因对BPH的侵扰具有较低的五个基因正在上调:OS01G0741200,OS01G0821200,OS02G0190500,OS03G0717000和OS08G0374701(图。6.B;桌子S6a) 是的。活化的受体激酶可能触发钙、磷脂酰肌醇和G蛋白信号通路,通过一系列蛋白质磷酸化事件将信号传递到细胞核(图。6.C表S6b) 是的。与GO富集结果一致,该信号激活转录因子(图。6.C表S6b)控制防御机制所需的基因的表达,特别是细胞壁改性和脂质代谢(图。6.D表S6C)。
讨论
青柳对叶螟和褐飞虱的双重抗性
筛选抗咀嚼和韧皮部双重抗性的水稻种质是培育广谱抗虫水稻品种的重要目标[12.]. 然而,JA和SA在水稻防御机制中的拮抗作用可能会阻碍这种努力[23.].例如,以前的研究报告说,BaiQiaowan对Leaffolders抵抗,因为它持续较少的叶片损伤和抑制幼虫的生长越来越易受米线[24.那26.].然而,本研究的海表温度和平均最低温度结果显示,白桥湾对BPH侵害高度敏感,不能认为具有双重抗性(表1)1).
以前的研究一致表明青柳对叶蝉侵害具有抗性[24.那25.那26.]. 这项工作始于在台湾的一个实验农场进行的270种水稻基因型的自然虫害筛选试验[24.].在经过测试的植物中,Qingliu具有最低叶片损伤的百分比[24.].先前的研究表明,在完整的植物和脱离的叶片中,喂养Qingliu的第三龄山羊毛毛虫记录了较高的死亡率和比莱斯 - 易感TN1上的那些更低的相对生长速度[26.].之前在青柳中发现了一些独特的属性,比如高的叶毛密度,可以阻止叶面螟的侵害[25.].
虽然青柳是已知的一种抗咀嚼性害虫,但其抗韧皮部食性害虫如BPH的报道尚不多见。在这项研究中,青柳被证明是中度抗前列腺增生症(图。1;桌子1).例如,基于源自SSST和MSST实验的损伤分数,Qingliu似乎对BPH侵蚀的正常抵抗力(表1).在选择试验中,吸刺虫对清柳的沉降偏好低于对TN1的沉降偏好。1a) 是的。此外,研究发现,取食青柳的个体BPH的蜜露排泄量低于TN1(图。1b)。
本研究表明,青柳对叶肉和褐飞虱表现出罕见的双重抗性。然而,根据生长-防御权衡假说,植物的防御激活通常是以牺牲植物生长为代价的,因为可分配给生长或防御的代谢资源有限[30.].例如,可以在组成型防御突变体中观察到SA的生长抑制,其由于升高的SA累积或信号传导而具有矮化表型[31.].多年来的研究证明,青柳在无菌条件下具有良好的生长和产量性能[27.],但目前尚不清楚这些指标是否会在受感染的条件下由于防御激活而急剧下降。因此,在获得用于广谱抗虫水稻品种的遗传标记之前,需要对青柳进行进一步的表型和遗传特性鉴定。
莽草酸和苯丙素途径在青柳叶材相互作用中的重要性
嚼叶昆虫唾液分泌物中的激发子通过一个复杂的伤口信号通路触发宿主防御,JA生物合成在其中起着重要作用[18.那32.].这解释了Limoxygenase(JA Biosynthesis基因; OS08G0508800,OS12G0559200,OS08G0509100,OS08G0509100)的诱导(表S2一种)。虽然JA生物合成在水稻植物中增加了莱斯伯尔草本植物,但之前的研究表明,清水产生了比Leaffolder - 易感TN1更高水平的JA [26.].据报道,JA生物合成通过激活苯丙醇丙烷途径来增加对Lemfoglower的耐水稻抗性[33.]. 在这里,观察到莽草酸途径中生物合成基因的转录水平增加,其产生三种必需的芳香氨基酸:色氨酸、苯丙氨酸和酪氨酸(图。5.一种;桌子S4一种)。最近的比较蛋白质组学研究表明,催化合成或酸酸的酶(Q10NY1,Q5VNW0),芳族氨基酸的前体在清含量高于TN1中的较高水平[28.]. 除了用于蛋白质合成外,这些必需的芳香族氨基酸还通过植物中的苯丙烷途径作为各种防御化合物的前体,例如SA、多酚化合物和木质素[32.那34.].
植物中色氨酸衍生的次生代谢物一般包括吲哚生物碱、吲哚硫代葡萄糖苷、camalexin、生长素、血清素和褪黑素[35.].响应于Leaffolder草食物,观察到编码血清素生物合成酶(OS08G0140300,OS08G0140500)和褪黑激素(OS08G0157500)的生物合成酶的基因诱导(表S2a).最近的一项研究表明,抑制5 -羟色胺生物合成增强了水稻对BPH和条纹茎螟虫的抗性,可能是通过提高苯丙氨酸衍生的SA水平[36.].基于该发现,观察到的血清素的增加的酵母素生物合成的增加可能用作褪黑素生物合成的前体。植物中的褪黑激素通过增强抗氧化酶的活性并增加黄酮类生物合成而延迟衰老[37.].
苯丙氨酸和酪氨酸被引导到苯丙类途径中,产生防御性次生代谢物-类黄酮[38.那39.]. 苯丙氨酸解氨酶(PAL)催化苯丙酸途径的第一步,即合成trans-肉桂酸盐,源自苯丙氨酸[40].这trans-Cinnamate然后羟基化以形成P.-coumarate [41.].最近的研究表明,单子叶草系Poaceae含有双官能苯丙氨酸/酪氨酸氨裂解酶(PTAL),其可以合成P.-香豆酸从酪氨酸,绕过trans-Cinnamate中级[35.那39.].在Qingliu的RNA-SEQ表达谱响应Leaffolder草食病,编码基因的上调OSPAL6.(Os04g0518400)与以下类黄酮生物合成酶一起被发现:查尔酮合酶(CHS;查尔酮异构酶(ch;Os06g0203600)、查尔酮还原酶(Os04g0167800)、黄酮3-羟化酶(Os03g0122300)和亮色花青素双加氧酶(Os01g0832600、Os03g0289800、Os05g0127500)(表1)S2a) 是的。最近的一项比较蛋白质组学研究证实了这些结果,该研究表明,在感染前和/或感染期间,青柳中PAL、CHS和CHI的表达水平高于TN1[28.].
在单子叶植物中,苯丙氨酸/酪氨酸苯丙素途径也产生木质素[42.那43.].鉴于植物细胞壁,木质素生物合成和沉积的保护作用可以响应口服昆虫害虫引起的伤害而触发[44.].在RNA-SEQ结果中,对木质素单体编码生物合成酶的基因诱导:4-作用:COA连接酶(OS08G0448000,OS02G0177600),咖啡酸O-甲基转移酶(OS08G0157500),咖啡酰COA O-甲基转移酶(OS08G0498400,OS08G0498100),观察到Coniferaldehyde 5-羟化酶(OS10G0512400),糖醇脱氢酶(OS02G0187800)和肉桂酰基还原酶(OS08G0441500)(表S2a).木质素单体最终被运送到外质体,在那里它们被过氧化物酶和漆酶聚合[45.].与这一发现一致的是,一项研究报道,昆虫特异性毒素蝎肽LqhIT2通过促进JA的生物合成提高了水稻对叶螟的抗性,而这反过来又增加了叶片组织细胞壁中的木质素沉积[33.].
PAL途径是水稻SA生物合成的主要途径[46.[这项研究在该研究中,发现了与SA生物合成相关的标记基因的诱导:OsAIM1(OS02G0274100)和SA信令:OsNPR1/3(Os03g0667100 Os01g0194300)(表S2一种)。先前的研究表明,在蔬菜饲喂之前,清水在6小时内具有较高水平的SA水平,在昆虫喂养之前,清鲁的SA水平总体上高于Leaffolder - 易感TN1中的SA水平[26.].在Leaffolder草食物下的Qingliu升高的SA生物合成可能会考虑由于SA和JA之间的众所周知的拮抗相互作用导致了对JA信号传导的抑制作用[19.].这解释了在青柳对叶螟侵染的响应中,参与JA生物合成的基因和JA信号的负调控基因的上调这一矛盾现象(表S2一种)。虽然SA生物合成和信号传导的功能重要性是针对富含磷酸昆虫害虫的良好记录,但SA对咀嚼昆虫害虫的作用仍需要进一步调查[18.那47.那48.].除非有证据表明SA信号通路的功能尚不明确,否则通过PAL途径增加SA的形成可能仅仅是为了抑制JA信号通路,而苯丙类次生代谢物的积累主要是青柳对叶材产生抗性的原因。
细胞壁修饰和脂质代谢在青柳褐飞虱互作中的重要性
与对叶片造成广泛损害的叶龄幼虫相比,bph通过表皮细胞间的外质体空间插入针状的花柱,到达含有汁液的韧皮部细胞,对宿主组织造成的机械损伤很小[12.].通过区分取食部位的组织损伤程度,水稻植株能够对这两种取食行会不同的害虫采取不同的防御机制[49.].迄今为止,已有5个BPH抗性位点通过基因图谱克隆得到了功能特征:Bph3公司那BPH14.那BPH18.那BPH26.和BPH29.[18.那47.那50.那51.那52.].除了BPH29.其他四个基因座编码卷曲线圈、核苷酸结合位点和富含亮氨酸的重复蛋白(CC-NBS-LRR)或凝集素受体激酶(LecRK),它们激活SA信号通路并诱导韧皮部细胞中的胼胝质沉积[18.那47.那50.那51.那52.].
在本研究中,在bph感染的鞘中24 h诱导表达了5个受体激酶基因:Os01g0821900、Os08g0374701、Os03g0717000、Os02g0190500和Os01g0741200(表S6a). 3个受体激酶基因已被报道为信号转导的上游调控因子,对抗非生物和生物胁迫[53.那54.那55.].例如,水稻受体样细胞质激酶253(OSRLCK253; OS08G0374701)与血浆膜,核膜和细胞核中的应力相关蛋白1/11(OSSAP1 / 11)相互作用,并且它们在拟南芥中的过表达提高了水缺陷和盐度耐受性[54.].拟南芥中的水稻赖辛基型受体样激酶4(OSLYSM-RLK4; OS01G0741200)的矫正器触发植物通过用作几丁质识别受体来对抗小菜信号传导途径的病原体55.].
24 h时,在bph感染的鞘中诱导钙信号通路(Os09g0482800、Os04g0492800、Os06g0683400、Os01g0949500、Os01g0955100)、磷脂脂质信号通路(Os02g0285300)和g蛋白信号通路(Os02g0719000、Os05g0513800、Os05g0454200)相关基因(表)S6b)。这些信号传导途径可能导致核中转录因子的激活。正如预期的那样,28个基因的转录物水平主要编码AP2 / ERF(8基因),MYB(5基因),BZIP(3基因),BHLH(3个基因)和WRKY(2基因)家族(表格)的转录因子(表S7被诱导。在这八个AP2/ERF公司转录因子基因,4个基因属于Osdreb.(脱水响应元素结合)亚家族:osdreb1a./C/E./H. 众所周知,这些OsDREB转录因子和OsbHLH148控制水稻对干旱、低温和盐胁迫的反应[56.那57.].有趣的是,一个专业的诱导OsMYB4观察到转录因子基因,其中前期研究全面显示OsMYB4在拟南芥中,改善了干旱,盐,紫外线辐射,臭氧,病毒,细菌和真菌的耐受性[58.].还观察到OSWRKY76的诱导 - 据报道,其在水稻植物中的过度表达增加了易感性magnaporthe oryzae.但增强对冷应激的耐受性[59.].
转录因子对控制褐飞虱感染水稻鞘中各种下游防御机制的基因的表达进行重新编程。细胞壁是水稻- bph相互作用的主要“战区”;因此,细胞壁相关的氧化石墨烯在被侵染的鞘中富集就不足为奇了(图。6.)[60.].BPH的唾液腺分泌物可能含有细胞壁修饰酶(CWMEs),促进花柱通过表皮细胞的细胞外基质渗透[61.].为了解决这个问题,水稻还采用了另一套cwme来加固细胞壁,阻止韧皮部吸吮害虫的取食过程[60.].同样,编码主要细胞壁成分(果胶、纤维素、半纤维素和胼胝质)生物合成、降解和修饰所必需的酶的基因在水稻鞘中24 h被诱导表达(表)S7b)。例如,果胶裂解酶(OS12G0554800)催化果胶的解聚对寡核苷酸的解聚,其用作损伤相关的分子模式(潮湿),通过丝裂原激活的蛋白激酶(MAPK)信号通路激活防御响应[62.那63.].木葡聚糖是一种半纤维素,是病原体降解的直接目标,可成功地定植于宿主植物[64].为了防止木葡聚糖的降解,我们诱导了四种细胞壁定位的木葡聚糖内转糖酶/水解酶(Os04g0604300, Os02g0696500, Os06g0696400, Os03g0239000)在青柳中bph感染的鞘中的表达(表S7b)[64]. 此外,解聚的木聚糖寡聚物也可以起到抑制作用,触发MAPK信号级联[65]. 除了胼胝质合成酶,还发现了编码β-1,3-葡聚糖酶的8个基因的诱导表达,表明韧皮部胼胝质沉积可能不是青柳抗BPH的机制(表1)S7b)[66].
脂质代谢包括脂质介导的信号传导和蜡质生物合成是另一个受BPH侵染的水稻鞘调节的过程(表1)S7C)。对于脂质信号传导,发现编码磷脂酶C(OS02G058500)和两个磷脂酶D酶(OS08G0401800,OS02G0120200)的基因表达增加(表S7C)。在环境压力下,磷脂酶酶催化膜磷脂的水解,产生信号信使,例如磷脂酸,二酰基甘油,磷酸膦酸酯和肌醇多磷酸盐[67].脂肪酸2-羟化酶基因表达增加(OsFAH1;OS12G0628400)还识别出在鞘磷脂的生物合成中的功能(表S7(三)[68].正确生产鞘脂保护通过Rac1-RboHb途径产生反应性氧物种所需的血浆膜微膜的完整性,这将赋予稻米免疫力magnaporthe oryzae.[68].有趣的是,两个脂肪酸延长酶基因(Os02g0205500, Os05g0568000)被诱导到感染的鞘中(表S7c).在内质网中,脂肪酸延长酶复合物催化C16和C18脂肪酸延伸为具有C26到C34链的极长链脂肪酸(VLCFAs) [69那70].VLCFAs转化为角质层蜡,形成空气器官的最外层疏水层,以保护植物免受非生物和生物的胁迫[71].在内质网中产生的切割蜡需要运输到角质层[71].因此,鉴定了编码脂质转移蛋白的五种基因的表达增加(OS03G0718800,OS12G0114500,OS06G0643500,OS07G0175600,OS07G0175600,OS10G0505500)(表S7C)。
结论
水稻对咀嚼性和刺吸性害虫的双重抗性是一个很少观察到的表型,因为每种抗性都涉及不同的防御机制,并且这些机制之间存在拮抗性串扰。据报道,青柳对食叶昆虫和刺吸昆虫具有双重抗性。因此,寻找青柳的双抗虫基因座对于培育广谱抗虫水稻品种具有重要意义。为了达到这一目的,我们利用组织特异性RNA-Seq分析技术,分别研究了青柳在叶夹和BPH侵染下的关键防御机制。结果表明,青柳叶卷叶病叶中JA生物合成的转录激活以及莽草酸和苯丙酸相互联系的途径,可能增加了SA、褪黑素、类黄酮和木质素等多种重要的防御相关次生代谢产物的产生。另一方面,在BPH侵染的青柳鞘中发现SA信号和细胞信号转导的转录激活,这可能导致细胞壁修饰和角质层蜡的形成,从而干扰BPH的摄食。尽管青柳对这两种害虫的防御反应似乎基本不相关,但苯丙酸途径(或更具体地说是PAL)可能是一种上游聚合途径,具有双重抗性,值得进一步研究。
方法
植物材料
从台湾区农业研究和拓延,台湾CoA,Coa,彰化,台湾省Qingliu米品种种子;TN1的种子是从农村,国立台湾大学,泥鳅种子,H105,TNG67和BaiQiaowan获得的,从台湾农业研究所获得Chiayi农业实验站。籼米品种Qingliu是抗性的c . medinalis[24.].籼稻品种TN1非常敏感c . medinalis和N卢根斯并被用作敏感性检验[26.那72]. 将清流和TN1两种水稻种子灭菌20min,用无菌水漂洗后,在皮氏培养皿中浸水滤纸上播种。2之后 37℃孵育天数 ℃下,将发芽的种子转移到600℃下 含1X Kimura B营养液的ml烧杯[73].将幼苗置于30/25°C(白天/晚上)的生长室内,光照时间为12/12小时(白天/晚上)。1X木村B营养液每3天更换一次。8 - 10天之后(大约在两扇阶段),大小一致的幼苗分别移植到一个塑料罐(底部直径64毫米,95毫米直径的孔,和高度165毫米)包含稻田土壤从桃园,台湾,和生长在环境可控生长室。盆栽苗分别施可溶性肥33、31、27 kg / hm2- 1NPK,分别),每2天浇水。植株在发芽30天后进行实验。
昆虫殖民地
藏红花
这c . medinalis蜂群最初从台湾彰化COA台中区农业研究推广站收集,并在网箱(BugDorm-4, MegaView,台湾)中用玉米幼苗(White Pearl, Known-You Seed Co.,台湾)饲养,郭等人描述2019 [26.]. 实验采用3龄幼虫。
褐飞虱
这N卢根斯生物型1殖民地是从嘉义农业实验站,台湾农业研究所,CoA,Chiayi,台湾。N卢根斯在30/25的生长室中,用网笼(BugDorm-4,MegaView,台湾)饲养TN1幼苗 °C(白天/晚上),12/12 h(昼/夜)光周期。
标准种箱筛选试验
用SSST法测定了青柳的抗药性N卢根斯[74].在SSST和以下改性种苗筛选试验(MSST)中使用四种品种作为BPH抗性和BPH易感检查:Mudgo和H105是BPH-中等抗性检查[75];TN1和TNG67是BPH易感检查[72那76],除了白桥湾(一种抗叶的检查)[24.].每个水稻品种共24粒成行播种。每个品种只选择20株幼苗进行SSST。播种后14 d,幼苗被2 ~ 3龄幼虫侵染N卢根斯若虫,每个幼苗密度为10个若虫。所使用的损害等级基于用于的标准评估系统N卢根斯在水稻中的侵染,其中0 =没有伤害,1 =略微受损,3 =第1次和第2叶的植物显示出泛黄症状,5 = 10%到25%的植物显示出明显的灼热和衰退或衰退症状,7 =超过50%枯萎的植物,9 =所有植物枯萎或死亡[77].还基于0-9刻度测定稻米线的抗性,其中0-3分为抗性,4-6,如适度抗性,7-9易感[74那77].该SSST实验重复三次。
改性种子盒筛选试验(MSST)
mst实验装置是在IRRI标准评价体系的基础上改进的[77].简单地说,6个水稻品种被种植在一个方形塑料盒子(1m × 1m)中。在每个盒子里,每个品种有四个山丘,有3-5株幼苗。在分蘖期(播种后约30 ~ 35天),水稻植株被妊娠雌虫侵染N卢根斯成虫密度为0.5-1株。当敏感检查(TN1)因中度枯萎N卢根斯侵染,使用与SSST中每2至3天相同的标准评估系统进行评分的每个幼苗的状况。该MSST实验重复三次。
解决偏好测验
将Qingliu的五种发芽种子和TN1的五种发芽种子移植到含有1x Kimura B营养溶液的每个塑料罐中。两种品种的种子沿着55mm滤纸(Advantec)的圆周以交替布置移植在金属平台上,彼此分开17mm的线性距离。移植后14天,100三龄N卢根斯将若虫释放到每个水培盆(共4个盆)的滤纸上。这些罐子用塑料盖着,里面有网布窗户,防止昆虫逃跑。的数量N卢根斯侵染3、6、24和48 h时,各水稻品种上均有若虫沉降记录(N. = 400).
蜜汁排泄实验
使用处理过的溴甲酚绿滤纸进行的蜜露排泄实验改编自Jena等人(2017年)[78]. 简而言之,55 mm滤纸(ADVANTEC)用0.1%溴甲酚绿(Alfa Aesar)处理5天 试验前除主茎外,水稻分蘖均被去除。在每隔30天的盆栽植物上放置一个中间有一个孔以容纳主茎的纸板。然后,将干燥的溴甲酚绿滤纸放在纸板上并用塑料杯(22)覆盖 底座直径45 mm 孔径处直径mm,高度45 mm)(倒置)用棉塞防止N卢根斯逃跑。一个怀孕的女性N卢根斯在每个植株上释放饥饿1小时并允许喂食。送料24 h后,收集滤纸,用ImageJ [79].由于Bromo-Cresol Green的化学特征,蓝色镶嵌点代表基于Phloem的蜜露,而白色斑点代表基于木门的蜜露。该实验重复三次,样品大小为8-10。
植物处理、RNA分离和测序文库制备
每个30日龄的青留稻植株分别被15只3龄褐飞虱若虫或1只3龄叶龄幼虫侵染24 h。未受感染的植物作为对照。褐飞虱侵染、叶面螟侵染和不侵染处理各15株。分别采集每株植物的叶片和叶鞘组织,立即用液氮冷冻,保存在−80℃。总RNA用TRIzol试剂(Ambion)提取,并按照制造商的说明使用Quick-RNA Miniprep (Zymo Research)对每个样品进行纯化。使用NanoDrop ND 1000分光光度计(NanoDrop Technologies, Wilmington, DE, USA)检测RNA的完整性和质量。从同一处理中提取的三种植物组织的总RNA集合为一个复制。每个处理设5个生物重复。根据制造商的建议,使用KAPA mRNA HyperPrep Kit (KAPA Biosystems, Roche, Basel, Switzerland)生成测序文库。文库制备和高通量RNA测序由台湾新北市Biotools公司完成。
生物信息学分析
通过高通量测序(Illumina NovaSeq 6000平台)获得的原始数据通过CASAVA基调用转换成原始测序reads,并以FASTQ格式存储。FastQC和MultiQC用于fastq文件的质量检测[80].通过Trimmomatic(V0.38)过滤所获得的原料配对末端读取,以丢弃低质量读取和修剪适配器序列,并通过以下参数消除质量良好的基础:领先:3尾随:3滑动窗口:4:15 Minlen:30 [81].获得的高质量数据(clean reads)用于后续分析。用HISAT2软件(v2.1.0)将每个样本的读对与水稻参考基因组(os - nipponbarey - reference - irgsp -1.0)进行比对[82那83]. FeatureCounts(v1.6.0)用于计算映射到单个基因的读取数[84]. 对于基因表达,使用DESeq2(v1.22.1)进行“相对对数表达”标准化(RLE)[85那86].在R中使用DESeq2进行两种条件之间的DEG鉴定分析。由此产生的P.-值被调整使用Benjamini和Hochberg的方法来控制错误发现率(FDR) [87].具有绝对日志的基因2-变化大于1 (LFC1)和一个调整P.-Value少于0.05被认为是次数。使用Agrigo(v2.0)和MAPMAN(V3.6.0)进行DEG的富集和途径分析,默认设置[88那89].使用RIMEFRend Server进行基因共表达分析[90].从Garg等人(2012)中提取了植物激素应答基因[29.[和r中的Pheatmap包生成热图以说明表达式改变模式的热图91].
实时RT-PCR
来自另一种独立实验批次的RNA样品用于QRT-PCR。对于每个样品,使用IScript cDNA合成试剂盒(Bio-rad,USA),1μg总RNA被逆转录。每个QPCR由3μLPCR级水,5μLIQSYBR绿色超混(Bio-rad),0.5μl正向引物,0.5μL反向引物和1μLcDNA模板组成。在QPCR套件协议之后,在CFX连接实时PCR检测系统(BIO-RAD)上进行QPCR。产生熔化曲线以确认引物特异性。感兴趣基因的相对表达[Δct;在每个样品中,在四个生物学重复和三种技术重复中测量每个样品中的ΔCt= CT(参考基因)]。九种感兴趣的引物细节和参考基因泛素(OS03G0234200)如表所示S8. 在以前的研究中,参考基因泛素(Os03g0234200)被用作qPCR分析的对照[92那93那94].
数据分析
采用统计学方法进行分析Z.- 酌情差异或分析方差(ANOVA),使用最低有显着差异(LSD)测试α= 0.05的样品之间的差异。使用免费统计软件R(版本3.5.1)进行分析数据[95].
数据和材料的可用性
在当前研究期间生成和/或分析的RNA-SEQ数据集可在加入号PRJNA689251下的NCBI序列读取存档(SRA)中获得[https://www.ncbi.nlm.nih.gov/bioproject/PRJNA689251]. 提供了RNA-Seq数据集的reviewer链接[https://dataview.ncbi.nlm.nih.gov/object/prjna689251?reviewer=2b89mnmtv4988j74d7umd9hpq8.),一旦审稿人和编辑推荐接受,即稿件被接受发表之前,数据集将被发布。本研究中产生或分析的所有数据均包含在本文及其补充信息文件中。
缩写
- SSST公司:
-
标准种箱筛选试验
- MSST:
-
改良种箱筛选试验
- BPH:
-
褐飞虱
- 度:
-
差异表达基因
- RNA序列:
-
RNA测序
- IPM:
-
综合虫害管理
- JA:
-
茉莉酸
- 山:
-
水杨酸
- ACC:
-
乙烯
- 质量指标:
-
清流县
- TN1:
-
台中本机1
- 主成分分析:
-
主要成分分析
- QRT-PCR:
-
实时逆转录聚合酶链反应
- 去:
-
基因本体论
- KEGG:
-
京都基因和基因组百科全书
- 液态氧:
-
脂氧合酶
- COI:
-
冠状含量不敏感
- 目的:
-
异常的开花单生成
- 美国国家公共电台:
-
非发病相关的表达
- 杰兹:
-
斋月zim-域
- 朋友:
-
苯丙氨酸ammonia-lyase
- 社区卫生服务:
-
查尔酮合酶
- Chi:
-
查尔酮异构酶
- CC-NBS-LRR:
-
螺旋线圈、核苷酸结合位点和富含亮氨酸的重复序列
- CWME:
-
细胞壁改性酶
- 潮湿:
-
损伤相关的分子模式
- MAPK:
-
促丝糖型活化蛋白激酶
- VLCFA:
-
Very-long-chain脂肪酸
- 飞行高度:
-
脂肪酸2-hydroxylase
参考
- 1。
Datta A,Ullah H,Ferdous Z.水稻水管理。在:Chauhan BS,Jabran K,Mahajan G,编辑。全球稻米生产。瑞士:Springer;2017. p。255-78。https://doi.org/10.1007/978-3-319-47516-5_11。
- 2。
全球水稻生产和埃塞俄比亚经济发展的出口机会评估。2013;2(6): 257-60。
- 3.
Ali MP,Bari MN,Haque SS,Kabir MMM,Afrin S,Nowrin F,et al.在稻田建立下一代害虫防治服务:生态农业。Sci代表,2019年;9(1):10180.https://doi.org/10.1038/s41598-019-46688-6。
- 4.
Pathak MD,Khan Zr。米饭的害虫。菲律宾:国际水稻研究所;1994年。
- 5。
Heong KL, Wong L, Reyes JHD。解决飞虱对亚洲水稻种植和粮食安全的威胁:解决杀虫剂滥用问题。菲律宾:亚洲开发银行;2013.
- 6。
孩子们。昆虫损害作为气候的函数。在:Padfield T,Borchersen K,编辑。博物馆微亚亚麻层。丹麦:丹麦国家博物馆;2007. p。57-60。
- 7.
Deutsch Ca,Tewksbury Jj,Tigchelaar M,Battisti DS,Merrill SC,Huey RB等。在温暖的气候中增加作物损失对虫害的影响。科学。2018; 361(6405):916-9。https://doi.org/10.1126/science.aat3466。
- 8.
Ali MP,Bari Mn,Ahmed N,Kabir MMM,Afrin S,Zaman Mau,等。小米生产没有杀虫剂的小农农业领域。前环境SCI。2017; 5:16。https://doi.org/10.3389/fenvs.2017.00016。
- 9
徐H,杨y,鲁y,zheng x,tian j,lai f等。中国非化学杀虫剂技术水稻害虫的可持续管理。米科。2017; 24(2):61-72。
- 10。
Ranga Rao G, Kumari B, Sahrawat K, Wani S.用于减少作物和自然资源中农药残留的虫害综合管理(IPM)。在:Chakravarthy A,编辑器。昆虫科学的新视野:朝向可持续的害虫管理。新德里:施普林格;2015.p . 397 - 412。
- 11.
应对全球水稻生产的挑战。水稻水环境。2006;4(1):1 - 9。https://doi.org/10.1007/s10333-005-0031-5。
- 12.
杜布,陈·郭家,何G.目前了解水稻昆虫抗虫基因组,遗传和分子控制。mol繁殖。2020; 40(2):24。https://doi.org/10.1007/S11032-020-1103-3。
- 13。
富士塔D,Kohli A,Horgan FG。耐水稻对植物和叶蝉的抗性。CRIT Rev Plant Sci。2013; 32(3):162-91。https://doi.org/10.1080 / 07352689.2012.735986。
- 14。
Al Atalah B, Smagghe G, Van Damme EJ。Orysata是一种与花椒素相关的水稻凝集素,可以保护植物免受咬咬和刺吸昆虫的侵害。植物科学。2014;221 - 222:21 8。
- 15.
墙壁ll。无数植物对食草动物的反应。J工厂增长调节。2000; 19(2):195-216。https://doi.org/10.1007/S003440000026.。
- 16。
关键词:水稻,害虫,分形维数,模糊c均值,分类算法数学计算模型。2013;58(3-4):701-9。https://doi.org/10.1016/j.mcm.2011.10.028。
- 17
Nault LR,Ammar Ed。叶蝉和植物病毒的植物搬运工。annu重新entomol。1989; 34(1):503-29。https://doi.org/10.1146/annurev.en.34.010189.002443。
- 18
杜波,张伟,刘波,胡娟,魏卓,史卓,等。水稻抗褐飞虱基因Bph14的鉴定与鉴定。中国科学:地球科学;2009;https://doi.org/10.1073/pnas.0912139106。
- 19
李C,罗C,周Z,王R,Ling F,Xiao L等。两种对比水稻基因型对褐色植物侵袭的植物素瘤的基因表达及植物激素水平。BMC植物BIOL。2017; 17(1):57。https://doi.org/10.1186/s12870-017-1005-7。
- 20.
郭慧明,李慧聪,周世荣,薛宏伟,苗XX。顺式12-氧-植物二烯酸刺激水稻对刺吸昆虫的防御反应。摩尔。2014;(11):1683 - 92。https://doi.org/10.1093/mp/ssu098。
- 21.
周G,齐J,Ren N,Cheng J,Erb M,Mao B等。沉默的Oshi-lox使米饭更容易咀嚼食草动物,但增强了对Phloem饲养者的抗性。工厂J. 2009; 60(4):638-48。https://doi.org/10.1111/j.1365-313x.2009.03988.x.。
- 22.
叶敏,罗思敏,谢建峰,李玉凤,徐涛,刘勇,等。沉默水稻COI1增加了对咀嚼昆虫的易感性,损害了诱导防御。《公共科学图书馆•综合》。2012;7 (4):e36214。https://doi.org/10.1371/journal.pone.0036214。
- 23.
Spoel SH, Koornneef A, Claessens SMC, Korzelius JP, Van Pelt JA, Mueller MJ等。NPR1通过细胞质中的一种新功能调节水杨酸盐和茉莉酸盐依赖的防御途径之间的交叉交谈。植物细胞。2003;15(3):760 - 70。https://doi.org/10.1105/tpc.009159。
- 24.
廖CT,陈克。水稻基因型患者(Lepidoptera:Pyralidae)的产卵偏好和幼虫表现。j econ entomol。2017; 110(3):1291-7。https://doi.org/10.1093/jee/tox071。
- 25.
Tu Ky,Tsai SF,Guo Tw,Lin Hh,Yang Zw,Liao Ct等。植物非生物因素对塞巴洛氏菌(Lepidoctera:Crambidae)及其宿主植物相互作用的作用。Environ Entomol。2018; 47(4):857-66。https://doi.org/10.1093/ee/nvy066。
- 26.
郭涛,廖春涛,庄文平。水稻品种对稻纵卷叶螟的防御反应。节肢动物与植物互动。2019;13(4):611-20。https://doi.org/10.1007/S11829-019-09673-4。
- 27。
蔡崇信。书写与展示农业知识:以19世纪台湾北部水稻品种过渡为例。公牛台湾历史回顾2013;6:3-51。
- 28。
Cheah Bh,Lin Hh,Chien Hj,Liao Ct,Liu Lyd,Lai Cc等。基于SWATH-MS的定量蛋白质组学揭示了CNAphalococis MEDINARINIS耐水稻的独特复杂的防御反应。SCI代表2020; 10(1):6597。https://doi.org/10.1038/s41598-020-63470-1。
- 29。
加格R,蒂亚吉AK,贾恩M。微阵列分析揭示了水稻对不同植物激素的重叠和特异的转录反应。电厂信号行为。2012;7(8):951–6.https://doi.org/10.4161/psb.20910。
- 30
霍特B,姚J,蒙哥马利BL,他SY。植物生长防御的权衡:一种优化适应度的平衡行为。摩尔植物。2014;7(8):1267–87.https://doi.org/10.1093/mp/ssu049.。
- 31
张毅,高瑞奇,董X,李X。植物抗病基因的功能获得性突变导致npr1-1抑制剂下游信号转导通路的组成性激活。2003;15(11):2636–46.https://doi.org/10.1105/tpc.015842。
- 32
Yadav V,Wang Z,Wei C,Amo A,Ahmed B,Yang X等。苯丙烷途径工程:对植物防御的新兴方法。病原体。2020; 9(4):312。https://doi.org/10.3390/pathogens9040312。
- 33。
关键词:全蝎肽LqhIT2,茉莉酸,苯丙素通路,水稻抗病性植物科学。2015;230:1-11。https://doi.org/10.1016/j.plantsci.2014.10.005。
- 34。
在绿色系中苯丙氨酸的生物合成与Shikimate。植物科学与技术,2013;
- 35。
Barros J, Dixon RA。苯丙氨酸和酪氨酸ammonia-lyases植物。植物科学进展;2010;https://doi.org/10.1016/j.tplants.2019.09.011。
- 36。
鲁H,罗T,傅H,王L,Tan Y,Huang J,等。水稻对抑制血清素生物合成介导的昆虫害虫的抵抗力。Nat植物。2018; 4(6):338-44。https://doi.org/10.1038/s41477-018-0152-7。
- 37。
梁丹,沈勇,倪铮,王强,雷智,徐宁,等。外源褪黑素的施用可通过调节猕猴桃叶片的抗氧化能力和黄酮类化合物的生物合成来延缓其衰老。植物科学与技术,2018;https://doi.org/10.3389/fpls.2018.00426。
- 38。
War AR, Paulraj MG, Ahmad T, Buhroo AA, Hussain B, Ignacimuthu S等。植物对食草昆虫的防御机制。植物信号处理技术研究进展。2012;https://doi.org/10.4161/psb.21663。
- 39。
Barros J, Serrani-Yarce JC, Chen F, Baxter D, Venables BJ, Dixon RA。双功能解氨酶在草细胞壁生物合成中的作用。Nat植物。2016;2(6):16050。https://doi.org/10.1038/nplants.2016.50。
- 40
Camm EL,塔GHN。苯丙氨酸氨裂解酶。植物化学。1973;12(5):961 - 73。https://doi.org/10.1016/0031-9422(73)85001-0。
- 41
Hasegawa S, Maier副总裁。肉桂酸羟基化及在葡萄柚组织中由苯基丙酮酸合成对香豆酸的酶。植物化学,1972;11(4):1365 - 70。https://doi.org/10.1016/s0031-9422(00)90089-x。
- 42
Barros J,Serk H,Granlund I,Pesquet E。高等植物木质化的细胞生物学。安·博特。2015;115(7):1053–74.https://doi.org/10.1093/aob/mcv046。
- 43
刘Q,罗L,郑L.荔枝素:植物中的生物合成和生物学功能。int j mol sci。2018; 19(2):335。https://doi.org/10.3390/ijms19020335。
- 44.
圣地亚哥R,Barros-Rios J,Malvar Ra。细胞壁组成对玉米对害虫和疾病的影响。int j mol sci。2013; 14(4):6960-80。https://doi.org/10.3390/ijms14046960。
- 45.
Alejandro S,Lee Y,Tohge T,Sudre D,Osorio S,Park J等人。ATABCG29是涉及木质素生物合成的单核醇转运蛋白。Curr Biol。2012; 22(13):1207-12。https://doi.org/10.1016/j.cub.2012.04.064。
- 46.
李建平,李建平。水杨酸在植物中的生物合成。植物科学与技术,2000,11:349。https://doi.org/10.3389/fpls.2020.00338。
- 47.
王勇,曹磊,张勇,曹超,刘芳,黄芳,等。水稻抗褐飞虱B3域隐性基因BPH29的克隆及特性分析实验机器人。2015;66(19):6035-45。https://doi.org/10.1093/jxb/erv318。
- 48.
他j,刘y,袁d,段m,刘y,沉z等。R2R3 MYB转录因子通过调节水稻中的苯丙氨酸氨酶途径来赋予褐色的Planthopper抗性。Proc Natl Acad SCI U S A. 2020; 117(1):271-7。https://doi.org/10.1073/pnas.1902771116。
- 49.
Howe Ga,Jander G.植物免疫食草动物。Annu Rev植物Biol。2008; 59(1):41-66。https://doi.org/10.1146/annurev.arplant.59.032607.092825。
- 50.
Tamura Y,Hattori M,Yoshioka H,Yoshioka M,Takahashi A,Wu J,et al.水稻褐飞虱抗性基因BPH26的图位克隆与鉴定栽培稻L. SSP。籼稻品种ADR52。SCI REP。2014; 4(1):5872。
- 51.
刘勇,吴浩,陈浩,刘勇,何杰,康浩,等。一个编码凝集素受体激酶的基因簇赋予水稻广谱持久的抗虫性。纳特生物技术公司。2015;33(3):301–5.https://doi.org/10.1038/nbt.3069。
- 52.
Ji H,Kim S,Kim Y,Suh J,Park H,Sreenivasulu n等。从野生稻赋予棕色Planthopper(BPH)虫害的野生稻(BPH)虫害的地图克隆和表征BPH18基因。SCI批准。2016; 6(1):34376。https://doi.org/10.1038/srep34376。
- 53.
1 . van der Knaap E, Song W, Ruan D, Sauter M, Ronald PC, kade H. effects of phosphatase and phosphatase in protein kinase in rice and phosphatase in rice . chinese journal of science and engineering, 2013, 34 (1): 1 - 7 . [10]植物杂志。1999;120(2):559 - 69。https://doi.org/10.1104/pp.120.2.559。
- 54
Giri J, Vij S, Dansana PK, Tyagi AK。水稻A20/AN1锌指胁迫相关蛋白(SAP1/11)与受体样胞质激酶(OsRLCK253)通过A20锌指相互作用,获得转基因拟南芥的非生物胁迫耐受性。新植醇。2011;191(3):721 - 32。https://doi.org/10.1111/j.1469-8137.2011.03740.x。
- 55
Wan J,Tanaka K,张X-C,儿子GH,Brechenmacher L,Nguyen Thn,等。Lyk4是一种赖辛基序受体样激酶,对于拟南芥中的甲壳素信号传导和植物先天免疫性是重要的。植物理性。2012; 160(1):396-406。https://doi.org/10.1104/pp.112.201699。
- 56
杜布泽等[j]。水稻OsDREB基因编码转录激活因子,在干旱、高盐和冷响应基因表达中发挥作用。植物j . 2003; 33(4): 751 - 63。https://doi.org/10.1046/j.1365-313X.2003.01661.x。
- 57。
SEO JS,JOO J,Kim MJ,Kim YK,Nahm BH,Song Si等。OSBHLH148是一种基本的螺旋环 - 螺旋蛋白,与奥斯妥甲酸蛋白在茉莉酸盐信号通路中相互作用,导致水稻的耐旱性。工厂J1111; 65(6):907-21。https://doi.org/10.1111/j.1365-313X.2010.04477.x。
- 58。
Vannini C, Iriti M, Bracale M, Locatelli F, Faoro F, Croce P,等。拟南芥中Osmyb4基因的异位表达增强了水稻对非生物、环境和生物胁迫的耐受性。植物病理学杂志。2006;69(1):26-42。https://doi.org/10.1016/j.pmpp.2006.12.005。
- 59。
Yokotani n,Sato Y,Tanabe S,Chujo T,Shimizu T,Okada K,等。Wrky76是一种稻米转录压缩机,在抗癌性和冷应力耐受性中起相反应的作用。J Exp Bot。2013; 64(16):5085-97。https://doi.org/10.1093/jxb/ert298。
- 60。
Silva Sanzana C、Estevez JM、Blanco Herrera F。植物-蚜虫相互作用中细胞壁聚合物及其修饰酶的影响。J实验机器人。2020;71(13):3854–64.https://doi.org/10.1093/jxb/erz550。
- 61。
蚜虫水凝胶唾液中蛋白质的功能评价。植物科学与技术,2016;
- 62。
Kubicek CP,Starr TL,玻璃NL。植物细胞壁降解酶及其在植物致病真菌中的分泌。Annu Rev phytopathol。2014; 52(1):427-51。https://doi.org/10.1146/annurev-phyto-102313-045831。
- 63。
植物细胞壁介导免疫:细胞壁变化触发抗病反应。植物j . 2018; 93(4): 614 - 36。https://doi.org/10.1111/tpj.13807。
- 64
miedes e,lorences ep。Xyloglucan内甘油糖苷基酶/水解酶(Xths)在番茄果实感染中的含义。一个JAgric Food Chem。2007; 55(22):9021-6。https://doi.org/10.1021/jf0718244。
- 65
C, Brulé D, Chiltz A, Granet L,等。在葡萄和拟南芥中,细胞壁衍生的木葡聚糖是一种新型的DAMP触发植物免疫的物质。植物科学与技术,2018;https://doi.org/10.3389/fpls.2018.01725。
- 66
郝平,刘聪,王勇,陈R,唐M,杜B,等。食草动物诱导的水稻筛板胼胝质沉积:寄主抗性的重要机制。植物生理学。2008;146(4):1810–20.https://doi.org/10.1104/pp.107.111484。
- 67
辛格A,Pandey A,Baranwal v,Kapoor S,Pandey GK。稻磷脂酶D基因家族综合表达分析在非生物应激和发育中的综合表达分析。植物信号表现。2012; 7(7):847-55。https://doi.org/10.4161/psb.20385。
- 68.
长野M, Ishikawa T, Fujiwara M, Fukao Y, Kawano Y, Kawai-Yamada M等。质膜微域在水稻Rac1-RbohB/ h介导的免疫中是必不可少的。植物细胞。2016;28(8):1966 - 83。https://doi.org/10.1105/TPC.16.00201。
- 69.
Todd J,后beittenmiller D, Jaworski JG。KCS1编码一个影响拟南芥蜡合成的脂肪酸延长酶3-酮酰辅酶a合成酶。植物j . 1999; 17(2): 119 - 30。https://doi.org/10.1046/j.1365-313x.1999.00352.x.。
- 70。
王X,guan y,张d,dong x,tian l,qu lq。β-酮酰基-CoA合酶参与水稻叶子切割蜡合成,并且需要Cer 2样蛋白作为辅因子。植物理性。2017; 173(2):944-55。https://doi.org/10.1104/pp.16.01527。
- 71.
薛D,张X,陆X,陈G,陈Z。植物抗旱性角质层蜡的分子进化机制。前植物科学。2017;8:621.https://doi.org/10.3389/fpls.2017.00621。
- 72.
万鹏,周锐,南达生,何娟,袁胜,王伟,等。两个褐飞虱群体对含Bph1的Mudgo水稻的表型和转录组反应Sci众议员2019;9(1):14049。https://doi.org/10.1038/s41598-019-50632-z。
- 73.
在培养液中种植水稻的常规程序。入选:Yoshida S, Forno DA, Cook JH, Gomez KA,编辑。水稻生理研究实验室手册。菲律宾:国际水稻研究所;1976.61 - 6页。
- 74.
Velusamy R,Heinrichs EA,Medrano FG。温室技术识别棕色Planthopper,Nileaparvata Lugens(Stål)(Homoptera:Delphacidae),水稻品种。作物科。1986; 5(5):328-33。https://doi.org/10.1016/0261-2194 (86)90112-2。
- 75.
黄舍,郑舍,陈CN,吴WJ。台湾棕色植物料斗生物型的生物测定。J台农业res。2016; 65:84-91。
- 76.
林海英,吴玉萍,郝等,何世伟,魏福杰,邢勇,等。台湾水稻种质资源遗传多样性研究。底部螺柱。2012;53:363–76.
- 77.
国际水稻研究所。水稻标准评价体系。菲律宾:国际水稻研究所;2002.
- 78
水稻(Oryza sativa L.) 10个抗BPH基因的25个近等基因系(NILs)的建立:产量、抗性谱和分子分析。中国生物医学工程学报。2017;130(11):2345-60https://doi.org/10.1007/s00122-017-2963-8。
- 79
NIH图像到ImageJ: 25年的图像分析。Nat方法。2012;9(7):671 - 5。https://doi.org/10.1038/nmeth.2089。
- 80。
Ewels P、Magnusson M、Lundin S、Kaller M。MultiQC:在一份报告中汇总多个工具和样品的分析结果。生物信息学。2016;32(19):3047–8.https://doi.org/10.1093/bioinformatics/btw354。
- 81。
Bolger Am,Lohse M,Usadel B. Trimmomatic:用于Illumina序列数据的灵活修剪器。生物信息学。2014; 30(15):2114-20。https://doi.org/10.1093/bioinformatics/btu170。
- 82。
(1) Kawahara Y, de la Bastide M, Hamilton JP, Kanamori H, McCombie WR,欧阳等。利用新一代水稻序列和光学图谱资料改良日本水稻参考基因组。大米。2013;6(1):4。https://doi.org/10.1186/1939-8433-6-4。
- 83。
Kim D,Langmead B,Salzberg SL。Hisat:一种快速拼接对齐器,内存要求低。NAT方法。2015; 12(4):357-60。https://doi.org/10.1038/nmeth.3317。
- 84。
Liao Y,Smyth GK,Shi W. FeatureCounts:用于分配序列的有效通用程序读到基因组特征。生物信息学。2014; 30(7):923-30。https://doi.org/10.1093/bioinformatics/btt656。
- 85。
Anders S,Huber W.序列计数数据的差异表达分析。基因组Biol。2010; 11(10):R106。https://doi.org/10.1186/gb-2010-11-10-r106。
- 86。
DESeq2对RNA-seq数据的fold change和dispersion的调节估计。基因组医学杂志。2014;15(12):550。https://doi.org/10.1186/s13059-014-0550-8。
- 87。
控制错误发现率-一个实用和强大的方法,多重测试。英国皇家中央集权主义出版社,1995;
- 88
Thimm O,BläsingO,Gibon Y,Nagel A,Meyer S,KrügerP,等。Mapman:一个用户驱动的工具,可以在代谢途径和其他生物过程图中显示基因组学数据。工厂J. 2004; 37(6):914-39。https://doi.org/10.1111/j.1365-313X.2004.02016.x。
- 89
天t,刘y,yan h,你q,yi x,du z等。Agrigo v2.0:2017年农业社区的GO分析工具包。核酸RES。2017; 45(W1):W122-W9。https://doi.org/10.1093/nar/gkx382。
- 90.
(1)佐藤Y,并木N,武久H, Kamatsuki K, Minami H, Ikawa H,等。检索水稻共表达基因网络的平台。核酸研究2013;41(数据库版):D1214-21。https://doi.org/10.1093/nar/gks1122。
- 91。
Kolde R. Pheatmap:漂亮的热爱[软件]。2015年。
- 92。
水稻硫胺素生物合成基因的过量表达增加了水稻叶片和粗粒硫胺素的含量,但对水稻白叶枯病菌(Xanthomonas oryzae pv)的抗性没有影响。oryzae。植物科学与技术,2016;
- 93。
吴婷,张敏,张宏,黄凯,陈敏,陈聪,等。水稻耐旱基因EDT1的鉴定与鉴定。植物生物学杂志。2019;62(1):39–47.https://doi.org/10.1007/s12374-018-0203-7。
- 94。
关键词:水稻,CCCH串联锌指蛋白,OsC3H47, ABA,抗旱性生物化学与生物物理学报,2015;https://doi.org/10.1016/j.bbrc.2015.05.087。
- 95.
发展R.核心团队。R:统计计算的语言和环境。维也纳,奥地利:统计学的基础。计算。2010年。
致谢
我们感谢国立台湾大学王淑仁博士慷慨提供TN1种子。我们感谢张menchi博士(国立台湾大学)和Liang-Jwu Chen博士(国立中兴大学)对数据分析和讨论的建议。
资金
这项工作得到了台湾科技部的资助,资助号为106–2311-B-002-025和107–2311-B-002-018-MY3(WPC)
作者信息
从属关系
贡献
WPC构思并设计了实验;YL、YHK和SCL进行了实验;YL、BHC和YFF对数据进行分析;BHC、CTL、SHH、YFL和WPC指导了研究并对结果进行了讨论;BHC, YFL和WPC撰写了论文。所有作者阅读并批准最终稿件。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者声明他们没有利益冲突。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
三十RNA-SEQ样品的主成分分析(PCA)曲线图。该样品由三种实验条件(对照,BPH或Leaffolder侵扰)和两个组织(叶子,护套)组成,每种组合有五种生物重复。图。S2。通过手动整理GO层次树图,筛选出响应叶卷的deg的非冗余GO术语。浓缩的一种与对照相比,叶片中上调的基因,B.Leaffolder中的下调基因VS Control_Leaf比较和C叶鞘中上调基因与对照的比较。图S3。通过手动管理GO层次树图,筛选出BPH-responsive deg的非冗余GO术语。浓缩的一种BPH VS Control_Leaf比较的上调基因比较,B.与对照相比,BPH下调了基因CBPH与Control_Sheath比较的上调基因。
附加文件2:表S1。
原始读取的统计和每RNA-SEQ样品的清洁读数映射到大米参考基因组。
附加文件3:表S2。
差异表达基因列表。显示上调和下调的基因一种Leaffolder VS Control_Leaf比较,B.Leaffolder VS Control_Sheath比较,CBPH vs control_leaf比较,D.前列腺增生与对照组比较E.叶子和F叶柄和褐飞虱侵染下的叶鞘。
附加文件4:表S3。
青柳叶片和褐飞虱侵染下防御激素应答基因的表达变化
附加文件5:表S4。
清流24日DEG的GO富集结果详情 草食动物。一种叶夹与对照叶比较中上调的基因,B.与对照相比,叶片中表达下调的基因,CLeaffolder中的上调基因与Control_Sheath比较和D.下调基因在叶面与对照-鞘的比较。
附加文件6:表S5。
在BPH侵扰的24小时时,Qingliu的Degs的富集结果的细节。一种前列腺增生与对照组比较中的上调基因,B.BPH与Control_Sheath比较中的下调基因,CBPH VS Control_Leaf比较的上调基因D.与对照相比,BPH下调基因。
附加文件7:表S6。
清柳褐变虫鞘中DEGs的MapMan通路注释结果。的映射结果一种受体激酶,B.生物压力和C表明了代谢概述。
附加文件8:表S7。
合并的Go和Mapman结果在24小时的BPH-infested护套中的DEGS的结果。一种转录因子,B.细胞壁修饰和C脂质代谢。
附加文件9:表S8。
用于qRT-PCR扩增的引物。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
李,Y.,Cheah,B.H.,Fang,YF。等等。转录组织鉴定了水稻对叶片喂养和植物饲喂食草动物的关键防御机制。BMC植物BIOL.21,306(2021)。https://doi.org/10.1186/s12870-021-03068-5
收到:
公认:
发表:
关键词
- 栽培稻
- 藏红花
- 褐飞虱
- RNA序列
- 双阻力