摘要
背景
PTI1(Pto-interacting-1)蛋白激酶属于受体样蛋白激酶(RLK)的受体样细胞质激酶(RLCK)组,但缺乏胞外和跨膜结构域。PTI1首先在番茄中被鉴定(Solanum lycopersicum.)和命名SlPTI1据报道,已据报道,与细菌效应PTO相互作用,血液/苏氨酸蛋白激酶参与植物抗细菌疾病。简而言之,宿主PTI1具体识别和与细菌效应AVRPTO相互作用,这触发过敏细胞死亡以抑制局部感染部位的病原体生长。以前的研究表明PTI1与氧化应激和过敏有关。
结果
我们确定了12个推定PTI1谷子基因组的基因(Setaria italica)在本研究中。基因复制分析表明,两个片段的复制事件在基因扩增中都起着重要的作用PTI1谷子基因家族。这PTI1模型植物的家族成员,即。美国italica拟南芥(拟南芥蒂利亚纳)、水稻(栽培稻),玉米(Zea Mays.),S圣女果,还有大豆(大豆),根据系统发育分析分为六大类,其中PTI1Foxtail Millet的家庭成员与水稻和玉米的同源性更高。分析一套SiPTI1基因/蛋白质包括分类、染色体定位、同源关系和复制。组织表达特征显示SiPTI1基因主要在茎和叶中表达。实验qRT-PCR结果表明,12SiPTI1基因是由多重胁迫诱导的。亚细胞定位显示谷子全部为谷子啜饮本地化为血浆膜。另外,异源表达sipti1-5.在酵母和大肠杆菌提高了它们对盐胁迫的耐受性。
结论
我们的研究结果有助于更全面地理解PTI1蛋白激酶的作用,并将有助于确定特定PTI1的优先顺序,以供将来在谷子中进行功能验证研究。
背景
PTI1(PTO-相互作用1)蛋白激酶属于受体样细胞质激酶(RLCK)的受体样蛋白激酶(RLK),但缺乏细胞外和跨膜结构域[1那2]. 在植物中,PTI1在植物抵御细菌性病原体的过程中起着重要的作用。它首先在番茄中被鉴定,并被证明能特异识别由病原菌注入植物细胞的AvrPto效应蛋白并与其相互作用,从而触发下游防御反应[3.].
PTI1通常包含一个由250到300个氨基酸残基组成的激酶结构域[4.],并具有STKc_IRAK、Pkinase_Tyr、STYKc和SPS1等特征域[5.那6.].近年来,PTI1基因在番茄等许多物种中已被广泛鉴定(Solanum lycopersicum.)[3.那7.),拟南芥(拟南芥蒂利亚纳)[1那8.],玉米(Zea Mays.)[9.那10.],大豆(大豆)[11.那12.),黄瓜(Cucumis sativus)[13.]和大米(栽培稻)[14.].
PTI1不同物种和亚型的基因参与不同的过程。在拟南芥中,PTI1–1,PTI1–2,PTI1–3,PTI1–4和PTI1–5被报道与蛋白激酶氧化信号诱导物1(OXI1)相互作用,并被OXI1磷酸化以响应磷脂酸(PAs),H2O.2、flg22和木聚糖酶[8.那15.]. 此外,第1–2页/第1–4页对氧化应激的反应OXI1-PTI1-2/第1–4页通路(1那8.]. 非生物胁迫激活第1–2页也增强了活性氧(ROS)应激反应基因的表达[1].Oxi1-PTI1还参与MAPK信号通路的激活,这反过来反应氧化和生物应力[8.那16.].第1–5页敲除影响花粉管的生长,导致雄性配子细胞无菌[15.].番茄SlPTI1与Pto相互作用并被Pto激活,调控病原菌入侵时的下游信号转导[3.那17.].有四名成员PTI1s在玉米中ZmPTI1a型参与花粉传播[9.].这ZmPTI1a型异源过表达的拟南芥表现出更强的耐盐性,与野生型植物相比,具有更高的鲜重和干重[10.].Overexpressing黄瓜CsPTI1-L在烟草中,通过上调多个抗性相关基因来提高烟草的耐盐性[13.].过度的OsPTI1公司增加水稻对真菌入侵的抵抗力[14.].
谷子(Setaria italica)约8700年前在新石器时代的中国被驯化,几千年来一直被视为中国重要的主食[18.那19.].它具有吸引人的特性,如小的二倍体基因组(~ 510 Mb) [20., DNA重复率低,生命周期短,C4光合作用[21.那22.].这些特性使它成为探索基本生物学过程的模范作物,如植物的构造、生理和基因组进化[23.那24.].同时,福克斯山块的应力和贫瘠耐受特性使它们降低了对合成肥料,农药,除草剂和杀虫剂的依赖性[25.]. 谷子种植可以减少对世界范围内数量有限的主要谷物的过度依赖[23.].特别是在全球新冠肺炎疫情困难时期,谷子在稳定粮食生产、保障全球经济和民生方面的战略作用越来越受到世界各国的关注[26.那27.].分析谷子的抗逆性和品质性状对现代谷子种质资源的开发具有重要意义。随着分子生物学的快速发展,谷子全基因组的测序和发表,使人们能够更好地了解这种作物的胁迫响应和分子调控机制[28.那29.].
PTI1谷子的基因家族尚未鉴定。在对谷子盐胁迫的转录组分析中,发现了一个功能未知的胁迫诱导基因Seita.5G023100.1[30.].JGI / NCBI Blast序列分析表明它是一种推定的PTI1蛋白激酶。考虑到PTI1蛋白在几种植物种类(如番茄)中的各种压力防御反应[3.那7.),拟南芥1那8.],玉米[9.那10.]迄今为止,谷子中未发现PTI1。系统分析PTI1本研究进行了基因家族研究,共12个PTI1对基因进行了鉴定。对它们的染色体位置和蛋白质结构进行了预测和分析。12的表达模式SiPTI1采用实时荧光定量PCR (qRT-PCR)对基因进行分析。我们的结果显示了这一点SiPTI1基因在盐胁迫和氧化胁迫反应中有差异表达。一个关键基因sipti1-5.这可能与盐胁迫有关被选作进一步的研究。过度的sipti1-5.在酵母和大肠杆菌(大肠杆菌)增强对盐胁迫的耐受性。
这些结果有助于加深我们对其特性和功能的认识PTI1谷子基因,也有助于确定潜在的非生物胁迫响应基因,以改善谷子和其他作物品种。此外,本研究也是国内外首次系统报道PTI1这也将为以后系统研究植物基因家族的功能提供参考PTI1在狐尾小米中的基因。与此同时,它还为研究的研究提供参考PTI1基因家族在其他物种中。
结果
啜饮谷子的鉴定与注释
我们对谷子盐胁迫的转录组分析揭示了一个功能未知的过表达基因(Seita.5G023100.1)[30.].JGI / NCBI Blast序列分析表明它是一种推定的PTI1蛋白激酶。鉴于PTI1蛋白参与各种压力防御响应和没有PTI1是之前在谷子中鉴定出来的,我们决定进一步分析PTI1以谷子为材料,对其盐胁迫反应基因家族进行鉴定,探讨其在作物改良中的应用。
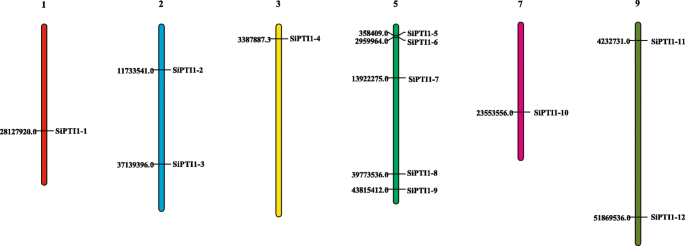
在本研究中,共有12个假定PTI1通过全基因组分析在谷子中鉴定出基因(表1额外的文件1). 这些基因被命名为sipti1-1.来sipti1-12.根据它们在染色体上的位置。谷子有9条染色体,大小从35.9 Mb(6号染色体)到58.9 Mb(9号染色体)SiPTI1图1中示出了粪码米特9颗染色体中的基因。1. 每个的具体位置SiPTI1染色体上的基因在附加文件中提供4..然而,分布的啜饮在染色体上是不均匀的,5个基因位于5号染色体上(sipti1-5.那sipti1-6那sipti1-7那sipti1-8, 和sipti1-9.)只有一个基因分别位于1号染色体、3号染色体和7号染色体上。有趣的是,9号染色体最长,但只有两条啜饮都位于上面(Sipti1-11和sipti1-12.). 因此,染色体长度与染色体数目之间不存在正相关关系PTI1基因。
通过SMART、NCBI-CDD和Pfam三个数据库进一步证实了它们的结构域。表中列出了基因分类和详细注释1.预测的SiPTI1s蛋白序列范围为362个氨基酸(SiPTI1-4) ~ 727个氨基酸(SiPTI1-5),相对分子质量为38.9802 ~ 80.9558 kDa。预测pI从6.01到9.26。除SiPTI1 - 5外,其余12个SiPTI1蛋白差异不大,一般PTI1蛋白激酶长度约为300-400个氨基酸,而SiPTI1 - 5编码727个氨基酸,最高分子量约为81 kDa。
植物系统发育分析啜饮与PTI1s其他植物种类
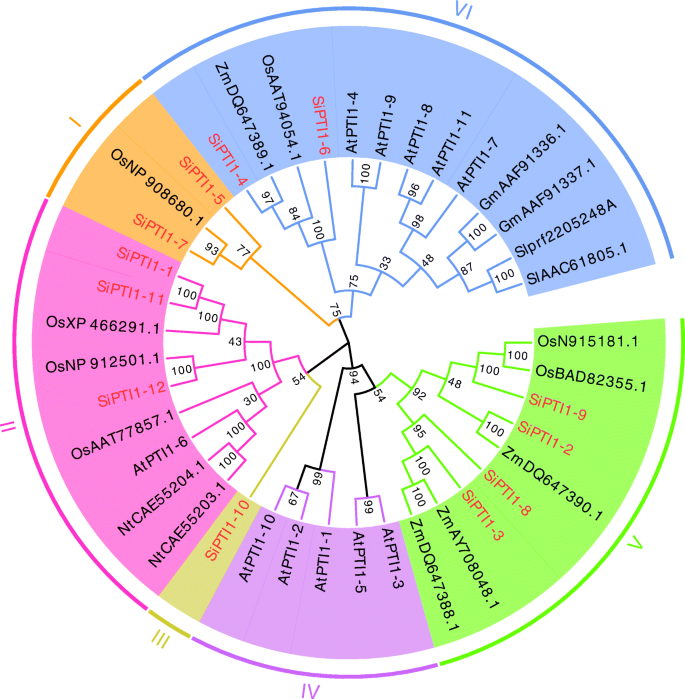
这PTI1近年来,在许多植物物种中发现了基因。根据公开的信息和相关程度,我们选择PTI1基因答:芥(在),o .漂白亚麻纤维卷(Os),烟草(尼科尼亚塔哈瓦姆) (Nt),Z. Mays.(Zm),S圣女果(Sl),以及g·马克斯(Gm)构建系统发育树PTI1基因的美国italica(国际单位制)。如(图。2额外的文件2),系统发育分析表明所有PTI1基因可分为六类,每个SiPTI1蛋白序列与其它植物的同源基因高度相似。由于观察到大量内部分支具有较高的引导值。系统发育树也显示谷子以谷子为主SiPTI1科分布以种偏优势,与禾本科(水稻和玉米)的亲缘关系更为密切,与双子叶拟南芥的远缘关系相对较远。
基因结构,图案模式分析PTI1谷子的基因
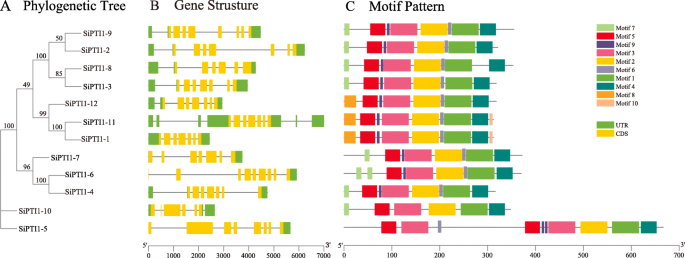
探索中国经济结构的多样性啜饮,分析其外显子-内含子结构的分布,并将其绘制在系统发育树中。如图所示。3.B,两PTI1基因(sipti1-9.和sipti1-5.)包含七个内含子,sipti1-8和sipti1-10.有5个内含子sipti1-6有八个内含子。的其余部分SiPTI1基因有六个内含子。外显子-内含子结构分析表明PTI1亚家族具有相似的外显子-内含子结构。玉米中也发现了类似的结果[31.]以及其他研究。
系统发育关系,基因结构与保守蛋白质基序的结构PTI1来自Foxtail Millet的基因。系统基于使用Mega7软件的Foxtail Millet PTI1蛋白的全长序列构建(一种).谷子的外显子-内含子结构PTI1基因。绿色框表示未翻译的5 ' -和3 ' -区域;黄色的盒子表示外显子;黑线表示内含子(B.).谷子PTI1蛋白的基序组成。数字1-10的图案在不同颜色的盒子里(C).每个主题的序列信息在附加文件中提供2.蛋白质的长度可以用底部的刻度来估计
其中的母题模式SiPTI1(图。3.C语言和附加文件3.). 共发现10个基序,其中5个基序高度保守。此外,所有SiPTI1S包含主题1、2、3、4和5。除了sipti1-10.,所有其他SiPTI1s包含图案6和9.此外,图案8在其中三个中被发现啜饮成员(sipti1-1.那Sipti1-11和sipti1-12.),而主题10仅在两个成员中呈现(sipti1-1.那Sipti1-11). 有趣的是sipti1-5.与家族其他成员不同的是,图案3、5、9各出现两次。尽管群体间的母题类型不同,但同一群体中的成员如sipti1-9.和Sipti1-2那sipti1-8和Sipti1-3那Sipti1-11和sipti1-1.倾向于展示相似的图案(图。3.A和C),表示它们之间的功能相似性。氨基酸序列分析显示,sipti1包含有代表性的激酶结构域,如STKC_IRAK、Pkinase_Tyr、STYKc和SPS1(数据未显示)。已知丝氨酸/苏氨酸激酶的催化结构域包含11个子结构域[31.那32.),堆积分析还显示12个SiPTI1激酶还包含了11个已知的保守子结构域PTI1基因SlPTI1在番茄(补充图。2).此外,当用玉米和水稻的PTI1序列比较粪码小米的Sipti1s序列时,发现丝氨酸/苏氨酸激酶的催化结构域还含有11个子域,其与Sipti1s和SLPTI1序列分析的结果一致(补充如图。3.).
独联体-作用元素和亚细胞定位PTI1谷子的基因
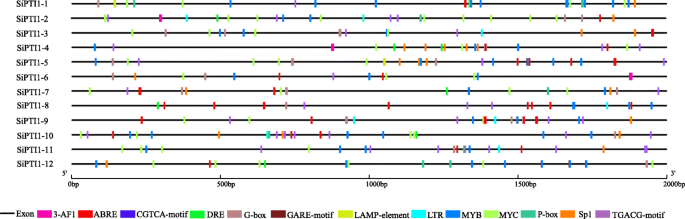
独联体-元素分析表明SiPTI1启动子基因含有MYB、MYC和ABA反应元件。除此之外sipti1-12.,包括CGTCA-motif和TGACG-motif独联体-谷子中含有微量元素PTI1基因家族(图。4.和附加文件5.).此外,50%的成员含有低温响应元件(LTR), 75%含有脱水响应元件(DRE)(图1)。4.和附加文件5.).此外,啜饮里面有大量的独联体-elements涉及光响应的调节元件,如Sp1、G-box和AF-box。同时还展示了赤霉素响应元件,如P-box和GARE-motif(图1)。4.和附加文件5.).
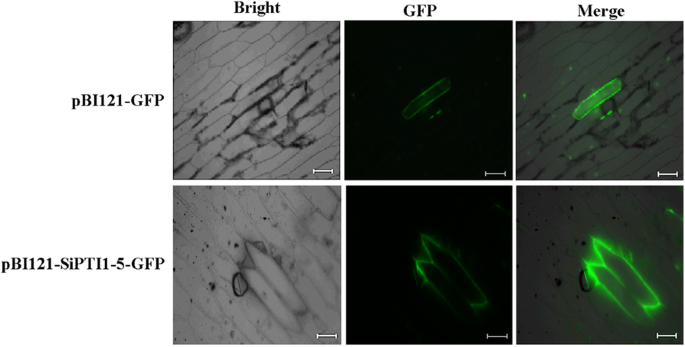
使用五种公开的亚细胞定位预测工具,我们发现所有的sipti1都被预测定位在质膜上(表1)1). 为了研究PTI1家族重要的耐盐相关基因SiPTI1–5在谷子中的潜在作用,我们检测了融合GFP的SiPTI1–5在洋葱表皮细胞中的亚细胞定位,并以GFP作为对照。通过共聚焦显微镜观察,SiPTI1–5-GFP的绿色荧光蛋白(GFP)荧光分布在洋葱细胞的质膜上(图。5.),表明SiPTI1-5定位于质膜。
重复和分化率SiPTI1基因
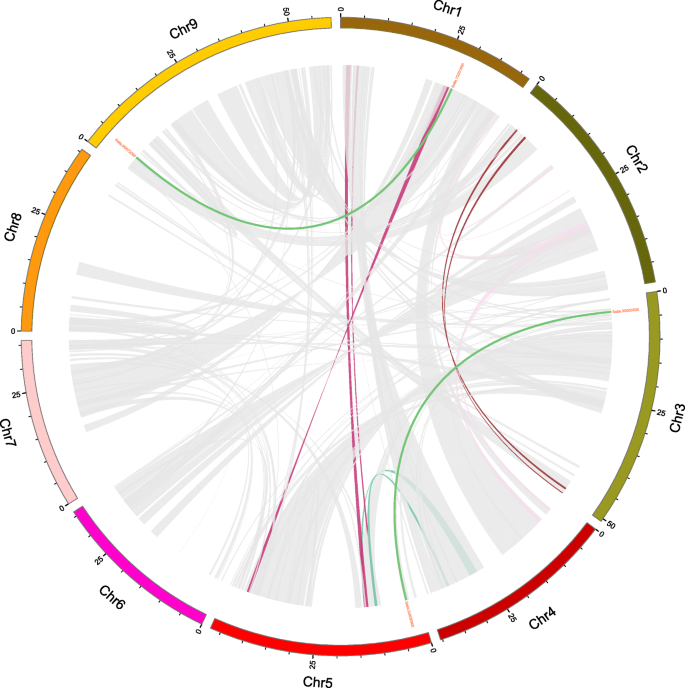
基因复制,包括片段复制和串联复制,长期以来被认为是基因家族进化和扩展的主要力量之一[33.].此外,还发现了两对片段重复的基因啜饮家庭 (sipti1-4/sipti1-6和sipti1-1./Sipti1-11)(图。6.和附加文件6.).进一步揭示重复事件和自然选择之间的关系,KA和KS值啜饮在重复的基因对中进行计算,发现Ka/Ks值小于1,表明SiPTI1家族经历了基因复制后的净化选择。
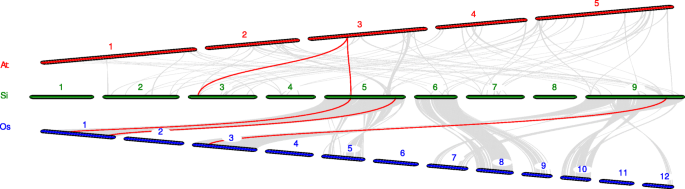
进一步推断谷子的系统发育机制PTI1家庭,我们构建了与两种代表性物种相关的两种比较同步地图,包括Dicots(拟南芥)和单子叶(米)(图。7.和附加文件7.).共2个SiPTI1这些基因与拟南芥的基因表现出同线性关系。而且,我们发现sipti1-4和sipti1-7呈现相同的共线基因(AT3G17410),水稻中的三种基因与狐尾小米有一个水分关系啜饮(sipti1-9./Os01t0899000那sipti1-7/Os01t0323100那sipti1-12./OS03T0226300.).另外,与拟南芥相比那这PTI1s谷子基因与水稻的同源性较高PTI1基因,基因组之间的水分性更丰富。
的表达模式SiPTI1
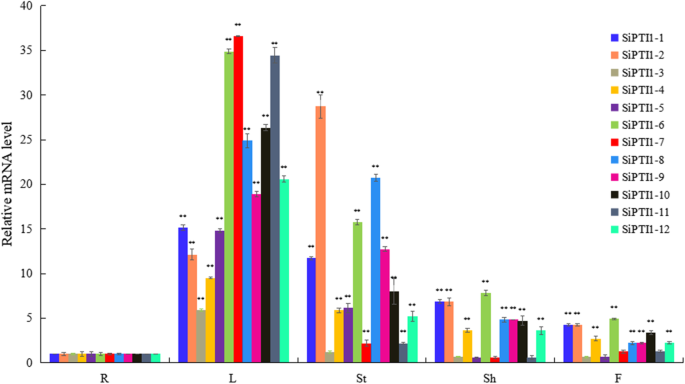
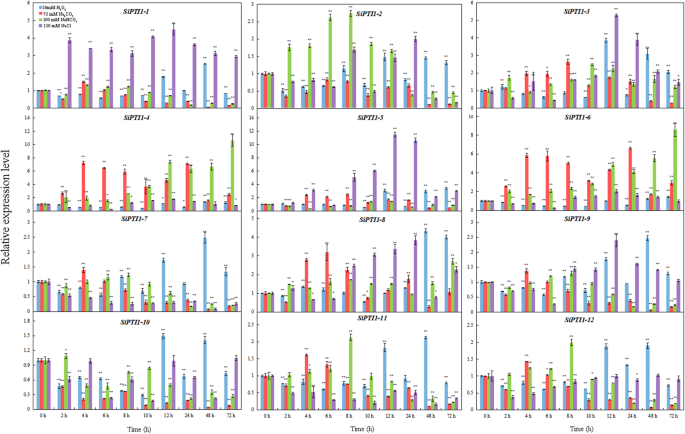
研究12个基因的组织特异性表达SiPTI1以谷子为材料,制备了根、茎、叶、鞘和花的总RNA,并用qRT-PCR进行了分析。如图。8.和额外的文件9.,这些的表达式SiPTI1基因在茎和叶中的表达量最高,其次是鞘和花,根的表达量最低。除外Sipti1-3那sipti1-7, 和Sipti1-11,表达水平啜饮茎中的家系成员比根中的家系成员高5倍以上,并且所有的表达水平SiPTI1叶片中的科成员数量也比根部高5倍以上。这些结果表明SiPTI1基因可能在茎和叶中发挥重要的功能。
进一步确认是否表达SiPTI1利用qRT-PCR技术检测12个基因在不同非生物胁迫下的表达SiPTI1NaCl、NaHCO处理诱导不同盐胁迫下植物的基因表达3., Na2CO.3.和H2O.2.如图所示。9.和附加文件9.,大部分的表达式SiPTI1基因对非生物应激处理敏感。表达模式SiPTI1NaCl-Regress下的基因可以分为三类。首先,波动变化,包括Sipti1-2那sipti1-4那sipti1-6和sipti1-10..第二,上调表达趋势,如sipti1-1.那Sipti1-3那sipti1-5.那sipti1-8和sipti1-9.. 其中NaCl诱导的表达量最高SIPTI1-5。此外,表达sipti1-5.当盐应激处理到达12小时时达到峰值,这约为11倍与对照进行比较。最后一个,下调表达,包括sipti1-7那Sipti1-11和sipti1-12.. 另外,在H2O.2治疗,大多数啜饮在12小时诱导(图。9.). 在Na之下2CO.3.治疗,大多数啜饮在4小时和6小时诱导,然后在8小时后下调。而且,除了上调的情况SiPTI1-4.那SiPTI1-6.和SiPTI1-8.,其他啜饮在Na作用下没有明显的诱导和/或下调2CO.3.治疗,如SiPTI1-1和SiPTI1-10.(无花果。9.).此外,根据NaHCO3.压力,SiPTI1-4.和SiPTI1-6.显著诱导(图。9.).重要的,Sipti1-3和sipti1-5.在各种压力条件下全部调节。他们之中,sipti1-5.在NaCl应激下显着诱导至11.5倍的变化(图。9.).
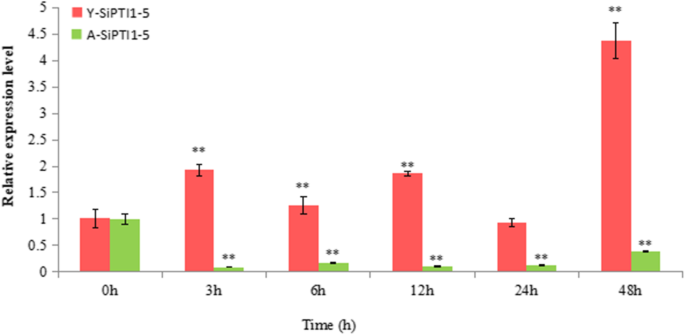
为了进一步评价其作用sipti1-5.在盐胁迫下,蛋白质的表达sipti1-5.基因在“yugu1”,耐盐品种和“An04”中进行比较,盐(NaCl)处理下的盐敏感品种。结果表明表达了sipti1-5.基因在‘渔谷1号’中表达上调,而在‘AN04’中表达下调。10.和附加文件9.).
过度的sipti1-5.在酵母中赋予了耐盐性
在无盐胁迫的YPD培养基中,对照菌株(用pYES2转化)和对照菌株之间几乎没有差异sipti1-5.-表达酵母菌(转化为pYES2-SiPTI1-5)(图。11.). 当暴露于钠时2CO.3.(8 毫米,10 嗯)还有NaHCO3.(15 毫米,20 mM)处理、控制应变和sipti1-5.-表达酵母菌在不同浓度下菌斑生长无差异,说明sipti1-5.不能耐受Na2CO.3.和Nahco.3.酵母压力,这与表达模式一致吸管1–5回应Na2CO.3.和Nahco.3.(无花果。11.). 对照组和对照组的生长没有差异sipti1-5.-12岁以下酵母 mM不适用2CO.3.和25毫米NaHCO3.(数据未显示)。在NaCl胁迫下,当NaCl浓度增加到0.6 M时,表达sipti1 - 5的酵母菌比对照菌株生长得更好(图5)。11.).总的说来,sipti1-5.这些基因可能参与了NaCl诱导的盐胁迫反应。
过度的sipti1-5.在大肠杆菌具有耐盐性
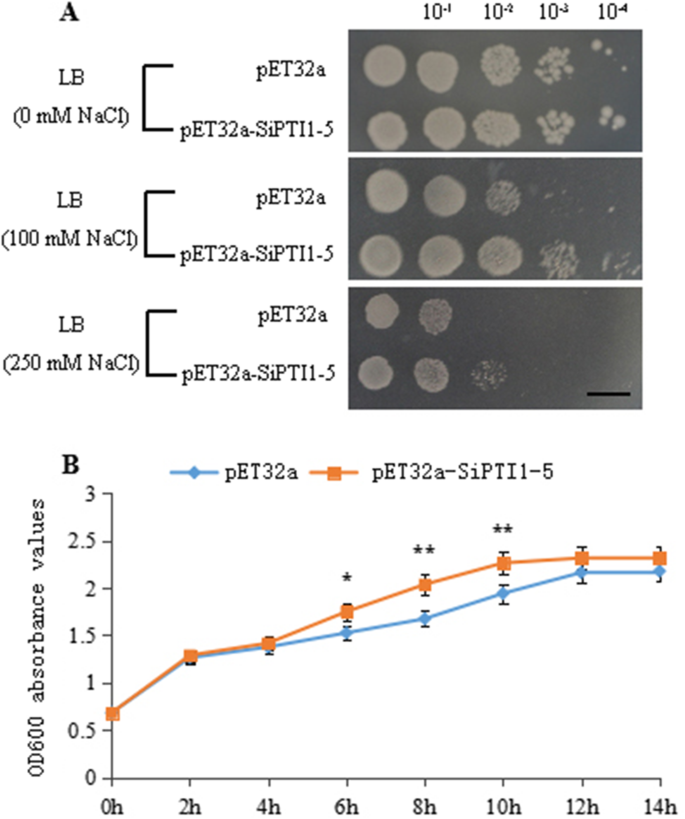
为探讨SiPTI1-5蛋白激酶与盐胁迫的关系,对对照组和对照组进行了体外耐盐性试验sipti1-5.-表达菌株(图。12.A).转化后的群体数量没有显著差异大肠杆菌窝藏sipti1-5.而在正常条件下,则表示过表达sipti1-5.没有影响成长吗大肠杆菌重组剂在非应激条件下。然而,当在补充100mM NaCl或更高的Luria-Bertani(LB)板上生长时,转化细胞的数量比对照的更好。在液体LB中获得类似的结果,具有250mM NaCl,生长速率SiPTI1-5 -过表达菌株比对照菌株高,且提前到达了对数生期,说明含有pET32a-SiPTI1-5重组质粒的菌株与对照相比具有一定的耐盐能力(图1)。12.B) 是的。
这些结果表明sipti1-5.在大肠杆菌对盐胁迫的耐受性显著增强。
讨论
系统发育分析表明SiPTI1基因在禾本科植物中是保守的
在本研究中,共有12名成员PTI1从谷子中鉴定出基因家族。所有家族成员均具有相似的分子量和结构特征sipti1-5..来自各种植物物种的大部分PTI1含有约300-400氨基酸(AA),而Sipti1-5含有727个氨基酸,其分子量为约81kDa。之前的报道显示,大多数PTI1s由300-400AA组成,分子量为约40kDa,例如大豆的Gmpti1(366A)[12.]番茄SlPTI1(370AA)[3.]、OsPTI1 (368 aa) [14.]黄瓜的CsPTI1-L(362 aa)[13.].较大的SiPTI1-5是否具有特定的功能有待进一步研究。
系统发育分析表明,每个SiPTI1蛋白序列与水稻和玉米的同源序列相似。这意味着同源蛋白质将共享来自同一祖先的类似功能[34].它揭示了大多数Foxtail小米分布的物种偏见SiPTI1禾本科种的基因,与双子叶种的同源基因比较。这与目前对植物进化史的理解是一致的[35].作为一种合理的系统方法,这种基于系统发育的功能预测已经应用于水稻等其他植物的胁迫响应蛋白预测[36]和玉米[37].
谷子生物学功能的新见解PTI1通过组合基因表达,系统发育和联合症分析可以推断基因,以及与已知功能的比较PTI1模式植物的基因。例如,sipti1-5.与水稻OsNP_908680同源性最高(OsPTI1b)介导超敏反应(hypersensitive response, HR),表明sipti1-5.可能与谷子有相似的功能。Sipti1-3表现出高度的相似性ZmPTI1b型和ZmPTI1a型,这意味着它可能参与了花的发育和防御胁迫[31.那38].此外,PTI1蛋白序列的多序列比对表明,PTI1蛋白在番茄、水稻、玉米和谷子中均较为保守。特别是激酶催化结构域高度保守(补充图)。2和补充图。3.).
实验证实了SiPTI1-5的质膜亚细胞定位。5.). 有趣的是,sipti1缺乏预测的跨膜结构或信号肽。因此,我们推测它的质膜定位是由于与质膜蛋白相互作用的结果[39]. 已有研究表明,水稻OsPTI1a通过N端棕榈酰化作用定位于质膜上,并在质膜上形成复合物参与免疫应答[39].随着系统发育树枝表明SiPTI1谷子基因家族成员与水稻和玉米关系密切,推测谷子的作用机制啜饮可能类似于大米和玉米。
表达模式啜饮非生物胁迫
土壤中无机盐浓度过高对植物的生长发育是必不可少的,但对植物造成了严重的损害[40那41],从离子中毒[42那43]、渗透应力[44那45]氧化应激[46那47].盐胁迫是非生物胁迫的一个重要来源[48那49全球范围内占耕地的20%,超过40%的灌溉土地[50那51]全世界都被认为有一定程度的盐分过剩[52那53].因此,研究植物尤其是农艺作物的耐盐机理就显得尤为重要。
在本研究中,qRT-PCR分析揭示了SiPTI1不同盐度处理下的基因(150 毫米氯化钠,100 嗯,纳科3.、75mm Na2CO.3.)(图。9.).在十二个中SiPTI1基因,表达sipti1-5.不同处理12h均有明显诱导。众所周知,盐胁迫通常伴随着ROS(包括H)的过度积累2O.2,导致蛋白质、DNA和脂质氧化损伤[54]. ROS也参与细胞增殖的调控[55],细胞防御[56]和信号转导[54那57]. 因此,氧化应激对研究植物耐盐机制具有重要意义。有趣的是sipti1-5.NaCl和H2O.2,表明这一点sipti1-5.通过调节ROS动态平衡参与盐胁迫反应。众所周知,丝氨酸/苏氨酸蛋白激酶OXI1介导氧化应激信号。以前的研究报告说AtPTI1-2可以通过Oxi1激活响应PA,H.2O.2,鞭毛蛋白[13.].此外,第1–4页通过OXI1和MPK6信号传导级联信号在氧化应激中发出信号[8.]. 此外,这PTI1基因也被其他胁迫诱导。例如,GmPTI1公司通过水杨酸和伤害诱导表达[12.],ZmPTI1–1号被淤积酸(ABA)和甘露醇显着诱导[58),CsPTI1-L当黄瓜植株受到真菌病原体攻击时,诱导黄瓜表达Sphaerotheca Fuliginea或者用盐处理[13.].众所周知,启动子可以调节基因的时间和空间表达,以及独联体- 通过与反作因子相互作用,启动子中的-ELEMENTS对基因函数调节至关重要。在这项研究中,启动子SiPTI1对家庭成员进行了分析,并对大量的独联体发现了与应激反应相关的元素(如MYB、MYC、ABRE和DRE)。同时,qRT-PCR检测结果SiPTI1家庭成员表明,它们可以由各种盐度和氧化应激引起的,这与先前的报告完全相关。此外,表达式sipti1-5.在“yugu1”和“An04”下分析盐度(图。10.),这意味着sipti1-5.与盐应激反应呈正相关。
sipti1-5.基因与耐盐性有关
这PTI1首次在番茄中发现了该基因,该基因参与了Pto介导的信号传导途径,是番茄的下游成员动力输出轴植物-病原相互作用过程中的磷酸化级联反应[3.].此外,在拟南芥中,PTI1家族的不同成员已经被报道在应激反应中发挥作用[1那8.],大豆[12.黄瓜[13.].这PTI1单子叶玉米中的基因[31.)、小麦(39那59],还有米饭[39那59]分别参与了花的发育和胁迫反应。据报道,过度表达PTI1类基因ZmPTI1型提高了拟南芥的抗盐性[38],过度表达ZmPTI1–1号显著提高拟南芥的耐旱性[58].此外,表达CsPTI1-L黄瓜积极调节病原体防御和盐胁迫的反应[13.].在目前的研究中,我们的结果显示过度表达sipti1-5.酵母中的基因大肠杆菌. 菌株提高了耐盐性。结合其应激诱导,我们推测sipti1-5.基因在谷子对盐度和氧化反应的响应中起着重要作用。然而,磷酸化级联反应中详细的盐度响应机制有待进一步证实。
结论
一共有12个假定SiPTI1通过全基因组分析,确定了谷子的基因。染色体分布,内含子-外显子结构,基序,复制和分化率,独联体-作用元件和亚细胞定位的结果蛋白质进行了分析。植物的同源性分析和系统发育比较PTI1来自几种不同植物的基因为研究谷子的进化特征提供了有价值的线索SiPTI1基因。SiPTI1基因在谷子的生长发育中起着重要的作用,其表达模式表明它们受各种发育和环境线索的诱导。系统发育分析和基因表达分析为功能分析提供了一些思路SiPTI1基因,暗示一个角色sipti1-5.可能与耐盐性有关。不同的表达sipti1-5.在酵母和大肠杆菌在本研究中增强了对盐胁迫的耐受性。这些结果为更好地理解个体的生物学作用提供了宝贵的资源SiPTI1在狐尾小米中的基因。
方法
植物材料和生长条件
“玉谷1号”和“AN04”的种子是由中国农业科学院刁贤民教授提供的。
器官表达分析SiPTI1结果表明,“玉谷1号”种子经水浸泡,28℃萌发 2天,然后在地里播种并培养幼苗。在花期,分别从根、第六节间、第七叶及其叶鞘和花中采集样品。
用于应力响应分析SiPTI1在Hoagland溶液中培养的三周大幼苗暴露于各种盐度处理(150mM NaCl,75mM Na2CO.3.、100mm NaHCO3.),以及10mm H2O.24 2 0 h, h, h, 6 h, 8 h, 10 h、12 h, 24小时、48小时、72 h。此外,为了比较sipti1-5.以耐盐品种豫谷1号和耐盐品种AN04两种2周龄幼苗为材料,分别用150 mM NaCl处理0 h、3 h、6 h、12 h、24 h和48 h。处理后采集5片幼叶进行qRT-PCR分析。
在这些实验中,收集了5种植物的样本,并将这些样本立即用液氮冷冻,然后保存在−80°C以供进一步分析。每个样本进行3次生物重复进行qRT-PCR分析。
总RNA分离,cDNA合成和定量实时PCR
用TransZol Up (TRANS)提取谷子总RNA,具体实验步骤见说明书。用1%琼脂糖凝胶电泳证实了RNA的完整性。的表达特征啜饮采用qRT-PCR技术对不同胁迫处理的谷子进行了检测。对于每个植物样品,1 μg总RNA在20℃下反转录为cDNA μl反应体系,使用PrimeScriptTM第一链cDNA合成试剂盒(TaKaRa)。用于qRT-PCR分析的引物是用引物爆炸法从非保守区设计的(http://www.ncbi.nlm.nih.gov/tools/primer-blast/)[34].Siacin.以AF288226.1基因作为qRT-PCR分析的参考基因[34].这些实验中使用的引物列在附加文件中8..Fold change是用2-ΔΔct方法(44].每个实验重复三次。数据以均数±标准差(SD)表示。采用SPSS 17.0进行统计学分析。统计学意义采用方差分析(ANOVA)确定,显著差异(P.< 0.05),使用Duncan多重范围检验确定值之间的差异[44].
生物信息学分析SiPTI1谷子家族
建立了隐马尔可夫模型(HMM)PTI1利用HMMER软件对水稻、拟南芥和玉米的家族序列和HMM剖面进行分析[60]. 然后在默认情况下,根据谷子蛋白质组数据搜索HMM配置文件E.值截断0.01 [61].的序列啜饮(编码序列(CDS)、蛋白质(Protein)和基因(Gene))https://phytozome.jgi.doe.gov/pz/portal.html),并在附加文件中演示1而拟南芥和玉米PTI1序列(CDS,蛋白质和基因)从Ensembl中沉积(http://plants.ensembl.org/index.html).每个推定PTI1基因序列检查了三个数据库:SMART(https://www.omicsclass.com/article/681),NCBI客户尽职调查(https://www.omicsclass.com/article/310),和Pfam(http://pfam.xfam.org/databas.)以确认PTI1域名。通过PCR扩增和测序进一步验证了预测基因的正确性PTI1经过综合整理,最终在谷子基因组中鉴定出基因模型,命名为前缀'硅' 为了美国italica使用,后跟'PTI1'中指定的sipti1-1.通过sipti1-12.根据他们的染色体位置。已鉴定的PTI1蛋白的序列长度、分子量和等电点是使用ExPasy网站上的工具获得的(http://web.expasy.org/protparam/).此外,使用五个公共可用工具预测亚细胞位置:http://abi.inf.uni-tuebingen.de/Services/YLoc/webloc.cgi那https://rostlab.org/services/loctree3/那http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/那http://genome.unmc.edu/ngLOC/index.html, 和http://www.cbs.dtu.dk/services/targetp/据索等人[62].
植物系统发育分析PTI1基因
为了进一步研究各种植物物种中PTI1蛋白的进化关系,构建了PTI1的系统发育树。使用默认多个对准参数,使用Clustalx 1.81程序进行PTI1蛋白序列的多序列对准。通过使用序列的最大似然方法使用Mega7.0软件构建大型系统发育树。美国italica(硅),S圣女果(Sl公司),n .烟草, (Nt),答:芥(在),o .漂白亚麻纤维卷(操作系统),Z. Mays.(Zm评选)[31.] PTI1蛋白序列用于构建系统发育树,但不包括SIPTI1S从NCBI获得(https://www.ncbi.nlm.nih.gov/),并在附加文件中列出相应的蛋白质序列2.从1000个重复中推断的引导一致树[63那64].
PTI1蛋白序列的同源对准
谷子、番茄、水稻和玉米PTI1s的序列比对分析。使用DNAMAN_6.0进行。
染色体定位,基因结构分析,启动子分析,基因组分布和基因复制的估计
全部SiPTI1对谷子的9条染色体按照从短臂端粒到长臂端粒的物理位置递升顺序(bp)进行基因定位,并用MapChart进行可视化[65].外显子系统结构SiPTI1通过使用基因结构显示服务器(GSD)将CD与其相应的基因组序列进行比较来确定基因。http://gsds.cbi.pku.edu.cn/)[66].MEME在线计划(http://meme.nbcr.net/meme/利用蛋白质序列分析来鉴定已鉴定的谷子PTI1蛋白的保守基序[67]. 优化参数为:重复次数:任意,最大基序数:15,每个基序的最佳宽度:6~100个残基[34那68]. 利用Plantcare鉴定了顺式调控元件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)数据库。所有siPTI1基于谷子基因组数据库中的物理位置信息,利用Circos [69]. 采用多重共线性扫描工具(MCScanX)对基因复制事件进行分析,并设置默认参数[33.那70].同源性表现出同源性的关系PTI1使用双系统绘图仪软件构建了从狐尾小米和其他所选物种中获得的基因,即同步分析图(https://github.com/cj-chen/tbools.)[71]. 每个副本的非同义(ka)和同义(ks)替换PTI1使用KaKs_Calculator 2.0 [72那73].的替代率PTI1根据先前描述的标准估计基因Ks和Ka [34那74]使用CODEML程序计算Ks和Ka替代率,并使用GEvo工具进行确认(https://genomevolution.org/coge/synmap.pl.). 复制和分化时间(T)的时间(百万年前,MYA)是使用每年每个同义位点λ替换的同义突变率作为T来计算的 = Ks/2λ(λ = 6.5 × 10–9) [33.].
SiPTI1-5的亚细胞定位
通过在没有终端密码子的情况下扩增Sipti1-5的编码序列来产生重组质粒pBI121-SIPTI1-5-GFP,然后将序列插入到其中Xba我/萨尔I pBI121-GFP的酶切位点。用pBI121-GFP和pBI121-SiPTI1-5-GFP轰击洋葱表皮细胞,并使用粒子枪介导系统PDS-1000/He (Bio-Rad, Hercules, CA, USA)。用共聚焦激光扫描显微镜观察GFP信号(LSM 510, Carl Zeiss MicroImaging GmbH, Jena, Germany) [75].
耐盐性测定大肠杆菌转化子
基因的编码序列经扩增得到重组质粒pET32a-SiPTI1-5sipti1-5.没有终止密码子,然后将序列插入囊我/Xho公司I为pET32a的酶切位点。然后转化pET32a空载体(作为对照)和pET32a- sipti1 - 5重组质粒大肠杆菌宿主菌株BL21(DE3)。表达sipti1-5.通过SDS-PAGE分析证实(补充图。1). 转化大肠杆菌将携带pET32a-SiPTI1-5或pET-32a的BL21 (DE3)细胞分别在含100 μg/ml氨苄青霉素的LB液体培养基中培养过夜,培养条件为37℃,180 rpm。为了分析耐盐性,将细菌用LB液稀释50倍,在37℃下孵育2-3 h,直至OD600 = 0.5-0.6 [75].加入异丙基硫代-β- d -半乳糖苷(IPTG),使其终浓度为0.5 mM,诱导插入基因的表达。
施用点测定施用盐度抗性分析SiPTI 1–5转变大肠杆菌[75].经4 h(25°C) IPTG诱导后,其浓度为大肠杆菌用LB液培养基(含100 μg/ml氨苄青霉素)调整至OD600 0.6 [75].为了测量对盐度的响应,将样品稀释10- 1, 10- 2, 10- 3., 10- 4.用含氨苄西林的LB培养基折叠。将三微升的稀释样品置于LB琼脂平板上,LB琼脂平板上添加0、100、250 毫米氯化钠,分别。孵育12天后 h在37℃的LB琼脂平板上 摄氏度[75].用佳能数码相机记录了盐胁迫下菌落的生长情况。
耐盐性检测SiPTI 1–5转变大肠杆菌在液体培养基中,经IPTG诱导后,在液体LB中25℃培养14 h。每隔2小时测量一次OD600的吸光度值,记录数据直到OD600达到大约2。实验重复三次。
酵母转化子耐盐性的测定
的顺序sipti1-5.被扩增并克隆到Kpn公司我/Xho公司构建pYES2-SiPTI1–5表达载体,并将其转化为pYES2y以pYES2空载体作为对照。制备对照菌株和pYES2-SiPTI1–5菌株的新鲜培养物,并在YPD培养基中将OD600调整为0.6。此培养物被连续稀释至10- 1, 10- 2, 10- 3., 10- 4.在含Na的YPD(无盐度)或YPD培养基上发现2CO.3.(8毫米,10毫米,12毫米),Nahco3.(15 毫米,20 嗯,25岁 mM)或NaCl(0.6 M、 0.8英寸 M、 和1 M) 在28岁时孵化 2°C 用佳能数码相机观察和拍摄表型。所有实验均独立重复三次。
数据和材料的可用性
本文的所有相关数据可在手稿及其附加文件中获得。的序列啜饮(编码序列(CDS)、蛋白质(Protein)和基因(Gene))https://phytozome.jgi.doe.gov/pz/portal.html),并在附加文件中演示1而拟南芥和玉米PTI1序列(CDS,蛋白质和基因)从Ensembl中沉积(http://plants.ensembl.org/index.html). PTI1蛋白序列用于构建系统发育树,但不包括啜饮是从NCBI获得的(https://www.ncbi.nlm.nih.gov/),并在附加文件中列出相应的蛋白质序列2.
缩写
- RLK:
-
受体蛋白激酶
- PTI1:
-
Pto-interacting 1
- cd:
-
编码序列
- ORF:
-
打开阅读框
- qRT PCR:
-
实时定量PCR
- UTR:
-
翻译区
- 阿坝:
-
脱落酸
- 惩罚:
-
甲基Jasmonate
- 钉:
-
聚乙二醇
- 南非:
-
水杨酸
- IPTG公司:
-
Isopropylthio -β-D-galactoside
- 磅:
-
卢里亚·贝尔塔尼
- OXI1:
-
氧化信号诱导1
- 活性氧:
-
活性氧物种
- 地图:
-
增殖蛋白激酶
工具书类
- 1。
Anthony RG、Khan S、Costa J、Pais MS、Bögre L。这个拟南芥蛋白激酶PTI1-2被聚合磷脂酸和PDK1和OXI1下游的氧化应激信号通路激活。生物化学杂志。2006;281(49):37536–46.https://doi.org/10.1074/jbc.M607341200.
- 2。
Shiu Sh,Bleecker Ab。拟南芥中的受体样激酶/骨液基因家族和受体样蛋白的扩增。植物理性。2003; 132(2):530-43。https://doi.org/10.1104/pp.103.021964.
- 3.
周建明,陆耀东,Bressan RA, Martin GB。番茄基因PTI1编码一种被Pto磷酸化的丝氨酸/苏氨酸激酶,并参与超敏反应。细胞。1995;83(6):925 - 35。https://doi.org/10.1016/0092 - 8674 (95) 90208 - 2.
- 4.
真核蛋白激酶超家族:(催化)结构域的结构和分类。美国实验生物学学会联合会j . 1995; 9(8): 576 - 96。https://doi.org/10.1006/excr.1995.1172.
- 5.
br1受体激酶的酪氨酸磷酸化作为油菜素内酯信号转导的一个组成部分拟南芥.国家自然科学基金资助项目:国家自然科学基金资助项目。https://doi.org/10.1073/pnas.0810249106.
- 6.
蛋白质磷酸化分析:研究激酶和底物的方法和策略。植物J。2006;45(4):512–22.https://doi.org/10.1111/j.1365-313X.2005.02613.x.
- 7.
Garcia AV,Al Yousif M,Hirt H。AGC激酶在植物生长和胁迫反应中的作用。细胞分子生命科学。2012;69(19):3259–67.https://doi.org/10.1007/s00018-012-1093-3.
- 8.
Forzani C,Carreri A,de la Fuente van Bentem S,Lecourieux D,Lecourieux F,Hirt H。这个拟南芥蛋白激酶pto -相互作用1-4是氧化信号诱导蛋白1和丝裂原激活蛋白激酶的共同靶点。2月j . 2011; 278(7): 1126 - 36。https://doi.org/10.1111/j.1742-4658.2011.08033.x.
- 9
Sessa G, D'ascenzo M, Martin GB。Pti1激酶被pto激酶磷酸化的主要位点位于激活域,是pto -Pti1物理相互作用所必需的。生物化学学报。2010;267(1):171-8。https://doi.org/10.1046/j.1432-1327.2000.00979.x..
- 10。
邹HW、田XH马GH,赵MM,李ZX。ZMPOT公司,一个玉米Pto-like基因,显著影响转基因植物的耐盐性拟南芥.作物学报,2012;
- 11.
Staswick P.两种表达大豆基因,对番茄的高序列同一性PTI1激酶缺乏自磷酸化活性。生物化学与生物物理学报,2000;https://doi.org/10.1006/abbi.2000.2080.
- 12.
田亚格,罗国珍,王亚杰,张建军,盖建英,陈世英。aPTI1从大豆同系物。中国生物医学工程学报,2004;https://doi.org/10.1093/jxb/erh035.
- 13。
吴世凯,张霞,李树生,赵恒生,李德生,崔德,等。黄瓜Pti1-L是一种细胞质蛋白激酶,参与防御反应和耐盐性。植物生理学杂志。2014;171(10):817–22.https://doi.org/10.1016/j.jplph.2014.02.002.
- 14.
关键词:生物力学,松井,Fujiwara M,岛本K,野村Y,中上H,等。质膜定位是必需的栽培稻水稻Pto相互作用蛋白1a介导的免疫信号负调控。植物生理学。2014;166(1):327–36.https://doi.org/10.1104/pp.114.243873.
- 15.
廖赫兹,朱明明,崔海华,杜新宇,于特,陈立群,等。马里斯在这个过程中扮演着重要的角色拟南芥花粉管和根毛生长。综合植物生物学杂志。2016;58(11):927–40.https://doi.org/10.1111/jipb.12484.
- 16.
Yoshioka H、Numata N、Nakajima K、Katou S、Kawakita K、Rowland O等。烟草GP91Phox.同源物恩伯哈和丁腈橡胶参加H2O.2积累和抗性晚疫霉.植物细胞。2003;15(3):706 - 18。https://doi.org/10.1105/tpc.008680.
- 17.
Bogdanove AJ,马丁GB。番茄AvrPto依赖的Pto相互作用蛋白和AvrPto相互作用蛋白。美国国家科学院学报。2000;97(16):8836–40.https://doi.org/10.1073/pnas.97.16.8836.
- 18.
刘江明,徐泽松,吕平,李文武,陈明,郭晨,等。谷子五肽重复蛋白基因家族的全基因组研究与表达分析。BMC基因组学。2016;17(1):840.https://doi.org/10.1186/s12864-016-3184-2.
- 19
熊莉,朱洁。脱落酸生物合成的调节。植物生理学。2003;133(1):29–36.https://doi.org/10.1104/pp.103.025395.
- 20
谷子:一种用于生物能源草遗传和基因组研究的模式作物。生物技术评论,2013;33(3):328-43。https://doi.org/10.3109/07388551.2012.716809.
- 21.
Brutnell TP、Wang L、Swartwood K、Goldschmidt A、Jackson D、Zhu XG等。狗尾草: C4光合作用模型。植物细胞。2010;22(8):2537 - 44。https://doi.org/10.1105/tpc.110.075309.
- 22.
潘建伟,李子忠,王庆国,阿克家乐,刘敏,关亚,等。谷子干旱响应的比较蛋白质组学研究。BMC植物生物学。2018;18(1):315.https://doi.org/10.1186/S12870-018-1533-9..
- 23.
李PH,布鲁内尔TP。狗尾草和Setaria italica, Panicoid草的模型遗传系统。实验机器人。2011;62(9):3031-7。https://doi.org/10.1093/jxb/err096.
- 24.
王普发,王洪林,王英明,任福斯,刘伟。谷子bHLH基因分析(Setaria italica)以及它们与干旱胁迫的潜在相关性。公共科学图书馆一号。2018;13(11):e0207344。https://doi.org/10.1371/journal.pone.0207344.
- 25.
Muthamilarasan M, Prasad M. Advances in奥特拉里亚谷物和能源草基因改良的基因组学研究。中国生物医学工程学报,2015;https://doi.org/10.1007/s00122-014-2399-3.
- 26
Doust AN、Kellogg EA、Devos KM、Bennetzen JL。谷子:一个序列驱动的草地模型系统。植物生理学。2009;149(1):137–41.https://doi.org/10.1104/pp.108.129627.
- 27
Muthamilarasan M,Prasad M.小米,用于持久的食物安全,在Pandemics中持久。趋势植物SCI。2021; 26(1):33-40。https://doi.org/10.1016/j.tplants.2020.08.008.
- 28
方XM,董刚,王昕,刘Tp,何耶,仁丽,等。高密度遗传地图和QTL用于福克斯尾部的农艺和产量特征(Setaria italica(L.)P。博夫)。BMC基因组学。2016;17(1):336.https://doi.org/10.1186/s12864-016-2628-z.
- 29
彭右章。谷子:C4植物的新模式。植物科学趋势。2021;26(3):199–201.https://doi.org/10.1016/j.tplants.2020.12.003.
- 30.
潘建伟,李忠,戴淑娟,丁海峰,王强,李晓斌,等。谷子种子萌发对盐度响应的转录组学和代谢组学综合分析。Sci众议员2020;10(1):13660。https://doi.org/10.1038/s41598-020-70520-1.
- 31。
PTI1-like kinase ZmPti1a from maize(玉米PTI1-like kinase ZmPti1a)Zea Mays.L.)在花粉的血浆膜上共定,并促进雄性配子体的竞争优势。BMC植物BIOL。2006; 6(1):22。https://doi.org/10.1186/1471-2229-6-22.
- 32。
汉克斯·斯克,奎因。蛋白激酶催化结构域序列数据库:一级结构保守特征鉴定及家族成员分类。方法Enzymol。1991;200:38 - 62。https://doi.org/10.1016/0076 - 6879 (91) 00126 - h.
- 33。
林奇M,Conery JS。作用的进化命运和二份基因的后果。科学。2000; 290(5494):1151-5。https://doi.org/10.1126/science.290.5494.1151.
- 34。
李伟伟,陈敏,王娥,胡玲,Hawkesford MJ,钟玲,等。谷子自噬相关基因的全基因组分析(Setaria italicaL.)和表征的功能SiATG8a型赋予水稻中氮饥饿的耐受性。BMC基因组学。2016; 17(1):797。https://doi.org/10.1186/s12864-016-3113-4.
- 35。
凯洛格ea。草地的进化史。植物理性。2001; 125(3):1198-205。https://doi.org/10.1104/pp.125.3.1198.
- 36。
Nghi KN, Tondelli A, Valè G, Tagliani A, Marè C, Perata P,等。淹水条件下粳稻胚芽伸长的全基因组关联定位和转录分析植物细胞环境。2019;42(6):1832-46。https://doi.org/10.1111/pce.13540.
- 37。
李一新、魏凯飞。小麦和玉米细胞色素P450基因超家族的比较功能基因组学分析。BMC植物生物学。2020;20(1):93.https://doi.org/10.1186/s12870-020-2288-7.
- 38.
邹鹤,吴泽,张兮,王子,黄克。过度表达ZMPTI1,与PTI1,增加耐盐性拟南芥蒂利亚纳.生物技术学报。2010;9(5):656-62。https://doi.org/10.5897/AJB09.1660.
- 39.
松井H、高桥A、广岛H。水稻免疫调节剂OsPti1a在质膜上特异性磷酸化。电厂信号行为。2015;10(3):e991569。https://doi.org/10.4161/15592324.2014.991569.
- 40
张义新,张勇,于建杰,张宏,王莉,王思南,等。碱茅愈伤组织中NaCl反应活性氧清除和能量供应的蛋白质组学研究。BMC基因组学。2019;20(1):990.https://doi.org/10.1186/s12864-019-6325-6.
- 41
于建军,陈尚新,王涛,孙格瑞,戴世杰。比较蛋白质组学分析Puccinellia tenuiflora叶子在Na2CO.3.压力。int j mol sci。2013; 14(1):1740-62。https://doi.org/10.3390/ijms14011740.
- 42
Maathuis FJ、Ahmad I、Patishtan J。钠的调节+植物中的助熔剂。前植物SCI。2014; 5:467。https://doi.org/10.3389/fpls.2014.00467.
- 43
刘杰,高慧,王旭,郑强,王超,王旭,等。24-表油菜素内酯对盐胁迫油菜生长、渗透调节和离子稳态的影响植物生物(Stuttg)。2014年,16(2):440 - 50。https://doi.org/10.1111/plb.12052.
- 44
李JP,元F,刘黄,张MJ,刘Y,赵Y, et al。外源性褪黑素通过上调盐腺中离子转运蛋白和囊泡转运基因的表达来增强盐的分泌Limonium二色的.BMC植物BIOL。2020; 20(1):493。https://doi.org/10.1186/s12870-020-02703-x..
- 45.
绿道H,Munns RA。非盐生植物的耐盐机制。植物生理学。1980;31(4):149–90.https://doi.org/10.1146/annurev.pp.31.060180.001053.
- 46.
罗Z、孔旭、戴JL、董HZ。土壤和叶面施氮增加棉花生长和耐盐性。植物营养学杂志。2015;38(3):443–55.https://doi.org/10.1080/01904167.2014.912324.
- 47.
王应祥,孙桂荣,索斌,陈刚,王建军,闫燕。钠离子的影响2CO.3.NaCl胁迫对水稻叶片叶绿体抗氧化酶和叶绿素荧光参数的影响Puccinellia tenuiflora(Turczscribn。等稳定。植物学报。2008;30(2):143-50。https://doi.org/10.1007/S11738-007-0102-X..
- 48.
赵q,张h,王t,陈sx,戴sj。基于植物根系盐响应机制的蛋白质组学研究。J蛋白质组。2013; 82:230-53。https://doi.org/10.1016/j.jprot.2013.01.024.
- 49.
张红,韩斌,王涛,陈淑娴,李海英,张应祥,等。植物盐的反应机制:来自蛋白质组学的见解。蛋白质组学杂志。2012;11(1):49-67。https://doi.org/10.1021/pr200861w.
- 50.
Corwin DL, Lesch SM。农业土壤表观电导率测量。计算机电子学报,2005;46(1-3):11-43。https://doi.org/10.1016/j.compag.2004.11.005.
- 51.
尹ZP,张h,赵q,yoo mj,zhu n,yu jl等。盐碱Nahco的生理和对比蛋白质组学分析3.-盐生植物叶片的响应Puccinellia tenuiflora. 种植土壤。2019;437(1–2):137–58.https://doi.org/10.1007/s11104-019-03955-9.
- 52.
Gomez L,Alvarez A,D'Ambrosio S,Zalazar G,Aravena R.使用同位素技术,揭示中西部地区干旱地区的水盐度起源。SCI总环境。2020; 755(PT 2):142576。https://doi.org/10.1016/j.scitotenv.202016/j.scitotenv.202016/j.scitotenv.2020.142935.
- 53.
Dalton Fn,Maggio A,Piccinni G.根温度对番茄植物反应功能的影响:静态和动态盐度应力指数的比较。植物土壤。1997年; 192(2):307-19。https://doi.org/10.1023/A:1004263505595.
- 54。
于建杰,金×,孙×m,高TX,陈×m,佘YM,等。杨树叶片过氧化氢反应(西蒙杨×杨树黑质)从生理学和蛋白质组学分析揭示。国际分子科学杂志。2017;18(10):2085.https://doi.org/10.3390/ijms18102085.
- 55。
索JW,张H,赵Q,张N,张YX,李Y,等.Na2CO.3.-磷脂酶组学揭示碱草叶绿体响应性光合和ROS清除机制。基因组蛋白质组学。2019;871046(3):271–88.https://doi.org/10.1016/j.gpb.2018.10.011.
- 56。
关键词:过氧化氢,一氧化氮,水稻,耐盐性,热胁迫植物科学。2002;163(3):515 - 23所示。https://doi.org/10.1016/S0168-9452(02)00159-0.
- 57。
Mittler R. ROS很好。趋势植物SCI。2017; 22(1):11-9。https://doi.org/10.1016/j.tplants.2016.08.002.
- 58。
李志乐,边MD,吴子志,张旭,杨Q,黄慈。大豆分离及抗旱功能分析ZmPti1-1,与PTI1,源自玉米(Zea Mays.l .)。生物技术学报。2011;10(27):5327-36。https://doi.org/10.1242/dev.00611..
- 59。
Takahashi A,Agrawal GK,Yamazaki M,Onosato K,Miyao A,Kawasaki T等,水稻Pti1a负调节RAR1型-依赖性防御反应。植物细胞。2007;19(9):2940–51.https://doi.org/10.1105/tpc.106.047142.
- 60.
老艾迪剖面隐马尔可夫模型。生物信息学。1998;14(9):755–63.https://doi.org/10.1093/bioinformatics/14.9.755.
- 61.
Muthamilarasan M, Bonthala VS, Mishra AK, Khandelwal R, Khan Y, Roy R等。C2H2谷子锌指转录因子的类型决定了对非生物胁迫的反应。功能整合基因组学。2014;14(3):531–43.https://doi.org/10.1007/S10142-014-0383.2..
- 62.
Suo JW,赵Q,张ZX,陈SX,Cao JG,Liu GJ等。奥斯蒙达肉桂美的细胞学和蛋白质组学分析萌发孢子揭示蕨孢子萌发和根茎尖端生长的特征。Mol细胞蛋白质组学。2015; 14(9):2510-34。https://doi.org/10.1074/mcp.M114.047225.
- 63.
塞图恩,内姆。邻接法:一种新的系统发育树重建方法。分子生物学。1987;4(4):406–25.https://doi.org/10.1093/oxfordjournals.molbev.a040454.
- 64.
系统发育的置信度限制:一种使用bootstrap的方法。进化。1985;(4):783 - 91。https://doi.org/10.1111/j.1558-5646.1985.tb00420.x.
- 65
Voorrips RE. MapChart:用于图形表示连锁图谱和qtl的软件。J在这里。2002;93(1):77 - 8。https://doi.org/10.1093/jhered/93.1.77.
- 66
郭爱,朱庆赫,陈X,罗JC。基因结构显示服务器。遗传病。2007;29(8):1023–6.https://doi.org/10.1360/yc-007-1023.
- 67
Bailey TL、Boden M、Buske FA、Frith M、Grant CE、Clementi L等,《模因套件:模因发现和搜索工具》。核酸研究,2009年;37(网络服务器问题):W202–8。https://doi.org/10.1093/nar/gkp335.
- 68
李DH,刘平,于JY,王立辉,Dossa K,张勇,等。芝麻基因组WRKY基因家族的全基因组分析及非生物胁迫应答相关基因的鉴定。BMC植物生物学。2017;17(1):152.https://doi.org/10.1186/s12870-017-1099-y.
- 69.
Krzywinski M, Schein J, Birol I, Connors J, Gascoyne R, Horsman D等。Circos:比较基因组学的信息美学。基因组研究》2009;19(9):1639 - 45。https://doi.org/10.1101/gr.092759.109.
- 70
王艳萍,唐海波,Debarry JD,谭鑫,李建平,王学勇,等。McScanx.:用于检测和进化分析基因共线性和共线性的工具箱。核酸研究,2012年;40(7):e49。https://doi.org/10.1093/nar/gkr1293.
- 71
杨紫育,古斯,王XF,李万,唐ZX,徐CW。分子演变的CPP-like植物的基因家族:来自比较基因组学的见解拟南芥还有米饭。摩尔进化杂志。2008;67(3):266–77.https://doi.org/10.1007/S00239-008-9143-Z..
- 72
张梓、李杰、赵旭、王杰、王国科、于杰。KaKsèu计算器:通过模型选择和模型平均计算Ka和Ks。基因组蛋白质组生物信息。2006;4(4):259–63.https://doi.org/10.1016/s1672 - 0229 (07) 60007 - 2.
- 73
Hiei Y,Ohta S,Komari T,Kumashiro T。水稻的高效转化(栽培稻调解者农杆菌属以及T-DNA边界的序列分析。植物j . 1994; 6(2): 271 - 82。https://doi.org/10.1046/j.1365-313x.1994.6020271.x.
- 74.
陈忠,陈敏,徐志生,李利民,陈小平,马玉忠。谷子醛脱氢酶(ALDH)基因超家族的特征及表达模式Setaria italicaL.)。公共科学图书馆一号。2014;9(7):e101136。https://doi.org/10.1371/journal.pone.0101136.
- 75.
王茂忠,李鹏,李超,潘亚龙,蒋学勇,朱元元,等。SiLEA14是一种新型的非典型LEA蛋白,在谷子中具有抗非生物胁迫的能力。中国生物医学工程学报,2014;https://doi.org/10.1186/s12870-014-0290-7.
致谢
一个也没有。
资金
基金资助:山东省自然科学基金资助项目(No。基金资助:国家自然科学基金资助项目(ZR2020MC110);国家重点研发计划(2019YFD1002701-04)。资助者不参与研究设计、数据收集、分析和解释以及手稿撰写。
作者信息
从属关系
贡献
YG-HF, WL和SJD设计了研究并监督了实验。YG-HF、ZL、QGW、YL和ML进行了实验。YG-HF, JWP分析数据,YG-HF写手稿。WL、SJD、JWP、MF和SY对稿件进行了审核。所有作者阅读并批准最终稿件。
通讯作者
伦理宣言
伦理批准并同意参与
不适用。
出版许可
不适用。
相互竞争的利益
作者们宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1。
的序列PTI1在狐尾小米中的基因。
额外的文件2。
PTI1蛋白用于构建系统发育,但不包括SIPTI1。
附加文件3。
SiPTI1蛋白质基序的详细特征。
额外的文件4。
每个的具体位置SiPTI1染色体上的基因。
额外的文件5。
启动子区的特征SiPTI1基因。
附加文件6。
分段和连续复制SiPTI1基因对。
附加文件7。
谷子和其它两种植物之间的一对一的同源关系。
附加文件8。
本研究使用的引物序列。
附加文件9。
相对表达值啜饮.
附加文件10:补充图1。
SDS-PAGE电泳鉴定SiPTI1-5融合蛋白。M: marker, 1: pET32a (0h), 2: pET32a- sipti1 - 5 (0h), 3: pET32a- sipti1 - 5T604A型(0 h) ,4:pET32a-SiPTI1–5K452N型(0 h) ,5:pET32a(4) h) ,6:pET32a-SiPTI1–5(4) h) ,7:pET32a-SiPTI1–5T604A型(4小时),8:PET32A-SIPTI1-5K452N型(4小时)。
附加文件11:补充图2. 2。
SiPTI1s的序列同源性。谷子和番茄PTI1s序列比对11个丝氨酸/苏氨酸激酶保守的典型亚结构域用罗马数字表示。大多数蛋白激酶常见的不变残基用黑点标记。亚结构域II中高度保守的赖氨酸残基是SlPTI1和大多数蛋白激酶活性所必需的。
附加文件12:补充图3。
PTI1s的序列同源性。PTI1S从粪码小米,米和玉米的序列对齐。11个丝氨酸/苏氨酸激酶保守的典型亚结构域用罗马数字表示。大多数蛋白激酶常见的不变残基用黑点标记。大多数蛋白激酶在大多数蛋白激酶中所需的亚域II中的高度保守的赖氨酸残基被盒装。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
黄富,潘杰,李卓。et al。全基因组鉴定PTI1家庭Setaria italica盐度反应性功能分析sipti1-5..BMC植物杂志21,319(2021)。https://doi.org/10.1186/s12870-021-03077-4
已收到:
公认:
出版:
关键字
- 谷子(Setaria italica)
- Pto相互作用1基因(PTI1s)
- 表达模式
- 功能鉴定
- 盐胁迫