摘要
背景
叶绿素的物理化学性质b和c已知几十年。然而,这些继发性叶绿素支持组装和积聚聚合物积聚的机制体内尚未解决。
演讲
在叶绿素分子外周上引入电负性群的生物合成修饰从吡咯氮汲取电子,从而降低了它们的碱度。因此,中央Mg与外源配体中的电子对形成配合键的趋势,其路易斯酸性的反映。我们的假设表明叶绿素中Mg原子之间的更强的协调键b和叶绿素c和叶绿素中的氨基酸侧链配体A / B.- 和的A / C-结合载脂蛋白分别增强其进入叶绿体和聚光复合物的组装。
测试
的捕光复合几个载脂蛋白,特别是主要的蛋白质Lhcb1,都不能检测叶绿素的叶子b- 植物。对假设 - 具有阳性选择的直接测试 - 是表达,在仅合成叶绿素的突变植物中一种,LHCB1的形式,其中弱配体被更强的刘易斯碱基替换。
影响
叶绿素缺陷效应的机制解释b要么c指出需要进一步研究这些叶绿素和叶绿素结合蛋白之间配位键的操纵。了解这些互动可能导致工程工厂扩展他们的光收获天线并最终提高生产率。
背景
在植物和藻类中,照相液I和II的反应中心封闭在含有精确定义的蛋白质集的核心复合物中 - 基本上均在叶绿体基因组中编码。主要辅助因子用于这些配合物中的光化学反应,叶绿素(CHL)一种,也需要这些复合物的装配。叶绿素生物合成途径中在黑暗中植物的终产物,原叶绿素(Pchlide),是无法支持组装工艺,这表明Pchlide的C17和C18之间的双键的光依赖性还原(参见图例无花果。1)对分子的性质有深远的影响。植物和绿藻(绿藻类)还含有Chlb,附件叶绿素仅在外围捕光复合物(LHCs)找到。这些复合物通常包含三个叶黄素分子,二叶黄素和一个新黄素,几乎相等量的叶绿素一个和叶绿素b(7或8 CHL一个和5或6氯b主要LHCII的分子,有一个A / B.与核基因组中编码的蛋白质(LHCPs)结合,并在胞质中合成后导入质体。的背影b-less突变体植物缺乏Chl,虽然含有功能完全的反应中心,但由于lhc的缺乏,其光合能力相对较低,对强光的敏感性更高[1].家庭中的藻类种类含有CHLc(图。1)而不是chlb,这也仅限于LHC,并且似乎在这些CHL中的这些生物中的功能b提供绿色植物[2].这些CHL衍生物的文献中存在大量数据。在本文中,我们提出了一种机制,使这些CHL在光合作用中的重要辅助角色。
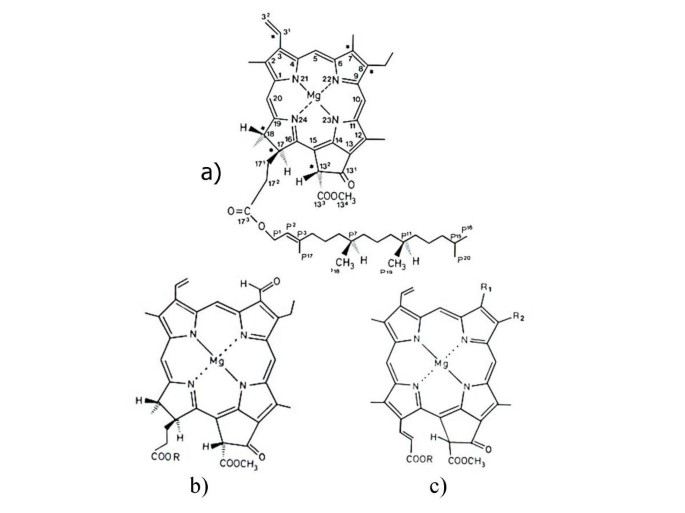
的Chls的结构。的(a)立体化学和编号系统在单乙烯基叶绿素一种。CHL的变化包括(b)chlb(7-甲酰基,r = phytyl);(c)chl c1(171-dehydro-pchlide,r1=甲基;R.2=乙基或乙烯基;r = h)。PCHLIDE类似于CHL,但含有饱和蛋白,而不是C17上的丙烯酸基团。(如[49.])。
假说的提出
在深生植物中发展的塑体的形式不能将LHCP插入膜,除非加入CHL [3.].在这些实验中,锌衍生物被使用,因为它们增加了化学稳定性的含镁分子,锌-脱镁素b在插入比Zn类脱镁叶绿素更有效一种。chl的重要作用b通过在新合成的LHCPs通过脉冲标记在叶绿素检测实验中进一步揭示b无树脂植物,但在从这些植物中分离的叶绿体中没有回收蛋白质[4].这些chl.b稀少的植物没有积累几个LHCPs,特别Lhcb1,Lhcb6和Lhca4 [5].的背影b在间歇性光照(光照周期为2 min,黑暗周期为98 min)下,Chl一个类囊体膜[6,7].这样处理的野生型植物只积累了一个LHCP (Lhcb5),而Chlb暴露于间歇光的突变体缺乏所有LHCPS [8].以互补的方式,Chlb当LHCPs的合成受到抑制并没有积累[9].当用氯霉素处理暴露于间歇光的豆植物以抑制叶绿体核糖体的合成蛋白质,CHLb和LHCP并行积累,没有增加总CHL的合成[10.].这些结果表明,在叶绿体中合成的光系统I和II核心复合蛋白,有效地竞争LHCP少量CHL一个在这些条件下制作,并且那个chlb没有积累,直到足够的叶绿素一个是为了满足核心复合物。
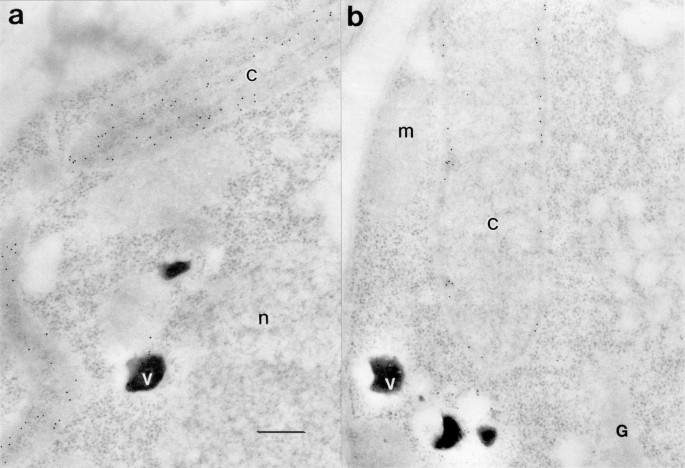
模型藻类实验Chlamydomonas Reinhardtii.[11.]表明,在没有CHL合成的情况下,LHCP不能在没有CHL合成的情况下被可检测到叶绿体中的,而是在细胞溶质和真空中的叶绿体外累积[12.].高浓度的氯霉素的总引起叶绿素合成的强烈抑制当黑暗生长的藻类细胞暴露于光时,可能通过抑制镁螯合酶的[13.除了叶绿体蛋白质的合成。细胞质核糖体上LHCPs的合成不受氯霉素的抑制,蛋白质积累到与未处理细胞相同的水平[14.,15.].然而,由于CHL合成的低速率,仅将蛋白质的小部分进入叶绿体中,并保持在整合的初始位点。如图1中所示。2B.,免疫电镜检测沿叶绿体包膜的LHCPs。在叶绿体内部未检测到LHCPs,尽管细胞分裂以可溶形式恢复了大量的数量[14.].在对照细胞中,当细胞被照射时,CHL和囊体膜的量迅速增加,并且在整个叶绿体中的囊体膜中检测到LHCPS(图。2A).这一结果与38℃时类囊体生物发生启动后LHCPs在细胞包膜上的定位一致[16.].在较高的温度下,并非所有新合成的LHCPs都被纳入包膜,多余的LHCPs在胞质液泡中积累[16.,17.].作为LHCPS与CHL的初始相互作用部位的这种证据也得到了深色的封装衍生的囊泡的增殖支持衣原体细胞暴露于只有几分钟的光[18.]并且在突变体中缺乏囊体拟南芥缺乏蛋白质显然需要从包络的内膜形成囊泡[19.].
这些实验,体内系统证明了CHLb在LHC组件中提供不由CHL提供的功能一种。Chl与蛋白质的结合是通过Chl的Mg(路易斯酸)和氨基酸侧链(路易斯碱)之间的配位键发生的。路易斯碱(配体)中未共享电子对的可用性变化很大,是配位键强度的主要因素。Chl中中心Mg的化学性质也影响所产生的配位键的强度。对四吡咯环外围的生物合成修饰逐渐导致电子从吡咯氮中撤出,从而降低其碱度[20.,21.].例如,Chl中的7-甲基氧化一个到CHL的电负剂醛b由2个pH单位降低吡咯氮的pK。类似地,在Pchlide丙酰基侧链的氧化中叶绿素的丙烯酸酯基团c使其电负性羧基与大环π体系共轭,效果相同[22.].因此,Chls的中心Mg原子b和c对外源电子具有更大的亲和力,因此是一种较强的路易斯酸。这些考虑因素指出了蛋白质与CHLS形成更强的配位键b和c比叶绿素一种,这对于弱路易斯碱配体尤其重要。在Chl大环的外围缺乏醛基c,它取代叶绿素b在chromophytic藻类同源复合物,表明的Chls和蛋白质之间的主要交互不涉及这样的取代基。叶绿素无论phytylation是蛋白质结合不清楚重要,因为叶绿素c被纳入CHL的A / C- 没有酯化的蛋白质复合物。
测试假说
Tamiaki等。[23.]证明引入一个氧原子与一个Zn的四吡咯大环的外周的,如发生在叶绿素的转化一个到chl.b,在苯中与吡啶形成配位络合物的平衡常数增加了两倍。与这种观察结果一致,对LHC的洗涤剂诱导的解离的研究表明CHLb由蛋白质比叶绿素持有约两倍更紧密一个[24.].叶绿素的结合更紧密b是在温和变性凝胶电泳的捕光络合物众所周知的稳定性显然负责。LHCPs在叶绿体包膜的初始累积意味着与这些蛋白质,叶绿素相互作用可能通过在第一跨膜区结合保守的基序(螺旋-1)[25.,26.当通过信封中转启动。分子建模表明,这种“保持”基序 - ExxHxR在第一和ExxNxR在第三跨膜区 - 所有LHCPs和相关蛋白质内提供两个配体为叶绿素,谷氨酸(E)和Arg(R)之间的离子对并且或者他的(H)的侧链或Asn(N)。叶绿素结合一个当His基序序列被Ala取代时,合成的16聚体肽减少了一半[27.].取代除了谷氨酸或精氨酸与消除结合到合成肽。突变LHCP导入分离叶绿体时,当基序内的His被Ala取代时,其导入几乎被取消[28.].叶绿素与此相关联的主题,因此,出现了蛋白对装配的LHC的途径延续至关重要。
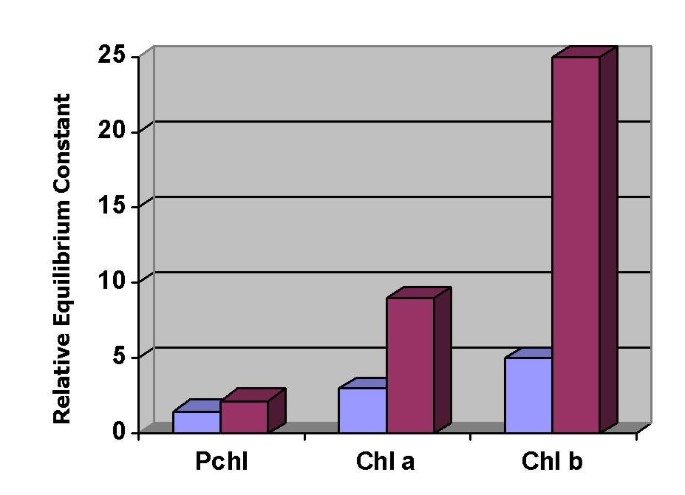
图中显示了结合两个Chl分子与一个保留motif增强亲和力的效果。3..假设chl的相对平衡常数为3.0一个和5.0 for chlb与LHCP中的配体粘合(从Tamiaki等人获得的数据近似的数字。[23.]),在叶绿素的亲和力的增加b用蛋白质导致复合物的稳定性近三倍增加,用CHL一个当两个分子约束时。该结论来自等式:R + CHL↔R·CHL;r·chl +chl↔r·chl2;r + 2chl↔r·chl2;K.情商= [R·的背影2] / [r] [chl]2.额外的Chl分子b在LHCII将进一步增强由平衡移朝向复合物形成这种效果。
LHCPs中电负性最强的配体是His的侧链。较弱的路易斯碱是与精氨酸离子对中的电荷补偿Glu, Gln和Asn的酰胺基,最后是肽骨干的羰基,是最弱的[29.].配体的重要性通过取代证明他与较弱的路易斯碱的Asn中的细菌捕光复杂LH1的脱辅基蛋白,这消除了复杂的装配体内和重构体外[30.].与较弱的路易斯碱形成稳定的配位键需要较强的路易斯酸。与这个预测一致的是,CP29的一个位置,一个较小的LHCII,在Chl重建过程中优先被填充一个当氨基酸残基是谷氨酸正常,在离子对用结合的Ca++离子,但占用转向chlb当配体是弱碱时,谷氨酰胺[31.].虽然chl的符合率b可以是比用于叶绿素较慢一种,因为可以通过更强烈地与CHL的中央Mg原子强烈协调的水分子阻抗b,Chl的路易斯酸强度越大b允许与弱配体更稳定的粘合。
我们对CHL的生物学作用的假设b应该体现在叶绿素中LHCII的结合位点。本地LHCII的结构在3.4的决议[29.]披露个别氯离子的位置,但没有提供每一场址的氯离子的身分,或大厦内是否有混合占用的场址。从这项工作发展起来的模型表明,在复合体的核心,靠近叶黄素分子中心的结合位点被Chl占据一种,而排名b更加外围。从MaviDaru等人内超快能量转移动力学测量。[32.表明叶黄素确实将激发能全部转移给了Chl一个而新黄质是一种结合在螺旋-2附近的叶黄素(见图)。4),将能量转移给Chlb。随着类似的技术,但是,克罗齐等。[33.]提出了从叶黄素到CHL可检测到的能量转移的证据b,这表明CHL的紧密接触b具有中心叶黄素的分子。之后,几个小组开发了一种更直接的方法,通过分析对最终综合体构成的影响来确定占用率体外当LHCPs中的氨基酸残基被不能作为配体的替代物取代时,LHCPs的重构。例如,在指定位置用大体积的苯丙醚取代Gly78(残基数参照Lhcbl给出)所引起的空间位阻一个6 [29.]防止该肽羰基,非氢键因为Pro82之一螺旋圈进一步,从作为配位体(参见图4).这种变化导致丢失一个CHLb重建后[34.].GLN 131(b6)和Glu 139(在离子对与Arg142)(b5)也被确定为配体叶绿素b[31.,34.- - - - - -36.].Remelli等。[35.]发现配体GLN197的替代(一个3)或His212(b3)用Leu或Val,分别导致叶绿素的子积分损失一个和叶绿素b,这表明在每个站点中混合占用。通过Rogl和Kühlbrandt[研究34.,则表明两个位点都充满了Chl一种。分配后,体外重构可能有一定程度的不确定性,因为最终复合物的组成随Chl的函数而变化a: b比在重建混合物[37.].混合网站,即使chl一个在混合物中过量存在[35.]可能反映了对CHL的结合的偏好b对蛋白质。基于配体的力量,占用的可能性是明确的体内[34., His212可以作为Chl的配体一个和gln197 for chlb。
Glu65突变(一个4)或Asn183 (一个2)每个都导致丢失一个CHL一个和一个背影b[35.].rogl和kühlbrandt[34.]建议Glu65(与arg185离子对)可以是CHL的配体b,另一个位置被Chl占据一种,受蛋白质结合的Chl损失的影响。的背影b在现场A4将与CHL结合的生物学必需品一致b在叶绿体中以螺旋-1的形式保留蛋白质。然而,基于与更简单的CP29 (Lhcb4)重构结果的相似性[31.],Remelli等人。[35.]表明Glu65 (一个4)和Asn183(一个2)被CHL占用一个.后者Chl的损失显然导致了“外置”Chl的损失b在现场B2,这是附近一个2在三维结构中。因此,这些任务占五个CHLb复合物中的分子(图。4).网站b因此,1必须充满一个Chl一个分子[38.].CHL过渡时刻的定向b在网站b5和b6 [38.]建议一个'out-saly'chl一个分子可以与CHL的甲酰基坐标b,比与13的协调更有利的安排1羰基氧,因为13的相反的方向的2-羧甲基和17-丙炔基(图1).尽管协调一个“失躺在”叶绿素的蛋白质结合的叶绿素将提高后者的路易斯酸强度的Chls之间的距离[29.,35.表明相互作用需要水分子的中介。或者,这些Chls可以与肽羰基配位。
网站一个6,认为是填充有叶绿素b[34.,38.,可能在叶绿体中LHCPs的保留中起作用。Lhcb6是一个次要的LHCP,在类似于Lhcb1 82的位置上含有甘氨酸而不是Pro,从而消除了甘氨酸作为配体的肽键羰基,但Lhcb6具有潜在的Chl配体b在Gln83 [39.,40].这两个LHCP亚种,与Lhca4沿着最易遭受缺乏叶绿素b体内[5].LHCB4(CP29的甲壳蛋白)在“位置82”处具有VAL而不是PRO,并且没有现场一个LHCB4中的6可能有助于其CHL的急剧减少b- 突变体[5,8].然而,Lhcb2, Lhcb3, Lhca1, Lhca2和Lhca3包含甘氨酸肽羰基作为配体(每个都有Pro在'位置82' [40]),但由缺乏叶绿素的仅略微减少,如果有的话,在量b。网站一个因此,6可能不是蛋白质积累的必要条件,但与Chl的初始参与一致b,直接或间接地,具有完全保守的保留图案。因为在综合变化的结果中,作为复杂组装的结果,可以改变导入期间的交互,特别是作为保留图案循环[27.]拉伸成螺旋结构,最终复合物中每个站点的最终占用可能无法反映初始关联。了解复杂的组装的限制体内- 包括缩回到胞质溶胶时叶绿素的量[不足12.] - 以及CHL绑定的顺序,需要新的实验设计。我们预计CHL的合成b通过叶绿素(IDE)一个氧化酶[41.]将由围绕特定CHL的本地环境确定一个分子由装配过程产生。有趣的是要注意包含CHL的所有LHC中的保留图案b然后是TRP残基,其可参与CHL的合成b。
逆变诱变方法将提供对假设的严格测试。只有CHL才能实现稳定的复合物一种,在叶绿素b稀少的植物或体外当lhcp中的弱配体被更强的路易斯碱取代时。增加了工程配位键与Chl的强度一个应该弥补缺乏chlb。特别是,在GLN131,GLU139,ASN183和GLN197中替换LHCB1中的稳定复合物应累积。较强的配体也可以在Gly78的位置引入,似乎是复合物中最弱的配体。在LHCB1的序列中取代这些氨基酸,在CHL中不能检测到的主要LHCPb- 植物[5,8],预计将恢复蛋白的积累,只有叶绿素一种。这个实验提供了一个积极的结果体内对假设验证的选择,与用非配体氨基酸取代时除去配体时蛋白质积累的显着降低相反[42.].此外,尽管稳定的复合物可以通过重构野生型和Lhcb1仅叶绿素来实现b但不仅仅是氯一个[37.,43.,该假说预测,含有这些取代和Chl的突变蛋白可以重组稳定的复合物一种。
假设的含义
文献中大量的证据支持本文中提出的关于Chl作用的假设b。然而,需要注意的是,在没有Chl的情况下,一些LHCPs会在叶绿体中积累b[5,8],也许是因为它们更容易集成到膜中,这意味着涉及蛋白质的其他特征。已经完成的工作已经确定,只有在足够的CHL时,才会以大量的速率进口到叶绿体中的几种LHCPb可用,并且它们最初累积在包络膜中。结果来自体内实验已经显示叶绿素的相互作用b第一个跨膜区域,包括保留基序,对这些蛋白的导入过程至关重要。组装的初始步骤也需要丰富的叶黄素[26.,这不是本文的重点。Chl的可用性b因此强烈调节LHCP的进口以及集装和最终积累光收获络合物。由于光合作用的光捕获效率的引起的急剧增强显然为开发光合生物合成CHL的能力而显然提供了强大的进化压力b或的背影c[44.].
lhc的结构已经得到了广泛的研究,络合物与反应中心的物理和功能联系也得到了很好的理解。进一步了解LHC组装需要更好地了解Chl(ide)催化反应的特性。一个氧化酶和是否chlb因为LHCP是Chl(ide)氧化的特定效应剂,所以只限于这些复合物。一个或者蛋白质是否只为CHL提供了结合位点b并防止它转化回Chl一个[45.].后者似乎不太可能作为特定效果,因为在其他蛋白质中应该发生类似的配体。特别地,早期诱导的蛋白质对LHCP具有同源物,但如果有任何CHL,则绑定很少b[46.].Chl的机理b合成,在位置7上的甲基的氧化41.,将是未来积极研究的一个领域,现在Chl(ide)基因一个氧化酶已被确定[47.,48.].而且,它还不知道是否有一个免费的CHL池b存在于叶绿体膜的局部环境,是由叶绿素的量模仿b在调整实验。试图理解复合体的组装体内将提供额外的试点工作充分的机会。
缩写
- 排名:
-
叶绿素
- Chlide:
-
叶绿素
- PCHLIDE:
-
原叶绿素酸脂
- LHC:
-
光收获复杂
- LHCII:
-
LHC与光系统II主要关联
- LHCP:
-
大型强子对撞机脱辅基蛋白
- LHCb的或LHCA:
-
分别与照相II或i相关的LHC的诱导素。
参考
- 1。
Leverenz JW,ÖquistG,Wingsle G:光合作用和叶绿素的叶光抑制b无与伦比的大麦。physiol植物。1992,85:495-502。10.1034 / J.1399-3054.1992.850313.X10.1034 / J.1399-3054.1992.850313.x。
- 2。
杜恩福德,迪恩JA, Tan S, McFadden GI, Gant E, Green BR:真核生物光收集天线蛋白的胶合发育评估,对质体进化的影响。中国科学:地球科学,1999,27(5):514 - 514。
- 3。
Kuttkat A, Edhofer I, Eichacker LA, Paulsen H:光收集叶绿素A / B.- 粘合蛋白稳定地插入补充有Zn-苯磷脂的etioplast膜中a / b。J Biol Chem。1997年,272:20451-20455。10.1074 / JBC.272.33.20451。
- 4。
普莱斯S,索恩伯JP:的捕光复合I和II中的脱辅基蛋白的稳定性在叶绿素类囊体的生物合成中b无重的大麦突变体chlorina F2。植物营养与肥料学报,2004,22(4):429 - 434。
- 5。
Bossmann B,Grimme LH,Knoetzel J:LHCB1蛋白稳定的LHCB1稳定的一体化依赖于叶绿素b在等位基因chlorina-f2大麦的突变体(Hordeum Vulgare.l .)。植物学报。1999,22:551-558。10.1007 / s00425005051710.1007 / s004250050517。
- 6。
Akoyunoglou G,Argyroudi-Akoyunoglou JH:间歇光和连续光对各种年龄的光学植物中CHL形成的影响。physiol植物。1969年,22:228-295。
- 7。
黄豆叶片叶绿体中光系统II单元的发育。生物化学学报。1997,18:571-580。
- 8。
KROL男,Spangfort MD,魂儿NPA,ÖquistG,古斯塔夫森P,Jansson的S:叶绿素A / B.结合蛋白,颜料转化,和早期光诱导蛋白在叶绿素b表示“不”大麦突变体。植物营养与肥料学报。10.1104 / pp.107.3.873。
- 9。
Maloney Ma,Hoober JK,Marks DB:绿化过程中叶绿素积聚和叶绿素 - 蛋白复合物的形成衣藻reinhardtii y-1在38°C。植物营养与肥料学报,2003,21(4):591 - 598。
- 10。
Tzinas G,Argyroudi-akoyunoglou JH:氯霉素诱导在发育过程中抗粒子骨质光学络合物的稳定化。费用。1988年,229:134-141。10.1016 / 0014-5793(88)80813-5。
- 11.
哈里斯EH:衣原体作为模型生物体。Annu Rev植物植物植物Mol Biol。2001,52:363-406。10.1146 / annurev.arplant.52.1.363。
- 12.
杨志强,杨志强,杨志强,等。叶绿素合成调节叶绿体捕获光复合物II载脂蛋白的保留衣藻reinhardtii。physiol植物。1997,101:135-142。10.1034 / j.1399-3054.1997.1010118.x10.1034 / j.1399-3054.1997.1010118.x。
- 13。
镁螯合酶:与核糖体和突变互补研究的关联,确定大麦亚基黄原酸g作为功能性的对应物Rhodobacter亚基BchD。王志强。1997:1 - 2。10.1007 / s004380050394。
- 14。
植物叶绿体膜的主要多肽衣reinhardi。证据合成在细胞质中作为可溶性组分。J细胞BIOL。1972年,52:84-96。10.1083 / jcb.52.1.84。
- 15.
黄志强,王志强,王志强:类囊体膜主要多肽合成的动力学和调控衣藻reinhardtii y-1在升高的温度下。中国生物医学工程杂志。10.1083 / jcb.70.2.326。
- 16。
白色RA,Wolfe GR,Komine Y,Hoober JK:在绿化期间叶绿体和细胞质中的光收获复合苯并蛋白的定位Chlamydomonas Reinhardtii.在38°C。Photosynth Res。1996,47:267-280。
- 17。
沃尔夫GR,公园H,夏普WP,Hoober JK:在胞浆空泡捕光复杂的载脂蛋白Chlamydomonas Reinhardtii.(叶绿藻)。J phycol。1997年,33:377-386。
- 18。
类囊体膜的起源衣藻reinhardtii y-1在38°C。植物理性。1991,96:1321-1328。
- 19。
Kroll D,Meierhoff K,Bechtold N,Kinoshita M,Westphal S,Vothknecht U,Soll J,Westhoff P:VIPP1,核基因拟南芥蒂利亚纳类囊体膜形成的必要条件。美国国家科学院学报。2001年,98:4238 - 4242。10.1073 / pnas.061500998。
- 20。
Phillips JN:卟啉的物理化学性质。见:《综合生物化学》,第9卷(Florkin M, Stotz EH编辑),阿姆斯特丹,Elsevier. 1963, 34-72。
- 21。
史密斯公里:卟啉化合物结构和化学的一般特征。在:卟啉和金属卟啉(由史密斯河编辑)阿姆斯特丹,elestvier科学。1975,1-58。
- 22。
黄志强,陈志强,陈志强:叶绿素的结构、性质和分布。应用化学学报。2000,20(3):427 - 434。
- 23。
Tamiaki H,Yagai S,Miyatake T:合成锌四吡咯配合物,吡啶作为单一轴向配体。Bioorg Med Chem。1998年,6:2171-2178。10.1016 / s0968-0896(98)00154-0。
- 24。
acta optica sinica, 2017, 29(3): 497 - 498 .刘志刚,李玉华,李玉华,杨玉杰,霍顿:测定叶黄素与光系统II光收获复合物的化学计量学和结合强度。中国生物医学工程杂志,1999,19(4):457 - 461。10.1074 / jbc.274.15.10458。
- 25。
Green BR, Pichersky E:三螺旋Chl演化的假说A / B.和叶绿素的A / C来自双螺旋和四螺旋祖先的光收获天线蛋白。Photosynth Res。1994年,39:149-162。
- 26。
HOOBER JK,Eggink LL:在叶绿体中组装光学络合物II和类囊体膜的生物发生。Photosynth Res。1999年,61:197-215。10.1023 /答:1006313703640。
- 27。
Eggink Ll,Hoober JK:叶绿素与含有保留术术的肽Maquettes结合。J Biol Chem。2000,275:9087-9090。10.1074 / JBC.275.13.9087。
- 28。
Kohorn BD:替代光收割叶绿素的组氨酸A / B.结合蛋白II破坏叶绿素-蛋白质复合物的组装。植物生理学报。1999,30(4):591 - 598。
- 29。
Kühlbrandt W, Wang DN, Fujiyoshi Y:基于电子晶体学的植物光收集复合物的原子模型。自然科学。1994,367:614-621。10.1038 / 367614 a0。
- 30.
利用突变多肽重建光合细菌核心捕光复合物的结构-功能关系。生物化学。1997,36:3671-3679。10.1021 / bi962386p。
- 31。
Bassi R, Croce R, Cugini D, Sandona D:一种高等植物天线蛋白的突变分析提供了结合到多个位点的发色团的鉴定。美国国家科学院学报。1999年,96:10056 - 10061。10.1073 / pnas.96.18.10056。
- 32。
Gradinaru CC, Stokkum van IHM, Pascal AA, van Grondelle R, van Amerongen H:识别LHCII和CP29中类胡萝卜素和叶绿素之间的能量传递途径。多色飞秒泵浦探测研究。acta physica sinica(物理学报),2000,30(4):593 - 598。10.1021 / jp001752i10.1021 / jp001752i。
- 33。
王志强,王志强,王志强,等:重组主要光收获复合物(LHCII)中类胡萝卜素到叶绿素的能量转移。I.飞秒瞬态吸收测量。acta physologica sinica(生物学报),29(4):457 - 461。
- 34。
Rogl H,Külbrandt宽:的捕光复杂II表现出改变的色素含量和光谱特征突变体三聚体。生物化学。1999年,38:16214-16222。10.1021 / bi990739p。
- 35。
Remelli R,Varotto C,桑多纳d,十字R,巴斯R:叶绿素结合单体捕光络合物:发色团结合残基的突变分析。J Biol Chem。1999年,274:33510-33521。10.1074 / jbc.274.47.33510。
- 36。
杨志刚,杨志刚,杨志刚:叶绿素中色素结合氨基酸的交换A / B.蛋白质。生物化学。1999年,38:16205-16213。10.1021 / bi990738x。
- 37。
Kleima FJ,HOBE S,Calkoen女,都市实践ML,彼得曼EJG,面包车Grondelle R,保尔森H,面包车Amerongen H:减少叶绿素A / B.重构LHCII中的比例:结构性和功能后果。生物化学。1999年,38:6587-6596。10.1021 / Bi982823V。
- 38。
Van Amerongen H,Van Grondelle R:了解LHCII的能量转移功能,绿色植物的主要光收获综合体。J Phys Chem B. 2001,105:604-617。10.1021 / JP002840610.1021 / JP0028406
- 39。
杨森:吸收光的叶绿素A / B.结合蛋白质。生物化学学报,1994,1184:1-19。10.1016 / 0005 - 2728(94) 90148 - 1。
- 40。
jansson s:一个指导LHC基因及其亲戚拟南芥。趋势植物SCI。1999年,4:236-240。10.1016 / S1360-1385(99)01419-3。
- 41。
黄志刚,田中华,田中华,Rüdiger W:叶绿素关键酶基因的克隆及功能表达b生物合成(CAO)从拟南芥蒂利亚纳。工厂J.2000,21:305-310。10.1046 / J.1365-313x.2000.00672.x。
- 42。
王志强,王志强:转基因烟草中重组天线复合物组装缺陷的结晶和鉴定。美国国家科学院学报。1996年,93:14966 - 14971。10.1073 / pnas.93.25.14966。
- 43。
Schmid VHR,ThoméP,RühleW,Paulsen H,KühlbandtW,罗格H:叶绿素b参与光收集复合物LHC I和LHC II的长波长光谱性能。费用。2001,499:27-31。10.1016 / S0014-5793(01)02509-1。
- 44。
Tomitani A, Okada K, Miyashita H, Matthijs HCP, Ohno T, Tanaka A:叶绿素b在蓝藻和叶绿体的共同祖先藻胆素。自然。1999年,400:159-162。10.1038 / 22101。
- 45。
田中。叶绿素的转化b叶绿素一个以及分离的叶绿体将叶绿素与载脂蛋白组装。植物营养与肥料学报。1997,19(4):457 - 461。
- 46。
Adamska I, Kruse E, Kloppstech K:早期光诱导蛋白稳定插入黄体膜需要叶绿素一种。J Biol Chem。2001年,276:8582-8587。10.1074 / jbc.M010447200。
- 47。
Tanaka A,Ito H,Tanaka R,Tanaka NK,Yoshida K:叶绿素一个加氧酶(CAO)参与叶绿素的生成b从叶绿素形成一种。美国国家科学院学报。1998,95:12719-12723。10.1073 / pnas.95.21.12719。
- 48。
Espineda Ce,Linford Al,Devine D,Brusslan Ja:The阿基因,编码叶绿素一个氧气需要氧气酶b综合拟南芥蒂利亚纳.美国国家科学院学报。1999年,96:10507 - 10511。10.1073 / pnas.96.18.10507。
- 49。
Scheer H:叶绿素的结构和发生。在:叶绿素(由Scheer H编辑)Boca Raton,CRC压力机。1991,3-30。
- 50.
Green Br,Durnford DG:含氧光合作用的叶绿素 - 类胡萝卜素蛋白。Annu Rev植物植物植物Mol Biol。1996,47:685-714。10.1146 / annurev.arplant.47.1.685。
致谢
公司获得美国国家科学基金会研究生培训基金ge9553456的资助。这是第498号出版物来自亚利桑那州立大学光合作用早期事件研究中心。
作者信息
隶属关系
通讯作者
作者的原始提交的图像文件
权利和权限
关于这篇文章
引用这篇文章
Eggink, l.l., Park, H. & Hoober, J.K.b在光合作用的假设。BMC植物BIOL.1,2(2001)。https://doi.org/10.1186/1471-2229-1-2
已收到:
接受:
发表:
关键字
- 包膜膜
- 吡咯氮
- 弱配位体
- 断断续续的光
- 保留母题


评论
查看存档评论(1)