摘要
背景
未更新的配子(具有体细胞染色体数量的配子)可以通过全多大倍性形成提供用于进化的物质的途径。我们评估了基因型和温度对男性未更新的配子形成的影响芸苔属植物异源四倍体及其种间杂交种。孢子中未减数分裂配子的频率由二分体或四分体的频率估计,花粉中未减数分裂配子的频率由可存活的巨花粉和正常花粉的频率估计。巨型四分体的体积是正常四分体的两倍,可能是减数分裂前染色体数目加倍的结果。巨型花粉被定义为大于1.5的花粉×正常直径,假设未更新的配子中的DNA含量加倍约为花粉细胞体积。基因型的效果在五分之一中进行评估B. Napus.,两个B. Carinata.和一个B. Juncea.亲本和13个种间杂交组合。在热(昼/夜30°C/20°C)、热(25°C/15°C)、冷(18°C/13°C)和冷(10°C/5°C)的基因型子集中评估温度的影响。
结果
在孢子期,一些种间杂交基因型产生未减少配子(范围0.06 ~ 3.29%)的频率比亲本(范围0.00% ~ 0.11%)高一个数量级以上。结果表明,9个有活力的成熟花粉杂交种产生活力的巨型花粉的频率(范围为0.2% ~ 33.5%)远高于亲本(范围为0.0% ~ 0.4%)。巨型花粉可能是由未减数配子形成的,在杂交体中比正常花粉更有活力。两个B. Napus.×B. Carinata.低温处理下,杂种产生了9%和23%的未减数分裂孢子,比亲本高出2个数量级以上。
结论
这些结果表明,异源多倍体进化的三倍体桥假说所需要的未减少配子来源在某些物种中是很容易获得的芸苔属植物三种杂种基因型,特别是在寒冷的温度下。
背景
未减数配子,或具有体细胞染色体数的配子(也称“2N配子),被认为在多倍体物种的进化中扮演着重要的角色[1那2].如果两个未退化的配子结合,可以形成可育多倍体杂种——同源多倍体(种内受精)或异源多倍体(种间受精)。大多数植物物种现在被认为是最近或祖先的多倍体起源[3.].但是,关于未更新的配子形成的频率以及影响大多数属于Genera的未收款的配子生产的遗传和环境因素很少。2].在茄属植物tuberosum和三叶草pratense,未收回的配子生产似乎是由单一的隐性等位基因发起的,其与影响生产频率的其他基因(由Bretagnolle和Thompson审核(1995)[4.])。最近在模式植物中也发现了与减数分裂细胞周期机制缺陷有关的未减少的配子产生突变体拟南芥蒂利亚纳,从而更好地理解未还原配子形成背后的机制[5.].然而,在大多数物种或种间杂交植物中,影响未减数配子产生的遗传或环境因素知之甚少。
如Ramsey和Schemske(1998)所建议的建议,所以杂交的混合动力器倾向于产生比父母更加不含的配子的频率。(1998年)[2].通过三倍体桥梁的多倍体演化可能是重要的[1].三倍体桥是由未还原配子(如2n = AA的AA)与还原配子(如2n = BB的B)结合产生的。然后,三倍体植株(AAB)可以在与BB花粉的回交中产生未减少的配子,从而产生新的多倍体物种(例如AAB + B = AABB)。三倍体桥假说建立在一种可能性之上,即不平衡的种间杂交植物产生的未减少配子比亲本植物多,但这一假说从未在受控实验条件下进行过定量测试[2].三倍体桥多倍体进化假说可能提供一种更有可能的情况比替代假说需要两个未还原的配子团结偶然在一个种间杂交事件(例如AA + BB = AABB),或要求染色体加倍发生在体细胞组织的seed-derived混合(如AB AABB) (6.].
未减少的配子产生可能是由紧张的环境条件刺激的[2那7.].在现场的冷咒,凉爽的玻璃室条件和生长室中的温度循环,都涉及不含未收音的配子生产(Ramsey和Schemske(1998)审查[2]并简要介绍Felber(1991)[8.])。在罗莎,高温诱导纺锤体异常,导致未减少的花粉粒形成增加[9.].然而,温度(或其他环境因素)和基因型对种间杂交种未减少配子产量的相互作用尚未进行评估[2].
当芸苔属植物“你的三角”10在研究基因型和温度对种间杂交种未减数配子产生的影响方面,种具有重要的属性。U's Triangle包括三个基因组互补的二倍体物种AA, BB和CC (B. Rapa,B. nigra和b . oleracea分别)和三种异源四倍体种AABB、AACC和BBCC (芥菜、甘蓝型油菜和B. Carinata.分别)。同种异形物种之间的三角细胞杂种(B. Juncea.×B. Napus.AABC;B. Juncea.×B. Carinata.,BBAC;和B. Napus.×B. Carinata., CCAB)可以很容易地建立[11那12],杂交种经常花,并生产可行的配子。这些不平衡杂交种中的一个二倍体基因组(例如AAA中的AA)的存在提供了适度的生育水平[10那13,这对评估未减量配子的产生很有用。未还原配子在许多芸苔属植物三种杂交类型[14-18包括杂交的芸苔属植物异源四倍体(19那20.]但是父母和杂种中未收入的配子的频率从未被量化。没有报告影响未减少的配子生产的遗传或环境因素芸苔属植物物种或其种类的杂种。
大多数关于产生未减数配子的实验都以雄性配子为目标[4.,这比女性配子更容易评估。在双子叶植物中,小孢子母细胞减数分裂后形成孢子体结构,这通常包含四个子细胞在外膜中,称为四分体(附加文件)1).含有未还原配子的孢子有两种类型。第一种类型是二分体,它包含两个未还原的细胞,在细胞膜外结合在一起[21)(附加文件1).第二个是巨大的四边形,其中包含四个未更新的配子[22].未收录的配子也被称为某些物种中的“巨型”花粉(如Bretagnolle和Thompson(1995)的审查[4.])包括芸苔属植物[23,这有助于评估未减少配子的频率和它们的生存能力。
在本研究中,我们研究了遗传和温度对异源四倍体种间杂交种雄性未减数配子产生的影响芸苔属植物你的三角形[10].这些物种对于此目的来说是理想的,因为它们产生杂种植物,花和许多杂种产生一些可行的雄性配子。我们评估了五分之一的雄性未知的配子生产B. Napus.,两个B. Carinata.和一个B. Juncea.父母基因型,以及这些父母之间的三十三种杂种组合。在五种父母基因型和五种间隙杂种组合的子集中研究了温度在雄性未再发育的配子生产中的温度效果。基于以前的工作[19那20.[我们假设杂交种与各自的父母相比,杂交种具有未更新的雄性配子的频率,并且这种频率将受到遗传因素和温度的影响。
结果
假定的种间杂交植物的特征
种子在34中设置芸苔属植物间隙交叉组合广泛变化,在29个成功的十字架中,平均每平均授粉芽为0.82种子(表1额外的文件2).所有三种物种都是雄性父母的成功,但是B. Carinata.是最不成功的女性父母(Table1).通过23种组合的90个推定的杂交植物通过基因组特异性多态性简单序列重复标记进行评估,其中一些剂量敏感(参见Nelson等人。(2009)[19和Mason等人(2011)[20.]详细信息),并表征形态属性(表2).在这些植物中,有79株是真正的杂种,是由双亲减少的(正常的)配子产生的。剂量敏感标记显示4株植物来源于未减少的配子B. Napus.和一个减少的配子B. Juncea.(表2额外的文件3.),以及一种由非整倍体配子衍生而来的植物B. Carinata.和一个减少的配子B. Juncea.(表2额外的文件3.).其余6个植株为母本(母本表型自花授粉的后代)(表)2).另一组40个假定的杂交种被用于温度试验,它们都是由双亲的一个正常的减少配子衍生出来的种间杂交种。
通过Sporad观测估计男性未知的配子生产
根据结构中存在的女儿细胞数量分类:MONADS,DYADS,TRIAS,TETRADS,PENTADS,HEXADS和eptads。此外,在一些杂种中观察到“巨型孢子囊”。这些四胞胎比来自相同花药的其他四胞胎更大。为了估计来自Sporad观察的未收款的配子形成,假设Dyads形成两个未更新的配子,并假设巨型孢子囊产生四种未更新的配子[24].假定正常尺寸的四分之一,以产生四种正常,减少的配子。为了估计异常的Sporad生产,假设分别形成一,两种,三个,五个,六和七个异常核来形成一个,二进制,二元,三合会,五角囊,六世和庚三。
所有八个芥菜、甘蓝型油菜和B. Carinata.母体基因型基于Sporad观察产生极低的未更新的配子(表3.).在母体基因型中观察到超过10 000孢子的四种二元,等同于整体未更新的配子频率为0.04%。Dyads仅在3/8父母基因型中观察到:B. Napus.n1和n5和B. Juncea.j - 1(表3.).相比之下,在所有三种杂交组合中观察到二元组合(表4.),在杂交组合中也观察到少量的大孢子B. Juncea.×B. Carinata.J1C1,B. Juncea.×B. Napus.J1N1和B. Napus.×B. Carinata.n1c1(表4.).杂交组合的平均雄未减数配子产量由孢子产量估计为1.32%(表1)4.).
混合组合在全异常孢子率的频率中变化,并且在SPORAD阶段的未发出的配子生产的导出估计范围为0.06%B. Juncea.×B. Carinata.J1C2至3.3%英寸B. Juncea.×B. Napus.J1N3(表4.).基于线性混合模型,母体父母(细胞质)对未收集的配子生产没有显着影响。总体而言,间隙的混合组合产生了比母体品种估计的摩托拉观察(平均0.02%)所估计(平均为1.32%)(表格3.,表4.).
温度对Sporad阶段观察到未更新的配子的影响
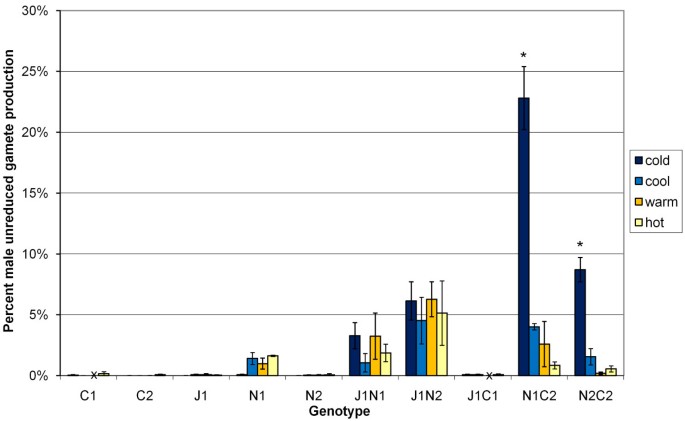
父母基因型J1,N2,C1和C2和B. Juncea.×B. Carinata.根据孢子观察估计,J1C1在所有温度处理中未减少的雄性配子平均少于0.2%(图)1).平均未知的横跨温度处理的配子生产B. Juncea.×B. Napus.J1N1和J1N2(分别为2.4%和5.5%)远大于母体基因型(J1:0.05%,N1:1.03%和N2:0.04%),但对这些杂种的温度没有明显的影响(图1).但是,B. Napus.×B. Carinata.N1C2和N2C2分别在寒冷温度处理中产生23%和9%未更新的配子(图1,图2 c, d),比亲本物种大两个数量级以上。在低温下,这些杂交基因型的巨型活花粉明显占优势(图)2摄氏度).
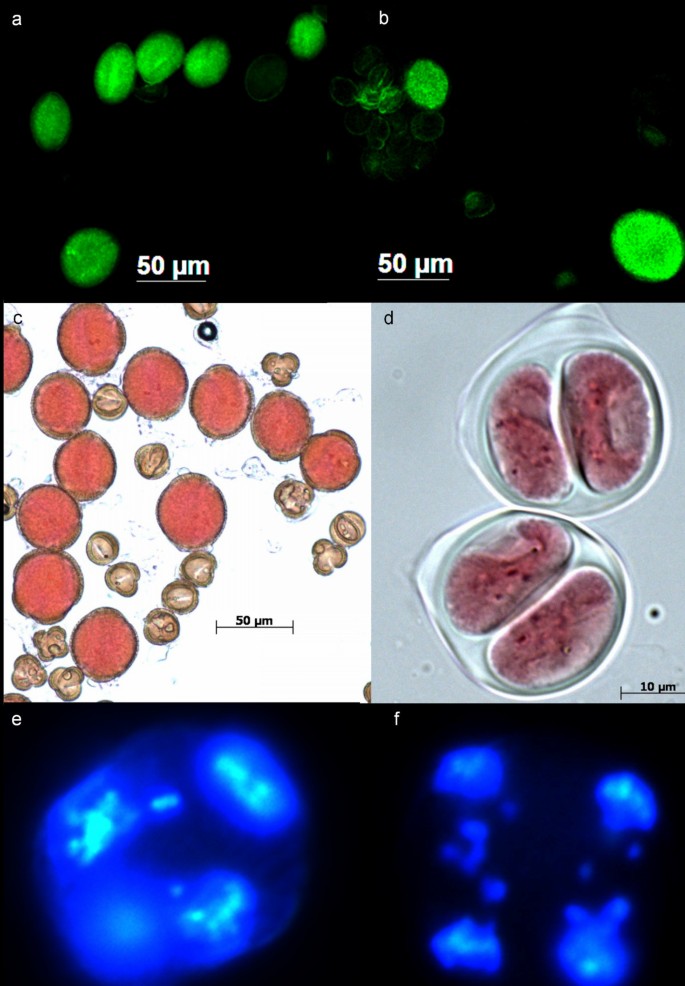
雄性未减少的配子形成芸苔属植物.a)一个“巨大”的花粉粒B. Napus.和几种正常大小的花粉颗粒;b)推定可行的(大,明亮),可行的减少(小,明亮)花粉和不可行(缩小,沉闷)花粉中的特异性杂交;c)B. Napus.×B. Carinata.(CCAB)花粉在寒冷(10°C昼/5°C夜)温度);d)由a产生的两对B. Napus.×B. Carinata.(CCAB)混合在寒冷(10°C昼/5°C夜)温度下;e)在种间杂交中,开始出现末期II,显示细胞内的四面体核排列,这是正常的垂直纺锤体方向的结果,但细胞核外的染色体滞后;f)末期II显示平行纺锤体,这是一种常见的二分体形成机制芸苔属植物.
杂种和亲本的可活花粉
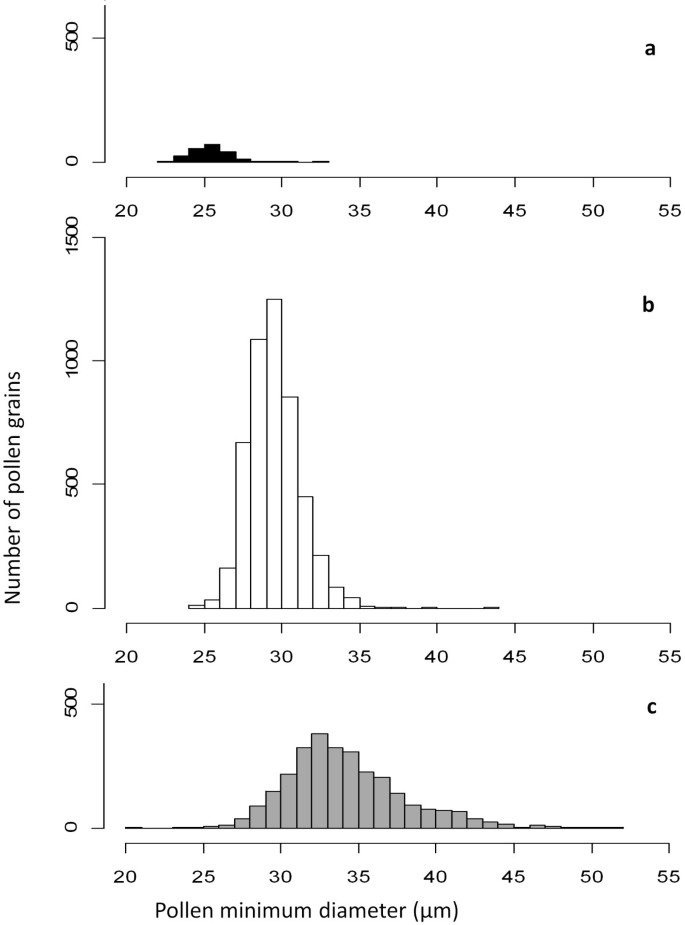
杂种的活花粉平均直径(34.2 μm)大于亲本的活花粉(29.5 μm),大小范围(20.6 ~ 51.9 μm)更大(图)3.)和更圆的形状。不同基因型间的平均花粉直径差异虽小但显著。B. Napus.和B. Carinata.基因型平均为28.5 ~ 29.5 μmB. Juncea.基因型平均直径31.7μm。
在父母线和芸苔的品种中可行的花粉大小分布和倍增性.用二乙酸荧光素染色估计花粉活力,并在显微镜下测量花粉直径(μm)(仅活花粉),以期花粉大小与花粉粒的DNA含量成正比。一)B. Rapa.(2N= 2X.= AA)花粉,预期花粉倍性N=x =一个;b)B. Juncea.(2N= 4X.= AABB),B. Napus.(2N= 4X.=协会)和B. Carinata.(2N= 4X.= BBCC)花粉,预期花粉倍增性N= 2X.= AB, AC, BC;c) 2N= 4x表示杂交芥菜×甘蓝型油菜(AABC),juncea × carinata(BBAC)和B. Napus×B.Carinata(CCAB)花粉,预期倍性减少花粉n =X.- 3X.:A-ABC,B-ABC和C-ABC。右侧杂交花粉尺寸分布的偏差表明未收回的配子生产(倍增4X.和以上)以及较高的DNA含量(平均分布> 2X.,预期倍性分布X.- 3X.).
在亲本中很少观察到巨大花粉粒(见表)5.,图2).在29株植株中,每个亲本基因型最多观察到2个巨大的活花粉粒(见表)5.).“巨型”花粉晶体被定义为可行的花粉颗粒,最小直径大于母体基因型中的基因型的1.5倍,并且在三种杂交组合中的减少1.5倍(2X.)该杂交种两个亲本基因型的花粉中本平均直径。这大约是减缩配子体积的两倍。产生活花粉的9个种间杂交组合均观察到活巨型花粉(B. Juncea.×B. Carinata.J1C1、表6.,图2 b).巨型花粉产量的频率在三种杂交基因型之间显着变化(表格6.).芸苔属植物juncea×B. Carinata.杂交种产生明显较少的巨大花粉(在可行的花粉级分中测量)比其他杂种类型(0.2%至1.8%,表6.).B. Juncea.×B. Napus.J1N2和B. Napus.×B. Carinata.N1C2产生的巨型花粉占活花粉的比例最大(30% ~ 34%,表6.),而其余的基因型则处于两个极端之间(6%到19%,Table6.).总体而言,三分之一的杂交种产生比父母更具巨大的花粉(P <0.01,学生的T检验;表5.,表6.).
估计来自Sporads和可行花粉的未更新的配子
杂交种中未更新的配子的频率,与可行巨粉比例的比例与总可行的花粉相比(平均为13.8%,表6.)远高于根据孢粉观测所得的估计(平均1.32%,表4.),差异有统计学意义(p < 0.05)。然而,在杂交组合中,花粉粒的比例很高,无法存活。因此,巨大花粉占总花粉产量(包括萎缩的、不能活的花粉粒)的比例为1.22%,这与孢子期未缩小的核的估计相似。这两种测量方法在雄性未减少配子频率上没有差异芥菜、甘蓝型油菜和B. Carinata.父母基因型。
减数分裂异常的证据
还观察到异常的Sporads(Dyads和巨型Sporads),包括Monads,Triads,Pentads,Hexads和eptads。假设这些含有异常染色体数字的配子。所有27的Sporad生产异常芥菜、甘蓝型油菜和B. Carinata.18°C / 13℃的植物每天/夜温度极低,范围为0%至0.25%(表2).杂交植株产生异常孢子的频率为0.2% ~ 6.2%4.).三联体、五联体和六联体的细胞核大小各不相同:几乎所有的五联体和六联体分别有4个大核和1个小核和2个小核。五端和六端频率高度正相关(r2= 0.56, p < 0.0001),三联体和二联体频率在杂种植株中也呈正相关(r2= 0.26, p < 0.0001),其他孢子类型间无显著相关性。一些染色体在末期II被排除在细胞核形成之外,而许多染色体在末期II被观察到是滞后的(图)2 e).在一些杂交基因型中也观察到平行纺锤体(一种导致配子形成未减少的减数分裂现象)2 f).
混合基因型B. Napus.×B. Carinata.在高温处理(11%)中,N1C2产生的四个以上核的孢子(五核、六核和七核)明显多于暖(3%)、冷(1%)和冷(0.5%)处理。芸苔栗鸟与其他温度处理相比,N1也在热温处理中产生更多的孢子,其在热温处理中具有超过四个核(9%)(1%)。减数分裂的同步时机也在管制中B. Carinata.C1,B. Napus.N1和B. Juncea.×B. Napus.J1N1对高温处理的反应,通常在同一花药中存在从前期I到孢子的多个减数分裂阶段(结果未显示)。芸苔属植物juncea×B. Napus.J1N1在高温处理下也表现出非同步减数分裂。
基因型和温度对花粉活力的影响
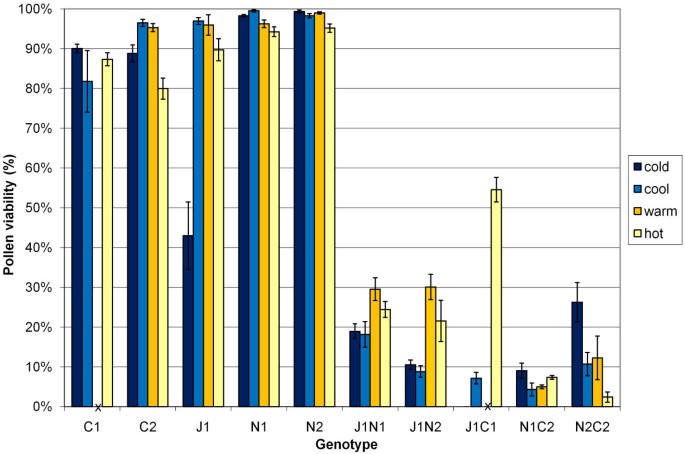
杂交组合的花粉活力和结实率差异显著6.).所有B. Juncea.×B. Napus.(AABC)和B. Juncea.×B. Carinata.(BBAC)基因型产生了一些活花粉(按基因型平均为4% ~ 25%,表6.).然而,所有六个B. Napus.×B. Carinata.(CCAB)杂交基因型具有<2%可行的花粉,其中四种是雄性无菌(表6.).芸苔属植物juncea×B. Napus.(AABC)杂交组合产生的花粉活力最强(见表)6.),但B. Juncea.×B. Carinata.(BBAC)杂交种产生了最自然的种子(每株植物13至248张表6.).
大多数种间杂种的杂种在所有(10°C / 5°C,18°C / 10°C,25°C / 15°C和30°C / 20°C)温度下产生至少一些花香和活性花粉治疗。但是,B. Juncea.×B. Carinata.J1C1杂交种在寒冷的温度处理中产生全雄性无菌花(10°C / 5°C日/夜)(图4.),以及两者生产的大多数花朵B. Napus.×B. Carinata.热温处理中的基因型也是雄性无菌(图4.).一些雄性不育的花也由B. Napus.×B. Carinata.基因型在冷暖温度处理下,并由B. Carinata.C2,B. Napus.N1和B. Juncea.×B. Napus.对J1N1和J1N2进行了高温处理。亲本基因型花粉活力不受温度处理的显著影响,但有两种情况例外:B. Juncea.J1花粉活力在冷处理时较低(图2)4.),B. Carinata.C2花粉活力在高温处理下降低(图2)4.).芸苔属植物juncea×B. Carinata.J1C1,B. Juncea.×B. Napus.J1N2和B. Napus.×B. Carinata.温度对N2C2花粉活力也有影响4.,图2摄氏度).
花粉活力估计为5芸苔属植物亲本和品种(J1 -B. Juncea.,n1和n2 -B. Napus.,c1和c2 -B. Carinata.)和五个芸苔属植物4种不同温度处理的种间杂交基因型在12小时的昼/夜温度-热(30°C/20°C),暖(25°C/15°C),冷(18°C/13°C)和冷(10°C/5°C).种间杂交基因型为J1N1和J1N2B. Juncea.×B. Napus.两个不同的杂种B. Napus.父母品种,J1C1 AB. Juncea.×B. Carinata.杂交和N1C2和N2C2B. Napus.×B. Carinata.来自同一两个地方的混血儿B. Napus.品种。在开花之前,J1C1和C1植物在“温暖”生长状态下,并且这些缺失值由“X”表示。数据作为组平均值给出,具有±一个标准误差栏。
在温度实验中的所有温度处理中,大多数间隙杂种中的开花时间是它们的母体和父亲母体品种之间的中间体(附加档案4.).寒冷温度处理在温度实验中平均延迟开花40天(附加文件4.).
讨论
某些配子产生未减少配子的频率芸苔属植物间隙的杂交体超过了父母基因型的频率超过一个数量级(表3.,表4.),各基因型间差异显著(表4.).在低温下,一些基因型产生的未减少的雄性配子比亲本高两个数量级(图)1).由于杂交种中降低的花粉的降低的低可活力,来自未更新的配子的可行性巨型花粉的频率,作为总可行的花粉的比例,杂种含量高。在这些条件下,可行的未更新的配子将随时可用于多倍体物种演化通过芸苔根据所有多元桥演化的三倍体桥梁假设所要求的间隙混合动力1那2].
高温在任何父母或杂种基因型中没有刺激未更新的配子的形成。父母基因型产生了非常低的未更新的配子频率(表3.,表5.),从已存在的具有二倍体减数分裂的物种(甚至异源多倍体物种)[3.].种间杂交基因型具有不平衡的基因组互补(一个二倍体和两个单倍体基因组),极有可能在减数分裂时具有单价染色体[25,这可能与这些杂交类型中未减少的雄性配子的形成增加有关。未减数配子的相对较低水平B. Juncea.×B. Carinata.(BBAC)杂交种(已知比单价更少B. Napus.×B. Juncea.(AABC)和B. Napus.×B. Carinata.(CCAB)类型;[25那26])支持这个假设。但是,不同的基因型B. Napus.×B. Juncea.(AABC)和B. Napus.×B. Carinata.(CCAB)混合动力车在相同条件下产生了多种频率的未更新的配子(图1,表6.),这表明从母体物种中遗传的遗传因素调解未更新的配子的生产。
异源多倍体进化的三倍体桥假说最近得到了支持[3.那6.那27那28].三倍体桥假设表明,从具有基因组的二倍体物种的多个单位从单分包物种与基因组补锌的二倍体物种减少的单位,给予三倍体杂交YY + Z = YYZ [2].该三倍体杂交种产生未减数配子YYZ,并与亲本ZZ减数配子Z结合形成新的平衡多倍体YYZ + Z = YYZZ。异源多倍体进化的三倍体桥假说的一个关键因素是种间杂交产生的未减少配子[2].我们的结果表明,未减少配子的产生芸苔属植物种间杂交比亲本基因型更高,这将通过三倍体桥促进多倍体进化。
Hybrid Pollen尺寸分布,预计将分布在预测的2周围X.平均花粉大小,偏向右侧(> 2X.)(图3.).这表明失去单价染色体赋予由三种杂种生产的配子的活力惩罚。在花粉开发过程中,由于我们的实验中的三种杂交种产生的降低的配子,未减少的配子也更加可行,因为在可行的花粉级分中估计的未收款配子的一部分比Sporad估计的未更好的配子的分数大得多(13.8%)人口(1.32%)。这支持类似的雄性未更新的配子的高可力度拟南芥[27].我们还观察到初始交叉事件中未更新的配子选择,以产生四个“三倍体”杂种,其中二倍体基因组B. Napus.和单倍体基因组B. Juncea.(表1).这表明无论倍率水平如何,所有间隙交叉都可能更加活跃。预计倍增性倍增性的多倍化和品种(例如未收录的配子生产)的机制将被保守[29],如大多数物种在大多数物种中发现的多轮多倍体所证明的[30.].因此,通过间隙的杂种杂交品未收回的配子生产芸苔属植物异源四倍体可能模仿二倍体未减少的配子产生过程芸苔属植物种间杂交。有趣的是,Palmer等人(1983)[31]从叶绿体DNA分析预测,新型杂交物对父母群体的后交叉必须发生在进化期间发生几次B. Napus.从祖先物种B. Rapa.和b . oleracea,支持该属多倍体形成的三倍体桥机制。
我们的研究预测了异常孢子产生的三个机制:落后的染色体,异常纺锤体形成和减数分裂前加倍。首先,五端和六端产量呈高度正相关(r2= 0.56),大多数这种形式的孢子似乎具有四种较大的核和一个或两个小核。这些额外的细胞核可能由Meiosis的淋巴结染色体形成(图2 e,也建议D'Erfurth等。(2008)[27),形成微核,在孢子期可见(有时在花粉期也能看到非常小的、未染色的细胞,数据未显示)。在我们的实验中观察到的二分体和三分体频率之间的相关性可能是由于共有的减数分裂机制。最可能解释二分体和三分体的减数分裂机制是纺锤体的异常形成。几个主要的基因突变芸苔属植物相对拟南芥通过与减数分裂II中平行纺锤体相同的机制,导致高频率的二联体和三联体(附加文件)1) [5.那27那32].一个基因被认为是负责任的茄属植物对于融合、平行和三极纺锤体[33],分别产生对、对和三合。如果一个基因也与异常纺锤体定向有关芸苔属植物,这可能解释了我们在实验中观察到的二元和三元之间的相关性。最后,在我们的研究中偶然观察到“巨大”孢子(也在芸苔属植物福岛事件(1930年)[24])提示某些花粉母细胞的体细胞加倍可能发生在减数分裂之前,尽管可能的原因尚不清楚。
温度对我的研究中的Meiotic产品评估的减数分裂行为有两种不同的影响。首先,寒冷的温度处理刺激了未雷的配子生产B. Napus.×B. Carinata.种间杂交组合N1C2和N2C2(图3.).其次,高温处理出现了刺激减数分裂的异常现象B. Napus.N1型和in型B. Napus.×B. Carinata.n1c2。减数分裂在每种花药中不良,并且经常导致额外的核或微核,可能是染色体的肺衬垫或主轴异常。MeIosis的染色体辛膜肿大,已知受温度的影响[34那35].最近的研究在拟南芥酵母与染色质重塑有关,以应对低温,导致基因转录的物理阻塞[36那37].DNA甲基化也与许多植物物种的低温春化反应有关[38].由于本研究中使用的冷热处理(30°C day/20°C night and 10°C day/5°C night)可以在全球正常生长条件下达到芸苔属植物这表明,温度对减数分裂反应在多倍体育性、物种形成和建立中的作用需要进一步研究。
结论
与母体基因型相比,在一些三种杂交体中,未更高的配子在一些种间杂交中的平均值较高。未收款的配子也比种间杂交种中的减少配子更加可行。基因型变异存在于未更新的配子中的混合组合中芸苔属植物寒冷的温度刺激三种杂种和一些杂交基因型,产生高水平的未更新的配子。这些结果表明,未更好的配子来源,易于使用的全多倍体物种形成的三倍体桥梁假设,可容易获得芸苔属植物种间杂交,特别是在开花期间温度较低的情况下。
方法
植物材料
在这项研究中,亲本基因型来自于Nelson等人(2009)所描述的通过小孢子培养协议的双单倍体过程[19]及Cousin and Nelson (2009) [39]并被纯种子方法膨胀。五B. Napus.基因型是“SURPASS400_024DH”,“TRILOGY”,“WESTAR_010DH”,“MONTY_028DH”和“BOOMER”,下文分别称为N1,N2,N3,N4和N5。两者B. Carinata.基因型分别为“195923.3.2_01DH”和“94024.2_02DH”,下文分别称为C1和C2。天生的B. Juncea.亲本“JN9-04”(以下简称J1)是Janet Wroth (UWA, Perth, Australia)自交单株选育的近油菜籽品质亲本芸苔属植物juncealine“JN9”由Wayne Burton (Primary Industries, Horsham, Victoria, Australia)提供。
在父母基因型之间进行了三种杂交组合芥菜、甘蓝型油菜和B. Carinata.通过在受控环境室(CER)在18°C / 13°C的粉状和授粉,在18℃/夜间/夜间,具有约500μmolm的光强度为16小时光周期-2S.-1.一个物种的每个品种或株系与其他两个物种的每个品种或株系杂交(见表)1),并尝试所有的交互杂交。每个杂交组合在每个方向至少传粉16个花蕾(平均59个)2).种间杂交组合以下指的是两个亲本基因型代码(例如J1N1 =B. Juncea.j - 1×显著N1杂种,以J1为母本)。将总状花序包裹在面包袋中,阻止了异花授粉。
生长条件和实验设计
假设的杂交种子的子集被种植在两组,以产生实验种间杂交群体。在第一组中,90颗推测杂交种子发芽成熟,代表23个杂交组合,其中21个组合经分子标记分析(分子标记方法见下表)证实为真正杂交植株(见下表)1).有13种成功组合的父母基因型组合,其中10种互核也是成功的10个(见表1):五芥菜×甘蓝型油菜(J1N1, J1N2, J1N3, J1N4和J1N5),二juncea × carinata(J1C1和J1C2)和6个B. Napus×B.Carinata(N1C1,N1C2,N2C2,N3C1,N4C1和N4C2)。每种Amphidiploid母体基因型的自带种子萌发并在杂合种子的同时成熟。来自大多数杂种组合和母基因型的种子在灌封混合物中发芽,在18℃/ 13℃的受控环境室(CER)中的盆中生长,在约500μmolm的光强度下,16小时光周期-2S.-1.只产生一粒种子的杂交组合和对生组合(山楂×甘蓝型油菜C1J1、C1N1、C2N1和C2N4;B. Napus×B.CarinataN3C1),种子在培养皿中无菌条件下在琼脂上萌发,然后转移到CER中的土壤中生长并进行后续测量。15株植物中的12株在后代集中juncea × carinataJ1C1在2008年澳大利亚大学(澳大利亚)的2008年春天,在两到四叶阶段转移到一个玻璃池,在2008年春天蒸发冷却(澳大利亚珀斯)。为所有杂种组合和父权控制收集了所有杂种组合和母体控制收集了可行的花粉晶粒和自种子集数据的花粉尺寸测量的形态学,Sporad生产,花粉尺寸测量。由于线性混合模型之后的低数量汇集了往复运动:未收音的配子生产〜基因型+母体母体显示出母体父母的显着影响(P> 0.05)。使用Hellop-Harrison等人详述的方法估计花粉活力估计。(1984)[40].仅假定荧光荧光(表示完整细胞膜)的花粉颗粒是可行的,随后测量的。使用Axiocammr3显微镜相机(Carl Zeiss,Germany)和使用AxioVision Software V4.6.3(Carl Zeiss Imaging Solutions GmbH,2007)的花粉最小直径进行了花粉的照片。在收集种子之前,通过在开花的面包袋中封闭植物来促进自授粉。
为了检验温度对雄性未减数配子产生的影响,我们选择了一个杂交组合和亲本基因型子集:5个种间杂交组合(芥菜×甘蓝型油菜J1N1 J1N2;juncea × carinataJ1C1;B. Napus×B.CarinataN1C2、N2C2)及其5个亲本基因型(B. Juncea.J1;B. Napus.N1、N2;B. Carinata.C1, C2)。这些植株均在光强约650 μmol m的光周期为12 h的条件下生长-2S.-1.每个基因型的种子在18°C/10°C白天/晚上的CER中种植,每个基因型的2株幼苗在2 - 6叶期随机转移到4个托盘(4 × 5 cell)的15 cm深的单个花盆中。5周后(就在早期基因型的螺栓之前)一个托盘移到30°C/20°C白天/晚上(热),一个托盘移到25°C/15°C白天/晚上(暖),另一个托盘移到10°C/5°C白天/晚上(冷),一个托盘保持在18°C/10°C(冷)。在“暖”温度处理中,有5株植物在开花前死亡,记录为缺失值:2 ×B. Carinata.C1、2×juncea × carinataJ1C1和1×B. Juncea.j - 1。用1%醋酸胭脂红染色测定花粉活力和孢子计数。成熟,肿胀的花粉粒强烈染色红色被认为是可行的。在每一株植物中,至少从两种不同的花中分别采集了300个花粉粒。在既产生雄性不育花又产生雄性可育花的植物中,只评估雄性可育花的花粉活力。开花时间被记录为第一个花蕾开放的天数。
Sporad观察
通过对孢子期减数分裂产物的评估来估计雄未减数配子的产量1).根据存在的核数(分别为1至7个核),Sporads被归类为MONADS,DYADS,TRIAS,TETRADS,PENTAD,Hexads或eptads。与来自相同花药的所有周围的四胞胎相比,视觉上鉴定出“巨型”旋转型,特别是较大的四胞胎,特别是含有更大的核。
使用以下公式估算未减少配子的男性频率:

单倍体、二倍体、三倍体、五倍体和六倍体可能产生异常(非整倍体、二倍体或四倍体)配子。
从公式计算出异常的配子频率:
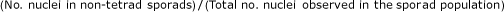
在温度研究中,每个植株每个芽至少有300个孢子,每个植株有两个不同的芽。
花粉大小估计
花粉尺寸也用于估计第一个实验群体中可行的未更新的配子生产,假设DNA含量加倍将导致花粉体积加倍。花粉长度和宽度上花粉粒的一个子集(估计使用荧光素二乙酸酯染色是可行的)从每个亲本基因型测量,并且用于计算花粉晶粒体积这些尺寸(基于使用直径和长度为卵形体积计算)。来自二倍物种的花粉B. Rapa.“Chiifu”(2N= AA = 2X.)也作为对照组进行了测量。为了控制基因型效应,以中亲本平均值为值计算种间杂交的预期花粉大小。海恩(1977)(22]证明了“巨型”花粉直径b .黑质(2N= bb = 2X.)范围从正常直径的1.26到1.54倍,花粉减少(基因组补充B = 1X.).嘿嘿嘿(1977)[22],我们使用最低值1.5倍“正常”减少(2X.),将花粉分类为“巨人”(4X.或者更大的倍倍数,例如AABC)。将花粉分类为4的平均最小直径X.本研究为39.7 μm。
DNA提取及分子标记分析
用MagAttract 96 DNA Plant Core Kit (Qiagen)从叶片组织中提取DNA。利用已知位点的b -基因组微卫星标记sJ0338和sJ6846进行杂交检测B. Juncea.由A. Sharpe和D. Lydiate提供[加拿大农业和农业食品研究中心,萨斯卡通;珀耳斯。通讯。有关更多信息,请参见http://brassica.agr.gc.ca.])。这两个标记都产生了三个父片种类中有两种的乐队。用分子标记结果证实的植物,但在A,B和C基因组中扩增34种特异性微卫星标记等位基因(SNRD03,SN11707,)进一步表征了母体基因型之间的血液表型的植物SN11722,SS2066,SN1988,SS1949,SR12384i,SR10417,SR12387,SN13039),以确定存在的父基因组的相对数量。使用AB3730使用荧光标记的引物和可视化的片段扩增xl毛细管测序仪(应用生物系统)是根据Nelson et al.(2009)详细的方法进行的[20.].
统计测试
使用R版本2.10.1进行统计分析(统计计算的R基础,2009)。使用Microsoft Excel 2002(Microsoft Corporation)生成数字。具有汇集SD和HOLM P值调整方法的成对T检验,用于多种比较进行基因型×温度处理的后HOC比较,并评估未更新的配子生产中的基因型差异。线性模型用于评估母体,父母,父母,基因型和杂种组合对未更新的配子生产的相对意义。
参考资料
- 1.
Harlan JR, DeWet JMJ:在Ö上。退缩和祈祷:多倍体的起源。acta botanica sinica(云南植物研究),2003,21(4):531 - 534。10.1007 / BF02860830。
- 2.
Ramsey J,Schemske DW:开花植物中多倍体形成的途径,机制和率。生态与系统性的年度审查。1998年,29:467-501。10.1146 / annurev.ecolsysys.29.1.467。
- 3.
李志强,李志强:多倍体植物基因组的可塑性和多样性。中国科学:地球科学。10.1126 / science.1153585。
- 4.
Bretagnolle F,Thompson JD:丹Lley审查78号。配有天籁的配子(原文如此)染色体数目:染色体数目的形成机制及其在同源多倍体植物进化中的作用。植物学报,1998,29(4):457 - 461。10.1111 / j.1469-8137.1995.tb03005.x。
- 5.
植物未还原配子的形成机制及展望。acta botanica sinica(云南植物学报),2011,32(6):643 - 648。10.1093 / jxb / erq371。
- 6.
丈夫BC:三倍体杂交种在混合倍性群体进化动态中的作用。临入社会生物学杂志。2004,82:537-546。10.1111 / J.1095-8312.2004.00339.x。
- 7.
Mable BK:“为什么多倍体在动物中比在植物中少见”:神话和机制。中国生物医学工程学报。2004,32(4):453-466。10.1111 / j.1095-8312.2004.00332.x。
- 8.
Felber F:在二倍体血泡中建立四倍体细胞型:细胞型相对适应性的影响。进化生物学杂志。1991年,4:195-207。10.1046 / J.1420-9101.1991.4020195.x。
- 9.
Pécrix Y, Rallo G, Folzer H, Cigna M, Gudin S, Le Bris M:多倍体化机制:温度环境可诱导二倍体配子形成罗莎《实验植物学杂志》。
- 10。
联合国:基因组分析进入芸苔属植物特别参照实验形成B. Napus.和特殊的施肥方式。《植物学报》,1995,7:389-452。
- 11.
Fitzjohn RG,Armstrong TT,Newstrom-Lloyd Le,Wilton Ad,Cochrane M:杂交内芸苔属植物和联盟属:转基因逃生潜力的评估。Euphytica。2007,158:209-230。10.1007 / s10681-007-9444-0。
- 12.
Chen S, Nelson MN, Chèvre A- m, Jenczewski E, Li Z, Mason AS,孟J, Plummer JA, Pradhan A, Siddique KHM, Snowdon RJ, Yan G, Zhou W, Cowling WA: trigenomics桥芸苔属植物改善。植物科学的关键评论。
- 13.
通过非同源重组重建异源多倍体芸苔属:荚裂抗性的渗透芸苔栗鸟.遗传学研究。1990,56:1-2。10.1017 / S0016672300028810。
- 14.
Morinaga T:三种杂交芸苔属植物2F1混合动力汽车的B. Cernua.以及其他有10条染色体的物种。acta botanica sinica(云南植物学报)。
- 15.
Morinaga T:三种杂交芸苔属植物六、F1混合动力汽车的B. Juncea.和b .黑质.细胞学。1934,6:62-67。
- 16.
Iizuka M:近交系引起的减数分裂不规则芸苔属植物和获得.遗传学。1961,46:873-
- 17.
黄志强,王志强,王志强,等Diplotaxis erucoides与芸苔栗鸟.I. F的细胞遗传学分析1和公元前1后代。Euphytica。1989,41:123-128。10.1007 / bf00022421。
- 18.
Chèvre AM, Eber F, Baranger A, Hureau G, Barret P, Picault H, Renard M:田间条件下油菜和野萝卜回交后代的特性1种间杂交种:转基因扩散的评估。遗传工程学报,1998,19(1):1 - 8。10.1007 / s001220050870。
- 19.
(1)利用小孢子培养技术,从一种杂种中优先选择未还原的(2n)配子芸苔栗鸟L.×芸苔属植物carinata布劳恩。理论和应用的遗传学。2009,119:497-505。10.1007 / s00122-009-1056-8。
- 20。
梅森as,纳尔逊Mn,Castello M-C,yan g,cowling wa:基因型对同源和同源重组频率的影响芸苔栗鸟×B. Carinata.混合动力车。遗传学报。2011,122(3):543-553。10.1007 / s00122 - 010 - 1468 - 5。
- 21。
d'Erfurth I, Jolivet S, Froger N, Catrice O, Novatchkova M, Mercier R:将减数分裂转化为有丝分裂。公共科学图书馆。2009,7:e1000124-10.1371/journal.pbio.1000124。
- 22。
通过种间杂交和倍性水平分析十字花科未还原配子。Zeitschrift毛皮Pflanzenzuchtung。1977、78:13-30。
- 23.
Ramsey J:在自然群体中未收回的配子和尼多利片蓍属北欧化工.遗传。2007,98:143-150。10.1038 / sj.hdy.6800912。
- 24.
Fukushima E:二倍体和四倍体配子的形成芸苔属植物.日本植物学杂志。1930,5:273-284。
- 25.
Mason as,Huteau v,Eber F,Coriton O,yan g,尼尔森Mn,Cowling wa,Chèvrea-m:基因组结构影响AABC,BBAC和CCAB中的AutoSyndesis和Allosyndesis的速率芸苔属植物种间杂交。染色体的研究。2010年,18:655 - 666。10.1007 / s10577 - 010 - 9140 - 0。
- 26.
哈伯德:一项关于物种关系的细胞学研究芸苔属植物.1950年,MSC论文:威尔士大学
- 27.
D'Erfurth I,Jolivet S,Froger N,Catrice O,Novatchkova M,Simon M,Jenczewski E,Mercier R:突变AtPS1(拟南芥平行纺锤体)导致二倍体花粉颗粒的生产。Plos遗传学。2008,4:E1000274-10.1371 / journal.pgen.1000274。
- 28.
Köhler C, Mittelsten Scheid O, Erilova A:三倍体块对多倍体植物起源和进化的影响。遗传学报。2010,26:142-148。10.1016 / j.tig.2009.12.006。
- 29.
异源多倍体形成。非洲爪蟾的生物学。编辑:Tinsley RC, Kobel HR。1996,牛津大学:克拉伦登出版社,391-401。
- 30.
被子植物的古代和近代多倍体。植物学报,2005,33(5):591 - 598。10.1111 / j.1469-8137.2005.01379.x。
- 31。
Palmer JD,Shields Cr,Cohen DB,Orton TJ:叶绿体DNA进化和Amphidiploid的起源芸苔属植物物种。理论与应用遗传学。1983,65:181-189。10.1007 / BF00308062。
- 32。
De Storme N,GEELEN D:拟南芥突变体杰森在减数分裂II中通过平行/融合纺锤体机制产生未减少的第一次分裂恢复雄性配子。植物营养与肥料学报。2011,29(4):591 - 598。10.1104 / pp.110.170415。
- 33。
Carputo D,Barone A,Frusciante L:马铃薯的配子:育种和种质转移的必要成分。理论和应用的遗传学。2000,101:805-813。10.1007 / S001220051547。
- 34。
Dowrick GJ:温度对减数分裂的影响。遗传。1957,11:37-49。10.1038 / hdy.1957.4。
- 35.
Bayliss MW,Riley R:对温度依赖的Asynapsis分析。遗传研究。1972年,20:193-200。10.1017 / S0016672300013707。
- 36.
Kumar SV,Wigge PA:含H2A.z的核体介导拟南芥中的热敏感应反应。细胞。2010,140:136-147。10.1016 / J.Cell.2009.11.006。
- 37.
富兰克林KA:植物染色质感觉热。细胞。2010,140:26-28。10.1016 / J.Cell.2009.12.035。
- 38.
Burn JE, Bagnall DJ, Metzger JD, Dennis ES, Peacock WJ: DNA甲基化,春化和开花的开始。美国国家科学院学报。1993年,90:287 - 291。10.1073 / pnas.90.1.287。
- 39.
表亲A, Nelson M:油菜籽小孢子衍生双胞胎胚胎(芸苔栗鸟都是基因相同的。植物学报。2009,28:831-835。10.1007 / s00299 - 009 - 0677 - 3。
- 40.
Heslop-Harrison Js,Heslop-Harrison Y,Shivanna Kr:花粉质量评估,以及荧光色(FCR)测试程序的进一步评估。理论和应用的遗传学。1984,67:367-375。10.1007 / BF00272876。
确认和资金
这项工作得到了澳大利亚研究委员会联系项目LP0667805的支持,行业合作伙伴Council of Grain Grower Organisations Ltd和Norddeutsche Pflanzenzucht Hans-Georg Lembke KG。我们感谢西澳大利亚油菜籽育种公司为本研究提供的品种和材料。在本项目中,MNN和WAC得到了粮食研发公司UWA00120项目的支持。
作者信息
隶属关系
通讯作者
额外的信息
竞争利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
所有作者都有助于概念化和实验设计。ASM进行了实验工作和数据分析,并起草了稿件。WAC,MNN和GY监督ASM并修订了稿件。所有作者均阅读并批准最终手稿。
电子辅料
2n = 2时减数分裂示意图
附加文件1:X.= 2株双子叶植物.2n = 2时减数分裂示意图X.= 2个双旋晶植物,显示在A)常规减数分裂的末端观察到的孢子制作,导致形成四核(4个减少的核,n =X.= 1)和b)具有平行锭子的减数,导致形成Dyad(2个未收音的核,n = 2X.= 2). (ppt 15kb)
一个基因型的种间杂交成功的详细杂交记录(花蕾授粉、荚果结实率和种子产量)
额外的文件2:B. Juncea.,五种基因型B. Napus.和两种基因型B. Carinata..一个基因型的种间杂交成功的详细杂交记录(花蕾授粉、荚果结实率和种子产量)B. Juncea.,五种基因型B. Napus.和两种基因型B. Carinata..(XLS 31 KB)
“巨型”花粉观察和未发出的和异常的男性配子生产在产生的异常间隙杂种中
附加文件3:Brassica Napus,B. Juncea和B. Carinata..“巨型”花粉观察和未发出的和异常的男性配子生产在产生的异常间隙杂种中芸苔栗鸟(b . n: N1和N3),B. Juncea.(b j: j - 1)和B. Carinata.(B.C.: C1)。四种植物由一个未减少的雌性配子产生B. Napus.和正常,减少的配子B. Juncea..另一个植物是由正常的,减少的女性配子引起的B. Juncea.和异常的(非整倍体,< n)配子B. Carinata..杂交种中的假设“巨型”花粉大小从N和2N花粉的测量估计B. Napus.和B. Juncea.假设a) DNA含量增加一倍,花粉粒体积增加一倍;假设b)减少花粉,杂种的DNA含量最高为4X..假设两对体和巨大孢子体产生未减少的雄配子,而非四分体孢子体产生异常的雄配子。(DOC 32 KB)
天到头两朵花
额外的文件4:B. Carinata.accessions (C1和C2), 1B. Juncea.加入(j - 1), 2B. Napus.品种(N1和N2)和它们之间的种间杂交(如J1N1 =B. Juncea.J1×B. Napus.n1)在四种不同的温度处理下.天到头两朵花B. Carinata.accessions (C1和C2), 1B. Juncea.加入(j - 1), 2B. Napus.品种(N1和N2)和它们之间的种间杂交(如J1N1 =B. Juncea.J1×B. Napus.N1)在四种不同的温度处理下。温度和基因型组合占开花时间方差的95%(P <0.0001,R2= 0.95),基因型与环境的交互作用虽小,但具有统计学意义(p < 0.05)。10个基因型中有9个基因型在低温下开花显著延迟(p < 0.0001)。(PPT 190 KB)
作者为图像提交的原始文件
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署名许可协议(http://creativeCommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Mason,A.S.,Nelson,M.N.,Yan,G。et al。可育雄性未减少配子的生产芸苔属植物间隙杂种是特异性的基因型,受到寒冷的温度刺激。BMC植物杂志11,103(2011)。https://doi.org/10.1186/1471-2229-11-103
收到:
接受:
发表:
关键字
- 三个杂交
- 父母的基因型
- 可行的花粉
- 未收音的配子
- 控制环境室