摘要
背景
转位蛋白18 kDa (TSPO),以前被称为外周型苯二氮卓受体(PBR),对哺乳动物和细菌的许多细胞功能非常重要,如类固醇生物合成、细胞呼吸、细胞增殖、细胞凋亡、免疫调节、卟啉和阴离子的运输。拟南芥包含一个TSPO / PBR与细菌或哺乳动物中的同源基因相比,该基因n端延伸40个氨基酸,表明该基因可能是叶绿体或线粒体定位的。
结果
为了测试TSPO n端延伸是否将其靶向到细胞器,我们在TSPO中融合了三个潜在的转译起始位点TSPOGFP n端cDNA (在TSPO: eGFP)。的位置在TSPO:发现eGFP融合蛋白依赖于翻译起始位置和植物生长条件。全身的在TSPO:在标准条件下植物生长时,在内质网和未知的囊泡中发现了eGFP融合蛋白。然而,全长在TSPO:eGFP在150 mM NaCl和盐胁迫条件下生长时定位于叶绿体。相反,当在TSPO:eGFP被截断至第2或第3起始密码子21或42位,融合蛋白在标准条件下与线粒体标记共定位。利用启动子格斯融合、qRT-PCR、荧光蛋白标记和叶绿体分割方法,我们证明了这一点在在非生物应激条件下,TSPO水平在转录、转录后和翻译后水平上受到调控。盐反应基因在atspo-1混战在盐胁迫条件下,突变体与野生型相比,而在盐胁迫条件下,突变体与野生型相比减少在TSPO过表达。四吡咯生物合成基因突变和叶绿素或类胡萝卜素生物合成抑制剂的应用也有影响AtTSPO表达式。
结论
我们的数据表明,AtTSPO在的反应中起着作用拟南芥对高盐胁迫。盐胁迫导致AtTSPO通过其n端延伸从内质网重新定位到叶绿体。此外,我们的研究结果表明AtTSPO在四吡咯生物合成突变体的转录水平上被调控。因此,我们提出在在盐胁迫和其他四吡咯代谢受损的条件下,TSPO可能在运输四吡咯中间体方面发挥作用。
背景
高等植物通过一个共同的分支途径合成四种主要的四吡啶(叶绿素、血红素、西罗血红素和光敏变色素)[1- - - - - -3.](附加文件1).在后生动物中,血红素和似红素是在线粒体中合成的,但在植物中,四吡咯的生物合成是质体定位的,这表明四吡咯是从叶绿体运输到线粒体的。这表明血红素生物合成途径的晚期存在于叶绿体和线粒体中(附加文件)1).四吡咯中间体的浓度是严格控制的,因为这些化合物是光反应性的,可以产生活性氧(ROS)。此外,该途径中的许多酶受到环境刺激和发育信号的调控[4,5].
在哺乳动物中,一个18kda的外周型苯二氮卓受体(TSPO/PBR)位于线粒体外膜[6]在此结合其他蛋白质,如34-kDa电压依赖性阴离子通道和内膜腺嘌呤核苷酸载体[7].TSPO最初被命名为“外周苯二氮卓受体”(PBR),然而,最近它被重新命名为“TSPO”,这反映了它与细菌富含色氨酸的感觉蛋白在结构和功能上的相似性[8].
TSPO主要功能是运输血红素、卟啉、类固醇和阴离子[8- - - - - -11].然而,TSPO蛋白对细胞呼吸作用也很重要[12],细胞增殖[13]和凋亡[14].例如,在红系中,在应激反应中,TSPO对于转运卟啉很重要,卟啉诱导血红素生物合成基因的表达。同样,在小鼠红白血病细胞中,TSPO已被证明运输原卟啉IX,在四吡咯和血红素生物合成中发挥关键作用[15].
在α-变形菌门Rhodobacter sphaeroidesTSPO定位于外膜,氧诱导其表达[16].在高氧条件下,TSPO通过输出四吡啶途径的过量中间产物,如Mg-Protoporphyrin IX (Mg-ProtoIX)和MgProtoIX单甲基酯,负调控光合基因的表达[17].河鼠TSPOHomologue补充Rhodobacter tspo突变,表明TSPO的功能是保守的r . sphaeroides后生动物[18].
TSPO蛋白功能性的证据拟南芥其他植物之前也有报道[19].重组体的运输研究拟南芥TSPO在大肠杆菌揭示了苯二氮平刺激的原卟啉和胆固醇的高亲和力摄取,导致了假设拟南芥同源在原卟啉原IX运输到可以合成血红素的线粒体中起作用。然而,作用在TSPO在植物代谢中的作用尚不清楚。
在动物和酵母中,TSPO存在于线粒体的外膜[6,20.].然而,TSPO在植物中的定位仍然存在争议。Lindenman等.[19]免疫金染色显示TSPO定位于线粒体和质体的外膜洋地黄lanata叶子。然而,后续的Western blot实验只能检测到线粒体部分的TSPO。在另一项研究中,TSPO在从茄属植物tuberosum分生组织,而在叶绿体部分检测到低水平[21].在Physcomitrella金属盘,瞬时表达的TSPO融合到GFP的n端,PpTSPO:GFP,定位于线粒体[22].在拟南芥, TSPO与YFP的c端融合导致YFP:在内质网和高尔基堆中发现TSPO [23].
的拟南芥基因组包含一个TSPO相关基因(AtTSPO).预测的蛋白质与其细菌和哺乳动物同源物的中心结构域高度相似。然而,在TSPO有一个40个氨基酸的n端延伸,在细菌或哺乳动物中都不存在。此外,在这40个氨基酸中,有三个帧内atg密码子可以编码第一个蛋氨酸(位于M1, M21和M42位置)(附加文件)2) [19].为了确定该区域是否包含细胞器靶向信息,我们利用3个不同的起始位点开发了一系列融合蛋白。我们的研究结果表明在TSPO存在于不同的细胞器区室,不同的环境胁迫不同。这些结果,加上插入突变和表达研究的分析,表明在TSPO在允许过程中起着重要作用拟南芥以应对高盐胁迫。
结果
感应AtTSPO非生物胁迫下基因表达
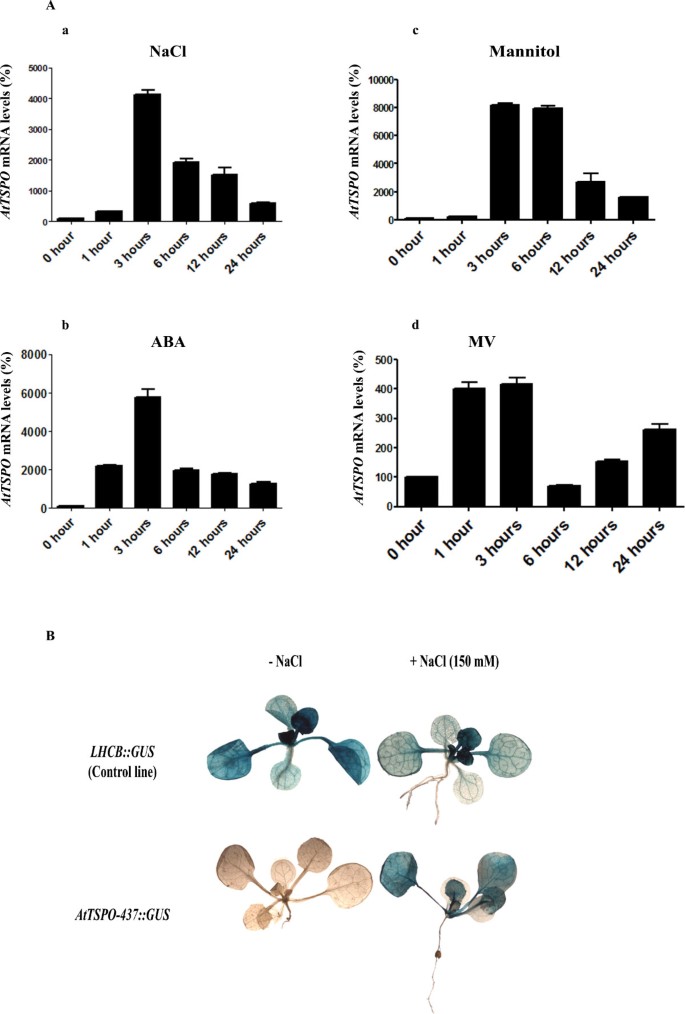
在Physcomitrella金属盘,表示PpTSPO-1是由盐胁迫和脱落酸(ABA)诱导的[22].AtTSPO也是由盐胁迫诱发的吗拟南芥[24],以及在拟南芥细胞培养[23].我们进一步定义了的转录丰度AtTSPO用NaCl、甘露醇、ABA和甲基紫ologen (MV)处理5日龄幼苗,提取总RNA,进行实时荧光定量PCR (qRT-PCR)。
与未处理植株相比,150 mM NaCl、250 mM甘露醇、1 μM ABA和0.2 μM甲基紫ologen (MV)处理均显著增加AtTSPO表达式(图1).的动力学AtTSPONaCl和ABA胁迫下的诱导效果相似,均在处理3 h后达到峰值,6 ~ 25 h后逐渐下降1一而且1 a - b分别)。甘露醇的加入导致峰值AtTSPO在3-6 h之间表达,然后丰度缓慢下降(图1一,1 a - b而且1得了).然而,与NaCl处理3小时相比,甘露醇处理显示出两倍的诱导作用(图1一而且1得了),这表明AtTSPO是由渗透胁迫而不是盐胁迫引起的。在MV处理迅速诱导TSPO,在1小时出现诱导,3小时达到峰值,然后在12-24小时之间下降到基础水平(图1模拟).
来确定AtTSPO积累是对NaCl胁迫的转录反应,一个结构,包含437 bp上游推定的翻译起始位点AtTSPO基因被融合到uidA报告基因(AtTSPO-437::格斯),并转化为植物,使在活的有机体内分析AtTSPO对应激条件的转录反应。AtTSPO-437::格斯在处理3 h内,150 mM NaCl诱导,与内源基因的qRT-PCR结果相似(图1 b).在对照实验中,150 mM NaCl处理使基因表达量略有下降奇迹:格斯(图1 b).综上所述,这些结果表明437 bp区域的AtTSPO启动子对TSPO的转录调控是充分的。
识别和表征AtTSPO突变体
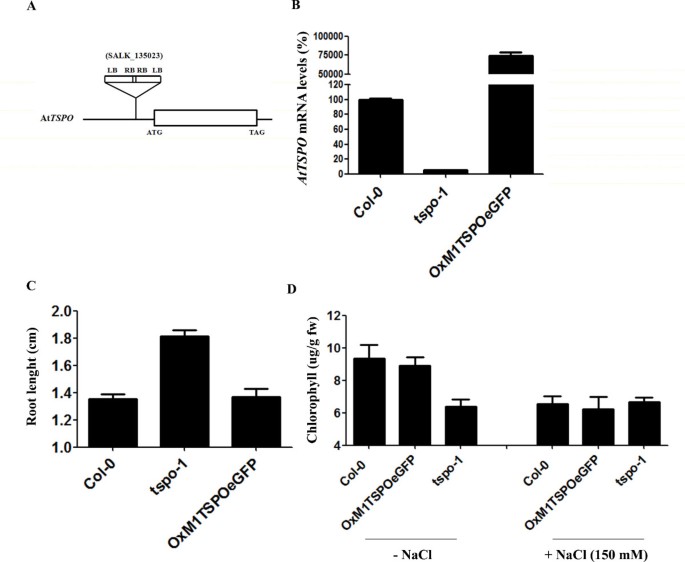
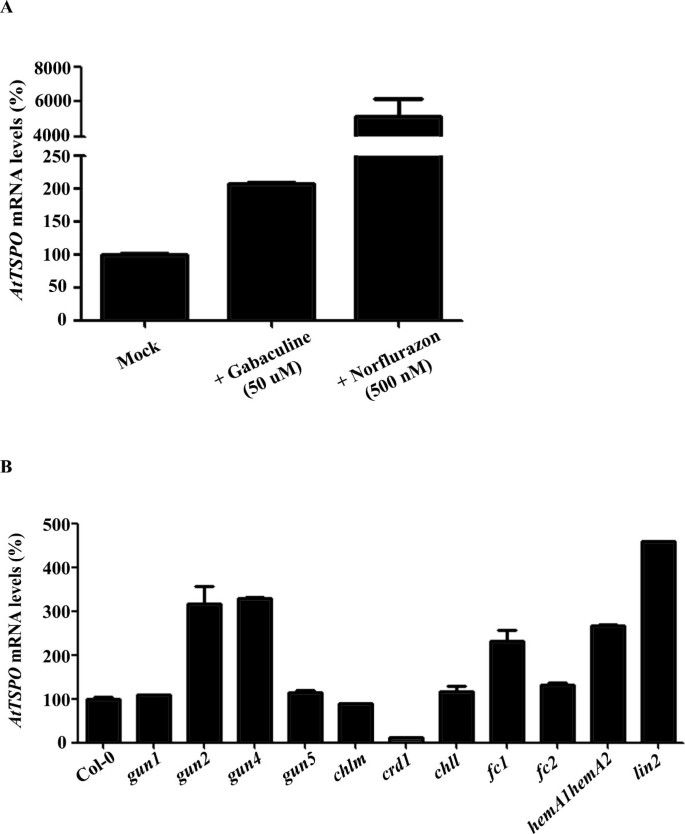
确定…的功能AtTSPO在活的有机体内,获得T-DNA插入突变体(SALK_135023) [25在AtTSPO.这一行(tspo-1)被发现有两个串联的T-DNA插入,在转录起始密码子上游123 bp处AtTSPO基因(图2).通过实时荧光定量PCR (qRT-PCR)分析,确认纯合子系为敲除突变体。在这个突变体中,TSPOmRNA水平约为野生型的20%(图2 b).
AtTSPO在转基因CaMV 35S启动子中,与GFP n端融合或不融合的基因均构成性过表达拟南芥(OxM1TSPO和OxM1TSPO:eGFP)。我们获得了10个过表达系,但主要集中在两个纯合子系,它们表现出~500倍的过表达AtTSPO(图2 b).的tspo-1, OxM1TSPO:eGFP和野生型在Murashige & Skoog (MS)琼脂培养基或土壤上并排培养,并监测可能的异常表型。与野生型和过表达株系相比,基因敲除的植株的根更长2摄氏度).此外,tspo-1在150 mM NaCl的作用下,与野生型或过表达系相比,其积累的叶绿素量减少了30%左右(图2)二维).
胁迫反应基因表达增强tspo-1
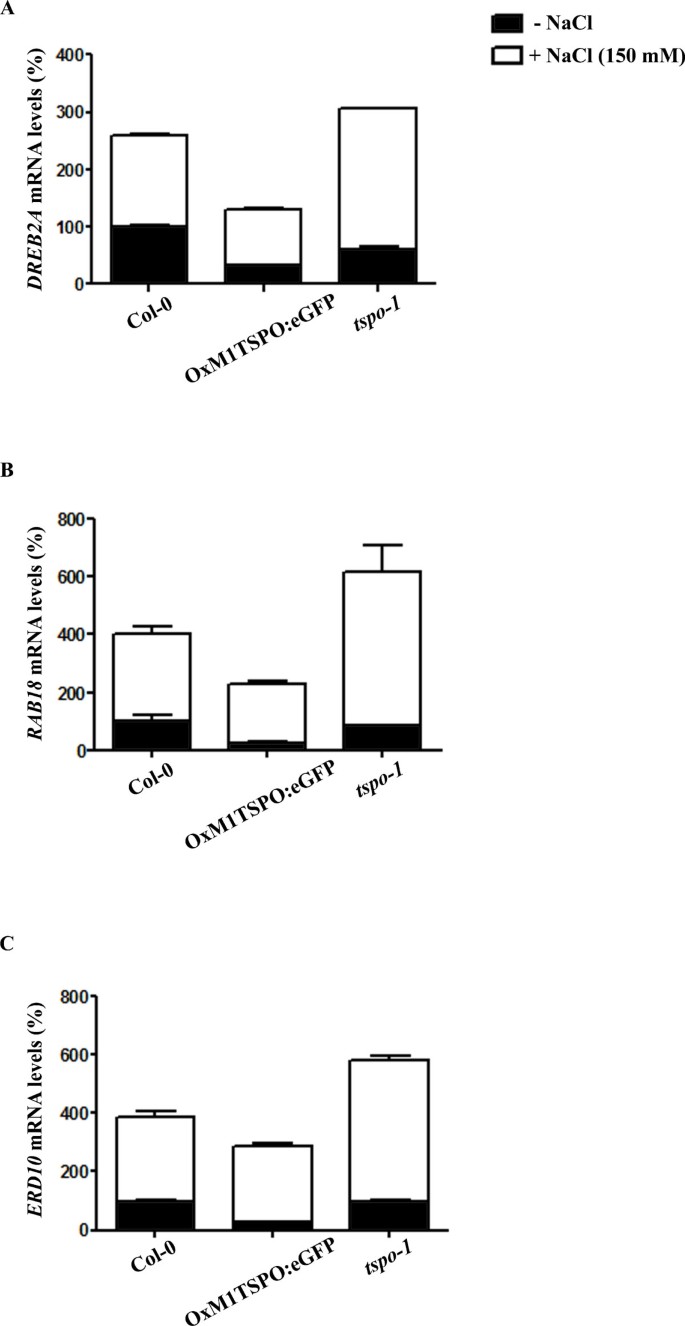
AtTSPO在发芽和幼苗生长试验中,先前的表达被渗透胁迫调节[23].因为TSPO调节光合基因的表达r . sphaeroides[16,我们假设tspo-1或OxM1TSPO:eGFP突变体可能具有盐胁迫反应受损。我们检测了一些已知的盐胁迫调节基因(RAB18, ERD10和DREB2A)的表达[26].正如预期的那样,在野生型植物中,150 mM NaCl诱导了胁迫标记基因3 a, B而且3 c).在在TSPO过表达系中,DREB2A和RAB18水平较低,但ERD10表达未见明显变化(图3 a, B而且3 c).
应激反应基因在tspo-1在盐胁迫下.(一个) - (C)胁迫诱导的OxM1TSPO基因表达:eGFP和tspo-1qPCR方法与野生型植物进行比较。5天大的幼苗在标准条件下生长,并转移到含有150 mM NaCl的培养皿中3小时。(一个)DREB2A, (B)RAB18和(C)ERD10定量qRT-PCR检测mRNA水平。相对量计算和归一化相对于未处理的Col-0(100%)。的肌动蛋白而且18岁rRNA作为内参基因。肌动蛋白,3 g18780;18岁RNA,在3 g41768;RAB18,在5 g66400;ERD10,在1 g20450;DREB2A,在5 g05410。所示数据为独立扩增反应(n = 3)和生物重复(n = 2)的平均值。计算相对表达水平。柱状图表示生物复制的标准误差。
在tspo-1在突变体中,150 mM NaCl处理3 h导致所有三个胁迫标记基因的表达增加(图3 a, B而且3 c).综合来看,这些结果表明AtTSPO在调节应激反应基因表达中起重要作用。
光调节四吡咯基因的表达受到抑制tspo-1可拆卸的突变
与TSPO转运四吡咯一致[17,19,27],tspo-1植物积累的叶绿素比野生型植物少(图二维).因为我们发现TSPO参与了盐胁迫反应,因为TSPO负调控光合基因r . sphaeroides[17].接下来,我们分析了几个关键的叶绿素生物合成基因的表达tspo-1植物。
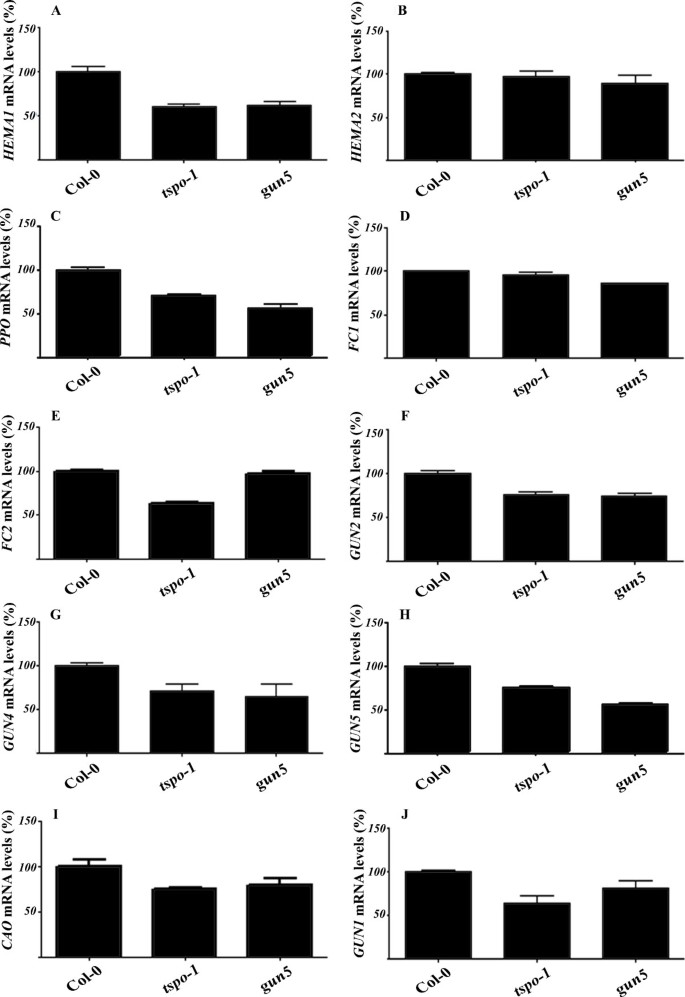
最初,我们确定了四吡咯途径中大多数关键基因的mRNA水平(附加文件)1)tspo-1而且gun5突变体。GUN5编码叶绿体mg -螯合酶的H亚基,参与感知四吡咯中间体水平的改变[28].所有已知的四吡咯生物合成基因都依赖于光[29]中被发现下调tspo-1,以及在gun5突变体(28)(图4a c e f g而且4 h),而这两个不依赖光的基因的表达在野生型和tspo-1突变体(图4 b而且4 d).
四吡咯生物合成基因的表达tspo-1突变体.四吡咯生物合成基因的qRT-PCR分析Col-0,tspo-1而且gun55天大的幼苗在持续光照下生长。相对量计算和归一化相对Col-0摘要(100%)。除了HEMA2而且FC1在美国,所有的基因都被证明是受光调节的。本文按照四吡咯生物合成的酶序进行了研究。的肌动蛋白而且18岁rRNA基因作为对照。肌动蛋白,在3 g18780;18岁核糖体rna,在3 g41768;(一个)HEMA1谷氨酰胺- trna还原酶1 -在1 g58290) (B)HEMA2谷氨酰胺- trna还原酶2 -在1 g04490);(C)PPO(Protoporphyrinogen氧化酶——在4 g01690);(D)FC1铁螯合酶1 -在5 g26030);(E)FC2铁螯合酶2 -在2 g30390);(F)GUN2血红素加氧酶1 -在2 g26670);(G)GUN4mg -卟啉合成调节剂-在3 g59400);(H)GUN5mg -螯合酶亚单位H -在5 g13630);(我)曹(叶绿素A加氧酶-在1 g44446);和(J)GUN1Pentatricopeptide repeat (PPR) protein -在2 g31400)。所示数据为独立扩增反应(n = 3)和生物重复(n = 2)的平均值。计算相对表达水平。柱状图表示生物复制的标准误差。
四吡咯通路通量与AtTSPO信使rna水平
tspo-1突变体的光调节四吡咯代谢基因水平降低(图4a c e f g,4 h),叶绿素含量也较低(图二维).为了研究降低四吡咯中间体的通量是否会影响AtTSPO我们使用了两种不同的药物来干扰四吡咯的生物合成,Gabaculine和Norflurazon。Gabaculine通过阻断谷氨酸-1-半醛转氨酶活性作为四吡咯生物合成抑制剂[30.,31].除草剂Norflurazon抑制类胡萝卜素的生物合成,并间接影响四吡咯生物合成中的酶[32- - - - - -34].AtTSPO在50 μM的gabaculine处理下,mRNA水平增加了2倍,500 nM的norflurazon处理下,mRNA水平增加了500倍5).
来探索AtTSPO表达受遗传改变的四吡咯生物合成途径的影响,我们分析了其表达AtTSPO在不同的突变背景(附加文件1).我们发现AtTSPO在不同的四吡咯途径突变体中,水平有不同的改变。AtTSPO稳态水平增加gun2(等位基因hy1-由血红素合成光敏色素动素所需)[35],gun4(原卟啉IX-和mg -原卟啉IX结合蛋白突变)[36],fc1(铁螯合酶突变体)[37],hemA1hemA2双突变体(谷氨酰胺- trna还原酶基因均突变)[38),lin-2(coproporphyrinogen III氧化酶突变)[39)(图5 b).增加的表达AtTSPO在这些突变体中与四吡咯水平降低是一致的在TSPO为其他舱室中的角色运输四吡体。唯一的生物合成突变体导致AtTSPO水平是crd1(mg -原卟啉IX单甲基酯环化酶突变)[40)(图5 b).所有这些突变,除了crd1[41],以某种方式抑制ALA的合成,这表明干扰四吡咯的生物合成或积累影响AtTSPO信使rna表达。
在TSPO定位取决于所使用的平移起始位置
AtTSPO(在2g47770)编码一种预测分子量为18 kDa的蛋白质。该蛋白在其n端扩展区有三个可能的帧内atg起始密码子(M1, M21和M42)(附加文件)2) [19].
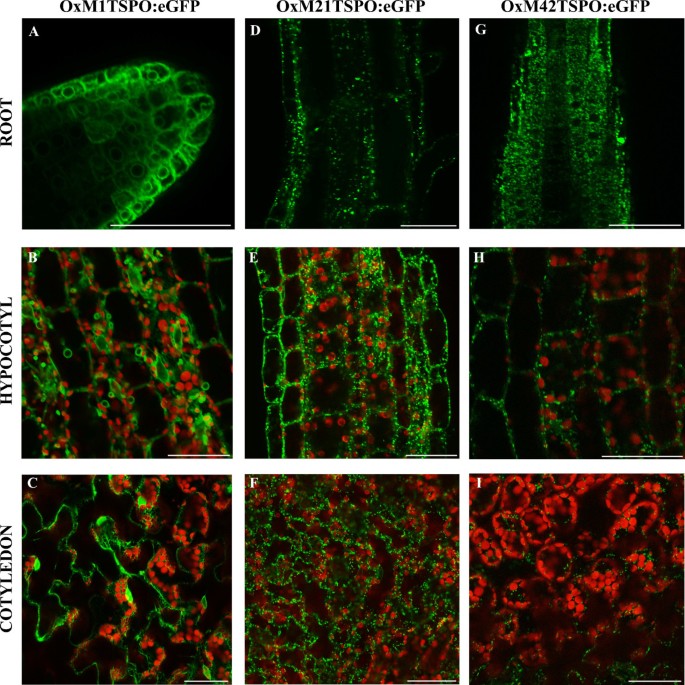
由于植物TSPO定位的报道有不同的结果,植物TSPO的亚细胞定位[19,21,23的亚细胞位置在TSPO,并评估n端延伸在目标定位中的作用AtTSPO在细胞内。过去的研究[20.,23]利用n端GFP融合,可能阻止潜在的器官靶向在TSPO,特别是线粒体或质体定位。瞄准:允许适当的瞄准在TSPO融合为GFP,AtTSPO位于GFP的n端。构建了3个结构子,分别代表从CaMV 35S启动子中表达的潜在起始密码子M1 (OxM1TSPO:eGFP)、M21 (OxM21TSPO:eGFP)和M42 (OxM42TSPO:eGFP)拟南芥.
在TSPO:通过共聚焦显微镜观察到eGFP在这些品系的根、下胚轴和子叶中的亚细胞定位。全身的在根尖内质网(ER)中发现TSPO:eGFP (OxM1TSPO:eGFP)(图6)和子叶(图6摄氏度)在5天大的幼苗中。然而,在这些植物的下胚轴中,在ER和未知身份的囊泡中发现了融合蛋白(图6 b).当使用M21 (OxM21TSPO:eGFP)或M42 (OxM42TSPO:eGFP)时,融合蛋白总是与有丝分裂追踪器共定位,表明线粒体定位(图6d e f g h而且6我)(附加文件3.).这些结果证实了先前对TSPO线粒体定位的观察d . Lanata叶用免疫金染色拟南芥western blot实验[19],以及内质网定位蛋白[23],表明三个起始密码子的替代使用可能对在TSPO定位及其翻译后控制。
在TSPO有不同的亚细胞位置,这取决于所使用的转译起始位点.OxM1TSPO共聚焦图像:eGFP (得了), OxM21TSPO:eGFP (D-F)和OxM42TSPO:eGFP (胃肠道)本地化。OxM1TSPO:eGFP定位于ER和根中功能未知的囊泡(一个),下胚轴(B)和子叶(C).OxM21TSPO:eGFP定位于根的线粒体(D),下胚轴(E)和子叶(F).OxM42TSPO:eGFP显示根中线粒体定位(G)、下胚轴(H)和子叶(我).绿色为GFP荧光,红色为叶绿素自发荧光。样本用Mitotracker进行孵育以识别线粒体(见附加文件3)。在野生型背景下使用含有35S-TSPO:eGFP的纯合转基因植物进行分析。比例尺= 50 μm。
在高盐胁迫下,OxM1TSPOeGFP与质体相关
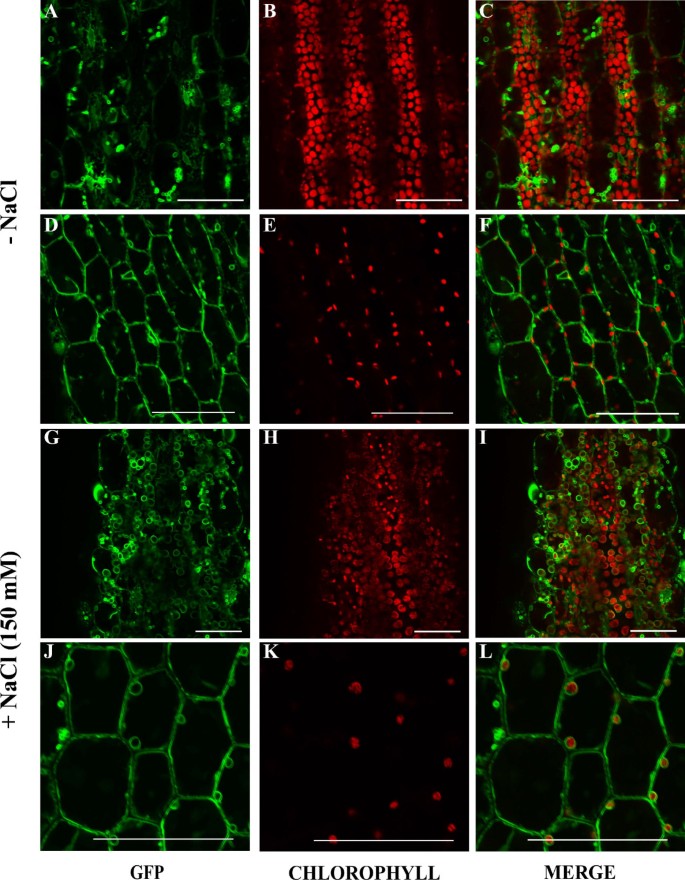
确立了关键的作用在TSPO对非生物胁迫的反应,我们接下来研究了TSPO的定位在TSPO:植物在不同胁迫条件下的eGFP融合蛋白。5日龄幼苗分别用250 mM甘露醇、1 μM ABA、0.2 μM MV和150 mM NaCl处理。处理18小时后,OxM1TSPO:eGFP定位于质体(图7g h i j k而且7 l),而OxM21TSPO:eGFP和OxM42TSPO:eGFP即使在NaCl处理延长5天也没有改变定位(数据未显示)。在TSPO:甘露醇、ABA或MV处理植物时,GFP定位没有变化(数据未显示)。
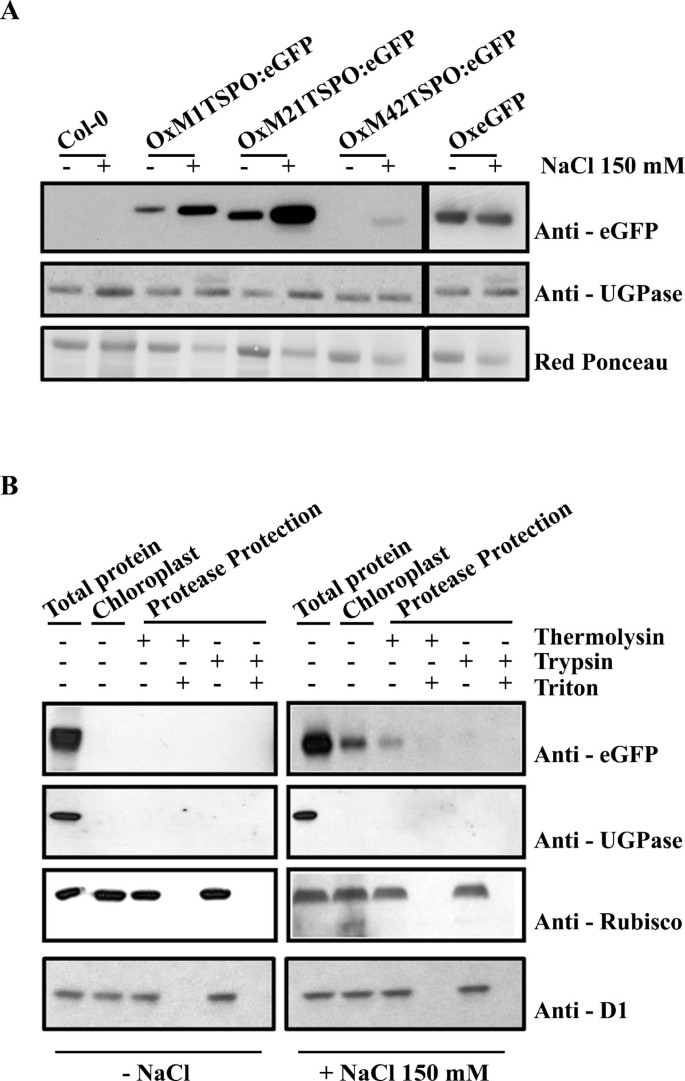
的表达水平AtTSPO在盐胁迫下,每个系的总蛋白用GFP抗体进行免疫印迹(图8).在所有情况下,在TSPO:GFP蛋白在盐处理24h后显著增加。的积累在TSPO:GFP依赖于在TSPO因为空载体控制使用CaMV或泛素10 [42]启动子驱动GFP的表达在盐胁迫下没有变化(图8没有显示)。这些结果表明在TSPO的积累在转录、转录后和翻译后水平上受到调控。
确认…的位置在我们对从OxM1TSPO:eGFP系中分离出来的叶绿体进行了蛋白酶保护实验,这些叶绿体分别在150 mM NaCl处理和不处理条件下生长。在叶绿体分离和蛋白酶保护后,等量的叶绿体用GFP抗体进行免疫印迹。在在叶绿体组分中检测到TSPO接近其预测的单体分子质量(附加文件)4而且5在150 mM NaCl处理18小时的植株中),而在未处理的植株中则没有8 b).由OxTSPO制备的叶绿体:eGFP系偶尔显示出与GFP质量近似的低分子质量带。这条带可能是蛋白质水解的结果在TSPO和GFP标签在样品制备过程中,尽管我们不能排除其他可能性,因为我们没有抗体在TSPO蛋白本身。RuBisCo和D1抗体证实了蛋白酶保护后叶绿体的完整性和存在。对细胞质蛋白UGPase的抗体也证实了这些组分不受细胞质污染(附加文件)5).这些数据以及共聚焦显微镜显示M1和M21之间的区域对于靶向很重要在盐胁迫下TSPO对叶绿体的影响。自在TSPO不受胰蛋白酶消化的影响(图8 b),AtTSPO可能是叶绿体外包膜的组成部分。
讨论
TSPO在叶绿体和线粒体中的定位与其在卟啉转运中的作用是一致的。植物TSPO已被提出参与质体与线粒体四吡咯生物合成途径的相互作用[19].在高等植物中,四吡咯几乎只在质体中合成,除了血红素合成的最后两个步骤可能同时发生在叶绿体和线粒体中。如果在TSPO参与四吡咯输运[19,我们有理由认为在TSPO可以将四吡咯中间体通过细胞器膜转运,这就解释了为什么植物需要TSPO的叶绿体和线粒体异构体。
与这一假设相一致的是在TSPO蛋白比哺乳动物和细菌的蛋白质长。叶绿体和线粒体的靶向决定因子通常位于蛋白质的n端;因此,在TSPO的c端形成了一个与GFP融合的蛋白。使用这个策略,我们证明了在TSPO有不同的亚细胞定位模式,这取决于转译起始密码子、组织类型或植物所受的非生物胁迫。GFP融合体位于TSPO的N端或c端可能解释了之前研究的不一致性[19,21,23]与这里介绍的相比。Guillaumot使用的结构[23的n端融合了YFP在TSPO,这可能潜在地掩盖了将TSPO靶向到叶绿体和线粒体的转运肽。事实上,最近观察到类似的情况拟南芥HEMERA蛋白。当HMR的c端有CFP时,它只定位在叶绿体中,然而,HMR与YFP的c端融合(YFP-HMR)只定位在细胞核和细胞质中,而不是叶绿体[43].
逆境条件的拟南芥导致er局部化的运动在M1TSPO:eGFP到叶绿体。我们还证明了TSPO n端扩展中不同的起始密码子可以将TSPO蛋白靶向到不同的细胞器上。其他植物蛋白,如MDAR(拟南芥单脱氢抗坏血酸还原酶)和tRNA核苷酸转移酶[44,45]也被认为是针对不同的细胞器,因为不同的转录起始位点。因此,很容易推测,氯塑性在TSPO可以保护叶绿体免受盐胁迫损伤,保护线粒体在TSPO通常可以将叶绿体合成的卟啉导入线粒体。已经在哺乳动物中观察到TSPO亚细胞定位的改变。哺乳动物TSPO定位于线粒体外膜,但在快速细胞增殖过程中,如转移过程,它重新定位于核膜,这表明发育控制其亚细胞定位[46].
我们的结果提示存在叶绿体靶区在在盐胁迫下工作的TSPO。的n端结构在TSPO (在M2TSPO: eGFP和在M3TSPO:eGFP)不能成为该细胞器的目标。这些结果表明,前20个氨基酸在TSPO可能是该蛋白叶绿体靶向肽的一部分。需要进一步的实验来精确地描述这一叶绿体靶向决定因素。
TSPO在植物细胞中的定位是复杂的,涉及到盐胁迫时蛋白质从内质网和囊泡到叶绿体的重新定位。近年来,人们提出了几种蛋白质导入叶绿体的新机制。例如,有人假设叶绿体、线粒体和其他细胞器膜的包膜之间的密切接触可以允许蛋白质在它们之间运动[47].在线粒体和内质网之间已经观察到这种融合[48],其中提示囊泡相关膜蛋白1 (VAMP-1)可能参与了线粒体与靶膜的对接[49].反过来,这可以促进蛋白质从线粒体到其他隔室的重新定位。最近在植物中发现了密切的胞内膜接触,即叶绿体和内质网之间的接触[50],以及线粒体和细胞核之间的关系[51,证实了这一假设。目前尚不清楚在此过程中使用的是哪种途径在盐胁迫下TSPO的迁移。然而,我们的数据表明在TSPO在压力下改变其定位,也有可能是Frank之前观察到的线粒体亚型等.[22]专利中林登曼著等.[19在d . lanata而且拟南芥可以在拟南芥通过使用替代翻译开始密码子。
转录水平AtTSPO在野生型拟南芥植物对盐、甘露醇、ABA和百草枯的反应增加。启动子区在TSPO对盐胁迫转录应答也有充分作用。归纳AtTSPO当使用本构启动子(35S和UBI10)表达时,也观察到受盐胁迫的影响AtTSPO,提示归纳在TSPO在转录水平和转录后水平都有发生。
在TSPO过表达系应激反应基因水平降低(ERD10,DREB2A而且RAB18),而tspo-1突变体过度表达这些基因。这表明AtTSPO表达和/或功能对于这些基因在应激条件下的适当调节是必要的。这些结果也表明在TSPO在应激适应中起重要作用拟南芥,这一观点与p .金属盘[22].自RhodobacterTSPO是光合基因的负调控因子[17),有可能在TSPO在调节植物的胁迫反应基因方面也有类似的作用。
的精确函数在盐胁迫下四吡咯转运中的TSPO尚待确定。然而,有许多报告表明,四吡咯流动的改变可能与耐盐性有关。外源5-氨基乙酰丙酸(ALA)可提高高等植物的耐盐性[51- - - - - -56].也有研究表明转基因拟南芥过量产生ALA的烟草和水稻具有更好的耐盐性[57,58].Abdelkader等.[59]认为,高盐胁迫主要通过降低卟啉的形成速率来抑制叶绿素的积累等.[58]表明盐胁迫导致血红素含量显著降低。因此,在高等植物中,ALA和四吡咯的合成对盐胁迫很敏感。
另外,我们证明了在TSPO对四吡咯的通量和/或代谢很重要。除草剂诺氟拉松,一种非竞争性植物烯去饱和酶抑制剂,[31- - - - - -33]和神经毒素Gabaculine,它通过阻断谷氨酸-1-半醛转氨酶活性来抑制四吡咯的生物合成[29,30.]在本研究中使用,以减少通过四吡咯生物合成途径的通量。我们的数据显示,四吡咯生物合成基因的突变和这两种不同药物的应用降低了四吡咯中间体的通量AtTSPO表达式。所有测试的抑制ALA合成的突变都增加了AtTSPOmRNA稳态水平。在诺氟拉松和gabaculine抑制ALA的形成时,也观察到同样的结果。唯一的突变体测试下降AtTSPO表达式是crd1,其积累mg -原卟啉单甲基酯,这种积累不影响ALA合成的抑制[40].最后,有可能在TSPO可能参与植物细胞内不同四吡咯信号分子的分配。四吡咯代谢基因的几种光调控mrna的稳态水平在实验中被下调tspo-1变种人,这表明,在TSPO可以作为四吡咯生物合成的调节器,类似于它的细菌对应物[16].
结论
TSPO已被证明在多种生物中运输许多小分子,但其在植物中的功能尚不清楚。这里我们演示一下拟南芥TSPO在转录、转录后和翻译后水平上被调节,以应对非生物应激条件,如盐胁迫。我们的研究结果表明在TSPO可以定位于ER和线粒体,但当植物受到盐胁迫时AtTSPO存在于叶绿体中。我们的数据也表明,在正常情况下AtTSPO可能是重要的进口叶绿体合成血红素到线粒体。然而,针对AtTSPO盐胁迫对叶绿体的作用可以保护叶绿体免受损伤。此外,四吡咯中间体被认为在叶绿体到细胞核的逆行信号传导中起作用[35,60].有可能在TSPO可能参与植物细胞内不同四吡咯信号分子的分配,这取决于环境条件。在在盐胁迫或四吡咯代谢受损的条件下,TSPO可能在重定向四吡咯中间体方面发挥作用。我们的发现表明,四吡咯生物合成途径的突变或抑制增加了AtTSPO表达式。与此同时,在TSPO可能直接参与细胞质中高活性卟啉的解毒。我们目前正在调查这些可能性。
方法
植物材料和生长条件
拟南芥种子生态型Col-0表面消毒和镀上MS1/2介质(61]使用或不使用50 mM卡那霉素。幼苗在4℃条件下保持3天,然后在23℃条件下光照/暗循环16/8小时的生长室中生长。在标准条件下垂直生长10天的植物上进行根长测量。对于非生物胁迫处理,150 mM NaCl, 250 mM甘露醇,1 μM ABA (Sigma;在MS中加入0.2 μM百草枯1/2琼脂板,5天大的幼苗在正常生长条件下孵育。诺氟拉松和Gabaculine实验用MS镀种子1/2含1%或2%蔗糖,含或不含5 μM诺氟拉松(山德士制药公司;维也纳,奥地利)或50 μM的gabaculine (Sigma,美国)。所有实验均独立重复3次,计算平均值。
RNA提取和qRT-PCR分析
根据制造商说明书,使用Spectrum™植物总RNA试剂盒(Sigma #STRN250-1KT)分离总RNA。使用First Strand cDNA synthesis Kit (#K1611)将1微克总RNA添加到每个cDNA合成反应中。对于qRT-PCR,在SYBR存在下进行DNA扩增®MyIQ™单色实时PCR检测系统(BioRad)中的绿色qPCR检测(Invitrogen),使用表中的引物对1.循环使用:95℃,1 min 30 sec;40 ×(95℃,10秒;60℃,1分钟);95℃,1分钟;60℃,1分钟和81 ×(60℃,10秒)。相对mRNA水平由归一化的PCR阈值循环数来确定肌动蛋白而且18 s RNA.所有实验均独立重复3次,计算平均值。
TSPO敲除验证
的tspo-1T-DNA突变体SALK_135023从Salk标本中获得[24].采用基因特异性PCR引物进行PCR分型,分离纯合突变体在TSPO-LP和在TSPO-BP联合LBa1(表2).表型研究仅采用纯合子系。
AtTSPO GUS融合载体的构建及GUS检测
平动星位上游437 bp处AtTSPO基因(在2g47770)被平动融合成uidAGateway法转染pKGWFS7基因®(表达载体™)[62]并被引入拟南芥通过农杆菌属-介导转化[63].有关克隆引物和构造信息,请参见表2而且3.,分别。对于组织化学GUS表达,植物样品在GUS测定液(1 mm 5-溴-4-氯-3-吲哚基葡萄糖苷,0.5 mm K)中37°C浸泡16小时3.铁(CN)6, 0.5 mm K4铁(CN)6, 0.3% (v/v) Triton X-100, 20% (v/v)甲醇,50mm无机磷酸盐缓冲盐水)。该反应进一步在37°C的黑暗中进行,最长持续16小时。
AtTSPO融合蛋白的亚细胞定位
对于GFP融合结构,克隆包含的编码区域AtTSPO以及从甲硫氨酸21和42开始的融合产生并克隆到pK7FWG2 [62)(表3.)根据制造商的说明(Invitrogen, CA, USA)。所用引物为:在TSPO M1: TSPO NT1和TSPO CT1;在TSPO M2: TSPO NT2和TSPO CT1;在TSPO M3: TSPO NT3和TSPO CT1;在TSPO 80aa: TSPO NT1和TSPO CT80(表2).拟南芥在徕卡DM IRE2(徕卡微系统)共聚焦激光扫描显微镜下观察。对于线粒体特异性染色,拟南芥幼苗在MitoTracker中孵育®红色CMXRos (Invitrogen, #M7512)根据制造商的说明。GFP的激发波长和发射波长分别为488和505-530 nm (BP 505-530滤波器),MitoTracker的激发波长和发射波长分别为543和560-615 nm (BP 560-615滤波器)®分别。所有图像都在徕卡DM IRE2图像浏览器程序(徕卡微系统)上处理。
叶绿素含量的测定
发芽后10天的幼苗称重,冷冻在液氮中,并在80% (v/v)丙酮中研磨。研磨的组织在2000克离心5分钟,将任何不溶性物质制成颗粒。然后测定了提取的叶绿素在645和663 nm处的吸光度。叶绿素(a和b)含量根据Lichtenthaler方法测定[64].
叶绿体隔离
从平板生长中分离叶绿体拟南芥如前所述进行苗木[65].叶绿体的最后再悬浮在缓冲液(330 mM山梨醇,50 mM HEPES-KOH, pH 8.0)中,浓度为1 mg叶绿素ml-1.
免疫印迹
通过添加蛋白提取缓冲液(50 mM HEPES pH 7.9, 300 mM蔗糖,150 mM NaCl, 10 mM乙酸钾,罗氏蛋白酶抑制剂鸡尾酒,1% (w/v) Triton, 1 mM DTT)从10日龄幼苗中提取总蛋白。研磨后的组织在5000 × g下离心5分钟,使组织成粒,用Bradford法定量蛋白质[66].样品在250 mM Tris-HCl, pH 6.8, 10% (w/v) SDS, 30% (v/v)甘油,5% (v/v) β-巯基乙醇和0.02% (w/v)溴酚蓝中煮沸5min。SDS-PAGE采用标准程序进行。叶绿体蛋白样品被等量的总叶绿素归一化加载。SDS-PAGE之后,分离的蛋白质转移到聚偏二氟乙烯膜(Bio-Rad)。免疫检测时,用抗GFP (ROCHE, #11814460001)、UGPase (AGRISERA, #AS05086)、RuBisCo (AGRISERA, #AS03037)和D1(AGRISERA, #AS05084)的抗体孵育膜。除GFP检测采用小鼠二抗外,其余免疫反应蛋白均采用兔二抗检测。根据制造商说明,使用化学发光试剂盒(Thermo Scientific, #34076)检测免疫反应。
缩写
- 阿坝:
-
脱落酸
- 阿拉巴马州:
-
5-Aminolevulinate
- CFP:
-
青色荧光蛋白
- D1:
-
光系统II反应中心D1蛋白
- HMR:
-
与蛋白质
- 绿色荧光蛋白:
-
绿色荧光蛋白
- 格斯:
-
β葡萄糖醛酸酶
- Mg-Proto第九:
-
Mg-Protoporphyrin第九
- MV:
-
甲基紫罗碱
- ROS:
-
活性氧
- 二磷酸核酮糖羧化酶:
-
核酮糖1 5 5-biphosphate羧化酶,
- TSPO:
-
易位蛋白
- UGPase:
-
UDP-glucose焦磷酸化酶
- 鞋面:
-
囊泡相关膜蛋白
- YFP:
-
黄色荧光蛋白。
参考文献
- 1.
Beale SI:叶绿素生物合成酶。光子学报,1999,30(3):344 - 344。10.1023 /: 1006297731456。
- 2.
Papenbrock J,格林B:四吡咯生物合成的调控网络-参与质体代谢和发育控制的细胞内信号的研究。植物学报,2001,29(3):366 - 366。10.1007 / s004250100593。
- 3.
Vavilin DV, Vermaas WFJ:植物和蓝藻中导致血红素和叶绿素的四吡咯生物合成途径的调控。中国生物医学工程学报,2002,29(3):344 - 344。10.1034 / j.1399-3054.2002.1150102.x。
- 4.
Reinbothe S, Reinbothe C:参与叶绿素生物合成的酶的调节。中华生物化学杂志,1996,23(3):323- 329。10.1111 / j.1432-1033.1996.00323.x。
- 5.
格林B:高等植物四吡咯代谢控制的新见解。植物学报,1998,1:245-250。10.1016 / s1369 - 5266 (98) 80112 - x。
- 6.
Papadopoulos V, Boujrad N, Ikonomovic MD, Ferrara P, Vidic B: Leydig细胞线粒体外周型苯二氮卓受体的地学研究。中国生物医学工程学报,2004,27(4):344 - 344。10.1016 / 0303 - 7207(94) 90061 - 2。
- 7.
McEnery MW, Snowman AM, Trifiletti RR, Snyder SH:线粒体苯二氮卓受体的分离:与电压依赖性阴离子通道和腺嘌呤核苷酸载体的关系。美国国家科学研究院。1992, 89: 3170-3174。10.1073 / pnas.89.8.3170。
- 8.
Papadopoulos V, Baraldi M, Guilarte TR:易位蛋白(18 kDa):基于其结构和分子功能的外周型苯二氮卓受体的新命名。药理学进展,2006,27:402-409。10.1016 / j.tips.2006.06.005。
- 9.
Li H, Papadopoulos V:外周型苯二氮卓受体在胆固醇转运中的作用。一种假定的胆固醇识别/相互作用氨基酸序列和一致模式的鉴定。中华内分泌杂志,1998,29(4):497 - 497。10.1210 / en.139.12.4991。
- 10.
帕帕多普洛斯V型:类固醇细胞外周型苯二氮卓受体的结构和功能。中华生物医学杂志,1998,26(3):326 - 326。
- 11.
Lacapere JJ, Papadopoulos V:外周型苯二氮卓受体:类固醇和胆汁酸生物合成中胆固醇结合蛋白的结构和功能。中国生物医学工程学报,2003,29(4):569-585。10.1016 / s0039 - 128 x(03) 00101 - 6。
- 12.
O’hara MF, Craig RC, Nemeth KR, Charlap JH, Knudsen TB:线粒体苯二氮卓受体调节早期小鼠胚胎中的氧稳态。中国生物医学工程学报,2003,17:365-75。10.1016 / s0890 - 6238(03) 00035 - 2。
- 13.
李丽娟,李丽娟,李丽娟。外周苯二氮卓受体的免疫组化评价及其与乳腺癌生存的关系。临床癌症杂志,2004,10:2058-2064。10.1158 / 1078 - 0432. - ccr - 03 - 0988。
- 14.
Taketani S, Kohno H, Okuda M, Furukawa T, Tokunaga R:小鼠红白血病细胞分化过程中外周型苯二氮卓受体的诱导。这些受体可能参与血红素生物合成。中国生物医学工程学报,2004,26(4):527- 531。
- 15.
Yeliseev AA, Kaplan S:一种与哺乳动物外周型苯二氮卓受体同源的感觉传感器,可调节光合膜复合物的形成Rhodobacter sphaeroides2.4.1.中国生物医学工程学报,2004,27(4):457 - 457。10.1074 / jbc.270.36.21167。
- 16.
叶利泽耶夫AA,卡普兰S:植物TspO外膜蛋白调控光合作用基因表达的新机制Rhodobacter sphaeroides2.4.1.中国生物医学工程学报,1999,29(4):344 - 344。10.1074 / jbc.274.30.21234。
- 17.
Yeliseev AA, Krueger KE, Kaplan S:哺乳动物线粒体药物受体作为细菌“氧气”传感器的功能。美国国家科学研究院。1997, 94: 551 -6。10.1073 / pnas.94.10.5101。
- 18.
林德曼P,科赫A,德根哈特B,豪斯G,格林B,帕帕佐普洛斯V:一部小说拟南芥蛋白质是一种功能性外周型苯二氮卓类受体。植物生理学报,2004,45:723-733。10.1093 /卡式肺囊虫肺炎/ pch088。
- 19.
Vanhee C, Guillon S, Masquelier D, Degand H, Deleu M, Morsomme P, Batoko H:一种tspo相关蛋白定位于早期分泌通路拟南芥,但在酵母中表达时针对线粒体。实验植物学报,2010,16:1-12。
- 20.
Corsi L, Avallone R, Geminiani E, Cosenza F, Venturini I, Baraldia M:马铃薯外周苯二氮卓受体(茄属植物tuberosum).生物化学与物理学报,2004,27(3):344 - 344。10.1016 / j.bbrc.2003.11.089。
- 21.
Frank W, Baar K-M, Qudeimat E, Woriedh M, Alawady A, Ratnadewi D, Gremillon L, Grimm B, Reski R:一种与哺乳动物外周型苯二氮卓受体同源的线粒体蛋白在植物逆境适应中至关重要。植物学报,2007,31(4):344 - 344。10.1111 / j.1365 - 313 x.2007.03198.x。
- 22.
Guillaumot, Guillon S, Deplanque T, Vanhee C, Gumy C, Masquelier D, Morsomme P, Batoko H: The拟南芥tspo相关蛋白是一种应激和脱落酸调节的内质网高尔基定位膜蛋白。植物学报,2009,30(4):344 - 344。10.1111 / j.1365 - 313 x.2009.03950.x。
- 23.
王晓霞,张海生,朱涛,王晓峰,王晓峰,王晓峰:转录组的变化拟南芥对盐、渗透和冷胁迫的反应。植物科学学报,2002,29(4):344 - 344。10.1104 / pp.008532。
- 24.
Alonso JM, Stepanova AN, Leisse TJ, Kim CJ, Chen H, Shinn P, Stevenson DK, Zimmerman J, Barajas P, Cheuk R, Gadrinab C, Heller C, Jeske A, Koesema E, Meyers CC, Parker H, Prednis L, Ansari Y, Choy N, Deen H, Geralt M, Hazari N, Hom E, Karnes M, Mulholland C, Ndubaku R, Schmidt I, Guzman P, Aguilar-Henonin L, Schmid M,等拟南芥.科学通报,2003,30(3):344 - 344。10.1126 / science.1086391。
- 25.
柴明峰,魏培才,陈庆杰,芮安,程军,杨松,王晓春:NADK3是氧化应激条件下NADPH的一个新的细胞质来源,它调控了植物的脱落酸反应拟南芥.植物学报,2006,47:665-674。10.1111 / j.1365 - 313 x.2006.02816.x。
- 26.
Verma A, Nye JS, Snyder SH:卟啉是线粒体(外周型)苯二氮卓受体的内源性配体。美国国家科学研究院。1987, 84: 2256-2260。10.1073 / pnas.84.8.2256。
- 27.
望月N,布鲁斯兰JA,拉金R,长谷A,乔里J:拟南芥基因组解耦5 (GUN5)突变揭示mg -螯合酶H亚基参与了质体到核信号转导。美国国家科学研究院。2001, 29(3): 344 - 344。10.1073 / pnas.98.4.2053。
- 28.
Stephenson PG, Terry MJ:叶绿素合成过程中mg -螯合酶分支点的光信号通路拟南芥.光化学与生物学报,2008,10:1243-52。
- 29.
刘志刚,刘志刚,刘志刚,刘志刚:植物叶绿素合成的抑制作用大麦芽由3-氨基-2,3-二氢苯甲酸(gabaculine)。生物科学学报,1985,5:775-81。10.1007 / BF01119876。
- 30.
格林B,史密斯AJ, Kannangara CG,史密斯M:聚球菌耐gabaculine半醛氨基转移酶。中华生物医学杂志,1998,26(3):344 - 344。
- 31.
Mayfield SP, Taylor WC:缺乏类胡萝卜素的玉米幼苗不能积累光收获叶绿素a/b结合蛋白(LHCP) mRNA。中国生物医学工程学报,2004,29(4):344 - 344。10.1111 / j.1432-1033.1984.tb08433.x。
- 32.
Oelmüller R, Mohr H:叶绿体的光氧化破坏及其对核基因表达的影响。植物学报,2004,27(3):366 - 366。10.1007 / BF00446376。
- 33.
核和质体基因组之间的调控相互作用。植物化学学报,2004,29(4):357 - 357。10.1146 / annurev.pp.40.060189.001235。
- 34.
李志强,李志强,李志强,等拟南芥将核CAB和RBCS基因表达与叶绿体发育分离。细胞学报,1993,74:787-99。10.1016 / 0092 - 8674(93) 90459 - 4。
- 35.
Larkin RM, Alonso JM, Ecker JR, Chory J: GUN4,叶绿素合成和细胞内信号通路的调节因子。科学通报,2003,29(4):529 - 529。10.1126 / science.1079978。
- 36.
周KS,辛格DP,沃克AR,史密斯AG:两种不同的基因编码铁螯合酶拟南芥:前体蛋白的定位、表达和亚细胞靶向。植物学报,1998,15:531- 531。10.1046 / j.1365 - 313 x.1998.00235.x。
- 37.
库马尔AM, Söll D:反义HEMA1 RNA表达抑制血红素和叶绿素的生物合成拟南芥.中国农业科学,2002,22(4):457 - 457。10.1104 / pp.122.1.49。
- 38.
石川A,冈本H,岩崎Y,朝日T: coproporphyrinogen III氧化酶缺乏导致病变形成拟南芥.植物学报,2001,27:89-99。10.1046 / j.1365 - 313 x.2001.01058.x。
- 39.
托蒂S,布洛克MA,艾伦M,韦斯特格伦T,阿尔布里厄C,谢勒HV, Merchant S,延森PE:拟南芥CHL27位于包膜和类囊体膜上,是原叶绿素合成所必需的。美国国家科学研究院。2003, 30(4): 344 - 344。10.1073 / pnas.2136793100。
- 40.
王志刚,王志刚,王志刚,王志刚,王志刚。不同光照条件下镁-原卟啉单甲基化酶缺乏症对四吡啶代谢的影响。植物营养学报,2010,29(4):344 - 344。10.1093 /卡式肺囊虫肺炎/ pcq071。
- 41.
PH:基于泛素启动子的单子叶植物可选择性和/或可筛选标记基因的高水平表达载体。转基因研究,1996,5:213-8。10.1007 / BF01969712。
- 42.
陈明,Galvão RM,李明,Burger B, Buger J, Bolado J, Chory J:拟南芥HEMERA/pTAC12通过光敏色素启动光形态建成。电子学报,2010,34(4):344 - 344。10.1016 / j.cell.2010.05.007。
- 43.
Obara K, Sumi K, Fukuda H:拟南芥单脱氢抗坏血酸还原酶对线粒体和叶绿体的双重靶向作用。植物生理学报,2002,43(7):697-705。10.1093 /卡式肺囊虫肺炎/ pcf103。
- 44.
冯·布劳恩·SS,萨贝提·A,汉尼克·乔伊斯·PJ,顾j, Schleiff E, Joyce PBM:植物tRNA核苷酸转移酶的双靶向性:不仅仅是信号。实验植物学杂志,2007,58(5/16):4083-4093。
- 45.
Hardwick M, Fertikh D, Culty M, Li H, Vidic B, Papadopoulos V:人乳腺癌中的外周型苯二氮卓受体(PBR):乳腺癌细胞侵袭性表型与PBR表达、核定位、PBR介导的细胞增殖和胆固醇核转运的相关性中华癌症杂志,1999,29(4):344 - 344。
- 46.
Krause K, Krupinska K:在细胞器中有第二个家的核调节器。植物科学进展,2009,14:194-199。10.1016 / j.tplants.2009.01.005。
- 47.
Soltys BJ, Gupta RS:线粒体基质蛋白在意想不到的位置:它们是输出的吗?生物化学,1999,24:174-177。10.1016 / s0968 - 0004(99) 01390 - 0。
- 48.
Isenmann S, Khew-Goodall Y, Gamble J, Vadas M, Wattenberg BW:一种含有线粒体靶向信号的囊泡相关膜蛋白-1剪接异型。分子生物学杂志,1998,9:1649-1660。
- 49.
Andersson MX, Goksör M, Sandelius AS:光学操作揭示了内质网和叶绿体之间膜接触部位的强大吸引力。中国生物医学工程学报,2007,28(3):344 - 344。
- 50.
Segui-Simarro JM, Coronado MJ, Staehelin LA:拟南芥茎尖分生组织和叶片原基分生组织细胞的线粒体周期由核周触手状/笼状线粒体定义。中国生物医学工程学报,2008,29(3):344 - 344。10.1104 / pp.108.126953。
- 51.
渡边K,田中T, Hotta Y, Kuramochi H, Takeuchi Y: 5-氨基乙酰丙酸提高棉花幼苗耐盐性。植物生长学报,2000,32:99-103。
- 52.
Nishihara H, Kizaka-Kondoh S, Insel PA, Eckmann L: cAMP通过诱导凋亡抑制蛋白(IAP)-2抑制正常和转化肠上皮细胞凋亡。美国国家科学研究院。2003, 21(3): 344 - 344。
- 53.
Watanabe K, Ryoji O, Rasid MM, Suliman A, Tohru T, Hitoshi K, Yasutomo T: 5-氨基乙酰丙酸对沙特阿拉伯棉花、番茄和小麦幼苗盐损伤恢复的影响。干旱区研究,2004,14:105-113。
- 54.
王丽娟,姜文彬,刘华,刘文琴,康玲,侯晓玲:5-氨基乙酰丙酸对小白菜萌发的促进作用。盐胁迫下的种子。中国生物工程学报,2005,9:1084-91。
- 55.
Watanabe K, Ryoji O, Rasid MM, Suliman A, Tohru T, Hitoshi K, Zhang ZJ, Li HZ,周文杰,Takeuchi Y, Yoneyama K: 5-氨基乙酰丙酸对马铃薯发育和耐盐性的影响(茄.)离体微块茎。植物生长学报,2006,49:27-34。
- 56.
黄志强,李志强,李志强:枣椰树幼苗光合气体交换机制研究(凤凰树在盐度胁迫下,5-氨基乙酰丙酸基肥料处理。)植物生长学报,2008,27:1-9。10.1007 / s00344 - 007 - 9025 - 4。
- 57.
郑世峰,杨凯,李国国,苏春:转基因水稻光动力损伤的防御反应。光合作用,2008,46:3-9。10.1007 / s11099 - 008 - 0002 - 3。
- 58.
张志平,姚庆华,王丽娟:酵母Hem1基因的表达拟南芥HemA1启动子提高植物的耐盐性拟南芥植物。BMB报告。2010年,330 - 336。
- 59.
杨晓明,杨晓明,孙德奎斯特C:高盐胁迫对小麦叶片叶绿素积累的影响是由于原叶绿素的生成速率有限。中国生物医学工程学报,2007,29(3):357 - 357。10.1111 / j.1399-3054.2007.00885.x。
- 60.
链A, Asami T, Alonso J, Ecker JR, Chory J: Mg-protoporphyrinIX积累引发叶绿体到核的通讯。自然科学学报,2003,29(3):344 - 344。10.1038 / nature01204。
- 61.
Murashige T, Skoog F:烟草组织培养快速生长和生物测定的修订培养基。中国生物医学工程学报,2004,27(3):344 - 344。10.1111 / j.1399-3054.1962.tb08052.x。
- 62.
Karime M, Inzé D, Depicker A: GATEWAY™载体农杆菌属介导植物转化。植物科学进展,2002,5:193-5。
- 63.
克拉夫SJ,弯曲AF:花浸:一个简化的方法农杆菌属-介导转化拟南芥.植物学报,1998,26(3):344 - 344。10.1046 / j.1365 - 313 x.1998.00343.x。
- 64.
叶绿素和类胡萝卜素:光合生物膜的色素。方法生物化学学报,1987,48(3):349-382。
- 65.
菲茨帕特里克LM, Keegstra K:一种分离高产量的方法拟南芥能够有效导入前体蛋白的叶绿体。植物学报,2001,27:59-65。10.1046 / j.0960-7412.2001.01061.x。
- 66.
Bradford MM:一种快速和灵敏的方法定量微量蛋白质利用蛋白质-染料结合的原理。生物化学学报,2003,27(3):344 - 344。10.1016 / 0003 - 2697(76) 90527 - 3。
确认
我们感谢Jesse Woodson, Juan M. Perez-Ruiz, Ana Lucia Giannini, Amanda Mangeon和Marcio Castro Silva-Filho对手稿提供了重要的反馈。索尔克研究所提供了插入突变系和ABRC,以提供材料。来自Rede de Plataformas Tecnológicas da Fundação Instituto Oswaldo Cruz (FioCruz)的Pedro Paulo de Abreu Manso和Bernardo Miguel de Oliveira Pascarelli为共聚焦显微镜分析提供技术支持。Luiza da Silva为工厂改造提供技术支持。EBP得到了CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior)的博士奖学金和CNPq (Conselho Nacional de Desenvolvimento Científico e Tecnológico)、索尔克研究所和Balcoffee Trading Intermediações Ltda的SWE奖学金的支持。YJ由欧洲分子生物学组织(EMBO)和马克和伊娃·斯特恩基金会长期资助。BJSCO由美国国立卫生研究院和美国国家综合医学科学研究所F32GM086037基金资助。JGU由美国癌症协会资助RSG-05-196-01-CCG。这项工作得到了美国能源部向JC提供的能源部能源部FG02-04ER15540的资助,国家环境保护委员会Científico e Tecnológico (CNPq)和Fundação卡洛斯·查加斯·菲尔奥·德·安帕罗à里约热内卢国家公园里约热内卢(FAPERJ)向GSM提供的资助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
EBP、JC和GSM构思并设计了实验。EBP完成了所有的实验,分析了数据并撰写了论文。YJ帮助共聚焦显微镜分析。BJSCO参与了分馏实验。上帝抵抗军和JGU提供了技术支持。JC和GSM是项目督导,参与了从项目开始所有实验的讨论和稿件的准备。所有作者都阅读并批准了最终的手稿。
电子辅助材料
显示本研究中分析基因的植物四吡咯生物合成途径示意图
附加文件1:。蓝色部分是已经描述过的基因。与这些基因名称和AGI代码相对应的酶是:在1 g58290);谷氨酰胺- trna还原酶2在1 g09940);谷氨酰胺- trna还原酶3在2 g31250);ALA合成调节剂在3 g14110);LIN2(协比卟啉原氧化酶1,在1 g03475);血红素加氧酶1,在2 g26670);光敏变色素合成酶在3 g09150);GUN4 (mg -卟啉合成调节剂,在3 g59400);GUN5 (mg -螯合酶亚单位H,在5 g13630);mg -螯合酶亚单位I,在4 g18480和在5 g45930);CHLD (mg -螯合酶亚基D,在1 g08520);原卟啉IX甲基转移酶在4 g25080);CRD1 (mg -原卟啉IX单甲基化酶在3 g56940);铁螯合酶1在5 g26030);铁螯合酶2在2 g30390)。(pdf 535kb)
不同生物TSPO序列的比对
附加文件2:。TSPO蛋白的ClustalW序列比对Rhodobacter sphaeroides(AF195122.1),鼠形(J05122)和拟南芥TSPO (在TSPO -在2 g47770)。左边的数字表示来自初级蛋白质的氨基酸位置。在一致线中,保守的氨基酸被高亮显示为(*),当观察到一个保存位置时为(.)。M1, M21和M42在突出显示TSPO异构体。黑色箭头代表前80种氨基酸(在TSPO80aa)拟南芥TSPO。(pdf 862 kb)
M42TSPO:eGFP与有丝分裂器共定位
附加文件3:在M42TSPO:eGFP与有丝分裂器共定位拟南芥.在M42TSPO:eGFP 5日龄转基因株系(A-C)用有丝分裂记录仪孵育,鉴定线粒体。(A)来自GFP通道的图像显示为绿色。(B)来自核分裂跟踪器通道的图像以红色显示。(C)绿色荧光蛋白和有丝分裂器通道合并,显示为黄色。比例尺= 50 μM。(pdf 528kb)
免疫印迹显示
附加文件4:在TSPO:eGFP在盐胁迫中积累.牛三种亚型蛋白水平的免疫印迹分析在盐胁迫下的TSPO:eGFP (OxM1TSPO:eGFP, OxM21TSPO:eGFP和OxM42TSPO:eGFP)显示了蛋白的积累。以野生型植物和过表达绿色荧光蛋白(OxeGFP)的植物为对照。以抗ugpase和红-ponceau染色作为加载对照。等量的总蛋白质。(pdf 924kb)
OxTSPO:eGFP植物叶绿体的免疫印迹
附加文件5:。拟南芥用GFP、RuBisCo、D1和UGPase抗体进行免疫印迹,用未处理或150 mM NaCl处理的10 d幼苗制备叶绿体。在每个通道中加载等量的OxM1TSPO:eGFP叶绿体蛋白样本。(TP)总蛋白;Chl:叶绿体蛋白;PP(蛋白酶保护处理)。(pdf 1004kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
Balsemão-Pires, E.,杰伊拉斯,Y.,奥尔森,B.J.et al。的拟南芥转位蛋白(在TSPO)在盐胁迫和四吡啶代谢扰动下在多个水平上受到调控。BMC植物生物学11日,108(2011)。https://doi.org/10.1186/1471-2229-11-108
收到了:
接受:
发表:
关键字
- 植物TSPO
- 亚细胞定位
- 非生物胁迫
- 监管
- 叶绿体