抽象的
背景
通过一些常染色体基因的基因组印记对基因剂量进行表观遗传调节,促进哺乳动物和开花植物的正常生殖发育。虽然许多印记基因已经在哺乳动物中被鉴定和深入研究,但开花植物中的印记基因数量较少,主要是在哺乳动物中拟南芥.通过对开花植物种子组织中亲本特异性单亲本表达的全基因组筛选,鉴定开花植物中额外的印迹位点,将有助于我们了解开花植物中印迹基因的来源和功能。
结果
的cDNA-AFLP可以检测特定等位基因的表达,依赖于其中限制性位点的多态性在从每个等位基因来源的转录物存在表达的基因起源父的-。使用全基因组的cDNA-AFLP屏幕测量的4500转录物衍生的片段的等位基因特异性表达,我们报告的52倍母体表达的基因(的MEG)显示在含有F1杂交种子拟南芥长角果母体的原产依赖性表达模式的标识(授粉后3,4和5天)。我们通过开发一个生物信息学工具(GenFrag),其可直接确定选自(i)它们的大小和转录物衍生的片段的身份鉴定这些的MEG(ⅱ),其选择性核苷酸加入到用于生成它们的引物。因此,便于GenFrag增加的吞吐量为全基因组的cDNA-AFLP片段的分析。我们确定了52级的MEG被进一步过滤以相对于种皮的胚乳中高表达水平,以确定候选基因最有可能代表的胚乳表达的新印记基因拟南芥.三个排名靠前的候选基因在种子组织中的表达,ATCDC48,PDE120和MS5样,利用激光捕获显微切割和定量RT-PCR分析证实。这些基因在特定的母体表达拟南芥通过在一系列不同的附加过程中通过等位基因特异性转录分析证实F1种子。鉴定差异甲基化区域邻近ATCDC48和PDE120,可能代表候选印迹控制区域。最后,我们证明了这三个基因在营养组织中的表达水平MET1-依赖,而它们在种子中的单亲本母性表达不依赖MET1.
结论
利用cDNA-AFLP转录组分析方法,我们鉴定了三个基因,ATCDC48,PDE120和MS5样哪一个代表了新母系表达的印迹基因拟南芥种子。我们对母系表达的印迹基因的cDNA-AFLP筛选与其他印迹基因和胚乳表达基因的筛选之间的重叠程度进行了讨论。
背景
开花植物(被子植物)的种子是含有组织的单元拥有从母本和父本[不等基因组的贡献的嵌合结构1- - - - - -3.].在拟南芥种子,即二倍体胚胎,是由含有核基因组的细胞组成的,这些细胞核基因组同样地从母体和父系遗传而来。相反,三倍体胚乳包含两个母系遗传的核基因组和一个父系基因组。此外,这两种受精产物被一种由母体衍生的二倍体种皮所包围[4].三倍体胚乳是一种终端差异化的结构,滋养发展胚胎,而二倍体孕产妇种子涂层在支持种子的发展和胚胎中发挥关键作用[5].在植物种子发育过程中,这些不同组织和基因组之间的相互作用仍然知之甚少[6,7尽管被子植物种子在经济上具有基础性的重要性。对于任何给定的基因,很难确定每个种子组织对种子整体转录水平的相对和绝对贡献。
雄性和雌性基因组对嵌合种子贡献不均等的一个重要后果是,种子的发育可能受到基因组量和亲本效应的影响[6,8,9].这种母体作用包括来自母猪衍生的种子涂层和源自雌性配子的植物母体效果的孢子化母体效应。杂草类母体对种子发育的影响可以到期(a)胚乳中的一般剂量效应;(b)沉积在卵和中央细胞中施肥之前表达的母体转录物,分别产生胚胎和胚乳;(c)通过基因组印记对基因的表观遗传调节,由此常染色体基因以母体特异性的方式分娩治疗后施用后施用后[9,10].
基因组印记主要在哺乳动物和开花植物中被描述,它们发生在营养组织(胚乳、胎盘)和发育中的胚胎中,尽管后者在植物中很少见[11]. 虽然有许多关于哺乳动物和植物基因组印记进化的理论,但一些理论关注的是由于资源分配上的“父母冲突”而产生的印记[12,13或由于在早期发育过程中有必要限制关键基因的基因剂量[14,15].
许多印迹基因(即几百个,通常沿着染色体排列在基因簇)已被确定并在哺乳动物物种[深入研究16].直到最近(2010年),所有开花植物种类只报告了18个印记基因,其中11种拟南芥(附加文件1表S1)。已通过一系列不同的策略鉴定了印迹基因,包括:母控种子流产的突变筛选(拟南芥MEA和FIS2.[17]);由FIS调节基因的屏幕Polycomb.基复合物(拟南芥PHE1[18]);微阵列分析搜索显示与已知印迹基因相似响应的基因(拟南芥[19]);胚乳mRNA图谱(玉米)nrp1[20.]),并且通过微阵列谱的组合,并且从往复交叉自交系胚乳等位基因特异性表达分析(8个玉米基因[21.])。使用cdka; 1贫化种子缺乏对(未受精)中央细胞的父子基因组贡献,Shirzadi等(2011)使用微阵列分析来识别AGL36作为之中的600个基因的母系表达印记基因在没有父本基因组的差异调节的[22.].下一代基于测序的转录组织的出现促进了最近识别额外的印记基因候选者拟南芥种子[23.,24.].谢等人(2011)[24.]在授粉后7-8天的F1杂交种子中鉴定出43个已确认的印迹基因(9个父系表达,34个母系表达)呃-0 × col0互交。再次使用下一代测序方法,Wolff等人(2011)[23.]已经确定在F1杂交种子65个候选印迹基因(授粉后4天)距离Bur-0×Col-0中正反交其中19种被证实在两个交叉的方向(8父本表达,和11母系表达)。因此,现在正在使用的“下一代”测序研究,以鉴定推定的印记基因[23.,24.].
在识别差异甲基化区(DMR)作为候选印迹控制区(ICR)的基础上,建立了一种识别新印迹基因的间接方法[25.].在植物中也发现了作为基因组印记修饰剂的基因,包括MET1[26.],DDM1[17),DME.[27.].例如5-甲基胞嘧啶DNA糖基化酶基因DME.在雌配子体中央细胞中优先表达,并可通过icr的去甲基化调控胚乳中某些印迹基因的表达[27.].在突变体中二甲醚胚乳ICRs仍然甲基化,因此一些印迹基因被错误调控,这有助于它们的检测[27.].
虽然存在许多可用于鉴定特异性表达的基因组型分析方法,但对于新型印迹基因的定义存在几个重大挑战[28.].为了区分亲本依赖(如印迹)或独立的等位基因特异性表达效应,有必要通过分析交互的F1杂交后代来证明印迹位点单亲本表达的亲本依赖。此外,在植物种子中检测到母系特异性表达时,有必要区分种皮相对胚乳(和/或胚胎)的表达,以及区分母性沉积在卵子和/或中心细胞中的转录本相对发育中胚乳和/或胚胎受精后产生的转录本[11].而印记基因显示清晰突变表型(例如美狄亚)对种子发育的研究,有助解释印上的基因座[10],迄今鉴定的许多印记基因不显示种子中任何明显的突变表型[29.].在某些情况下,推动者:记者构建已经用于识别CIS.-印迹所需的调控区域[19,30.],而只有一项研究表明受精后新生单亲德诺维胚乳中印迹基因的转录[17].
转录谱分析平台的选择是新型印迹基因鉴定的重要考虑因素。微阵列依赖于基因表达水平足以通过杂交检测,互补策略也需要检测可能低表达的印迹基因。因此,在本研究中我们选择了cDNA-AFLP [31.用于全基因组筛选新的印迹基因。虽然是早期一代的转录本分析技术,但作为一种基于pcr的技术,cDNA-AFLP可以扩增甚至是低表达的转录本,并且可以在所有亲本等位基因之间存在限制性位点多态性的情况下鉴定单亲本表达的转录本。为了便于全基因组cDNA-AFLP表达谱分析,我们开发了基因识别生物信息学软件GenFrag,它可以确定显示亲本特异性cDNA-AFLP表达谱的基因的身份。
通过对4500个转录衍生片段(TDFs)的等位基因特异性表达分析,我们发现了52个表现母系特异性表达(MEGs)的基因。其中一些meg的母系特异性表达可能是由于基因组印记。在这52个母系表达基因中,有18个基因在胚乳中相对和绝对表达量高于母系种皮。因此,在授粉后4天(dap)的F1杂种种子中检测到这些基因的母系特异性表达,与发育中的胚乳中受基因组印记影响的基因是一致的。这18个甲基中有4个在野生型和野生型的种子胚乳中具有近端差异甲基化区域(DMRs)二甲醚可能代表候选印迹控制元素(ICRs)的突变背景。排名最高的三名候选人(ATCDC48,PDE120和MS5样)我们证实在F1杂交种子母系专一表达4 DAP和不同发育阶段表征它们的等位基因特异性表达的控制,并且在不同的遗传和突变型背景。总体而言,我们已经确定了一系列新的MEG的拟南芥种子中,我们进一步证明了三种新的母系表达的印迹基因拟南芥种子。
结果
cDNA-AFLP表达谱分析拟南芥含有F1杂交种子的单片机检测分娩93个单一表达的TDFS
鉴定F1杂种种子中单亲本表达的基因拟南芥我们采用了全基因组的cDNA-AFLP分析转录的做法。在图3,4和5 DAP,从含有通过种质的Col-0和Ler的-0之间正反交的F1产生杂种种子的长角果中产生的RNA样品。这三个阶段对应于从晚期球形(3 DAP)的种子中的胚胎发育的早期和晚期阶段心脏(4和5 DAP)发育阶段。胚胎发育的这些阶段被选择以减轻检测卵细胞和/或中央细胞中母系沉积长寿命的RNA的可能性,并且还因为从两个亲本等位基因的合子的表达在这些发育阶段是显而易见的[32.].在这些样品中,可以从二氧化硅或F1种子组织中检测母体表达基因,以及来自母体种子涂层或施肥产物的F1种子内(即胚胎和/或胚乳)。
AFLP是在用一种经常切割的酶进行限制性消化后,对来自RNA样品的cDNA进行的(BstYI)和稀有切割酶(MSEI)(附加文件2图S1)。片段被连接到与酶的限制位点互补的适配器。为了降低片段混合的复杂性,我们利用选择性引物进行了一系列PCR扩增,生成片段亚群。这些选择性引物有一个共同的序列,对应于适配器和一段限制位点,但在3'端被一个或两个额外的核苷酸区分,称为选择性核苷酸(方法;附加文件2图S1)。
将cDNA-AFLP产生转录物的片段(TDF的)的上运行ABI3130XL毛细管分析器和可视化用荧光标记的探针,以准确地估计它们的大小(参见方法)。总共10200个TDF的横跨三个时间点(3,4,5 DAP)进行检测。TDFS的尺寸范围从50到500个碱基对(bp)和80个碱基对的平均每样品可视化。的10200个TDF筛选,4500显示的cDNA之间的多态性来自两个不同种质(遗传背景)与大小从100bp的至500bp之间的正反交的。在大约相等数目被发现母系表达的等位基因时所述两个种质的在正反交用作母本(附加文件3.表S2)。例如,在4- DAP时间点,366母系表达在Col-0中×LER-0交叉检测Col-0中的等位基因,而在往复LER-0中检测到306母系表达LER-0等位基因×COL-0交叉。母系表达TDF的数早期发现角果发育过程中跨越了具体说明产妇转录的一致性三个发展阶段相似。对于每一个多态性等位基因(即Col-0中VS LER-0等位基因在一个限制性位点不同)中,只有一个片段是从每个限制酶切消化事件检测的,因为只有那些TDF的邻近所述多聚A尾巴分离进行分析。因此,对于每两个种质的存在在每个时间点上检测到TDF的次数内没有冗余。
To identify uniparentally expressed genes, cDNA-AFLP profiles for these 4500 polymorphic TDFs were compared between those obtained from siliques containing reciprocal F1 hybrid seeds (i.e. F1 progeny of Ler-0 × Col-0 versus Col-0 × Ler-0 crosses) and those obtained from the equivalent cross between plants of the same accession (i.e. Col-0 × Col-0, Ler-0 × Ler-0). The samples at 3, 4 and 5 dap were used to filter for TDFs which displayed uniparental expression for at least two of the stages sampled. This strategy allowed the identification of 93 uniparentally expressed TDFs. All 93 of the uniparentally expressed TDFs displayed a maternal-specific expression pattern (Additional file4表S3)。
基于TDF大小的基因和使用生物信息学GenFrag程序中的每个引物组合的选择性核苷酸的直接识别
为了鉴定产生在检测到的母体TDF的基因拟南芥含有F1混合种子的单片机(附加文件4表S3),我们开发了一个名为Genfrag的生物信息学程序。Genfrag旨在允许生物信息学利用公开的cDNA和EST文库(用于注释良好的文库)鉴定cDNA- aflp产生的TDFs序列拟南芥基因组还包括所有策划的可变剪接变体[33.])。利用这些资源,GenFrag被设计用来模拟cDNA-AFLP的步骤生物信息学通过扫描现有拟南芥双酶切位点的基因组信息(见方法和附加文件)2图S1)。根据片段大小(通过毛细管测序仪评估)和用于生成TDF的引物所添加的选择性核苷酸,GenFrag可以识别TDF的相应序列,从而确定与TDF相对应的基因。GenFrag软件是作为开源软件开发的,可在网上免费使用:http://www.nem.wur.nl/UK/Research/bio/.
从93个母系表达的TDFs中鉴定出52个基因
Genfrag用于识别对应于93个母体特定TDFS的基因(附加文件4表S3).为了增加选择性,我们在GenFrag中加入了一个选项,只返回5'-3'序列中最后匹配的片段,即最接近mRNA poly-A尾部的片段。我们将这种适应性与毛细管分析仪运行时TDF的观测尺寸与预测尺寸之间的1 bp偏差相结合生物信息学用于候选序列。利用这些条件,GenFrag能够确定93个母系表达TDFs中的52个的唯一序列(即基因ID)匹配(即附加文件中的TDFs 1-52)4表S3)。在剩余的TDFs中,21个匹配序列由多个基因共享,因此无法唯一区分(附加文件中的TDFs 53-73)4表S3),而剩余的20不能与使用GENFRAG方法的任何基因匹配(TDFS 74-93在附加文件中4表S3)。缺乏鉴定这20个TDF可能是由于异常酶限制和/或不完全覆盖拟南芥转录组。将52个TDFs独特序列通过BLAST搜索与基因匹配拟南芥基因组(TAIR v.8)。这使我们能够明确地识别52个母系表达基因拟南芥含有F1杂交种子的单片机(表1).52个母体表达基因的基因本体浓缩分析没有揭示任何显着的富集术语(未显示数据)。我们的52个Megs套没有包括已知的印记基因拟南芥,然而,这并不奇怪,因为这52个meg中的大多数在不同的遗传来源的等位基因之间有很少的SNP差异,即使它们有,SNP也不会破坏使用这些限制性内切酶的cDNA-AFLP技术扫描到的限制性内切位点(附加文件)5表S4)。例如,不存在的Col-0 / LER-0的SNP在母系表达印记基因的编码序列美狄亚. 我们鉴定的52个基因代表了新的母系表达基因(MEG)。
在18个候选印迹基因中,观察到的母质表达主要来自胚乳中相对于母质种皮较高的转录水平
在含有互惠F1杂交种子的西力克中检测到52个母系表达基因(MEG),其中母系特异性表达可来自西力克、母系种皮、胚乳和/或胚胎。种子表达基因主要在3个dap(晚球形期胚胎)的胚乳中母源表达,是通过基因组印记进行调控的极好候选基因。最近的研究表明,直到球状阶段的胚胎发育并不依赖于德诺维转录,而胚乳发育需要在受精后有活跃的转录,表明母体沉积的RNA不会在胚乳中发挥主要作用[34.]. 因此,在胚乳中检测到的mRNA≥ 3 dap最有可能来源于德诺维转录post-fertilization。为了确定52个母系表达基因中哪些主要在胚乳中高表达,我们使用了一个公开的表达数据集(Seed Gene Network - Harada-Goldberg Arabidopsis Laser Capture Microdissection Gene Chip Data Set,http://seedgenenetwork.net;[35.]),其中在种皮和种子的胚乳组织(外周血,合点和珠孔馏分)在胚胎发育(3 DAP)的球形期的基因的相对表达水平进行了评估。
从52个母性表达基因中,我们鉴定出32个基因在3dap种子中表达强烈。11个基因没有被检测到,因为它们在使用的阵列数据集中没有探针,或者它们的探针与另一个基因匹配。9个基因在种子中没有表达,因此可能是siilique特异性meg的良好候选基因。通过比较胚乳和种皮的表达水平,我们发现有3个MEGs只在种皮中表达,而没有在种皮中缺失但在胚乳中表达的MEGs。在胚乳和种皮中均有29个meg表达。我们认为,如果能在胚乳信号表达量主要来自胚乳的种子中发现母系特异性表达的meg基因,那么这一模式将强有力地表明母系在胚乳中表达了印迹基因。在这种情况下,胚乳中的双等位基因表达也应该更容易检测。因此,对于这29个megg,我们旨在鉴定在种子中检测到的大多数表达来自胚乳部分的基因。我们从29个基因中筛选出18个在胚乳中表达量高于种皮的基因,并根据表达量最高的胚乳部分与种皮表达量的绝对差异对这些基因进行排序(表1)2). 我们推断,在3个dap种子的胚乳中表现出最高表达水平的基因最不可能是由于母体在中央细胞中沉积转录物而检测到母体特异性转录物的基因[34.或如最近所提出的,由母体种皮转移而来[24.即,我们主要关注相对于母体种皮在胚乳中高度表达的基因。作为一种互补的方法,我们还在相对转录水平的基础上对这些基因进行了比较(附加文件6表S5)。对于与种子涂层相比,在胚乳中具有明显较高的表达水平的MEGS,在4个DAP的相互F1杂交种子中检测到的母体特异性表达与通过胚乳中的基因组印记的调节一致。使用这些方法,我们选择通过胚乳中表达的总富集来测量的三个顶部排名基因,ATCDC48(At3g09840),PDE120(At5g16620)和MS5样(AT3G51280)作为我们最强烈的印记候选人进行进一步调查。虽然PDE120和MS5样总共不太高度表达,它们也是通过胚乳的比例测量的最高级基因:种子涂层表达(附加文件6表S5),如表所示1在Day等人进行的微阵列研究中,已报道胚乳优先表达[36.].因此,我们认为这三个MEG的相对于母体种皮的胚乳F1中主要表达。
激光捕获微散(LCM)和QRT-PCR确认表达ATCDC48,PDE120和MS5样在拟南芥种子
验证3个排名靠前的候选印迹基因的表达模式ATCDC48,PDE120和MS5样,我们采用激光捕获显微切割(LCM),以microdissect拟南芥加入的种子(5 dap)l呃-0分为胚乳(ES)、种皮(SC)和胚(EM)部分。通过定性终点RT-PCR对三个LCM组织进行筛选,以研究在5 dap时种子内每个基因的组织特异性表达,这证实所有三个基因确实在细胞中表达拟南芥种子(附加文件7图S2)。在种皮和胚乳中均检测到三个基因的转录本ATCDC48和MS5样是在胚胎中也检测到。虽然这种定性RT-PCR分析中的每个种子的三个不同的部分的没有设置相对表达水平的指示,它提供给独立地确认,这三个基因在种子组织在由所述种子预测组织5 DAP确实表达基因表达网络数据库(表2).
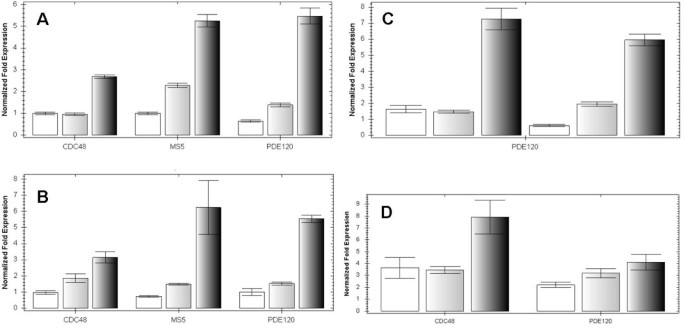
为了确定这些基因的种子中的表达水平如何变化随时间进程由我们的cDNA-AFLP实验覆盖,我们手工授粉后3,4和5-6天进行的qRT-PCR在种子上,在不同时间点。在WS-0(种子基因网络进行全种子的表达水平中的现有数据,[35.])预测的表达MS5样和CDC48A会通过发展(穿过球状,心脏和细长的子叶阶段)增加。在我们的QRT-PCR分析中,我们发现在COL-0和L中保存了这种表达模式呃-0种子(图1a,b)这表明对于这些基因,加入背景对总表达水平的影响很小。然而,我们也发现了基因表达的增加PDE120在两个载体中的5-6个DAP时间点,与WS-0数据不同(种子基因网络)不同(图1a,b).
候选印迹基因的表达谱拟南芥由QRT-PCR测定的种子.1.表达式AtCDC48A, MS5-like和PDE120在3个dap(左列),4个dap(中间列)和5-6个dap(右列)时,col0种子发育增加。1 b.表达式AtCDC48A, MS5-like和PDE120在3个dap(左侧列)、4个dap(中间列)和5-6个dap(右侧列)时,通过Ler-0种子发育增加1 c.PDE120在类似的模式对非杂交种子杂种种子中表达。在图3,4和5-6 DAP测定Col-0中×L呃-0(前3列)和l呃-0×COL-0(第二三列)。1 d.ATCDC48A和PDE120在col0(左列)或L呃-0(中列)与Col-0 4 DAP种子(右侧列)相比。显示标准错误。
为了排除任何可能由杂交背景引起的表达水平差异,我们还测量了PDE120在倒数Col-0×L范围内呃-0在3、4和5-6个dap时间点杂交,再次发现通过种子发育表达增加(图1 c).这表明,这三个在亲本遗传中相似的种子表达基因的表达模式在其F1杂种后代中没有显著改变,尽管转录水平PDE120在col0 × L中,在3 dap时可能略高呃-0交叉方向。因为表达在整个发育过程中增加,相反,在受精前的胚珠中表达较低(图1)1 d),这表明我们检测到的表达是由于德诺维分别从中央细胞和/或卵细胞到受精后胚乳和/或胚胎的长期RNA转录物的受精后转录而非母体沉积。
母性表达的种子基因ATCDC48,PDE120和MS5样在不同的遗传背景下会受到基因特异性印记的影响吗
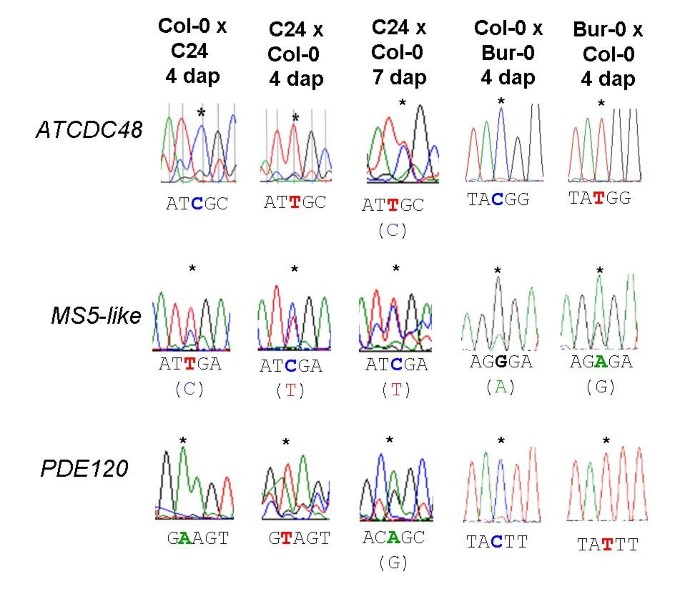
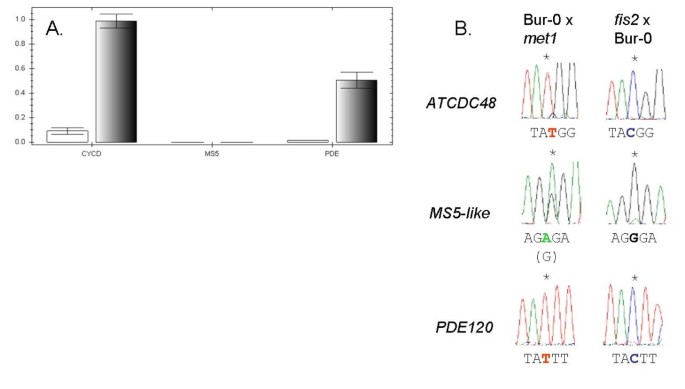
基因组印迹可以是“基因特异性的”(即基因的所有等位基因在大多数遗传背景中都被印迹)或“等位基因特异性的”(即只有一个或几个等位基因在特定的遗传背景中被印迹)[28.]. 为了验证三个排名靠前的基因是否为母体表达的印迹基因,并测试基因与等位基因特异性印迹,我们在Col-0和C24材料之间以及Col-0和Bur-0材料之间的每个基因编码区中鉴定了SNP。我们对互惠F1杂交种子(4dap)的cDNA进行测序,以检测与基因组印迹调控基因一致的单等位基因表达模式的任何证据。为了证实这两种遗传背景对cDNA-AFLP的影响,我们还对L呃-0×COL-0十字架PDE120和MS5样.在所有情况下,我们都发现ATCDC48,PDE120和MS5-like在杂交F1种子中4 dap母性表达(图2;附加文件8图S3)。而二元印迹表达(开/关)则被观察到ATCDC48和PDE120,MS5样显示母动继承的等位基因的优先表达(图2).这表明这三个基因的压印状态,就像它们的表达水平(图1),在不同的遗传类型中是保守的,它们可能代表了基因特异性印记的案例。
为了更普遍地验证cDNA- aflp方法检测母系表达的种子基因,我们进一步选择了6个预测在种子组织中表达的基因,并对col0 × C24和C24 × col0 F1杂交种子在4 dap产生的cDNA中的snp进行了测序。在所有6个病例中,我们验证了母亲特异性表达。因此,我们验证了9/52 = 17%的经cDNA-AFLP单亲表达的基因为MEGs(附加文件)9图S4)。
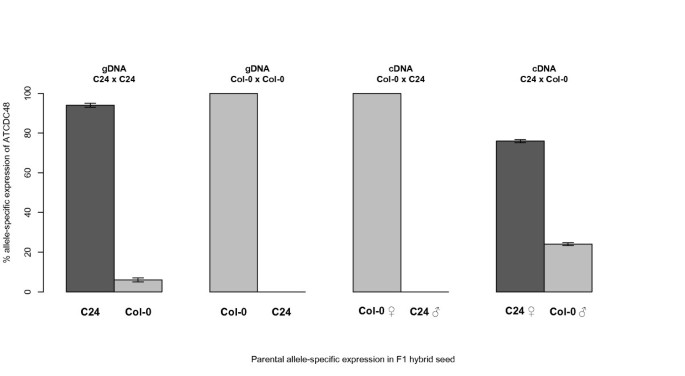
对于排名的印迹基因ATCDC48此外,我们还使用了基于实时焦磷酸(PP)技术的定量焦磷酸测序(Quantification of Allele Specific Expression by Pyrosequencing, QUASEP)对印迹的程度进行了量化我)检测[32.- - - - - -34.,它允许对SNP频率进行精确的相对量化(图3.).在母体表达的印迹基因上进行QuasePATCDC48利用col0 × C24杂交一代(4 dap)的cDNA。已知的印迹基因澳洲公平工作委员会和PHE1作为对照(表3.),分别证实了这两个印迹基因的母系特异性(二元)和父系特异性(优先)表达模式[26.,37.].PHE2非印迹胚乳表达的同源基因为PHE1作为双等位基因对照(表3.).结果表明,杂种F1种子在4 dap时,与母系遗传等位基因的相对表达量显著增加ATCDC48是100%(COL-0×C24)和80.5%(C24×COL-0),表明这一点ATCDC48显示了母亲特有的表达(图2).虽然ATCDC48在种皮中表达,合点胚乳中表达量高(表2),这与胚乳受精后的转录一致,而不是母体转录本沉积在中央细胞。因此,表示模式ATCDC48符合ATCDC48是一种新的母系在胚乳中表达的印迹基因拟南芥种子。
两个都ATCDC48和MS5样在胚胎中也表现出高水平的表达(表2).随着父系基因组的早期重新激活(从球状胚胎阶段开始),大多数胚胎表达基因在胚胎发育的心脏阶段的双等位基因表达被认为是可能的拟南芥[32.].在…的情况下MS5样,在种子内的表达主要局限于胚和外围胚乳。很可能是印的MS5样仅发生在4 dap胚乳内,而在胚胎中的表达为双等位基因,这可以解释该基因父系等位基因表达的部分峰值(图2).为ATCDC48然而,通过测序和QUASEP检测几乎完全产妇成绩单可以建议ATCDC48父系遗传等位基因在4 dap胚胎中可能发生延迟再激活。
在以后的发育阶段的种子胚乳印迹基因的表达
在最近的一项研究中,Hsieh et al. (2011) [24.]在Col-0和L之间的互殖交交叉中筛选在7-8个DAP种子中的新型印迹基因。呃-0。(附加文件在3,4和5 DAP利用cDNA-AFLP鉴定单亲TDF的数之间的差异2表S2)中,在多个发育阶段仅检测到92个单亲TDF,这表明在基因印迹调控中存在一些时间动态拟南芥这可能解释了我们的结果与Hsieh等人的结果之间缺乏重叠[24.].为了测试这一点,我们调查了我们在4个DAP识别的MEGS仍然是单方面的,或者在以后的发展阶段成为双倍曲线。我们的结果表明,在7个DAP种子中,在所有三种基因中,父态等位基因比4个DAP更高度表达(图2).在…的情况下ATCDC48A,这使表达完全双等位基因,同时母性等位基因仍优先表达MS5样和PDE120(图2).在7 DAP时间点,而所有这三个基因源自于胚和胚乳表示,总转录水平在7 DAP种子各组织的相对和绝对贡献尚不清楚。因此,在7 DAP种子观察到父亲的等位基因的表达增加可以从压印和/或胚胎与在7 DAP种子胚乳组织的量的相对比例的偏移(相对于4 DAP种子)的损失引起的。在后一种情况下,MEG可以在胚乳组织保持印迹,但是从更丰富胚胎组织在7 DAP由双等位基因表达信号被屏蔽。两个等位基因的表达很可能会在p排除它们的鉴定<0.001截止用于通过Hsieh等大多数基因标识。[24.].我们还考虑我们的数据和沃尔夫等人进行了进一步的新一代测序屏幕之间的一致性。[23.](附加文件10图S5),并没有发现与我们的屏幕或Hsieh等人的屏幕重叠[24.](另见讨论)。我们在通过Gehring等人预先预测的这两项研究和差异甲基化区域(DMRS)检测到的印迹基因之间,我们也发现非常重叠(100分)。[25.].这促使我们考虑可能存在未知的DMRs,它可能作为与我们的印迹基因相关的印迹控制区(ICRs)。
dmr的识别ATCDC48,PDE120和MS5样座位
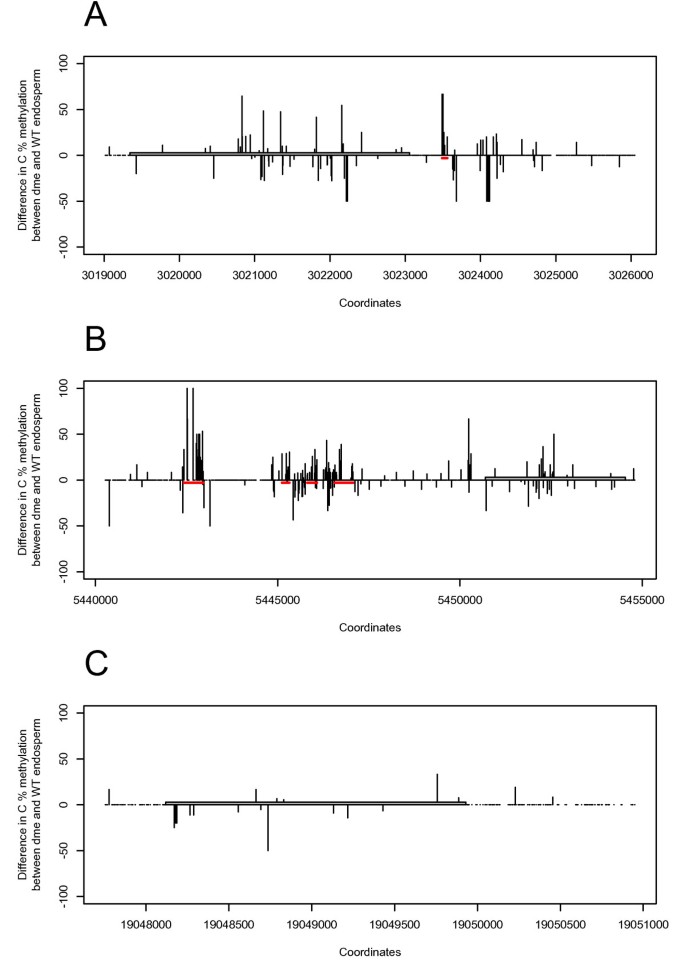
虽然哺乳动物中印迹基因的印迹控制区域(ICR)通常与差异甲基化区域(DMRS)重叠,但DMRS的基因组分布意味着其中一些可能是ICRS [38.- - - - - -41.]. 在植物基因组中,与DMR一致的ICR已被鉴定为印记基因澳洲公平工作委员会[26.,42.],PHE1[30.],及货币政策委员会[19].如上所述,然而,它们还没有被检测到用于许多其他印迹基因,以及由许多推定的DMR压印的诱导[11]仍未确认(附加文件10图S5)。利用野生型和二甲醚胚乳[43.],我们在母体表达的印迹基因座的基因组附近寻找DMRATCDC48,PDE120和MS5样.
我们确定了可以作为icr的dmrPDE120和ATCDC48(数字4A和4B.)通过分析从野生型和种子的胚乳的胚乳来源的表达数据缺陷的母体DME.等位基因[43.].这些从ArrrayExpress检索和位于基因之间的胞嘧啶的甲基化百分比,立即在基因体上游和下游的基因之间计算。DMR位于下游432bpATCDC48A含26个胞嘧啶,其中6个在超甲基化二甲醚(图4A).四个DMR位于上游PDE120在8273个碱基对的距离(30个胞嘧啶,17高甲基化在二甲醚),5377 bp(49个胞嘧啶,6个高甲基化二甲醚), 4620 bp(46个胞嘧啶,13个高甲基化二甲醚)和3635 bp(115个胞嘧啶,12个高甲基化二甲醚) (数字4B.).无明显测距装置,依赖性DMR可以在印迹基因的基因组附近鉴定MS5样(图4C.).我们还分析了整个候选印迹基因组合(见表)2)对于其附近的潜在DMR。与我们的三个排名靠前的印迹基因相比,我们只能从另外49个基因中识别出另外两个基因的DMR,即At1g25370(编码一种含有DUF1639的未知功能蛋白质)和At2g32000(编码一种DNA拓扑异构酶,1A型)(附加文件11图S6)。总的来说,这些数据表明印记MS5样与印迹基因相比,基因不太可能通过甲基化依赖机制受到调控ATCDC48和PDE120.
印迹基因的表达水平ATCDC48和PDE120是由甲基化途径调控的吗
为了确认DNA甲基化变化是否与我们的新型印迹基因的改变表达水平有关,我们在衍生自幼苗的cDNA上进行了QRT-PCRmet1-3结果表明,印迹MEGs具有明显的异常诱导作用ATCDC48A和PDE120在met1-3突变体(图5A).同时失败检测候选DMRMS5样,该基因未发生这样的诱导(图5A).然而,有趣的是,由野生型产生种子拟南芥与花粉met1-3植物没有引起这三个基因中的任何一个的父性等位基因的重新激活(图)5B.).母体FIS-复合体也已被证明可以调节某些MEGS的印记[37.,44.- - - - - -46.].然而,在这项研究重点的三大烙印位点,我们发现,施肥fis2带有野生型花粉的植物也不会导致印记的丢失(图5B.).总的来说,这可能意味着我们已经确定的近端DMRs对这些印迹位点并不起ICRs的作用。或者,这可能表明存在一个子集的印迹megg,其印迹状态和表达水平是通过aMET1- - -DME/FIS- 独立途径。对于这些表述改性剂途径对这三种基因的响应缺乏对Hsieh等人的失败提供了进一步的解释。[24.]察觉ATCDC48A, MS5-like和PDE120作为标记meg,作为他们的过滤方法,比较了野生型杂交和那些杂交到这种表观遗传修饰背景的序列读取的数量。
讨论
与哺乳动物基因组中基因组印记的现有知识(即关于印记基因数量和调控机制)相比,植物中基因组印记的研究受到迄今为止报道和研究的印记基因数量较少的阻碍。在这项研究中,我们试图通过在模式植物中识别新的印迹基因来解决这个问题拟南芥并将我们的研究结果与其他人的研究结果相对照,以及当前关于植物印记调控的理论。
在本研究中,我们利用cDNA-AFLP进行全基因组等位基因特异性表达分析,从4500个多态性等位基因特异性TDFs中鉴定出93个母系表达的TDFs。其中一些可能代表了模式植物中由印迹调控的母系表达候选基因拟南芥.To identify the genes represented by each TDF, we developed a novel bioinformatics software program called GenFrag which can directly identify genes (in well annotated sequenced genomes e.g. Col-0 accession) based only on the size of the TDF and the selective nucleotides of the primers used to generate the TDF. Although cDNA-AFLP is an early generation transcriptomics platform, as a technique it has some distinct advantages over probe hybridisation based approaches such as microarrays. These advantages include: (a) applicability to any species (including species with no genomic information), (b) low cost and reproducibility, (c) small amounts of RNA template needed, (d) detection of lowly expressed genes and (e) high specificity to distinguish closely related genes [47.- - - - - -50.].然而,cDNA-AFLP技术中最耗时的步骤之一是从凝胶切除TDF的切除,使得TDF可以被测序(通常在扩增和/或亚克隆到质粒之后)。提高涉及测序和良好注释基因组的cDNA-AFLP实验中基因鉴定的吞吐量(例如拟南芥),我们开发了Genfrag BioInformatics软件程序。
为了提高(cDNA-)AFLP技术的效率,人们已经开展了生物信息学研究。多个物种的大量DNA序列数据已被用于生物信息学预测虚拟成绩单配置文件。量身定制的软件,如AFLPinSilico[51.]及基因科技[52.,53.,允许AFLP和cDNA-AFLP TDFs的高通量鉴定拟南芥和马铃薯球胞囊线虫,分别。这些生物信息学还开发了方法来实现实验模拟,降低AFLP优化所需的时间,以及需要处理的样本数量[51.- - - - - -53.].本研究开发的GenFrag程序旨在促进从cDNA-AFLP实验中获得的基因的高通量直接鉴定,这些基因具有完整的测序和注释的基因组,例如拟南芥.我们已将GenFrag项目免费提供给研究社区,网址为:http://www.nem.wur.nl/UK/Research/bio/.
在我们的研究中,我们发现了新的印迹基因拟南芥,我们将GenFrag程序应用于93个显示母体特异性表达模式的TDFs,从而可以在这些基因中识别52个母体表达基因(MEG)拟南芥(表1). 通过筛选种子内的表达和胚乳组织内的富集,我们根据种皮和胚乳之间表达水平的绝对差异对18个MEG进行了排名(表1)2).的识别MS5样和PDE120还通过替代支持接近即具有Day等的数据集的比较。([36.];表格1),并按胚乳/种皮表达比例排序(附加文件6表S5)。对于在显影种子中表达的任何给定基因,难以分离不同种子组织的绝对和相对贡献,特别是给出它们不同的血浆(胚乳中的三倍体,种子涂层中的二倍体母体,胚胎中的二倍体杂种)和不同组织细胞/核丰度的差异(种子涂层,胚乳,胚胎)。由于对总转录的贡献是针对RNA单位的标准化,因此不能直接测定每个种子组织的绝对贡献。然而,我们可以证明通过使用双倍胚乳表达基因的发育阶段可检测种子中的双腿表达是可检测的,我们的样品PHE2)作为阳性对照(表3.).我们的方法确实有一个优势,即允许重点研究高表达基因,这些基因的转录本在种子4 dap中最不可能在受精前由母体沉积在中心细胞中。胚乳在受精后立即具有转录活性,因此母质沉积的长寿rna不太可能发挥重要作用[34.或在胚乳组织中发现高含量。这与胚胎早期发育形成对比,胚胎中的表达是由母亲决定的(例如,在2-4细胞阶段有88%的转录本),随后在胚胎发育的后期球形阶段父系等位基因被重新激活[32.]. 因此,在我们的研究中发现的排名靠前的富含胚乳的基因可以被认为是最有可能的印迹基因(表1)2).
我们的研究中的一个引人注目的发现是,在所有不同屏幕中检测到的印迹基因之间的基因几乎没有重叠拟南芥迄今为止,包括我们的研究(附加文件)10图S5)。这种缺乏重叠的可能解释包括(a)使用不同的遗传背景;(b)使用来自不同发育阶段的样品(胚胎与胚乳组织的相对丰度和贡献不同);(c)使用不同的过滤标准;(d)使用不同的实验方法从种子、胚胎和胚乳组织中分离出RNA;(e)使用不同的转录组分析平台和生物信息学管道。在这项研究中,我们证明了我们已经识别的印迹基因在Hsieh等人使用的发育后期阶段不太可能被检测到[24.],而缺乏下一代测序之间重叠的接近Hsieh等人的。(2011)和Wolff等。[23.可能导致对不同时间点的分析(7-8个DAP相对4 DAP)和不同品种(Col-0 × Ler-0相对Col-0×Bur-0)。基因的RNA测序方法之间存在一些重叠(7个基因)[23.](Col-0×Bur-0杂交)和Col中DMRs调控基因的筛选-德国劳埃德船级社X L.呃-0杂交[25.暗示DMRS可以控制有限数量的基因座的基因特异性,以及它们的能力可以根据不同的遗传背景而变化。虽然似乎所有这些方法都鉴定了印迹基因,但似乎似乎是印迹基因座(基因特异性或等位基因特异性)的检测可能依赖于探讨(遗传背景),采样的发育阶段和实验方法。这些因素可能会在不同研究结果之间引入显着的变化。鉴于植物中检测到的等位基因特异性表达效果的增加,可能是印记研究界可能适用于开花植物中印迹基因的定义和验证的一些常见标准(另见[11])。
前三名排名基因ATCDC48,PDE120和MS5样在4个dap种子组织(种皮、胚乳和胚)中,我们可以独立检测到这些基因的表达7图S2)。为ATCDC48和PDE120我们还证实,表达在预受精胚珠低但种子发育过程中增加(图1a,b),这与这些基因经受受精后表达在发育中的种子是一致的(即,不母系沉积)。我们证实,所有这三种胚乳表达的基因的来自不同种质4 DAP倒数F1杂种种子母系表达,并因此代表基因特异性印迹的新颖例拟南芥(数字2和3.). 虽然ATCDC48和PDE120受二进制印迹表达,MS5样显示了母系优先的印迹表达模式[9,21.],因为还检测到一些父亲表达式(图2).虽然表达水平MS5样Col-0和L呃-0(图1),而在Ws-0(种子基因网络)确定的模式中,印记的程度是不同的,C24和bur0等位基因在父系遗传时表现出更大程度的印记。
印记基因的ICR通常与DMR重叠。因此,我们认为我们排名第一的印迹基因ATCDC48,PDE120和MS5样可能在其基因组附近包含候选DMR,如果是,这些可能是候选ICR。我们可以确定上游的DMRPDE120和下游的DMRATCDC48可以充当icr(图)4A和4B.).但是,野生型和丙基之间的甲基化差异二甲醚胚乳未显示任何DMRMS5样(图4C.). 表达DME.在中央细胞中导致母体基因组的低甲基化。然而,使用的甲基化数据[43.]代表胚乳母系和父系基因组的整体甲基化状态。这可以解释为什么不能识别DMRMS5样.控制印记MS5样该位点可能独立于DNA甲基化,或受远端基因的DMR调控。在哺乳动物中已经观察到一些印迹位点的甲基独立印迹[54.和组蛋白甲基化Polycomb.组蛋白已经显示出调节一些印迹基因在植物中[37.,44.,55.].我们的研究结果表明,缺乏MET1在雄配子上对印迹没有影响ATCDC48,PDE120和MS5样在发育的种子。与此相反,我们发现,缺乏MET1导致的过度表达ATCDC48和PDE120在营养叶组织中。没有效果的缺乏MET1在营养组织中观察了MS5样.考虑到最近的发现结果23.]和先前的报告显示,PCG络合物调节压印[37.,44.- - - - - -46.,我们还测试了母系fis复合物对母系表达的三个印迹基因调控的可能影响,发现受精fis2与野生型植物的花粉并没有导致印记的任何损失。因此,替代后生途径可能调控的印记MS5样. 这样的监管也不能排除ATCDC48和PDE120.进一步表征印迹ATCDC48,PDE120和MS5样座位将增加我们的参与基因组印记的被子植物调控的表观遗传机制的了解提供了机会。
母体表达印迹基因,ATCDC48A,是一个同六聚的AAA(+) atp酶伴侣,涉及细胞周期控制和细胞增殖。CDC48/p97是一种高度保守的蛋白质,在许多物种中起着DNA复制起始因子的作用[56.],并已被证明在广泛的多细胞和单细胞生物中是必不可少的[57.]. 在植物中,CDC48A蛋白已被证明与体细胞胚胎发生受体样激酶1(SERK1)蛋白发生物理相互作用[58.,59.].的拟南芥基因组包含三个CDC48基因座,ATCDC48A(At3g09840),ATCDC48B(At3g53230)和ATCDC48C(At5g03340)。ATCDC48A可以在功能上补充CDC48突变体酿酒酵母酿酒酵母[56.,和损失的pux1.消极的监管机构ATCDC48由于细胞分裂和扩张的增加而加速植物生长[60.].额外的研究拟南芥T-DNA敲除株ATCDC48A已经证实,纯合缺失苗是可行的,直到老5天,但此后不久死亡。它也表明,空Atcdc48a等位基因具有通过雄配子体一个急剧降低传输效率(即ATCDC48A是正常花粉萌发和花粉管伸长所必需的)[57.].
我们的结果表明ATCDC48A是母系表达并受的基因组印记在发育中的种子(胚乳)(图1,2和3.).虽然玉米印迹的地位同源ATCDC48A尚未确定,玉米同源物的印记可能是可能的ATCDC48A(或其他细胞周期基因)可能是玉米倍性杂交胚乳中观察到的细胞周期进程的剂量效应的原因[61.]. 而一个明确的角色ATCDC48在DNA复制的植物细胞中控制尚未建立起来,我们发现:ATCDC48是在胚乳发育过程中母系表达的印迹基因与亲代冲突理论所提出的印迹基因在控制增殖中的作用相一致[12].
从功能角度来看,本研究中发现的另外两个印迹基因尚不清楚。的MS5样母系表达的印迹基因与雄性不育5 (5级),这个基因已经被证明是雄性减数分裂的关键拟南芥[62.].MS5样还显示与硫缺乏诱导的基因的序列相似性AtSDI1[63.].
母系表达的印迹基因PDE120被标注为色素有缺陷的胚胎(PDE)种子基因数据库中的突变体[64.,65.].核编码PDE120基因座编码TIC40蛋白,该蛋白是叶绿体内层包膜蛋白质进口装置的组成部分[66.].母系表达的印迹核基因编码针对母系遗传叶绿体的蛋白质产物,这可能提示在核位点上印迹的选择,在这些位点上,母系遗传的叶绿体功能等位基因的强大控制是必不可少的[67.].
结论
在这项研究中,我们已经包含倒数F1杂交种子角果确定52倍母系表达的基因。我们已经开发并使用名为GenFrag,以方便高通量基因cDNA-AFLP实验与注释良好的测序的基因组的生物体分析了一种新的生物信息学工具。我们根据胚乳的相对表达水平排名52种母系表达的基因相对在球胚期的种皮组织中,选择3个排名靠前的印迹候选基因进行进一步研究。我们通过LCM RT-PCR确认了这3个候选基因在4个dap种子中的表达,并进一步确认了这3个基因在不同类型的4个dap F1杂交种子中的母系特异性表达拟南芥登记入册。综上所述,我们的结果表明ATCDC48母系表达的印迹基因在发育中吗拟南芥种子,并且很可能印在胚乳中,也可能印在胚胎中。另外两个排名靠前的基因也证实了印迹母性表达PDE120和MS5样. 如有,表中三个印迹基因和18个母体表达基因的DMR2确定并假定为假定的icr。但是,分析了印迹ATCDC48,PDE120和MS5样带有候选修饰符的基因座met1-3和fis2表明,在这三个基因压印的调节是独立的DNA甲基化和FIS-络合物。在总体上,我们的研究发现了新的母系表达的基因拟南芥种子并验证三个基因(ATCDC48,PDE120和MS5样)作为一种新的母体表达的印迹基因拟南芥种子。本文和其他研究人员对这些基因的进一步分析,将有助于我们进一步了解开花植物中印迹基因的表观遗传调控机制和进化。
方法
植物生长和cDNA的产生
拟南芥种质的L.的Col-0,L呃-0、C24和bur0在8份威斯兰(Dungannon, n.ireland)多用途堆肥(1份珍珠岩和1份蛭石)上生长,200 μmol m-2s-1在21°C/18°C和16:8小时的光:暗周期。通过col0和Ler-0、bur0和C24的互交产生F1杂种种子[24.,25.].在Leica MZ6解剖显微镜(Leica Microsystems CMS GmbH, ernst - leitz - stra e 17-37, Wetzlar, D-35578, Germany)下,使用Dumostar No. 5镊子(Dumont Biology, Switzerland),在开花期前人工阉割植株,并手工交叉。角果和种子是在描述的时间点收获的。采用无rnase DNase试剂盒(Qiagen,美国)结合柱上DNase处理提取mRNA。将5 μg总RNA与生物素化的oligo dT杂交,该oligo dT与链菌亲和素包被的PCR管壁结合(mRNA Capture Kit, Roche),并进行cDNA合成(quantitative Reverse Transcriptase Kit, Qiagen)。使用安捷伦2100生物分析仪(安捷伦科技瑞士公司,巴塞尔,瑞士)进行质量控制。样品在使用前保存在-80°C。
cDNA-AFLP
如描述的,用限制性酶消化的分层中的cDNABst易,MSE我并与适配器互补的适配器连接Bstyi(5'-ctcgtagactgcgtagtagtgatcygatccgttca-3和3'-catctgacgcatcactagrctaggcaagt-5)和MSEI (5'-GACGATGAGTCCTGAGTAACACTGGATCATG-3'和3'-CTACTCAGGACTCATTGTGAGGTAGTAC-5)。第一次使用选择性扩增结扎的片段MSE我引物(5'-GATGAGTCCTGAGTAA-3' )和BstYI引物(5'-GACTGCGTAGTGATCN-3和5'-GACTGCGTAGTGATTN-3')。扩增片段以1:20稀释,并使用128个引物组合(8BstYI可能引物5'-GACTGCGTAGTGATCCNN-3和5'-GACTGCGTAGTGATCTNN-3' × 16MSE引物5'-GATGAGTCCTGAGTAANN-3' = 128个组合)。产品使用聚丙烯酰胺凝胶,并使用GelDoc-ItTM成像系统(Ultra-Violet Products Ltd., Cambridge, UK)进行可视化。样品使用16-毛细管3130 × l基因分析仪(Applied Biosystems Inc.)进行处理。0.5 μl反应产物与0.4 μl内Lane Standard 600 ROXTM尺寸标准(Promega, WI, USA)或GeneScanTM 500 ROXTM尺寸标准(Applied Biosystems, UK)混合在9 μl Hi-Di Formamide (Applied Biosystems, UK)中。碎片分析在一个多重运行和可视化Bst易+ C和BstYI+T引物,分别用荧光染料JOE和6-FAM标记。使用GeneMapper v3.7软件对样本进行分析,该软件根据与ILS600-C标记(Promega)比较确定的TDF大小,为每个TDF分配一个等位基因标签或bin。Bin分配允许在确定的大小上有±0.5 bp的变化。对给定引物组合生成的cDNA-AFLP样品,分别用col0 × col0和L呃-0×L呃-0,以及两个倒数杂交种,Col-0×L呃-0和L.呃在运行中分析-0×COL-0以允许鉴定多态和差异表达的TDF。使用默认的信号量程法则化用于Genemapper的片段大小和等位基因调用参数;不删除样品之间的等位基因。这种产生的电泳图与其等位基因呼叫的检测到峰值,从中得到基因型。
GenFrag程序及软件的开发
我们下载了包含可用全长的两个数据集拟南芥TIGR v.4.0(2005年3月发布)和TAIR v.7数据库中的cDNAftp://ftp.tigr.org/pub/data/a_thaliana/ath1/SEQUENCES/和ftp://ftp.arabidopsis.org/home/tair/sequences/(分别发布2007年4月)。拟南芥ests正在下载http://www.plantgdb.org/download/download/sequence/estcontig/arabidopesis_thaliana/current_version/arabidopesis_thaliana.mrna.put.fasta.bz2 .put.fasta.bz2以及来自TEGR-ATG数据库的替代拼接变体的数据集(2003年6月发布)http://www.tigr.org/tdb/e2k1/ath1/altsplicing/splicing_variations.shtml..
GenFrag扩展了早期的GenEst包[53.],提供一个网址为:http://www.nem.wur.nl/UK/Research/bio/.Genfrag为rebase中列出的所有已知限制酶提供完整的命名支持[68.],对引物组合的额外支持,其尺寸校正以及错配的片段尺寸的列表。Genfrag还允许基于候选序列列表中基因的潜在兴趣来选择实验等位基因片段的子集,而不是测序所有片段。GenFrag软件是用Ruby编写的,可以在Ruby支持的所有平台上运行,包括Windows,OSX,Linux和Java虚拟机。限制酶模块可作为开放生物信息学基础Bioruby Toolkit的一部分提供[69.]并由名称包含所有已知的限制酶。基因组信息可以以任何Bioruby支持格式读取,包括Fasta。Web界面在Ruby上写入Ruby,并且SQLite用于缓存搜索。Genfrag软件可以通过两种方式使用:通过公共网络界面和计算管道中的软件模块。
表达分析
来自种子网络的基因表达水平和缺失呼叫的微阵列数据(Harada-Goldberg拟南芥激光捕获微解剖基因芯片数据集,http://seedgenenetwork.net)从基因表达综合[下载70],登录号GSM284397和GSM284398(种皮)、GSM284390和GSM284391(外胚乳)、GSM284388和GSM284389(珠孔胚乳)、GSM284392、GSM284393和GSM284394(合点胚乳)以及GSM284384和GSM284385(胚)。这些实验取样的发育阶段是胚胎发育的球状阶段。使用所有重复的平均表达值。以下基因没有探针:At1g12420、At1g55320、At2g45315、At3g21465、At4g01000、At4g25315、At5g04895、At5g35737和At5g40240。At4g37530和At1g14880的探针也与另一个基因匹配,因此由于结果可能不明确,因此从分析中省略。
中国大陆
登月树去雄株和手交株的角果呃-0收集并直接在梯度乙醇系列转移至ASP200包埋机(徕卡GmbH公司威兹拉,德国)和脱水在室温下(在70%1小时,3×1小时,在90%,3×1小时在99.98%),并在其通过Paraplast的X-TRA包埋介质(罗斯AG,阿勒斯海姆,瑞士)在56°C(2×1小时取代的二甲苯(2×1小时1×75分钟),1×3小时),倾入石蜡块,并储存在4℃。石蜡块切成上的RM2145切片机(Leica Microsystems公司有限公司,韦茨拉尔,德国)10微米的薄切片并安装在在甲醇中的金属框架滑动,在42℃干燥过夜,并在56在二甲苯脱蜡保持无核酸酶的膜°C(3×10分钟)。显微切割是使用在MMI CellCut加激光捕获显微镜角果薄切片上进行(MMI分子机器和工业AG,Glattburg,瑞士),以产生circ每个样品切割(1500个细胞)。使用Picopure RNA分离试剂盒(Arcturus工程,山景,CA 94043-4019,USA)和使用Nugen Wt-Ovation Pico RNA扩增系统产生的单链cDNA(Nugen Technologies Inc.,Brockville, 加拿大)。
rt - pcr
使用Universal ProbeLibrary Assay Design Center(罗氏,瑞士,瑞士)设计了三个排名最高的候选基因的引物。http://www.roche-applied-science.com)所有基因均采用相同的PCR条件,Tm为59℃,扩增周期为40次。进行了两次重复(数据未显示),显示了三个排名最高的候选印迹基因分析的一个代表性结果(附加文件)7图S2)。使用SYBR Green master mix (ABI)对生物三重重复样品进行定量RT-PCR,并在C1000热循环器中运行CFX Real-Time系统。所有底漆的详细资料可根据要求提供。
DNA测序和QUASEP
其实单核苷酸多态性之间拟南芥在拟南芥信息资源中识别出识别[71.) (PERL0437780ATCDC48, PERL0895299PDE120, PERL0626585MS5样Exon 2, 2345566 (C/T)为PHE1).从colo -0 × C24和colo -0 × Ler-0杂交的种子中获得cDNA。在标准条件下用GoTaq (Invitrogen公司)进行PCR扩增,用GATC进行测序。通过QUASEP(通过焦磷酸测序定量等位基因特异性表达)对母系和父系来源的SNPs进行定量。采用定量RT试剂盒,按照厂家说明书进行RT- pcr。对cDNA进行PCR,每对使用一个生物素化引物,使用由PSQ分析软件设计的序列(序列可根据要求提供)。从至少3个重复中计算亲本表达的平均值。基因组DNA和基因澳洲公平工作委员会,PHE1和PHE2用作对照。
dmr的识别
高吞吐量二硫酸氢盐测序数据拟南芥野生型胚乳和缺乏母系DME等位基因种子的胚乳[43.]从ArrayExpress(检索http://www.ebi.ac.uk/arrayexpress,登录号E-GEOD-15922),对应于TAIR 8版本的基因组。计算甲基化在位于基因直接上游和我们的候选人的下游之间的胞嘧啶的百分比。该地区表现之间的差异二甲醚和野生型胚乳胞嘧啶甲基百分比被确定为DMR中和潜在的ICR。
参考
- 1.
Walbot V,Evans MMS:植物生命周期的独特功能及其后果。自然评论遗传学。2003,4(5):369-379。10.1038 / NRG1064。
- 2.
EM勋爵,Russell SD:植物授粉和受精的机制。细胞和发育生物学年度回顾。2002年,18:81-105.10.1146/annurev.cellbio.18.012502.083438。
- 3.
Dresselhaus T:双受精过程中的细胞-细胞通讯。植物生物学进展。2006,9(1):41-47。10.1016 / j.pbi.2005.11.002。
- 4.
胚乳:种子发育的十字路口。植物生物学的最新观点。2003,6(1):42-50.10.1016/S13695266020000043。
- 5。
Haughn G,Chaudhury A:拟南芥种皮发育的遗传分析。趋势植物科学。2005,10(10):472-477.10.1016/j.tplants.2005.08.005。
- 6。
Brukhin V, Curtis MD, Grossniklaus U:被子植物雌性配子体:不再是被遗忘的一代。现代科学。2005,89(11):1844-1852。
- 7。
Johnston AJ, Meier P, Gheyselinck J, west SE, Federer M, Schlagenhauf E, Becker JD, Grossniklaus U:遗传减法分析确定了拟南芥繁殖所需的基因,揭示了雌性配子体和母体孢子体之间的相互作用。中国生物医学工程学报。2007,28(6):691 - 698。
- 8。
王志强,王志强,王志强:亲本效应对拟南芥种子发育的影响。发展。1998,125(17):3329-3341。
- 9。
杨志强,王志强:亲本效应在种子发育中的差异剂量假说。acta botanica sinica(云南植物研究),2004,16(4):593 - 598。10.1105 / tpc.104.161230。
- 10.
Grossniklaus U,Vielle-Calzada JP,Hoeppner Ma,Gagliano WB:Metea胚胎发生的母体控制,拟南芥中的Polycomb组基因。科学。1998,280(5362):446-450。10.1126 / science.280.5362.446。
- 11.
栽培MT, Baroux C, Grossniklaus U:基因组印记在种子发育中的调控和灵活性。植物细胞在线,2011。
- 12.
黄志刚,王志刚:胚乳基因组印记对种子发育的影响及其对无融合生殖进化的意义。伦敦皇家学会哲学汇刊b辑:生物科学。1991,333(1266):1-13。10.1098 / rstb.1991.0057。
- 13。
Kinoshita T,Ikeda Y,Ishikawa R:基因组印记:亲本染色体拮抗作用之间的平衡。细胞与发育生物学研讨会。2008,19(6):574-579.10.1016/j.semcdb.2008.07.018。
- 14。
植物的基因组印记。表观遗传学。2008,3(1):14-20。10.4161 / epi.3.1.5554。
- 15。
O’connell MJ, Loughran NB, Walsh TA, Donoghue MT, Schmid KJ, Spillane C:一种系统发育学方法,用于检测胎盘哺乳动物中与蛋白质编码同源基因相关的亲代冲突或基因重复的证据。中国生物医学工程学报。2010,21(9-10):486-498。10.1007 / s00335 - 010 - 9283 - 5。
- 16。
哺乳动物印记的普查。遗传动态。2005,21(8):457-465。10.1016 / j.tig.2005.06.008。
- 17。
六弦琴-卡尔萨达JP,托马斯·,毕兰C,科卢乔A,Hoeppner MA,Grossniklaus U:基因组印记的维护在拟南芥麦迪亚轨迹需要合子DDM1活性。基因开发。1999年,13(22):2971至2982年。10.1101 / gad.13.22.2971。
- 18。
Kohler C,Hennig L,Spillane C,Pien S,Gruissem W,Grossniklaus U:Polycomb-Group蛋白质MEDEA通过控制疯箱基因拍摄的表达来调节种子开发。基因开发。2003,17(12):1540-1553。10.1101 / gad.257403。
- 19。
Tiwari S, Schulz R, Ikeda Y, Dytham L, Bravo J, Mathers L, Spielman M, Guzman P, Oakey RJ, Kinoshita T, et al:拟南芥中表达的PAB C-TERMINAL基因编码聚腺苷酸结合蛋白的保守C-TERMINAL结构域。植物学报。2008,20(9):2387-2398。10.1105 / tpc.108.061929。
- 20。
郭敏,杨晓峰,杨晓峰,何振华:玉米胚乳异源等位基因和一个新的印迹基因的全基因组表达分析。植物学报,2003,36(1):30-44。10.1046 / j.1365 - 313 x.2003.01852.x。
- 21。
玉米胚乳非加性表达和亲本效应的微阵列和等位基因特异性表达谱鉴定。植物营养与肥料学报。2007,32(4):457 - 461。10.1104 / pp.107.101428。
- 22。
Shirzadi R、Andersen ED、Bjerkan KN、Gloeckle BM、Heese M、Ungru A、Winge P、Koncz C、Aalen RB、Schnittger A等:无父系贡献的胚乳全基因组转录谱确定了类遗传性36的亲本依赖性调控。《公共科学图书馆·遗传学》。2011年,7(2):e1001303-10.1371/journal.pgen.1001303。
- 23。
Wolff P,Weinhofer I,Seguin J,Roszak P,Beisel C,Donoghue MTA,Spillane C,Nordborg M,Rehmmeier M,Köhler C:拟南芥胚乳中起源亲本等位基因表达的高分辨率分析。《公共科学图书馆·遗传学》。2011,7(6):e1002126。
- 24.
谢T-楼信Ĵ,宇泽R,Silva的P,科恩S,鲍尔MJ,桥本男,Kirkbride RC,原田JJ,齐尔伯曼d,等人:在拟南芥胚乳印迹基因表达的调控。国家科学院的诉讼程序。2011年,108(5):1755至1762年。10.1073 / pnas.1019273108。
- 25.
Gehring M,Bubb Kl,Henikoff S:种子发育过程中的重复元素的广泛去甲基化基因印迹。科学。2009,324(5933):1447-1451。10.1126 / Science.1171609。
- 26.
3 .林毅夫,陈志刚,陈志刚,陈志刚:拟南芥胚乳FWA印迹的DNA甲基化调控。中国科学(d辑):地球科学(d辑)。10.1126 / science.1089835。
- 27.
Choi Y、Gehring M、Johnson L、Hannon M、Harada JJ、Goldberg RB、Jacobsen SE、Fischer RL:DEMETER是拟南芥胚乳基因印迹和种子活力所必需的一种DNA糖基化酶结构域蛋白。牢房。2002,110(1):33-42.10.1016/S0092-8674(02)00807-3。
- 28.
Baroux C,毕兰C,Grossniklaus U:种子发育过程中基因组印记。同源性的影响。2002年,46:165-214。
- 29.
Jullien PE,Berger F:配子特异性表观遗传机制形成基因组印记。植物生物学。2009,12(5):637-642.10.1016/j.pbi.2009.07.004。
- 30.
Villar CB,Erilova A,Makarevich G,Trosch R,Kohler C:通过直接串联重复控制拟南芥中的1印迹。摩尔植物。2009,2(4):654-660.10.1093/mp/ssp014。
- 31.
Bachem CWB,Vanderhoeven Rs,Debruijn Sm,Vreugenhil D,Zabeau M,Visser RGF:使用基于AFLP的RNA指纹识别新方法可视化差异基因表达:马铃薯块茎发育过程中基因表达分析。植物杂志。1996,9(5):745-753。10.1046 / J.1365-313x.1996.9050745.x。
- 32.
Autran D, Baroux C, Raissig Michael T, Lenormand T, Wittig M, Grob S, Steimer A, Barann M, Klostermeier Ulrich C, Leblanc O, et al .:母体表观遗传途径控制亲本对拟南芥早期胚胎发生的贡献。细胞物理学报,2011,45(5):707-719。10.1016 / j.cell.2011.04.014。
- 33.
Haas BJ、Delcher等人、Mount SM、Wortman JR、Smith RK、Hannick LI、Maiti R、Ronning CM、Rusch DB、Town CD等:使用最大转录物比对组件改进拟南芥基因组注释。核酸研究2003,31(19):5654-5666.10.1093/nar/gkg770。
- 34.
在拟南芥中,胚胎和胚乳从雌性配子中继承了不同的染色质和转录状态。植物学报。22(2):307-320。
- 35.
Le BH,Cheng C,Bui AQ,Wagmaister JA,Henry KF,Pelletier J,Kwong L,Belmonte M,Kirkbride R,Horvath S等:拟南芥种子发育过程中基因活性的全球分析和种子特异性转录因子的鉴定。国家科学院学报。2010,107(18):8063-8070.10.1073/pnas.1003530107。
- 36.
日RC,Herridge RP,刘汉BA,Macknight RC:增殖拟南芥胚乳的转录组分析揭示了合胞司的控制,细胞分裂素信号和基因表达调控生物学意义。植物生理学。2008年,148(4):1964至1984年。10.1104 / pp.108.128108。
- 37。
科勒C,页DR,Gagliardini V,Grossniklaus U:拟南芥由亲本印记PHERES1的拟南芥MEDEA梳组蛋白表达的控制。NAT Genet。2005年,37(1):28-30。
- 38。
Tycko B:等位基因特异性DNA甲基化:超越印迹。acta optica sinica, 2010, 29(3): 497 - 503。10.1093 /物流/ ddq376。
- 39。
Meaburn EL,范斯卡尔奎LC,穆勒记者:在人类基因组的影响复杂疾病的遗传研究等位基因特异的甲基化。表观遗传学。2010年,5(7)。
- 40.
Wang W, Zhang K:等位基因特异性甲基化在人类基因组中普遍存在,并由CpG-SNPs贡献。中国生物医学工程学报,2010,30(7):883-889。10.1101 / gr.104695.109。
- 41.
范斯卡尔奎LC,Meaburn EL,史密斯R,登普斯特EL,杰弗里斯AR,戴维斯MN,普洛明R,米尔Y:等位基因偏斜的DNA甲基化是整个基因组广泛。我是j嗡嗡声的遗传。2010年,86(2):196-212。10.1016 / j.ajhg.2010.01.014。
- 42.
Kinoshita Y,Saze H,Kinoshita T,Miura A,Soppe WJ,Koornneef M,Kakutani T:通过正弦相关直接重复控制拟南芥FWA基因沉默。植物J。2007, 49 (1): 38-45.
- 43.
HSIEH TF,Ibarra Ca,Silva P,Zemach A,Eshed-Williams L,Fischer RL,Zilberman D:拟南芥胚乳的基因组宽去甲基化。科学。2009,324(5933):1451-1454。10.1126 / Science.1172417。
- 44。
Baroux C,Gagliardini V,Page DR,Grossniklaus U:多梳组基因的动态调节相互作用:拟南芥印迹基因表达需要MEDEA自动调节。基因发展,2006,20(9):1081-1086.10.1101/gad.378106。
- 45。
Gehring M,Huh Jh,Hsieh T-F,Penterman J,Choi Y,Harada JJ,Goldberg RB,Fischer RL:Demeter DNA糖基酶通过等位基因特异性去甲基化建立MEDEA Polycomb基因自我印记。细胞。2006,124(3):495-506。10.1016 / J.Cell.2005.12.034。
- 46。
于连PE,木下T,辖N,伯杰F:DNA甲基化的维护拟南芥生命周期中为亲本印记是必不可少的。植物细胞。2006年,18(6):1360至1372年。10.1105 / tpc.106.041178。
- 47。
Wenz H, Robertson JM, Menchen S, Oaks F, Demorest DM, Scheibler D, Rosenblum BB, Wike C, Gilbert DA, Efcavitch JW:利用变性毛细管电泳进行高精度基因分型。中国生物医学工程学报,1998,18(1):69-80。
- 48.
Cho RJ,Huang M,Campbell MJ,Dong H,Steinmetz L,Sapinoso L,Hampton G,Elledge SJ,Davis RW,Lockhart DJ:人类细胞周期中的转录调控和功能。纳特·吉内特。2001, 27 (1): 48-54. 10.1038/83751.
- 49.
Fukumura R,Takahashi H,Saito T,Tsutsumi Y,Fujimori A,Sato S,Tatsumi K,Araki R,Abe M:一种敏感的转录组分析方法,可以检测未知的转录物。核酸RES。2003,31(16):E94-10.1093 / NAR / GNG094。
- 50
Reijans男,拉斯卡里斯R,Groeneger AO,贝格A,韦塞林克E,面包车OeverenĴ,解威特E,Boorsma A,Voetdijk B,范德华斯贝克H,等人:的cDNA-AFLP,微阵列的定量比较,以及基因芯片表达数据在酿酒酵母中。基因组学。2003年,82(6):606-618。10.1016 / S0888-7543(03)00179-4。
- 51
robauts S, Van De Peer Y, Rouze P: aflpinsilica,模拟AFLP指纹。生物信息学。2003,19(6):776-777。10.1093 /生物信息学/ btg090。
- 52。
Qin L,Prins P,Helder J:链接CDNA-AFLP的基因表达模式和EST。方法Mol Biol。2006,317:123-138。
- 53。
秦L,王子P,琼斯JT,Popeijus H,Smant G,巴克Ĵ,埃尔德Y:GenEST,利用cDNA-AFLP产生的cDNA序列数据和基因表达型材之间的强大双向链路。核酸研究。2001年,29(7):1616至1622年。10.1093 / NAR / 1616年7月29日。
- 54。
GribnauĴ,Hochedlinger K,畑钾,锂E,詹尼士R:印迹位点的异步复制定时是独立的DNA甲基化的,但具有差亚核定位相一致。基因开发。2003年,17(6):759-773。10.1101 / gad.1059603。
- 55.
Fitz Gerald Jn,Hui PS,Berger F:Polycomb依赖于肌动蛋白调节剂ATFH5的依赖印迹调节拟南芥的形态发生。发展。2009,136(20):3399-3404。10.1242 / dev.036921。
- 56.
Deichsel A,MouyssetĴ,霍普T:泛素选择性伴侣CDC-48 / P97,在DNA复制一个新的播放器。细胞周期。2009年,8(2):185-190。10.4161 / cc.8.2.7356。
- 57.
Park S,Rancor DM,Bednarek SY:在Planta分析ATCDC48A的细胞周期依赖性定位及其在细胞分裂,扩张和分化中的关键作用。植物理性。2008,148(1):246-258。10.1104 / pp.108.121897。
- 58.
Aker J, Borst JW, Karlova R, de Vries S:拟南芥AAA蛋白CDC48A在体内与质膜上的体细胞胚胎发生受体样激酶1受体相互作用。中国生物医学工程学报。2006,31(1):62-71。10.1016 / j.jsb.2006.03.004。
- 59.
Aker J,Hesselink R,Engel R,Karlova R,Borst JW,Visser AJ,De Vries SC:使用Forster共振能量转移荧光寿命显微镜和荧光相关光谱法的拟南芥AAA AAA复合体的体内六种αAAA复合物。植物理性。2007,145(2):339-350。10.1104 / pp.107.103986。
- 60。
Rancour DM, Park S, Knight SD, Bednarek SY:植物UBX结构域蛋白1,PUX1,调节拟南芥CDC48的低聚体结构和活性。中国生物医学工程学报。2004,27(5):531 - 534。10.1074 / jbc.M405498200。
- 61。
Jullien PE,Berger F:亲本基因组剂量失衡解除了对拟南芥印迹的调控。《公共科学图书馆·遗传学》。2010年,6(3):e1000885-10.1371/journal.pgen.1000885。
- 62。
Glover J,Grelon M,Craig S,Chaudhury A,Dennis E:拟南芥MS5的克隆和鉴定:雄性减数分裂的关键基因。植物J。1998,15(3):345-356.10.1046/j.1365-313X.1998.00216.x。
- 63.
Howarth JR,Parmar S,Barraclough PB,Hawkesford MJ:一种硫缺乏诱导基因sdi1,参与硫限制条件下储存的硫酸盐池的利用,有可能作为硫营养状况的诊断指标。植物生物技术杂志。2009,7(2):200-209.10.1111/j.1467-7652.2008.00391.x。
- 64.
陈志刚,陈志刚,陈志刚:拟南芥种子基因研究进展。核酸学报2003,31(1):90-93。10.1093 / nar / gkg028。
- 65.
Tzafrir I,佩纳-城墙R,Dickerman A,伯格男,罗杰斯R,哈钦斯S,理发师TC,McElverĴ,辅助G,巴顿d,等人:用于在拟南芥胚胎发育所需的基因的鉴定。植物理性。2004年,135(3):1206至1220年。10.1104 / pp.104.045179。
- 66.
叶绿体转位子成分Tic40与人类伴生蛋白hsp70相互作用蛋白Hip的功能相似性。中国生物医学工程学报。2007,29(3):427 - 434。10.1074 / jbc.M611545200。
- 67.
WOLF JB:因子核互动可以赞成基因组印记的演变。进化。2009,63(5):1364-1371。10.1111 / J.1558-5646.2009.00632.x。
- 68。
Roberts RJ,Vincze T,Posfai J,Macelis D:rebase - 限制酶和DNA甲基转移酶。核酸RES。2005年,D230-232。33数据库。
- 69。
Goto N, Prins P, Nakao M, Bonnal R, Aerts J, Katayama T:基于Ruby编程语言的生物信息学软件。生物信息学。2010,26(20):2617-2619。10.1093 /生物信息学/ btq475。
- 70
巴雷特T,特鲁普DB,Wilhite SE,勒杜P,Rudnev d,斯塔C,金IF,Soboleva A,托马舍夫斯基男,马歇尔KA等人:NCBI GEO:归档高通量功能基因组数据。核酸RES。2009年,D885-890。37数据库。
- 71
王志强,王志强,王志强,等:拟南芥信息资源(TAIR)的基因结构和功能注释。核酸学报2008,vol . 32, no . 1, no . 2。36个数据库。
- 72
水稻种子发育过程中基因组印迹的调控及适应性研究。植物细胞》2011。
确认
这项工作得到了爱尔兰农业、渔业和食品部门(RSF 07-534)和爱尔兰科学基金会(SFI) (02/IN)对CS的资助。1 / B49和08年/ IN.1 / B1931)。对UG的资金支持也得到了Zürich大学的“Stiftung für wissenschaftliche Forschung”的承认。获得了成本行动FA0903 (HAPRECI)对“利用植物繁殖进行作物改良”的支持。作者感谢匿名评论者的评论和建议。
作者信息
隶属关系
相应的作者
额外的信息
作者的贡献
PMcK设计了测定方法,进行了测序和焦磷酸测序,并编写了手稿。SLD进行cDNA-AFLP筛选,分析TDF数据,并进行焦磷酸测序对照。页了in-silicocDNA-AFLP和TJW共同开发了GenFrag软件。PW从Col-0×Bur-0材料和突变体修饰物的杂交中产生了cDNA序列跟踪。MS进行LCM和RT-PCR实验。MTAD分析和比较数据集,确定候选基因的表达率,准备图S1,格式化并编辑手稿。AF和DD进行qRT-PCR。NTL产生杂交cDNA并进行测序反应。AC鉴定了差异甲基化区域并编辑了手稿。TJW和GS监督了GenFrag的开发。CK和UG协助实验设计,UG监督并资助LCM的性能和相关的表达分析。CS设计实验,为其实施筹集资金,监督实验和项目开发,并准备最终手稿。所有作者都阅读并确认了手稿。
Peter C McKeown、Sylvia Laouielle Duprat、Pjotr Prins对这项工作做出了同样的贡献。
电子补充材料
表S1-开花植物中的已知印迹基因
其他文件1:。在被子植物中,有11个印迹基因被报道拟南芥6种来自玉米,1种来自水稻。除三种外,其余均仅由母体遗传等位基因表达。除了美狄亚,为此,矛盾的报告已经发表(为讨论参见[72.),所有压印拟南芥基因仅在胚乳终末分化时表现为单等位基因表达,而玉米则相反Mee1在玉米胚中清楚地显示印迹表达(文件40KB)
图S1 - GenFrag程序流程图
附加文件2:。通过poly-A捕获角子组织的mRNA,生成转录衍生片段(TDF),然后使用第一次酶切Bst那么MSE我限制酶。将片段连接到适配器并选择性地使用所描述的引物组合选择性放大(附加文件4,表S3).然后在ABI3130XL遗传分析仪上测定转录尺寸。如母体杂种横向所谓的TDF,但从往复交叉缺失的情况下被认为是衍生自候选MEG(附加文件3,表S2). 随后,GenFrag使用公开的拟南芥转录序列将转录序列分配给祖基因。成绩单经过两个阶段生物信息学消解时使用的第一个Bst那么MSE我限制酶以产生每个成绩单的一个片段模仿体外确定基因识别的协议(表1).(PDF 23 KB)
12870 _2011_903_moesm3_esm.doc
附加文件3:表S2 - 如由混合的Col-0×LER-0正反交的cDNA-AFLP跨越3个时间点确定在长角果表达单亲TDF的的相对比例。(医生27 KB)
表S3 -使用GenFrag软件鉴定93个母系特异性表达的TDFs
附加文件4:。用GenFrag分析了93个母系特异性表达的TDFs。利用设计的引物组合预测基因同源性Bst易,MSE切割部位(3理查德·道金斯和图4TH.柱)和通过毛细管电泳测定的TDF大小(5TH.列)作为唯一标识符。预测单个独特的基因是93个母体特异性TDF的52个TDFS(7TH.列,TDFs 1-52)。另外21个TDFs(TDFs 53-73)进行了非唯一预测,另外20个TDFs(TDFs 74-93)无法与GenFrag的任何已知预测相匹配拟南芥序列。对于8个TDF,预测的尺寸(标有*)与毛细管电泳确定的预测尺寸不同,其量在括号中指示的量。(Doc 153 KB)
12870 _2011_903_moesm5_esm.doc
附加文件5:表S4 -由于限制位点缺乏SNPs,所以无法检测到已知的印迹基因。MseI在T/TAA上下文中进行剪切,Bst YI在R/GATCY上下文中进行剪切(来源:SALK SNP viewer, TAIR)。(DOC 37 KB)
12870_2011_903_moesm6_esm.doc.
附加文件6:表S5 -母性表达的种子基因在胚乳和种皮中的相对表达量。通过cDNA-AFLP检测到的母系基因的log2比大于1(表明在胚乳中的表达是种皮的两倍)。(医生27 KB)
图S2 -表达谱分析
附加文件7:ATCDC48,PDE120和MS5样在LCM组织拟南芥种子(4 dap).对LCM胚乳(ES)、种皮(SC)和胚(EM)组织的cDNA进行了RT-PCR,结果显示两个组织的一个代表性重复。ACT11和UBC9用作加载控制(PDF 328 KB)
图S3 - CDNA-AFLP候选基因的母体表达对LER-0的母体表达
附加文件8:。4个DAP组织的cDNA被扩增并从F1 L上测序呃-0×Col-0中杂交种子和MS5样和PDE120发现是母系表达。(PDF 9 KB)
12870 _2011_903_moesm9_esm.pdf
附加文件9:图S4 - 确认六种另外的cDNA-AFLP基因作为种子组织母体。来自F1 4 DAP种组织的cDNA被扩增并测序。在每种情况下,来自Col-0×C24的cDNA在左侧示出,右侧显示C24×COL-0。SNP标有星号。(PDF 46 KB)
作者的原始提交的图像文件
权限
开放获取本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0),允许在任何媒介中不受限制地使用、分发和复制,前提是原作被正确引用。
关于这篇文章
引用这篇文章
McKeown的,P.C.,Laouielle-DUPRAT,S.,普林斯,P.等等。印迹基因的鉴定受亲本特异性表达的影响拟南芥种子。BMC植物BIOL.11,113(2011)。https://doi.org/10.1186/1471-2229-11-113
收到了:
接受:
出版:
关键词
- 种皮
- 印记基因
- 激光捕获显微切割
- 种子组织
- 胚乳组织