摘要
背景
令人毛骨悚然的霉菌,由oomycete造成的霜霉,是一种严重的疾病vitis.酿酒用葡萄,最常见的葡萄树脂。几个野生vitis.相反,已发现物种对这种病原体具有抗性,并已被用作将抗性渗入到一种V. Vinifera.背景。斯蒂骨代表葡萄葡萄酒中的主要植物脂蛋素,它们的毒性与特定化合物密切相关。本研究的目的是评估阻力响应p . viticola通过在感染后谱分析整个人口叶片的斜纹含量和感染后的抗性和易感个体的转录组的倍细×Teroldego十字架。
结果
对人工接种的响应的三年分析表明,个体分布在九个类别中,范围从总抗抗敏感性。此外,使用HPLC-DAD-MS进行群体中斯蒂屈曲的定量代谢物分析,确定了根据存在的浓度和它们谱的复杂性不同的三个不同的基团。高生产商的特征在于存在trans白藜芦醇,trans-piceid,trans-Perostilbene和最多十三种不同的Viniferins,葡萄藤中的九个新。
这些化合物的积累与抗性表型一致,表明它们可能有助于抗性反应。
使用cDNA-AFLP选择一组由Oomycete以抗性基因型调节的一组基因的初步转录研究。然后通过比较微阵列分析评估该组在后代群体的抗性和敏感基因型的表达。
发现了一组57个基因在耐药基因型中专门调节,表明它们涉及葡萄 -p . viticola不兼容的交互。这些转录本的功能注释表明,它们属于防御反应、光合作用、初级和次级代谢、信号转导和转运等类别。
结论
这项研究报告了一个葡萄种群分离抗性的代谢和转录分析的结果p . viticola.鉴定一些抗性个体并进一步在分子水平上表征。这些结果对未来的葡萄养殖计划有价值。
背景
培养欧洲vitis Vinifera L..生产高品质的葡萄,但容易发生几种疾病。然而,该属的其他物种vitis.,最初来自东亚和北美洲和中美洲,已被描述为几种病原体部分或完全抵抗1-4.].其中,oomycete霜霉(伯克。和柯特。)贝尔。De Toni是世界各地葡萄生产的主要问题。在敏感的品种中,这种生物养殖病原体迅速侵入感染的叶片,导致淡黄色油性斑点和下侧的大量孢子[5.].侵袭也发生在抗性基因型中,但通过组成型和感染后抗性机制的组合迅速阻断增殖[6.那7.].
确实,耐药vitis.物种可能受益于较高水平的组成型抵抗力p . viticola[8.-10]显示感染后抗性机制,触发反应性氧物质,抗微生物酚类化合物以及病因相关蛋白和过氧化物酶的积累[3.那11-13].这些事件导致细胞的形态变化,包括细胞壁增厚,坏死和某些情况下局部过敏反应(HR)[12那14那15].
二苯乙烯类是葡萄藤中主要的抗菌酚类化合物[16-19],它们可能在木质化器官中组成表达[20.-22在葡萄里[23],或可能由真菌感染引起[17]、非生物压力或诱发因子[24-27].
葡萄抗性机制的复杂遗传基础p . viticola通过定量性状的基因座(QTL)分析对抗性和易感物种的基因组表达研究进行了广泛的分析。QTL研究已经确定了一些主要的电阻基因座[28-32它们富含抗性基因类似物(RGAs)。葡萄亲和和不亲和相互作用的转录组分析[6.那33那34在这两种情况下,强调了植物反应的复杂性,并强调了整个转录组的很大一部分被调节,尽管这在不相容相互作用中发生得更早,强度更大。
在目前的工作中,我们研究了抗p . viticola通过测定整个群体的斯蒂骨曲线和抗性和易感个体之间的转录组差异来进行混合(m)×teroldego(t)十字架p . viticola感染。这项研究是更广泛的耐药性机制调查的一部分p . viticola在M × T杂交中,包括所有viniferins的分离和结构表征[35],以及用HPLC-DAD-MS定量分析葡萄叶中病毒的新方法的验证[36].
结果
分离的P. viticola-抗性表型与后代群体二苯乙烯含量
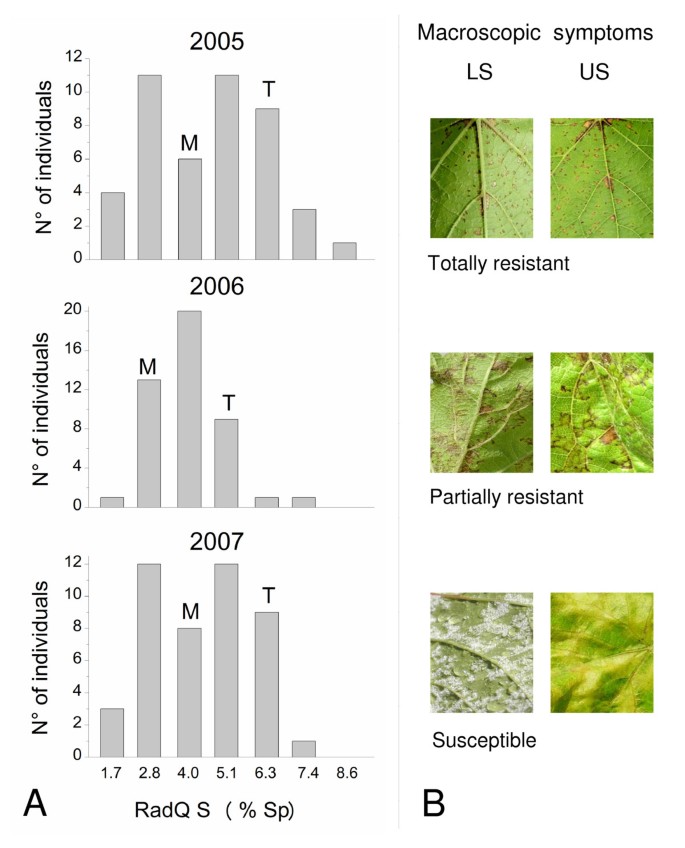
灵敏度的连续变化p . viticola作为下叶表面上的孢子花束(%SP)的百分比面积,在三个不同年份进行的所有感染实验中,在M×T群体中发现了在M×T群体中(图1).分布的两尾分布着一侧表现出完全抗性的个体,另一侧则是完全易感的个体。前者的特点是小的坏死HR点和没有产孢,而后者则表现为弥漫性褪绿,黄色油斑和高产孢(图)1 b).
三年的分布比较突出了观察表型的变异范围的一般守恒,以及表型课程的频率的差异。这种表型似乎取决于环境因素。特别是,在2005年和2007年,后代的平方根转化%SP值(RADQ S)具有双峰分布,而2006年中央课程较为填充分布正常趋势。
使用OIV452描述符评估霜霉病的敏感性[37,该研究考虑了所有的植物症状,而不只是孢生面积,发现个体分布在9类,从全面抗性到全面易感(附加文件1).
在这三年中,无论症状的严重程度如何,父母们都表现出一定程度的变异性,其中一位被证实是部分抗性(M),另一位是易感(T)。有趣的是,对p . viticola分离群体中鉴定的抗性性状大于亲本界定的抗性性状,表明抗性性状发生了越位分离。
改进的版本[36]先前方法的[38那39用于测量在射击的第二和第三片叶片的汇集样品中的106个体的感染叶中的斯蒂屈氏纤维积累。在感染后6天(DPI)的6天内分析总斯蒂甲酸含量(DPI),人口的个体被分为三个不同的群体(附加档案1).高生产商(18个体)的总斜纹含量最高,平均值为78.8μg/ g鲜重(FW)和146.3μg/ g fw至19.8μg/ g fw的范围。第二组低生产者是最大(66个个体),平均斜纹含量为2.7μg/ g fw(范围15.4μg/ g fw至0.2μg/ g fw)。剩下的22个个体被认为是非斯蒂骨素生产者,浓度低于定量极限。
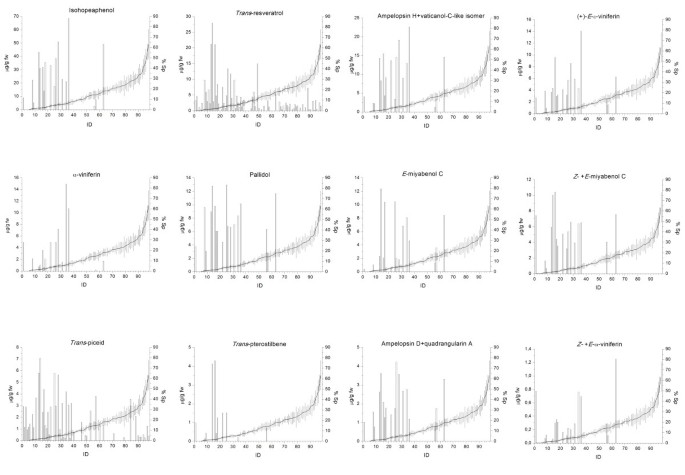
在6 dpi时,我们能够在高产组中鉴定出3个单体二苯乙烯和13个二苯乙烯类viniferin,包括白藜芦醇的二聚体、三聚体和四聚体。其中一些,例如trans白藜芦醇,trans-piceid,trans-pterostilbene,(+) -E.-ε-viniferin,α-viniferin,E.-miyabenol C和pallidol已经在葡萄藤中发现,在某些情况下与植物对真菌攻击的反应有关[18那39-41].此外,我们还鉴定和量化了其他的葡萄素(葡萄糖苷D、四角素A、Z.- 和E.- - - - - -ω-viniferin,Z.- 和eMiyabenol C,Isohopeaphenol,Ampelopsin H和vaticanol-C样异构体)葡萄葡萄酒中未被发现,可能有助于p . viticola阻力。这些化合物已由Mattivi分离并进行结构表征等.[35].不同二苯乙烯类化合物的相对含量差异很大,异希望酚含量最高(在2.6 ~ 68.4 μg/g fw之间)Z.- 和E.-ω-葡萄素最低(低于1.25 μg/g fw)。它们在高二苯乙烯类生产者中的分布也是高度可变的,表明立体特异性氧化反应导致不同基因型受感染叶片中不同的viniferin模式(附加文件2).
从图中也可以看出这一点2在感染后观察到的不同尖端和孢子率之间存在负相关性。凭借很少的例外情况,高生产商也是孢子症症状最小的个体。在单体斯蒂芬内斯的情况下,这并不存在真实trans-Resveratrol和trans-piceid,也在高产孢率的个体中发现,是唯一在低产孢率的个体中检测到的二苯乙烯(图)2和额外的文件1).
抗性和敏感基因型的基因表达分析
后代人群的表型和代谢谱分析显示了后代抗性之间的正相关性p . viticola以及它们叶子中二苯乙烯的含量。为进一步研究植物的抗性反应p . viticola我们利用了一个越位基因型(F1 21/66),表现出几乎全抗性和高含量的二苯乙烯类化合物。对F1 21/66基因型及其抗性亲本Merzling在感染后不同时间进行cDNA-AFLP分析。的表达式配置文件p . viticola然后通过靶向的微阵列分析验证了响应基因,这也使我们能够比较F1 21/66基因型与两个易感型的表达响应(Teroldego和F1 22/73)。
cDNA-AFLP分析
进行CDNA-AFLP分析以研究在抵抗力期间发生的转录变化p . viticola在几乎完全抵抗的后代21/66和部分耐父母混合中。
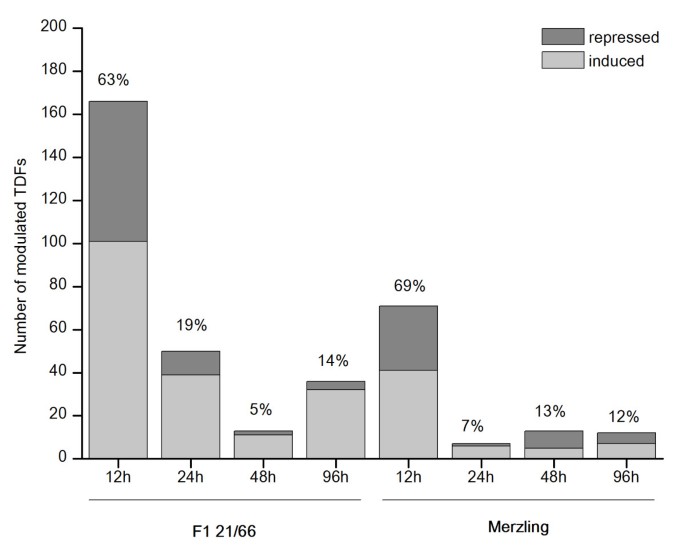
使用128种不同的BSTYI + 1 / MSEI + 2引物组合(PC)来监测约7,000种转录物衍生片段(TDFS)的表达以进行选择性扩增。对于每台PC,我们能够可视化55到75件碎片,大小为50-1000英镑。通过将治疗样品(12,24,48,96小时后感染 - HPI后96小时后的条带的强度与所述对照中的那些(Mock-Inoculation-HPMI后0小时)进行比较,四百TDF在感染时显示调节表达谱。有趣的是,400个TDFS的272名(68%)仅在F1 21/66基因型中进行调制,而不是在父母混合中进行调制。此外,400转录物的调节的动力学不同。两种基因型中的两个主要基因表达模式是主要的:一大群早期调制基因,似乎在12hPI内接通(63%在F1 21/66和69%的erzling中的69%)和一组后期活化基因从48个HPI调制(在F1 21/66中的19%和Merzling的15%)。诱导的TDF的级分通常大于两组中的压抑;这种抗性后代的后期基因更加明显(图3.).
通过cDNA-AFLP分析揭示了葡萄球菌感染的转录本.代表转录物衍生片段(TDF)的数量,诱导(浅灰色)和抑制(浅灰色),在F1 21/66和12,24,48,96 HPI中诱导(浅灰色)和压制(浅灰色)的数量。p . viticola.每个时间点的调制片段的总百分比显示在每个条形图的上面。TDFs的完整列表可以在附加文件中找到3..
将差异表达的片段从凝胶中切除,并使用适当的选择性pc进行PCR扩增(数据未显示)。PCR产物获得278条优质独特序列(70%)。278个TDFs中,265个在F1 21/66中被调制,103个在Merzling中被调制。其余的序列不是唯一的,不能明确地归属,可能是因为两个或更多的共迁移片段。
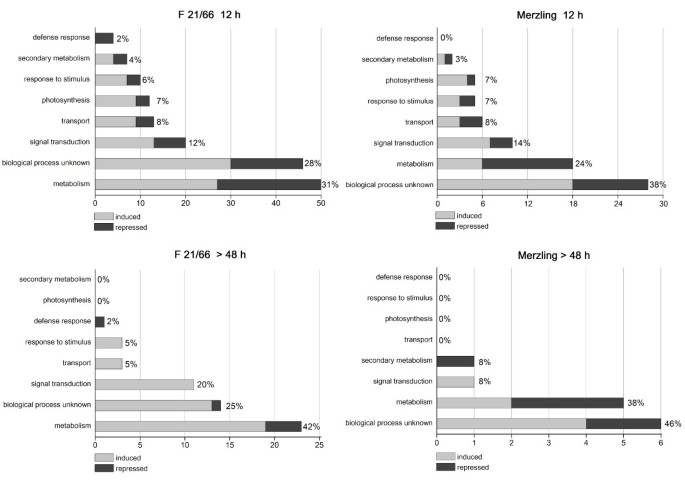
在278个序列中,261与数据库匹配,并在功能上注释(附加文件3.).其余17个序列与任何重要数据库不匹配,也不匹配已知的Phytophthora.SPP。源自序列Phytophthora.基因组序列[42].使用基因本体(GO)分类对278份转录本进行自动注释[43],然后进一步手工策划。TDFs被划分为8个GO功能类别,并在早期和晚期调节转录本之间以及两种基因型之间进行区分,如图所示4..
在F1 21/66中调制的功能类别的转录物和混合在感染时p . viticola.在F1 21/66中调制的转录物和在12hPI内的混合中,并在48 HPI之后,根据文献的证据手动修改的自动注释,将48个HPI分配到8个功能类别。诱导基因以深灰色的浅灰色,抑制基因表示。每个类中的TDF的总百分比显示在每个栏旁边。注释的详细信息在附加文件中给出3..在这两种情况下,每个TDF在多于一个时间点调制时才计算一次。
主要代谢是两种基因型中最大的代谢类别,其次是信号转导、转运、光合作用和对刺激的反应。有趣的是,防御反应和次级代谢类的基因在抗性基因型中被高度调节,主要发生在前24 hpi。正如预期的那样,从48 hpi开始的后期TDFs数量减少,同时功能类别也减少了。两种基因型的大量调控转录本的功能尚不清楚。
微阵列分析
通过CDNA AFLP分析鉴定的转录物用于设计一种定制的寡核微阵列,用于研究耐母萜泡和22/73后代的抗性F1 21/66的抗性响应,易于真菌。除了278个TDF之外,还包括代表另外72个基因已知参与植物 - 病原体相互作用的探针。阵列与从0 HPMI(对照样品),12和96 HPI(处理样品)收集的三种基因型的叶子中提取的总RNA杂交,(额外文件4.).之所以选择这些时间点,是因为它们与在cDNA-AFLP实验中观察到的转录调控的早期和晚期相对应。
对处理样品的比较分析与每个基因型内的对照样品分别在F1 21/66,Teroldego和F1 22/73中突出显示93,45和36个调制基因(附加文件5.).在F1 21/66,42中的93个调制基因中显示出与cDNA-AFLP分析中相同的轮廓,尽管采样时间仅部分重叠。
在抗性基因型的93个调控基因中,有19个在易感个体中表达上调。这类基因主要分为三类:对刺激的反应、初级代谢和光合作用。有57个基因只在抗性基因型中被调节。其中48例在96 hpi时表达上调,4例在12 hpi时表达上调,其余5例在某一时间点表达下调。这些转录本中有一些属于防御反应、光合作用和初级代谢,还有一些属于次级代谢、信号转导和转运的主要功能类群。我们还在易感个体中发现了一组特异性调控的基因,其中13个基因在Teroldego和11个子代(5个诱导和6个抑制)均在12hpi和96hpi水平上被诱导。
通过逆转录定量聚合酶链反应(RT-QPCR)分析,验证了9种差异表达转录物的9个差异表达转录物的微阵列数据,其相对表达从0.17倍达到6.8倍验证(RT-QPCR)分析(附加文件6.).选择它们是因为它们与耐药过程有关,也因为在对照和处理样品之间的折叠变化有很大的差异。如附加文件所示6.,与阵列数据有良好的一致性,在某些情况下,RT-QPCR确定的变化的大小揭示了更大的差异表达,表明微阵列结果低估了基因表达的实际变化。
讨论
与此相反葡萄,欧亚亚洲,美国和亚洲野生葡萄种类的物种通常是抵抗力的霜霉,与发生在同一栖息地的霉菌共同进化。有令人信服的证据表明存在多样性p . viticola为机制(3.那12那14那15它们可能依赖于对通用激发子或编码的特定激发子的识别Avr的基因,如其他模型所示[44那45].
在这项研究中,我们使用代谢和转录分析的组合来调查p . viticola在葡萄植株的抗性中,通过杂交Merzling(一个复杂的杂种)所产生的后代群体V. Vinifera.XV. Rupestris.X诉lincecumii) 和V. Vinifera.Teroldego。这个群体显然是被隔离的p . viticola阻力。个体对卵菌的敏感程度表现为由少数显性效应的主要qtl控制的典型性状分布,与文献[28那29那31那32].
葡萄藤中经常观察到的一种防御机制是二苯乙烯家族植物抗毒素的积累[17-19那39].我们测量了接种6天后整个种群叶片中单体二苯乙烯和所有低聚二苯乙烯类化合物的浓度,发现二苯乙烯类化合物的类型和相对数量(剖面)存在很大差异。此前有报道称健康葡萄中含有不同水平的白藜芦醇单体和低聚物[23那46,但也存在于受感染的叶子中,它们与基因型的易感性有关p . viticola[19那47].据估计,接种叶片中二苯乙烯类化合物的浓度范围从小于1 μg -1 fw到大于100 μg -1 fw,这表明至少有一些二苯乙烯类化合物以对病原体有毒的浓度存在(Smith [48])。使用分离的二苯乙烯类化合物进行活性测定的结果将使我们得出最终结论。值得进一步研究的是,对二苯乙烯类化合物在染病叶片中的积累和传播进行详细的动力学分析,以证实本研究得出的相关性。我们在6 dpi区间进行分析,因为这个区间是区分不同基因型中二苯乙烯类植物抗毒素生产的理想区间,如Vrhovsek所强调的等.[36].
我们的数据间接证实了这一点trans-白藜芦醇及其糖化形式trans-piceid不是本身非常有毒的反对p . viticola如前所述通过直接测定(Jeandet审核等.[17])通过对oomycete不同程度的抗血糖基因型的分析[18那19].取代的类型和寡聚化状态在确定二苯乙烯作为植物抗毒素的作用中似乎是重要的[18那19那47].实际上,两种白藜芦醇单体在大多数易感基因型中发现,而白藜芦醇低聚物几乎完全在抗性后代积累。有两种例外:三种基因型,具有可检测的低聚物水平,但显示中间孢子(≥15%)和一组基因型,没有可检测或非常低的低聚物水平,但仍然耐受p . viticola.两组个体代表了高度有趣的材料,用于进一步分析,特别是后一种组,其阻力可以归因于不涉及viniferins存在的不同机制。
有趣的是,对于抵抗性状分配和斯蒂尔贝特概况而言,人口包括违规成员,该成员在父母界定的范围之外表达了正在调查的特征。因此,我们的转录分析包括F1 21/66基因型。
一些研究已经证明了这一点V. Vinifera.经历强烈的转录调节p . viticola感染以预防病原体入侵[6.那33那34]但是在不相容的反应情况下,反应似乎更具变量。在相互作用中报道了非常有限的基因调制V. Aestivis.和erysiphae necator.[10,而最近则研究了两者之间不相容的相互作用V. Riparia.和p . viticola反而揭示了一个明显的转录变化[6.].
为了研究基因在我们病理系统中的表达反应,我们使用cDNA-AFLP和寡核苷酸阵列技术对耐药和易感个体进行了比较分析。微阵列实验突出了耐药基因型和易感基因型在感染时的不同行为。在21/66后代中有比Teroldego和22/73后代高得多的调节转录本。值得注意的是,这项研究的设计不允许我们将这一结果扩展到没有出现在基因阵列上的那部分基因。
F1 21/66调制基因的一半具有在cDNA-AFLP实验中观察到的相同型谱,并且通常上调(附加文件5.).然而,在调制的时间上存在差异:在微阵列实验中,基因诱导主要在12hpi后检测到,而在cDNA-AFLP研究中,53%的基因已经在12hpi诱导。这种差异可能在于dna - aflp研究中考虑的采样次数较多,而且事实上微阵列技术比基于pcr的dna - aflp技术更不敏感。在最近的一项研究中发现了类似的技术差异,该研究涉及对大麦叶条病抗性的分子分析[49].
在抗性后代的93个调控基因中,只有19个在易感个体中被诱导。这类基因包括转录和翻译激活相关蛋白的编码基因,即延伸因子1- α [DFCI:TC96066]和五五肽重复含蛋白[DFCI:TC91629],以及相变相关蛋白[GenBank:JG391699,DFCI:TC93391]和一种脂质转移蛋白[DFCI:TC90421]在其他植物-病原体互作中激活[50那51].它们的早期上调,在12 hpi范围内,表明在抗性和敏感基因型中识别通用诱导子后,代谢重编程和植物防御反应。
特别值得注意的是,在抗性基因型中只有57个基因被调节。考虑到卵菌的功能类别,以及在某些情况下受卵菌影响的特定基因,我们认为在我们的研究中观察到的抗性机制与在V. Riparia.后p . viticola感染(6.].
编码用于识别和信号转导组分的基因,例如两种受体样蛋白激酶[DFCI:TC80277,GenBank:JG391865]和一个TiR-Nbs受体[DFCI:TC98959]略微活化。依赖钙依赖性蛋白激酶[DFCI:TC79194]也在抗性后代进行特异性诱导,表明该次要信使可能在防御反应中发挥作用。然而,主要作用似乎是乙烯作为信号分子的播放。涉及乙烯生物合成的几记录物[DFCI:TC98757,DFCI:TC89222,DFCI:TC77376,DFCI:TC75061]以及下游乙烯响应因子[DFCI:TC92107,DFCI:TC89392]似乎被诱导。有趣的是,我们发现了编码的基因的转录激活V. Vinifera.卵黄素样蛋白[Genbank:Y10992]和β1,3-葡聚糖酶[Genbank:AJ277900],其分别属于5级和第2类相关蛋白质。有几项研究证明亚乙烯调节葡萄葡萄葡萄葡萄葡萄葡萄葡萄葡萄葡萄葡萄葡萄葡萄葡萄葡萄葡萄葡萄 - 5和PR-2基因[52]并表明了这些游戏在抵抗生物营养和病症病原体的作用[53].与之前的报告一致p . viticola-受感染的葡萄藤叶盘[12[我们还观察到PR1 [Genbank:AJ536326]的积累,PR10 [Genbank:AJ291705]转录物在96 HPI。
通过调节纤维素合酶转录物的稳定状态,在转录水平上严格控制白藜芦醇积累[54],在开发期间都是[23]并且在elicitation下[24-27].但是,到目前为止没有确定转录调节因素。如预期的那样,我们发现两种斯蒂替斯合酶,[Genbank:S63225] [55]和[GenBank:X76892] [56],在96 hpi时在抗性个体中被激活。另一方面,在易感基因型中未观察到调控。诱导的时间与我们的生化结果和文献一致[47].特别地,在12至96hpi之间的同种型[Genbank:S63225](在RT-QPCR中检测到的12次)的强大上调确实与六天后抗性后代积累的Viniferins的复杂型材相容感染。
有趣的是,通过cDNA-AFLP分析发现,两个过氧化物酶基因[DFCI:TC81349, DFCI:TC56380]在24 hpi的抗性后代中诱导表达。过氧化物酶是已知的催化氧化的trans-白藜芦醇在H2O.2,产生白藜芦醇自由基,然后低聚形成二苯乙烯类低聚物[57那58].
我们发现三种诱导属于苯丙醇丙烷代谢的基因,编码含咖啡合器-CoA O-甲基转移酶[GENABANK:Z54233],一种类黄酮3',5'-羟化酶[GENABANK:CF404908]和二氢烷烃还原酶[GENBANK:X75964].虽然我们没有检查在感染的叶片中的单醇素和花青蛋白的积累,但是已知他们在植物的防御反应中发挥作用。单醇素对细胞壁增强是必不可少的[59]原花青素是病原体的毒性化合物[60那61].
生物营养相互作用中的防御反应还涉及主要代谢重编程[6.].在我们的研究中,几种可能与蛋白质退化相关的基因似乎被诱导p . viticola在耐药基因型中,如前所述用于其他植物病原体相互作用[62].
有趣的是,在感染时诱导了一个带环- h2结构域的泛素e3连接酶[DFCI:TC101906]和一个泛素蛋白[DFCI:TC85973]V. Riparia.[6.].许多其他编码蛋白质分解酶(羧肽酶、氨基肽酶)和碳水化合物(淀粉酶)的基因也在96 hpi水平上调。
特异于易感个体的26个调制基因的大多数原因被诱导(74%),但在易感基因型中没有表现出相干的表达谱。因此,这种分析并没有让我们得出关于葡萄冠的机制的结论 -p . viticola兼容性,因为这些基因中的16个在抗性基因型中显示出相同的cDNA-AFLP轮廓。
在调制的基因中,我们发现15个基因,其调节表达在抗性与两个易感基因型中没有共同规则。This group contained genes encoding for a plastidic aldolase [GenBank:JG391820] and for photosynthetic proteins such as chlorophyll a-b binding proteins [DFCI:TC93431, GenBank:JG391764, DFCI:TC84281, DFCI:TC73356], a cytochrome b [DFCI:TC78321] and a ribulose 1-5-bisphosphate carboxylase/oxygenase activase [GenBank:JG391868]. Most of the genes were already down-regulated in Teroldego at 12 hpi and highly activated in the resistant offspring, mainly at 96 hpi. Down-regulation of photosynthesis-related genes following pathogen infection in susceptible genotypes during compatible interactions has already been widely reported [10那33那63-65].如图所示,在这里报道的抗性基因型的上调已经在少数情况下描述了[66].这可能是细胞为防御反应而采用的另一种策略,而不是前面描述的转化酶活性的诱导p . viticola感染(6.].
结论
本文报道了从葡萄杂交群体(Merzling × Teroldego)中选择的抗霜霉病和敏感个体的生化和转录组分析,分离出抗性和二苯乙烯含量性状。
结果表明,二苯乙烯类植物viniferins浓度与侵染过程呈显著负相关。此外,对感染后的抗性和易感个体的全面转录组分析导致了一组在抗性基因型中特别调节的基因的鉴定,这应该在未来的育种计划中考虑。
方法
植物材料,接种物和植物感染方法
一个由猫鼬(M)衍生的种间居群V. Vinifera.从天而降葡萄属rupestris和肺炎林科利)×V. Vinifera.cv Teroldego (T)具有抗性p . viticola以及感染时二苯乙烯类化合物的积累。杂交是埃德蒙·马赫基金会开发的,由255个后代植物组成。在255个F1个体中,每年将木插枝嫁接到KOBER 5BB砧木上进行复制。在日光温室中,在25°C/20°C昼夜温度、16 h光周期、相对湿度(RH)为70±10%的条件下,将植株置于1L的花盆中,花盆内填满土壤:沙子:泥炭:蛭石(3:1:3:3,v/v)。孢囊梗的p . viticola(伯克。和柯克)贝尔。从感染的叶子收集et de toniV. Vinifera.CV通过刷牙在冷的Bidistillaped水中叶子下面的白色模具通过刷牙,CV松弛GRIS植物。通过喷洒10分的共分悬浮液,将植物完全扩张为8至10周嫁接植物4./ 105.孢子/ ml到轴向叶片表面上,并在24℃下在生长室中保持过夜,含有80%RH。然后将受感染的植物转移到温室中并保持在与上述相同的条件下。通过在温室中喷洒蒸馏水来获得模拟接种的植物。
根据每一项分析(表型评价、二苯乙烯类分析、基因表达分析),根据实验设计组织植株。
对抗性的表型评估p . viticola
255个亲本加104个、87个和86个F1个体进行抗性评分p . viticola分别在2005年、2006年和2007年。
植物反应被标记为感染后10天可见坏死的存在或不存在(dpi)。通过在所有复制的所有受感染叶片的下叶表面目测产孢面积百分比(% Sp)来评估产孢程度。67].为每个单独计算平均值和标准错误。通过视觉指数,OIV452描述符,由Office International de la Vigne et du Vin推荐的视觉指数同时评定植物反应和孢子水平的幅度[37].根据不存在或存在可见坏死及其大小以及孢子状面积的缺失或存在,以及孢子囊的程度,分配来自1(最容易受影响)至9(最抗性)的分类值:1:Sporangiophores密集地覆盖整个叶面积,弥漫性萎黄,没有坏死;3:占主导地位的致密孢子,氯化区域,没有坏死;5:稀疏孢子的斑块与无症状区域相同混合,孢子状区域下的坏死斑点;7:具有稀疏孢子囊的小斑点,具有人力资源的坏死病变的同心发育;9:缺乏孢子囊,小坏死斑点,人力资源。偶数甚至用于描述中级类别。
的缺席p . viticola在对照植物的所有叶片上证实了症状。
通过应用于%SP值的单样本Kolmogorov-Smirnov测试评估孢子形值的正常分布,使用统计数数据分析软件版本6(Statsoft,Tulsa,OK)的平方根转换(RADQ S)。
斯蒂屈含量分析
在2005年收获期间,在6 dpi和0 hpmi收集来自每个基因型的一个生物学复制的第二和第三叶。收集的所有叶片储存在-20°C直至分析。样品制备和HPLC-DAD-MS分析的条件与Vrhovsek中所述相同ET.AL..[36].通过将保留时间,MS和UV光谱与真实标准的保留时间,MS和UV光谱进行比较,并通过使用外标方法在280nm和310nm处通过UV-VIS检测来鉴定斯蒂替斯单体和斜脂蛋白低聚物。反式-Resveratrol,trans-piceid和IS (trans-4-羟基二苯乙烯(-4-hydroxystilbene))的单体在310 nm处进行紫外-可见检测。二聚体((+)-eε-viniferin,Z.- 和E.-ω-viniferin,Ampelopsin d和Quadrangularin a),三聚体(Z.-miyabenol c和e根据分离的化合物的校准曲线定量Miyabenol C和α-viniferin,与四聚体(异ohealphenol,Ampelphen in H和vaticanol-C样异构体)。Pallidol表示为Ampelopsin H,trans-Perostilbene表示为相当于trans白藜芦醇。由于黄烷醇类同分异构体和蛇葡萄素H的同源性,两者的和被表达为蛇葡萄素H,由于同源性Z + E-miyabenol C,两者的和表示为Z.-miyabenol C,由于coelutionZ + E-ω-viniferin的和表示为E.- - - - - -ω-viniferin。所有浓度均表示为毫克/公斤鲜重(fw)。
cDNA-AFLP分析
分别从F1 21/66和Merzling的12、24、48和96 hpi的5个生物重复中采集用于分析的叶片(从顶端第2和第3个)p . viticola2005年夏季在0 hpmi (C)时,立即在液氮中冷冻,-80°C保存。根据Moser的说法,总RNA从第二和第三片冷冻叶子的混合样本中提取等.[68],由Nanodrop 8000 (Thermo Scientific)进行量化,并使用安捷伦2100生物分析仪(安捷伦技术)进行质量检查。
双链cDNA合成和cDNA- aflp程序如Polesani先前所述等.[33],从2μg的总RNA开始,使用Bstyi和Msei作为限制酶。共进行总共128个选择性扩增33P-labeledBst每条引物含有一个额外的选择性核苷酸。扩增产物被分离,凝胶被扫描,如Polesani所述等.[33].通过对接种和对照样品有关的差异表达的转录物通过视觉检查进行放射显影膜,并且在视觉上进行视觉评分和将术语U分配给感染样品中的术语u℃,d至受感染样品中的下调的那些。'和感染或喷水处理后相同概况的人(附加文件3.).为了验证cDNA-AFLP数据的重现性,从两个独立的预扩增产物开始,对6个引物组合进行2次选择性扩增反应。从凝胶中提取差异表达转录本对应的条带,用100 μl无菌双蒸馏水洗脱。以5 μl为模板,用与选择性扩增相同的非标记引物进行再扩增。
通过将1.5μl的外切核酸酶 - 磷酸酶(Exosapit,Amersham)加入到每个5μlPCR产物中以37℃加入45分钟,然后在75℃下孵育15分钟,然后直接测序,然后直接测序PCR产物。
序列分析和注释
通过用爆炸进行同源搜索分析序列[69]查询以下数据库:NCBI的EST数据库[70] DFCI葡萄基因指数(第6.0版)[71],IASMA葡萄基因组数据库(3.0版)[72], NCBI的RefSeq爆炸数据库[73]和uniprot [74].爆破结果(爆破-n: E-value < 10-10年,爆破-x: e值< 10-6)通过GO相关条款,通过在内部开发的注释的“Argot”工具进行了分析[75]高度置信(ID> 80%)。自动注释结果被手动检查并与文献中的证据支持的“生物过程”条款相结合。最后,分配给功能类别的序列。
序列数据已储存于NCBI的EST数据库[70登录号:JG391664-JG391941。
Combimatrix阵列设计
考虑在微阵列上表达的基因包括那些包含278个cDNA-AFLP片段的基因,这些片段根据基因型/治疗表现出不同的条带强度,并给出了高质量的序列,除了在文献中报道的可能或证明在病原体防御中有作用的72种蛋白质编码。对于大多数序列,两个探针被设计在不同的区域,而在非定向序列的情况下,两个探针被设计在每个方向,并在探针的名字后面加上后缀“RC”R.ewerve.C杂项股。共有1530个探针在习惯array 4×2240微阵列载玻片(Combimatrix Corp.,WA)的每个扇区上。阵列中还包括病毒和细菌(Combimatrix Corp.,WA)和四个推定的家务基因的阴性对照探针。
杂交和微阵列分析
将F1 21/66、F1 22/73和Teroldego接种后的两个生物复制的18个总RNA样品进行杂交探针p . viticola以12和96 hpi采集,或用水喷洒(C)。
使用氨基烯丙基Messageamp™II ARNA扩增试剂盒(AMAMION,USA)扩增总RNA(1μg),并将得到的AMININALLL-ARNA与荧光标记(CY-5)缀合。通过分光光度法(ATI Unicam)量化纯化的标记的AARNA,并且根据制造商的方向将2μg与定制COMBIMATRIX阵列杂交。每次杂交重复三次。根据制造商的协议进行预杂交,杂交,洗涤和成像[76].
使用ScanArray4000XL扫描阵列(Perkin Elmer,美国),并将TIF图像导出到MicroArray Imager 5.8 (Combimatrix,美国)进行密度分析。根据[49经过一些修改。简单地说,为了排除坏斑(基于斑点饱和度和不均一性),对图像进行斑点标记和视觉检查。对原始数据进行分析,并通过分配零权重将负面标记点排除在进一步分析之外。只有信号强度至少为500荧光单位的探针[77对所有生物复制进行进一步分析。使用肌动蛋白和Ufgt(UDP-葡萄糖:黄酮3-O-葡糖基转移酶作为参考基因。标准化的中值强度值是LOG2转换的。
对于每个数据集,对归一化的log2转换值进行皮尔逊相关检验,以评估技术和生物重复中的变异性。每个个体的数据集在计算每个探针技术重复标准化值的平均表达值(由于得到的皮尔逊系数的范围)后独立进行分析(附加文件)4.).统计分析前,将杂交技术重复的归一化值计算平均值(log2 -均值)。对于每一个个体,将归一化后的值按收获时间点分为三组进行比较。通过进行微阵列的显著性分析(SAM)多类比较,确定了三个具有高数量显著差异表达基因的数据集[78]使用tiger多实验查看器[71],并规定错误发现率(FDR) < 5%,如[6.].SAM输出进一步限制在mRNA表达变化大于或等于1.5倍的基因中,至少在两个分析的表达点中的一个。对于那些发现两个寡聚体显著差异表达的基因,从每个时间点的中值强度值计算平均值(附加文件5.).
表达数据已沉积在NCBI的基因表达式综合症中[79],可通过GEO系列登录号GSE28851访问。
实时RT-PCR分析
逆转录定量聚合酶链反应(RT-qPCR)总RNA与阵列杂交相同。对于每个时间点,首先用RNase free- rdnase (Ambion)处理RNA,然后根据制造商的说明使用Superscript™III逆转录酶试剂盒(Invitrogen)进行第一链cDNA合成。使用SYBR Green PCR主混合剂进行扩增,如[23],使用设计在同一基因组区域内的基因特异性引物,其中局部分析的寡核苷酸分析(参见附加文件6.对于序列)。循环条件为:50℃,2分钟,95℃,2分钟,然后40个循环为95℃,15秒,60℃,1分钟。用ABI棱镜7000序列检测系统(应用生物系统,福斯特城,CA)进行三份定量测定。使用龈臂7000 DS软件分析原始数据以提取CT值。将基线校正的数据导入LinRegPCR软件以计算反应效率[80那81].然后根据Pfaffl的等式计算每个基因(靶)的相对表达[82)使用肌动蛋白为标准化(参考)和喷水控制作为校准样品(对照),它代表感兴趣基因的1X表达。平均归一化表达式的总体标准误差(SE)采用基于REST开发的Taylor级数的误差计算得到©.软件(83].
缩写
- cDNA:
-
互补脱氧核糖核酸
- 美东时间:
-
表达序列标签
- 地理:
-
基因表达综合
- HPLC-DAD-MS:
-
高效液相色谱-二极管阵列检测-质谱法
- NCBI:
-
国家生物技术信息中心
- RT-QPCR:
-
反转录定量聚合酶链反应
- 山姆:
-
微阵列的意义分析
- TC:
-
暂定共识。
参考
- 1.
Staudt G,Kassemeyer HH:对野生泻药的柔软效力评估vitis.物种。血管。1995年,34:225-228。
- 2.
Denzer H, Staudt G, Schlosser E霜霉耐药性和易感性葡萄葡萄园品种。血管。1995年,34:113-117。
- 3.
Kortekamp A,Zyprian E:在体外植物中葡萄鱼中抗疟疾抗性的表征。J植物理性。2003,160:1393-1400。10.1078 / 0176-1617-01021。
- 4.
Cadle-Davidson L:在内部和之间的变化vitis.叶面对霜霉病菌的抗性霜霉.植物营养与肥料学报,2008,32(6):757 - 762。10.1094 / pdi - 92 - 11 - 1577。
- 5.
葡萄病害概要,圣保罗,明尼苏达州。,美国:APS出版社;1988.
- 6.
Polesani M,Bortesi L,Ferrarini A,Zamboni A,Fasoli M,Zadra C,Lovato A,Pezzotti M,Delledonne M,Polverari A:一般和物种特异性转录对易感中的柔软霉菌感染的特定于粪便感染(葡萄)和抗性(V. Riparia.)葡萄藤的物种。基因组学杂志。2010,11:117-10.1186/1471-2164-11-117。
- 7.
Gessler C,Pertot I,Perazzolli M:霜霉,葡萄霜霉病的致病因子。植物病理学杂志。2011,50:3-44。
- 8.
Borie B,Jeandet P,鉴定A,Bessis R,Adrian M:白藜芦醇和斯蒂替酒合酶MRNA生产,用生物和非生物植物植物素诱导素治疗。Am J enol Viticatory。2004,55:60-64。
- 9.
Figueiredo A,Fortes Am,Ferreira S,Sebastiana M,Choi Yh,Sousa L,Acioli-Santos B,Pessoa F,Verpoorte R,PAIS MS:葡萄的转录和代谢分析(葡萄L.)留下衰老可能对抗病原真菌的先天性抵抗力。J Exp Bot。2008,59:3371-3381。10.1093 / JXB / ERN187。
- 10。
白粉病诱导易感葡萄转录组的防御定向重编程,而非抗性葡萄。植物营养与肥料学报。2008,32(4):436 - 442。
- 11.
Kortekamp A:使用光和外荧光显微镜的Plasmopara viticola和Peronosporacea的其他成员的生长,发生和发展。Mycol Res。2005,109:640-648。10.1017 / S0953756205002418。
- 12.
Kortekamp A:葡萄叶片接种寄主和非寄主病原体后防御相关基因的表达分析植物生理学报。2006,44:58-67。10.1016 / j.plaphy.2006.01.008。
- 13.
Vandelle E,Poinssot B,Wendehenne D,Bentejac M,Alain P:涉及钙,一氧化氮和活性氧物质的集成信号网络,但不是BCPG1引发葡萄树防御中的丝裂原活化蛋白激酶。Mol植物微生物相互作用。2006,19:429-440。10.1094 / mpmi-19-0429。
- 14.
Allegre M, Daire X, Heloir MC, Trouvelot S, Mercier L, Adrian M, Pugin A:气孔放松霜霉来华的葡萄藤叶子。植物营养学报,2007,33(6):832-840。10.1111 / j.1469-8137.2006.01959.x。
- 15.
Diez-Navajas AM, Wiedemann-Merdinoglu S, Greif C, Merdinoglu D:在组织水平上研究了葡萄霜霉病(Plasmopara viticola)的非寄主与寄主抗性。植物病理学杂志,2008,36(6):736 -780。10.1094 /发朵- 98 7 - 0776。
- 16.
Derckel JP, Baillieul F, Manteau S, Audran JC, Haye B, Lambert B, Legendre L:两个菌株对葡萄防御的差异诱导Botrytis cinerea.植物病理学。1999年,89:197-203。10.1094 / phyto.1999.89.3.197。
- 17.
杨志强,杨志强,杨志强:植物抗毒素的生物合成、转基因植物抗毒素基因表达、抗真菌活性和代谢。食品化学学报,2002,21(5):741 - 741。10.1021 / jf011429s。
- 18.
Pebzet R,Gindro K,Viret O,Richter H:白藜芦醇,viniferins和Pterostilbene的影响霜霉游动孢子移动和疾病发展。葡萄。2004,43:145-148。
- 19.
Alonso-Villaverde V, Voinesco F, Viret O, Spring JL, Gindro K:二苯乙烯在抗性中的作用葡萄科:超微结构和生物化学事件期间霜霉感染过程。植物理性生物化学。2011,49:265-274。10.1016 / J.Plaphy.2010.12.010。
- 20.
陈志强,陈志强。葡萄果实中pterostilbene的鉴定葡萄.植物理性生物生物。1988年,26:603-607。
- 21.
Korhammer S, Reniero F, Mattivi F:来自vitis.的根源。植物化学学报。1995,38:1501-1504。10.1016 / 0031 - 9422(94) 00811 - 7。
- 22.
Reniero F, Rudolph M, Angioni A, Bernreuther A, Cabras P, Mattivi F:两种二苯乙烯类化合物的鉴定vitis.的根源。血管。1996,35:125-127。
- 23.
gattto P, Vrhovsek U, Muth J, Segala C, Romualdi C, Fontana P, Pruefer D, Stefanini M, Moser C, Mattivi F, et al:成熟和基因型控制健康葡萄二苯乙烯积累。中国食品科学。2008,27(6):593 - 598。10.1021 / jf8017707。
- 24.
Langcake P,Pryce RJ:通过葡萄园产生白藜芦醇和Viniferins,以应对紫外线辐照。植物化学。1977年,16:1193-1196。10.1016 / S0031-9422222222222222222222222222222222222222222222222222(00)94358-9。
- 25.
Schubert R, Fischer R, Hain R, Schreier PH, Bahnweg G, Ernst D, Sandermann H:葡萄白藜芦醇合酶启动子的臭氧响应区不同于基础的病原体响应序列。植物生态学报,1999,19(4):417-426。10.1023 /: 1005830714852。
- 26.
Lijavetzky D,Almagro L,Belchi-Navarro S,Martinez-Zapater JM,BRU R,Pedreno Ma:甲基己酰胺和环糊精对斯蒂替莱烯生物合成途径基因表达和白藜芦醇生产的协同作用。BMC RES笔记。2008,1:132-10.1186 / 1756-0500-1-132。
- 27.
Zambobi A,Gatto P,Cestaro A,Pilati S,Viola R,Mattivi F,Moser C,Velasco R:葡萄细胞早期激活对DIMEB的特定反应,成为DIMEB,Alveratrol Elicitor。BMC基因组学。2009,10:363-10.1186 / 1471-2164-10-363。
- 28.
Fischer BM, Salakhutdinov I, Akkurt M, Eibach R, Edwards KJ, Topfer R, Zyprian EM:葡萄分子图谱上真菌抗病因子的数量性状位点分析。中国科学(d辑):地球科学(英文版)。10.1007 / s00122 - 003 - 1445 - 3。
- 29.
关键词:葡萄,真菌,抗病,叶片,数量性状,遗传定位葡萄(2).中国生物医学工程学报。2007,20(3):369 - 372。10.1007 / s11032 - 007 - 9097 - 7。
- 30.
雏菊E, Boury C, Manicki A, Donnart M, Butterlin G, Nemorin A, Wiedemann-Merdinoglu S, Merdinoglu D, Ollat N, Decroocq S:葡萄性别决定、花序形态和霜霉病抗性的遗传分析。应用电子学报。2009,18:1261-1278。10.1007 / s00122 - 009 - 0979 - 4。
- 31。
Bellin D,Peressottie E,Merdinoglu D,Wiedemann-Merdinoglu S,Adam-Blondon AF,Cipriani G,Morgante M,Testolin R,Di Gaspero G:抵抗力霜霉在葡萄藤中,“Bianca”是由一个主要显性基因控制的,导致感染部位的局部坏死。中国科学(d辑),2009,26(6):591 - 598。10.1007 / s00122 - 009 - 1167 - 2。
- 32。
Moreira FM, Madini A, Marino R, Zulini L, Stefanini M, Velasco R, Kozma P, Grando MS:两个种间葡萄杂交的遗传连锁图谱(vitis.用于定位霜霉病抗性的数量性状位点。植物遗传学报。2010,7:153-167。
- 33。
Polesani M, Desario F, Ferrarini A, Zamboni A, Pezzotti M, Kortekamp A, Polverari A:葡萄植株和病原菌表达基因的cDNA-AFLP分析霜霉.BMC基因组学。2008,9:142-10.1186 / 1471-2164-9-142。
- 34。
吴军,张颖,张华,黄洪,黄洪,吕军:全基因组表达谱血管血管血管利用Solexa测序技术对霜霉病的葡萄反应。植物营养与肥料学报。2010,30(4):514 - 514。
- 35.
关键词:白藜芦醇,低聚物,胁迫代谢产物,杂交后代葡萄(Merzling×Teroldego)基因型感染霜霉.JAgric Food Chem。2011,59:5364-5375。
- 36.
Vrhovsek U,Malacarne G,Masuero D,Zulini L,Guella G,Stefanini M,Velasco R,Mattivi F:分析和准确量化trans白藜芦醇,trans-piceid,trans-pterostilbene和11种viniferin霜霉在部分抗葡萄树叶中。Aust J葡萄酒Res。10.1111 / J.1755-0238.2011.00163.x。
- 37.
匿名:葡萄品种和的OIV描述符列表vitis.物种。办公室International de la Vigne et du Vin(oiv),巴黎;1983年。
- 38.
白藜芦醇的生产葡萄与vitaceae的其他成员作为对感染或伤害的反应。物理植物差。1976,9:77-86。10.1016 / 0048-4059(76)90077-1。
- 39.
Langcake P:抗病抗病vitis.SPP和胁迫代谢物的生产过滤,epsilon-viniferin,α-viniferin和pterostillbene。物理植物差。1981,18:213-226。
- 40.
Alpha-viniferin:一种抗真菌的从葡萄藤中提取的白藜芦醇三聚体。植物化学。1977,16:1452-1454。10.1016 / s0031 - 9422(00) 88809 - 3。
- 41.
利用液相色谱-气压光电离质谱法快速分析霜霉病葡萄叶片中二苯乙烯及其衍生物。中国有色金属学报,2003,21(4):417 - 422。10.1016 / j.chroma.2006.01.060。
- 42.
Tyler BM, Tripathy S, Zhang X, Dehal P, Jiang RH, Aerts A, Arredondo FD, Baxter L, Bensasson D, Beynon JL,等:植物疫病基因组序列揭示了其进化起源和发病机制。中国科学:地球科学。10.1126 / science.1128796。
- 43.
基因本体。[http://www.geneontology.org/]
- 44.
Jones JD,Dangl JL:植物免疫系统。自然。2006,444:323-329。10.1038 / Nature05286。
- 45.
潘志强,李志强,李志强:植物免疫反应途径。细胞。2009,36:978 - 978。10.1016 / j.cell.2009.02.020。
- 46.
Landrault N, Larronde F, Delaunay JC, Castagnino C, Vercauteren J, Merillon JM, Gasc F, Cros G, Teissedre PL:法国葡萄品种葡萄酒和葡萄在贵族腐烂过程中二苯乙烯低聚物和落新丁的水平。中国农业科学。2002,20(5):457 - 461。10.1021 / jf010794g。
- 47.
PEZET R,Gindro K,Viret O,Spring J1:白藜芦醇的糖基化和氧化二聚化分别与葡萄种类对霜霉病的敏感性和抗性相关。Physiol Mol Plant P. 2004,65:297-303。10.1016 / J.PMPP.2005.03.002。
- 48.
史密斯DA:植物脂蛋素的毒性。Phytoalexins。编辑:Bailey Jaam,J.W. 1982,Glasgow,伦敦:Blackie,218-252。
- 49.
Haegi A, Bonardi V, Dall’aglio E, Glissant D, Tumino G, Collins NC, Bulgarelli D, Infantino A, Stanca AM, Delledonne M,等:Rdg2a大麦抗叶条纹病的组织学和分子分析。植物营养与肥料学报。2008,29(4):457 - 461。10.1111 / j.1364-3703.2008.00479.x。
- 50。
Laquitaine L,Gomes E,Francois J,Marchive C,Pascal S,Hamdi S,Atanassova R,Delrot S,Coutos-anvenot P:Ergosterol诱导葡萄保护保护的分子基础Botrytis cinerea:诱导I型LTP启动子活性,WRKY和STILBENE合酶基因表达。Mol植物微生物相互作用。2006,19:1103-1112。10.1094 / mpmi-19-1103。
- 51。
Perazzolli M, Bampi F, Faccin S, Moser M, De Luca F, Ciccotti AM, Velasco R, Gessler C, Pertot I, Moser C:蜜环菌侵染诱导葡萄树根中的一组防御基因,其中一个是用抗真菌活性的蛋白质编纂蛋白质。Mol植物微生物相互作用。2010年,23:485-496。10.1094 / mpmi-23-4-0485。
- 52。
Jacobs AK, Dry IB, Robinson SP:在葡萄白粉病感染和乙烯利处理后不同致病相关cdna的诱导。植物病理学。1999,48:325-336。10.1046 / j.1365-3059.1999.00343.x。
- 53。
acta optica sinica (acta optica sinica), 2010, 31(4): 559 - 564。植物病理学杂志。2003,33(4):497 - 503。10.1094 / PHYTO.2003.93.12.1505。
- 54。
Richter H, Pezet R, Viret O, Gindro K:从20多个表达的二苯乙烯合成酶基因中鉴定出3个新的部分基因葡萄在与霜霉.植物营养与肥料学报,2006,32(4):457 - 461。
- 55。
Melchior F, Kindl H:二苯乙烯合酶和苯丙氨酸解氨酶基因的协调和诱导子依赖表达vitis.简历。Optima。拱生物学生生物糖。1991,288:552-557。10.1016 / 0003-9861(91)90234-a。
- 56。
C:葡萄类黄酮和二苯乙烯生物合成相关结构基因的克隆和分子分析(葡萄l .)。植物营养与肥料学报,1994,24(4):743-755。10.1007 / BF00029856。
- 57。
Pérezf,villegas d,Mejia n:抗坏血酸和黄酮过氧化物酶反应作为H的解毒系统2O.2在葡萄藤叶子。植物营养与肥料学报。2002,30(4):531 - 534。10.1016 / s0031 - 9422(02) 00146 - 2。
- 58。
Takaya Y,Terashima K,ITO J,He Yh,Tateoka M,Yamaguchi N,Niwa M:白藜芦醇的生物体制转化。四面体。2005,61:10285-10290。10.1016 / J.Tet.2005.08.023。
- 59.
木质素生物合成。acta botanica sinica(云南植物研究),2012,28(5):531 - 534。
- 60。
原花青素——类黄酮研究的最后前沿?植物营养学报,2003,22(6):514 - 514。
- 61。
Mellway RD, Tran LT, Prouse MB, Campbell MM, Constabel CP:伤口、病原体和紫外线b反应MYB134基因编码调节杨树的原霉素合成的R2R3 MyB转录因子。植物理性。2009,150:924-941。10.1104 / pp.109.139071。
- 62。
Delauré SL, van Hemelrijck W, De Bolle MFC, Cammue BPA, De Coninck BMA:通过分解蛋白质建立植物防御。植物科学学报。2008,34(4):457 - 461。10.1016 / j.plantsci.2008.01.008。
- 63。
黄志强,王志强,王志强,等:大豆侵染过程中基因表达的变化规律Phytophthora sojae..植物营养与肥料学报,2004,17(4):451 - 462。10.1094 / MPMI.2004.17.10.1051。
- 64.
Restrepo S, Fry WE, Smart CD:理解土豆-Phytophthora Infestans.兼容的互动。植物病理学。2004,94:S87。
- 65.
葡萄品种亲和性病毒病相关基因的表达。功能基因组学。2007,7:95-110。10.1007 / s10142 - 006 - 0031 - 6。
- 66.
Wang X, Liu W, Chen X, Tang C, Dong Y, Ma J, Wei G, Han Q, Huang L, et al:小麦与条锈菌不亲和互作的基因表达差异及亲和互作比较。植物学报。2010,33(6):723 - 732。
- 67.
OEPP/ epo:植物保护产品功效评估指南。植保公告。卷27。编辑:OEPP /植保。1997年,385 - 387。
- 68.
Moser C,Gatto P,Moser M,Pindo M,Velasco R:少量不同葡萄和苹果组织的功能性RNA的分离。莫尔生物科技。2004年,26:95-100。10.1385 / MB:26:2:95。
- 69.
Altschul SF,Madden TL,Schaffer AA,张J,Zhang Z,Miller W,Lipman DJ:Papped Blast和Psi-Blast:新一代蛋白质数据库搜索程序。核酸RES。1997年,25:3389-3402。10.1093 / nar / 25.17.3389。
- 70。
- 71。
DFCI葡萄基因指数。[http://compbio.dfci.harvard.edu/tgi/cgi-bin/tgi/gimain.pl?gudb=grape]
- 72。
IASMA基因组浏览器。[http://genomics.research.iasma.it/]
- 73。
dbRefSeq。[http://www.ncbi.nlm.nih.gov/RefSeq/]
- 74。
uniprot。[http://www.uniprot.org/]
- 75。
Fontana P, cesaro A, Velasco R, Formentin E, Toppo S:利用语义相似性和基因本体论中的权重方案快速注释基因组项目中的匿名序列。公共科学图书馆。2009,4:e4619-10.1371/journal. pon. 0004619。
- 76。
Combimatrix公司。[http://www.combimatrix.com.]
- 77。
GALBraith DW:细胞类型特异性基因表达的全局分析。Comp Funct基因组学。2003,4:208-215。10.1002 / CFG.281。
- 78。
Tusher Vg,Tibshirani R,Chu G:施加到电离辐射响应的微阵列的重要性分析。Proc Natl Acad Sci USA。2001,98:5116-5121。10.1073 / pnas.091062498。
- 79。
Edgar R,Domrachev M,Lash Ae:基因表达综合症:NCBI基因表达和杂交阵列数据存储库。核酸RES。2002,30:207-210。10.1093 / nar / 30.1.207。
- 80。
Ramarkers C,Ruijter JM,Devez RHL,AFM M:无定量实时聚合酶链式反应(PCR)数据的无假设分析。神经科学字母。2003,339:62-66。10.1016 / s0304-3940(02)01423-4。
- 81。
Ruijter JM,Ramakers C,Hoogaars WMH,Karlen Y,Bakker O,Van Den Hoff MJB,Moorman AFM:放大效率:在分析定量PCR数据分析中链接基线和偏差。2009,37:E45。
- 82。
Pfaffl MW:一种新的实时RT-PCR相对定量数学模型。核酸学报2001,29:e45-10.1093/nar/29.9.e45。
- 83。
Pfaffl MW, Horgan GW, Dempfle L:相对表达软件工具(Relative expression tool, REST)用于实时PCR中相对表达结果的分组比较和统计分析。核酸学报2002,30:e36-10.1093/nar/30.9.e36。
确认
作者要感谢Domenico Masuero在生化分析方面的帮助,David Glissant博士在杂交实验和阵列数据分析方面的支持。他们也非常感谢Alberto Ferrarini博士和Annalisa Polverari博士对手稿的批判性阅读。这项工作得到了特伦托自治省Unico基金会资助的“白藜芦醇”项目的支持。
作者信息
从属关系
通讯作者
额外的信息
利益争夺
两位作者宣称他们没有相互竞争的利益。
作者的贡献
通用通用通用通用通用通用通用通用委员会进行了cDNA-AFLP和微阵列实验(包括Combimatrix阵列设计),进行了微阵列统计分析,帮助葡萄感染,并在研究的概念上进行了合作,并写了稿件。紫外线进行生化分析。LZ进行了葡萄感染,MS开发了M×T交叉并提供了木质切割。AC帮助序列分析和注释。FM协作研究的概念以及对生物化学结果的批判性解释,并修改了手稿。MD在实验设计上进行了协作,并负责进行杂交实验的功能基因组学中心(维罗纳大学)进行杂交实验。RV构思了该研究并修改了手稿。CM合作的研究概念和写作稿件。所有作者阅读并认可的终稿。
电子辅料
12870 _2011_899_moesm1_esm.xls
附加文件1:Merzling (M) × Teroldego (T)杂交后对16种二苯乙烯类化合物的定量分析p . viticola.该文件含有在106个个人的一个重复(2 + 3)的第二和第三叶片的合并样品中鉴定的16个斜纹素的量化(μg/ g fw)和百分比(%)十字架在6 dpi。根据斯蒂屈(高生产商,低生产商,非生产者),将个体分配给三组。在最后三列中报告了在2005年收获期间收集的表型数据(叶片下侧的孢子率(%SP)(%SP),过敏反应(HR)和OIV452类别)。ID:分配给每个基因型的数字代码。N.D .:由于没有复制的植物而没有检测到表型对表型分析的表型(XLS 78 KB)
12870_2011_899_moesm2_esm.tiff.
附加文件2:Merzling (M) × Teroldego (T)杂交18个高产品种中16个二苯乙烯类化合物的概况。图中显示了通过HPLC-DAD-MS分析鉴定出的各二苯乙烯类化合物在18个高产玉米染病叶片中的百分比。(TIFF 537 KB)
从Merzling和F1 21/66中分离到的转录衍生片段(TDFs)
附加文件3:p . viticola通过cDNA-AFLP分析.该文件包含显示差异表达的TDFs的完整列表,通过比较Merzling和F1 21/66接种样品和对照样品中的条带强度直观估计。对于每个TDF报告:i)标识符(ID)(1,2,3,4对应用于选择性扩增的A, T, C, G核苷酸,BC/BT = BstT0/BstC0, M = Mse0);ii) GenBank登录号;iii) 12、24、48、96 hpi和0 hpmi的表达谱(C);缩略语S、U、D分别表示“感染或水雾处理后的相同轮廓”、“感染样本中上调”和“感染样本中下调”;- =无扩增未检测到的频带;(四)的长度;v)注释过程的结果:对假定功能(如有)的描述,以及由blastn/x对NCBI EST数据库获得的EST/TC登录号、基因和蛋白质登录号[70] DFCI葡萄基因指数[71],IASMA葡萄基因组数据库(3.0版)[72],Refseq数据库[73]及UNIPROT数据库[74].(XLS 151 KB)
12870_2011_899_moesm4_esm.xls.
附加文件4:Merzling (M) × Teroldego (T)杂交的耐药和易感个体感染后的微阵列分析结果p . viticola.该文件包含了每个基因型(F1 21/66, Teroldego, F1 22/73)的微阵列(SAM)多类比较的显著性分析结果。对于每个探针:i) oligo标识符(ID);(2)斑点序列的登录号;iii)三个技术重复(Log2均值)在0 hpmi (C)、12和96 hpi时的Log2均值表达值;iv)处理样品与对照样品的mRNA表达变化(fold change)计算为2 EXP(处理样品的log2均值-对照样品的log2均值);v)表示错误发现率(FDR)的q值(粗体值是那些低于所选阈值5%的值)。(XLS 378 KB)
12870_2011_899_moesm5_esm.xls.
附加文件5:感染后F1 21/66,Teroldego和F1 22/73中的明显调制基因的完整列表p . viticola.该文件包含表现出统计上显着的差异表达的转录物列表,具有假发现率(FDR)<5%,折叠变化大于1.5。对于F1 21/66基因型,报告了cDNA-AFLP和微阵列结果(浅灰色表示CDNA-AFLP和微阵列型材之间的一致)。每个转录本给出:i) TDF标识符或基因代码(ID)的缩写;(2)斑点序列的登录号;iii)蛋白质功能和功能类别的描述;iv)F1 21/66中的cDNA-AFLP简介;v)如通过微阵列分析所获得的,在F1 21/66,Teroldego和F1 22/73中的12和96 HPI折叠变化。(XLS 56 KB)
Real-time RT-PCR验证表达谱9
附加文件6:p . viticola反应的基因.之间的差异p . viticola通过反转录定量PCR (RT-qPCR)和微阵列检测9种接种条件p . viticola-反应基因。每个转录本给出:i) TDF标识符或基因代码(ID)的缩写;Ii)蛋白质功能的描述;(三)扩增所用引物的序列(用于肌动蛋白来自Gatto.等.[23];iv)通过阵列杂交实验和RT-qPCR获得F1 21/66、Teroldego和F1 22/73在12和96 hpi处的fold change (FC)。SE是平均归一化表达式值的总体标准误差。(XLS 36 KB)
作者为图像提交的原始文件
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署名许可协议(http://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
Malacarne,G.,Vrhovsek,U.,Zulini,L.等等。抵抗霜霉在葡萄植株中,分离群体与二苯乙烯类物质的积累和特定的宿主转录反应有关。BMC植物杂志11,114(2011)。https://doi.org/10.1186/1471-2229-11-114
已收到:
公认:
发表:
关键词
- 白藜芦醇
- 对称二苯代乙烯
- 霜霉病
- 耐药基因型
- 易感基因型