摘要
背景
间质是由充满间质的质体表面形成的动态管状结构。尽管在理解某些细胞骨架元件和马达蛋白对stromule维持的重要性方面取得了相当大的进展,但它们在植物细胞内的功能仍然未知。已经有人提出,通过增加细胞质暴露的质体表面积,strostrom促进质体和其他细胞区室之间的代谢物和/或信号的交换,但没有实验证据证明strostrom参与代谢过程。在水槽组织和异养细胞培养中频繁出现的间质粒表明,细胞外空间中碳水化合物的存在可能是间质粒形成的触发因素。我们用莲座叶上表皮的诱导实验来检验这一假设拟南芥作为一个模型系统。
结果
我们发现,无论蔗糖还是葡萄糖,通过真空渗透的方式施加到外质体上,stromule频率都显著升高。相比之下,果糖、山梨醇或甘露醇都不能诱导磁梭形成,这就排除了磁梭形成仅仅是渗透条件变化的结果的假设。Stromule的形成依赖于细胞质中的翻译活性,而质体内的蛋白质合成不是必需的。最后,stromule诱导不仅限于上表皮的质体,栅栏薄壁组织的叶绿体也有类似的现象。
结论
通过对叶片组织进行真空浸渍,建立了一个可重复诱导间质层的实验系统,为系统分析导致这些动态细胞器结构形成的条件和要求提供了一个合适的工具。本文通过分析异体糖溶液对stromule形成的影响,证明了该方法的适用性。我们发现,只有在植物的初级代谢中产生的一个子集的糖诱导了stromule的形成,这进一步依赖于细胞质翻译活性。这表明糖感机制调控了间质粒的形成,并可能在碳水化合物代谢和代谢物交换中发挥作用。
背景
间质细胞(充满间质的小管)[1]是质体包膜的突起,直径通常小于1 μm [2].这些丝状结构是高度动态的,可以在几秒钟内伸展和收缩[3.].尽管在1908年的一篇关于质体的专著中已经描述了从质体表面延伸出来的小管(见[4]),只有在适当的荧光显微镜技术发展和改进后,才认识到它们的意义和形态学相关性。特别是,表达由绿色荧光蛋白(GFP)与叶绿体靶向转运肽融合而成的嵌合蛋白的转基因植物的产生,使首次详细分析证明了这些结构中存在基质蛋白[1].近年来,在多种维管植物、非维管植物及绿藻中均发现了strostrom(总结于[5]),这表明了这些结构的进化守恒性,并暗示它们可能在地球的所有成员中发挥重要作用Viridiplantae.尽管在理解某些细胞骨架元件和运动蛋白对stromule维持的重要性方面取得了重大进展[6- - - - - -8], stromle的功能仍然难以捉摸。接近它们在植物细胞中的作用的一种方法是寻找导致strostrom诱导的生理条件。
stromuls的出现频率相对较高,例如,在成熟的番茄等组织中[9],在放置于富含蔗糖的培养基和BY2细胞培养物的叶片样本中[10].在所有这些例子中,显示出高stromule频率的细胞暴露在相对高浓度的碳水化合物中,这表明糖的存在与stromule形成之间存在联系。在这里,我们试图通过测量暴露于不同糖溶液对模型植物组织(特别是上叶表皮)中stromule频率的影响来阐明这种潜在的相关性拟南芥.
我们在实验中发现,蔗糖和葡萄糖在表皮质体中被强烈诱导形成stromule。果糖、山梨醇和甘露醇都不能诱导相同的反应,这证实了这种诱导的特异性。此外,蔗糖和葡萄糖的stromule诱导不仅局限于表皮质体,同样可以在栅栏薄壁组织的叶绿体中观察到。
结果
上叶表皮为适宜的模型组织,用于梭麦诱导
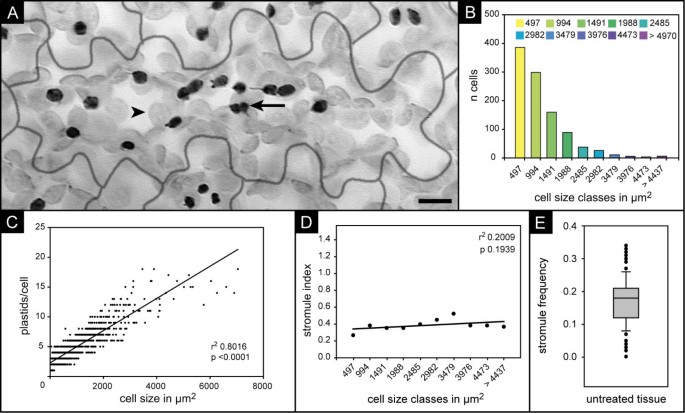
对于预期的实验,需要一个合适的模型系统,既允许控制暴露于糖溶液,又易于分析足够多的质体。我们选择拟南芥以FNR/EGFP(一种由铁氧还蛋白- nadp氧化还原酶(FNR)的叶绿体靶向转运肽与绿色荧光蛋白的衍生物EGFP融合而成的嵌合蛋白)组成的转基因株系(FNR/EGFP-7-4) [11,12].由于产生绿色荧光基质,通过常规荧光显微镜可以很容易地在该转基因系中观察到质体和基质1).为了避免植物材料在栽培过程中暴露于外界的糖,这可能会干扰预期的糖诱导实验,使用了土壤种植的植物。这些研究选择了莲座叶的上表皮组织,因为它有利于相对容易的数据采集。由于这些细胞的平面形状和质体数量相对较低(通常低于20个),在一个给定细胞内的所有质体和间质都可以通过荧光显微镜在一个小于20个焦平面的z-stack中监测(图1).此外,它的表面不像下表皮那样有纹理,有凸出的血管,这将阻碍显微成像。
上叶表皮的特征.一个)在“堆叠”图像的上表皮细胞拟南芥FNR/EGFP-7-4,一个细胞内的所有质体都是可见的(细胞边界为灰色线)。为了更好地显示strostrom,图像进行了灰度缩放和倒置。因此,表皮质体呈深灰色(箭头),栅栏薄壁的较大质体呈浅灰色(箭头)。尺寸条对应10 μm。B)上表皮细胞大小的直方图,说明细胞大小的巨大差异和小细胞在该组织中的优势。x轴上给出的值是大小类的上限。可见表面积,由侧壁定义,被用作细胞大小的衡量标准,(见a)。C)质体数与细胞大小的散点图和线性回归线显示两者之间有很强的线性相关性(r20.8016;P值< 0.0001)。这强调了表皮细胞在细胞大小和质体数量上可以有很大的不同。D) stromule频率与细胞大小类别的关系图及线性回归线显示两者之间无显著相关性。由于班级规模不等,' > 44376'在回归检验中没有被考虑。E) 109个未处理上叶表皮的独立样本中stromule频率的箱线图。具体参数:最大值= 0.34,90%百分位= 0.26,75%百分位= 0.21,中位数0.18,25%百分位= 0.13,10%百分位= 0.08,最小值0.02。
Stromule频率不受细胞大小的影响
为了识别所选模型组织的变化,需要一个合适的stromule参数。Stromule频率(SF),即显示至少一个Stromule的质体的比例,以前已用于定量实验处理对表皮细胞的影响烟草benthamiana[13],并在番茄果实成熟过程中发生[9].因为SF是一个比例,Waters和同事[9]引入了用于统计分析和图形显示的“stromule指数”,它表示arcsin变换后的SF (arcsin√x,其中as ×为比例)。SF,正如以前所使用的,是基于对单个细胞估计的SF的比较。这就需要考虑细胞环境,并需要质体和细胞边界的成像。不需要考虑细胞环境将允许简化成像和数据分析,但前提是不同大小的细胞在SF中没有差异。我们从3片叶子中测量了1023个细胞的大小(作为细胞大小的测量,被外侧细胞壁束缚的表面积被使用),表明上表皮的拟南芥由大小不同的细胞组成(我们的测量范围从15 μm2至7044 μm2),小细胞以数量支配表皮(图1 b附加文件1A).如图所示1 c,每个细胞的质体数量(在我们的测量范围从1到20)与细胞大小正相关(决定系数r20.8016, p < 0.0001)。为了测试stromule频率是否随细胞大小的变化而变化,将细胞分成大小每增加497 μm的级别2.相应的SF是通过将显示stromuls的质体总数除以给定大小类内所有质体的数量来计算的。如图1 d显示,在该组织中,细胞大小和SF的相关性不太可能(r20.009;p 0.1939;由于尺寸类' > 4437'的大小不等,因此没有考虑回归分析)。考虑到这一点,可以在不考虑细胞环境的情况下估计上表皮的stromule频率,这使得成像细胞边界成为不必要的。
在未处理的叶片中,Stromule频率不同
为了确定SF在未处理组织中的变异性,对来自不同植物的109个叶片的SF进行了估计。箱形图如图所示1 e结果表明,50%的样品的SF在0.13 ~ 0.23之间,中位数为0.18,而少数(< 20株)样品的叶片出现了明显的偏差频率(< 0.09或> 0.27)。通过在时间过程实验中不同时间点使用不同叶片,这种变化可以掩盖潜在的诱导效应。因此,我们在给定的时间过程实验中使用了来自单个叶片的叶片方格。
Stromule的形成是由细胞外蔗糖诱导的
植物韧皮部汁液中最主要的运输糖是蔗糖[14)通常从韧皮部释放到水槽组织的外质体中。蔗糖也是植物组织培养所用培养基的主要碳源。在这两种类型的细胞中,均观察到大量的间质[9,10这表明植物细胞外质体中蔗糖的存在可能支持stromule的形成。为了实验验证这一假设,我们渗透树叶拟南芥用缓冲溶液(APW)补充40mm蔗糖,一个浓度通常用于拟南芥组织培养基。
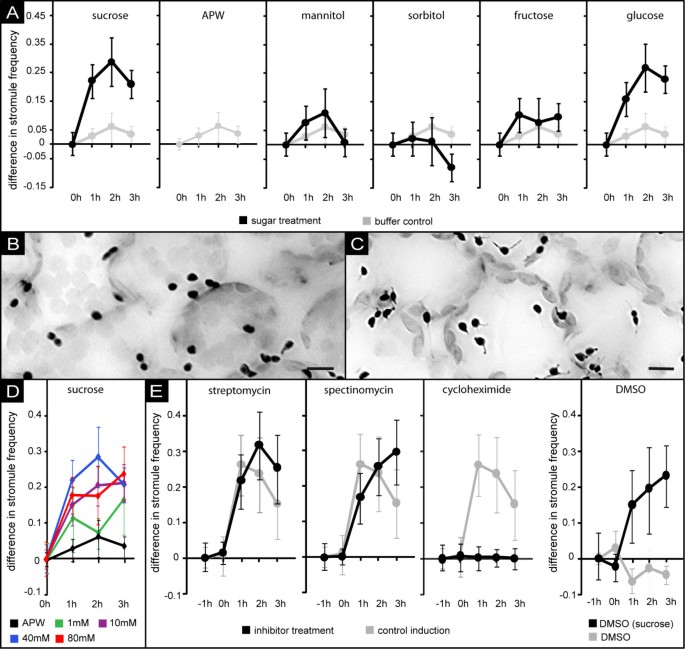
我们使用叶片组织的真空浸润,以确保细胞快速和均匀地暴露在溶液中。在不同的时间点(0,60,120和180分钟),用荧光显微镜对给定叶片的单个样本进行独立分析(浸润和孵育程序的方案见附加文件)1图像处理后,统计每个样品中有或没有stromules的质体数量,以确定SF。每个处理进行三次。SF的变化结果显示为图中99%置信区间的平均值2(stromule指数和stromule频率的绝对值见附加文件1面板C和D)。如图所示2以及图中所示的显微图像2 b而且2摄氏度在暴露于40mm蔗糖的前60分钟内,SF显著增加(完整的图像系列见附加文件)2).120分钟后,SF达到最大值,进一步暴露于蔗糖溶液导致SF缓慢下降。对照叶片样品除使用缺乏蔗糖的APW进行渗透外,均按上述方法处理。在这些样本中,与未浸润的样本相比,SF仅略有增加(图2)表明,是蔗糖的存在,而不是叶片组织的真空处理,导致了stromule诱导。
糖暴露对stromule频率的响应变化.一个) 40mm糖溶液(蔗糖、甘露醇、山梨醇、果糖或葡萄糖)真空渗透后SF随时间变化的折线图;如黑线所示),或缓冲控制(APW,灰色线所示)。错误条表示99%的置信区间。为了更好地进行比较,将缓冲对照的值与糖处理一起绘制。有关绝对SF值,请参阅附加文件1 c.c)“堆叠”和倒置的荧光图像显示叶表皮质体(黑色)在40 mM葡萄糖溶液浸润后0 h (B)或2 h (C)。请注意,在2h (C)下拍摄的图像中,具有纹层的质体数量显著增加。尺寸条对应于10 μm。D)不同蔗糖浓度(1 mM、10 mM、40 mM和80 mM)和缓冲对照(APW)诱导的stromule频率变化的折线图。结果表明,蔗糖浓度在40 mM以上时,stromule诱导不增强。错误条表示99%的置信区间。40mm和APW的值取自先前展示的实验(A)。E99%置信区间的线状图显示存在或不存在翻译抑制剂时SF增加的时间过程。用APW补充环己亚胺、DMSO、链霉素或大霉素预处理叶片1小时(-1小时至0小时)。在时间点“0小时”,所有缓冲液均额外添加40 mM蔗糖,并再孵育3小时。详情见同图A的图例。
如其他蔗糖诱导的生理反应,如花青素的积累拟南芥大麦胚的幼苗或α -淀粉酶诱导[15,16]时,SF的增加呈浓度依赖性。用1mm、10mm或40mm蔗糖溶液浸润组织样品,提示SF与浸润介质蔗糖浓度的相关性(图二维;有关stromule指数和stromule频率的绝对值,请参阅附加文件1然而,蔗糖浓度的进一步增加(> 40 mM)并没有导致SF的额外增加,这表明了一种饱和效应。此外,我们从未观察到SF超过60%,即即使在“最佳”诱导条件下,样本中约有40%的质体仍然没有可见的stromules。
stromule形成的诱导不是渗透效应
为了阐明蔗糖诱导stromule形成是否仅仅是一种渗透效应,用甘露醇和山梨醇溶液重复了实验,这两种溶液都不是初级碳代谢的一部分,通常用于施加渗透胁迫[17- - - - - -20.].在这两种情况下,真空入渗都没有导致SF的显著增加(图2).相反,山梨醇的渗透甚至导致了对stromule形成的轻微抑制,这表明渗透条件的变化不可能是在蔗糖存在下观察到的stromule诱导的原因。这表明,在初级碳代谢过程中存在的糖可以特异性地诱导stromule的形成。
然而,并不是所有这些糖都能诱导stromule的形成。如果在渗透实验中蔗糖被葡萄糖或果糖替代,只有葡萄糖能够诱导stromule的形成,而果糖处理没有导致SF的任何变化(图2).虽然这个过程还没有被很好地理解,但它被广泛接受(基于支持的实验证据,总结在[21]),即外质体中蔗糖裂解产生的细胞外果糖被输入细胞。考虑到细胞内果糖可以转化为磷酸化葡萄糖,stromule诱导可能不是由细胞代谢活性的整体增加引起的,而可能取决于特定的代谢和/或信号通路。
Stromule地层需要新创细胞质中蛋白质的合成
通过在蛋白质生物合成抑制剂的存在下进行蔗糖诱导实验,进一步分析了代谢活性对stromule形成的明显影响。如果蔗糖溶液中额外添加了环己亚胺(CHX),其可抑制80S核糖体的活性,从而用于阻止细胞质中的翻译[22,23],我们观察到stromule的形成完全被抑制(图2 e).相比之下,在蔗糖溶液中添加0.03% DMSO (CHX的溶剂)的对照实验中,没有表现出任何抑制或诱导作用(图2 e)证实了这种反应的特异性。另一方面,通过抑制70S核糖体来阻止质体内翻译的链霉素和大霉素[22,24- - - - - -26],影响蔗糖触发stromule诱导(图2 e).这表明新创核编码蛋白的合成,而质体基因组编码蛋白的合成,是介导从外质体蔗糖积累到stromule形成的信号所必需的。
在栅栏薄壁组织中也观察到蔗糖依赖性stromule的形成
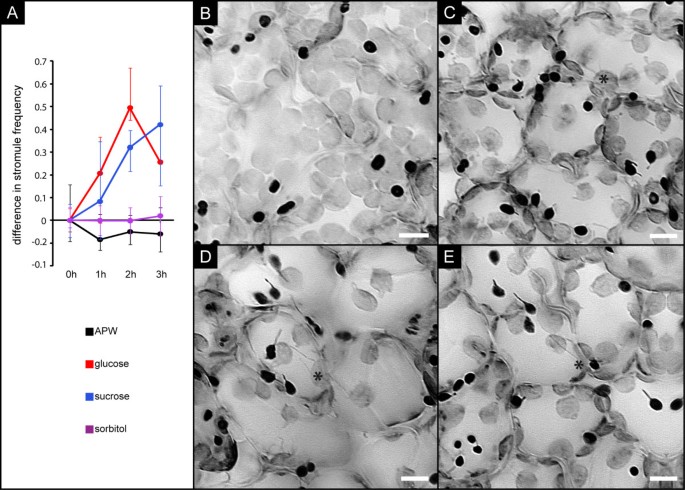
为了检验发育完全的叶绿体是否也能在蔗糖和葡萄糖处理后形成stromule,实验中获得的图像堆栈如图所示2另外还筛选了栅栏薄壁细胞的存在。这种具有光合活性的组织携带发育完全的叶绿体。事实上,我们在蔗糖、葡萄糖、APW和山梨糖醇处理的图像中不仅检测到足够数量的叶绿体,而且发现这些叶绿体显示出与表皮质体难以区分的stromule诱导特征。虽然蔗糖和葡萄糖的溶液导致了明显的stromule形成的诱导,但山梨醇和缓冲对照都没有任何刺激作用(图3;有关stromule指数和stromule频率的绝对值,请参阅附加文件3.甚至蔗糖诱导后表皮细胞的最大SF(单次处理60%,SF绝对值的平均值见附加文件)1面板D和F,并与其他文件进行比较3.B)观察光合活性细胞的叶绿体。应该注意的是,这些细胞中的间质的检测由于大多数叶绿体的密集堆积而变得复杂。此外,视场内的薄壁细胞的许多叶绿体在图像中没有被捕获,因此不能被考虑用于估计stromule频率。这两个因素都可能导致了相对较大的置信区间。然而,我们的数据仍然清楚地表明,通过选择糖诱导stromule并不局限于在上叶表皮中发现的质体,这表明导致stromule形成的机制在不同质体类型中是保守的。
栅栏薄壁质体对糖暴露的反应.一个) APW或APW加40 mM葡萄糖、40 mM蔗糖或40 mM山梨糖醇真空浸润后,叶肉细胞中stromule频率增加。错误条表示99%的置信区间。SF的绝对值见附加文件2面板B。B - e)“堆叠”和倒置的荧光图像显示了40 mM葡萄糖溶液浸润后0 h (B)、1 h (C)、2 h (D)或3 h (E)的叶片组织。表皮细胞的质体颜色较暗,而较大的叶肉叶绿体颜色较亮。注意两种组织中形成strostros的质体比例都在增加。星号突出显示叶肉叶绿体与strostrom。尺寸条对应10 μm。
讨论
在本研究中,我们旨在建立一个实验系统,促进在活植物组织中可重复诱导stromule形成,以便更好地对这些神秘的结构进行系统研究。一些关于异养细胞培养和下沉组织中高频率的stromule的报道表明,细胞外糖和stromule形成之间可能存在联系。利用转基因植物的上叶表皮拟南芥以绿色荧光质体基质为模型组织,研究了细胞外糖对基质形成的影响。
Stromule的形成是由蔗糖和葡萄糖特异性诱导的
我们发现,只有植物中产生的糖的一个子集才会特异性地诱导stromof的形成。蔗糖或葡萄糖的真空浸润导致SF显著增加,而果糖或甘露醇的诱导作用没有观察到。山梨醇的渗透甚至可以轻微地抑制stromule的形成。因此,我们的数据表明,stromule的形成很可能既不是由于渗透作用,也不是由于一般代谢糖的存在。相反,似乎涉及蔗糖和/或葡萄糖的特定信号通路在诱导过程中发挥作用。
蔗糖在信号转导中的作用难以评估,尽管有强有力的证据表明植物中存在蔗糖特异性的细胞内和细胞外传感机制[15,27].由于蔗糖被转化酶和蔗糖合酶有效地在外质体和细胞质中裂解为果糖和葡萄糖,蔗糖的信号功能很难与其裂解产物葡萄糖或udp -葡萄糖区分开来。另一方面,葡萄糖传感技术已经有了一些细节上的了解。特别是,细胞内酶己糖激酶1 (HXK1)已被确定为这一过程中的关键角色。除了酶活性外,HXK1也是一种重要的葡萄糖传感器。这种酶的异构体存在于质体内,也与线粒体有关。后一种亚型也在细胞核中发现,它是参与基因调控的蛋白质复合体的一部分[28].除HXK1外,其他潜在的葡萄糖传感器已被报道,它们或多或多地可能参与葡萄糖诱导的stromule形成[27].
在这一阶段,尚不清楚蔗糖和葡萄糖是否可以作为stromule形成的独立信号,或者观察到的蔗糖诱导是否由蔗糖裂解后葡萄糖的释放引起。同样,关于stromule诱导信号是在细胞外还是细胞内被感知的问题仍有待回答。
应该记住,细胞外糖水平的变化不仅可能影响细胞的碳水化合物代谢,而且可能是植物细胞应激的一个原因,可能导致应激信号通路的诱导[29].因此,还需要进一步的实验证据来证实stromule的形成和碳水化合物代谢之间假定的相互依赖性。因此,我们接下来的实验将探讨葡萄糖和蔗糖是否产生独立的stromule诱导信号,以及糖水平的内部变化是否足以改变stromule频率(例如,利用非代谢葡萄糖和蔗糖类似物以及细胞内蔗糖和葡萄糖水平改变的突变体)。
strombles可能支持代谢物交换
虽然已经提出并讨论了几种可能的strostrom功能[5],但基质在植物细胞中的最终作用仍然是个谜。通过观察到偶粒或其他包膜突起与线粒体和过氧化物酶体直接接触,认为包膜突起的形成,如偶粒,支持光呼吸[30.- - - - - -33通过增加细胞器之间的相互作用表面,从而促进高效的代谢物交换。然而,在光呼吸条件下,这些细胞器连接变得更加频繁的实验证据还没有,这将支持这一假设。
另一方面,由stromule形成的相互作用质体表面的增加可能对质体与细胞质或其他细胞器的相互作用产生更普遍的影响,这可能在质体包膜上代谢产物进口或出口需求增加的条件下尤其相关[2,5].事实上,我们的研究结果证明了蔗糖和葡萄糖的stromule诱导似乎支持了这一假设。异形葡萄糖和/或蔗糖在槽组织和异养细胞培养中特别突出。这些细胞的非光合活性或光合活性较低的质体从细胞质中输入大量的葡萄糖-6磷酸,以产生完成其代谢功能所需的ATP和NADPH,而ATP和NADPH又源于细胞外的蔗糖或葡萄糖池。另一方面,在这一过程中同时产生的磷酸三糖被输出回细胞质。在异营养组织中,这种对代谢物输入和输出的持续需求可能解释了BY2细胞以及成熟的番茄果实和深色生长的幼苗等非绿色组织中stromule丰度高的原因。此外,它还可以解释为什么通过光合作用过程产生ATP和NADPH的叶绿体比非绿色质体显示出普遍较低的stromule频率[2].在葡萄糖或蔗糖真空浸润后,叶绿体产生与表皮质体相似程度的激粒,乍一看似乎是矛盾的。然而,在高糖条件下,源活性被抑制,而汇活性被触发,这一点已得到证实。34].自然地,这种变化发生在果实发育过程中[35],在番茄果实中,这一过程伴随着stromule频率和长度的增加[9].此外,暴露于细胞外葡萄糖和蔗糖可诱导基因表达发生重大变化[36,37].这样的变化也可能发生在我们的蔗糖和葡萄糖处理,因为环己亚胺实验证明了的要求新创stromule诱导蛋白合成。
结论
虽然到目前为止,关于strostrom相关过程的推测是可能的,但本研究提供了实验证据,这表明strostrom可能参与碳水化合物代谢。这支持了stromle参与优化代谢物交换的观点。葡萄糖和蔗糖是重要的代谢产物和信号分子,它们诱导stromule的能力为典型的糖感机制参与stromule调控提供了实验证据。然而,其中的糖感机制和信号级联仍不清楚,需要进一步研究。我们的模型系统,上叶表皮拟南芥,可能为解决这些问题提供有用的工具。
方法
化学品和解决方案
所有化学品均购自Sigma-Aldrich (Deisenhofen, Germany)、Roth (Karlsruhe, Germany)或Serva (Heidelberg, Germany)。人工池塘水(APW)作为溶解和稀释糖和抑制剂的缓冲液[38]被使用。所有溶液在使用前立即准备好。
显微镜,硬件和软件
对于EGFP荧光成像,使用Axioscop 2直立显微镜(卡尔蔡司,耶拿,德国)在epifluorescence模式下操作(荧光滤镜'endowGFP' F41-017,购买自AHF Analysetechnik, Tübingen,德国)。使用Axiocam HRc相机(卡尔蔡司,耶拿,德国)或KY-F75相机(JVC,日本)拍摄图像。显微镜、相机和piezo步进由框架抓取软件包AxioVision(卡尔蔡司,耶拿,德国)或DISKUS(希尔格斯,Königswinter,德国)控制。
植物材料,样品制备和药物处理
转基因拟南芥在120 μEinstein m的土壤条件下,以叶绿体为靶点的铁氧还原酶(FNR)转运肽与绿色荧光蛋白(EGFP)的增强型衍生物融合为嵌合蛋白FNR/EGFP-2年代-1在短日照条件下(8小时亮/16小时暗),相对空气湿度为60%。对于真空入渗,从10 - 12周的植物中收获膨胀的叶子,这些叶子已经达到成熟叶子大小的75%左右。去除中静脉后,将叶片切成四方形,使用5ml或10ml注射器和2ml反应管进行真空浸润。在试管中分别注入1.5 ml溶液,并在试管顶部放置一个10 ml注射器。通过拉动注射器的柱塞,真空时间不超过2s。释放后,在组织中产生的负压导致液体淹没细胞间隙。渗透的叶片立即进行分析或进一步培养。用翻译抑制剂处理叶片样品时,APW加入100 μM环己亚胺,100 μg ml-1大霉素,或100 μg ml-1链霉素在黑暗中孵育一小时。然后将溶液替换为APW,除相应的抑制剂外,还添加了40 mM蔗糖。在APW中添加0.03% DMSO作为环己亚胺处理的溶剂对照。每个实验至少用不同植物的叶子进行三次。
成像和数据处理
真空入渗后,立即对叶片进行分析(时间点0 h),或在给定的时间内(1、2或3 h)在室温下在黑暗中孵育。对于每个时间点,通过沿z轴捕获一系列图像,对6个单个叶扇区的表皮质体进行成像。得到的图像堆栈使用AxioVision软件包(卡尔蔡司,耶拿,德国)进一步处理。在CombineZP的帮助下,图像堆栈被处理成一张“堆叠”的2D图像[39]如上文所述[40].在将堆叠的图像导入ImageBrowser包(Carl Zeiss, Jena, Germany)后,有和没有stromuller的质体按照颜色代码进行标记。生成的图像层仅由标记组成,被导出为图像文件。这些图像中的标记是使用Photoshop插件FoveaPro 4(驯鹿图形,阿什维尔,美国)自动计数的。用FoveaPro 4生成的数据文件用Excel (Microsoft, Redmond, Washington, USA)进行分析。
计算stromule频率
SF的数值计算如下。对于一个时间过程的一个时间点,实验图像堆栈在每个叶方6个不同的点被采取如上所述(捕获约。每个斑约有250个表皮质体。1500质体每叶平方)。对于每个叶方,计算6个点的stromule频率,得到每个叶方的6个SF值(为了估计栅栏薄壁组织中的SF,只考虑在所拍摄的图像堆栈中完全可见的叶绿体)。然后SF值根据Waters et al进行arcsin变换(arcsin√SF) [9]产生stromule指数(SI)。为了总结实验重复的数据,对每个实验用SI值计算算术平均值和99%置信区间(附加文件)1面板C, E和附加文件3.面板)。
这些平均SI值和置信区间已通过计算SI值的鼻窦的平方(sinsi)转换回SF值。2)以方便运输。stromule指数柱状图以及反向转换数据在附加文件中显示1面板C-F和附加文件3.为了更好地比较不同处理的效果,图中绘制了与初始stromule频率相关的增减曲线2a d e而且3.
参考文献
- 1.
Köhler RH,曹娟,曹斐,韦文伟,汉森MR:高等植物质体间蛋白质分子交换的研究。科学通报,1997,27(4):344 - 344。10.1126 / science.276.5321.2039。
- 2.
Hanson MR, satarzadeh A: Stromules:一个长期被忽视的质体形态和功能特征的最新见解。植物生理学报,2011,29(4):344 - 344。10.1104 / pp.110.170852。
- 3.
喷射BE:质体突起:其生长、收缩、拉伸、锚定、分支、桥接和尖端脱落的视频显微镜。中国生物医学工程学报,2005,26(2):344 - 344。10.1007 / s00709 - 004 - 0073 - 3。
- 4.
Gray JC, Sullivan JA, Hibberd JM, Hansen MR: Stromules:可移动的突起和质体之间的相互连接。植物学报,2001,3(3):223-233。10.1055 / s - 2001 - 15204。
- 5.
韩春华,王晓峰,王晓峰,等。被子植物质体和间质体的动态形态学研究。植物细胞环境,2008,31(5):646-657。10.1111 / j.1365-3040.2007.01768.x。
- 6.
郭永毅,汉森先生:在活的有机体内gfp标记的微丝与质体间的相互作用分析。中国生物医学工程学报,2004,4:2-10.1186/1471-2229-4-2。
- 7.
烟草benthamiana.分子植物,2009,2(6):1351-1358。10.1093 / mp / ssp094。
- 8.
Kwok EY, Hanson MR:微丝和微管控制烟草中非绿色质体和strostrom的形态和运动。植物学报,2003,35(1):16-26。10.1046 / j.1365 - 313 x.2003.01777.x。
- 9.
Waters MT, Fray RG, Pyke KA: Stromule的形成取决于质体的大小、质体分化状态和细胞内质体的密度。植物学报,2004,39(4):655-667。10.1111 / j.1365 - 313 x.2004.02164.x。
- 10.
Köhler RH, Hanson MR:高等植物的质体小管具有组织特异性和发育调控作用。中国生物医学工程学报,2000,29(1):1-8。
- 11.
Marques JP, Dudeck I, Klosgen RB:在叶绿体内靶向EGFP嵌合体。中国生物医学工程学报,2003,26(3):381-387。10.1007 / s00438 - 003 - 0846 - y。
- 12.
Marques JP, Schattat MH, Hause G, Dudeck I, Klosgen RB:在活的有机体内拟南芥叶绿体中DeltapH/ tat依赖通路对折叠EGFP的转运。应用物理学报,2004,29(3):344 - 344。10.1093 / jxb / erh191。
- 13.
植物学报,2009,2(6):1262-1272。10.1093 / mp / ssp078。
- 14.
Dinant S, Lemoine R:韧皮部通路:新问题和旧争论。中国生物工程学报,2010,32(4):357 - 357。10.1016 / j.crvi.2010.01.006。
- 15.
杨晓明,杨晓明,杨晓明,杨晓明,杨晓明。拟南芥花青素合成途径的研究进展。植物科学进展,2006,30(2):344 - 344。10.1104 / pp.105.072579。
- 16.
Loreti E, Alpi A, Perata P:葡萄糖和双糖感应机制调节大麦胚胎α -淀粉酶的表达。植物科学进展,2000,23(3):339 - 344。10.1104 / pp.123.3.939。
- 17.
罗艳,刘亚波,董玉玉,高晓青,张雪生:拟南芥解旋酶的表达通过增强ROS清除和渗透调节能力来增强对非生物胁迫的耐受性。中国植物学报,2009,26(4):366 - 366。10.1016 / j.jplph.2008.06.018。
- 18.
杨晓明,王晓明,王晓明,等:拟南芥锌指蛋白Zat12在活性氧和非生物胁迫信号传导中的作用。植物生理学报,2005,39(2):344 - 344。10.1104 / pp.105.068254。
- 19.
Arce DP, Godoy AV, Tsuda K, Yamazaki K, Valle EM, Iglesias MJ, Di Mauro MF, Casalongue CA:对拟南芥三敲除突变体的分析揭示了氧化应激条件下MBF1基因的功能。中国植物学报,2010,37(3):344 - 344。10.1016 / j.jplph.2009.09.003。
- 20.
朱俊华,李伯强,Dellinger M,崔雪平,张长青,吴松,Nothnagel EA,朱建军:拟南芥抗渗透胁迫需要一种纤维素合成酶样蛋白。植物学报,2010,63(1):128-140。
- 21.
Büttner M:拟南芥中的单糖转运体(类)基因家族。中国农业科学,2007,27(3):344 - 344。10.1016 / j.febslet.2007.03.016。
- 22.
穆洛。P . Pursiheimo S . Hou CX . Tyystjarvi T . Aro EM:抗生素对叶绿体和核基因表达的多重影响。功能植物学报,2003,30(11):1097—1103。10.1071 / FP03149。
- 23.
Boulter D:植物蛋白质合成。植物生理学报,1997,21:91-10.1146/annurev.pp.21.060170.000515。
- 24.
烧伤DJW, Cundliff E:细菌蛋白合成-研究抗生素在体内作用的新系统。生物化学学报,1997,37(3):570-574。10.1111 / j.1432-1033.1973.tb03020.x。
- 25.
Moazed D, Noller HF:抗生素与16S核糖体RNA功能位点的相互作用。自然科学学报,1997,27(6):389-394。10.1038 / 327389 a0。
- 26.
黄志刚,张志刚,张志刚。烟草耐链霉素株叶绿体16s Rna基因的点突变。农学通报,1997,19(2):343-346。10.1016 / 0014 - 5793(87) 80249 - 1。
- 27.
Hanson J, Smeekens S:糖的感知和信号——一个更新。植物学报,2009,12(5):562-567。10.1016 / j.pbi.2009.07.014。
- 28.
王晓明,王晓明,王晓明,王晓明。植物生长发育中糖信号的分子网络研究。植物学报,2010,13(3):274-279。
- 29.
黄志刚,李志刚,李志刚:植物叶片衰老的代谢调控:糖信号与生物和非生物胁迫的相互作用。植物学报,2008,10:50-62。
- 30.
Sage TL, Sage RF:水稻叶片的功能解剖:光呼吸CO2再固定的意义和工程C4光合作用进入水稻的努力。植物生理学报,2009,30(4):756-772。10.1093 /卡式肺囊虫肺炎/ pcp033。
- 31.
Hanson MR, satarzadeh A: Stromules:对长期被忽视的质体形态和功能特征的最新见解。植物物理,2011。
- 32.
李志强,李志强,李志强,等:植物叶绿体突起形成的细胞骨架功能研究。植物生物学(Stuttg)。2007,9(3): 400-410。10.1055 / s - 2006 - 924727。
- 33.
Buchner O, Holzinger A, Lütz C:温度和光照对高寒植物叶片叶肉细胞叶绿体突起形成的影响。植物细胞环境,2007,30(11):1347-1356。10.1111 / j.1365-3040.2007.01707.x。
- 34.
李志强,李志强,李志强,等。植物糖信号的研究进展。植物学报,2006,29(3):344 - 344。10.1146 / annurev.arplant.57.032905.105441。
- 35.
何新浩,孙文杰:质体的非光合代谢。植物生理学与分子生物学学报,2000,51:111-140。10.1146 / annurev.arplant.51.1.111。
- 36.
王晓明,李志刚,李志刚,王志刚,王志刚,王志刚,王志刚,王志刚,王志刚。拟南芥糖调控基因的鉴定及其在体糖感知的研究进展。中国植物学报,2006,29(2):344 - 344。10.1007 / s10265 - 005 - 0251 - 1。
- 37.
李志刚,李志刚,张志刚:拟南芥糖信号转导机制的研究进展。植物学报,2004,16(8):2128-2150。10.1105 / tpc.104.022616。
- 38.
杨春华,王志刚,王志刚,王志刚:水绵植物根状茎分化过程中胼胝体物质的合成。植物生理学报,2003,44(11):1225-1228。10.1093 /卡式肺囊虫肺炎/ pcg152。
- 39.
Hadley A:我的软件结合图片来增加景深。2006,[http://www.hadleyweb.pwp.blueyonder.co.uk/]
- 40.
Schattat MH, Klösgen RB:利用“景深”扩展软件改进植物细胞显微镜图像。中国生物医学工程学报,2009,29(4):344 - 344。
确认
我们感谢Jaideep Mathur和Sebastian Schornack对手稿的有益讨论和评论;娜奥米·马蒂和迈克尔·沃兹尼帮助翻译英语;Martin Paulmann, Max Paulmann和Armin Danziger感谢他们对标记质体的支持。这项工作得到了萨克森-安哈尔特州(Exzellenznetzwerk Biowissenschaften)的资助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
MHS设计并实施了所有实验,并撰写了手稿。RBK参与了实验设计,并帮助起草和撰写了手稿。两位作者都阅读并批准了最终的手稿。
电子辅助材料
表皮细胞stromule指数和stromule频率的实验方法和绝对值
附加文件1:。一个)表皮细胞轮廓的描绘,说明了在植物表皮中发现的各种各样的细胞大小拟南芥.表皮细胞按大小分类染色。灰色显示的气孔未被考虑。尺寸条对应50 μm。B)实验过程的示意图,显示样品制备,渗透和数据采集。C)柱状图显示40 mM糖(蔗糖、山梨醇、甘露醇、葡萄糖或果糖)和缓冲对照(APW)处理的上表皮“stromule指数”平均值,计算方法见材料和方法。y轴的Scale maximum设置为1.57,对应stromule频率为1(或100%)。误差条显示99%置信区间,因此表示计算平均值的可能性。D)通过与将stromule频率转换为stromule指数的数学函数相反,将stromule指数的平均值反向转换为stromule频率值。同样的程序应用于99%置信区间。柱状图显示了每个时间点的两个值,如图c所示。为了说明stromule频率与“stromule饱和”组织的关系,y轴的最大值被设置为1(或100%)。E-F) 1 mM、10 mM和80 mM蔗糖处理的绝对stromule指数和反变换stromule频率值。(tiff格式4mb)
12870 _2011_900_moesm2_esm.tiff
附加文件2:蔗糖诱导实验的图像系列。40 mM蔗糖诱导实验时间点0 h (A)、1 h (B)、2 h (C)、3 h (D)的“堆叠”倒置灰度图像。比例尺对应10 μm。(tiff格式4mb)
栅栏实质细胞中stromule指数和stromule频率的绝对值
附加文件3:。A和B)基于栅栏薄壁细胞叶绿体的40 mM山梨醇、40 mM蔗糖、40 mM葡萄糖和APW处理的绝对stromule指数和反变换stromule频率值。(tiff格式457 kb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
Schattat, m.h., Klösgen, R.B.植物表皮叶组织中细胞外蔗糖和葡萄糖诱导stromule形成的研究拟南芥.BMC植物生物学11,115(2011)。https://doi.org/10.1186/1471-2229-11-115
收到了:
接受:
发表:
关键字
- 图像叠加
- 真空渗透
- 叶表皮
- 柱状薄壁组织
- 水槽组织