摘要
背景
在具有低磷(P)供应的土壤中,已知甘蔗比其他物种,含糖,小麦或地生等其他物种。我们假设甜菜根部渗出的有机化合物溶解土壤P并通过P饥饿刺激这种渗出。
结果
在低于和高PA的可用性下从水培中生长的植物收集根渗出物。通过HPLC分离出渗出物组分,通过电喷雾离子化,并通过质谱法在100至1000的质量射频(m / z)的范围内检测。通过低p增强八个质谱信号至少5倍所有收获时间的可用性。在这些信号中,显示具有137和147的M / Z的负离子源自水杨酸和柠檬酸。通过用磷酸钙施肥的纯物质孵育纯物质,证明了化合物来动力释放土壤p的能力。
结论
甜菜根系分泌物中含有水杨酸和柠檬酸,而后者在植物中检测较少。这两种代谢产物都能溶解土壤中的磷,根系分泌磷是由于缺磷引起的。这些结果提供了对植物来源的柠檬酸的生物学功能的首次确定。
背景
甜菜和小麦在其磷(P)效率方面相似[拍摄生产[1[但它们似乎使用不同的机制来克服土壤P.小麦的低可用性,小麦有一个大根系,当P可用性低时,糖甜菜能够实现高P流量,尽管土壤中的低可用性低[1].甜菜比其他植物有更高的磷流入不能仅仅是由于更有效的吸收生理。在磷有效度较低时,土壤磷运移是磷吸收的限制因素[2].因此,甜菜的高磷涌入归因于植物的动员在土壤中的能力,即溶解,P。这种动员是最有可能是由于根系分泌物根际的化学修饰。
植物将高达30%的吸收碳释放到根际[3.-5.].根渗出物的组成是复合物的,并且包括高分子量(HMW)和低分子量(LMW)分子。HMW渗出物包括分泌的酶和粘液,主要由多糖组成。Liebersbach等人。[6.结果表明,高分子量渗出液能提高植物对磷的有效性,这可能是因为多糖的羧基与土壤中的磷结合位点相互作用,将磷释放到土壤溶液中。高分子量渗出液中聚半乳糖酸酯的长链也可能覆盖土壤颗粒,减少磷酸盐的再吸附[7.].此外,HMW渗出物膨胀和吸水的能力可能有助于磷向根部扩散[8.].低分子量的渗出物包括有机酸、糖、酚类、氨基酸、植物铁质、类黄酮、维生素和其他化合物[4.那5.那9.].酚类可能影响铁(Fe)的络合物种,因此可能会增加由Fe-oxides封闭的P的可用性[10].有机酸,特别是柠檬酸、苹果酸和草酸,是根系分泌物中最常被调查的磷动员。
P缺陷通常会增加根部渗出速率并改变渗出物的组成[11那6.],这导致有机酸释放到土壤中[12那13].埃尔南德斯(14结果表明,磷胁迫下的菜豆根系中有机酸的含量低于磷胁迫下的菜豆根系;缺磷根中有机酸的减少可能反映了有机酸从根向根际的渗出。这些观察结果表明有机酸参与了磷的获得。
有机酸促进磷的获取有不同的机制。例如,柠檬酸可以通过结合钙(Ca)来增加土壤中磷的有效性,从而减少钙与磷的不溶性复合物的形成[15].柠檬酸盐还可以用Fe-和Al氧化物/氢氧化物(Ligand交换)替代络合物中的磷酸盐。如Gerke等人所示,这些过程将p释放到土壤溶液中。[16,他描述了枸橼酸吸附与p溶液浓度之间的正相关关系。此外,柠檬酸能与铁络合,形成可溶的柠檬酸-铁-磷聚合物,并能扩散到根部。根将Fe还原,从而破坏聚合物,直接在根表面释放P [17].因此,在不同的有机酸土壤培养实验,柠檬酸往往对磷释放的影响最大。
然而,仍然尚不清楚,无论柠檬酸盐和其他有机酸是否对P获取的有益作用实际上发生在根际。在相对高浓度的柠檬酸盐(> 1mmol L.的柠檬酸盐(> 1mmol L)中进行大多数土壤孵育实验。进行柠檬酸盐的p释放效果-1)通过根释放的有机酸的量相对较低。此外,有机酸通过根际微生物快速分解并吸附到土壤颗粒上。因为根际土壤溶液中柠檬酸盐的浓度非常低(通常<10μm; [18]),柠檬酸盐对P释放的贡献仍有质疑。例外是簇根的根际,具有比非聚类根部的根表面积和渗出率更大,并且在根际产生低pH,因此仅支持低水平的微生物活动[19那20.].在这些条件下,柠檬酸盐可能是提高植物P的可用性的关键因素。
对于没有簇根的植物,即,对于大多数植物物种,其他根渗出物化合物,代替柠檬酸盐,可以在增加P可用性时发挥重要作用。例如,鸽子豌豆的高p吸收效率是由于分枝酸的渗出[21,它的分泌量比柠檬酸低,但释放磷的效率更高。到目前为止,只有鸽子豆通过分泌鱼酸来抵消磷缺乏。除了常见的有机酸外,根系分泌物中未知的成分可能有助于植物获取土壤中的磷。这些代谢物可以通过比较低磷和高磷供应下产生的根系分泌物的组成来识别。使用高效液相色谱结合电喷雾电离和质谱(HPLC- esi - ms)特别适合于这一目的,因为它允许同时对大量物质进行无目标检测,并同时测定其分子量。
本研究的目的是使用HPLC-ESI-MS来鉴定甜菜根部的渗出物的组分,这可能会增加土壤中的P可用性。假设P缺陷型植物将大量溶解土壤P的大量化合物,从营养溶液中生长的糖甜菜植物中收集根出渗出物,其具有足够的P供应。通过差异代谢分析鉴定低P供应量在低P供应量的较大量产生的根渗出物的组分,并测试其溶解土壤中P的能力。
结果
地上部分干重,冠磷浓度
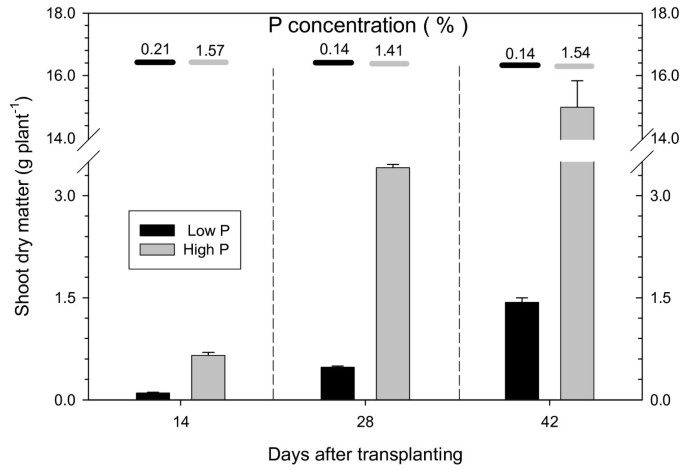
甜菜生长于营养液与2和500微摩尔P大号-1.低磷浓度导致产量下降,仅为高磷浓度下产量的10-15%(图)1).在低p处理中,芽干物质中的P浓度为0.14-0.21%,比认为足够的范围(0.35-1.10%,[22]),表明在低p下生长的植物是P缺陷。高p植物在干物质中达到了约1.5%的P浓度(图1).
渗出率
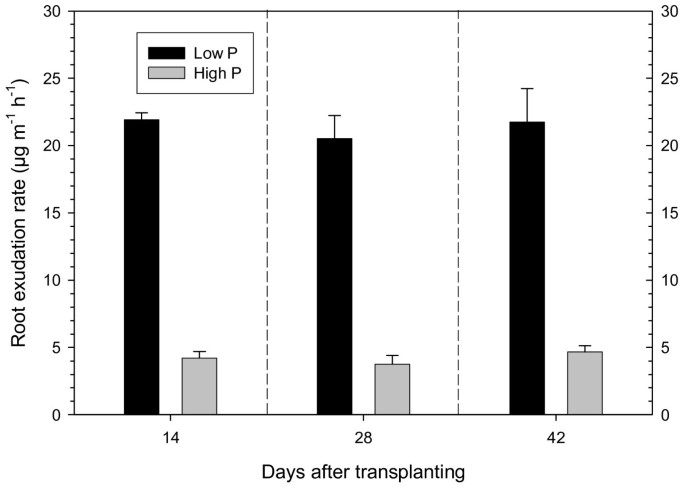
在每次收获时,在2小时内收集捕集溶液中的根出渗出物。将捕获溶液冻干,称重干物质,并考虑表明根部渗出物的量。P缺陷型植物中的渗出速度比在所有三个收获的良好供应植物中更高了4-5倍(图2).渗出率在整个生长期保持不变。在缺磷的情况下,高的渗出率,特别是高的羧酸盐渗出,常常被证明[13那16那23];又见审查琼斯[18].本研究的重点是低磷和高磷植物的分泌物组成的差异。
根分泌物的HPLC-MS分析
如方法部分所述,收集根分泌物的全扫描HPLC-MS数据。信号被归一化,分别比较每个收获的低p和高p样本。归一化数据被人工检查以去除来自溶剂加合物和同位素峰的信号。在控制中出现的背景峰被删除。比较高磷和低磷渗出液的分布,在负电离模式下共检测到55个信号,在正电离模式下共检测到12个信号,低磷渗出液的信号至少是高磷渗出液的5倍(表)1).然而,这些信号中的大多数只在一次采集时发生。在至少两次采集中,低磷条件下采集的分泌物中只有14个负模式信号高于高磷条件下采集的分泌物。其中离子[M-H]-选择M / Z为137和147进行进一步调查,因为它们不同的MS信号和收获信号之间的信号的高再现性。
土壤磷动员
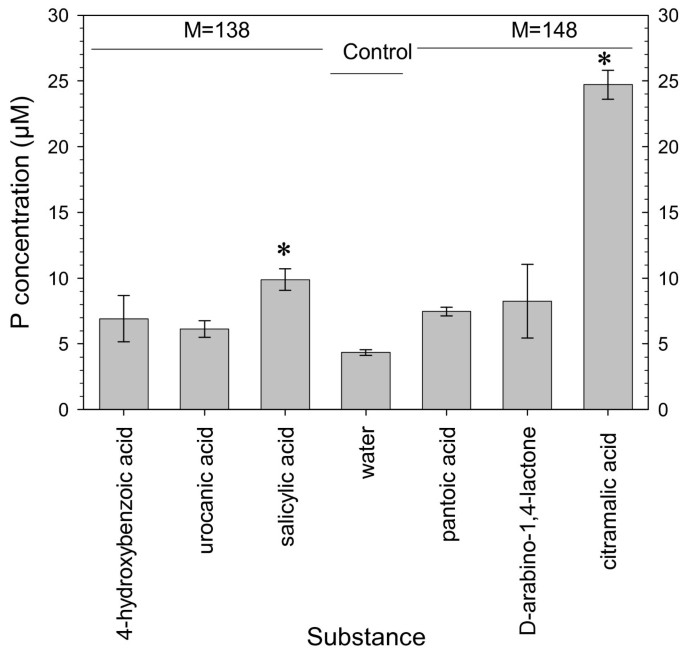
测试候选化合物的溶解溶液从土壤中溶解P.从Kegg数据库中选择六种化合物[24[基于它们的分子量,羧酸和商业可用性的存在:4-羟基苯甲酸,偶胆酸,水杨酸,松辛酸,D-亚丙基-1,4-内酯和柠檬酸。选择具有羧酸基团的化合物,因为有机阴离子对磷酸盐在土壤中磷酸盐的影响是由其官能团介导的[25],已知羧基在作用中的作用[26].P溶解实验的结果显示在图中3..显著相比水控制仅水杨酸和柠苹酸(分子量138和148,分别地)增加磷的浓度。浓度的增加是由分别2和6,一个因素。使用1毫摩尔升-1以5 mL g的比例加入候选化合物的溶液中-1结果表明,每g土壤添加5 μmol的化合物。这个量是基于22 μg m的渗出率-1H-1根际半径为0.5 mm,分泌物分子量为147。计算值增加了5倍,对应的渗出率比实际测量的高。但根系分泌物的局部浓度高于整体土壤溶液的浓度。高浓度的可溶解p的代谢物也被用来产生显著的、明确的效果。Fox等[27使用相同的浓度(1 mmol l-1)和相同的土壤溶液比(1:5),以比较有机酸在缩影地平线中动员P的能力。
甜菜根渗透物中水杨酸和拟亚酸的鉴定
将来自具有推定分子量138和148的根渗漏组分的质谱信号分别与由纯水杨酸和柠檬酸标准品产生的信号进行比较。对于这种比较,汇集了源自相同水平的P供应量的样品,得到了所有三个收获的应用,以提供高P池和低P池。基于水杨酸和HILIC用于柠檬酸的逆相色谱(参见方法部分)的保留时间和碎片模式的比较(参见方法部分),证明了具有M / Z值的根渗出物信号137 [M-H]-源自水杨酸和与的m / z值的信号147 [M-H]-起源于柠檬酸。SALICYLIC和Citramalic酸存在于源自低P和高P处理的根部渗出物中,但两种化合物的浓度高于高p处理(图4.和5.).
讨论
根分泌物从营养液中生长的根,其可以从土壤中生长的根由不同,例如,缺乏根毛收集。然而,在形成密集的根毛在营养液P缺乏条件[下28];实际上,缺磷对根毛的影响经常被研究在水培生长的根上[29].因此,可以有把握地假设,不同磷供应引起的根系渗出模式在溶液和土壤生长的植物之间是可比较的。
水杨酸和柠檬酸从土壤中调动磷的能力与它们的羧基和羟基官能有关(图)6.).有机阴离子磷酸盐的动员从土壤和金属氧化物的增加与羧酸基团的数量[效果26].羟基和羧基的相对位置是重要的[21]因为它控制了P与Fe相关的土壤中螯合Fe离子的能力。
Sapunton和Leprice研究了水杨酸对土壤中P可用性的影响[30.[谁表明,水杨酸盐增加了中性钙石酚的土壤溶液中的P浓度。Xu等人还记录了两个可变电荷土壤中的水杨酸和吸附位点之间的竞争。[31].另一方面,Fox等人[27]相比16种有机酸,发现P中溶解水杨酸和水之间没有显著差异。他们的结果之间的差异士丹顿和Leprice [30.],徐等人。[31],该研究可能是不同土壤中P的化学形式的差异引起的。
枸橼酸是一种细菌代谢物,是合成药物的重要手性组成部分,但在植物中却很少发现。目前在植物中发现柠檬酸的报道只有3篇。它是57年前在苹果皮中发现的[32],它在番茄汁中检测到[33],它被鉴定为在代谢分析期间罕见的代谢物中的一种拟南芥蒂利亚纳[34].既不是生物合成途径,也不是柠檬酸的生理功能在植物中是已知的。我们的结果为这种罕见的植物代谢物提供了生物学作用的第一个推定分配。
我们在8个质谱信号中鉴定了2个在低磷条件下甜菜根分泌物中持续增强的信号。需要进一步的工作来确定剩余化合物和评估其溶解土壤磷的能力。
结论
由下低磷可用性和由这些代谢物土壤P的增溶糖用甜菜根柠苹酸和水杨酸的增强渗出强烈表明,柠苹酸和水杨酸根渗出物的功能是增加P的可用性,同时存在在根分泌物和其功能水杨酸被建立的,柠苹酸很少被在植物中观察到前。土壤磷的溶解是植物分配给柠苹酸第一生物学作用。
方法
水培实验
甘油甜菜植物在生长室中的水培培养物中生长。甜菜种子在沙子中播种,仅使用蒸馏水长14天。选择相似尺寸的幼苗,用蒸馏水洗涤砂,并小心地转移到含有12μl的燃气营养液的罐中。该实验包括两种水平的P,三个收获日期,以及每个P级和收获日期的组合的三个复制盆。植物在16/8 H光/暗循环中生长在生长室中,25°C / 16℃,60%/ 75%相对湿度,41 W m-2PAR(白天的光合活性辐射)。营养溶液的组成为1mm Ca(不3.)2.4H2o,0.1毫米NH4.不3.,0.2 mm KCl,0.1毫米MgSO4..7h.2O,17.9μmfe-EDTA,16μmH3.博3.,9.1μmmncl2.4H2o,0.8μmznso4..7h.2O, 0.5 μm (nh4.)6.莫7.O.24.4H2O, 0.3 μM CuSO4..5H2O.磷被添加为Nah2宝4.浓度为2或500μm,分别指定为低p和高p。每个锅的幼苗数量依赖于该罐的计划收获日期:15,10和6种植物分别置于用于第一,第二和第三收获的盆中。移植后每2周收获植物。更换营养溶液,每隔一天测量pH。在每次收获时,收集根出渗出物(参见下一节),记录芽干重,在4ml HNO中消化0.3g细碎的研磨材料后测定芽P浓度3.和2ml H2O.2在175°C的压力下在微波炉中保存1小时。采用Scheffer和Pajenkamp的钼钒酸盐法测定磷[35].根长采用截线法确定[36].
根系分泌物取样
用运行的去离子水小心地洗涤整个完整的植物系统,以除去营养溶液。对于渗出物的集合,将整个根系系统浸入玻璃容器中的空气化的去离子水中,其体积依赖于根系的大小(年龄)。容器用铝箔覆盖,为根部产生黑暗条件。在对植物生长的相同控制的气候条件下,将根部保持在水中2小时。Röhmheld和Neumann [23结果表明,在2 h的短时间内,去离子水对根系没有伤害,分泌物没有发生明显的微生物降解[23].将收集的根出渗出物在-30℃下立即冷冻,冷冻干燥,称重。
HPLC-MS分析样品和标准的制备
将冻干后的根分泌物称取0.5 mg,加入乙腈100 μL。30分钟后,大力摇匀样品。然后加入900 μL的HPLC-quality water,再次摇匀,通过Teflon膜过滤器(0.2-μm孔径,13 mm直径,Optiflow-TF, Wicom Germany GmbH, Heppenheim, Germany)过滤。将枸橼酸和水杨酸标准品制备为10 mg/mL原液,甲醇:水(50:50 v/v),流动相稀释至100 ng/mL,用于柱平衡。
根渗出物的代谢分析
根分泌物的代谢分析,采用高效液相色谱系统耦合离子阱质谱仪。HPLC分离方法如下[37].用配备有电喷雾离子源(Varian,Darmstadt,德国)的500-MS LC离子阱进行质谱。雾化器和干燥气体压力分别设定为50和20psi(345和138kPa)。在梯度开始时干燥气体温度设定为350℃,并随着洗脱液中甲醇的增加而逐渐降低至250℃。为了检测正离子和负离子,将针电压设定为5000和-3500V,分别屏蔽电压至600和-600V。毛细管电压为+/-50V。在正电离模式中,在单次运行中收集具有100至1000的离子,而在负模式范围内M / Z 50-400和M / Z 400-单独扫描1000。扫描速率为5000A / s,平均三个连续扫描。使用MS Data Review 6.9(Varian)将MS数据转换为色谱图并转换为NetCDF格式。来自正极和负电离模式的数据如下分别处理:通过XCMS 1.5.2版进行的峰对准来校正保留时间的微小差异[38]在R包裹下运行2.4.0。所得到的数据被归一化以补偿由如前所述的样品的不均匀制备引起的差异[39].
选择代谢物的鉴定和分析
HPLC-MS-MS检测特异性化合物的检测在具有三重四极杆质谱仪(1200L,Varian)的相同HPLC系统上进行。在极性改性的RP-18相和蜂鸣(亲水性相互作用色谱)相对上进行色谱法。在相同的条件下分离根出渗出物和试验物质。如前所述进行RP-18色谱法[40].对于HILIC,缓冲系统由水溶液和(B)乙腈中的(a)25mM乙酸铵组成。将10μl体积的样品加载到Zic-Hilic(烯,Haltern AM See,Germany)上,与95%B平衡,并在10分钟内以95-10%B的线性梯度分离。将柱保持在40℃,流速为0.2ml / min。通过质量转变137> 93 [M-H-Co]鉴定水杨酸2]和Min的RP-18相的7.15的保留时间。柠苹酸,鉴定由质量过渡147> 87 [M-H-CH3.CoOH]和HILIC相阶段的9.2分钟的保留时间。
P溶解度实验
4-羟基苯甲酸(Fluka,Germany),尿嘧啶酸(Fluka,德国),水杨酸(Merck,德国),柠檬酸(Aldrich,德国),D-亚马诺-1,4-内酯(UK,英国)和松辛酸(从德国的Aldrich购买的Pantolactone,通过水解在0.1米NaOH中),以1mmol L的浓度在水中制备水中-1.溶液的pH调节至5.6,用NaOH或HCl。高度P定影化石Oxisol,主要含有P结合到Al和Fe与788毫克对公斤-1作为fe / al-p和330 mg p kg-1作为Ca-P,粘土含量50%,pH(CaCl2) 5.6,土壤溶液中磷浓度为0.17 μmol L-1和Ca -乳酸(CAL)可提取磷4.3 mg kg-1用100毫克对公斤受精-1的Ca(H2宝4.)2。H2O和受潮到22%w / w水含量。后10天的平衡的,9.76克潮湿的土壤(相当于8.0克干燥土壤)中的溶液用40毫升以上或用蒸馏水中列出的化合物的溶液混合。通过加入甲苯两滴防止微生物降解。每个处理重复三次。将样品以每分钟150个循环的5小时,在2660克离心相对力离心15分钟振摇上的往复式摇床,过滤虽然0.45μm的尼龙膜过滤上清液。无机磷浓度通过钼蓝比色法[41].
参考文献
- 1。
Bhadoria PBS, Steingrobe B, Claassen N, Leibersbach H:在以钙、铁和磷酸铝为主的土壤中生长的小麦和甜菜幼苗的磷效率。植物生态学报,2002,26(4):441 - 452。
- 2.
科瓦JL,CLAASSEN N:土根相互作用和磷营养ofplants。在磷:农业和环境。西姆斯JT,夏普利AN:主编。麦迪逊,农学美国社会;2005:379-414。
- 3.
Lynch JM, Whipps JM:根际基质流动。土壤学报,1999,29(1):1-10。10.1007 / BF00011685。
- 4.
Marschner H:高等植物的矿物营养。学术媒体有限; 1995年。
- 5.
whpps JM:碳经济。在根际。编辑:Lynch JM。西萨塞克斯郡。约翰·威利父子公司;1990:59 - 98。
- 6.
Liebersbach H,Steingrobobe B,Claassen N:根部调节根际的离子输送,抵消干燥土壤中的迁移率降低。植物土壤。2004,260:79-88。
- 7.
Grimal Jy,Frossard E,Morel JL:玉米根粘膜降低磷酸盐的吸附。BIOL海洋土壤。2001,33:226-230。10.1007 / S003740000312。
- 8.
Carminati A,Moradi AB,Vetterlein D,Vontobel P,Lehmann E,Weller U,Vogel HJ,Oswald SE:根际土壤水分含量的动态。植物土壤。2010,332:163-176。10.1007 / s11104-010-0283-8。
- 9.
Walker Ts,Bais HP,Grotewold E,Vivanco JM:根出渗出和根际生物学。植物理性。2003,132:44-51。10.1104 / pp.102.019661。
- 10。
Marschner H,RömheldV:收购铁的植物策略。植物土壤。1994年,165:261-274。10.1007 / BF00008069。
- 11.
张志强,刘志强,刘志强:植物根系分泌物和化感物质在根际土壤中的作用。植物生态学报,2003,32(6):689 - 694。
- 12.
黄志强,王志强,王志强:缺磷羽扇豆对根系二氧化碳的固定作用。蛋白质类根对有机酸渗出的贡献。植物生理学报,1996,12(4):491 - 498。10.1104 / pp.112.1.31。
- 13.
Neumann G,RömheldV:含磷缺乏植物中羧酸和质子的根排泄。植物土壤。1999年,211:121-130。10.1023 /答:1004380832118。
- 14.
Hernandez G,Ramirez M,Valdes-Lopez o,Tesfaye M,Graham Ma,Czechowski T,Schleeth A,Wandrey M,Erban A,Cheung F,Wu HC,Lara M,Town CD,Kopka J,Udvardi Mk,Vance Cp:常见豆类中的磷胁迫:根转录和代谢反应。植物理性。2007,144:752-767。10.1104 / pp.107.096958。
- 15.
丁kelaker B, Römheld V, Marschner H:白露平根际柠檬酸的排泄和柠檬酸钙的沉淀Lupinus阿不思·l .)。植物细胞环境。1989,12:285-292。10.1111 / J.1365-3040.1989.TB01942.x。
- 16.
GerkeĴ,BeißnerL,罗梅尔宽:通过上吸磷羧酸盐阴离子由单个根化学磷酸盐动员的定量效果。一,基本概念和土壤参数的确定。Ĵ植物营养土壤科学。2000,163:207-212。10.1002 /(SICI)1522年至2624年(200004)163:2 <207 :: AID-JPLN207> 3.0.CO; 2-P。
- 17.
Gardner WK,Barber Da,Parbery DG:磷的收购卢普斯·阿尔巴斯l . III。磷在土壤/根界面中运动增强的可能机制。植物土壤。1983,70:107-124。10.1007 / BF02374754。
- 18.
琼斯DL:根际有机酸 - 一个批判性评论。植物土壤。1998年,205:25-44。10.1023 /答:1004356007312。
- 19.
Hoffland E,Findengg Gr,Nelemans Ja:强奸磷酸盐的溶解。II。局部根系渗出有机酸作为对P饥饿的反应。植物土壤。1989,113:161-165。10.1007 / BF02280176。
- 20。
Kania A,Neumann G,Cesco S,Pinton R,RömheldV:使用血浆膜囊泡以检查白羽磺尼簇根系柠檬酸盐的缺乏诱导的根排泄(卢普斯·阿尔巴斯l .)。通过基础和应用研究植物营养 - 食品安全和农业生态系统的可持续性。编辑:Horst WWJ,Schenk Mk,BürkertA. 2001,Dordrecht,Kluwer学术出版商,546-547。
- 21。
王志强,王志强,王志强,等:大豆对土壤磷的吸收及其在农业生产中的作用。中国科学:地球科学。10.1126 / science.248.4954.477。
- 22。
温带和热带作物。植物分析:解释手册。编辑:路透社DJ, Robinson JB。1997,澳大利亚,CSIRO, 83-284。
- 23。
Neumann G,Römheldv:根除释放物的释放渗出物的含蓄的佩戴者的生理状态。在根际 - 土壤 - 植物界面的生物化学和有机臂。编辑:Pinton R,Varanini Z,Nannipieri P. New York,Marcel Decker,Inc;2001年:41-93。
- 24.
Masoudi-Nejad A, Goto S, Endo TR, Kanehisa M: KEGG生物信息学资源用于植物基因组学研究。方法:中国生物医学工程学报。
- 25.
Hue NV:有机酸/阴离子对不同矿物质的土壤中P吸附和Phytoavailave的影响。土壤SCI。1991,152:463-471。10.1097 / 00010694-199112000-00009
- 26.
低分子量有机酸对磷酸盐增溶的影响。植物营养与肥料学报,1994,18:311-319。10.1007 / BF00570634。
- 27.
Fox Tr,Comerford Nb,McFee WW:磷和铝释放由有机酸介导的略微的地平线。土壤SCI SOC AM J 1990,54:1763-1767。10.2136 / SSSAJ1990.03615995005400060043x
- 28.
Foehse D,Jungk A:磷酸盐和硝酸盐供应对强奸,菠菜和番茄植物根毛的影响。植物和土壤。1983,74:359-368。10.1007 / BF02181353。
- 29.
小麦和大麦品种根毛对磷的吸收。植物生态学报。1998,19(4):497 - 503。10.1023 /: 1004270201418。
- 30.
王志强,王志强。土壤磷的生物有效性研究进展。环境科学学报,2003,23(4):427 - 434。土壤通报,1998,31(4):441 - 446。10.1111 / j.1365-2389.1996.tb01394.x。
- 31。
许RK,萧SC,张H,姜Ĵ,籍GL:通过由硫酸根和磷酸根的影响两个可变电荷土壤邻苯二甲酸和水杨酸的吸附。EUR J土壤SCI。2007年,58:335-342。10.1111 / j.1365-2389.2006.00842.x。
- 32。
hulme cc:从苹果果皮果皮中分离L-柠檬酸。Biochim Biophys Acta。1954,14:36-43。
- 33。
Marconi o,佛罗里达州,Montanari L:通过HPLC检测通过HPLC番茄汁的有机酸谱。J Food Urd。2007,30:253-266。10.1111 / J.1745-4557.2007.00119.x。
- 34。
Fiehn O,Kopka J,Trethewey RN,Wilmitzer L:基于使用气相色谱和四极杆质谱法计算元素组合物的罕见植物代谢物。肛门化学。2000,72:3573-3580。10.1021 / AC991142i。
- 35。
雅伯楼Pajenkamp H:Phosphatbestimmung在Pflanzenaschen NACH DERMolibdän-Vanadin-了Methode。Ĵ植物营养土壤科学。1952年,56:2-8。
- 36.
一种估计根长度的修正线相交法的测试。中国科学:地球科学。10.2307 / 2258617。
- 37.
杨志强,李志强,李志强,等。木质部液中水杨酸和水杨酸苷的含量及其与木质部液中水杨酸的关系芸苔栗鸟感染了verticillium longisporum.j植物res。2009,122:571-579。10.1007 / S10265-009-0237-5。
- 38.
史密斯CA,Want EJ,O'Maille G,Abagyan R,Suizdak G:XCMS:使用非线性峰对准,匹配和识别处理代谢物分析的质谱数据。肛门化学。2006,78:779-787。10.1021 / AC051437Y。
- 39.
芝麻代谢与基因组多样性的关系(胡麻属indicuml .)。基因组学杂志。2008,9:250-10.1186/1471-2164-9-250。
- 40。
阿德朱莫,赫莱赫·乌,卡洛夫斯基P:来自尼日利亚西南尼日利亚的玉米调查,α-和β-酸甲醛,Fumonisin B1和羊皮蛋白镰刀菌素物种。食物加入污染。2007,24:993-1000。10.1080 / 02652030701317285
- 41。
一种改进的单溶液法测定天然水体中磷酸盐的方法。Acta geographica sinica, 1962, 27: 31-36。
确认
AR是由德国德国德国Forschungsgemeinschaft(DFG)的546号研究单位的支持支持。
作者信息
隶属关系
通讯作者
附加信息
作者的贡献
RK进行了水培实验和P溶解试验。UH和AR进行了根渗透组分的代谢分析和分析。BS设计和监督P Solibilization实验。PK引导代谢分析并写下数据处理的脚本。NC构思了这项研究。所有作者都评估了数据,写了一部分稿件并批准了提交的稿件。
作者为图像提交的原始文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0.)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
Khorassani,R.,Hettwer,U.,Ratzinger,A。等等。甜菜根系分泌物中柠檬酸和水杨酸对土壤磷有溶解作用。BMC植物杂志11,121(2011)。https://doi.org/10.1186/1471-2229-11-121
已收到:
公认:
发表:
关键词
- 水杨酸
- 甜菜
- 根渗出
- 群集根
- 糖用甜菜植物