- 研究文章GydF4y2Ba
- 开放访问GydF4y2Ba
- 发表:GydF4y2Ba
在橄榄期间表达的亚莱蛋白酶的表征(GydF4y2BaOlea EuropaeaGydF4y2BaL.)花粉个体发育GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba11.GydF4y2Ba, 文章编号:GydF4y2Ba122.GydF4y2Ba(GydF4y2Ba2011年GydF4y2Ba)GydF4y2Ba
抽象的GydF4y2Ba
背景GydF4y2Ba
橄榄树是一种油储存品种,花粉是储存脂肪合成的第二个最活跃的部位。Caleosins是种子萌发期间参与存储脂质动员蛋白。尽管不同的脂质结构在花药的存在,也有关于caleosins在本机关至今存在任何数据。本研究的目的是表征在橄榄花药的花粉在个体发育的不同关键阶段表达了caleosin,以解开其生物学功能在重放的第一途径。GydF4y2Ba
结果GydF4y2Ba
通过蛋白质印迹分析在花药组织中鉴定了30kDa亚葡聚糖蛋白。使用荧光和透射电子显微镜免疫致统化方法,首先将蛋白质定位在自由孢子阶段的凹版细胞中。将亚硒酸酯释放到花药时,并进一步沉积在花粉外部的雕塑上。随着花药的开发,塔皮特细胞显示由含有含有含糖蛋白素的脂液体构成的结构的存在,并且由ER-衍生的岩壁和囊泡包围。塔皮特细胞丧失完整性后,含有含胞苷的残余物的绦虫填充了成熟花粉外来的空腔,形成花粉涂层。在发育梭菌中,最初在外出雕塑上检测到这种亚葡聚糖。在花粉成熟期间,含有油体同时逐渐增加的糖聚蛋白水平逐渐增加。橄榄花粉胶囊能够结合钙GydF4y2Ba体外GydF4y2Ba.此外,Pegymation实验支持从种子油体的亚硒蛋白表明的结构构象模型。GydF4y2Ba
结论GydF4y2Ba
在橄榄花药中,胶林蛋白在翅膀和种系细胞中表达,其合成独立调节。花粉油体相关的糖苷由营养细胞合成,而位于花粉外来的蛋白质及其涂层具有孢子素的来源。具有脂质储存花粉的物种在生殖过程中的亚罗氏蛋白酶的生物学意义可能取决于其亚细胞施加。花粉内亚葡聚糖素可以在花粉成熟期间参与OB生物生物。位于外部的蛋白质可能在花粉水合和萌发过程中发挥花粉 - 耻辱相互作用的作用。GydF4y2Ba
背景GydF4y2Ba
在被子植物中,雄蕊在哪里花粉发育出现花器官。每个雄蕊通常由茎(即灯丝)和具有四个花粉囊或孢子囊[一个bilobed花药的GydF4y2Ba1GydF4y2Ba].在花药的横截面,三个不同的隔室是可区分的:花药壁(即孢子体组织),则子房室和显影花粉粒(即雄性配子体)。花药壁包括结缔组织和即四个周围心室细胞层两者,从外到内,表皮,,中间层和绒毡层。绒毡层细胞合成和分泌几种不同的化合物的locular空间,包括营养物,代谢物和前体壁,以促进和调节花粉发育[GydF4y2Ba1GydF4y2Ba].在花药发育过程中,绒毡层经历程序性细胞死亡(PCD),并形成脂质团,沉积在花粉壁表面[GydF4y2Ba2GydF4y2Ba].因此,花药间流体代表了花药壁和符合符合符合孤立的花粉颗粒之间的化学环节[GydF4y2Ba3.GydF4y2Ba].花粉发育始于花粉母细胞(PMC)减数分裂形成四分体的单倍体小孢子,这些小孢子被胼胝质壁包围。绒毡层β-1,3-葡聚糖酶降解胼胝质后GydF4y2Ba4.GydF4y2Ba,小孢子被释放并进行有丝分裂,产生双细胞花粉粒。每个花粉粒包括一个大的营养细胞,营养细胞包围着一个小的生殖细胞,生殖细胞分裂形成两个精子细胞。在花粉成熟过程中,营养细胞积累了大量的贮藏化合物,这些化合物将进一步用于花粉萌发和花粉管的早期生长[GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba].GydF4y2Ba
中性脂质构成许多真核细胞中的主要能源[GydF4y2Ba7.GydF4y2Ba].在植物组织中,它们仅限于分离的球形液滴,称为油体(OBs)[GydF4y2Ba8.GydF4y2Ba].油体经常被视为支持细胞中活性新陈代谢期的简单储存网站[GydF4y2Ba7.GydF4y2Ba[但是,近期数据表明,这些细胞器涉及血液亚细胞过程,如脂质贩运和营业额,以及钙介导的信号传导[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10.GydF4y2Ba].在结构上,已经提出了OBS组成的含有中性脂质的疏水核,例如三酰基甘油(标签)和甾醇酯,被嵌入有少数独特的蛋白质,即油糖苷,碳糖苷和杀虫磷脂的单层磷脂(PLS)包围[GydF4y2Ba11.GydF4y2Ba-GydF4y2Ba14.GydF4y2Ba].GydF4y2Ba
亚硒酸盐属于在高等植物中发现的大型基因家族,并在几种脂质积累的真菌中发现[GydF4y2Ba7.GydF4y2Ba].所有亚硒蛋白有三种结构特征:一个保存良好的EF手,钙结合图案[GydF4y2Ba11.GydF4y2Ba],中央疏水区与潜在脂质结合结构域和具有几个推定磷酸化位点的C末端。Caleosins位于脂质体的表面上或与ER-子域相关联[GydF4y2Ba15.GydF4y2Ba].这些蛋白被认为是通过钙参与信号转导在例如膜膨胀,脂质贩卖和OB生物发生和动员[过程结合或磷酸化/去磷酸化GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10.GydF4y2Ba].Ob衍生标签的LiNoleate部分(18:2)通过特异性脂氧合酶氧化至(9Z,11e,13秒)-13-二烯酸(13-HPOD)氧化至(9Z,11E,13S)-13-二烯酸(13-HPOD)[GydF4y2Ba16.GydF4y2Ba那GydF4y2Ba17.GydF4y2Ba].它已经假定13-HPOD可能被减少到(9Z,11E,13S)-13-羟基十八碳-9,11-二烯酸(13-HOD),推测是由OB caleosin的过氧化酶活性[GydF4y2Ba18.GydF4y2Ba],以及释放到细胞质[GydF4y2Ba19.GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba].此外,caleosin的表达似乎受到生物和非生物胁迫因子的上调,因此这些蛋白可能参与了oxylipin的代谢[GydF4y2Ba21.GydF4y2Ba-GydF4y2Ba23.GydF4y2Ba].GydF4y2Ba
几个橄榄(GydF4y2BaOlea EuropaeaGydF4y2BaL.)的器官和组织已被报道含有大量的储存脂质[GydF4y2Ba24.GydF4y2Ba-GydF4y2Ba28.GydF4y2Ba]花粉粒是TAG生物合成中仅次于种子的第二活跃部位[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba29.GydF4y2Ba].橄榄花药的翅膀细胞产生胞质脂质结构,称为Pro-Orbicules(或Pro-Ubisch体),以及一种称为Plastoglobuli的独特血液脂质体[GydF4y2Ba24.GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba].胞间卟啉通过外尿剂分泌到花药型,并含有合成花粉外部所必需的酰基前体。PLASTOGLOBULI在PCD接受PCD后释放到轨迹[GydF4y2Ba2GydF4y2Ba]这些脂质结构覆盖外壁,形成花粉粒的最外层,即花粉被,它在授粉中具有重要功能[GydF4y2Ba6.GydF4y2Ba].成熟花粉粒也在营养细胞的细胞质中积累了大量的OBs [GydF4y2Ba24.GydF4y2Ba那GydF4y2Ba26.GydF4y2Ba那GydF4y2Ba27.GydF4y2Ba].在花粉水合过程中,这些细胞器在孔附近偏振,花粉管出现的光圈GydF4y2Ba27.GydF4y2Ba].然后,在萌发和生长期间,OBS在花粉管内逐渐动员[GydF4y2Ba31.GydF4y2Ba].这些数据表明,OBS可以在耻辱中发芽的早期阶段提供花粉颗粒,以便在花粉管的快速生长[GydF4y2Ba32.GydF4y2Ba].GydF4y2Ba
在前一篇论文中,在成熟的橄榄花粉中鉴定了约30kDa的Ob相关的糖蛋白[GydF4y2Ba31.GydF4y2Ba].该蛋白质的表达模式与OBS动态之间的表观同步性表明,在花粉萌发期间,它可能在动员储存脂质中的动员中发挥作用,以及在膜隔室的重组中,在花粉萌发过程中[GydF4y2Ba31.GydF4y2Ba].尽管存在大量的橄榄花药组织中的脂质结构,但对其生物发生时几乎不知道,并且没有关于糖苷期间在花药开发期间的存在和功能的数据已发布于迄今为止。本文是关于橄榄油储存物种花液中的胶囊细胞定位和表达模式的第一个报告(GydF4y2BaOlea EuropaeaGydF4y2BaL.)。讨论了这种亚葡聚糖在橄榄性繁殖的背景下的推定功能。GydF4y2Ba
结果GydF4y2Ba
橄榄花药发育过程中OBs的行为GydF4y2Ba
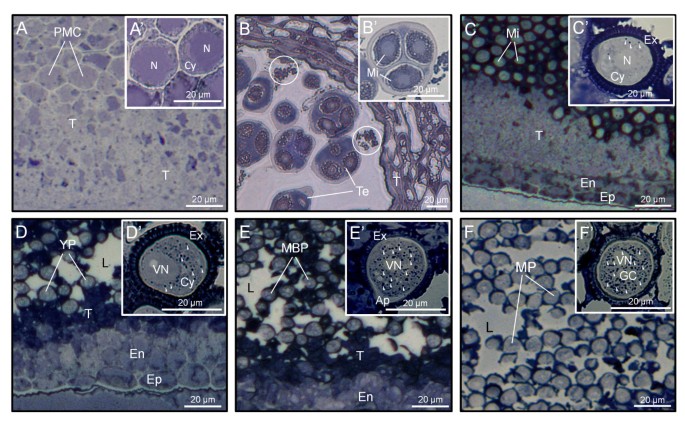
苏丹黑B技术用于在花药组细胞期间研究OB分布和行为。在开发的早期阶段,当花药含有PMC时,中性脂质的含量非常低,在PMC或花药的任何其他组织中观察到OBS(图GydF4y2Ba1a,a'GydF4y2Ba).在Tetrad阶段,花药组织似乎微弱地染色,而花药的含量含有粒状外观的脂质物质(图GydF4y2Ba1B.GydF4y2Ba).面对室的绒毡层边缘也有稠密的染色。当小孢子从四分体中释放出来后,我们发现绒毡层细胞和花药室中脂质物质显著增加,染色较密(图)GydF4y2Ba1CGydF4y2Ba).在这个阶段,很少有OBS在发育micropores的细胞质中分散,而外部呈现大量染色(图GydF4y2Ba1C'GydF4y2Ba).在微孔第一有丝分裂后,塔皮组织,具有明显变性的症状,含有强烈染色的大量中性脂质(图GydF4y2Ba1DGydF4y2Ba)。在这一阶段,室液染色不均匀,脂质形成斑块,主要分布在发育中的花粉粒附近。在年轻花粉粒的细胞质中观察到OBs的数量显著增加,同时花粉壁也被严重染色(图1)GydF4y2Ba1D'GydF4y2Ba).在花粉成熟步骤期间,营养细胞的细胞质中存在的OBS的数量逐渐增加(图GydF4y2Ba1E'GydF4y2Ba),而花药中的中性脂质的量减少并形成密集染色的斑块(图GydF4y2Ba1EGydF4y2Ba)在开花前,绒毡层的残余仍然被浓密染色。花药室中的脂质显著减少,并且大部分覆盖在花粉壁上(图1)GydF4y2Ba1F.GydF4y2Ba).在这个阶段,成熟花粉粒的细胞质中充满了大量的OBs(图)GydF4y2Ba1F.GydF4y2Ba')。GydF4y2Ba
橄榄花药切片中中性脂质的苏丹黑B染色GydF4y2Ba.Light microscopy sections (A-F) -and enlarged views (A'-F')- of olive anthers at the PMC (A and A'), Te (B and B'), Mi (C and C'), YP (D and D'), MBP (E and E') and MP (F and F') stages. Oil bodies are indicated by arrowheads, while circles denote lipidic masses. Ap: pollen aperture; Cy: cytoplasm; En: endothecium; Ep: epidermis; GC: generative cell; L: anther locule; MBP: mid bicellular pollen grain; Mi: microspore; MP: mature pollen grain; N: microspore nucleus; PMC: pollen mother cell; T: tapetum; Te: tetrad; VN: vegetative nucleus; YP: young pollen grain.
糖苷在橄榄花药开发期间的表达GydF4y2Ba
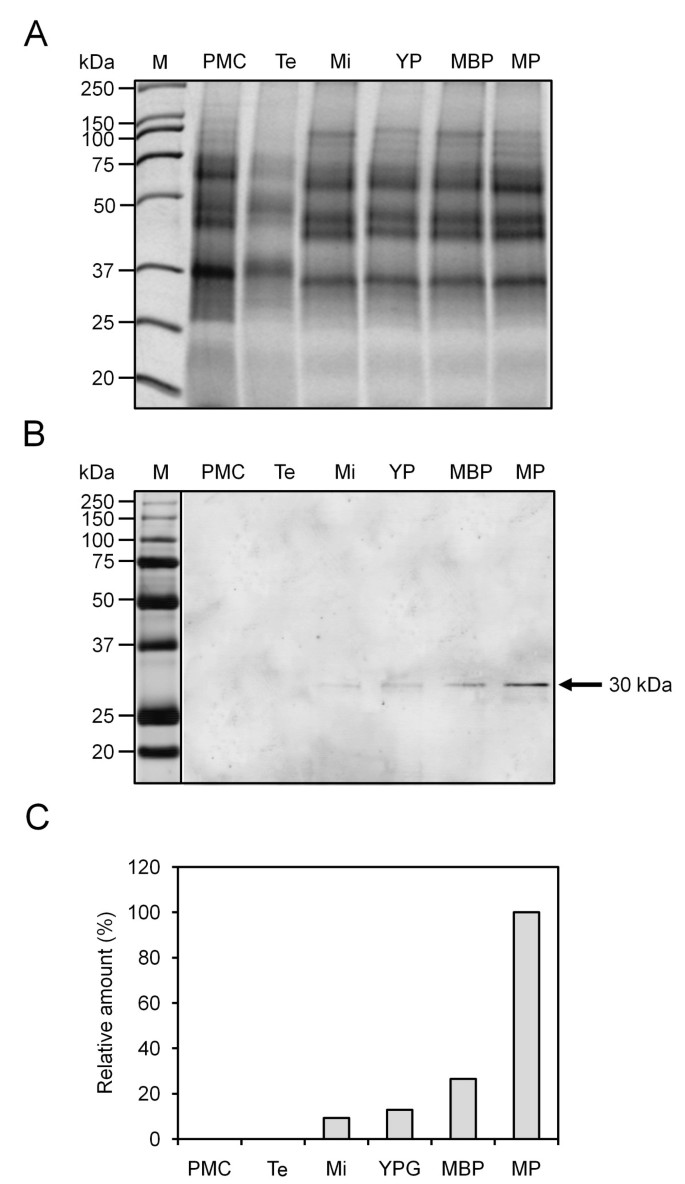
Western印迹实验表明,在橄榄的发展水表中存在约30kDa的带,其被FL AB交叉识别(图GydF4y2Ba2GydF4y2Ba).该抗体的特异性在以往的工作证明[GydF4y2Ba31.GydF4y2Ba].因此,减少后几乎不检测到微弱的蛋白质带。在花粉成熟的后续步骤和随后的花粉成熟步骤后,亚葡聚糖水平显着增加(图GydF4y2Ba2B.GydF4y2Ba).在花药开发的早期阶段没有检测蛋白质。密度计量数据显示,亚罗宾的最高表达发生在花粉成熟,只是花开花花粉和脱裂(图GydF4y2Ba2CGydF4y2Ba).GydF4y2Ba
花药组织中胶囊的免疫循环化GydF4y2Ba
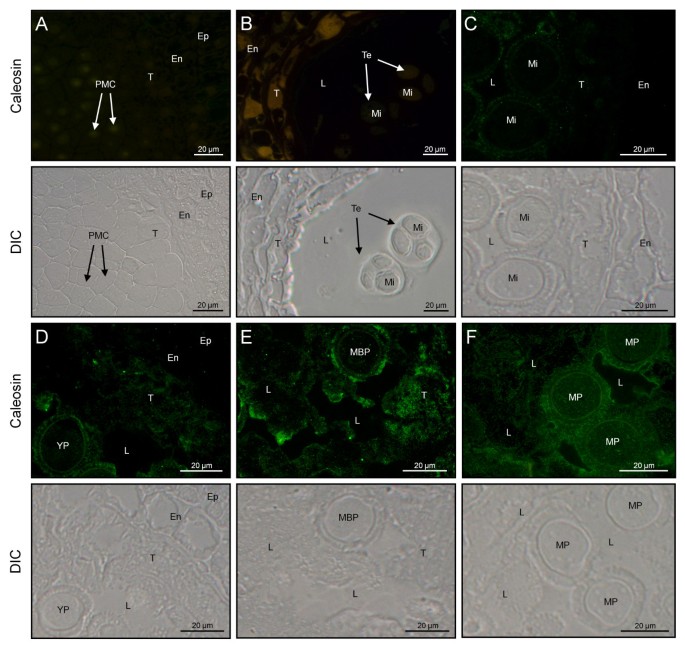
用荧光显微镜和透射电镜观察了30kda -caleosin在花药发育过程中的细胞定位。在含有小孢子细胞的年轻花药中,花药中荧光信号的缺乏表明在发育的那个点上钙红素缺乏(图GydF4y2Ba3AGydF4y2Ba).首先在自由孢子阶段检测到亚霉素。蛋白质位于翅扣和宫殿液中,以及在外出层中,而显影微孔的细胞质缺乏显着的荧光标记(图GydF4y2Ba3B.GydF4y2Ba).小孢子有丝分裂后,绒毡层组织中caleosin水平增加(图GydF4y2Ba3CGydF4y2Ba)。在这个阶段,花粉粒的细胞质中开始出现斑点状荧光图案(图GydF4y2Ba3CGydF4y2Ba).在花粉成熟过程中,荧光物质斑块在花药室中分布不一致,主要位于发育中的花粉粒附近(图)GydF4y2Ba3dGydF4y2Ba[此外,荧光强度在花粉晶粒的细胞壁和细胞质中增加。在花粉成熟结束时,荧光标记在粘附在花粉壁上的材料中最高,并在营养细胞的细胞质内部(图GydF4y2Ba3EGydF4y2Ba).在退化的Tapetum中,观察到荧光信号的显着降低。GydF4y2Ba
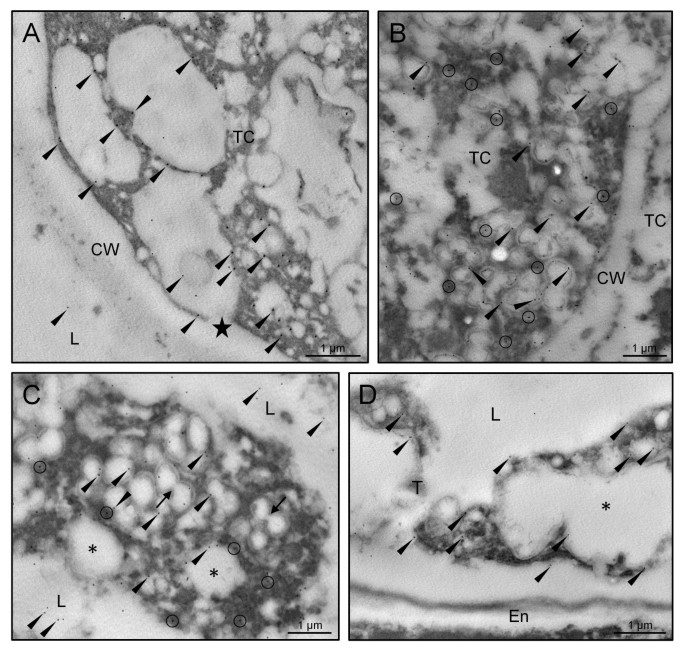
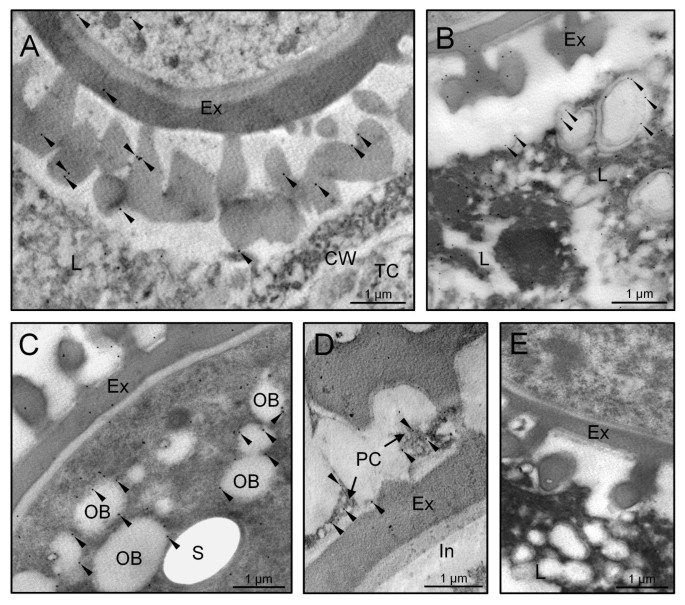
橄榄色开发的30kDa胶囊中的金免疫标签提供有关其亚细胞定位的额外细节,并确认了通过荧光显微镜观察的组织分布模式。在幼小微孔阶段,金颗粒位于填充翅膀细胞的细胞质的许多囊泡的边界上。这些囊泡与细胞膜融合并将其含量释放到花药区域和翅膀外细胞间空间(图GydF4y2Ba4AGydF4y2Ba).孢子空泡化之前,为了有丝分裂后,脂质液滴填充绒毡层细胞的细胞质中,以及在紧密结合ER潴的表面(图上未找到caleosinsGydF4y2Ba4B.GydF4y2Ba).微孔有丝分裂后,塔皮特细胞接受了PCD并失去了完整性。在嵌入电子 - 密集材料中填充的脂液滴的边界上检测到亚葡萄糖素,含有彼得塞纳雷,其含有附着在其表面上的金颗粒(图GydF4y2Ba4CGydF4y2Ba).脂滴合并(图GydF4y2Ba4CGydF4y2Ba,箭头)和他们的炮弹也显示金标记。在花粉成熟结束时,在绒毡层减少到大油滴与电子致密材料,其仍显示出附加了一些金颗粒的补丁(图GydF4y2Ba4D.GydF4y2Ba).GydF4y2Ba
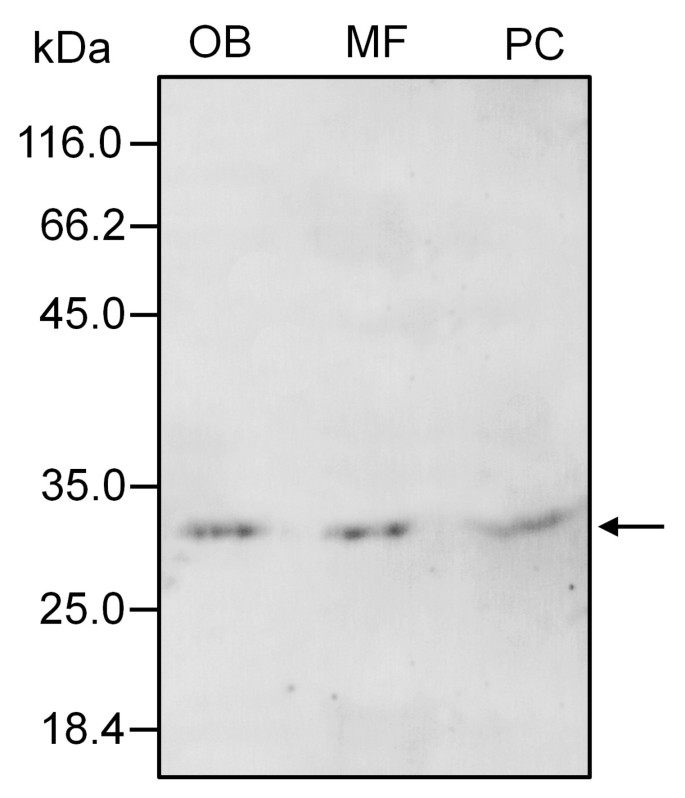
在小孢子发育的早期阶段,少量的金颗粒也位于外壁雕塑中,并与分散在发育中的小孢子细胞质中的短ER池相关(图)GydF4y2Ba5GydF4y2Ba).将亚霉素与电子 - 致密材料一起沉积在成形外部(图GydF4y2Ba5GydF4y2Ba).随着微孔的漂浮液化进展,膨胀层和微孔细胞质的金颗粒的数量显着高(未显示数据)。在双细胞花粉形成时,在进出层中存在亚硼丝(图)增加(图GydF4y2Ba5 bGydF4y2Ba).在花药时,金颗粒出现在油体和腹部的边界上。随着花粉成熟的进展,金颗粒的数量增加(图GydF4y2Ba5度GydF4y2Ba和GydF4y2Ba5 dGydF4y2Ba).信号定位于分布在营养细胞胞浆中的大量OBs的边界,并与ER池相关(图)GydF4y2Ba5度GydF4y2Ba).此外,在衍生自填充外出腔的牵引的电子致密碎片中发现了亚霉素(图GydF4y2Ba5 dGydF4y2Ba).内脏、营养核和生殖细胞均无金颗粒。对照反应省略了原抗体,没有显示任何显著的标记(图)GydF4y2Ba5 eGydF4y2Ba).在亚细胞分级后,Western印迹分析证实了花粉OBS中独特的糖苷和微粒体馏分以及花粉涂层(图GydF4y2Ba6.GydF4y2Ba).GydF4y2Ba
橄榄花粉糖苷的钙结合能力GydF4y2Ba
花粉糖蛋白结合钙的能力GydF4y2Ba体外GydF4y2Ba经过测试。从OBS和花粉涂层中分离出亚霉素,并用EGTA处理以除去内源性CAGydF4y2Ba2+GydF4y2Ba.然后,caleosins进行电泳,并通过Western印迹免疫检测。在这两种花粉纯化的OB(图GydF4y2Ba7AGydF4y2Ba)和花粉涂层提取物(图GydF4y2Ba7B.GydF4y2Ba),钙红蛋白在CaGydF4y2Ba2+GydF4y2Ba治疗。因此,CaGydF4y2Ba2+GydF4y2Ba- 通过EGTA治疗延迟了链胶囊。与MG等其他阳离子一起孵育后没有发现移动偏移GydF4y2Ba2+GydF4y2Ba或者KGydF4y2Ba+GydF4y2Ba(数据未显示)。GydF4y2Ba
橄榄花粉胶囊的结构构象GydF4y2Ba
为了检查橄榄花粉的N-和C-末端域是否暴露于胞浆溶胶,我们使用30kDa碳糖苷作为OB标记进行分离的OB进行聚乙二醇化测定。为此目的,使用与巯基Cys残基反应的膜不可渗透探针(PEG-MAL,5,000da)。PEG-MAL为每个SH封闭增加5kDA,因此Pegymated OBS在SDS-PAGE中迁移慢于非聚乙二醇化OBS。因此,SDS-PAGE中较高质量分子带的数量应对应于蛋白质中存在的CYS的数量。在我们的实验中,观察到单一突出的分子量乐谱,表明只有一个Cys残留物与PEG-MAL反应(图GydF4y2Ba8.GydF4y2Ba).GydF4y2Ba
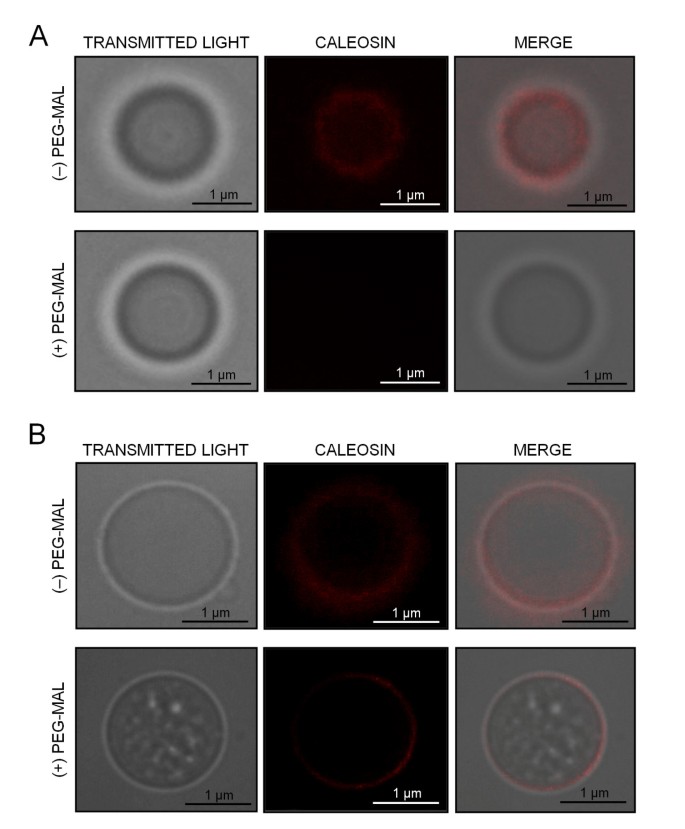
同时,我们开展了两种聚乙二醇化和非聚乙二醇化的OB免疫定位试验,以检查两个反Clo3抗体的可访问性(图GydF4y2Ba9.GydF4y2Ba).的FL抗体是能够识别caleosin非PEG化的OB的表面上,被可视作为红色荧光标记(图GydF4y2Ba9AGydF4y2Ba,上半部分)。聚乙二醇化阻碍了FL Ab与蛋白质的结合,导致荧光丧失(图)GydF4y2Ba9AGydF4y2Ba较低的面板)。同样,αN Ab与caleosin结合并产生红色荧光信号(图)GydF4y2Ba9B.GydF4y2Ba,上半部分)。然而,聚乙二醇化并没有妨碍αN抗体的caleosin(图结合GydF4y2Ba9B.GydF4y2Ba较低的面板)。这些结果表明:i) FL Ab特异性识别蛋白的C端结构域,ii)蛋白的C端和n端结构域都暴露在细胞质中。GydF4y2Ba
讨论GydF4y2Ba
花药Tapetum是开发花粉粒的营养和细胞壁前体的主要供应商[GydF4y2Ba6.GydF4y2Ba].该组织在发育过程中积累了大量的脂质材料,并且该过程中的任何异常都导致Tapetum形态和花粉膨胀的缺陷导致缺陷[GydF4y2Ba33.GydF4y2Ba].橄榄花药的塔皮特细胞缺乏典型的种子OB [GydF4y2Ba8.GydF4y2Ba].然而,在中间二胞花粉阶段,绒毡层细胞显示大量的含脂质的微滴,紧密堆积和通过ER衍生的小管和囊泡包围。这些结构类似于非常那些被称为tapetosomes [GydF4y2Ba34.GydF4y2Ba,在种的绒毡层中有描述GydF4y2BaBrassicaceae.GydF4y2Ba家族[GydF4y2Ba34.GydF4y2Ba-GydF4y2Ba37.GydF4y2Ba].然而,这些结构在橄榄中表现出一些形态上的差异GydF4y2BaBrassicaceae.GydF4y2Batapetosomes。例如,橄榄中的脂滴并没有显示出电子密集的结构,甚至在锇膜固定后也没有[GydF4y2Ba27.GydF4y2Ba那GydF4y2Ba38.GydF4y2Ba,可能是因为它们的脂质组成不同。这一事实使我们能够更好地观察相关的内质网膜。此外,tapetosomes从GydF4y2BaBrassicaceae.GydF4y2Ba被描述为离散实体[GydF4y2Ba34.GydF4y2Ba那GydF4y2Ba39.GydF4y2Ba],而在橄榄中报道的结构显示概述不明确。可以通过方法(即样品处理)差异来解释这种结构差异,因为绦虫是渗透活性的细胞器[GydF4y2Ba34.GydF4y2Ba].GydF4y2Ba
橄榄翅膀是顶型型,当梭毛孢子从四边形释放时,塔皮特壁开始崩解[GydF4y2Ba24.GydF4y2Ba].在完成橄榄翅膀劣化后,将含有脂液滴和ER-囊泡的结构释放到当地并沉积在显影花粉的表面上。在成熟的最终阶段,蓟马的电子密集残余物填充了外腔。这些结果与先前的观察结果一致GydF4y2Ba芸苔GydF4y2Ba[GydF4y2Ba40GydF4y2Ba],并表明这些脂质液滴和ER-囊泡也有助于在橄榄中形成花粉涂层。在GydF4y2Ba芸苔GydF4y2BaTapetosomes,脂液滴的组成类似于种子油体,主要含有标签和PLS [GydF4y2Ba34.GydF4y2Ba那GydF4y2Ba37.GydF4y2Ba那GydF4y2Ba41.GydF4y2Ba].这些标签在花药成熟过程中消失[GydF4y2Ba42.GydF4y2Ba],在脂质液滴和ER-衍生的囊泡中储存烷烃和黄酮类化合物[GydF4y2Ba37.GydF4y2Ba那GydF4y2Ba40GydF4y2Ba].我们可以推测橄榄中可能发生类似的东西,尽管有必要进行额外的实验来确认这一假设。关于Tapetosome功能的最早证据表明,将烷烃和黄酮醇排放到花粉表面并保护来自紫外损伤和干燥的花粉粒[GydF4y2Ba40GydF4y2Ba].此外,影响绒毡体生物发生的基因突变导致花粉被膜形成缺陷和花粉育性降低[GydF4y2Ba43.GydF4y2Ba].GydF4y2Ba
目前关于caleosin在高等植物生殖组织中的存在和功能的资料非常少。在之前的一篇文章中,我们从橄榄花粉中发现了一种新的caleosin,它可能参与了花粉萌发过程中OB的动员和膜室重组[GydF4y2Ba31.GydF4y2Ba].据我们所知,这些数据是关于贮藏油植物花药发育过程中caleosin的表达模式和细胞定位的首次报道。利用抗外源caleosin (Clo3)的抗体GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba22.GydF4y2Ba],在橄榄小孢子早期开始的整个花药中检测到分子量约为30 kDa的caleosin亚型。该抗体的特异性在之前的论文中通过免疫沉淀和测序实验得到了证实[GydF4y2Ba31.GydF4y2Ba].GydF4y2Ba原位GydF4y2Ba表达和本地化研究为我们提供了有关该胶囊的空间和时间分布在花药的不同隔室中的有价值的信息。根据我们的数据,似乎两种不同的表达程序影响了在其开发期间橄榄花药中的30 kda caleosin蛋白共存。GydF4y2Ba
小孢子从四分体释放出来后不久,孢子体程序就开始了。在这一阶段,30kda caleosin主要在绒毡层细胞中表达,因此可以认为该蛋白最初是在绒毡层中合成的。这些数据支持这样一种观点,即来自外壁层和花粉被的caleosins具有孢子体起源,正如之前所提出的[GydF4y2Ba31.GydF4y2Ba].在此早期阶段,caleosins是专门位于整个绒毡层细胞的细胞质中散布不同尺寸的大量囊泡的边界,随后排出其内容到花药心室。亚硒蛋白酶也出现在TECTUM和BACULA中,这构成了雕刻的微孔外部的层。有趣的是,在双细胞花粉阶段的外部层(即讷姆)中存在粘虫素的存在非常显着。这一发现表明,亚硒酸丝可能从最外边缘移动到花粉外来的深层层。已经描述了几种蛋白质GydF4y2BaBrassicaceae.GydF4y2BaTapetosomes,包括涂层脂质液滴的45kDa油蛋白[GydF4y2Ba34.GydF4y2Ba],以及两种蛋白质,分别名为calreticulin和luminal binding protein (BiP),它们位于er源小泡的管腔空间[GydF4y2Ba44.GydF4y2Ba].在这里,我们证明了caleosin也位于两个脂滴及ER潴橄榄油绒毡层细胞的边界。在GydF4y2Ba芸苔GydF4y2Ba中,45kDa的油质蛋白行选择性蛋白水解和37kDa的片段进一步释放到花药loculus并且在绒毡层退化保持在花粉涂层[GydF4y2Ba37.GydF4y2Ba].相比之下,橄榄绒毡层caleosin没有发生蛋白水解和花粉外套保留完整无缺。类似地,caleosins也在花粉涂层发现GydF4y2Ba芸苔栗鸟GydF4y2Ba[GydF4y2Ba45.GydF4y2Ba),GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba46.GydF4y2Ba].我们的数据也与Tapetum脂液滴组装在一起的想法一致,然后从ER中分离GydF4y2Ba44.GydF4y2Ba],并表明亚硒蛋白酶可能参与生物发生。花粉涂层是涉及细胞壁松动,花粉水合和花粉 - 耻辱通信的功能蛋白质的部位[GydF4y2Ba45.GydF4y2Ba-GydF4y2Ba47.GydF4y2Ba].花粉涂层相关caleosins的功能目前是未知的,但是几种磷酸化位点的存在,以及作为脂质结合结构域和单EF-手钙GydF4y2Ba2+GydF4y2Ba- 绕线域,表明这些蛋白质可能在花粉 - 耻辱信号中具有功能[GydF4y2Ba45.GydF4y2Ba].GydF4y2Ba
在微孔成熟期间开始的配子蛋白程序。在Tetrad和早期微孔阶段的翻译机械的缺席或减少可以解释这些发育阶段的缺乏大量裂谷。因此,减数后核糖体群显着下降[GydF4y2Ba48.GydF4y2Ba那GydF4y2Ba49.GydF4y2Ba].此外,在幼小微孔中观察到的低水平的含糖苷与该阶段的ER短缺相关[GydF4y2Ba50.GydF4y2Ba].成熟的橄榄花粉含有许多OBS,其数量从晚期微孔阶段的数量增加[27,目前的工作]。有趣的是,发育花粉中30kDa糖聚蛋白的表达水平与OB编号平行增加。这些结果表明,这种胶囊的合成和靶向在花粉晶粒中与OB生物发生密切相关。从橄榄花粉中纯化了30 kda糖蛋白,并显示结束caGydF4y2Ba2+GydF4y2Ba体外GydF4y2Ba作为在种子[证实了它的对应GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba12.GydF4y2Ba那GydF4y2Ba18.GydF4y2Ba那GydF4y2Ba21.GydF4y2Ba].钙结合调节碳糖苷的过氧酶活性[GydF4y2Ba18.GydF4y2Ba]它可能会介导影响种子萌发过程中obs动员的ob-varole相互作用[GydF4y2Ba10.GydF4y2Ba].同样,已经提出了CAGydF4y2Ba2+GydF4y2Ba也可能调节生长花粉管中钙红素介导的OB动员和膜室重组[GydF4y2Ba31.GydF4y2Ba].因此,亚莱斯汀也可以参与CAGydF4y2Ba2+GydF4y2Ba介导的新生脂质微生物融合,在花粉晶粒中产生成熟的较大油体。GydF4y2Ba
关于Caleosin表达如何在植物组织中调节的实验数据是稀缺的迄今为止。一些研究GydF4y2Ba拟南芥GydF4y2Ba显示ATCLO3亚葡聚糖表达在生物和非生物应激反应中受脱落酸(ABA)上调[GydF4y2Ba21.GydF4y2Ba-GydF4y2Ba23.GydF4y2Ba]而AtCLO4可能是ABA反应的负调节因子[GydF4y2Ba51.GydF4y2Ba].在花药中,ABA积聚在孢子源和翅膀细胞中,但在幼儿孢子/花粉颗粒中不可检测到[GydF4y2Ba52GydF4y2Ba].这与最近的研究一致,表明ABA可能会在早期制造期间调节细胞分离[GydF4y2Ba53GydF4y2Ba],以及绒毡层内的质外体糖运输[GydF4y2Ba54GydF4y2Ba].我们实验室目前正在研究ABA调控橄榄花药中caleosin表达的可能性。GydF4y2Ba
亚霉素与植物细胞中的不同膜相关联。在GydF4y2Ba拟南芥GydF4y2Ba,ATCLO3本地化在微粒体膜,叶绿体包封和叶片的液体调色剂[GydF4y2Ba22.GydF4y2Ba那GydF4y2Ba55GydF4y2Ba].蛋白酶保护测定表明,ATCLO3 Caleosin是以I型定向排列的整体膜蛋白[GydF4y2Ba56GydF4y2Ba], n端结构域面向管腔,c端结构域面向胞质侧[GydF4y2Ba22.GydF4y2Ba].这种取向是细胞内信号转导或调节蛋白的典型特征,与生物和非生物应激反应中oxylipin信号通路的假定作用相一致。橄榄花粉caleosin也与ER池、质膜和液泡膜紧密结合[31,本工作]。同样,我们可以推测钙钙红具有I型膜取向,尽管还需要进一步的实验工作来证实这一假设。与AtCLO3相反,橄榄花粉30 kDa caleosin也被发现与纯化的OBs紧密相关,即使是在强烈和重复的洗涤后。有人认为,由于热力学原因,ob结合的caleosins将其N-和c端结构域暴露于胞质中,而中心疏水结构域仍然埋藏在PL单层中[GydF4y2Ba12.GydF4y2Ba].蛋白酶保护测定表明,蛋白水解攻击分别可分别为N-和C末端结构域的约1和2kDa [GydF4y2Ba18.GydF4y2Ba那GydF4y2Ba22.GydF4y2Ba那GydF4y2Ba57GydF4y2Ba].来自几种植物物种的亚唑辛氨基酸序列的对准显示出蛋白质的C末端结构域中的单个保守CYS存在[GydF4y2Ba12.GydF4y2Ba那GydF4y2Ba15.GydF4y2Ba].基于这一假设,我们进行了peg修饰实验,以验证该模型在橄榄花粉ob相关的caleosin中。PEG-MAL是一种膜不透的探针,它与Cys的巯基不可逆反应,为每个SH基添加5 kDa。这是一种定位胞质侧膜蛋白区域中Cys残基的简单而有用的方法[GydF4y2Ba58GydF4y2Ba].因此,PEG-MAL治疗完整分离的OB的后,我们发现在SDS-PAGE凝胶的附加更高的质量带,如果单个Cys残基暴露于胞质溶胶按预期方式。这些结果在通过测试不同防caleosins ABS的辅助功能的微观层面上得到了证实。我们的数据有力地表明:1)半胱氨酸PEG化不妨碍αN的抗体对caleosin但阻碍FL抗体结合的结合,以及ii)FL抗体只识别蛋白的C末端部分。因此,我们的发现这里表明,橄榄花粉OB结合caleosin暴露二者其C-和N-末端结构域到细胞质,所以其结构构象可以是类似于从种子的OB caleosins的。GydF4y2Ba
结论GydF4y2Ba
迄今为止,关于植物中性繁殖期间的生物学功能非常少。在先锋的工作中,我们鉴定并表征了来自橄榄花粉的新亚葡聚糖,其可以在花粉萌发过程中涉及OB动员和膜隔室重新排列。在本文中,我们首次报道了Tapetum中表达的亚莱蛋白,并在橄榄等石油储存植物物种的花粉中发展。我们发现,在Tapetum和发育花粉中合成了约30kDa的亚霉素,但其合成是独立调节的。此外,橄榄花粉糖素具有双重孢子素和配子酵母起源。Tapetum衍生的Caleosin沉积在花粉外部并作为花粉涂层的一部分。该蛋白质的内在特征表明,其在该地方的功能可能与花粉水化和萌发过程中的花粉 - 耻辱相互作用有关。花粉内亚葡聚糖由营养细胞合成。我们的数据通过Tapetum和花粉晶粒中的ob生物组合来连接合成和靶向。因此,亚霉素可以参与CAGydF4y2Ba2+GydF4y2Ba-介导的新生脂质微体融合,产生成熟的更大的OBs。总之,研究结果表明,在具有贮藏脂质花粉的物种有性生殖过程的早期阶段,钙红素可能具有相关的功能。GydF4y2Ba
方法GydF4y2Ba
植物材料GydF4y2Ba
从中收集了开发的花药和成熟花粉颗粒GydF4y2BaOlea EuropaeaGydF4y2Ba(l)树(简历。生长在格拉纳达省(西班牙)。成熟的花粉粒从开裂的花药通过在大纸袋内的花芽有力的抖动收获。然后,通过一套合适的网格筛选花粉样品,以去除花的碎片。用立体显微镜(Zeiss, Germany)从花芽中分离出PMC期、四分体期、离体小孢子期、幼双胞花粉期、中双胞花粉期和成熟花粉期的花药,并通过挤压和DAPI(4’,6- diamido -2-phenylindole)染色进行分期。该材料经新鲜加工或液氮冷冻处理GydF4y2Ba2GydF4y2Ba保存至-80°C。GydF4y2Ba
显微分析样品的准备GydF4y2Ba
用4% (w/v)多聚甲醛和0.2% (v/v)戊二醛将花药和成熟花粉粒固定在0.1 M cacodylate buffer (pH 7.2)中,4°C 24 h。然后,样品在乙醇系列中脱水,并嵌入Unicryl树脂(BBInternational, UK),根据[GydF4y2Ba31.GydF4y2Ba].使用Reichert Jung Ultracut E切片机(德国莱卡微系统公司)使用玻璃刀获得半薄(1μm)切片,并放置在BioBond上™ (BBInternational)涂层载玻片。超薄(80nm)切片也使用金刚石刀(美国硅藻)切割,并安装在formvar涂层镍网格上。GydF4y2Ba
中性脂质染色GydF4y2Ba
采用苏丹黑B技术对橄榄花药发育过程中的中性脂质进行染色,方法如下:[GydF4y2Ba59GydF4y2Ba].使用70%(v / v)乙醇制备的苏丹黑B的新鲜饱和溶液,在60℃下在60℃下染色30分钟。使用AxioPlan显微镜(Carl Zeiss,德国)进行观察,并使用Progres CapturePro V2.6软件(Jenoptik AG,德国)用Progres C3数码相机记录图像。GydF4y2Ba
橄榄花药中caleosins的免疫定位GydF4y2Ba
含有在室温下与含有1%(w / v)bsa的溶液在室温下孵育不同发育阶段的半薄部分的橄榄色的橄榄色,在磷酸盐缓冲盐水(PH7.2)中,以阻止非特异性结合位点。通过在4℃下在4℃下孵育过夜,用多克隆血清(在阻塞溶液中稀释1:50稀释)升高的全长(FL)的Clo3 Caleosin序列的培养物免疫GydF4y2Ba拟南芥GydF4y2Ba,在抗兔IgG-Alexa氟488-缀合的二抗(AB)(分子探针,美国)(在阻断溶液中稀释1:100稀释),在37℃下稀释1小时。使用以下过滤器组合(FT510和LP520)在配备有外荧光系统的Axioplan显微镜(Carl Zeiss)中检查剖面部分.PP450-490,FT510和LP520。使用Nomarski视镜系统从树脂块的串行部分捕获透射光图像。对于免疫功能,如前所述加工超薄部分[GydF4y2Ba31.GydF4y2Ba].在控制部分中,省略主AB。GydF4y2Ba
成熟橄榄花粉中OBs的纯化GydF4y2Ba
油体隔离在4℃下进行,如[GydF4y2Ba60GydF4y2Ba,只做了一些修改。花粉样品在100 mM 4-(2-羟乙基)-1-哌嗪乙基磺酸(HEPES)缓冲液(pH 7.5)中研磨,该缓冲液含有0.4 M蔗糖、10 mM KCl、1 mM EDTA和2 mM二硫苏糖醇(DTT)。匀浆在6000℃离心GydF4y2BaGGydF4y2Ba2分钟去除碎片。然后,通过以20,000离心分级分级GydF4y2BaGGydF4y2Ba20分钟。较低的级分以100,000离心GydF4y2BaGGydF4y2Ba1小时。回收对应于微粒体级分的颗粒并在-20℃下储存直至使用。将上脂垫重悬于含有1M NaCl,9M尿素和0.2%(w / v)吐温的50mM Tris-HCl缓冲液(pH7.2)中。将悬浮液用0.5ml均质化缓冲液稀释并用四个分层稀释并分层含有0.1μm蔗糖的100mM Hepes缓冲液(pH7.5)的体积。以上述离心后回收油体,并根据[GydF4y2Ba60GydF4y2Ba].最后,将OB级分在10mM PBS缓冲液(pH7.5)中与0.6μm蔗糖混合并在-20℃下储存直至使用。GydF4y2Ba
蛋白质提取GydF4y2Ba
橄榄花药样品(每个样品约0.1g)在液体n下研磨GydF4y2Ba2GydF4y2Ba在10000℃下离心后,将其重新悬浮于1.5 ml提取缓冲液[40 mM Tris-HCl(pH 7.4)、2%(v/v)Triton X-100、1 mg/ml抗坏血酸、60 mM DTT、5%(w/v)聚乙烯吡咯烷酮(PVPP)和15μl蛋白酶抑制剂混合物(目录号P9599,美国西格玛·奥尔德里奇)]中GydF4y2BaGGydF4y2Ba在4℃下30分钟,将所得上清液转移至15ml管,并在丙酮中与10体积的20%(w / v)三氯乙酸(Tca)和0.2%(w / v)dtt混合。蛋白质在-20℃下沉淀过夜,并通过离心收集10,000GydF4y2BaGGydF4y2Ba在4°C下30分钟。将所得颗粒用冷丙酮冲洗三次,每次15分钟,重悬于样品缓冲液中[GydF4y2Ba61GydF4y2Ba],分配到等分试样中并在-20℃下储存直至使用。GydF4y2Ba
将0.1 g花粉样品与1.5 ml提取缓冲液混合,在4℃下搅拌6 h洗脱蛋白。所得匀浆按上述方法处理。花粉衣(PC)蛋白提取物由[GydF4y2Ba62GydF4y2Ba].简而言之,通过将1g花粉中的1ml环己烷重新悬浮,除去涂层。离心14,000后GydF4y2BaGGydF4y2Ba对于30秒,将环己烷级分转移到清洁的1.5ml管中。通过21,000的重复离心除去脂质GydF4y2BaGGydF4y2Ba20分钟。然后,将样品在Speed-Vac浓缩器(Braun Biotech公司国际GmbH,德国)在4℃下离心,直至溶剂被完全蒸发。将细胞再悬浮于1ml的样品缓冲液[花粉外壳蛋白GydF4y2Ba60GydF4y2Ba通过剧烈涡旋20分钟。GydF4y2Ba
纯化观察和微粒体分数混合1:2 (v / v)解决方案包含7 M尿素,2 M硫脲,4% (w / v) 3 - [(3-cholamidopropyl) dimethylammonio] 1-propanesulfonate(家伙),3% (w / v) SDS, 60毫米德勤和0.5% (v / v) Bio-Lyte 3 - 10缓冲区(美国Bio-Rad),孵化1 h与偶尔的涡流,在4°C和加工。GydF4y2Ba
根据制造商的指示,通过使用2D量子试剂盒(Amersham Biosciences)估计每个样品中的蛋白质浓度。GydF4y2Ba
SDS-PAGE和Western blottingGydF4y2Ba
SDS-PAGE法按标准进行[GydF4y2Ba60GydF4y2Ba].每种样品的25μg总蛋白质加载12%(w / v)聚丙烯酰胺凝胶上,并使用迷你素3装置(Bio-rad,USA)电泳。电泳后,根据标准程序,用Coomassie辉煌的蓝色R250染色凝胶。在半干燥转移细胞(Bio-rad)中被电镀到聚偏二氟乙烯(PVDF)膜上的蛋白质。如前所述进行亚氨素的免疫缩乳[GydF4y2Ba31.GydF4y2Ba].在Pharos FX分子成像仪(Bio-rad)中检测信号。GydF4y2Ba
钙绑定GydF4y2Ba体外GydF4y2Ba分析GydF4y2Ba
钙绑定GydF4y2Ba体外GydF4y2Ba按先前所述的方法进行化验[GydF4y2Ba12.GydF4y2Ba].将25 μg花粉OBs和花粉被膜总蛋白重悬于250 μl 10 mM Tris-HCl缓冲液(pH 7.5)中,并与等体积的200 mM乙二醇双(β-氨基乙醚)-混合GydF4y2Ban,n,n',n'GydF4y2Ba- 室温下 - 乙酸(EGTA)5分钟。然后用100mM CaCl温育样品GydF4y2Ba2GydF4y2Ba在室温下培养5分钟,然后与100 mM EGTA孵育GydF4y2Ba2+GydF4y2Ba如上所述,通过SDS-PAGE和Western blot分析caleosin的迁移率。GydF4y2Ba
聚乙二醇化测定GydF4y2Ba
聚乙二醇化测定根据[GydF4y2Ba58GydF4y2Ba]有一些修改。如上所述纯化花粉OB,并处理(250μl),含有0.1M Tris-HCl(pH7.0),10mM离子聚甲基二醇 - 马来酰亚胺(PEG-MAL)5,000de(Sigma-Aldrich)和1mM EDTA的溶液,用于0,5和20分钟,在黑暗中在4°C。通过加入含有100mM DTT的等体积的Laemmli样品缓冲液来终止聚乙二醇化反应。OB样品(每种40μl)加载到SDS-PAP BIS-TRIS凝胶上(7.5%),使用3-(正质)丙磺酸(MOPS)以迷你蛋白3装置(Bio-rad)进行电泳。)运行缓冲区。电泳后,OBS在半干燥传递细胞(Bio-rad)中被电印迹到PVDF膜上。将所得膜在4℃下在TBS缓冲液中含有3%(w / v)Bsa的溶液中封入过夜。通过与升高的CLO3碳糖苷的N-末端(αn)序列培养,通过与CLO3 CaleOsin的N-末端(αn)序列孵育来进行Ob相关亚氨酸的免疫检测GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba22.GydF4y2Ba, 4°C, 12 h。用DyLight 549 (Agrisera AB, Sweden)标记的山羊抗兔IgG作为次级抗体,在TBST缓冲液中1:2000稀释。信号在Pharos FX分子成像仪(Bio-Rad)中检测,并使用Quantity One v.4.6.2软件(Bio-Rad)记录图像。GydF4y2Ba
聚乙二醇化OBs中caleosin的免疫定位GydF4y2Ba
caleosins的免疫组化是在非聚乙二醇化和聚乙二醇化的OB进行。为了这个目的,OB中(每个样品40微升)在一个1.5ml试管中温育与任一FL或αN抗Clo3抗体(在研磨介质以1:30稀释),在室温下2小时。在含0.4 100mM的HEPES缓冲液(pH 7.5)M蔗糖200,1个小时,在37℃下:另外,OB中,然后用抗兔IgG二级抗体缀合与DyLight 549(Agrisera AB)孵育,稀释1轻轻摇动。加入Citifluor(Sigma-Aldrich公司)的抗褪色溶液几滴和下白色和绿色光照射的Axioplan落射荧光显微镜(Carl Zeiss)观察样品。在一个PROGRES C3数字照相机获得图像,使用PROGRES CapturePro V2.6软件(Jenoptik的AG)。GydF4y2Ba
缩写GydF4y2Ba
- AB:GydF4y2Ba
-
抗体GydF4y2Ba
- BSA:GydF4y2Ba
-
牛血清白蛋白GydF4y2Ba
- 德勤:GydF4y2Ba
-
二硫苏糖醇GydF4y2Ba
- EDTA:GydF4y2Ba
-
乙二胺四乙酸GydF4y2Ba
- EGTA:GydF4y2Ba
-
乙烯 - 乙二醇 - 双(β-氨基乙醚) -GydF4y2Ban,n,n',n'GydF4y2Ba- 乙酸GydF4y2Ba
- 呃:GydF4y2Ba
-
内质网GydF4y2Ba
- HEPES:GydF4y2Ba
-
(4-(2-羟乙基)-1-哌嗪乙烯磺酸)GydF4y2Ba
- 13-HPOD:GydF4y2Ba
-
(9.GydF4y2BaZGydF4y2Ba11.GydF4y2BaEGydF4y2Ba,13GydF4y2BasGydF4y2Ba)-13-水石油ocdadeca-9,11-己酸GydF4y2Ba
- OB:GydF4y2Ba
-
油体GydF4y2Ba
- PBS:GydF4y2Ba
-
磷酸盐缓冲盐水GydF4y2Ba
- 纤毛运动:GydF4y2Ba
-
编程细胞死亡GydF4y2Ba
- PEG-MAL:GydF4y2Ba
-
聚乙二醇 - 马来酰亚胺GydF4y2Ba
- PL:GydF4y2Ba
-
磷脂GydF4y2Ba
- PMC:GydF4y2Ba
-
花粉母细胞GydF4y2Ba
- PVDF:GydF4y2Ba
-
聚偏二氟乙烯GydF4y2Ba
- PVPP:GydF4y2Ba
-
聚乙烯丙基吡咯烷酮GydF4y2Ba
- 标签:GydF4y2Ba
-
三酰基甘油GydF4y2Ba
- TBS:GydF4y2Ba
-
Tris缓冲盐溶液。GydF4y2Ba
参考GydF4y2Ba
- 1。GydF4y2Ba
高德伯格,比尔斯TP,桑德斯PM:花药发育:基本原理和实际应用。植物细胞。1993,5:1217-1229。GydF4y2Ba
- 2。GydF4y2Ba
黑塞男,帕齐尼E,WILLEMSE玛:绒毡层:细胞学,功能,生物化学和进化。纽约:Springer-Verlag;1993年。GydF4y2Ba
- 3.GydF4y2Ba
克莱门特C,拉波特P,Audran的JC:在花粉发育过程中的loculus内容GydF4y2Ba百合GydF4y2Ba.性植物团体。1998,11:94-106。10.1007 / S004970050125。GydF4y2Ba
- 4.GydF4y2Ba
Steiglitz H:在postmeiotic孢子释放β-1,3-葡聚糖酶的作用。Dev Biol。1997年,57:87-97。GydF4y2Ba
- 5。GydF4y2Ba
Pacini E:花粉碳水化合物储备的类型和含义。性植物团体。1996,9:362-366。10.1007 / BF02441957。GydF4y2Ba
- 6.GydF4y2Ba
皮法内利P,罗斯JHE,墨菲DJ:花粉粒脂质结构的生物发生和功能。性植物繁殖。1998,11:65-80。10.1007/S00497005122。GydF4y2Ba
- 7.GydF4y2Ba
Murphy DJ:动物,植物和微生物中脂质体的生物发生和功能。Prog Lipid Res。2001,40:325-438。10.1016 / s0163-7827(01)00013-3。GydF4y2Ba
- 8。GydF4y2Ba
黄艾氏:种子和其他器官的油素和油体。植物理性。1996,110:1055-1061。10.1104 / pp.110.4.1055。GydF4y2Ba
- 9。GydF4y2Ba
弗朗森GI,瑟曼Ĵ,Tzen JTC:油体及其结合蛋白质,油质和caleosin。植物理性。2001年,112:301-307。10.1034 / j.1399-3054.2001.1120301.x。GydF4y2Ba
- 10。GydF4y2Ba
Poxleitner M,Rogers SW,Samuels AL,Browse J,Rogers JC:caleosin在种子萌发过程中油体贮藏脂质降解中的作用。植物杂志2006,47:917-933.10.1111/J.1365-313X.2006.02845.x。GydF4y2Ba
- 11.GydF4y2Ba
Frandsen G,Müller-Urif,Nielsen M,Mundy J,Skriver K:新颖的植物CAGydF4y2Ba2+GydF4y2Ba结合蛋白响应于脱落酸和渗透胁迫表达。J Biol Chem。1996年,271:343-348。10.1074 / jbc.271.1.343。GydF4y2Ba
- 12.GydF4y2Ba
陈家发,蔡云云,Tzen JTC:植物种子油体中钙结合蛋白caleosin的克隆及二级结构分析。植物生理学报。1999,40(4):591 - 598。GydF4y2Ba
- 13。GydF4y2Ba
墨菲DJ,Vance J:脂质体形成机制。趋势Biochem SCI。1999年,24:109-115。10.1016 / s0968-0004(98)01349-8。GydF4y2Ba
- 14。GydF4y2Ba
林丽娟,Tzen JTC:在种子油体中存在两种不同的甾醇苷。植物营养与肥料学报。2004,22(4):491 - 498。10.1016 / j.plaphy.2004.06.006。GydF4y2Ba
- 15.GydF4y2Ba
n @ sted H, Frandsen GI, Jauh GY, Hernandez-Pinzon I, Nielsen HB, Murphy DJ, Rogers JC, Mundy J: Caleosins: CaGydF4y2Ba2+GydF4y2Ba- 与脂质体相关的蛋白质。植物mol biol。2000,44:463-476。10.1023 /答:1026564411918。GydF4y2Ba
- 16.GydF4y2Ba
Feussner I,Bachmann A,HöhneM,Kindl H:所有三个三叶油部分的三烯醇部分通过重组他标记的脂质体脂氧合酶有效氧化GydF4y2Ba体外GydF4y2Ba.费用。1998年,431:433-436。10.1016 / S0014-5793(98)00808-4。GydF4y2Ba
- 17.GydF4y2Ba
关键词:脂氧合酶,种子萌发,子叶醛糖体,(9Z, 11E, 13S)-13-羟基-十八碳-9,11-二烯酸植物学报。2005,32(4):434 - 434。10.1007 / s00425 - 004 - 1408 - 1。GydF4y2Ba
- 18.GydF4y2Ba
花野A,Burcklen男,Flenet男,Ivancich A,Louwagie男,加林Ĵ,BléeE:植物种子过氧是一个原始的血红素加氧与EF手钙结合基序。J Biol Chem。2006年,281:33140-33151。10.1074 / jbc.M605395200。GydF4y2Ba
- 19。GydF4y2Ba
Feussner I,Wasternack C,Kindl H,KühnH:脂氧合酶催化的储存脂质的氧合在萌发期间含有脂质的血液。美国国家科学院学报。1995,92:11849-11853。10.1073 / pnas.92.25.11849。GydF4y2Ba
- 20.GydF4y2Ba
魏志强,王志强,王志强,等:氧合酶对黄瓜幼苗氧化磷脂代谢及挥发性醛类化合物的影响。植物学报。2002,32(6):612-619。10.1007 / s00425 - 002 - 0779 - 4。GydF4y2Ba
- 21.GydF4y2Ba
Takahashi S,Katagiri T,Yamaguchi-Shinozaki K,Shinozaki K:一个GydF4y2Ba拟南芥GydF4y2Ba编码Ca的基因GydF4y2Ba2+GydF4y2Ba- 在脱水过程中由脱落酸诱导粘连蛋白。植物细胞生理。2000,41:898-903。10.1093 / PCP / PCD010。GydF4y2Ba
- 22。GydF4y2Ba
PARTRIDGE M,MURPHY D:膜结合的亚唑肽和引用的过氧酶在生物和非生物应激反应中的作用GydF4y2Ba拟南芥GydF4y2Ba.植物理性生物化学。2009,47:796-806。10.1016 / J.Plaphy.2009.04.005。GydF4y2Ba
- 23。GydF4y2Ba
Aubert Y,Vile D,Pervent M,Aldon D,Ranty B,Simonneau T,Vavasseur A,Galaud JP:RD20,一种应激诱导型胶囊,参与气孔控制,蒸腾和耐旱耐受性GydF4y2Ba拟南芥GydF4y2Ba.植物细胞生理。2010年,51:1975-1987。10.1093 / PCP / PCQ155。GydF4y2Ba
- 24。GydF4y2Ba
柏木BE:橄榄花粉粒发育的超微结构GydF4y2BaOlea EuropaeaGydF4y2BaL.)2.分泌由绒毡层细胞。新植物。1979年,83:165-174。10.1111 / j.1469-8137.1979.tb00738.x。GydF4y2Ba
- 25。GydF4y2Ba
罗斯JHE,桑切斯Ĵ,MILLAN楼墨菲DJ:在橄榄在oleogenic种子和中果皮组织油质蛋白的微分存在(GydF4y2BaOlea EuropaeaGydF4y2Ba)和鳄梨(GydF4y2Ba佩戴尔亚洲人GydF4y2Ba).植物科学学报,1993,93:203-210。10.1016 / 0168 - 9452 (93) 90050 - a。GydF4y2Ba
- 26。GydF4y2Ba
AlchéJD,Castro AJ,Rodríguez-GarcíaMI:Oleosin基因在橄榄中的表达(GydF4y2BaOlea EuropaeaGydF4y2Ba花药。花药和花粉:从生物学到生物技术。编辑:Clément C,Pacini E,Audran JC。柏林,海德堡:Springer Verlag;1999:91-99。GydF4y2Ba
- 27。GydF4y2Ba
Rodríguez-garcíami,M'rani-Alaoui M,FernándezMC:储存脂质在开发过程中的行为和橄榄萌发(GydF4y2BaOlea EuropaeaGydF4y2Ba花粉。原生质体。2003,221:237-244。GydF4y2Ba
- 28.GydF4y2Ba
AlchéJD,Jiménez-LópezJC,Wang W,Castro Aj,Rodríguez-GarcíaMI:橄榄液中11S型储存蛋白的生化表征和细胞定位(GydF4y2BaOlea EuropaeaGydF4y2Bal .)种子。中国食品科学。2006,22(4):542 - 546。10.1021 / jf060203s。GydF4y2Ba
- 29.GydF4y2Ba
植物花粉发育过程中细胞内外脂质组成及相关基因表达模式的研究GydF4y2Ba芸苔栗鸟GydF4y2Ba.植物杂志1997年,11:549-562。10.1046 / j.1365-313X.1997.11030549.x。GydF4y2Ba
- 30.GydF4y2Ba
Pacini E,Casadoro G:Tapetum PlastidsGydF4y2BaOlea EuropaeaGydF4y2BaL.原生质。1981,106:289-296。10.1007 / BF01275559。GydF4y2Ba
- 31.GydF4y2Ba
Zienkiewicz K,Castro Aj,AlchéJD,Zienkiewicz A,SuárezC,Rodríguez-GarcíaMI:橄榄胶囊的鉴定和本地化(GydF4y2BaOlea EuropaeaGydF4y2BaL.)花粉期间GydF4y2Ba体外GydF4y2Ba发芽。中国生物医学工程学报。2010,31(4):457 - 461。10.1093 / jxb / erq022。GydF4y2Ba
- 32.GydF4y2Ba
染型睫毛症JP:花粉管生长和分化的分子机制。植物细胞。1993年,5:1303-1314。GydF4y2Ba
- 33.GydF4y2Ba
Arizumi T,Toriyama K:孢子膜素合成和花粉的遗传调节。Annu Rev植物Biol。2011,62:1.1-1.24。GydF4y2Ba
- 34.GydF4y2Ba
吴SSH,普拉特KA,Ratnayake C,王TW,挺JT,黄AH:含中性脂质的细胞器,并从globuli充质的分离和鉴定GydF4y2Ba芸苔栗鸟GydF4y2Ba绒毡层。美国科学院学报,1997,94:12711-12716。10.1073/pnas.94.23.12711。GydF4y2Ba
- 35。GydF4y2Ba
Murgia M,Charzynska M,Rougier M,Cresti M:分泌TapetumGydF4y2BaBrassica oleracea.GydF4y2Ba极性和超微结构特征。《植物生殖》1991,4:28-35。GydF4y2Ba
- 36。GydF4y2Ba
acta hornanica (acta hornanica (acta hornanica) (acta hornanica (acta hornanica) (acta hornanica (acta hornanica))GydF4y2Ba拟南芥GydF4y2Ba(左)Heynh生态型GydF4y2BaWassilewskija.GydF4y2Ba(GydF4y2BaBrassicaceae.GydF4y2Ba).原生质。1995,185:7-21。10.1007 / BF01272749。GydF4y2Ba
- 37。GydF4y2Ba
婷jt,wu ss,ratnayake c,huang啊:Tapetosomes和elaioplast的成分GydF4y2Ba油菜GydF4y2Ba锭剂和它们在微孢子发生过程中的降解和保留。工厂J. 1998,16:541-551。10.1046 / J.1365-313x.1998.00325.x。GydF4y2Ba
- 38。GydF4y2Ba
Rangel B,Platt Ka,Thomson WW:橄榄果汁中细胞质起源和油积累的超微结构方面(GydF4y2BaOlea EuropaeaGydF4y2Ba).植物科学学报。1997,101:109-114。10.1111 / j.1399-3054.1997.tb01826.x。GydF4y2Ba
- 39。GydF4y2Ba
Platt Ka,Huang AHC,Thomson WW:超微结构研究如果粒状细胞中的脂肪积累GydF4y2Ba芸苔栗鸟GydF4y2BaL.品种。孢子在西星。诠释J植物科学。1998年,159:724-737。10.1086 / 297590。GydF4y2Ba
- 40。GydF4y2Ba
谢克、黄阿:录音带在哪里GydF4y2Ba芸苔GydF4y2Ba绒毡层积聚内质网来源的黄酮类和烷烃,以传递到花粉表面。植物营养与肥料学报。2007,19:582-596。10.1105 / tpc.106.049049。GydF4y2Ba
- 41。GydF4y2Ba
Hernández-pinzóni,ross jh,Barnes Ka,Damant Ap,Murphy DJ:Tapetal Lipid体在花粉涂层生物发生中的构成和作用GydF4y2Ba芸苔栗鸟GydF4y2Ba.Planta。1999年,208:588-598。10.1007 / S004250050597。GydF4y2Ba
- 42.GydF4y2Ba
吴SSH,莫罗RA,惠特克BD,黄AHC:在绒毡层的在开发elaioplasts固醇酯GydF4y2Ba芸苔GydF4y2Ba花粉和花粉表面的复苏。脂质。1999年,34:517-523。10.1007 / s11745-999-0393-5。GydF4y2Ba
- 43.GydF4y2Ba
Ishiguro S,Nishimori Y,Yamada M,Saito H,Suzuki T,Nakagawa T,Miyake H,冈田K,Nakamura K:TheGydF4y2Ba拟南芥GydF4y2Ba片状POLLEN1GydF4y2Ba基因编码3-羟基-3-甲基utaryl-辅酶,一种合成梭菌的梭子特异性细胞器和花粉颗粒的生育能力所需的合成酶。植物细胞生理。2010年,51:896-911。10.1093 / PCP / PCQ068。GydF4y2Ba
- 44.GydF4y2Ba
谢K,黄AH:在富含脂质的tapetosomesGydF4y2Ba芸苔GydF4y2Ba绒毡层由油质蛋白包被的小油滴和囊泡的,无论是在组装,然后从内质网分离。植物J. 2005,43:889-899。10.1111 / j.1365-313X.2005.02502.x。GydF4y2Ba
- 45.GydF4y2Ba
Murphy DJ:细胞外花粉涂层GydF4y2BaBrassicaceae.GydF4y2Ba:组成,生物合成和授粉的功能。原生质。2006,228:31-39。10.1007 / S00709-006-0163-5。GydF4y2Ba
- 46.GydF4y2Ba
Mayfield JA, Fiebig A, Johnstone SE, Preuss D:基因家族GydF4y2Ba拟南芥GydF4y2Ba花粉涂层蛋白质组。科学。2001,292:2482-2485。10.1126 / science1060972。GydF4y2Ba
- 47。GydF4y2Ba
墨菲DJ,罗斯JH:甲酚样蛋白的生物合成,靶向和加工,其中是主要的花粉涂层组分GydF4y2Ba芸苔栗鸟GydF4y2Ba.工厂J.998,13:1-16。GydF4y2Ba
- 48。GydF4y2Ba
ALCHÉJD,FernándezMC,Rodríguez-GarcíaMI:核仁和细胞质核仁常见的细胞化学特征GydF4y2BaOlea EuropaeaGydF4y2BaMeiocytes:通过原位杂交检测RRNA。J Cell SCI。1994年,107:621-629。GydF4y2Ba
- 49。GydF4y2Ba
acta botanica botanica(云南植物研究中心)GydF4y2Ba普通贝塔GydF4y2Bal .定量GydF4y2Ba原位GydF4y2Ba杂交分析。J Cell SCI。1996,109:859-866。GydF4y2Ba
- 50。GydF4y2Ba
Rodríguez-García MI, Fernández MC:橄榄花粉粒成熟过程中内质网变化的超微结构证据GydF4y2Ba(油橄榄L.,木犀科)GydF4y2Ba.植物生态学报。1998,18(1):1- 8。10.1007 / BF00940607。GydF4y2Ba
- 51。GydF4y2Ba
AtCLO4作为ABA响应的负调控因子,在ABA响应中起着重要的作用GydF4y2Ba拟南芥GydF4y2Ba.植物细胞生理。2011,52:874-884。10.1093 / PCP / PCR039。GydF4y2Ba
- 52。GydF4y2Ba
彭烨,邹达,王德,龚议员,徐泽,白SN:拟南芥和黄瓜生殖器官原始和护理细胞中脱落酸的优先定位。新植物。2006,170:459-466。10.1111 / J.1469-8137.2006.01683.x。GydF4y2Ba
- 53。GydF4y2Ba
朱y,邓x,周z,x x s,yi b,wen j,shen j,ma c,tu j,fu t:Tapetum细胞和微孔母细胞的分离缺陷导致雄性不育GydF4y2Ba芸苔栗鸟GydF4y2Ba:脱落酸在早期花药发育中的作用。植物mol biol。2010,72:111-123。10.1007 / s11103-09-9556-0。GydF4y2Ba
- 54.GydF4y2Ba
奥利弗SN,丹尼斯ES,Dolferus R:ABA调节质外体糖转运并且是用于在稻感冒引起的花粉育电位信号。植物细胞生理。2007,48:1319年至1330年。10.1093 / PCP / PCM100。GydF4y2Ba
- 55.GydF4y2Ba
卡特C,潘S,ZouharĴ维拉EI,Girke T,Raikhel NV:拟南芥的植物液泡蛋白质组揭示了预测的和意想不到的蛋白质。植物细胞。2004年,16:3285-3303。10.1105 / tpc.104.027078。GydF4y2Ba
- 56.GydF4y2Ba
歌手SJ:膜中整体蛋白的结构和插入。Annu Rev Cell Biol。1990,6:247-266。10.1146 / annurev.cb.06.110190.001335。GydF4y2Ba
- 57.GydF4y2Ba
Hernandez-Pinzon I,Patel K,Murphy DJ:该GydF4y2Ba芸苔栗鸟GydF4y2Ba钙结合蛋白,caleosin,具有明显的内质网和脂质体相关的同种型。植物理性生物化学。2001年,39:615-622。10.1016 / S0981-9428(01)01274-8。GydF4y2Ba
- 58.GydF4y2Ba
Balsera M,Goetze Ta,Kovács-bogdáne,schürmannp,瓦格纳r,buchanan bb,soll j,bölterb:tic110的表征,在叶绿体内包膜膜的沟道形成蛋白,推出对CA的反应GydF4y2Ba2+GydF4y2Ba和基质调节二硫化物。J Biol Chem。2009,284:2603-2616。GydF4y2Ba
- 59。GydF4y2Ba
布朗纳R:脂肪和淀粉的植物组织的同时演示。生物技术Histochem。1975年,50:1-4。10.3109 / 10520297509117023。GydF4y2Ba
- 60GydF4y2Ba
江口,王CS,HSU CM,JAUH GY,TZEN JTC:百合花花粉中独特的油蛋白遮蔽的稳定油体。植物细胞生理。2007,48:812-821。10.1093 / PCP / PCM051。GydF4y2Ba
- 61。GydF4y2Ba
Laemmli UK:在噬菌体T4的头部组装过程中裂解结构蛋白。自然。1970,277:680-685。GydF4y2Ba
- 62。GydF4y2Ba
Doughdy J,Hedderson F,McCubbin A,Dickinson H:涂层肽之间的相互作用GydF4y2Ba芸苔GydF4y2Ba花粉粒和柱头S(自交不亲和)基因座特异糖蛋白。美国国家科学院学报。1993年,90:467 - 471。10.1073 / pnas.90.2.467。GydF4y2Ba
致谢GydF4y2Ba
我们感谢Dennis Murphy教授(Glamorgan大学,卫生,体育和科学,Biology,Pontypridd,UK划分),为我们提供抗CLO3抗体,并向康佩佩斯·普通女士提供专家技术技术帮助。我们还要感谢iFapa''Venta delllano''(西班牙的Venta del Llano')提供橄榄材料。这项工作得到了Micinn(ERDF-Cofinance Project AGL2008-00517 / AGR)和Junta deAndalucía(ERDF-Cofinance Projects P06-AGR-01791和P10-CVI-5767)的支持。KZ和AZ感谢CSIC提供JAE-DOC Grant资金。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
相应的作者GydF4y2Ba
附加信息GydF4y2Ba
作者的贡献GydF4y2Ba
AJC和Mirg构思了这项研究。AJC设计和监督实验。KZ和AZ进行了实验。这四位作者讨论了结果并准备了稿件。所有作者阅读并认可的终稿。GydF4y2Ba
作者为图像提交的原始文件GydF4y2Ba
权限GydF4y2Ba
开放访问GydF4y2Ba本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(GydF4y2Bahttps://creativecommons.org/licenses/by/2.0.GydF4y2Ba),允许在任何媒介中不受限制地使用、分发和复制,前提是原作被正确引用。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
齐恩凯维奇,K.,齐恩凯维奇,A.,罗德里格斯·加西亚,M.I。GydF4y2Ba等等。GydF4y2Ba在橄榄期间表达的亚莱蛋白酶的表征(GydF4y2BaOlea EuropaeaGydF4y2BaL.)花粉组织化。GydF4y2BaBMC植物BIOL.GydF4y2Ba11,GydF4y2Ba122(2011)。https://doi.org/10.1186/1471-2229-11-122GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
出版GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/1471-2229-11-122GydF4y2Ba
关键词GydF4y2Ba
- 花粉管GydF4y2Ba
- Tapetal Cell.GydF4y2Ba
- 花粉成熟GydF4y2Ba
- 花粉的外套GydF4y2Ba
- 橄榄花粉GydF4y2Ba