摘要
背景
内质网(内质网,ER)是一种主要的信号细胞器,它整合了对生理应激的各种反应。在植物中,这种胁迫整合反应之一是富n蛋白(NRP)介导的细胞死亡信号通路,该通路由内质网胁迫和渗透胁迫信号共同激活。尽管这一整合信号具有保护植物细胞免受不同胁迫条件的潜力,但该通路的机制知识尚不清楚,其下游成分也尚未确定。
结果
在本研究中,我们从大豆中发现了一个含NAC结构域的蛋白GmNAC6 (甘氨酸最大NAC6),作为整合途径的下游组分。类似于NRP-A和NRP-B, GmNAC6是由内质网应激和渗透应激单独诱导的,但需要两种信号的充分激活。瞬态的表达GmNAC6促进细胞死亡和超敏反应在足底。GmNAC6和nrp也有对生物信号的重叠反应,但诱导nrp在GmNAC6转录本积累增加之前达到峰值。与延迟动力学相一致GmNAC6诱导,增加的水平NRP-A和NRP-B转录子诱导启动子的激活和表达GmNAC6基因。
结论
总的来说,我们的研究结果通过生物化学方法将GmNAC6与内质网应激和渗透应激整合细胞死亡反应联系起来,并表明GmNAC6可能作用于NRPs的下游。
背景
植物不会被动地接受非生物胁迫,如干旱、盐度和温度变化,或生物侵略者,如病毒、细菌、昆虫和真菌。为了应对这些环境胁迫,植物细胞形成了相互协调和整合的分子网络,在逆境生长条件下进行胁迫信号的感知、转导和适应机制。一般来说,一些对特定压力条件的适应性细胞反应与其他环境反应是相互关联的[1- - - - - -3.].例如,水分胁迫会导致营养和渗透胁迫,而渗透胁迫也可能由盐胁迫引起。类似地,文献中越来越多的证据证明了对病原体攻击的反应和发育信号之间的相互联系[4- - - - - -6].在这种复杂的生理胁迫相互作用下,植物细胞在细胞器之间进化出了顺行和逆行的转导途径,以综合协调的方式对环境信号作出反应。其中一个主要的信号细胞器是内质网(ER),它整合了针对压力的各种反应[7,8].
ER是一种多功能细胞器,支持一系列基本的蜂窝方法,例如蛋白质折叠和质量控制,维护CA2+平衡和脂质生物合成。任何扰乱内质网稳态和内质网功能的情况都可以在细胞器中诱发应激。一般来说,内质网应激是由蛋白质合成速率和内质网蛋白质加工活动之间的不平衡引起的。在新生的、未折叠的多肽流入内质网腔超过细胞器的折叠和处理能力的情况下,未折叠的蛋白质在内质网腔内积累,反过来,触发一个名为“未折叠蛋白质反应(UPR)”的细胞保护途径,已在哺乳动物细胞中详细描述[综述,见[9]]。为了缓解内质网应激,激活转录因子6 (ATF6)、肌醇需要激酶1 (IRE1)和类双链rna激活蛋白激酶(PKR)内质网激酶(PERK)这三种UPR转导物的协同作用导致以下三种类型的细胞反应的激活:(1)内质网分子伴侣BiP (binding protein)和calnexin (CNX)上调;(2) PERK通过真核起始因子2α (eIF2α)磷酸化介导的蛋白翻译衰减;(3)通过一种称为“er相关降解”(ERAD)的过程降解错误折叠的蛋白质。然而,过度或长期的压力会导致适应不良反应,并最终激活凋亡细胞死亡,以保护组织免受坏死损伤[9].最近的研究表明,内质网应激还可以引发先天免疫防御来保护哺乳动物细胞中的组织,而在植物细胞中,内质网应激与宿主对微生物感染的防御反应有关[10.- - - - - -12.].因此,除了UPR,其他信号通路从内质网辐射到线粒体、细胞核,可能还有其他细胞器。
最近,一项针对衣霉素诱导和聚乙二醇(PEG)诱导的大豆叶片的整体表达分析揭示了内质网胁迫和渗透胁迫共同响应,由共同调控的基因代表,发现这两种胁迫都是协同诱导的[13.,14.].该综合途径中的基因编码具有不同作用的蛋白质,例如植物特异性的发育和细胞死亡(DCD)含有域域的蛋白质,由富乙酰胺的蛋白质NRP-A和NRP-B表示,遍氨酰相关(UBA)蛋白质同源物和NAC(N点,一个TAF1, ATAF2和CUC2) domain-containing蛋白质。NAC蛋白是植物特有的转录因子,参与多种发育事件以及生物和非生物应激反应[综述,参见[15.]]。它们由一个大型的转录调节基因家族组成,在大豆基因组中,至少有101个序列[16.].
富氮蛋白(NRP)基因,表现出最强的协同诱导,共享一个高度保守的c端DCD结构域,以及在其更分散的N端高含量的天冬酰胺残基[13.].这种结构结构使NRP-A和NRP-B属于植物特异性含dcd蛋白的亚群I [17.].最近,我们证实了NRP-A和NRP-B在大豆细胞和烟草叶异位表达时均可诱导衰老样反应[13.].这些研究表明内质网应激和渗透应激途径在NRP基因激活水平上汇合,从而增强细胞死亡反应。事实上,这两种应激信号的结合加剧了NRP表达时不同通路的输出;因此,NRPs作为整合内质网应激和渗透应激反应的分子链接。这种内质网应激和渗透应激整合反应被指定为nrp介导的细胞死亡信号,由这两种应激信号协同激活。我们最近证实转录因子GmERD15作用于NRPs的上游,并在渗透胁迫和内质网胁迫下激活NRP-A和NRP-B的表达[18.].尽管整合的信号通路具有适应一般植物特异性适应性反应的潜力,但该通路的机制知识尚缺乏,下游成分尚未确定。在这里,我们描述了大豆含NAC结构域的蛋白超家族成员GmNAC6 (甘氨酸最大NAC6)可能是该途径的下游组分。除了内质网胁迫和渗透胁迫信号协同上调外,异位表达GmNAC6导致senescence-like反应在足底,这是一种类似于nrp介导的反应的表型。我们还发现NRPs可诱导GmNAC6基因启动子的激活和表达。
结果
GMNAC6被ER应激和渗透压单独引起,但需要两个信号进行全激活
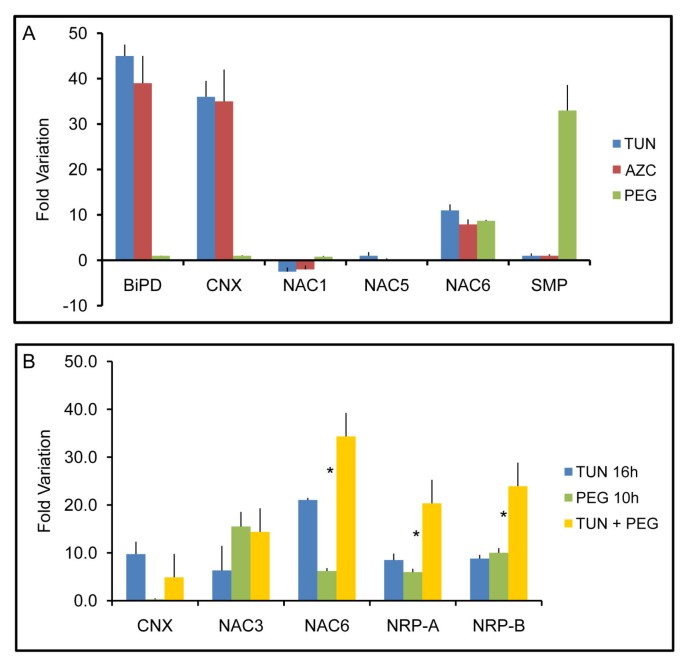
为了鉴定ER应激和渗透胁迫 - 整合NRP介导的细胞死亡反应的组分,我们通过两个压力在共调节基因中搜查了[14.]对于那些由应力信号协同诱导的人。在这方面,我们将注意力集中在编码含NAC域蛋白家族的成员的EST上,并将我们的搜索扩展到大豆NAC蛋白家族的其他成员。来自大豆--gmNAC1,GMNAC5和GMNAC6的至少三个含NAC域蛋白质家族的成员与衰老或细胞死亡有关[16.].然而,只有GmNAC6被渗透胁迫诱导剂PEG和内质网胁迫诱导剂tunicamycin (TUN)和L-azetidine-2-carboxylic acid (AZC)诱导,它们通过不同的机制导致内质网蛋白的错误折叠(图)1A).ER应激(BiPD和CNX)和渗透压力(SMP)标记基因被纳入检测,以确保衣霉素和PEG处理的有效性。内质网胁迫和渗透胁迫的结合促进了GmNAC6转录本的积累,其作用略大于加性作用,其方式类似于NRP-A和NRP-B基因的诱导(图)1B.).这些结果表明,内质网胁迫和渗透胁迫信号的整合导致了GmNAC6的完全激活。
内质网胁迫和渗透胁迫信号的整合导致了GmNAC6的完全激活。A. PEG、衣霉素或AZC对表达的影响GmNAC1, GmNAC5和GmNAC6。用唐氏霉素(10μg/ ml,24小时),PEG(MW:8000,10%,16h)或AZC(50mm,16小时)进行三周龄植物。UPR代表性基因的相对表达(BiPD和CNX)、渗透胁迫特异性反应(SMP)和衰老相关的大豆GMNAC.基因(母,NAC5,NAC6),采用定量RT-PCR检测。TUN的值相对于DMSO控制处理,PEG和AZC的值相对于H2O控制;值表示三个独立实验中三个重复的平均值±SD。B. PEG和衣霉素联合作用对GmNAC6转录本的协同诱导作用。分别用TUN (16 h)或PEG (10 h)单独或TUN + PEG组合处理植株。PEG + TUN联合处理时,再加入PEG 10 h,衣霉素预处理6 h。在指定时间后,RNA被分离出来,并通过实时RT-PCR对RNA进行定量,针对特定的基因,CNX,衰老相关的大豆基因,GmNAC3和GmNAC6,和整合通路基因,NRP-A和NRP-B。星号表示附加响应的位置。H2o和DMSO分别用于PEG和TUN的控制处理。值表示三个独立实验的三种重复的平均值±SD。
我们还检测了大豆NAC基因家族的其他成员的诱导,如被PEG上调的GmNAC3 [16.和衣霉素(图1B.),以及在叶片衰老时[17.].然而,大豆幼苗对两种应激诱导剂的组合暴露未促进对GmnAc3的诱导的添加剂或协同作用。总之,这些结果证实了GMNAC6,但不是GMNAC3的论点可以是NRP介导的细胞死亡信号的靶标,其整合ER应激和渗透应激反应。
GmNAC6在烟草和大豆细胞中促进细胞死亡
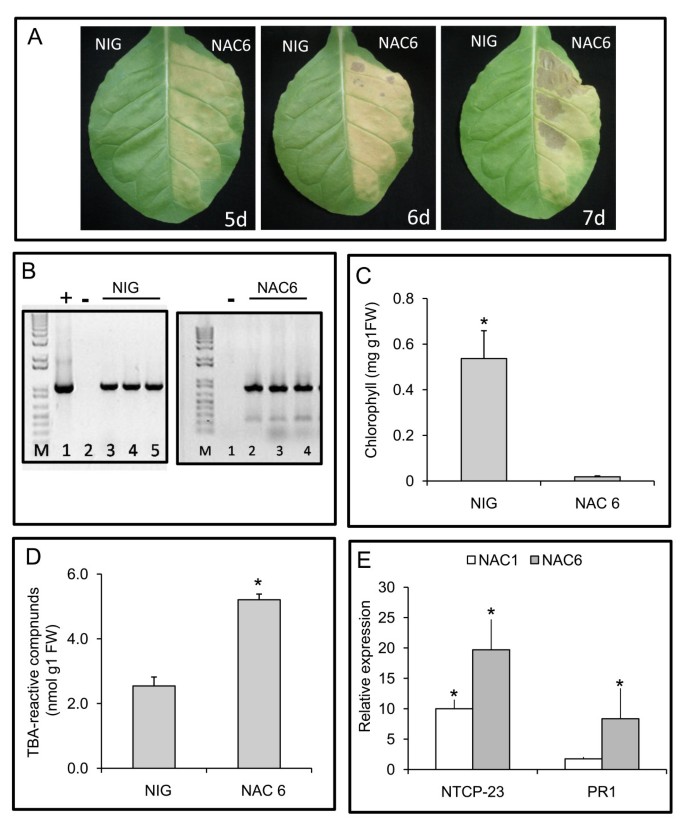
最近,我们证实了整合通路转导由内质网和渗透胁迫产生的程序性细胞死亡(PCD)信号,导致与叶子衰老相关标记的出现[13.].为了评估GmNA6是否参与了细胞死亡,我们检测了叶片衰老的特征,如褪绿病、叶绿素损失、脂质过氧化以及含有35S::GmNAC6构建的农杆菌对烟草叶片衰老相关基因的诱导。经过5天后的渗透,叶片表达GmNAC6表现为褪绿表型,坏死灶,在浸润后7天迅速演变为严重坏死,导致大量细胞死亡;这一观察与一个不相关的人的表情形成了鲜明的对比傻瓜基因(19.]用作阴性对照(图2).我们还注意到,gmnac6诱导的褪绿表型的出现速度要快于NRP-B基因(比较数字2和额外的文件1).事实上,在类似条件下,NRP-B表达引起的症状在农业渗透后8天首次出现,同时也观察到NRP-B农业渗透叶片的膜离子泄漏增加(附加文件)2).
GmNAC6促进细胞死亡在足底。A.三周大的烟草叶子被携带35s :: yfp-nac6构建体或无关的35s :: nig构建体的农杆菌细胞渗透。A. GMNAC6表达引起的黄化表型和坏死病变。叶片渗透用指定的农业接种物,在5天(5 d),6天(6d)和7天(7 d)后的农业接种后,采用照片。B.农药5天后5天在农业渗透叶片扇区中NIG和GMNAC6基因的瞬态表达。如图中所示,半定量RT-PCR在农业渗透叶片扇区的RNA上,如图所示。C. 35S :: GMNAC6渗透部门的叶绿素损失。通过(a)中的样品,从渗透到浸润5天的叶片植物中测定总叶绿素。从三次重复的值给出了均值±SD。D. GMNAC6表达诱导的脂质过氧化。 The lipid peroxidation in the 5-d-infiltrated leaf sectors from (A) was monitored by determining the level of TBA-reactive compounds. The values are given as mean ± SD from three replicates. Asterisks indicate values significantly different from the control treatment (p < 0.05, Tukey HSD test). E. The induction of the senescence-associated gene, NTCP23, and pathogenesis-related gene 1, PR1, by GmNAC6 expression. Total RNA was isolated from 5-day-infiltrated leaf sectors that were infiltrated with 35S::GmNAC6 (gray bars) or 35S::GmNAC1 (white bars), and the gene induction was monitored by quantitative RT-PCR using gene-specific primers. Values are relative to the control treatment (NIG infiltration) and asterisks indicate statistic differences (p < 0.05, Tukey HSD test).
的表达GmNAC6(图2 b)促进了农业渗透区叶绿素损失(图2摄氏度),农业渗透叶片的膜离子泄漏增加(另附文件2 b)和脂质过氧化显著增加(图二维)渗透后的五天。通过测量硫碱尿酸(TBA) - 反应性化合物的积累来检查后者,在35s ::中明确提高GmNAC6用农杆菌接种的叶区,与用农杆菌接种的对照叶片进行比较35 s::国家行业集团公司基因。这些tba活性化合物是衰老相关脂质过氧化的产物,这一过程导致活性氧(ROS)的产生和叶绿素损失[20.].
通过监测衰老相关基因标记的表达,我们进一步证实了gmnac6诱导的衰老样表型,NTCP-23(AB032168,称为CP1 in [13.,研究表明,它与烟叶衰老有关[13.,21.],致病相关基因1 [PR1, (22.],通过定量RT-PCR。GmNAC6的表达促进了NTCP-23和PR1转录本的积累(图)2 e).GmNAC1也被证明与大豆的衰老有关[16.,诱导的表达NPCP-23而且,在更小的程度上,PR1当在烟草叶中瞬时表达时,证明了该检测方法在这种异种系统中的有效性。综上所述,这些结果表明GmNAC6表达诱导烟草叶片的衰老反应。
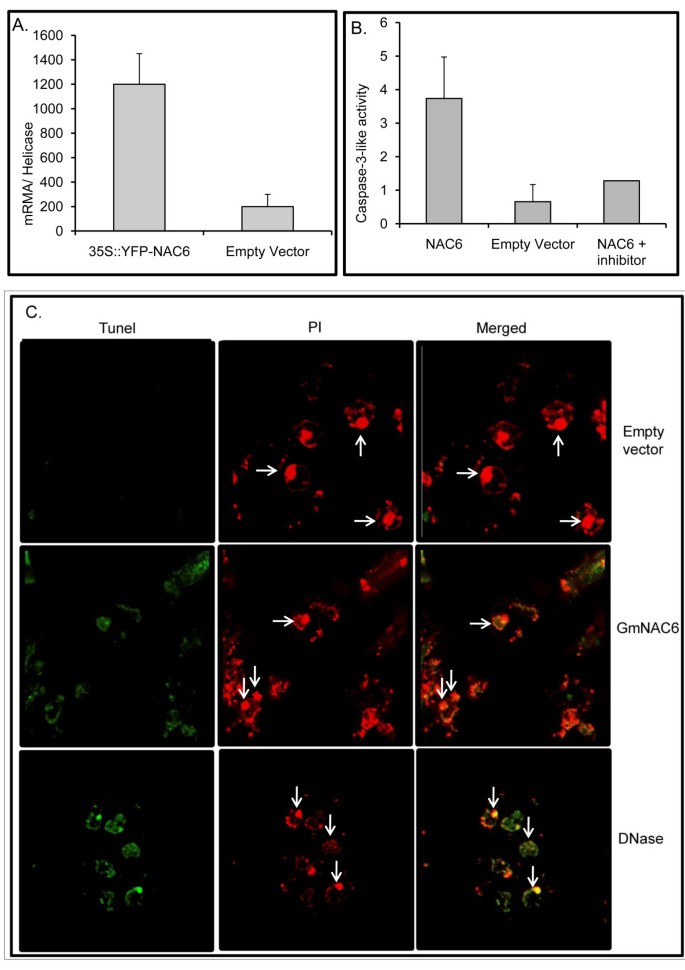
由于内质网胁迫和渗透胁迫整合细胞死亡反应的效应因子NRPs,也被证明在大豆细胞中短暂表达时可诱导细胞死亡,因此我们检测了GmNAC6是否能诱导内源性系统中caspase 3-like的活性和DNA片段。的瞬态表达式GmNAC6由大豆原生质体中的35S启动子驱动,通过RT-PCR检测,相对于解旋酶标记来控制转化效率的任何变化(图3).过表达gmnac6的大豆细胞总蛋白提取物中caspase - 3的活性是空载体转化原生质体提取物的3.62倍(图)3 b).我们还使用末端脱氧核苷酸转移酶介导的dUTP裂口末端标记(TUNEL)技术来测量电穿孔36小时后单个细胞的DNA片段(图)3 c).TUNEL标记后,用碘化丙啶(PI)对甲醛固定和渗透的半原生质体叶片细胞进行反染色。在这些条件下,PI染色所有细胞,当我们用RNase处理样品时,红色荧光信号集中在细胞核(图)3 c,空向量,见箭头)。用空载体转化的对照细胞的细胞核用碘化丙啶(PI,红色)强烈荧光,只显示tunel阴性细胞核(空载体)。相比之下,GmNAC6- 表达样品具有Tunel阳性核,显示出与染色程度相同的核NRP-B(数据未显示)和DNase治疗阳性对照。合并为TUNEL标记的荧光图像与PI染色细胞的叠加,便于TUNEL阳性核的识别。通过两次独立实验,35S::GmNAC6转化的半原生质体叶细胞中约21%±1.5的细胞核为TUNEL阳性。在35S::GmNAC6电穿孔的原生质体中,TUNEL阳性核的比例相对较低,很可能是原生质体转化效率低的原因。因为在大豆悬浮细胞中,caspase 3样活性和DNA片段被描述为与程序性细胞死亡相关的生化标志物[13.,我们的结果与GmNAC6参与细胞死亡事件是一致的。
的瞬态表达式GmNAC6大豆叶片原生质体诱导细胞死亡。瞬态的表达GmNAC6在原生质体。用35S::YFP-NAC6结构体或空载体电穿孔大豆原生质体,表达GmNAC6通过电穿孔后通过定量RT-PCR 36-H监测YFP-GMNAC6。使用2计算表达的值——ΔCt方法以解旋酶为内源对照。值代表三个重复的平均值±SD。b . Caspase-3-like活动。36 h后,从gmnac6电穿孔原生质体中提取总蛋白,在没有或存在特定抑制剂的情况下,用DEVD-pNA底物监测caspase 3样活性。值代表三个重复的平均值±SD。C. DNA片段促进GmNAC6表达式。用空载体或空载体对大豆原生质体电穿孔36 h后的细胞取样GmNAC6表达盒,TUNEL标记,共聚焦显微镜检查。用碘化丙啶(PI)对细胞进行反染色,在632 nm处检测红色荧光。箭头表示一些核。合并为TUNEL标记的荧光图像与PI染色细胞的叠加,便于TUNEL阳性核的识别。作为阳性对照,未转染的细胞也用DNase处理。
NRP和GMNAC6由生物应激和不同的动力学诱导
nrp介导的衰老样反应的激活不是内质网应激或渗透应激所特有的,而是一般环境适应途径的一个共同分支。事实上,nrp也是由其他非生物和生物信号引起的,例如干旱和病原体不相容的相互作用[23.,24.].作为nrp介导信号的假定组成部分,我们研究了是否GmNAC6也是由生物信号引起的(图4).我们首先用细胞壁降解酶(CDE)处理大豆叶片,它模拟细菌病原体的攻击并诱导防御反应[25.,然后我们将不相容细菌接种在大豆叶片上,番茄紫丁香假单胞菌(附加文件3.),作为我们的实验系统。在CDE处理和接种病原菌后的不同时间检测GmNAC6 mRNA的水平(图)4和4 b).作为CDE处理中的阳性对照,我们还检测了er分子伴侣、结合蛋白(BiP)和calnexin (CNX)的表达,这些蛋白此前已被证明是由CDE诱导的[10.],以及谷胱甘肽- s -转移酶(GST)基因,该基因也受内质网应激和渗透应激共同调控[14.],其方式与NRPs和GmNAC6相同(图4).为了检测不相容细菌的有效性,番茄紫丁香假单胞菌在大豆中,我们检测了致病相关基因的诱导,PR1和PR4(图4 b).和我们一样nrp,两种处理均促进诱导GmNAC6但动力学略有不同。CDE处理(图4)和细菌接种(图4 b)导致NRP-A和NRP-B转录水平在处理后1 h和3 h分别升高。与NRPs的快速诱导相反,NRPs的诱导GmNAC6发生了延迟动力学,类似于er驻留伴侣,毕普和CNX(图4)和致病相关基因,PR1和PR4(图4 b).的感应GmNAC6经CDE处理和接种不亲和菌3 h后首次检测。在大豆叶片接种不亲和细菌10 h后,GmNAC6转录本的积累达到最大值(图)4 b).这些结果表明NRP-A和NRP-B诱导先于表达的增加GmNAC6。
NRP-A和NRP-B诱导表达GmNAC6基因
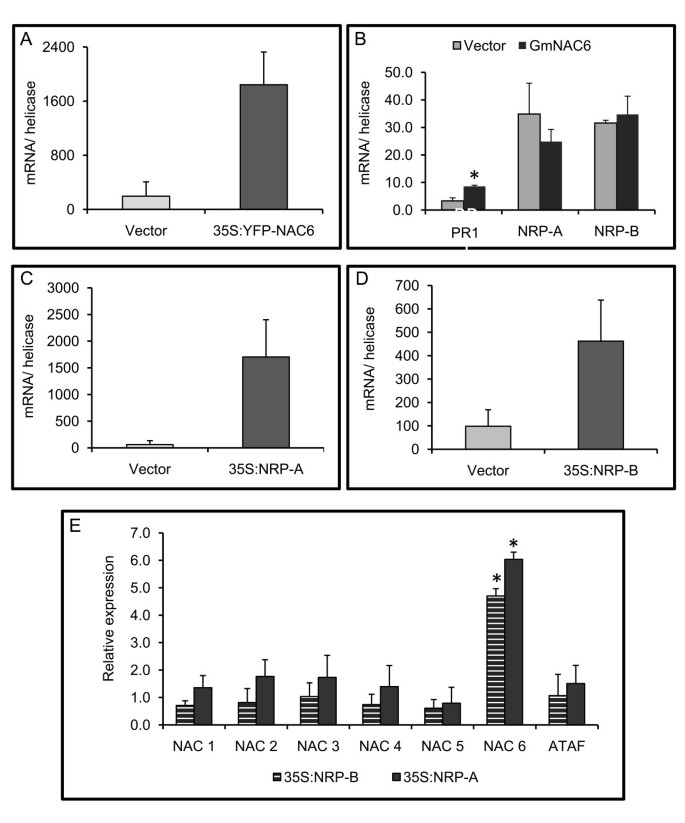
协同协同诱导GmNAC6通过渗透胁迫和内质网胁迫,以及其促进植物nrp样衰老表型和pcd样响应的能力,将GmNAC6与内质网胁迫和渗透胁迫联系起来,整合nrp介导的信号通路。为了定位GmNAC6在该通路中的位置,我们检测了GmNAC6和nrp以回应彼此。的基因GmNAC6(图5A),NRP-A(图5C),NRP-B(图5D)置于35S启动子的控制下,在培养细胞衍生的大豆原生质体中过表达。我们首先分析了动力学nrp和GmNAC6对原生质体过程中使用的植物细胞壁降解酶(CDE)的响应的诱导(附加文件4).NRP-B转录物通过CDE处理迅速且瞬时致动,而GMNAC6诱导的动力学延迟。与延迟动力学一致GmNAC6CDE治疗和生理压力诱导,我们发现瞬态表达GmNAC6在大豆原生质体上没有导致增加的积累NRP成绩单(图5B.).相比之下,两者的瞬态表达NRP-A或者NRP-B诱导GmNAC6表达式(图5e.).NRPs增加GmNAC6转录本的积累是一种特殊的现象,而不是普遍现象,因为NRPs的瞬时表达NRP-A或者NRP-B没有促进含大豆NAC域蛋白质家族的其他成员的上调。这些结果表明,NRP可以诱导GMNAC6,但GMNAC6不能诱导NRPS。
NRP-A和NRP-B的瞬时表达诱导GmNAC6的表达。A.大豆悬浮细胞原生质体中GmNAC6的表达。用35S::YFP-NAC6载体或空载体电穿孔大豆原生质体,采用qRT-PCR检测GmNAC6和YFP-GmNAC6的表达情况。这些值代表两个独立实验中三个重复的平均值±SD。B. YFP-GmNAC6的瞬时表达不影响NRP-A和NRP-B转录本的积累。用35S::YFP-NAC6构建物(深灰色)或空载体(浅灰色)电穿孔大豆原生质体,采用qRT-PCR检测NRP-A和NRP-B的表达。这些值代表三个独立实验中三个重复的平均值±SD。星号表示与对照处理有显著差异(p < 0.05, Tukey HSD试验)。C、D. NRP-A和NRP-B在大豆原生质体中的表达。将含有NRP-A (C)或NRP-B (D)表达盒的质粒电孔到大豆原生质体中,通过定量RT-PCR检测瞬时基因表达情况,如(A)。 Plasmids containing NRP-A (light gray) or NRP-B (dark gray) expression cassettes were electroporated into soybean protoplasts, and the relative expression of NAC genes was monitored by qRT-PCR. The relative quantitation of expression was calculated using 2——ΔΔCt方法。数值相对于对照处理(空载体),星号表示与对照处理有显著差异(p < 0.05, Tukey HSD检验)。
NRPs的瞬时表达可激活大豆细胞中的GmNAC6启动子
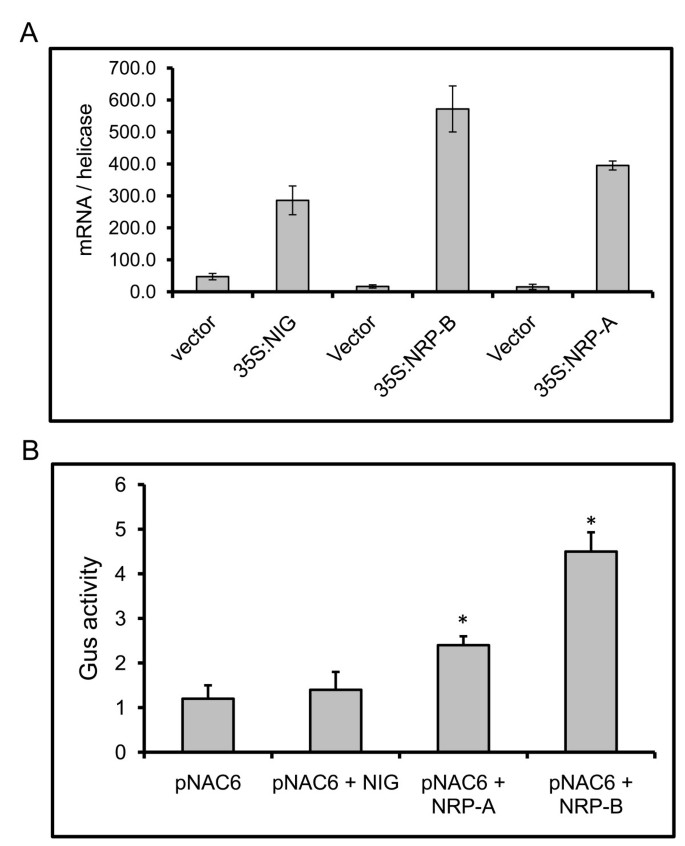
接下来我们检查观察到的激活是否GmNAC6利用NRP-B启动子::β-glucuronidase (GUS)报告基因构建的大豆原生质体瞬时表达检测结果显示,NRPs在大豆原生质体中的表达处于转录水平。在该构建中,一个5'-侧翼序列片段NRP-B(至-1000位置,相对于翻译起始密码子)格斯表达式。因为GmNAC6, NRP-B和NRP-A是在CDE制备原生质体时瞬间诱导的(附加文件4)及伤人[18.,我们在转染36小时后测量报告基因的活性,此时NRPs的表达恢复到基础水平,而由CDE和创伤诱导的GmNAC6启动子驱动的GUS积累预计将下降到较低水平(见附加文件)4).在这些条件下,的瞬时表达式NRP-A和NRP-B在大豆原生质体(图6)导致报告基因表达增加(图6 b),表示控制GmNAC6NRP-B和NRP-B的表达至少部分发生在转录水平。我们也包括了不相关的表达傻瓜测定中的基因作为特异性启动子激活的阴性对照。
NRP-A和NRP-B诱导GmNAC6启动子活化。A. NIG、NRP-A和NRP-B在大豆悬浮细胞原生质体中的瞬时表达。将携带35S::NIG、35S::NRP-A或35S::NRP-B表达盒或空载体的质粒电穿孔至大豆原生质体中,并通过电穿孔36 h后的瞬时表达量(qRT-PCR)检测转染效率。B. NRP-A和NRP-B在大豆原生质体中的瞬时表达激活了GmNAC6启动子::β-葡萄糖醛酸酶基因。大豆原生质体与携带gmnac6启动子::β-葡萄糖醛酸酶基因和35S::NIG, 35S::NRP-A或35S::NRP-B DNA结构的质粒或空载体(pNAC6)共电孔。36 h后,检测转染大豆细胞总蛋白提取物中β-葡萄糖醛酸酶活性(nmol/min/mg蛋白)。这些值代表三次独立实验中五个重复的平均值±标准差。星号表示与对照处理在统计上不同的平均值。
讨论
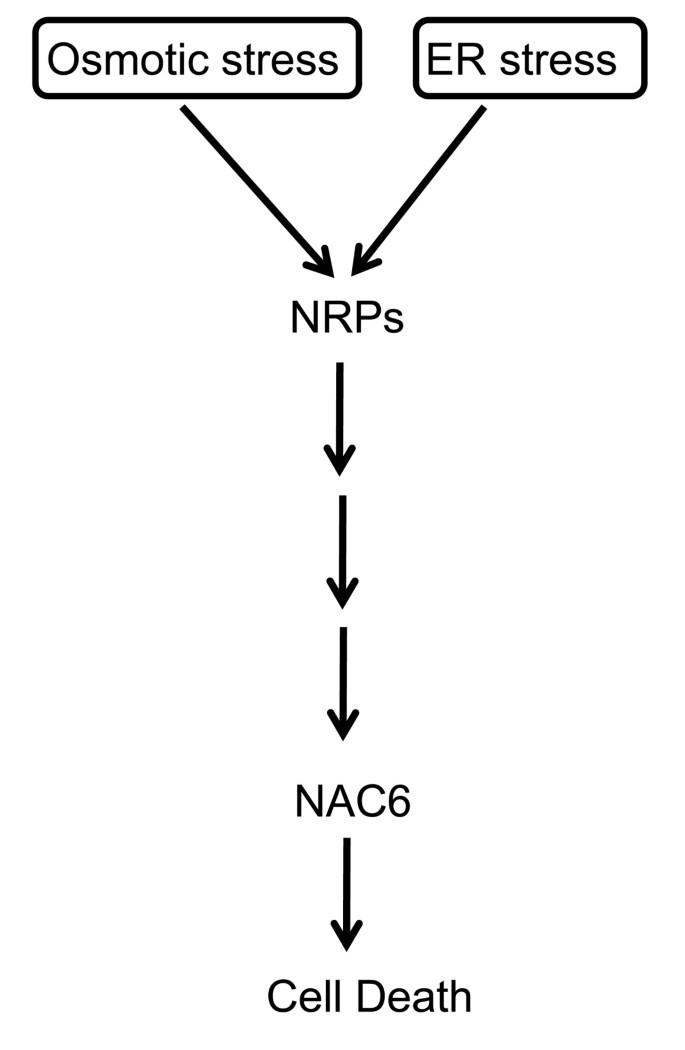
与UPR相比,NRP介导的细胞死导途径是一种植物特异性的ER-应激细胞死亡反应,其通过共用组件与其他环境刺激通信。实际上,渗透压还通过NRP激活细胞死亡信号的转导。在协同方式中对NRP表达的两个应力信号的收敛允许在这两个不同的应激响应途径之间传递信息以使细胞死亡反应增强。因此,通过NRP介导的信号传导的激活,将ER应激和渗透应激信号的整合到细胞死亡电路中发生。这种细胞死亡综合途径已成为植物细胞对多种环境刺激的相关自适应响应。然而,关于该信号传导途径的知识仅限于作为细胞死亡响应和Gmerd15的关键介质的NRP作为激活NRPS表达的转录因子。这里,我们描述了来自大豆,GMNAC6的NAC域蛋白质家族的成员,其可以在ER - 应力和渗透胁迫细胞死亡信号的整合中起作用的NRP-A或NRP-B下游。基于三个标准,GMNAC6与NRP介导的细胞死亡信号联系起来。首先,我们表明GMNAC6表达被ER应激和渗透压单独调节,但是当组合时,两个应力信号促进了GMNAC6转录物的协同积累。通过ER应激和渗透应激诱导剂组合的基因表达的协同诱导是将靶基因与ER应激和渗透胁迫 - 整合途径连接的标准之一。 Second, similar to the NRPs, the transient expression of GmNAC6 induced a senescence-like response in tobacco leaves and a cell death response in soybean cells. Lastly, the ectopic expression ofNRP-A和NRP-B在大豆细胞中,促进了GMNAC6启动子的活化和诱导GmNAC6表达式。综上所述,这些结果将GmNAC6定位于内质网应激和渗透应激整合途径中NRPs的下游(图)7).然而,GmNAC6在整合途径中是否与NRPs线性耦合仍存在争议。
NRPs和GmNAC6也受到生物信号的诱导,如不相容相互作用和CDE处理,但其动力学不同(图)4).虽然两种处理都能迅速诱导NRPs,但GmNAC6转录子的积累增加,且动力学延迟。这些数据与原生质体制备过程中GmNAC6的延迟诱导一致,产生与CDE处理相似的信号。因此,NRP-B转录本积累的增加先于诱导GmNAC6这支持了GmNAC6作用于NRPs下游的观点。在我们的实验烟叶瞬时表达系统中,gmnac6诱导的细胞死亡比nrp介导的细胞死亡发生得更快,这进一步证实了这一解释,因为在细胞死亡信号通路中,作用于NRPs下游的效应子可以预期这一点。
我们发现NRP-B在大豆原生质体中诱导GmNAC6GmNAC6启动子的表达和激活。nrp是否介导的GmNAC6表达是NRPs反转录激活基因表达的直接结果,还是由NRPs介导的信号转导的二次效应,尚不清楚。我们的数据支持后一种假设,因为我们之前已经表明,大豆NRPs定位于细胞质中与质膜相关(13)。拟南芥的NRP同源物也是一种胞质蛋白,但在胁迫条件下转移到线粒体[26.].我们不知道大豆NRPS是否也共享压力介导的线粒体分区化,但我们未能证明NRP-B的核定位,因为它将预期转录激活功能。1-kB 5'Flanking序列的序列分析GmNAC6揭示了大多数真核生物启动子的一些保守的基序,如TATA盒子(附加文件)5(粉红色)和倒置的CCAAT盒子(粗体),以及植物启动子的一些潜在调控元件,可能参与对细胞死亡或渗透胁迫和干旱事件的响应。这些包括aba响应元件,水稻RAB16b基因1的基序III(紫色),OsBIHD1的结合位点(绿色),水稻BELL同源结构域转录因子参与抗病,四个假定元件(NGATT,在ERD1基因中发现的两个结合位点(蓝色),参与对脱水应激和暗诱导衰老的反应。这些推测的GmNAC6启动子上的顺式调控元件说明了转录因子组装的潜在位点,这些位点可能构成nrp介导的应激诱导的细胞死亡反应的靶点。
的证据nrp和GmNAC6提示nrp介导的细胞死亡信号是植物普遍的适应性反应。在不相容的相互作用中,病原菌诱导PCD的保护作用,这一现象在植物中有很好的记录,限制了病原菌对接种细胞的攻击[27.].快速诱导NRP提示nrp介导的PCD诱导可能是超敏反应的一部分。与这一假设一致的是,GmNAC6在烟草叶片中的瞬时表达促进了致病相关基因1,PR1的诱导,导致了坏死病变。
除了内质网胁迫和渗透胁迫诱导外,nrp介导的信号传导也受到干旱的诱导[18.].这些非生物应激信号通过NRPs诱导共同的细胞死亡反应。而内质网应激反应分支不同于UPR的分子伴侣诱导分支[13.],我们之前的研究表明,响应的渗透胁迫分支可能是酸脱落(ABA)依赖的[16.].事实上,NRP-B和GmNAC6都是由ABA诱导的。此外,文献证据表明ABA对水杨酸(SA)依赖的防御途径具有拮抗作用[28.,29.].因此,有可能nrp介导的信号激活导致sa介导的反应增强,如诱导的结果所示PR1和超敏反应样表型,并拮抗地抑制aba介导的反应。由于ABA是植物适应干旱的中央调节因子[30.,31]在透析水分损失的调节中起着至关重要的作用[32],研究nrp介导的细胞死亡反应的失活是否会促进对脱水的耐受性将是有趣的。
结论
我们之前已经证明内质网应激和渗透应激信号整合到细胞死亡回路中是通过激活nrp介导的信号通路实现的[13.,14.].NRPs的表达被证明是由GmERD15调控的,GmERD15是一种内质网和渗透胁迫诱导的转录因子[18.].在这里,我们提供了一些证据,表明含NAC结构域的蛋白GmNAC6与nrp介导的细胞死亡反应有关。就像nrp, GmNAC6是内质网应激和渗透应激信号的组合协同激活,并诱导衰老样反应在足底大豆原生质体的细胞死亡。nrp和GmNAC6是由多种生物和非生物胁迫协调调控的,但诱导nrp的上调之前GmNAC6。与这种早期诱导动力学一致,NRPs的表达激活GmNAC6启动子并诱导GmNAC6表达式。总的来说,这些结果表明GmNAC6可能在内质网应激和渗透应激整合细胞死亡反应中作用于NRPs的下游(图)7).在烟草叶片中瞬时表达GmNAC6诱导的细胞死亡反应比NRP介导的细胞死亡反应更快,这进一步证实了这一解释,因为在细胞死亡信号通路中,作用于NRPs下游的效应子可以预期这一点。然而,GmNAC6在整合途径中是否与NRP线性耦合尚待确定。
方法
质粒结构
在35S启动子的控制下,含有与黄色荧光蛋白(YFP)融合的NAC6 cDNA的克隆35S::YFP-NAC6已被描述[16.].同样,克隆35s :: nrp-a,35s :: nrp-b [13.]和35S::NIG [19.,包含各自的cdna在启动子35S的控制下,已经被描述。
植物生长、大豆悬浮细胞与胁迫处理
大豆(甘氨酸最大)种子(品种Conquista)在土壤中发芽,并在温室条件下(平均温度21°C,最高。31°C,最小15°C),在自然光下,相对湿度70%,昼夜长度大致相等的条件下。发芽两周后,将幼苗转移到2ml 10% (w/v)聚乙二醇(PEG;10 μg/mL衣霉素(Sigma;DMSO,作为对照)或50 mM l -azetidine-2- carboxyacid (AZC, Sigma)溶液。处理8 h后,采收叶片,立即用液态氮冷冻2保存至-80°C。或者,将三周植株的气生部分从子叶下方切除,直接用衣霉素或PEG处理,如前所述[13.,14.].每个胁迫处理和RNA提取在三个独立的实验中重复。
在不亲和互作试验中,大豆植株在发育阶段VC[完全展开的单叶叶片,如Fehr和Caviness的物候尺度所述]33受到了挑战番茄紫丁香假单胞菌。细菌细胞在28°C的523培养基中生长[34].离心后用10 mM氯化镁重悬培养菌2一个的外径600海里约等于1 × 107细胞/毫升(35].用微压注射器接种大豆叶片,在叶片的下表皮接种细菌悬浮液。按照图例所示的时间间隔,将叶片组织用液氮冷冻,-80°C保存至使用。
用细胞壁降解酶(CDEs)处理大豆叶片,如前所述[10.].简而言之,VC阶段的大豆叶片[32用酶溶液(0.4%纤维素酶,0.2%麦胶酶,0.6%甘露醇,20 mM MES, pH 5.5)或单独用缓冲液(0.6%甘露醇,20 mM MES, pH 5.5)作为对照。接种后大约3、10或24小时,将渗入的叶片收获进行分析。
实时rt - pcr分析
对于定量RT-PCR,根据制造商的说明,用TRIzol (Invitrogen)从冷冻叶子或细胞中提取总RNA。RNA用2个单位的RNase-free DNase (Promega)处理,通过RNeasy Mini Kit (QIAGEN)柱进一步纯化。根据生产说明书,从4 μg总RNA中使用oligo-dT(18)和转录酶逆转M-MLV (Invitrogen)合成第一链cDNA。
如前所述进行实时RT-PCR反应[14.].为了确定扩增产物的质量和引物特异性,我们通过1.5%琼脂糖凝胶进行电泳,验证扩增产物的大小,并通过ABI7500仪器进行解离曲线分析扩增产物的Tm(熔化温度)。所使用的引物在附加文件中列出6。为了定量分析大豆原生质体和幼苗中的基因表达,我们使用RNA解旋酶[14.]作为实时RT-PCR分析数据归一化的内源性控制基因。为了定量分析烟草叶片中的基因表达,我们使用肌动蛋白作为对照基因[[13.];ABI 158612]。fold variation是基于实验和对照样品靶基因表达(归一化为内源对照)的比较,使用比较Ct方法进行量化:2——(ΔCtTreatment——ΔCtControl)。用2——ΔCT方法,将测定值归一化为内源对照。
瞬态超表达在烟草通过农杆菌渗透
农杆菌菌株GV3101 pYFP-NAC6渗入3 ~ 4周龄的烟叶,如所述[36].叶裂片(约0.5厘米2),共聚焦显微镜观察蛋白表达情况。收集可见细胞死亡外观的叶片,用液氮冷冻,-80°C保存至使用。
叶绿素含量、脂质过氧化和离子泄漏的测定
用80% (v/v)丙酮从单叶中定量提取,在约1 mg nac存在的情况下,在663和646 nm处用分光光度法测定总叶绿素含量3.(37].通过测定多不饱和脂肪酸氧化分解产物丙二醛(MDA)的含量来估计叶片脂质过氧化程度。如Hodges等人所述,通过硫代巴比妥酸(TBA)反应测定丙二醛(MDA)含量[38].如Wang等人所描述的那样,测定了经农业接种的圆盘叶片的电解质渗漏。39].
原生质体中的瞬时表达
大豆原生质体由大豆品种征服的胞嘧啶细胞的5天旧的亚培养物制备[40],如前所述[41,只做了一些修改。简单地说,在40 rpm搅拌下,用0.5%的纤维素酶、0.5%的macerozyme R-10、0.1%的果胶酶Y23、0.6 M甘露醇和20 mM MES (pH 5.5),在传代5 d后,用消化3 h分离原生质体。消化的程度是通过检查监控细胞显微镜下每30分钟。通过65μm的尼龙网过滤后,通过离心分离原生质体,resuspended 2毫升0.6甘露醇+ 20 mM MES, pH值5.5,通过在蔗糖梯度离心分离(20% (w / v)蔗糖、甘露醇0.6和20毫米MES,用2 mL电穿孔缓冲液(25 mM HEPES-KOH (pH 7.2), 10 mM KCl, 15 mM MgCl)稀释2和0.6 M甘露醇)。将10 μg表达盒DNA和30 μg剪切后的鲑鱼精子DNA电切(250 V, 250 μF)至2 × 10,进行瞬时表达检测5- 5 × 106将原生质体稀释到MS培养基中,MS培养基中添加0.2 mg/ mL 2,4 -二氯苯氧乙酸和0.6 M甘露醇,pH为5.5。在黑暗培养36 h后,用0.6 M甘露醇+ 20 mM MES洗涤原生质体,pH 5.5,在N2直到使用。原生质体也可直接从大豆叶片中制备,如前所述[42].
Caspase 3样活性原位DNA碎片(TUNEL)的标记
大豆细胞电穿孔36 h后提取总蛋白。用ApoAlert检测caspase 3样活性®Caspase 3比色测定试剂盒(Clontech),根据制造商的说明,pH值7.4。底物为DEVD-pNA, caspase 3样活性的抑制剂为试剂盒提供的合成四肽DEVD-fmk。根据制造商的指示,使用ApoAlert DNA片段检测试剂盒(Clontech),通过末端脱氧核苷酸转移酶介导的dUTP划痕末端标记(TUNEL)检测DNA中的游离3'OH。经35S:GmNAC6转化的甲醛固定半原生质体细胞经0.2% Triton X-100/PBS渗透,TUNEL标记。用蔡司LSM 410倒置共聚焦激光扫描显微镜观察样品,显微镜的结构为:激发在488 nm,发射在515 nm。TUNEL标记后,PBS在室温下冲洗5分钟,10 μg ml反染色-1碘化丙啶(PI)含0.5 μg ml-1无DNA酶RNase。作为阳性对照,用DNase1处理样品。
GmNAC6启动子报告基因构建
5′-侧翼序列的1000 bp片段GmNAC6基因http://www.phytozome.net/soybean用引物promNAC6Fw(5’-)从大豆DNA中扩增出相对于翻译起始密码子的序列GAATTCGTCATTTGATTTAAGG-3',创建一个EcoRI站点,下划线)和pNAC6Rv (5'-AGATCTTCCATGGTTGCCATAT-3',创建带下划线的BGLII网站,然后克隆到TOPO-PCR4载体(Invitrogen)中。然后将GMNAC6启动子片段与EcoRi和Bglii双消化物从Topo-PCR4中释放,并插入PCAMBIA1381Z的同一部位,得到PNAC6 :: GUS(PUFV1255)。
GUS活动测定
Gus活性的蛋白质萃取和荧光测定基本上如Jefferson所描述的等。(43以甲基伞形酮(MU)为标准品。在标准检测中,将叶圆盘磨碎在0.5 mL GUS检测缓冲液(100 mm NaH)中2宝4·H2O [pH 7.0], 10 mM EDTA, 0.1% [w/v] sarcosyl, 0.1% [v/v] Triton X-100), 25 μLμL的GUS检测缓冲液中含有2 mM的荧光4-甲基伞形花序酮β-D葡糖苷(MUG)作为底物[44].混合物在37℃黑暗中孵育30分钟,使用DYNA Quant 200荧光仪测定GUS活性。
参考文献
- 1。
Denekamp M, Smeekens SC:损伤和渗透胁迫信号的整合决定了AtMYB102转录因子基因的表达。植物生理学报。2003,32(4):591 - 598。10.1104 / pp.102.019273。
- 2。
张海涛,王鑫,张海涛:拟南芥转录组对盐胁迫、渗透胁迫和冷胁迫的响应。植物营养与肥料学报。2002,30(4):429 - 434。10.1104 / pp.008532。
- 3.
塞其M, Narusaka M,石田J, Nanjo T, Fujita M, Oono Y, Kamiya A, M,只是Enju,樱井T, Satou M,秋山K,塔基T, Yamaguchi-Shinozaki K, Carninci P,卡瓦依J,崎Y, Shinozaki凯西:监测7000个拟南芥基因的表达谱在干旱、寒冷和盐碱地强调使用全长cDNA微阵列。植物学报,2002,31:279-292。10.1046 / j.1365 - 313 x.2002.01359.x。
- 4.
陈志刚,王志刚,王志刚,等:受体相关激酶BAK1。植物科学进展。2009,14:535-541。10.1016 / j.tplants.2009.08.002。
- 5。
脱落酸在植物-病原互作中的作用。植物营养与肥料学报。2005,8:1-6。
- 6。
nsp相互作用激酶,NIK:植物防御信号转导器。中国生物医学工程学报。2010,31(4):489 - 494。10.1093 / jxb / erq219。
- 7.
Liu JX, Howell SH:植物内质网蛋白质量控制及其与环境胁迫响应的关系。acta botanica sinica(云南植物研究),2010,29(4):429 - 434。10.1105 / tpc.110.078154。
- 8.
Urade R:植物内质网应激信号通路。BioFactors。2009年,35:326 - 331。10.1002 / biof.45。
- 9.
Malhotra JD, Kaufman RJ:内质网和折叠蛋白反应。细胞生物学杂志。2007,18:716-731。10.1016 / j.semcdb.2007.09.003。
- 10。
Jelitto-Van Dooren EP, Vidal S, Denecke J:预期内质网应激:发病相关基因诱导前的新早期反应。植物学报。1999,11:1935-1944。
- 11.
王丹丹,王志伟,董晓东:诱导蛋白分泌途径对系统性获得性抗性的作用。自然科学进展。2005,32(6):733 - 741。10.1126 / science.1108791。
- 12.
从内质网应激到炎症反应。自然科学。2008,454:455-462。10.1038 / nature07203。
- 13。
Costa MDL, Reis PAB, Valente MAS, Irsigler AST, Carvalho CM, Loureiro ME, Aragão FJL, Boston RS, Fietto LG, Fontes EPB:内质网应激信号和渗透信号在植物特有的富含天冬酰胺的蛋白上聚合,促进细胞死亡。中国生物医学工程学报。10.1074 / jbc.M802654200。
- 14.
Irsigler AST, Costa MDL, Zhang P, Braga PA, Dewey R, Boston RS, Fontes EPB:大豆叶片表达谱揭示了内质网和渗透胁迫途径的整合。基因组学杂志。2007,8:431-10.1186/1471-2164-8-431。
- 15.
Nuruzzaman M, Manimekalai R, Sharoni AM, Satoh K, Kondoh H, Ooka H, Kikuchi S:水稻NAC转录因子家族的全基因组分析。基因。2010,465:30-44。10.1016 / j.gene.2010.06.008。
- 16。
Pinheiro GL,Marques CS,Costa MDBL,REIS PAB,Alves MS,Carvalho CM,Fietto LG,Fontes EPB:完整的大豆NAC转录因子库存:序列保护和表达分析在应力反应中揭示了他们不同的作用。基因。2009,444:10-23。10.1016 / J.GENE.2009.05.012。
- 17.
程序性细胞死亡的不同分子刺激。生物化学学报。1996,21:359-364。
- 18.
Alves MS, Reis PAB, Dadalto SP, Faria JAQA, Fontes EPB, Fietto LG:一种新的转录因子,对脱水的早期反应15,将内质酸胁迫与渗透胁迫诱导的细胞死亡信号联系起来。中国生物医学工程学报。2011,31(4):429 - 434。10.1074 / jbc.M111.233494。19.
- 19.
Carvalho CM, Fontenelle MR, Florentino LH, Santos AA, Zerbini FM, Fontes EPB:一种新型核浆转运GTPase,被鉴定为双偶双生子病毒核穿梭蛋白的功能靶点。植物学报,2008,55:869-880。10.1111 / j.1365 - 313 x.2008.03556.x。
- 20.
Dhindsa RS, Plumb-Dhindsa P, Thorpe TA:叶片衰老:与膜透性和脂质过氧化水平升高,超氧化物歧化酶和过氧化氢酶水平降低有关。中国生物医学工程学报,2001,21(4):457 - 461。10.1093 / jxb / 32.1.93。
- 21.
关键词:烟草,半胱氨酸蛋白酶,基因表达,衰老植物生态学报。2000,44(4):449 - 457。10.1023 /: 1026546004942。
- 22。
Van Loon LC, Rep M, Pieterse CMJ:诱导性防御相关蛋白在受感染植物中的意义。植物病理学杂志。2006,44:135-162。10.1146 / annurev.phyto.44.070505.143425。
- 23。
陈志强,陈志强,陈志强,等。一种新的富含n蛋白的细胞壁定位蛋白在植物超敏反应中被强烈诱导。植物学报,2001,21(4):427 - 434。10.1023 /: 1011202225323。
- 24。
瓦伦特MAS,法里亚JAQA,拉莫斯JRLS Reis帕布,ibsen Pinheiro GL, Piovesan ND,极其,德梅内塞斯CC,毛卡诺,Fietto LG、Loureiro我,阿拉冈FJL,丰特斯EPB: ER腔的结合蛋白(毕普)介导的增加抗旱大豆在大豆和延迟drought-induced叶衰老和烟草。中国生物医学工程学报,2009,30(4):531 - 534。10.1093 / jxb / ern296。
- 25。
Erwinia carotovora细胞壁降解酶在水杨酸非依赖性诱导植物防御反应中的协同作用。植物与微生物学报,1998,11:23-32。10.1094 / MPMI.1998.11.1.23。
- 26.
王志强,王志强,王志强:不同胁迫条件下拟南芥富氮蛋白(NRP)的研究。植物营养与肥料学报。2011,29(4):491 - 497。10.1016 / j.plaphy.2011.01.005。27.
- 27.
植物免疫系统的识别与应答。《现代文学》2003,37:579-609。10.1146 / annurev.genet.37.110801.142628。
- 28。
李建平,李建平,李军。拟南芥脱落酸反应的负调控因子的研究进展。植物营养与肥料学报。2006,32(4):459 - 463。10.1104 / pp.106.086223。
- 29.
Mohr PG, Cahill DM:脱落酸影响拟南芥对丁香假单胞菌的敏感性。番茄与寄生孢霉。植物营养与肥料学报。2003,30:461-469。10.1071 / FP02231。
- 30.
Shinozaki K, Shinozaki K:细胞反应和对脱水和冷胁迫的耐受性的转录调控网络。植物学报,2006,57:781-803。10.1146 / annurev.arplant.57.032905.105444。
- 31.
朱建平:植物盐和干旱胁迫的信号转导。植物生态学报,2003,22(4):427 - 434。10.1146 / annurev.arplant.53.091401.143329。
- 32.
Schroeder JI, Allen GJ, Hugouvieux V, Kwak JM, Waner D:保卫细胞信号转导。植物营养与肥料学报。2001,22(6):627-658。10.1146 / annurev.arplant.52.1.627。
- 33.
Fehr WR, caveness CE:大豆发育阶段。艾奥瓦州科技大学;1977年,11。
- 34。
农杆菌(Agrobacterium)、棒状杆菌(Corynebacterium)、Erwinia、假单胞菌(Pseudomonas)和黄单胞菌(Xanthomonas)的选择性分离。植物病理学杂志,1997,60:969-976。10.1094 /发朵- 60 - 969。
- 35。
关键词:番茄,致病力,Erwinia amylovora, dspEF,假单胞菌,avrE美国国家科学院学报。1998年,95:1325 - 1330。10.1073 / pnas.95.3.1325。
- 36。
Carvalho CM, Santos AA, Pires SR, Rocha SR, Saraiva DI, Joao PB Machado, Eliciane C Mattos, Luciano G Fietto, Elizabeth PB Fontes: NIK1介导的rpL10A核转运调控是植物细胞对抗病毒的一种防御策略。PLoS Pathog. 2008, 4: e1000247-10.1371/journal.ppat.1000247。
- 37。
光合生物膜的叶绿素和类胡萝卜素色素。甲安非他明酶。1987,148:350-382。
- 38.
Hodges DM, Delong JM, Forney CF, Prange RK:改进硫代巴比土酸反应物质测定法,用于估算植物组织中含有花青素和其他干扰化合物的脂质过氧化。植物学报。1993,29(4):593 - 598。
- 39.
王小龙,王小龙,王小龙。拟南芥中异三聚体G蛋白信号通路的研究进展。美国国家科学院学报。2007年,104:3817 - 3822。10.1073 / pnas.0611735104。
- 40.
Cascardo JCM, Almeida RS, Buzeli RAA, Carolino SMB, Otoni WC, Fontes EPB:大豆BiP亚型的磷酸化状态和表达在非生物胁迫后受到不同的调控。中国生物化学杂志。2000,27(4):497 - 498。10.1074 / jbc.275.19.14494。
- 41.
双生病毒复制蛋白和原始DNA之间的相互作用是病毒复制的必要条件。中国生物医学工程学报。
- 42.
法兰西奇VR,Ku MSB,Wittenbach VA:来自大豆叶片的叶蛋白和蛋白质叶片原生质体的分离。植物sci lett。1984年,36:181-186。10.1016 / 0304-4211(84)90166-4。
- 43.
Gus融合:β-葡萄糖醛酸酶在高等植物中的敏感和通用的基因融合标记。中国海洋大学学报(自然科学版),1997,6:3901-3907。
- 44.
Freitas RL, Carvalho CM, Fietto LG, Loureiro ME, Almeida AM, Fontes EPB: SBP2启动子远端区域的不同抑制模块有助于其在不同营养器官中的维管组织特异性表达。植物生态学报。2007,32(6):693 - 698。10.1007 / s11103 - 007 - 9225 - 0。
确认
我们感谢克里斯·霍斯教授为35s-yfp-cassetea-nos-pcambia1300二进制向量,Claudine M. Carvalho教授,用于与共聚焦显微镜和Luciano G. Fietto教授的技术援助,用于批评稿件。This research was supported by the Brazilian Government Agencies CNPq grants 559602/2009-0, 573600/2008-2 and 470878/2006-1 (to E.P.B.F.) as well as by a FAPEMIG grant, CBB-APQ-00070-09, and a FINEP grant, 01.09.0625.00 (to E.P.B.F.). J.A.S.A.F. and G.L.P. were supported by a CAPES graduate fellowship, and P.A.B.R. was supported by a CNPq graduate fellowship.
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
JAQA进行了实验,对数据进行了统计分析,并起草了手稿。MTBR和PABR直接辅助qRT-PCR检测和caspase 3样活性实验。GLR辅助农业渗透试验。GCM直接辅助TUNEL检测和离子泄漏检测。EPBF设计实验并编辑手稿。所有作者均已阅读并批准本稿件。
电子辅料
12870 _2011_916_moesm1_esm.tiff
附文件1:由NRP-B在烟叶中的表达。在接种后8天(8d)、10天(10d)和11天(11d),用指定的农用接种物浸渍叶片,并拍照。在农业渗透后8天首次检测到强烈的褪绿。(TIFF 2 MB)
农渗叶片NRP-B (A)和GmNAC6 (B)的膜离子泄漏
附加文件2:。用指示的农杆菌浸渍叶片,在浸渍后8天(NRP-B)和5天(GmNAC6)收获的叶盘上测定离子渗漏量。LBA是叶片部分被渗透和未转化的结果根癌土壤杆菌菌株LBA4404。(TIFF 263 KB)
(
额外的文件3:番茄紫丁香假单胞菌(太平洋标准时间)诱导大豆的超敏反应。一种细菌悬液太平洋标准时间渗透于大豆叶片的下表皮。接种后24小时拍照。(TIFF 1 MB)
12870_2011_916_moesm4_esm.tiff.
附加文件4:原生质体过程中GmNAC6和NRP-B诱导的动力学。用空载体pMON921电穿孔大豆原生质体,以解旋酶为内源对照,定量RT-PCR检测电穿孔后指示时间内的内源GmNAC6和NRP-B的表达。(TIFF 190 KB)
在GMNAC6启动子区域上推定的顺式调节元素
附加文件5:。GmNAC6序列延伸至ATG(粗体)的翻译起始密码子GmNAC6。数字表示相对于翻译起始密码子的位置。几种假定的顺式调节元件用颜色表示。这些包括一个假定的塔塔框(粉红色),一个倒CAAT框(粗体),一个ABA-responsive元素(紫色)的结合位点OsBIHD1(绿色),四个假定的元素(NGATT,红色)cytokinin-regulated转录因子ARR1和cis-elements(蓝色)参与反应脱水压力和dark-induced衰老。(TIFF 347 KB)
12870 _2011_916_moesm6_esm.pdf
附加文件6:用于实时RT-PCR表达分析的引物。表中显示了用于基因表达分析的引物的序列。基因的存取号码也被告知。(PDF 23 KB)
作者的原始提交的图像文件
权利和权限
开放访问本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
法利亚,j.a.,里斯,p.a.,里斯,M.T.et al。含有NAC结构域的GmNAC6蛋白是内质网应激和渗透应激诱导的nnp介导的细胞死亡信号通路的下游成分。BMC植物杂志11,129(2011)。https://doi.org/10.1186/1471-2229-11-129
收到了:
接受:
发表:
关键字
- GmNAC6
- 细胞死亡
- ER应激
- 渗透压力
- nrp
- 富含氢蛋白