抽象的
背景
议会大厦(T.兰斯洛肯酒店一世内包膜C叶绿体)介导核编码的叶绿体蛋白穿过内层膜的转运。Tic110形成一个突出的蛋白易位通道。此外,该复合物的另一个亚基Tic20被认为可以形成一个蛋白输入通道——与Tic110一起或独立于Tic110。然而,迄今为止还没有提供关于Tic20通道活动的实验证据。
结果
我们在综合生化和电生理学研究中进行了详细描述了TIC20,并更深入地了解其在蛋白质进口到叶绿体中的潜在作用。首先,我们在两者中比较了TIC20和TIC110的转录物和蛋白质水平Pisum一和拟南芥蒂利亚纳.我们发现Tic20蛋白的含量普遍较低,这在拟南芥中尤其明显。其次,我们证明了Tic20在内膜中形成一个大于700千道尔顿的复合物,该复合物与Tic110明显分离,在约250千道尔顿时作为二聚体迁移。第三,我们在内膜内定义了Tic20的拓扑结构,发现它的N-和c端都朝向基质侧。最后,我们成功地将过表达的Tic20重组并纯化到脂质体中。利用这些Tic20蛋白脂质体,我们首次证明了Tic20可以独立形成阳离子选择性通道在体外.
结论
提出的数据为Tic20可以作为叶绿体输入转位复合体的通道蛋白的概念提供了第一个生化证据。然而,Tic20在内膜中的丰度非常低,表明它不能形成一个主要的蛋白转运通道。此外,Tic20和Tic110的独立复合形成不利于共同形成通道。因此,基于在蛋白脂质体中观察到的Tic20通道活性,我们推测叶绿体内膜包含多个(至少两个)易位通道:Tic110是一般的易位孔,而Tic20可能负责一个特殊的蛋白质亚群的易位。
背景
质体起源于一个单一的内共生事件,涉及一个与蓝藻相关的生物体[1,2].在内核细胞的过程中,发生了大量基因转移,在此期间将大多数塑性基因转移到宿主细胞核中。因此,今天,大多数血浆蛋白质必须翻译成细胞器。到目前为止,在外壳和内部包膜(IE)膜中的表征了两种蛋白质易位复合物:TOC和TIC(T.兰斯洛肯酒店O.uter /一世内包膜Chloroplasts) [3.,4].在通过Toc转位通过外膜后,Tic复合物催化剂通过IE膜导入。到目前为止,有七个组成部分被明确地描述为Tic亚基:Tic110, Tic62, Tic55, Tic40, Tic32, Tic22和Tic20(详细综述见[5,6在其中引用)。
Tic110是最大的,最丰富的[7- - - - - -9最好的是Tic组件。它在其N-末端含有两个疏水性跨膜螺旋,锚定膜中的蛋白质[8,10]在大C末端结构域中有四个两亲性α-螺旋,其负责通道形成[11,12].在Intermbrane Space侧,TiC110接触TOC机械并识别前蛋白质[8,13,14].此外,面向基质的环提供了一个过境肽对接位点,并招募伴侣,如Cpn60、Hsp93和Hsp70 [13- - - - - -17].
Tic110在花、叶、茎和根组织中表达,表明在所有类型的质体中起导入作用[14,18].这对于叶绿体生物发生和胚胎发育至关重要[14]杂合子敲除植物明显受到影响:它们具有淡绿色表型,表现出植物生长缺陷,叶绿体中类囊体膜和淀粉颗粒的数量显著减少,再加上穿过IE膜的蛋白质易位受损。
Tic20是Tic复合物中的第二个候选物,该复合物被提议构成蛋白质易位通道[19- - - - - -22].例如,在与TOC复合物之后的交联中检测到TIC20在体外豌豆的进口实验[21].在更新的研究中,发现TIC20形成一个含有前蛋白质的梅加尔顿的复合物途中进入质体后,豌豆温和的溶解和拟南芥叶绿体(20.,也表明它参与了蛋白质的进口。
预计TiC20具有四个α-螺旋跨膜结构域,因此与线粒体内膜旋转蛋白蛋白质,即TIM17和TIM23(TMHMM Server [23]和[21])。在TIC20和两个原核支链氨基酸转运蛋白之间还报告了遥远的序列相似性[24].计算预测将N-和c -末端置于基质中(TMHMM Server [23]和[25),然而,没有实验证据证明这种拓扑结构在高等植物中是可行的。唯一的迹象是N在- c在拓扑是C末端GFP融合到TIC20蛋白家族的高度不同成员的结果Toxoplasma Gondii.[22].在同一项研究中,tgtic20分析突变体的蛋白质进口到磷胶体中,源自二次内联症的体积型,并且发现该TIC20的远处同源物也很重要,尽管可能是辅助部件。
这拟南芥蒂利亚纳基因组编码四个TIC20同源物:AtTic20-I,——,四世和-v。AtTic20-I显示与最接近的同源性Pisum sativum Tic20 (PsTic20).它存在于所有植物组织中,在快速叶生长期间,其表达最高了[19].AtTic20-I反义植物表现出严重的苍白表型,生长缺陷和塑性函数的缺乏,例如较小的塑性,降低囊体,塑性蛋白质的含量下降,以及预蛋白质的进口率改变[19,26].击倒AtTic20-I白化病甚至在幼苗最年轻的部分吗[27].另一个密切相关的存在Tic20.同源物(阁楼20-IV.)可能会预防attic20-I.杀伤力的植物,自从Tic20-IV.在突变体中上调[26,27].然而,额外的过度表达阁楼20-IV.只能在非常低的程度上补偿观察到的缺陷,说明AtTic20-IV不能完全替代AtTic20-I的功能[26].还有两个更恒定的相关同源物也存在拟南芥(AtTic20-II和AtTic20-V)然而,它们最接近的直系同源物是蓝藻蛋白质[11],即使叶绿体转运肽的预测很弱[28[单元格中的本地化(和功能)仍然未知[29].
基于对形成蛋白质的结构相似性,在敲低突变体中可检测到进口前预蛋白质和蛋白质进口缺陷的交联,其假设Tic20在IE膜中形成蛋白质易位通道[21,24].此外,在TIC-TIC超复杂中的TIC110的小部分到TIC20的次要分数的交联[19表明两种蛋白质的结合。因此,提出两种蛋白可能在通道形成过程中协同作用。然而,在没有Toc复合物的情况下,两种蛋白之间未检测到交联,因此不太可能发生直接或永久的相互作用[21].最近,TIC20被证明是在BN-PAGE上检测到的一个Megadalton易位复合物的组成部分在体外进口豌豆和拟南芥叶绿体(20.].在这种易位复合体中无法观察到TIC110,它形成了不同,数百千盎司的较小复杂,支持两种蛋白质不关联的想法。然而,TIC20的预期信道活动尚未通过实验证明。
在这项工作中,我们更详细地探讨了Tic20在Tic110中的作用。我们分析了细胞中Tic20的表达Pisum一(PSTIC20.) 和拟南芥蒂利亚纳(专注于AtTic20-I和阁楼20-IV.),并直接与表达Tic110在这两种生物。此外,半定量免疫印迹分析揭示了叶绿体包膜中Tic20和Tic110的绝对数量。此外,我们发现Tic20和Tic110不是豌豆IE中相互复合物的一部分。在成功表达和纯化Tic20后,我们通过实验验证了预测的α-螺旋结构和N在- c在拓扑。最后,我们首次报告TIC20在重构成脂质体时形成阳离子选择性渠道。
结果与讨论
TIC20和TIC110显示差异表达式图案
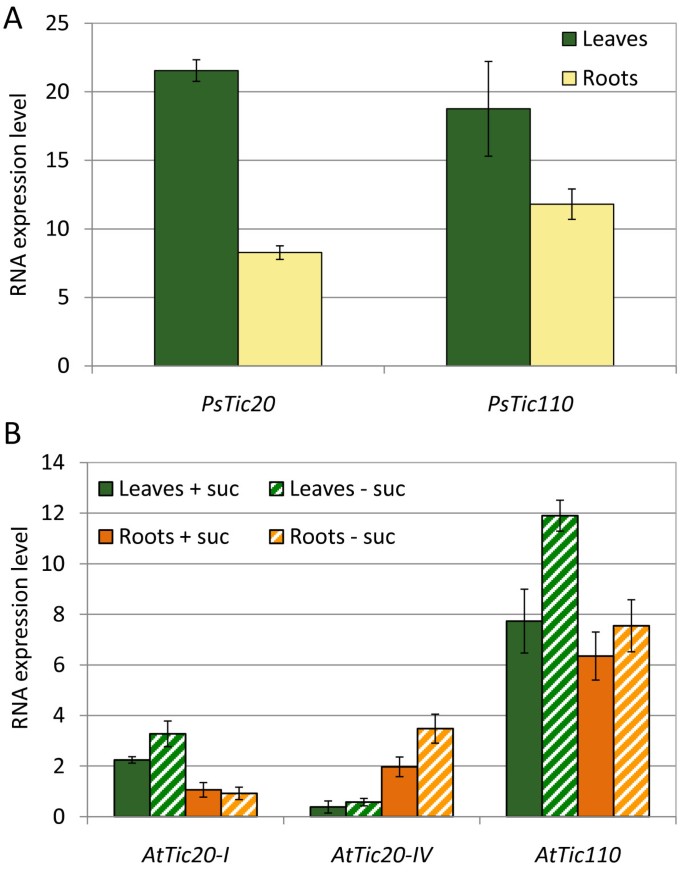
由于注释中的错误AtTic20-I,目前可用的Affymetrix微阵列不含该同种型的特定寡核苷酸,因此不能用于研究表达水平AtTic20-I[27].我们设计了特异性引物Tic20.和Tic110在豌豆和拟南芥并进行定量RT-PCR(QRT-PCR)分析,以获得关于表达的综合和更可靠的定量数据Tic20.比半定量分析和大规模并行签名测序数据库提供的数据要好[19,26,27].
为了进行分析,分别从2周龄和4周龄豌豆幼苗的叶片和根部分离RNA拟南芥植物。拟南芥被水贫地生长,以便易于进入根组织。在所有样本中,表达Tic20.分析结果与Tic110(图1).
在豌豆中,这两个基因在根组织中的表达量低于叶片。在根,PsTic110RNA的含量要高40%,而在叶片中的表达水平PSTIC20.和PsTic110似乎在一个类似的范围内拟南芥,AtTic20-I和AtTic110在根中表达比叶子更低,类似于豌豆(图1 b).这些结果似乎与Hirabayashi的结果相矛盾等[26],他总结了Tic20-I在芽和根中的可比表达水平。然而,与我们的定量分析相比,他们使用了一种不可量化的方法。此外,在我们的实验中AtTic20-I和AtTic110与豌豆明显不同的是,AtTic110RNA大约是。的3.5倍和6倍AtTic20-I分别在叶和根中。
我们还设计了特异性引物,用于第2个Tic20同源物拟南芥,阁楼20-IV.,我们的定量方法具有足够的灵敏度,可以精确地确定其RNA水平拟南芥叶子和根,允许与表达的直接比较AtTic20-I和AtTic110(图1 b).转录阁楼20-IV.与AtTic110在腾等[27[谁观察了使用两种不同方法的表达的差异比,其中一个甚至没有足够敏感以检测阁楼20-IV..最近的一项研究[26的表达也进行了研究阁楼20-IV.,但没有对他们的数据进行任何量化。
我们的数据显示阁楼20-IV.是否存在于叶和根的转录水平相似AtTic20-I,但不如AtTic110.有趣的是,并按照Hirabayashi提出的数据等[26],转录水平阁楼20-IV.在根中高于那些AtTic20-I而在叶组织中则相反。可以推测,观察到的表达模式反映了这两个基因的组织特异性分化。阁楼20-IV.仍然可以部分地补充功能AtTic20-I的可行性证明了这一点attic20-I.敲除植物和黄色表型attic20-I.AtTic20-IV过表达突变体[26,27].然而,严重的表型attic20-I.植物,结合观察到的差异表达模式,清楚地表明了两个同系物的特定功能AtTic110反义观察到的表达率attic20-I.线条可能表明另一种可能的代偿效应[19].
发现三种研究基因的表达模式相似拟南芥水培生长,含或不含蔗糖(图)1 b)或土壤(数据未显示)。然而,在无蔗糖生长的植物中,基因表达普遍较高。
Tic20蛋白在包膜中的含量远低于Tic110
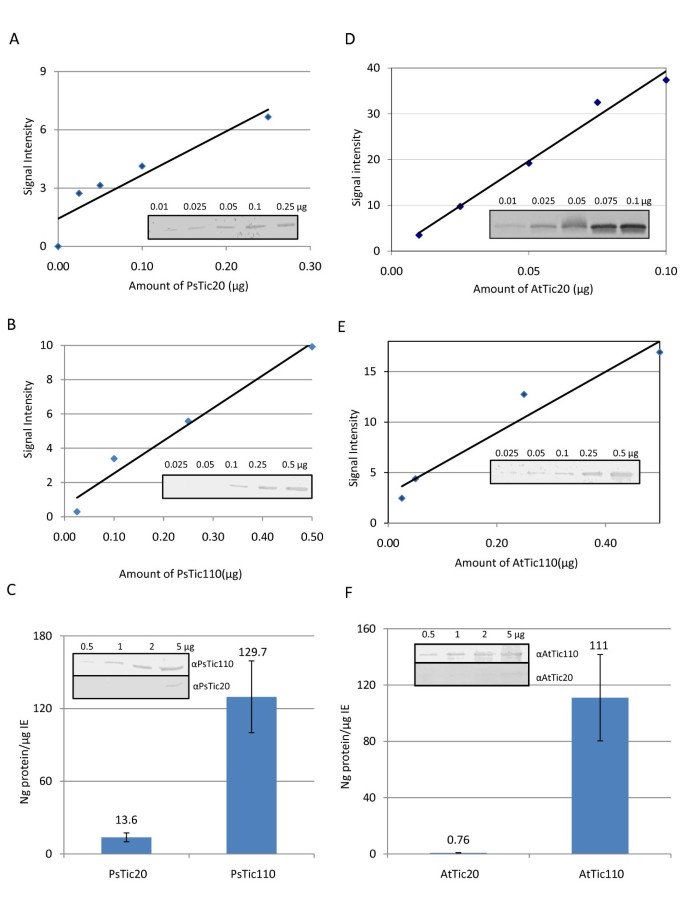
利用从2周龄豌豆和4周龄豌豆中分离的包膜的免疫印迹,在蛋白质水平上对Tic20和Tic110进行半定量分析拟南芥植物。并行地,使用一系列已知的过表达和纯化蛋白质产生校准曲线(图2 a, B, D和2 e)。对来自信封的免疫印迹进行量化后,使用相应的校准曲线确定PsTic20、PsTic110、AtTic20和AtTic110的数量。发现IE中PsTic110的数量几乎是PsTic20的八倍(图2摄氏度),这与在叶片中检测到的两种基因相似的转录水平有显著差异(图)1),表明翻译后过程如翻译速率和蛋白质转换率存在显著差异。在拟南芥,attic110的绝对量与豌豆相同(图2 f), 然而,拟南芥包膜代表一种混合物,包括外层和IE囊泡。因此,AtTic110的相对含量可能高于豌豆。令人惊讶的是,AtTic20的数量是AtTic110的100多倍,与观察到的RNA表达水平相比,差异更大(图)2 f).考虑到Tic110和Tic20的分子大小不同(约5:1),我们仍然观察到AtTic110比AtTic20蛋白多20倍。在豌豆中,我们发现了比Tic20多1.4倍的Tic110 RNA,而在拟南芥TIC110至TIC20的比率为20.3。由于TiC110显示形成二聚体,因此甚至必须更不同的通道形成单元的数量更加不同[11],而Tic20构建了700 kDa(本研究)和1 MDa之间的非常大的复合物[20.].因此,对于与TIC20相比,需要两个TiC110分子以形成通道,这将需要更多的分子形成孔。虽然我们不能排除TIC20可能受到体内未知蛋白酶的降解,但右侧液体的蛋白酶处理,即在体外囊泡清楚地表明,即使在洗涤剂存在下,TIC20也是非常抗蛋白酶的。相比之下,Tic110已经容易地降解已经没有添加洗涤剂(附加文件1).与TIC110相比,在编写IE的编写过程中,这符合TIC20的更快降解。TiC110对豌豆和蛋白质水平的TiC110至TiC20比率的差异拟南芥可能是由于植物的不同年龄或在给定的生长条件下的不同需求,并表明两种蛋白质之间没有严格的化学计量。此外,与信封中的TIC110相比,TIC20的低丰度(另见附加文件2)清楚地表明,Tic20不能像先前所建议的那样成为Tic转运的主通道[21,24],因为它不能支持叶绿体中需要的一些高度丰富的预蛋白质的所需进口率。
Tic20与Tic110单独形成高分子量的配合物
实验数据表明,在叶绿体包膜膜中,Tic110和Tic20之间通过交联方法存在一个共同的复合物[21].然而,在没有Toc成分的情况下,相互作用是不可见的,这使得稳定的关联不太可能。此外,菊池没有发现共同的复合物的证据等[20.利用豌豆的可溶性叶绿体和拟南芥二维蓝色原生/SDS-PAGE (2D BN/SDS-PAGE)分析。同样,在RNA和蛋白质水平上,豌豆的Tic110和Tic20的差异拟南芥表明,常见的复合物,其中两个蛋白质在合理的化学计量中在易位信道中配合,是不可能的。
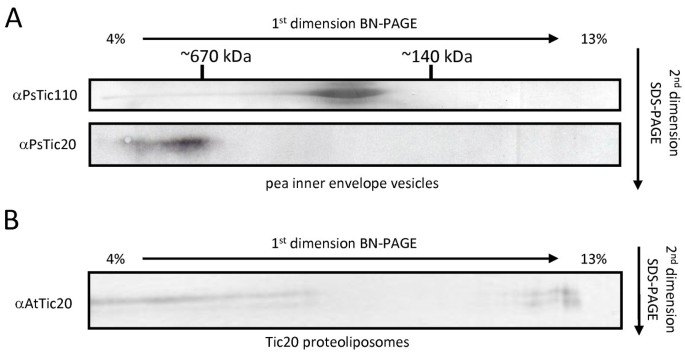
为了澄清这一问题,我们通过使用IE囊泡解决了这些部分相互矛盾的结果,这将最小化与Toc组分相互作用对复合物形成的可能影响。将Pea IE囊泡溶解在5%的洋地黄素中,并进行2D BN/SDS-PAGE。免疫印迹显示Tic20和Tic110均存在于不同的高分子量复合物中(图3):含Tic110络合物迁移在尺寸〜200-300 kDa的的,而Tic20显示在BN-PAGE慢得多的迁移率,并且存在于复合物超过700 kDa的,符合从菊池结果等[20.].然而,在类似分子量为250 kDa的BN-PAGE上不仅描述了Tic110,而且还描述了Hsp93、Tic62和Tic55 [30.].包含所有这些成分的复合物的分子量会高得多。因此,Tic配合物的组分可能会与Tic110非常动态地结合,在不同的条件下产生不同的组成,或者在相同分子量下存在不同的配合物。
到目前为止,一个悬而未决的问题是Tic20在综合体中可能的交互伙伴的身份。Tic22是唯一位于膜间空间的Tic组分,是一个潜在的候选蛋白,因为这两个蛋白在交联实验中被共同鉴定[21].然而,在增溶包膜凝胶过滤后,只有少量的Tic20和Tic22显示出共定位[21].常见复合物形成的第二个候选是PIC1/Tic21: Kikuchi等[20.[表明TIC20的一元达达尔顿复合物包含PIC1 / TIC21作为次要亚基。提出了PIC1 / TIC21以在TIC复合物中形成蛋白质易位通道,主要基于淘汰突变体的蛋白质进口缺陷以及与氨基酸转运蛋白和糖的结构相似性[27].杜伊的独立研究等[31]支持PIC1/Tic21在叶绿体IE中形成金属渗透酶的假设,这使得其导入相关的作用值得怀疑。这种差异将在未来得到解决。
测试TIC20的复杂形成在体外在没有其他蛋白参与的情况下,我们使用tic20蛋白脂质体进行2D BN/SDS-PAGE分析,类似于IE囊泡(图)3 b).蛋白质的迁移行为类似于IE:大部分蛋白质在高分子量范围内定位,然而,信号看起来更广泛,并且在较低分子量中也可以在较低的分子量下检测到一部分作为单体。该观察结果表明,TIC20在脂质双层存在下具有同型寡聚化的固有能力。由于在IE囊泡与脂质体中,Digitonin的TIC20的不同溶解越少,或者可能是额外亚基稳定在重构之后不存在的内源TIC20络合物的指示。然而,我们将这些观察结果解释为对该假设的支持,即IE中的一只梅加尔顿综合体的主要成分是由TIC20组成的同源寡聚体。
Tic20的N-和c -末端面向基质侧
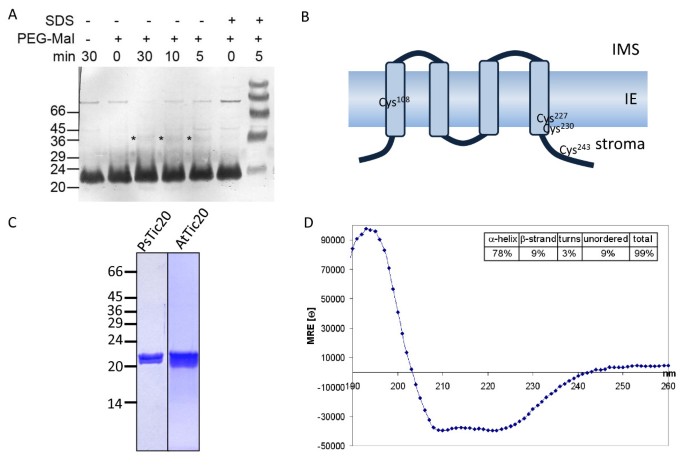
在Silico.TIC20的分析预测四种疏水性跨膜螺旋的存在定位N-和C-Termini两侧的膜(TMHMM Server [23]和[21,25])。根据这些预测,Pstic20中的三个半胱氨酸(Cys)面对相同的一侧,而第四则位于膜的平面中。我们使用豌豆,即以右侧取向编制的囊泡[32]来确定Tic20的拓扑结构。为此,IE囊泡与不透膜的胱氨酸反应剂(甲氧基聚乙二醇-马来酰亚胺,PEG-Mal)一起孵育,该剂为每个反应的胱氨酸残基向目标蛋白添加5,000 Da的分子量。在我们的实验中,PEG-Mal在应用的条件下没有强烈地标记出Tic20的任何Cys残基(图)4),表明膜外没有可接近的胱氨酸残基。只有一个微弱的更高分子量的额外带被检测到(图4标记为星号),可能是由于位于膜内的部分可触及的CYS。然而,在1%SDS的存在下,PSTIC20中存在的所有四个CYS残基迅速聚普齐缩,如在仅孵育5分钟后的四个强烈额外带的外观所证明的。每个修饰的分子量的观察到的增益大于每种Cys的预期5kDa,但这可归因于在测定中使用的BIS-TRIS / SDS-PAGE中的修饰蛋白质的异常迁移率。
Tic20的拓扑结构和二级结构(A)PEG-Mal标签Pisum一(Ps)内包膜(IE)囊泡在1% SDS存在或不存在的指示时间内,使用针对PsTic20的特异性抗体进行免疫检测。星号表示跨膜区域有一个很可能代表Tic20的弱带,带有一个标记的半胱氨酸(Cys)。给出了重复三次的典型结果。(B) Tic20的拓扑模型-指示PsTic20中Cys残基的位置-考虑(A)中的聚乙二醇化分析(基于TMHMM Server的结构预测[23]和[25])。方框代表α-螺旋跨膜结构域(TM 1-4)。IMS -膜间间隙。(C) Tic20的成熟部分Pisum一(PSTIC20,氨基酸83-253)和拟南芥蒂利亚纳(AtTic20氨基酸59-274)过表达大肠杆菌细胞裂解系统大肠杆菌BL21细胞,分别。两种蛋白均用镍纯化2+- 亲和性色谱。显示了代表性纯化的Coomassie染色的凝胶。(d)过表达和纯化的PSTIC20在20mM Na-磷酸盐缓冲液(pH8.0),150mM NAF,0.8%Brij-35中的圆形二色谱。呈现的色谱图是三个独立实验的平均值。使用来自Dichroweb服务器的CDSSTR方法量化二次结构元素,并且在插图中呈现结果。
我们的结果支持四种跨膜螺旋拓扑,其中C-和N-Termini都面临膜的基质侧面(图4 b),没有Cys残留物,朝向互相空间取向。Cys.108很可能位于螺旋一,cys227和cys.230螺旋4和Cys的基质侧243位于基质中。这种拓扑结构也与van Dooren的绿色荧光蛋白标记研究相一致等[22]表示n-和c-termini也是Toxoplasma Gondii.TiC20的同源物面向内剥氧膜的基质侧。
Tic20主要为α-螺旋结构
TIC20在十年前鉴定但是由于因此,没有报道异源表达和纯化程序,这可以成功地合成折叠的全长TIC20。在这里,我们报告了两个效率大肠杆菌(大肠杆菌)从豌豆和大豆中表达和纯化Tic20的基于DNA的系统拟南芥:密码子优化PsTic20(附加文件3.)在有洗涤剂存在的S12细胞裂解液中过表达,而AtTic20通过适应一种特殊的诱导系统成功地实现过表达[33].遵循这些步骤,豌豆和拟南芥蛋白可以通过金属亲和纯化得到同质性(图)4摄氏度).
使用纯化的蛋白质,我们通过使TIC20进行TIC20对圆形二色性(CD)光谱进行的结构表征研究(图4 d).PsTic20记录的光谱在210和222 nm处有两个极小值,在193 nm处有一个大的正椭圆度峰,这是α-螺旋蛋白的高度特征,因此证明了在洗涤剂存在下纯化后蛋白质以折叠态存在。通过将光谱拟合到参考数据集(DichroWeb服务器[34,35])导致α-螺旋含量约为78%,确认在Silico.预言[21,25].
纯化的TIC20蛋白牢固地插入脂质体中
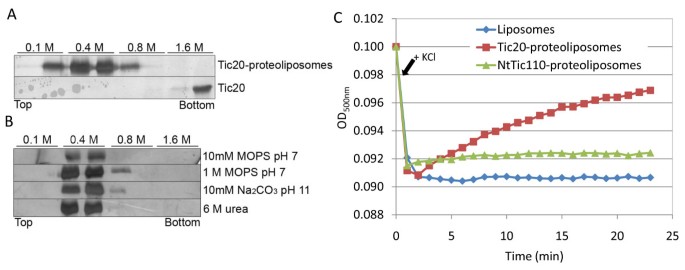
为了更好地在模拟膜环境中表征Tic20,我们将异质性表达和纯化的AtTic20重组成脂质体在体外.最初,进行了浮选试验,以验证稳定的插入。在脂质体存在或不存在时,将Tic20置于从1.6 M(下)到0.1 M(上)的蔗糖梯度的底部。在脂质体存在的情况下,Tic20迁移到梯度的中间,表明其密度发生了变化,这是由于脂质体相互作用引起的。相比之下,蛋白质单独留在梯度的底部(图)5).在浮选之前(在4℃下持续30分钟),还用各种缓冲液处理蛋白质胶质体,以测试蛋白质是否牢固地插入脂质体膜中,或者只是松散地与囊泡表面结合。没有施用条件(控制:10 mm MOP / TRIS,pH 7;高离子强度:1米MOP / TRIS,pH 7;高pH:10 mm NA2CO.3.,ph 11;变性:10 mm MOPS / TRIS的6米尿素,pH7)改变了TIC20在梯度中的迁移行为(图5 b),表明Tic20已深深插入脂质体膜。因此,蛋白脂质体代表了一种合适的在体外系统用于分析Tic20通道活动。
脂质体中Tic20的插入和通道的形成(A)Tic20蛋白脂质体和不含囊泡的Tic20在蔗糖梯度中的浮选实验。将含有1.6 M蔗糖的样品装载在蔗糖梯度的底部,并离心至平衡(100000 g,19 h,4°C)。通过银染色分析各组分。(B)Tic20蛋白脂质体的浮选实验(类似于(A))在离心前在指定的缓冲条件下在4°C下培养30分钟。(C)脂质体、Tic20蛋白脂质体和含有20 mM Tris-HCl(pH 8.0)、100 mM NaCl的NtTic110蛋白脂质体的溶胀试验。在500 nm(OD)下测量光密度的变化500海里),每分钟用1ml溶液。箭头表示添加300mm KCl展示的结果是至少5次重复的平均值;标准偏差在1.5-3%以内。
Tic20在脂质体中形成一个通道
尽管TIC20已经建议在IE膜中形成沟道,但这种观点仅基于对其他四跨膜螺旋蛋白的结构类比[21,24,目前还没有实验证据。为了研究Tic20是否真的能形成离子通道,我们对Tic20-蛋白脂质体进行了肿胀试验(图)5度).在高盐浓度存在下脂质体大小的变化,如光密度的变化所揭示的,可用于检测成孔蛋白的存在[36].在脂质体和tic20 -蛋白脂质体中加入300 mM KCl后,由于盐浓度增加导致收缩,其光密度开始下降[37].然而,蛋白质无脂质体的光学密度保持在该低水平,尺寸没有变化;然而,在TiC20-蛋白质体的情况下,光密度随着时间的推移而不断增加。光密度(和因此尺寸)的增加强烈地支持在透过离子的TiC20-蛋白质体中的沟道的存在,从而在蛋白质单体和周围缓冲液的内隔室之间产生平衡。
为了排除(i)污染的沟道形成蛋白质衍生自细菌膜的可能效果和(ii)插入脂质体(但未形成通道)的蛋白质,设置了另一个阴性对照:Tic110仅包含第一将三个跨膜螺旋(NTTIC110)类似于TiC20纯化并重构成脂质体。我们选择了这种结构,因为NTTIC110在膜中插入膜在体外蛋白质进口实验[10].此外,全长和n端截断的Tic110具有非常相似的通道活动[11,12,则n端不太可能单独形成一个通道。在不同的缓冲液条件下(高盐浓度、高pH和6 M尿素)孵育,然后进行浮选实验,确认NtTic110插入脂质体,与Tic20类似(数据未显示)。然而,在肿胀试验中,这些nttic110 -蛋白脂质体的行为与空脂质体相似:加入盐后,光密度降低,除了最初有一个小的增加,它保持在一个恒定的水平(图)5度).这使得污染不太可能来自大肠杆菌或者简单地将蛋白质的插入脂质体导致观察到的TIC20-蛋白质体的光学密度。
为了进一步表征Tic20的通道活性,我们进行了电生理学测量。在tic20 -蛋白脂质体与脂质双分子层融合后,观察到离子通道活性(图)6 a、B).对称缓冲条件(10 mM MOPS/Tris (pH 7.0), 250 mM KCl)下的总电导随施加电位的方向而变化:负电压和正电压下的总电导分别为1260 pS(±70 pS)和1010 pS(±50 pS)。通道大部分处于完全开放状态,然而,单个的门控事件也经常被观察到,变化范围从25 pS到600 pS(图)6模拟).所有检测到的门控事件都在两个直方图中描绘(图6C,D对于负电压,分别为负电压)。两个电导等级(I和II)分别以220 ps和180 ps的阈值分别定义为负极和正电压值(图6 a e).注意,属于较小的电导类(I)的门控事件发生得更频繁。观察到的孔隙似乎是不对称的,因为在正电压和负电压下,更高的电导等级明显不同。这可能是由于渗透离子与通道的相互作用,可能沿孔隙呈现不对称的电位分布。由于在所有的实验中都同时观察到小的和大的开口事件,所以它们不太可能属于两个不同的孔隙。
Tic20的电生理特性.(A)和(B)分别在-100 mV和+100 mV时脂质双分子层中Tic20通道的电流迹线。虚线表示每个电导等级的阈值(I和II)。下面的面板显示属于每个等级的代表性门控事件。(C)和(D)分别为负、正电压下Tic20所有门控事件的电导直方图。颜色代表不同的电导等级(I和II)。(E)用(C)和(D)中相同的颜色代码绘制四种指示电导等级中所有分析门控事件的电流-电压关系图。指示电导值对应于每一类拟合线性的斜率。(F)具有代表性的Tic20的电压斜坡,显示了具有正反向电位的通道的阳离子选择性(E修订版).在对称(a) - (e)和不对称(f)缓冲条件下进行测量(20mM MOPS / TRIS(pH7.0),250mM和20/250mm KCl)。呈现的数据从两个独立的融合占超过4500个Gating事件和16个电压斜坡。
在不对称盐条件下(10 mM MOPS/Tris(pH 7.0),250/20 mM KCl)研究了Tic20的选择性。与电导值类似,通道本质上是整流的(在正负电压值下表现不同),支持不对称通道特性。获得的反向电势为37.0±1.4 mV(图6 d).根据高盛-霍奇金-卡茨方法,这对应于K的选择性为6.5:1+: Cl--离子,显示出类似于Tic110的阳离子选择性[11].
为了确定双分子层内通道的方向,我们考虑了两个侧面特性:在负电压下测量对称缓冲条件下的最高总电导,在非对称缓冲条件下的相同方向整流(见电压斜坡,图)6 d)因此,似乎蛋白质是随机插入双层的。
根据Hille粗略估计孔隙大小等[38].考虑到孔内电解质溶液的电导率比本体溶液低约5倍,最高电导率等级为350 pS,通道长度为1- 5nm,电阻率为247.5 Ω cm [39[估计孔径估计为7.8-14.1Å。这与诸如TOC75(14-26Å,[40])在外层包膜膜和Tic110(15-31Å[12])在IE。因此,TiC20孔的尺寸足以通过膜转移前体蛋白质。
作为阴性对照,NtTic110在电生理测量中没有显示任何通道活动,这表明所测量的通道不是可能的细菌污染的结果(数据未显示)。
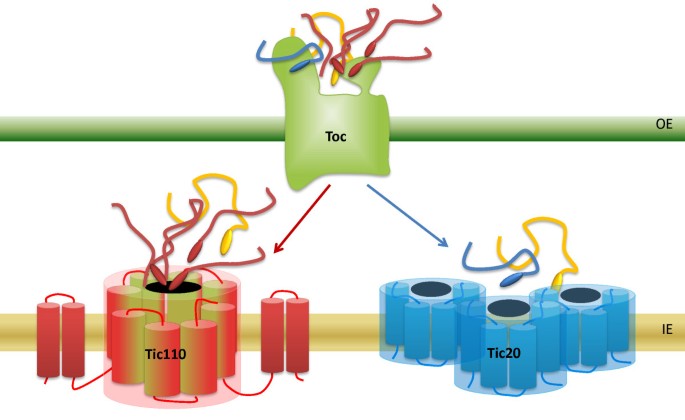
考虑到我们在这里提供的数据和之前发表的研究,我们可以得出结论,Tic易位子由不同的(至少两个)易位通道组成:一方面,Tic110形成主要的易位孔,因此有利于大多数叶绿体靶向前蛋白的输入;另一方面,Tic20可能促进蛋白质亚群的易位。这种情况将与在线粒体内膜中发现的情况相匹配,在线粒体内膜中,特定的前体蛋白组存在特定的转位酶:线粒体载体蛋白的进口途径与基质靶向前蛋白的进口途径明确分离[41].叶绿体中的情况似乎并不像透明切割,但是通过最终目的地和/或易位蛋白质的内在性质确定的类似分离是可行的。
的严重表型attic20-I.突变体提示我们假设某些必要蛋白的易位可能具体所需的TIC20。根据交联效果[21], Tic20连接到Toc转位元件。因此,部分前蛋白通过Toc复合物进入膜间隙后,可能通过Tic20转运至IE。相反,菊池等[20.] TIC20在与Rubisco(PSSU)的小亚基的进口前体相同的分子量上迁移到BN-Page上迁移Tic20-I.突变体显示人工前体蛋白RBCS-NT:GFP的降低速率。作者以TIC20在TICOROCON与TIC110的信道之间的中间步骤中起作用的方式解释了这些结果。然而,由于TIC20的丰富度极低,这是一般进口途径的大部分似乎不太可能。推测这种丰富的蛋白质作为PSSU的速率非常高的速率是可行的,这可能与附近的蛋白质偶然或漠不关心地使用所有可用的进口渠道。为了澄清这个问题,TIC20的底物蛋白和互动伙伴应该是进一步调查的问题。
此外,最近的一项研究[26]建议将AtTic20-IV作为与AtTic20-I一起工作的导入通道。然而,蛋白质的详细特性(如定位、拓扑)和通道活性的实验证据仍然缺失。
结论
在这项研究中,我们可以清楚地证明Tic20和Tic110根据其不同的化学计量比以及它们在IE囊泡中独立的复合物形成而相互独立地发挥作用。此外,我们提出了Tic20通道功能的第一个实验证据。与Tic110相比,Tic20的丰度非常低,这表明Tic20不支持Tic20形成一个主要的蛋白质易位通道,该通道将导入叶绿体中所需的大量前蛋白。因此,我们的数据支持这样的观点:Tic易位子至少包含两个易位通道:Tic110,构成主要的导入通道[11和Tic20,后者可能输入一个特殊的前蛋白子集(两个Tic易位通道的假设模型如图所示7).线粒体的内膜中也存在一个类似的系统,其中TIM22和TIM23复合物介导了不同组蛋白质的输入[41].不幸的是,由于致命的tic110以及非常严重的表型Tic20-I.纯合敲除突变体,其单独的作用方式将很难研究在活的有机体内.
方法
植物生长条件
豌豆(Pisum一var。Arvica)在20℃/ 15℃下在14-H光/ 10-H暗状态下生长。拟南芥蒂利亚纳植物(生态型哥伦比亚)生长在土壤上或在奔驰描述的条件下等[42]后者在非无菌条件下培养,如[43].简而言之,在将其第一个真叶的扩展扩展后,将幼苗从平板(含有0.5×MS用1%蔗糖)转移到Ga-7品红色的容器(Sigma-Aldrich)上的一厘米厚的切割海绵上。营养溶液含有1毫米KH2阿宝4,0.5 mm mgso4, 0.25 mM CaSO4, 20 μM Fe-EDTA, 25 μM H3.博3.,2μmznso4, 2 μM MnSO4, 0.5 μM CuSO4, 0.5 μm (nh .4)6莫7O.24和0.5 mM NH4没有3.在含或不含1%蔗糖的情况下。生长室在21°C/16°C光照16 h /黑暗8 h条件下保存4周。植物要么在黑暗中收获,要么在中午前从生长光中收获。材料通常使用即时和新鲜。如果不可能,则将叶片材料在液氮中冲击冷冻,并在-80°C下保存直到使用。
中存在
RNA分离、cDNA制备、qRT PCR和数据分析基本上按照中所述进行[44].构建基因特异性引物PSTIC20.[基因库:AF095285.1],PsTic110[基因库:Z68506.1],,AtTic20-I[TAIR: At1g04940.1],阁楼20-IV.[TAIR: At4g03320.1]AtTic110[TAIR:At1g06950.1](表1).所有反应进行四次。
隔离信封囊泡
如前所述,从10至12日龄豌豆植株完整的叶绿体中分离出富含豌豆叶绿体膜右边外IE泡的膜组分[32].为拟南芥如Seigneurin-Berny所述,首先从黑暗中从4周龄土壤生长的植物中分离出包膜制备,如Seigneurin-Berny所述等[45].叶绿体随后重悬于15ml 10 mM HEPES-KOH, pH 7.6, 5 mM MgCl中2并且在小(15毫升)拨射组织研磨机(Wheaton科学产品,Millville,NJ,USA)中使用50冲程裂解。进一步分离成基质,基质和包络根据李进行等[46].
蛋白质表达和纯化
从Tic20成熟部分的序列编码Pisum一(PsTic20,氨基酸83-253)用Entelechon (Regensburg, Germany)的Leto 1.0程序优化密码子(附加文件3.).优化后的基因由Entelechon合成,最终克隆到pIVEX2.3 (Roche, Germany)。成熟的部分拟南芥蒂利亚纳TiC20-I(Attic20,氨基酸59-274)被克隆到PColdii(Takara-Bio,Kyoto,日本)。Tic110的成熟部分Pisum一无n端疏水结构域(PsTic110,氨基酸122-996)和来自同源部分的类似结构拟南芥蒂利亚纳TiC110(attic110,氨基酸141-1016)克隆到PET21D中[11].用相同的表达载体克隆了成熟的Tic110 (NtTic110,氨基酸76-258)的n端拟南芥蒂利亚纳.
密码子优化的PSTIC20在自制中过表达大肠杆菌无细胞裂解液系统(S12),其制备基本如Kim所述等[47].很快,可溶性Pstic20的表达在30℃下进行1-2小时,在100-200μL反应混合物中恒定轧制(57mM Hepes-KOH(pH8.2),1.2mm ATP,0.65mm阵营,每个0.85mmCTP,GTP和UTP,2 mm DTT,90毫米谷氨酸,80mM乙酸铵,15mM乙酸镁,34μg/ mlL.-5-甲酰基-5,6,7,8-四氢叶酸,每0.75 mM 20个氨基酸,2%聚乙二醇8000,100 mM磷酸肌酸,0.27 mg/ml肌酸激酶,0.17 mg/ml大肠杆菌总tRNA混合物(来自菌株MRE600), 10 μg/ml质粒DNA, 25% BL21 (DE3)和2% BL21 (DE3) RIL-pAR1219细胞提取物,0.8% Brij-35)。去除不溶物(10,000 g, 4℃,10 min)后,用50 mM NaH稀释上清液1:32阿宝4-NAOH(pH8.0),300mM NaCl,0.8%Brij-35,20mM咪唑并使用Ni-NTA-Sepharose(GE Healthcare,德国GE Healthcare)纯化。
为了表达和纯化AtTic20/pCOLDII,转化的BL21 (DE3)细胞(Novagen/Merck)在M9ZB培养基中37℃培养至OD6001 mM异丙基-1-硫代-β- d -半乳糖苷诱导后,在15°C下进一步培养过夜。收集的细胞在50 mM Tris-HCl (pH 8.0), 150 mM NaCl, 5 mM二硫苏糖醇(DTT)中重悬,裂解(M-110L Microfluidizer Processor, Microfluidics, Newton, MA, USA),成球(20,000 g, 4°C, 20分钟),在1%的存在下溶解N.-Lauroylsarcosine(N-LS)在4℃下为1小时。使用Ni-NTA-Sepharose(GE Healthcare,Munich,德国)在0.3%N-LS存在下进行纯化。PSTIC110 / PET21D过表达并如前所述纯化[11].与PsTic110相似,AtTic110/pET21d过表达和纯化。NtTic110的过表达与PsTic110相似,而其纯化与AtTic20相似,只是在所有缓冲液中存在300 mM NaCl。
免疫印迹
免疫印迹使用来自兔子的多克隆抗血清对抗异质性过表达蛋白,然后与兔子的单克隆二抗孵育,通过碱性磷酸酶或化学发光检测系统(Pierce, Rockford, IL, USA)观察。以多组氨酸为基质,纯化了抗atTic110和psTic20的血清。为此,根据制造商的建议,将聚l -组氨酸偶联到cnbr活化的琼脂糖(GE Healthcare)上。抗血清稀释3倍,4℃Poly-His基质孵育过夜。在免疫印迹中,琼脂糖珠沉淀,上清作为纯化血清(见附加文件)4).
半定量蛋白质分析
对于半定量蛋白质分析,纯化的Pstic20,Pstic110,attic20和attic110的稀释系列与稀释系列的豌豆平行于SDS-PAP上加载到SDS-PAP上。拟南芥混合膜的信封。用特异性抗体进行免疫检测后,对产生的条带强度进行量化(AIDA软件)。首先根据已知的蛋白量绘制出纯化蛋白的条带强度。用此校准曲线测定膜样品中Tic20和Tic110的含量。不同包膜制剂的分析重复两次。
二维BN / SDS-PAGE
BN-PAGE基本上如Schaegger和Von Jagow所描述的[48]还有库奇勒等[30.]在冰上(IE)或室温下(脂质体)孵育后,将IE膜(50-200μg蛋白质)或Tic20蛋白脂质体(30μg蛋白质)溶解在50 mM双Tris/HCl(pH 7.0)、750 mM 6-氨基己酸和5%洋地黄苷中在4°C下以256000 g离心样品15分钟,10分钟。向上清液中添加0.1体积的考马斯蓝g溶液(5%考马斯亮蓝g-250、750 mM 6-氨基己酸)在第一维之后,lanes依次在1%SDS、1 mMβ-巯基乙醇(β-ME)、1%不含β-ME的SDS和SDS-PAGE运行缓冲液(25 mM Tris、192 mM甘氨酸和0.1%SDS)中培养在室温下各15分钟,然后水平进行二维SDS-PAGE。分离后,进行免疫检测。
镉光谱
纯化的PsTic20对20mm Na进行透析2HPO4/不2阿宝4缓冲液(pH值8.0),150 mM NaF,0.8%Brij-35,然后进行CD分析。使用J-810分光光度计(Jasco,Groβ-Umstadt,德国)在20°C下进行实验,并用N2。使用1 mm路径长度的圆柱形石英细胞,从260至190 nm处收集光谱。每个光谱是以20 nm/min的扫描速率和1 nm的光谱带宽进行的三次扫描的平均值。在0.02至0.284 mg/ml蛋白质浓度范围内重复实验三次。对于最终表示,巴塞尔从光谱中减去ine。使用DichroWeb服务器上的CDSSTR方法进行分析[34,35].
PEGylation化验
IE囊泡在含有100 mM Tris-HCl (pH 7.0)、1 mM EDTA的缓冲液中,用10 mM甲氧基聚乙二醇-马来酰亚胺5000 Da (PEG-Mal, Laysan Bio, Arab, AL, USA)处理,在室温、无或有1% SDS的黑暗中处理指定的时间。加入100 mM DTT和SDS-PAGE样品缓冲液,终止聚乙二醇化反应。NuPAGE双- tris凝胶(10%丙烯酰胺)使用MES运行缓冲液。免疫印迹法检测Tic20。
脂质体制备和浮选测定
如前所述制备了AtTic20和NtTic110蛋白脂质体[11].为了制备Unilamellar脂质体囊泡,通过200nM聚碳酸酯过滤器(Liposofast,Avestin,渥太华,加拿大)挤出样品21次。将纯化的attic20(在20mM Tris-HCl pH 8.0,150mM NaCl,0.3%N-LS)(或NTTIC110或作为对照中)与脂质体混合并在4℃下温育1.5小时。将样品在4℃下透析16小时,对没有洗涤剂的缓冲液(20mM Tris-HCl pH8.0,100mM NaCl),并在4℃温育期间用生物珠SM-2孵育剩余的洗涤剂(Bio-Rad Laboratories,Hercules,USA)。通过浮选通过蔗糖梯度分离脂质体相关和无脂质体的蛋白质,类似于双甘露拉等[11]:将样品调整至蔗糖浓度1.6 M(底部为1 ml),并覆盖3 ml阶梯蔗糖梯度(顶部为0.8、0.4和0.1 M)。离心后(10万g, 19 h, 4℃)收集0.5 ml馏分,用三氯乙酸(TCA)沉淀。样品用laemmli缓冲液重悬,SDS-PAGE分离,银染检测。
溶胀试验
新鲜制备的脂质体和蛋白脂质体(AtTic20和NtTic110)稀释至1 ml,在500 nm处初始光密度约为0.1。用岛津紫外- 2401pc分光光度计(哥伦比亚,美国)测量样品的光密度。在测量开始时,向样品中加入300毫米氯化钾。实验至少重复了五次。
电生理测量
根据供应商指示,使用离子双层探险家(Osnabrück,德国)进行电生理测量。通过在由双层分开的两个腔室之间施加250/20mm Kcl的渗透梯度,与双层融合蛋白质胶质体(将样品加入到)之间顺式房间)。在对称缓冲条件下(10mM MOPS / TRIS(pH7.0),250mm,250mm KCl),在从-140mV到+140mV施加每个电压值5分钟的步进梯度下以15种不同的电压值测量电导率。在不对称缓冲条件下进行选择性(10mm MOPS / TRIS(pH 7.0),250 / 20mm KCl),电压值在-100mV到+100 mV的线性梯度中改变反之亦然,每次融合8次。
对于分析,使用滑动仪10.2(轴突仪器,Union City,USA),Ephys 5.0(由奥斯纳布鲁克大学制造的Osnabrück)结合起源7.0(orignlab公司,北安普敦,马,美国)和Microsoft Excel 2007软件。呈现的数据来自两个独立的融合事件。
参考
- 1.
Gould SB, Waller RF, McFadden GI:质体进化。植物学报,2008,59:491-517。10.1146 / annurev.arplant.59.032607.092915。
- 2.
从细胞器到细胞核的基因转移:多少,发生了什么,为什么?植物生理学报。1998,19(4):417 - 422。10.1104 / pp.118.1.9。
- 3.
Balsera M,Soll J,Bölterb:indosymbiotic细胞器中的蛋白质进口机械。细胞mol寿命。2009,66:1903-1923。10.1007 / s00018-009-8644-2。
- 4.
Inaba T,Schnell DJ:贩运塑料的蛋白质:一个主题,许多变化。Biochem J. 2008,413:15-28。10.1042 / BJ20080490。
- 5.
Kovács-Bogdán E, Soll J, Bölter B:蛋白质进入叶绿体:Tic复合物及其调控。中国生物化学学报,2010,27(3):489 - 494。10.1016 / j.bbamcr.2010.01.015。
- 6.
李·米,Chiu CC:蛋白质输送到叶绿体中。Annu Rev植物Biol。2010,61:157-180。10.1146 / Annurev-Arplant-042809-112222。
- 7.
acta optica sinica, 2010, 31 (4): 559 - 564 . acta optica sinica, 2010, 31 (4): 559 - 564 . acta optica sinica, 2010, 31 (4): 559 - 564 . acta optica sinica, 2010, 31(4): 559 - 564。2生化鉴定。中国生物化学杂志。
- 8。
Lübeck J, Soll J, Akita M, Nielsen E, Keegstra K: IEP110的拓扑结构。中国海洋大学学报(自然科学版),1996,15:423 -4238。
- 9。
Schnell DJ,Kessler F,Blobel G:分离叶绿体蛋白质进口机械的组分。科学。1994年,266:1007-1012。10.1126 / Science7973649。
- 10.
吕贝克J,海因斯L,索尔J:一种核编码的叶绿体内膜蛋白在导入细胞器时使用可溶性分选中间体。细胞生物学杂志,1997,137:1279-1286.10.1083/jcb.137.6.1279。
- 11.
Balsera M,Goetze Ta,Kovács-bogdáne,schürmannp,瓦格纳r,buchanan bb,soll j,bölterb:tic110的表征,在叶绿体内包络膜的沟道形成蛋白,推出对Ca的反应(2+)和基质调节二硫桥。J Biol Chem。2009,284:2603-2616。
- 12.
海因斯L,梅勒A,亨姆勒R,瓦格纳R,库奇勒M,赫尔曼F,斯维什尼科夫D,索尔J:质体内包膜上的预蛋白传导通道。EMBO J.2002,21:2616-2625.10.1093/emboj/21.11.2616。
- 13.
Inaba T,Li M,Alvarez Huerta M,Kessler F,Schnell DJ:atTic110作为协调蛋白质导入叶绿体的基质事件的支架。生物化学杂志,2003,278:38617-38627。10.1074/jbc.M306367200。
- 14.
Inaba T,Alvarez-Huerta M,Li M,Bauer J,EWERS C,Kessler F,Schnell DJ:Arabidopsis TiC110对于塑体蛋白质进口机械的组装和功能至关重要。植物细胞。2005,17:1482-1496。10.1105 / TPC.105.030700。
- 15.
Jackson DT, Froehlich JE, Keegstra K: Tic110的亲水结构域,是叶绿体蛋白易位器的内层包膜组件,面向基质室。中国生物医学工程学报。1998,27(6):593 - 598。10.1074 / jbc.273.26.16583。
- 16.
蛋白质导入与叶绿体折叠机制的相互作用。美国国家科学院学报。1996年,93:7684 - 7689。10.1073 / pnas.93.15.7684。
- 17.
苏pH,李HM:基质HSP70对于蛋白质易位成豌豆和拟南芥叶绿体是重要的。植物细胞。2010年,22:1516-1531。10.1105 / TPC.109.071415。
- 18.
Dávila-Aponte JA, Inoue K, Keegstra K:两种叶绿体蛋白易位成分Tic110和Toc75在多种植物的不同质体类型中被保守。植物营养与肥料学报,2003,21(4):457 - 461。10.1023 /: 1021190319786。
- 19。
Chen X, Smith MD, Fitzpatrick L, Schnell DJ: atTic20在蛋白质导入叶绿体中的作用的体内分析。acta botanica sinica(云南植物研究),2002,14(4):441 - 454。10.1105 / tpc.010336。
- 20.
1 megadalton transalton complex containing Tic20 and Tic21介导了叶绿体蛋白在细胞膜上的导入。acta botanica sinica(云南植物研究),2009,31(4):531 - 534。10.1105 / tpc.108.063552。
- 21.
Kouranov A、Chen X、Fuks B、Schnell DJ:Tic20和Tic22是叶绿体内膜蛋白质导入装置的新组成部分。J细胞生物学。1998, 143: 991-1002. 10.1083/jcb.143.4.991。
- 22.
van Dooren GG, Tomova C, Agrawal S, Humbel BM, Striepen B:刚地弓形虫Tic20在apicoplast蛋白进口中起重要作用。美国国家科学院学报。2008年,105:13574 - 13579。10.1073 / pnas.0803862105。
- 23.
TMHMM服务器。[http://www.cbs.dtu.dk/services/tmmm/]
- 24.
Reumann S,Keegstra K:叶片包膜膜的蛋白质进口机械的内骨生物起源。趋势植物SCI。1999年,4:302-307。10.1016 / s1360-1385(99)01449-1。
- 25.
叶绿体中蛋白质的输入:氧化还原的调节作用。植物研究进展。2009,52:277-332。
- 26.
Hirabayashi Y, Kikuchi S, Oishi M, Nakai M:两种密切相关的拟南芥Tic20蛋白AtTic20-I和AtTic20-IV作用的体内研究。植物营养与肥料学报。2011,32(4):469-478。10.1093 /卡式肺囊虫肺炎/ pcr010。
- 27.
Teng YS, Su YS, Chen LJ, Lee YJ, huang I, Li HM: Tic21是叶绿体内层膜蛋白质转运的重要易位元件。acta botanica sinica, 2017, 36(4): 457 - 461。10.1105 / tpc.106.044305。
- 28.
Aramemnon:植物膜蛋白数据库。[http://aramemnon.botanik.uni-koeln.de/]
- 29.
Reumann S,Inoue K,Keegstra K:塑性蛋白质进口途径的演变(审查)。Mol Membr Biol。2005,22:73-86。10.1080 / 09687860500041916。
- 30.
KüchlerM,Decker S,Hörmannf,令人姐妹L:蛋白质进口到叶绿体中涉及氧化还原蛋白。禁止J.2002,21:6136-6145。10.1093 / EMBOJ / CDF621。
- 31。
黄志强,王志强,王志强:PIC1是拟南芥叶绿体中一种古老的渗透酶,介导铁的转运。植物学报。2007,19:986-1006。10.1105 / tpc.106.047407。
- 32.
黄志强,王志强,王志强:叶绿体蛋白进口机制的研究进展。中国生物医学工程学报。1995,50:255-267。
- 33.
清G,MA LC,Khorchid A,Swapna GV,Mal TK,Takayama MM,夏B,Phadtare S,Ke H,Acton T等人:冷冲击诱导大肠杆菌的高产蛋白质产生。NAT BIOTECHNOL。2004,22:877-882。10.1038 / NBT984。
- 34.
Whitmore L,Wallace Ba:DichroweB,一种用于蛋白二分结构的在线服务器,从圆形二中间结构分析。核酸RES。2004,32:W668-W673。10.1093 / nar / gkh371。
- 35.
王志强,王志强:基于圆二色谱的蛋白质二级结构分析:方法和参考数据库。生物高分子学报。2008,32(4):489 - 494。10.1002 / bip.20853。
- 36.
Ertel F, Mirus O, Bredemeier R, Moslavac S, Becker T, Schleiff E: Pisum sativum和Nostoc PCC7120中进化相关的β -barrel多肽转运体包含两个不同的功能域。中国生物医学工程杂志。2005,28(4):431 - 434。10.1074 / jbc.M503035200。
- 37.
Pencer J, White GF, Hallett FR:动态光散射法测量渗透诱导大单瓣囊泡的形状变化。acta physologica sinica(生物学报),32(4):457 - 461。10.1016 / s0006 - 3495(01) 75914 - 0。
- 38.
Sunderland, Massachusetts:Sinauer Associates Inc.;1992.
- 39.
智能操作系统,Breed J, Smith GR, Sansom MS:一种基于结构的离子通道电导特性预测新方法。中国生物物理学报,2003,23(4):591 - 598。10.1016 / s0006 - 3495(97) 78760 - 5。
- 40.
Hinnah Sc,Wagner R,Sveshnikova N,Harrer R,Soll J:叶绿体蛋白质进口通道TOC75:孔隙性质和与过境肽的相互作用。Biophys J.2002,83:899-911。10.1016 / s0006-3495(02)75216-8。
- 41.
Mokranjac D, Neupert W:线粒体TIM23复合体的许多面。Acta photonica sinica, 2010, 37(4): 593 - 598。10.1016 / j.bbabio.2010.01.026。
- 42。
Benz JP,Stengel A,Lintala M,Lee Yh,Weber A,Philippar K,GügelIL,Kaieda S,Ikegami T,Mulo P等人:Arabidopsis TiC62和Ferridoxin-NADP(H)氧化还原酶形式的光调复合物综合成叶绿体氧化还原泊。植物细胞。2009,21:3965-3983。10.1105 / TPC.109.069815。
- 43。
拟南芥NRT1和NRT2基因家族的调控:对硝酸盐供应的响应。植物营养与肥料学报。2003,27(4):489 - 498。10.1093 /卡式肺囊虫肺炎/ pcg036。
- 44.
Benz M,Bals T,Gugel IL,Piotrowski M,Kuhn A,Schunemann D,Soll J,Ankele E:Alb4促进了非叶绿素结合光合作合酶的组装和稳定,CF1CF0-ATP合酶。莫尔植物。2009,2:1410-1424。10.1093 / mp / ssp095。
- 45.
Seigneurin Berny D,Salvi D,Dorne AJ,Joyard J,Rolland N:Percoll从拟南芥叶片中纯化和光合作用活性叶绿体。植物生理生化。2008,46:951-955.10.1016/J.plaphy.2008.06.009。
- 46.
Li HM,Moore T,Keegstra K:蛋白质靶向外壳膜,使用不同的途径而不是运输到叶绿体中。植物细胞。1991年,3:709-717。
- 47.
Kim TW,Keum JW,Oh IS,Choi CY,Park CG,Kim DM:构建强健且经济高效的无细胞蛋白质合成系统的简单程序。生物技术杂志,2006,126:554-561.10.1016/J.jbiotec.2006.05.014。
- 48.
Schaegger H,Von Jagow G:蓝色天然电泳,用于分离酶活性形式的膜蛋白复合物。肛门生物化学。1991年,199:223-231。10.1016 / 0003-2697(91)90094-a。
确认
我们感谢Eike Petersen为优秀的技术援助和Carsten Studte,Anke Harsman和Tom-AlexanderGötze有助于电生理测量和评估。我们还感谢Christoph Schwartz博士和HüseyinBess博士的膜生物化学部门,AG博士博士博士,在MPI的生物化学(Martinsrid)的MPI,有助于提供无细胞的建造大肠杆菌蛋白质表达系统。这项工作得到了德国福松格梅因夏夫大学(SFB594)、拜耳伊斯霍奇斯丘尔岑特鲁姆医学院(Bayerisches Hochschullzentrum für Mittel-、奥斯特和苏多斯泰鲁帕大学(EKB)和国际马克斯普朗克生命科学研究院(EKB)的支持。JPB感谢拜仁大学的支持。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
JPB开发了TIC20的表达和纯化方法,进行了QRT-PCR和半定量免疫印迹分析,进行了二维BN / SDS-PAGE,以及通过聚乙二醇化和CD光谱进行TIC20的拓扑表征。EKB进行了所有蛋白质体测定,包括TIC20的电生理学并起草稿件。JS构思了该研究并参与了其设计和协调。BB参与了该研究的设计和协调。所有作者阅读并认可的终稿。
ErikaKovács-bogdán,J Philipp Benz贡献了这项工作。
电子补充材料
12870_2011_919_moesm1_esm.jpeg.
附加文件1:内层囊泡的热分解素处理。用蛋白酶热溶素(1 μg/10 μg内膜)处理右侧IE囊泡。1% Tx100表示治疗期间存在1% Triton X100。用EDTA终止蛋白水解,用抗Tic110、Tic62和Tic20的抗体进行免疫检测。(JPEG 84 KB)
Coomassie染色的内部外壳囊泡
附加文件2:。20μgPisum一将外囊泡和内囊泡分别装入12.5% SDS-PAGE凝胶上,考马斯蓝染色。Tic110和Toc75用星号表示。Tic20应该位于的区域用括号标出。(JPEG 76 KB)
PSTIC20与其密码子优化形式的序列对准
附加文件3:。与成熟株的cDNA序列进行序列比对Tic20.从…起Pisum一(PsmTic20,氨基酸83-253)和密码子优化的形式(PsmTic20-opt)从恩特莱康(德国雷根斯堡)获得。相同的核苷酸用黑匣子遮盖。(DOC 296KB)
对his标签的抗体测试
附加文件4:。(a)所示的HIS-FNRL1和10μg的量Pisum一内层囊泡被载入sds - page并在硝酸纤维素上印迹。免疫检测结果显示,抗pstic20、抗pstic110和抗attic110对his部分无特异性检测。(B)抗pstic20和抗attic110对cnbr偶联的Poly-His进行纯化,并再次进行反应性测试。(C)将纯化的n端his标记蛋白A和B以及10 μg和15 μg AtEnv装载到sds - page上,并在硝化纤维素上印迹。用抗AtTic20血清进行免疫检测。内源性AtTic20蛋白用箭头表示。(JPEG 443 KB)
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0.),允许在任何媒介中不受限制地使用、分发和复制,前提是原作被正确引用。
关于这篇文章
引用这篇文章
Kovács-bogdán,E.,Benz,J.P.,Soll,J.等TIC20形成与叶绿体中TIC110无关的通道。BMC植物杂志11,133(2011)。https://doi.org/10.1186/1471-2229-11-133
收到了:
接受:
发表:
关键词
- 包膜膜
- 高分子量配合物
- 基质的一面
- 阳离子选择性通道
- 易位通道