- 研究文章
- 开放获取
- 发表:
遮荫诱导和naa诱导苹果脱落的转录组学研究(马吕斯有明显)揭示了一个共同的途径,包括光合作用减少、碳水化合物运输的改变以及信号和激素的相互作用
BMC植物生物学体积11,文章号:138(2011)
摘要
背景
萘乙酸(NAA)是一种人工合成的生长素类似物,在苹果园中被广泛用作有效的稀释剂。在果实坐果后不久施用,一些果实会脱落,从而改善果实的大小和质量。然而,NAA疏疏结果不一致且难以预测,有时会导致果实掉落过多或疏疏不足,这对种植者来说是昂贵的。这种不可预测性反映了我们对NAA促进果实脱落作用方式的不完全了解。
结果
在这里,我们通过对处理后1、3和5 d的果实脱落区(FAZ)进行基因表达分析,比较naa诱导的果实脱落和遮荫引起的果实脱落。从naa处理的FAZ中鉴定出700多个转录物丰度有显著变化的基因。结合两种处理的结果,我们发现与光合作用、细胞周期和膜/细胞运输相关的基因被下调。另一方面,与ABA、乙烯生物合成和信号通路、细胞壁降解和程序性细胞死亡相关的基因表达上调。虽然NAA和遮荫处理的差异表达基因集仅具有25%的同源性,但NAA和遮荫处理在识别的基因类别方面显示出实质性的相似性。在NAA和遮荫诱导的幼果脱落过程中,光合作用、碳利用、ABA和乙烯途径均受到影响。此外,我们发现NAA与遮荫相似,在处理后10分钟内通过抑制光系统II (PSII)效率直接干扰叶片光合作用,这表明NAA和遮荫诱导了一些相同的光合作用降低的早期反应,这与激素信号通路的变化同时发生,并引发果实脱落。
结论
本研究为进一步研究可能参与苹果幼果脱落的调控基因提供了广泛的转录组研究和良好的平台,这将有助于我们更好地了解苹果幼果脱落的机制,并为苹果幼果脱落的潜在化学物质选择提供参考。
背景
大多数苹果树的结果量往往超过它们所能支撑的成熟期。虽然这种过度种植可能有助于确保繁殖成功,但它可能导致枝条受损,果实质量低,并在第二年大幅减少种植。因此,过度种植是一种不受欢迎的性状。尽管一种被称为“六月掉落”的自我减薄过程有助于减轻果实过多的负面影响,但苹果种植者经常发现有必要在果实发育的早期阶段使用化学稀释剂来去除多余的果实。萘乙酸(NAA)是最常用的化学稀释剂之一,但其功效因品种而异,并受应用后环境条件的影响。
本文讨论了NAA促进苹果幼果脱落的生理机制[1- - - - - -3.]。在这些机制中,最主要的是通过干扰光合作用来减少发育中的果实所能获得的碳水化合物[4,5]或通过减少代谢产物(包括光合产物)从叶子到果实的转运[6]。光合作用和光合产物转运在果实保留中的重要性在遮荫或去除叶子的实验中得到了进一步的说明,这两种处理会导致大面积的苹果果实脱落[7,8]。此外,正常的小果脱落,可以在开花后不久和“六月落”期间发生,至少部分归因于幼果之间以及果实和营养芽之间对碳水化合物的竞争[7,9]。综上所述,这些发现表明光合作用对果实发育至关重要,改变可用于向发育中的果实转移的碳水化合物水平的处理可以影响苹果树的结果。
除了对碳水化合物水平的影响外,NAA的施用还通过增加乙烯的产生,明显地促进了苹果小果的脱落[10- - - - - -13]。乙烯利能释放乙烯,有效促进苹果幼果脱落。14],而乙烯生物合成的强抑制剂氨基乙氧基乙烯基甘氨酸(AVG)可减少苹果果实乙烯产量和幼果脱落[13,15]。naa诱导乙烯产量的增加与乙烯生物合成和信号转导基因的表达变化呈正相关,其中包括5个ACC合成酶基因(mdac),一个ACC氧化酶基因(MdACO)、四个乙烯受体基因(MdETR而且mder)和一个乙烯信号转导基因(MdCTR1) [12,13,16]。据报道,苹果小果的脱落是由乙烯生物合成的刺激和乙烯敏感性的获得引起的。12]。此外,最近对番茄花脱落区(AZ)中脱落相关转录组的微阵列分析揭示了AZ中乙烯敏感性的获得与生长素消耗导致的生长素调控基因表达改变之间的联系[17]。
果实脱落区(FAZ)内的细胞壁破裂和细胞分离是果实脱落的必要条件。FAZ诱导细胞壁重塑基因[18,19]而细胞壁重塑和降解酶的活性,包括膨胀素、果胶酸裂解酶、聚半乳糖醛酸酶和β-1,4-葡聚糖酶,已被证明显著增加,伴随着乙烯的增加,催化细胞壁的松动和分解,促进果实脱落[20.- - - - - -23]。
上述研究结果表明,脱落相关的碳水化合物、乙烯和生长素响应信号通路相互之间以及与其他信号通路进行串音以协调脱落。增加与脱落相关的基因表达变化的知识将有助于制定更可预测的减薄结果的策略,并为改进减薄剂的开发奠定基础。此外,识别苹果果实脱落的核心调控网络将增强我们对器官脱落的基本认识,器官脱落是植物发育的一个基本方面。本研究通过转录组分析,比较了NAA和遮荫诱导的苹果果实脱落,揭示了控制苹果果实脱落诱导的分子机制。结果表明,NAA与遮荫一样,通过光合作用损伤施加胁迫信号,引起激素信号的改变并引发果实脱落。
结果
NAA和遮荫对幼果脱落和幼果叶片产乙烯的影响
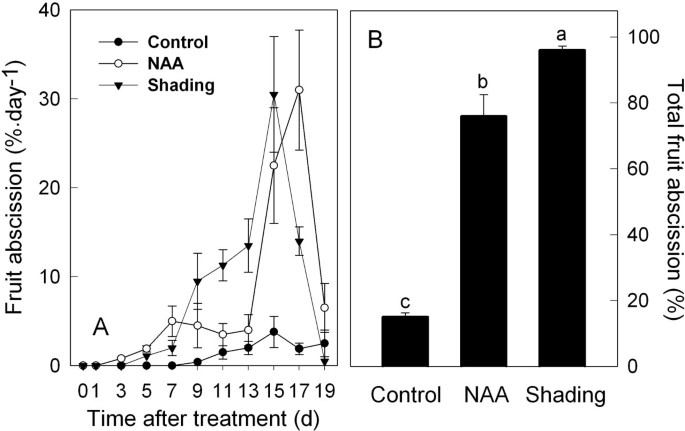
NAA和遮荫作为果实脱落诱导剂的相对有效性的比较表明,在脱落率和总数上有显著的处理特异性差异。例如,虽然两种处理在处理后的前7天内促进了脱落率的可检测性增加,但naa诱导的脱落率在7 - 13天内基本保持不变,而遮荫导致同一时期果实脱落率相对稳定地增加(图1)。然而,到15 d时,两种处理的脱落率相似,到19 d时,两种处理的脱落率接近或低于对照率。最终,遮荫显著更有效地促进果实掉落,导致98%的果实在研究的19天内脓肿,相比之下,NAA处理在同一时期损失了75%。有趣的是,对照树的脱落模式与处理树的脱落模式大致相同,但结果只有不到10%的果实脱落,这表明NAA和遮荫处理能够与内源早期果实脱落程序起附加或协同作用(图1 b)。
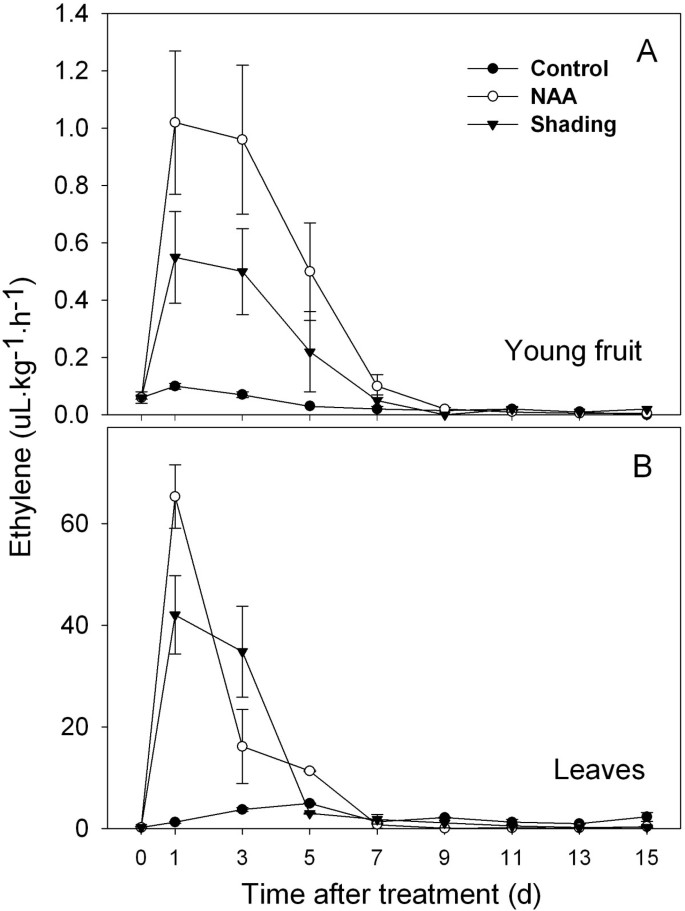
先前的研究已经证明了NAA和遮荫诱导的脱落与乙烯产生之间的联系。我们证实乙烯产量的主要增加先于果实脱落的开始(图2与图相比1)。naa诱导果实乙烯产量在处理1 d时达到最高水平,在处理7 d时降至对照水平。在1 - 5天内,遮荫处理的水果释放的乙烯含量也高于对照,但仅为naa处理水果的50%(图2)2)。叶片的乙烯释放也出现了类似的模式,遮荫和naa处理叶片的乙烯产量均在处理后1 d达到峰值,但分别在处理后5和7 d下降到对照水平。然而,在1 d的峰值时,叶片释放的乙烯几乎是水果的70倍(图2)2 b)。
NAA和遮荫诱导幼果脱落的表达谱
为了鉴定其表达模式与NAA和遮荫诱导的果实脱落相关的基因,在三个时间点(D1、D3和D5)使用FAZ进行基因表达谱分析,这段时间跨越了处理依赖性脱落高于对照组水平的最早阶段(图1)。对于每个时间点,来自NAA处理或遮荫处理树木FAZ的标记cDNA与来自未处理树木FAZ的参考cDNA在同一时间点进行杂交,以避免处理引起的基因表达变化与果实发育过程中发生的变化混淆。
来自naa处理的杂交样品中的722个基因和来自阴影处理的杂交样品中的1057个基因在表达上显示了统计学上的显著变化(附加文件1,表S1)。在这些基因中,有168个基因在NAA和阴影处理的faz中表达差异,其中86%(145个)的表达模式相似,这表明NAA和阴影诱导的脱落具有一些共同的信号通路。
时间点和选择的基因根据表达模式进行分层聚类分析(附加文件)2,图S1)。NAA处理后,3 d时差异表达基因数量最多,5 d和1 d次之,说明NAA在诱导脱落过程中产生了短暂效应。相比之下,遮荫处理导致差异表达基因的数量在1至5 d持续增加。对于两种处理,在1 d内表达上调或下调的基因数量大致相同,但在3和5 d内诱导基因的数量超过了抑制基因。
利用k -均值聚类(KMC)对两个阵列数据集进行了进一步分析,以寻找表达模式与果实脱落诱导相关的基因(附加文件)3.,表S2)。集群名称的分配是上调的(u),不变(o)或调低(d)。naa反应基因被分为8个主要簇。如附加文件所示4(图S2),在3 d时检测到最大的差异调控基因群(由簇2和簇6组成)。阴影响应基因被分为10个簇。与NAA数据集类似,大多数集群在一个或两个时间点反映了上调或下调。与NAA处理相比,阴影数据集中的两个簇(2和7)在所有三个时间点都表现出持续的抑制或诱导,一个簇(5)包含51个基因,这些基因在处理后第1天首次下调,但随后在5天上调(附加文件)4,图S2)。
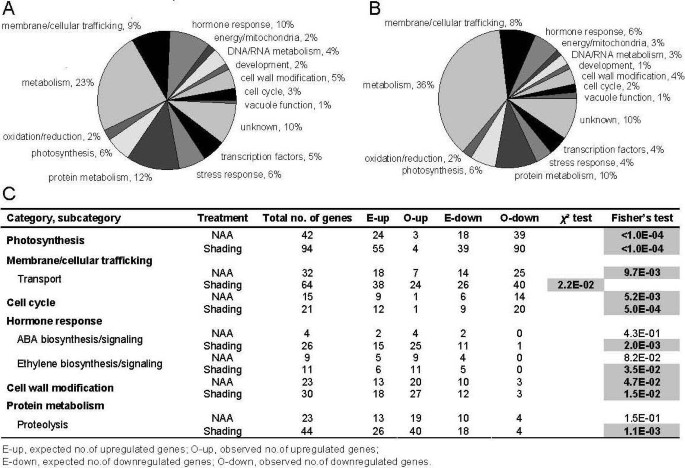
我们检测了基因表达模式,以确定与果实脱落相关的功能类别。苹果阵列探测的基因既具有注释信息,又具有基因本体信息。然而,由于一些注释和GO类别没有提供关于生物学机制的详细信息,因此对整个差异表达基因列表进行了额外的手工注释和文献验证。由此产生的15个功能类别包括8个类别(光合作用、代谢、膜/细胞运输、细胞周期、激素反应、细胞壁修饰、蛋白质代谢和转录因子),占两种处理中所有差异表达基因的70%以上(图)3 a - b)。在进一步的基因分类后,我们发现一些类别及其子类别显示出大多数成员被一种或两种处理上调或下调的趋势。为了确定这些表达趋势是否有统计学意义,还是只是偶然发生,用χ2对这些类别及其子类别进行了Fisher的精确检验,显示出大多数,但不是所有类别和子类别具有非随机表达趋势。Dardick等人(2007)使用了类似的方法进行富集分析[24]。具有统计学意义的类别和子类别如图所示3 c.所有产生的分类显示在附加文件中5(表S3),用于后续分析。
Photosynthesis-related基因
叶绿体是能量转导和光合作用和淀粉代谢的卡尔文周期阶段的场所。以前曾报道过遮荫对叶绿体功能的影响[7],并且与我们从遮荫处理过的树木中获得的转录资料一致。我们发现NAA处理也导致光合作用相关基因表达的强烈减少,这支持了之前的一份报告[4]。尽管遮荫处理比NAA处理降低了更多的光合作用相关基因,但在两种处理中,超过90%与叶绿体功能相关的差异表达基因被抑制(附加文件)5,表S3)。受影响的基因在光收集、氧气进化、电子传递和碳固定等方面发挥作用。遮荫抑制基因还与叶绿素生物合成、叶绿体DNA结合、类囊体形成和碳利用有关。然而,后一组遮荫抑制基因与NAA抑制基因之间只有少量重叠,这表明NAA和遮荫通过部分不同的机制抑制光合作用相关的过程。
碳水化合物代谢和糖感
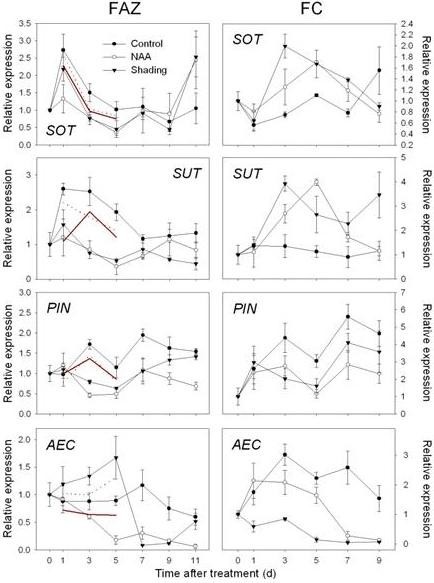
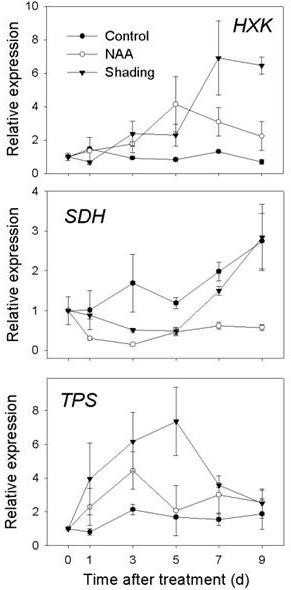
不足为奇的是,两种处理引起的光合作用相关基因表达的抑制与代谢类基因表达的变化有关,差异表达基因的最大亚群属于碳水化合物代谢。这类受影响的基因包括与糖酵解、糖苷键的裂解、糖磷酸化和信号转导相关的基因。38个碳水化合物代谢基因在NAA反应中表现出显著的表达改变,而149个基因受阴影调节(附加文件)5,表S3)。naa诱导的基因包括与糖酵解和淀粉降解相关的基因,如丙酮酸激酶、乙醇脱氢酶、淀粉酶和极限糊精酶。同样,遮荫处理诱导了糖酵解相关基因,但也导致了碳水化合物活性酶基因表达的变化,即诱导β -糖苷酶和糖基转移酶,抑制α -糖苷酶。与蔗糖代谢有关的基因,如蔗糖磷酸合酶(SPS)和蔗糖磷酸酶(仕达屋优先计划),受两种处理的负调控:NAA受抑制SPS和诱导仕达屋优先计划,而遮阳诱导SPS和压抑仕达屋优先计划.一组被鉴定为细胞质和细胞壁转化酶的基因被FAZ的阴影诱导,表明FAZ中的蔗糖分解可能增加。然而,NAA对这些相同的转化酶的调控没有差异。NAA和遮荫处理后,三种不同的碱性/中性转化酶基因的表达都降低了。山梨醇脱氢酶(SDH)受到NAA和遮荫的抑制,而依赖于nadp的d -山梨醇-6-磷酸脱氢酶(S6PDHNAA诱导,遮荫抑制。许多负责淀粉合成的ADP/ udp -葡萄糖焦磷酸化酶基因被遮荫下调,但没有一个基因被NAA差异调控。
糖信号由不同器官源产生,以应对应激和代谢通量的变化[25]。己糖激酶(HXK)感知葡萄糖水平和snf相关蛋白激酶(SnRKs)对于代谢重编程以应对碳水化合物水平的变化很重要[26]。遮荫改变了各种碳水化合物激酶的表达,但HXK仅在FAZ被NAA上调。
海藻糖是一种储存碳水化合物和压力保护剂,通常在饥饿条件下积累[25,27]。海藻糖代谢基因经遮荫处理下调,NAA处理未下调。具体来说,编码海藻糖-6-磷酸合成酶(TPS)和海藻糖-6-磷酸磷酸酶(泛太平洋伙伴关系)在遮荫处理的FAZ中被抑制,这表明遮荫导致FAZ中海藻糖水平下降。
运输
大量糖、脂质、氨基酸和金属离子的转运蛋白在两种处理下都有差异表达。两种处理均抑制了所有山梨醇/蔗糖转运蛋白基因的表达,而遮荫则下调了更多与一般糖转运相关的基因,如己糖转运蛋白。与膜和细胞骨架功能相关的一类基因,包括微管、囊泡介导的膜转运蛋白和细胞粘附基因,被发现仅被NAA抑制。总的来说,遮荫对运输相关基因的影响是NAA的两倍,其中一些离子转运蛋白,特别是钙和钾离子转运蛋白,在遮荫下显著上调,而其他水分转运蛋白则下调。另一组转运蛋白,atp结合盒转运蛋白(ABC转运蛋白),被两种处理诱导。
细胞周期相关基因
在两个差异表达基因的数据集中,我们发现了相似数量的细胞周期基因,包括两类调控基因,周期蛋白和周期蛋白依赖激酶(CDK),同时受到NAA和阴影的抑制。FAZ中几种细胞分裂控制蛋白也被下调,而一种CDK抑制剂被上调。
激素合成和信号传递
许多参与不同激素合成和信号通路的基因对这两种治疗都有显著的表达变化。ABA被认为是应激诱导衰老的调节因子[28,29]。在本研究中,NAA似乎对aba相关基因的作用有限,它仅上调了3个9-顺式环氧类胡萝卜素双加氧酶(数控)基因和玉米黄质环氧氧化酶基因,它们编码ABA生物合成中的关键酶。相反,遮荫改变了26个与aba相关的基因,包括生物合成数控短链脱氢酶/还原酶(特别提款权)和脱落醛氧化酶(阳极氧化铝),以及几个与ABA信号通路相关的基因,包括蛋白磷酸酶2C型和ABA响应元件结合因子。
遮荫处理与naa处理的树木生长素相关基因表达存在差异。只有2个生长素诱导的sar样基因和2个生长素转运基因对遮荫有显著的响应。然而,21个生长素相关基因被NAA差异改变,这些基因包括IAA-酰胺合酶、生长素-酰胺水解酶、AUX/IAA蛋白和各种生长素反应因子(东盟地区论坛)。生长素极性转运相关基因也受到NAA的影响,生长素内流载体被诱导,外排载体被大量抑制。后一种效果与遮荫处理的树木所观察到的效果不同,在遮荫处理的树木中,诱导了相同的生长素外排载体基因(附加文件)5,表S3)。
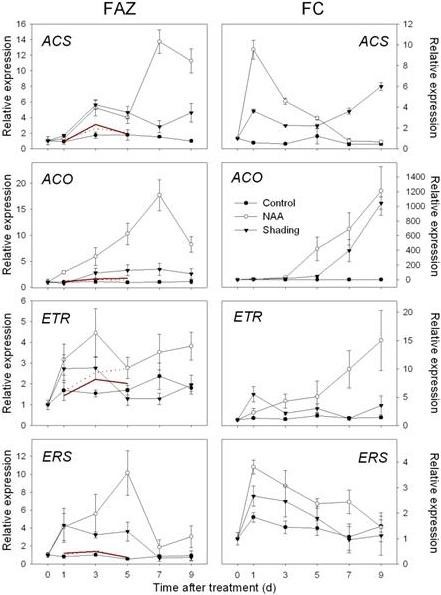
在对这两种处理的反应中,乙烯生物合成和感知的基因上调,包括1-氨基环丙烷-1-羧酸合成酶(ACS)和氧化酶(华)和两类乙烯受体(人队而且ETR)。与乙烯生物合成的增加相一致(图2),两种处理均降低了与多胺生物合成相关的关键基因亚精胺合成酶基因的表达。
细胞分裂素和赤霉素(GA)信号通路相关基因在遮荫和NAA处理下表达下调。此外,荫蔽增加了ga2氧化酶基因的表达,该基因负责GA的分解代谢。遮荫对油菜素内酯(BR)相关基因的影响是,一个BR氧化酶基因被抑制,而一个BR信号激酶基因在遮荫3 d后被诱导。相反,NAA处理不影响br相关基因的表达。
细胞壁修饰
一组与细胞壁生物合成、松动和降解相关的11个共享基因对两种处理都有反应,其中大多数在处理后3和5 d表现出变化。其中,纤维素合成酶基因被抑制,而其他与细胞壁松动和水解相关的基因,包括β-1,3-葡聚糖酶、聚半乳糖醛酸酶和膨胀素均被诱导。
蛋白质水解和程序性细胞死亡
许多推测参与泛素化途径的基因被上调。NAA数据集中的几个上调基因编码F-box蛋白和泛素E3连接酶复合体的其他成员,包括cullin和泛素偶联酶。相比之下,遮荫能更广泛地诱导负责蛋白质泛素化和降解的基因。遮荫对26S蛋白酶体亚单位基因的表达也有较大影响。另一组由两种治疗共同诱导的基因包括那些可能参与程序性细胞死亡的基因,如clp和半胱氨酸蛋白酶和自噬基因。与观察到的细胞壁降解基因的模式相似,在3和5 d检测到细胞死亡类别中几乎所有基因的诱导。
转录因子
有几类tf的表达出现了明显的变化。有10个转录因子被shading和NAA共同调控,包括ERF/AP2转录因子、bZIP蛋白、MADS-box蛋白和MYB结构域蛋白。差异表达的ERF/AP2 tf与乙烯和ABA的生物合成和信号通路基因共表达,与它们在这两种激素信号通路中的作用一致[30.,31]。有趣的是,同源的无接缝的基因(JNT),编码MADS-box TF和脱落区形成的调节器[32],两种处理均上调。虽然在着色数据集中有上调和下调的NAC结构域基因,南汽基因在NAA反应中无差异表达。不同的WRKY tf由NAA诱导和阴影抑制(附加文件5,表S3)。
通过RT-qPCR验证FAZ中的阵列数据和分析其他组织中选择的基因
从上述类别中选择基因子集,通过RT-qPCR在FAZ中验证阵列数据(附加文件6而且7,表S4和S5)。来自另外三个时间点(处理后的D0, D7和D9)的cDNA样本被包括在内,以扩展这些基因的表达模式数据。将RT-qPCR检测到的相对表达量转换为相对于参考对照样品阵列数据的倍数变化,以便与RT-qPCR结果直接比较。总体而言,FAZ样本的RT-qPCR结果与阵列数据的总体表达模式一致,但也观察到差异(图)4,5,6而且7)。为了进一步探索NAA和遮荫对源-库关系的影响,我们利用来自叶片和果实皮层(FC)的cDNA分析了光合作用、糖代谢和激素代谢及信号通路相关基因的组织特异性表达模式(图)8而且9)。
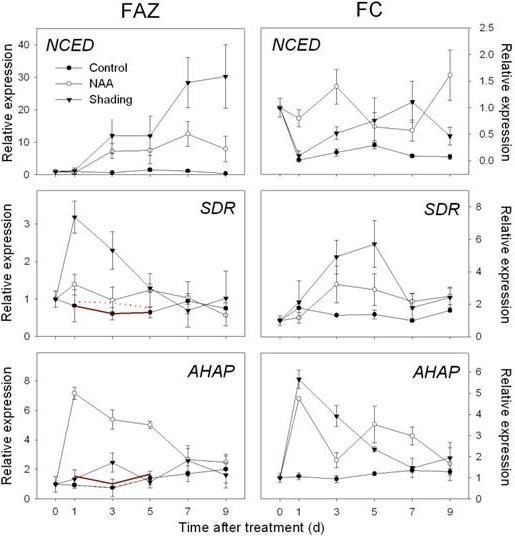
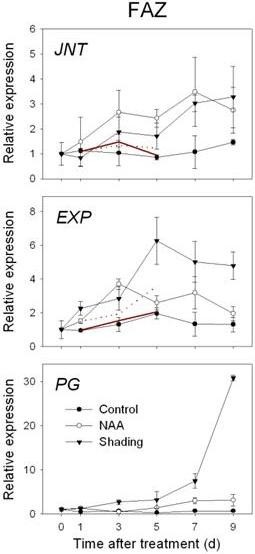
在FAZ和FC中,的表达式MdNCED此外,编码SDR家族蛋白和转录因子(AHAP),以调节ABA信号通路。在FAZ中,这些基因的表达在两种处理下均持续增加,特别是在处理后3和5 d(图4)。编码乙烯生物合成和信号的基因上调(mdac,MdACO,MdETR而且mder)通过RT-qPCR对NAA和阴影处理的FAZ进行了确认,并在FC中进行了镜像。总体而言,与遮荫相比,NAA处理的FC中乙烯相关基因的诱导更大,对应的是NAA处理的果实释放的乙烯水平高于遮荫(图5与图相比2)。与微阵列数据一致,山梨醇和蔗糖转运蛋白基因(MdSOT而且MdSUT)在FAZ中被NAA和遮荫抑制1 - 5 d。相反,在两种处理后的3 - 7 d,这些转运蛋白在FC中的表达增加。在生长素的极性运输方面,一个pin样的生长素转运基因(销)和生长素外排载体基因(原子能委员会)在naa处理的FAZ和FC中,表达量均从3 d开始持续下降(图6)。关于AZ的形成和细胞壁的降解,研究人员MdJNT处理后3 d, NAA和遮光处理均可提高FAZ基因表达量,且仍高于对照组。我们还观察到膨胀素(经验值在处理后1 d, NAA处理和遮荫处理的FAZ中基因的表达,同时果实乙烯产量的爆发(图7与图相比2)。MdPG2从5 d开始,NAA和遮荫诱导FAZ的表达,相应的果实脱落率增加(图7与图相比1)。
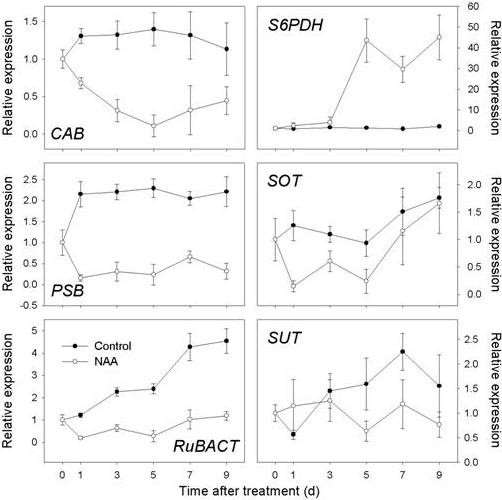
由于阵列数据显示FAZ中叶绿体相关基因普遍受到抑制,我们进一步测试了叶片,看看光合器官是否受到类似的影响,RT-qPCR结果显示,所选的和光收集相关基因持续受到抑制(出租车)、氧生成增强(公安局)和Rubisco活化(RuBACT)在naa处理后1 d就能在叶片中产生明显的活性(图8)。山梨醇和蔗糖转运蛋白基因的表达(MdSOT而且MdSUT)在叶片中也被发现受到抑制。另外三种与糖代谢相关的基因的表达在FC中进行了测试,FC是一个活跃的碳水化合物代谢位点。如图所示9,HXK遮荫显著诱导表达,在7 d时达到峰值。HXKNAA在第5 d时表达量增加最多,此后仍高于对照组。的表达式SDH而NAA和遮荫显著抑制。虽然我们的阵列数据显示了一致的下调TPS在FAZ中,遮荫处理的树木没有影响TPSNAA和遮光均可引起早期的诱导TPSFC(图9),暗示TPS在果实具体脱落方面独立于诱导方法。
NAA对叶片光合作用的影响
从我们的阵列数据中,我们发现FAZ中大量与光合作用相关的基因在早期阶段被NAA强烈抑制,这意味着NAA可能直接干扰光合作用。因此,我们通过监测FV/ F米为PSII初级光化学的最大量子产额提供了一个有用的相对度量。受naa影响的叶片在荧光成像系统下Fv/Fm值显著降低,表明叶片处于胁迫状态。我们还发现NAA在不同浓度下(15、150、450和900 mg L1)引起生长室幼苗叶片PSII的浓度依赖性损伤(图10)。NAA 15 mg L1,间伐实验中使用的工作浓度对叶片PSII效率产生了明显的光抑制作用(图10个罪犯)。早在处理后10分钟就观察到这种抑制作用,并持续8小时或更长时间,叶子通常在1天内恢复。接下来,在结果树上进行了现场试验。NAA在15 mg L时影响更严重1对叶片光合作用的影响,这些影响比幼苗持续的时间更长(图10 eg)。考虑到与温室条件相比,田间(充分日照)的光照水平更高,这种严重程度的增加并不令人惊讶。同样值得注意的是,在田间条件下,处理后24 h,叶片出现明显坏死,特别是在光抑制最强烈的叶柄附近。目前还不清楚这种空间不平衡是由于NAA溶液聚集在叶子底部附近引起的,还是这部分叶子对NAA特别敏感。综上所述,这些结果表明NAA的施用对叶片光合效率有快速而严重的影响。
讨论
在苹果中,遮荫和NAA是研究人员常用的促进果实脱落的两种处理方法,而NAA已被种植者广泛用于减少苹果树的过度坐果。而与脱落相关的转录组拟南芥[33- - - - - -35]和苹果的果实发育[36,37],关于多种诱导诱导果实脱落的分子机制的详细信息仍然有限。利用抑制-消减杂交(SSH)技术,从荫蔽的小苹果果实中鉴定出多种转录本存在差异表达,其中超过20%与碳水化合物代谢有关[38]。最近的一项转录组研究聚焦于苄茄碱(BA)在苹果果实脱落中的作用,提出了这样的假设:BA处理施加了一种营养胁迫,主要由小果皮层感知,然后是种子,可能是通过ros -糖- aba信号传导,最终导致脱落区激活[39]。这些发现仅针对果实皮质和种子,因此不包括FAZ或叶片发生变化的信息。也有人提出,脱落前乙烯产量的增加可能会阻碍从种子向下通过FAZ的生长素的极性运输,并导致小果实脱落[40]。番茄花AZ转录组分析也部分支持了生长素-乙烯串音的潜在重要性[17],其中生长素消耗导致生长素调控基因的表达改变,这与在AZ中获得乙烯敏感性有关。虽然这些发现表明生长素-乙烯串音与脱落有关,但他们没有关注与代谢重编程相关的植物应激反应,这是影响脱落激素信号的一个因素。此外,这些研究还没有检查诱导脱落的不同治疗方法,如遮荫和NAA,是否收敛于导致脱落的共同遗传途径。
在本研究中,通过比较NAA和遮荫导致幼果脱落的基因表达谱,我们发现这两种处理影响的基因数量与疏变反应的严重程度呈正相关。我们的微阵列实验包括在脱落诱导和脱落率开始可检测的增加期间采样,而不是在脱落过程本身。因此,需要额外的工作来确定在脱落后期发生的基因表达的变化。尽管由于取样包括了不同脱落电位的混合果实,限制在脱落区时间或空间调节的狭窄窗口内的任何较大的表达变化都可能被减弱,但我们观察到的基因表达变化证实了早期有关两种重要激素信号通路乙烯和ABA参与的报道[12,13]。此外,我们的阵列数据表明,NAA可能通过干扰叶片光合作用以及树内糖感和碳水化合物分配来发挥其减薄作用,这与遮荫诱导苹果幼果脱落的途径相似。
激素在果实脱落中的调节作用
我们的微阵列结果与之前的观察一致,乙烯是协调化学稀释剂NAA在苹果中诱导幼果脱落的关键信号[12,13,41]。在本研究中,NAA和遮荫处理的果实和叶片乙烯产量增加并达到峰值,与编码乙烯生物合成和信号成分的基因上调一致,但在果实掉落开始之前(图)1,2而且5)。这些结果与之前的一篇报道一致,即苹果小果脱落前乙烯生物合成和敏感性增加[12],尽管不依赖乙烯的途径也可能促进果实脱落[41]。
还有一种假设认为,防止脱落需要通过脱落区不断地从果实中输送生长素,而器官的吸收强度与它们产生和输出生长素的能力有关[42,43]。生长素输出由pin -形成的蛋白和atp激活的磷酸化糖蛋白(pgp) [44,45]。我们发现两个生长素转运相关基因(销而且原子能委员会)在FAZ和FC中被NAA抑制,即从3 d开始,其表达水平一直低于对照,表明果实生长素的外排被阻断(图6)。生长素转运蛋白的下调与乙烯产量的增加以及乙烯生物合成和信号相关基因的表达有关(图5而且6)。利用番茄花AZ模型,Meir和同事[17]注意到乙烯敏感性的获得与生长素调控基因的表达改变有关,乙烯在脱落过程中起触发作用,尽管这些作者没有测量的表达销基因。综上所述,乙烯和生长素相关基因在FAZ和FC中的表达模式表明,乙烯可能作为一种反馈抑制剂控制果实生长素的转运,并增加FAZ对乙烯的敏感性。
脱落酸与应激诱导的衰老调控有关[29],有人提出ABA可能感知营养胁迫,并与柑橘果实中乙烯相关的脱落激活相关[46]。我们观察到与ABA生物合成和信号传导相关的基因在遮荫下的广泛诱导,以及NAA处理下ABA生物合成基因表达的增加(附加文件)5,表S3,图4)。这些ABA相关反应的差异表明ABA信号通路对两种处理都有反应,但在遮荫诱导的果实脱落中更活跃。如上所述,与NAA相比,遮荫改变了更多与糖代谢和糖信号相关的基因,这表明糖和ABA之间存在密切的相互作用,以诱导衰老[47]。
光合作用相关基因的抑制
光照强度降低会抑制光合作用,导致叶片和果实脱落[7],我们的遮光实验也证实了这一点。我们还发现NAA引起了可观察到的叶片坏死和整体PSII效率的降低(图10),结果与先前的报告一致[48], NAA持续降低了整个树冠层的光合作用。在naa处理过的叶片中,还观察到一组叶绿体相关基因的抑制(图8),这些基因表达模式也与NAA处理树木FAZs的阵列数据一致,表明NAA同时影响叶片和茎组织的光合作用。NAA对叶片光合作用和PSII活性的负面影响表明NAA引起了碳水化合物胁迫,最终影响了包括果实在内的库组织。
对糖代谢、感知和运输的影响
据报道,深色诱导的果实脱落可以通过树干注射山梨醇来逆转,山梨醇是苹果中碳水化合物的主要易位形式[49],这支持了目前公认的假设,即限制同化物供应至少在一定程度上降低了果实的生长并导致果实掉落。植物己糖激酶与糖信号转导和衰老调控有关[50,51]。作为一种激酶和葡萄糖传感器HXK基因已被证明在葡萄糖代谢和信号传递中具有双重功能[50,51]。在这项研究中,我们发现了同源的HXK遮光处理和NAA处理均能诱导FC中的基因表达9),提示hxk依赖的糖信号通路在诱导脱落过程中是活跃的。据报道,转基因番茄植株过度表达拟南芥HEXOKINASE1显示出生长受到抑制和快速衰老[52),而拟南芥葡萄糖不敏感2(gin2)突变植株表现为延迟衰老表型[51]。的表达水平升高HXK本研究中观察到的结果可能部分解释了果实生长受到抑制和果实脱落加速的原因。
山梨糖醇占苹果韧皮部转运碳水化合物的80%以上,是果汇进口的主要碳资源[49]。山梨醇脱氢酶已被确定为山梨醇代谢的关键酶,将山梨醇转化为果糖[53,54]。在本研究中,表达SDH在对照果中逐渐增加,说明其在调节早期果实发育中的作用。而NAA和遮荫均能抑制SDHFC(图9),表明山梨醇分解代谢受到很大程度的抑制,果实库强度受损[55],导致脱落。另一种重要的山梨醇代谢酶是山梨醇-6-磷酸脱氢酶(S6PDH),在树叶中合成山梨醇,以转移到下沉组织[56]。先前的研究已经报道了一些蔷薇科果树可溶性碳水化合物的增加与耐受力之间的关系[57,58),而S6PDH已被揭示为aba诱导基因[59]。我们观察到强烈的感应S6PDH在naa处理过的叶片中的表达(图8), FAZ和FC中ABA生物合成和信号转导相关基因的诱导先于ABA的升高S6PDH叶中的表达式(图4),与S6PDH是aba介导的应激反应基因。
NAA和遮荫处理均显著抑制了FAZ和叶片中某些糖转运蛋白基因,表明果实碳分配受到了抑制。然而,两种处理后,这些转运蛋白在FC中的表达均增加(图6)。此外,阵列数据显示,许多转运蛋白基因被NAA诱导,包括一些ABC转运蛋白和一些阳离子转运蛋白,这与之前的研究结果一致[33]。本研究还诱导了几种硝酸盐和硫酸盐转运蛋白基因。这些转运蛋白的上调,特别是那些参与糖转运的转运蛋白的上调,可能反映了脓肿小果的转移功能,因为它们成为了将营养物质动员到非脓肿小果的源组织。
FAZ形成和细胞壁降解相关基因的诱导
组成AZ的细胞通常在脱落开始前在形态学上可区分[60]在这些细胞形成之前,无法诱导细胞脱落[61]。番茄无接缝的基因是MADS-box基因,在控制脱落区发育中起关键作用[32]。在这项研究中,MdJNTNAA和遮荫处理均使FAZ的表达逐渐增加,表明该转录因子参与苹果和番茄脱落区形成是保守的。
脱落区细胞增大包括细胞壁松动。扩张蛋白有助于壁的松动,一些报道表明扩张蛋白在脱落区大量表达[22,62]。我们还观察到膨胀素(经验值)在处理后1 d, NAA处理和遮荫处理的FAZ中都有表达,与果实乙烯产量的爆发一致。据报道,某些类型的AZ细胞对乙烯有反应而扩大[61]。这些结果共同支持了膨胀素在乙烯介导的脱落相关的细胞增大中的作用。
一些报告显示,聚半乳糖醛酸酶(PG)活动与果实脱落有关[18,63]。然而,MdPG1在“Golden Delicious”或“Delicious”苹果的FAZ或FC中未检测到表达[13],这与其他研究结果形成对比MdPG1参与苹果果实软化,且1-MCP和AVG处理均抑制其表达[16,64]。在这项研究中,MdPG1不是从数组中识别出来的,而是MdPG2NAA和遮荫5 d诱导FAZ中果实脱落率增加。这一结果与我们之前与NAA在“美味”苹果中所做的工作一致。13]。另一份报告显示MdPG2与naa依赖性的收获前落果减少相伴的下调[16支持我们目前的观点MdPG2而不是MdPG1似乎与小果脱落密切相关。
结论
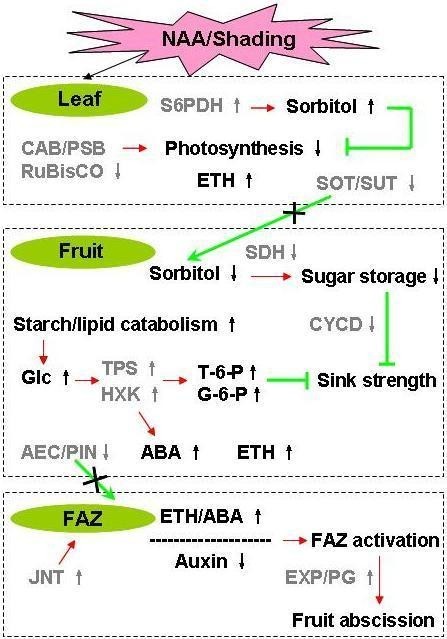
本研究的目的是比较化学稀释剂NAA和遮光剂两种不同诱导苹果果实离体早期整体基因表达的变化。本文提出了一个模型来说明在果实脱落诱导的早期过程中,两种脱落诱导因子共同的基因表达变化之间的关系(图11)。综上所述,NAA就像遮光一样,对叶片施加压力信号,或对树内任何其他光合活性组织施加压力信号,导致光合作用抑制和相关的营养胁迫。当营养胁迫在果实水平上被感知时,其生长受到糖运输阻塞的抑制,导致小果的下沉强度降低。同时,乙烯和/或ABA在光合作用抑制下通过糖信号通路产生。乙烯水平升高降低了生长素向FAZ的转运,提高了FAZ对乙烯的敏感性,导致FAZ分化和果实脱落。本研究中提出的差异基因表达数据允许关于水果脱落的重要调节基因的新假设的发展。这些假设可以通过RNA干扰或病毒诱导的基因沉默进行功能测试,这些基因是通过最近发布的苹果基因组确定的[65]。此外,本研究结果可能有助于选择新的化学物质或遗传策略,以开发更有效的苹果疏果方案。
方法
植物材料和样品采集
研究人员选择了36棵12年树龄、长在M.9砧木上的“金香”苹果树,将其分成三块,每块12棵。每组4棵树分别进行以下处理:1)对照(水);2) NAA(果酮N;AMVAC, Newport Beach, CA), 15 mg L1;3)遮阳(92%聚丙烯遮阳连续5天,然后取下)。在果实直径约10 mm时进行处理。分别进行3个生物重复。分别于处理后0、1、3、5、7、9 d采集幼果。在每个采集时间,每棵树采集果实约80个,分离果实皮质(FC)和果实脱落区(FAZ)。在椎弓根部离断面两侧各切割1mm收集faz [41]。所有样品均迅速冷冻在液氮中,并保存在-80°C下,以便未来提取RNA。
果实脱落模式和叶/果乙烯产量
为测定果实脱落率,在处理后0、1、2、3、7、9、11、14、16、18、21、25和26 d对每棵树上的2个枝干进行标记,计数标记枝干上的果实。为了测量乙烯产量,在处理后0和6小时,1、3、5、7、9、11和14天,分别从三棵复制树的每棵树上收集15个果实和20片叶子,并将它们装入100毫升(果实)或1000毫升(叶子)的容器中。经过2小时的孵育期后,从密封容器中通过贴在盖子上的橡胶隔片取出1 ml气体样品,用配备活性氧化铝柱和FID检测器的气相色谱仪(型号3700;瓦里安,帕洛阿尔托,加州),并表示为μL C2H4公斤1h1.
实验设计与微阵列杂交
使用了由~33,825个独特序列和~ 6,000个对照组成的苹果70-mer寡核苷酸微阵列[66]。来自三个时间点(D1、3和5)的RNA在染料交换设计(每个时间点6次杂交)中由3个生物重复分析,用于NAA处理和阴影处理共18张幻灯片。对照RNA(同一时间点未处理的样品)与处理RNA杂交,但使用相反的染料。在杂交中,每个样本cDNA和参考cDNA使用总共50 pmol的合并染料,FOI至少为2.0(使用Invitrogen公司的碱基/染料比率计算器计算)。
RNA提取、扩增和标记
如前所述,从FAZ中提取每个生物重复的总RNA [16],并使用TURBO DNA-free™试剂盒(Ambion, Austin, TX)进行dna检测。RT-PCR使用跨越内含子的引物进行MdACO以确认每个RNA样本都没有基因组DNA污染。RNA定量使用NanoDrop nt -1000 (Thermo Scientific, MA),质量检查使用Bioanalyzer 2100 (Agilent, CA),根据制造商的说明。根据《氨基烯丙基MessageAmp™II aRNA Amplification Kit说明书》,从1 μg总RNA的mRNA中合成cDNA。利用含有5-(3-氨基烯丙基)-UTP (50 mM)、ATP/CTP/GTP Mix (25 mM)、UTP (50 mM)、T7 10 × Reaction Buffer和T7 Enzyme Mix的IVT Master Mix将纯化的cDNA转录成aRNA。纯化的aRNA用AlexaFluor555或AlexaFluor647 (Invitrogen, CA)标记,按照制造商的说明进行杂交。将标记好的样品(10 μL)与1 × Slide Hyb Glass Hybridization Buffer (Ambion)混合,注入加热至65℃的载玻片腔中。在42°C下培养过夜。第二天用1 × SSC、0.2% SDS洗涤5 min、0.1 × SSC、0.2% SDS洗涤5 min、0.1 × SSC洗涤2次。
数据扫描与分析
使用GenePix 4000B微阵列扫描仪(Axon Instruments, CA)对微阵列切片进行干燥,并捕获双通道图像。通过手动检查每个载玻片以去除不合格的点来增强自动点位。采用GenePix Pro软件(Axon Instruments, CA)进行数据归一化和统计分析。采用线性模型方法,在R编程环境中使用LIMMA包[67]。使用调节F检验检测每个探针在时间点上的表达变化,这与每个探针的ANOVA方法类似,除了跨基因的残留标准误差被调节[68]。线性模型允许基因表达在连续时间点之间的一般变化。在实验设计中使用染料交换消除了每个探针的染料效应,从而提高了检测差异表达的精度。计算出的P为控制错误发现率(FDR),对数值进行了多次测试调整[69]。调整后的基因被认为显著表达P值<0.01(即预期FDR小于1%)。
基因聚类和分类
利用欧几里得距离对R进行统计包进行分层聚类。进行优势图(FOM)分析,以确定解释表达模式中大多数变异所需的聚类数量[70]。然后分配一个聚类号用于K-means聚类(KMC)分析,根据其表达模式的相似性将数据划分为不同的表达聚类,使用TM4包[70]。在这些分析中使用默认的统计参数,并根据折叠变化和日志对数据进行分层和KMC聚类2基因表达比例。现有的苹果基因注释由应用程序Blast2Go补充[71]并进一步补充了手动BLASTX,保守域和文献搜索,主要基于拟南芥数据库。使用这些组合信息,手动创建了功能驱动的分类。更大的类别被进一步划分为小类别,以涵盖所有相关的基因。
RT-qPCR
从每个样品中纯化的总RNA (1 μg)使用高容量cDNA逆转录试剂盒(Applied Biosystems, Fosters City, CA)在20 μ l反应中合成cDNA。每个qRT-PCR反应采用Power SYBR Green qRT-PCR试剂盒(Applied Biosystems),每次15 μl,提取40 ng cDNA,重复3次。基因特异性引物集采用引物表达3.0从现有的苹果est序列设计,并由Integrated DNA Technologies (Coralville, IA)合成[13]。苹果基因组公布后[65],我们使用BlastN搜索来检查我们的qPCR引物是否特异性于单个基因或可能扩增多个基因家族成员。那些可以放大一个以上的基因被丢弃(附加文件7,表S5)。这些反应在7500 Real-time PCR Cycler (Applied Biosystems, CA)上进行。定量是使用相对标准曲线来实现的,该相对标准曲线是由与每个引物组并行运行的标准RNA得出的。用来放大的引物马吕斯在所有样本上运行肌动蛋白RNA,并用于归一化数据。通过解离曲线验证每个反应都能获得一个所需的扩增产物(应用生物系统公司)。
测量叶片光合作用效率
在生长室(21 ~ 24℃,50%湿度,16:8 h的光-暗循环)中直接施用NAA;幼苗在光照周期开始4小时后处理),并在田间(日出后4小时,日照充足)成熟的苹果树。处理后,每隔10 min、1 h、5 h采集成熟树幼苗和离叶;成熟树10 min、4 h、1 d)。利用image - pam荧光仪和Walz ImagingWin V2.32软件,拍摄叶绿素荧光图像(CFI),记录Fv/Fm值,监测PSII效率的变化。FV/ F米在对照和受naa影响的田间果树叶片上分别记录3次。
参考文献
- 1.
亨纳蒂·MJ,福希·CG:苹果果实化学疏变变化的树木生理条件。HortScience。1972, 7: 259-260。
- 2.
小果实的脱落和变薄及其受植物激素和生物调节剂的调节。植物生长学报,2000,31(1-2):43-59。
- 3.
Dennis FG:苹果减薄化学物质的作用机制。HortScience。2002, 37(3): 471-474。
- 4.
Stopar M, Black BL, Bukovac MJ: NAA和BA对刺激型“美味”和“帝国”苹果树茎叶吸收二氧化碳的影响。植物生态学报,1997,33(6):357 - 357。
- 5.
袁振荣,格林DW:苯拉丁碱作为麦金托什苹果的化学稀释剂。I.果实变薄效应1及其与光合作用、同化物转运和非结构性碳水化合物的关系。环境科学学报,2004,26(2):379 - 379。
- 6.
施耐德GW:苹果小果的脱落机制研究。植物生态学报,2004,26(4):455-458。
- 7.
袁振荣,格林DW:苯拉丁碱作为麦金托什苹果的化学稀释剂。2苯腺苷、茎尖去除和叶数对果实保持性的影响。环境科学学报,2004,26(2):379 - 379。
- 8.
拜尔斯回复:花和果变薄和营养:果平衡。InApples:植物学,生产和使用。编辑:Ferree DC, Warrington IJ。纽约,CABI出版社;2003:409 - 436。
- 9.
昆兰·JD,普雷斯顿·AP:枝条竞争对苹果果实保持性和产量的影响。中国生物医学工程学报,2001,26(4):525-534。
- 10.
咖喱EA: naa诱导的乙烯和Acc在美味的刺组织-随温度和时间的变化。环境科学学报,2004,26(5):344 - 344。
- 11.
麦卡特尼SJ:化学稀释剂对分离苹果刺乙烯演化的影响。HortScience。2002, 37(4): 662-665。
- 12.
林志刚,王志刚,王志刚,王志刚。苹果果实脱落过程中乙烯的生物合成及对乙烯的感知。应用物理学报,2005,26(4):379 - 379。10.1093 / jxb / eri296。
- 13.
朱海红,朱海平,袁崇荣:氨基乙氧乙烯基甘氨酸抑制萘乙酸诱导的果实脱落及其与乙烯生物合成、感知和细胞壁降解基因表达的关系。环境科学学报,2008,29(6):344 - 344。
- 14.
袁锐:温度对“金香苹果”乙烯利疏果的影响。科学通报,2007,32(1):1 -12。10.1016 / j.scienta.2007.01.005。
- 15.
Williams RR, Flook VA:应用于Cox Orange Pippin的激素苹果坐果混合物Pp-341b的作用模式。植物科学,2000,25(3):379 - 379。
- 16.
李建刚,袁瑞荣:NAA和乙烯调控“美味”苹果果实脱落成熟过程中乙烯生物合成、感知和细胞壁降解相关基因的表达。植物生长学报,2008,27(3):283-295。10.1007 / s00344 - 008 - 9055 - 6。
- 17.
Meir S, ph- hadas S, Sundaresan S, Selvaraj KSV, Burd S, Ophir R, Kochanek B, Reid MS, Jiang CZ, Lers A:植物生长素耗竭对番茄花脱落区脱落相关转录组的响应。植物营养学报,2010,34(4):344 - 344。10.1104 / pp.110.160697。
- 18.
王晓明,王晓明,王晓明,等。果实脱落的分子生物学研究进展。植物生长学报,2000,31(1-2):35-42。
- 19.
Lashbrook CC, Cai S:拟南芥雄蕊脱落区细胞壁重构。植物信号与行为学报,2008,3(9):733-736。10.4161 / psb.3.9.6489。
- 20.
Lashbrook CC, gonzalebosch C, Bennett AB: endo - β -1,4-葡聚糖酶基因在成熟果实和脱落花中的重叠表达。中国生物医学工程学报,1994,6(10):1485-1493。
- 21.
Ward DL, Beers EP, Byers RE, Marini RP:切开苹果果实诱导脱落区纤维素酶活性。HortScience。1999, 34(4): 601-603。
- 22.
王晓明,王晓明,王晓明,等。乙烯诱导黑松叶叶片脱落过程中扩张蛋白活性和基因表达的变化。应用物理学报,2005,26(3):344 - 344。10.1093 / jxb / eri076。
- 23.
杨晓明,杨晓明,陈晓明,等:花器官脱落中多聚半乳糖醛酸酶的表达差异和功能冗余。植物信号行为学学报,2006,1(6):281-283。10.4161 / psb.1.6.3541。
- 24.
benthamiana烟叶系统感染三种果树病毒的比较表达谱。植物与微生物相互作用,2007,20(8):1004-1017。10.1094 / mpmi - 20 - 8 - 1004。
- 25.
李志强,李志强,李志强,等。植物糖信号的表达机制研究进展。植物学报,2006,29(3):344 - 344。10.1146 / annurev.arplant.57.032905.105441。
- 26.
Hanson J, Smeekens S:糖的感知和信号——更新。植物学报,2009,12(5):562-567。10.1016 / j.pbi.2009.07.014。
- 27.
彭丽娟,李丽娟,李丽娟,李丽娟。海藻糖对植物胁迫响应的影响:敌与友。植物科学进展,2010,15(7):409-417。10.1016 / j.tplants.2010.04.004。
- 28.
Weaver LM, Gan SS, Quirino B, Amasino RM:应激和激素治疗下几种衰老相关基因表达模式的比较。植物分子生物学,1998,37(3):455-469。10.1023 /: 1005934428906。
- 29.
杨春春,张建辉,王志强,朱秋生,刘丽娟:脱落酸和细胞分裂素在灌浆期水分胁迫下小麦衰老和碳储量再动员中的作用。植物细胞环境学报,2003,26(10):1621-1631。10.1046 / j.1365-3040.2003.01081.x。
- 30.
孙晓明,王晓明,张晓明,孙晓明。AP2/EREBP转录因子在非生物胁迫下基因调控中的作用。中国生物医学工程学报,2001,29(3):344 - 344。10.1016 / s0014 - 5793(01) 02460 - 7。
- 31.
Dietz KJ, Vogel MO, Viehhauser A: AP2/EREBP转录因子是基因调控网络的一部分,在应激适应和逆行信号传递中整合了代谢、激素和环境信号。中国生物医学工程学报,2010,34(1):1-4。10.1007 / s00709 - 010 - 0142 - 8。
- 32.
自然科学学报,2000,27(6):516 - 516。10.1038 / 35022611。
- 33.
Buchanan-Wollaston V, Page T, Harrison E, Breeze E, Lim PO, Nam HG, Lin JF, Wu SH, Swidzinski J, Ishizaki K,等:拟南芥发育和暗/饥饿诱导衰老基因表达和信号通路的比较转录组分析。植物学报,2005,42(4):567-585。10.1111 / j.1365 - 313 x.2005.02399.x。
- 34.
Cai SQ, Lashbrook CC:雄蕊脱落区转录组分析揭示了新的脱落控制候选:过表达拟南芥锌指蛋白2的转基因植物增强花器官保留。植物学报,2008,29(3):339 - 344。10.1104 / pp.107.110908。
- 35.
杨春华,杨春华,杨春华,杨春华,杨春华,杨春华。拟南芥叶片和花瓣衰老的分子结构特征及其转录谱分析。植物学报,2009,35(4):379 - 379。10.1111 / j.1365 - 313 x.2008.03722.x。
- 36.
李永平,刘海生,徐玉生,韩思,崔友,金东,莫ig,金文涛,成SK:苹果早期果实发育基因表达的微阵列分析。植物细胞学报,2007,26(7):917-926。10.1007 / s00299 - 007 - 0308 - 9。
- 37.
Janssen BJ, Thodey K, Schaffer RJ, Alba R, Balakrishnan L, Bishop R, Bowen JH, Crowhurst RN, Gleave AP, Ledger S,等:苹果花蕾到成熟果实发育的全局基因表达分析。中国生物医学工程学报,2008,8:16-10.1186/1471-2229-8-16。
- 38.
周春华,李志强,李志强,甘志强:苹果脱色相关基因的分离与鉴定。中国生物医学工程学报,2008,28(1):344 - 344。10.1007 / s00438 - 008 - 0348 - z。
- 39.
Botton A, Eccher G, Forcato C, Ferrarini A, Begheldo M, Zermiani M, Moscatello S, Battistelli A, Velasco R, Ruperti B,等:诱导苹果果实脱落的信号通路。中国生物医学工程学报,2011,29(1):457 - 457。10.1104 / pp.110.165779。
- 40.
Dal Cin V, Velasco R, Ramina A:家苹果(L. Borkh)果实脱落的显性诱导:与生长素极性转运相关的分子变化。中国生物医学工程学报,2009,29(3):379 - 379。
- 41.
朱华,袁锐,Greene DW, Beers EP: 1-甲基环丙烯和萘乙酸对苹果坐果及乙烯生物合成、感知和细胞壁降解相关基因表达的影响。植物生态学报,2010,35(5):344 - 344。
- 42.
克莱恩MG:顶端优势。机械工程学报,2001,29(3):344 - 344。10.1007 / BF02858771。
- 43.
泰勒JE,怀特洛CA:脱离信号。植物学报,2001,29(3):344 - 344。10.1046 / j.0028 - 646 x.2001.00194.x。
- 44.
Petrasek J, Mravec J, Bouchard R, Blakeslee JJ, Abas M, Seifertova D, Wisniewska J, Tadele Z, Kubes M, Covanova M,等:PIN蛋白在细胞生长素外排中的限制作用。科学通报,2006,31(4):344 - 344。10.1126 / science.1123542。
- 45.
Blakeslee JJ, Bandyopadhyay A, Lee OR, Mravec J, Titapiwatanakun B, Sauer M, Makam SN, Cheng Y, Bouchard R, Adamec J,等:拟南芥PIN-FORMED与p -糖蛋白生长素转运蛋白的相互作用。植物细胞学报,2007,19(1):131-147。10.1105 / tpc.106.040782。
- 46.
Gomez-Cadenas A, Mehouachi J, Tadeo FR, Primo-Millo E, Talon M:碳水化合物缺乏诱导柑橘果实脱落的激素调节。植物学报,2000,21(4):636-643。10.1007 / s004250050054。
- 47.
黄志刚,李志刚,李志刚:植物叶片衰老的代谢调控:糖信号与生物和非生物胁迫的相互作用。植物生物学(Stuttg)。2008, 10(增刊1):50-62。
- 48.
杨晓明,杨晓明:疏果剂对苹果冠层光合作用和暗呼吸的影响。植物生长规律,2001,35(1):1-9。10.1023 /: 1013894901621。
- 49.
Loescher W, Marlow GC, Kennedy RA:山梨醇代谢与苹果叶片发育的源库相互作用。植物营养学报,2002,27(2):339 -339。10.1104 / pp.70.2.335。
- 50.
张春春,李永平,周玲,陈娟:己糖激酶在植物中的应用。植物细胞学报,1997,9(1):5-19。
- 51.
Moore B, Zhou L, Rolland F, Hall Q,程文华,刘玉霞,Hwang I, Jones T, Sheen J:拟南芥葡萄糖传感器HXK1在营养、光和激素信号通路中的作用。科学通报,2003,29(3):332- 332。10.1126 / science.1080585。
- 52.
Dai N, Schaffer A, Petreikov M, Shahak Y, Giller Y, Ratner K, Levine A, Granot D:番茄植株过表达拟南芥己糖激酶抑制生长,降低光合作用,诱导快速衰老。中国生物医学工程学报,1999,11(7):1253-1266。
- 53.
山口H, Kanayama Y, Soejima J, Yamaki S: nad依赖性山梨醇脱氢酶含量的变化及其在苹果果实发育中的参与。环境科学学报,2004,26(5):344 - 344。
- 54.
杨晓明,李志刚,李志刚,等。生长中苹果果实中山梨糖醇和蔗糖的分配。植物营养学报,1997,15(3):379 - 379。
- 55.
Ho LC:输入糖在下沉器官中的代谢和区室化与下沉强度的关系。植物化学学报,1998,39:355-378。10.1146 / annurev.pp.39.060188.002035。
- 56.
Sakanishi K, Kanayama Y, Mori H, Yamada K, Yamaki S:不同发育阶段桃叶片中nadp依赖性山梨醇-6-磷酸脱氢酶基因的表达。植物生理学报,1998,39(12):1372-1374。
- 57.
Brown CS, Young E, Pharr DM:砧木和接穗对年轻苹果干重和碳水化合物季节分布的影响。环境科学学报,2004,26(5):589 - 597。
- 58.
罗碧anco R, Rieger M, Sung sj:干旱对桃源和库中山梨醇和蔗糖代谢的影响。中国生物医学工程学报,2000,38(1):344 - 344。10.1034 / j.1399-3054.2000.108001071.x。
- 59.
金山Y, Moriguchi R, Deguchi M, Kanahama K, Yamaki S:环境胁迫和脱落酸对蔷薇科果树山梨醇-6-磷酸脱氢酶表达的影响。环境科学学报,2007,37(3):344 - 344。
- 60.
罗伯茨•塞克斯顿:脱落细胞生物学。植物化学学报,2002,26(3):344 - 344。
- 61.
Osborne DJ:生长素和乙烯以及细胞生长的控制。鉴定三类靶细胞。植物生长调节。编辑:Pilet P. 1976,柏林,Springer-Verlag, 161-171。
- 62.
陈芳,陈志军,陈志军:番茄种子萌发过程中一种扩张蛋白的表达与胚乳弱化有关。植物营养学报,2000,27(3):344 - 344。10.1104 / pp.124.3.1265。
- 63.
王晓明,王晓明,王晓明,等。纤维素酶基因家族成员在诱导鳄梨果实脱落和成熟过程中的表达。植物细胞环境,1995,18(6):709-713。10.1111 / j.1365-3040.1995.tb00573.x。
- 64.
Wakasa Y, Kudo H, Ishikawa R, Akada S, Senda M, Niizeki M, Harada T:具有长期贮藏潜力的苹果果实中一种内聚半乳糖醛酸酶基因的低表达。生物技术,2006,39(2):193-198。10.1016 / j.postharvbio.2005.10.005。
- 65.
Velasco R, Zharkikh A, Affourtit J, Dhingra, Cestaro A, Kalyanaraman A, Fontana P, Bhatnagar SK, Troggio M, Pruss D,等:驯化苹果(Malus × domestica Borkh.)的基因组分析。植物学报,2010,42(10):833-839。10.1038 / ng.654。
- 66.
Soria-Guerra R, Rosales-Mendoza S, Gasic K, Band M, Wisniewski ME, Korban SS:苹果早期发育果实的基因表达受到高度调控。植物摩尔生物学代表2011。
- 67.
Gentleman RC, Carey VJ, Bates DM, Bolstad B, Dettling M, Dudoit S, Ellis B, Gautier L, Ge YC, Gentry J,等:Bioconductor:计算生物学和生物信息学的开放软件开发。中国生物医学工程学报,2004,5 (10):R80-10.1186/gb-2004-5-10-r80。
- 68.
线性模型和经验贝叶斯方法评估微阵列实验中的差异表达。中华生物医学杂志,2004,3:第3篇。
- 69.
Benjamini Y, Hochberg Y:控制错误发现率-一种实用而强大的多重测试方法。中国科学(d辑),2004,26(1):1 - 5。
- 70.
Saeed AI, Sharov V, White J, Li J, Liang W, Bhagabati N, brasted J, Klapa M, Currier T, Thiagarajan M,等:TM4:一种免费、开源的微阵列数据管理和分析系统。生物技术,2003,34(2):374-378。
- 71.
Conesa A, Gotz S, Garcia-Gomez JM, Terol J, Talon M, Robles M: Blast2GO:功能基因组学研究中注释、可视化和分析的通用工具。生物信息学,2005,21(18):3674-3676。10.1093 /生物信息学/ bti610。
确认
谨以此手稿献给袁荣才博士,以纪念他对植物科学的贡献。那些有幸认识他的人将会深深地怀念他。我们要感谢弗吉尼亚理工大学生物信息研究所的张燕博士,感谢他在阵列数据分析方面的帮助。我们也感谢AREC的David Carbaugh和Grace Engelman的技术支持。这项研究得到了维吉尼亚农业委员会对袁博士的资助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
RY构思了这个项目,获得了资金并设计了实验。HZ参与实验设计,进行化学处理和阵列实验,进行数据分析并撰写稿件。CDD参与实验设计,监督数据分析,编辑稿件。EPB和AMC参与了成果讨论,为稿件组织和写作提供了广泛的智力建议。RX对实验设计和阵列数据分析做出了贡献。所有作者都认真阅读并批准了手稿的最终版本。
电子辅助材料
12870 _2011_931_moesm1_esm.xls
补充文件1:补充表S1。表S1 -苹果果实脱落区基因芯片研究具有统计学意义。(xls 419kb)
12870 _2011_931_moesm2_esm.pdf
补充文件2:补充图S1。图S1 - 722个从naa处理的FAZ (A)和1057个从阴影处理的FAZ (B)从40 K苹果微阵列中选择的基因的分层聚类。基因表达的折叠变化从0.5缩放到2.0,允许通过表达模式进行聚类,强烈的红色表示最大表达,强烈的绿色表示最小表达。(pdf 291kb)
12870 _2011_931_moesm3_esm.xls
附加文件3:补充表S2。表S2 NAA处理和阴影处理苹果果实脱落区微阵列数据的k -均值聚类。(xl392 kb)
补充图S2。图S2 - naa反应基因(A)和阴影反应基因(B)的聚类,显示所选基因表达水平的平均值(粉红色线)和标准差(灰色区域)
附加文件4:。在这些图表中,“y”轴代表log2-fold变化,“x”轴表示采样的不同时间点。为每个时间点分配的集群名称为上调(u)、不变(o)或下调(d)。(pdf 87kb)
12870 _2011_931_moesm5_esm.xls
附加文件5:补充表S3。表S3 -编码具有多种生物学功能的酶的重要基因的分类。在这个表中,从阵列数据中列出了NAA和遮光处理后显示差异表达模式的8个功能基因类别。还包括一个比较热图。折叠变化比例显示在顶部和时间点,基因类别与颜色条一起列出。(xls1mb)
12870 _2011_931_moesm6_esm.xls
附加文件6:补充表S4。表S4 - NAA和荫蔽处理后早期(D1、3和5)修饰基因的阵列测量表达的摘要。“+”和“-”分别表示基因上调和下调,“0”表示没有变化。(xls 27kb)
12870 _2011_931_moesm7_esm.xls
附加文件7:补充表S5。表S5 -实时qPCR引物。用于定量聚合酶链反应研究的引物序列和基因登录号列表。(xl20kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
朱,H.,达迪克,c.d.,比尔斯,E.P.et al。遮荫诱导和naa诱导苹果脱落的转录组学研究(马吕斯有明显)揭示了一个共同的途径,包括光合作用减少、碳水化合物运输的改变以及信号和激素的相互作用。BMC植物生物学11日,138(2011)。https://doi.org/10.1186/1471-2229-11-138
收到了:
接受:
发表:
关键字
- 乙烯生产
- 乙烯生物合成
- 棒曲霉素
- 乙烯的敏感性
- 离层区