- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
葡萄保卫细胞相关的转录因子VvMYB60参与气孔活动的调控,在ABA和渗透胁迫下表达差异gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba11gydF4y2Ba,文章号:gydF4y2Ba142gydF4y2Ba(gydF4y2Ba2011gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
在干旱条件下,植物积累信号激素脱落酸(ABA),诱导气孔迅速关闭,防止水分流失。这一事件是由保护细胞内产生的一系列信号触发的,这些信号最终减少了它们的膨胀。其中许多事件在转录水平上受到严格调控,包括MYB蛋白施加的控制。在之前的一项研究中,在识别葡萄R2R3 MYB家族这两个密切相关的基因时,gydF4y2BaVvMYB30gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba被发现与gydF4y2BaAtMYB60gydF4y2Ba,一个拟南芥保卫细胞相关的干旱响应基因。gydF4y2Ba
结果gydF4y2Ba
启动子- gus转录融合实验显示gydF4y2BaVvMYB60gydF4y2Ba局限于气孔保护细胞,对ABA的反应减弱。不像gydF4y2BaVvMYB30gydF4y2Ba,gydF4y2BaVvMYB60gydF4y2Ba能够弥补功能的丧失吗gydF4y2Baatmyb60-1gydF4y2Ba突变体,表明gydF4y2BaVvMYB60gydF4y2Ba是唯一正确的正交正交向量吗gydF4y2BaAtMYB60gydF4y2Ba在葡萄基因组中。此外,gydF4y2BaVvMYB60gydF4y2Ba在葡萄器官发育过程中,以及对ABA和干旱相关胁迫条件的响应中受到差异调控。gydF4y2Ba
结论gydF4y2Ba
这些结果表明,VvMYB60可以调节保护细胞的生理反应,从而使葡萄气孔导度工程成为可能,减少水分损失,帮助该物种在极端气候条件下耐受干旱。gydF4y2Ba
背景gydF4y2Ba
小道消息(gydF4y2Ba葡萄gydF4y2BaL.)是一种传统上受中度或严重水分胁迫的水果作物,因为这是一种提高水果和葡萄酒品质的有效策略(在[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba])。葡萄品种因其良好的渗透调节能力、大而深的根系、气孔孔径和木质部栓塞的有效控制而很好地适应干旱条件[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].这些反应的强度和时间在不同品种之间有所不同,与葡萄属的其他品种或杂交品种相比,在耐水胁迫方面存在重大差异[gydF4y2Ba5gydF4y2Ba].虽然这些基因型相关的变异涉及植物生理的不同方面,但它们在很大程度上与气孔导度的差异有关(gydF4y2BaggydF4y2Ba年代gydF4y2Ba) [gydF4y2Ba6gydF4y2Ba].气孔是分布在叶片和茎表面的微观孔隙,由两个高度特化的保护细胞包围。气孔的打开和关闭是对内部信号和环境信号的响应,使植物能够应对相互冲突的需求,以确保充分吸收COgydF4y2Ba2gydF4y2Ba用于光合作用和防止蒸腾造成的水分流失[gydF4y2Ba7gydF4y2Ba].在干旱条件下,脱落酸(ABA)积累,诱导气孔迅速关闭,限制水分流失。gydF4y2Ba
越来越多的证据表明,属于R2R3 MYB亚家族的转录因子作为气孔生理反应的关键调节因子[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].特别是,gydF4y2BaAtMYB60gydF4y2Ba在保护细胞中对ABA的反应表现出差异表达,而功能的丧失gydF4y2Baatmyb60-1gydF4y2Ba突变体表现出光诱导气孔开放的本构性减少和对脱水的耐受性增强[gydF4y2Ba10gydF4y2Ba].因此,保护细胞特异性MYB基因是了解植物气孔调节的焦点,是调节保护细胞活性以提高干旱期间作物生存和生产力的分子靶点。gydF4y2Ba
据估计,葡萄基因组共包含279个MYB基因[gydF4y2Ba11gydF4y2Ba],其中108个属于R2R3亚族[gydF4y2Ba12gydF4y2Ba].利用葡萄、拟南芥和水稻R2R3MYB完整亚家族构建的系统发育树显示,许多功能相似的基因聚集在相同的系统发育群中。其中一些进化支在基因拷贝数上是保守的(例如那些与毛状体发育有关的基因),而在那些控制类黄酮合成的基因中可能发生了几次扩展事件[gydF4y2Ba12gydF4y2Ba].gydF4y2Ba
在这项工作中,我们报告了两个密切同源的保卫细胞相关的鉴定gydF4y2BaAtMYB60gydF4y2Ba葡萄基因组中的基因,即gydF4y2BaVvMYB60gydF4y2Ba而且gydF4y2BaVvMYB30gydF4y2Ba.葡萄组织中的基因表达分析表明,两者都有gydF4y2BaVvMYB60gydF4y2Ba而且gydF4y2BaVvMYB30gydF4y2Ba在绿色组织和发育中的种子中表达。与之相反gydF4y2BaVvMYB30gydF4y2Ba,gydF4y2BaVvMYB60gydF4y2BaABA和渗透胁迫显著降低了转录本丰度。在拟南芥中GUS报告基因的研究表明gydF4y2BaVvMYB60gydF4y2Ba启动子局限于气孔保护细胞,并被ABA下调。对调控区域的比较分析显示,在葡萄和拟南芥的启动子中存在共同的保护细胞特异性基序gydF4y2BaMYB60gydF4y2Ba基因。最后,gydF4y2BaVvMYB60gydF4y2Ba,不像gydF4y2BaVvMYB30gydF4y2Ba,充分补充了气孔缺陷gydF4y2Baatmyb60-1gydF4y2Ba突变,从而表明gydF4y2BaVvMYB60gydF4y2Ba是拟南芥的功能同源吗gydF4y2BaAtMYB60gydF4y2Ba气孔监管机构。gydF4y2Ba
结果gydF4y2Ba
MYB60同源物的系统发育关系gydF4y2Ba
作为识别葡萄AtMYB60转录因子同源物的第一个方法,我们搜索了在葡萄转录因子AtMYB60中鉴定的108个R2R3 MYB蛋白gydF4y2Ba葡萄gydF4y2BaPN40024基因组[gydF4y2Ba12gydF4y2Ba],因为存在一个独特的c端基序(CtM2, YaSSgydF4y2BaTgydF4y2Ba/gydF4y2Ba一个gydF4y2Ba埃尼集团gydF4y2Ba一个gydF4y2Ba/gydF4y2Ba年代gydF4y2BaRgydF4y2Ba/gydF4y2BaKgydF4y2BaLl),在拟南芥MYB家族亚组1成员中发现[gydF4y2Ba13gydF4y2Ba].该亚群包括:调节光诱导气孔孔径的AtMYB60 [gydF4y2Ba10gydF4y2Ba,gydF4y2Ba14gydF4y2Ba];AtMYB30,与油菜素类固醇诱导的基因表达调控相关[gydF4y2Ba15gydF4y2Ba]以及与超敏细胞死亡有关的超长链脂肪酸的生物合成[gydF4y2Ba16gydF4y2Ba];AtMYB96是一种ABA/生长素的交联物,在干旱胁迫中介导ABA信号通路,并参与促进病原体抗性[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba]和AtMYB94,其功能尚不清楚。gydF4y2Ba
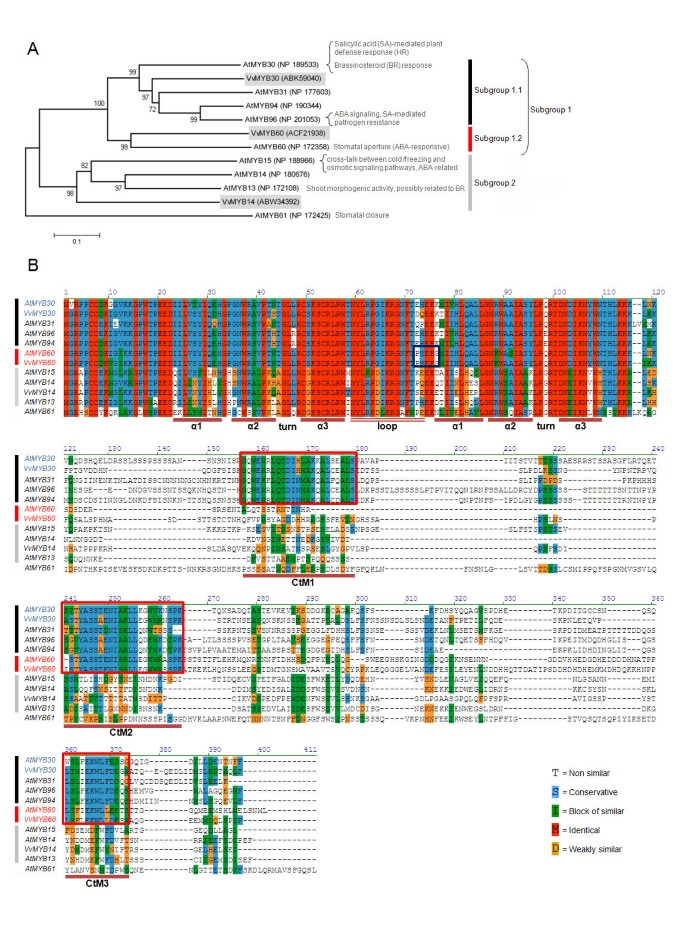
我们的研究在葡萄基因组版本12x中发现了两个密切同源的葡萄:注释基因模型GSVIVT01008005001(蛋白质接入ABK59040)和GSVIVT01029904001(蛋白质接入ACF21938)。为了研究这些葡萄蛋白与拟南芥R2R3 MYB亚组1成员之间的系统发育关系,构建了一棵简约共识树。亚群2也被包括在内,因为它的一些成员参与干旱响应和ABA信号传导[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].从这个亚群中,一个葡萄gydF4y2BaMYB14gydF4y2Ba同源物也曾被分离出来[gydF4y2Ba12gydF4y2Ba].AtMYB61,调控气孔活动[gydF4y2Ba21gydF4y2Ba],但不属于这些子群体中的任何一个,被列为外群体。如图所示gydF4y2Ba1gydF4y2Ba,两个葡萄蛋白ACF21938和ABK59040与拟南芥亚群1成员聚在一起。有趣的是,亚群1中距离最远的AtMYB60与葡萄蛋白接入ACF21938的亲缘关系比亚群中的其他成员(AtMYB30、31、94和96)更密切。另一方面,葡萄加入蛋白ABK59040与AtMYB30和AtMYB31密切相关,与AtMYB94和AtMYB96关系较小(图gydF4y2Ba1gydF4y2Ba).下面,我们将ACF21938和ABK59040分别称为VvMYB60和VvMYB30。基于这些结果,我们将Subgroup1进一步划分为subgroup1.1 (AtMYB30、AtMYB31、AtMYB94和AtMYB96)和subgroup1.2 (AtMYB60和VvMYB60)(图gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
葡萄和拟南芥MYB亚群1的同源基因分析gydF4y2Ba.(gydF4y2Ba一个gydF4y2Ba),拟南芥与葡萄R2R3 MYB因子亚群1和2之间的系统发育关系,如Kranz所述gydF4y2Ba等gydF4y2Ba, (gydF4y2Ba13gydF4y2Ba].使用MEGA4构造的最大简约方法推断出共识根树gydF4y2Ba®gydF4y2Ba软件(gydF4y2BaBgydF4y2Ba)拟南芥和葡萄中R2R3 MYB亚群1和2同源物的氨基酸序列比对。R2和R3重复位于每个重复的三个alpha螺旋之间。方框表示子组1成员中保守的c端图案CtM1、CtM2和CtM3(红色方框)和与AtMYB60和VvMYB60(1.2子组)不同的PHEEG签名(蓝框)。氨基酸残基用不同颜色表示,如图所示。点表示为改善对齐而引入的间隙。gydF4y2Ba
正如预期的那样,树中包含的所有蛋白质都揭示了一个高度保守的R2R3 DNA结合域(图gydF4y2Ba1 bgydF4y2Ba).AtMYB60与VvMYB60和VvMYB30的R2R3结构域的一致性分别为99%和90%。此外,AtMYB60和VvMYB60揭示了一个独特的PHEEG特征,包括两个高度保守的谷氨酸残基,位于连接R2和R3重复序列的环中(图2)gydF4y2Ba1 bgydF4y2Ba).AtMYB60蛋白全序列与VvMYB60的氨基酸同源性为51%,与VvMYB30的氨基酸同源性为48%。所有这些蛋白共享两个c端基序(CtM2和CtM3),这两个基序只在亚组1中发现。此外,AtMYB30、31、96和94具有第三个MYB结构域(CtM1),这在AtMYB60和VvMYB60中不存在(图gydF4y2Ba1 bgydF4y2Ba).这些c端结构域的功能仍然未知,尽管它们可能反映了亚组1.1和1.2之间的功能差异。我们确定了两者的精确基因结构gydF4y2BaVvMYB30gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba通过将完整的编码序列与分别从Pinot noir PN40024基因组DNA和叶片cDNA中扩增出的全长cDNA序列进行比较(附加文件gydF4y2Ba1gydF4y2Ba).有趣的是,在葡萄基因组的12倍版本中,GSVIVP01008005001代表gydF4y2BaVvMYB60gydF4y2Ba基因模型,在外显子数量方面被错误地注释了。事实上,我们的结果表明存在三个外显子,而不是基因模型预测的五个外显子,从而揭示了保守的外显子/内含子组织gydF4y2BaVvMYB30gydF4y2Ba,gydF4y2BaVvMYB60gydF4y2Ba而且gydF4y2BaAtMYB60gydF4y2Ba(附加文件gydF4y2Ba1gydF4y2Ba).根据基因结构,MYB基因可分为四个不同的类群[gydF4y2Ba12gydF4y2Ba].gydF4y2BaVvMYB30gydF4y2Ba,gydF4y2BaVvMYB60gydF4y2Ba而且gydF4y2BaAtMYB60gydF4y2Ba所有的基因都属于I类,这类基因的特征R2域在外显子1和2之间分裂,R3域在外显子2和3之间分裂(附加文件)gydF4y2Ba1gydF4y2Ba).长度差异最大的是第一个内含子和第三个外显子,葡萄基因中的这两个外显子较长gydF4y2BaAtMYB60gydF4y2Ba.gydF4y2Ba
的表达gydF4y2BaVvMYB30gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba在葡萄组织中以及对激素和应激因素的反应中gydF4y2Ba
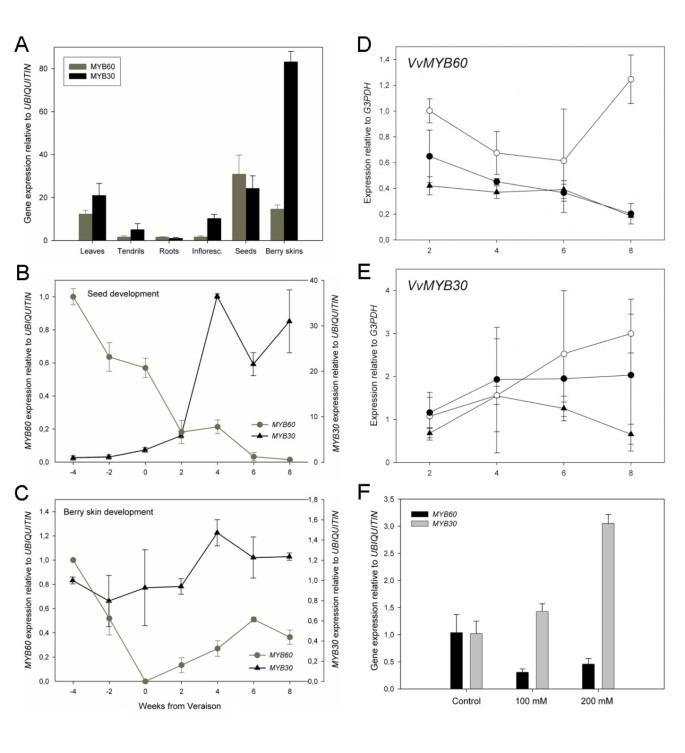
qPCR分析葡萄不同器官的基因表达gydF4y2BaVvMYB30gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba转录本在叶子、种子和成熟的浆果皮中最为丰富(图gydF4y2Ba2gydF4y2Ba).有趣的是,gydF4y2BaVvMYB30gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba在种子发育过程中显示完全相反的表达模式;而gydF4y2BaVvMYB60gydF4y2Ba表达量在成熟开始时逐渐下调(gydF4y2BaveraisongydF4y2Ba),gydF4y2BaVvMYB30gydF4y2Ba表达迅速被激活(图gydF4y2Ba2 bgydF4y2Ba).在浆果皮肤发育过程中,gydF4y2BaVvMYB60gydF4y2Ba表情也表现出急剧下降,至完全压抑时gydF4y2BaveraisongydF4y2Ba,然后逐渐接近成熟(图gydF4y2Ba2摄氏度gydF4y2Ba).在这个组织中,gydF4y2BaVvMYB30gydF4y2Ba大多在绿色和成熟阶段不断表达(图gydF4y2Ba2摄氏度gydF4y2Ba).gydF4y2Ba
基因表达谱gydF4y2BaVvMYB60gydF4y2Ba而且gydF4y2BaVvMYB30gydF4y2Ba在不同的植物组织中以及对ABA的反应gydF4y2Ba.(gydF4y2Ba一个gydF4y2Ba)在葡萄器官中的表达。(gydF4y2BaBgydF4y2Ba)及(gydF4y2BaCgydF4y2Ba)在浆果种子和皮肤发育过程中的表达(x轴对应从变种开始的周数)。每个基因独立归一化。(gydF4y2BaDgydF4y2Ba)及(gydF4y2BaEgydF4y2Ba)叶片对ABA响应的表达。x轴对应施用ABA后的小时数。白圈:模拟溶液,黑圈:50 μM ABA,黑三角:100 μM ABA。(gydF4y2BaFgydF4y2Ba)的表达变化gydF4y2BaVvMYB60gydF4y2Ba而且gydF4y2BaVvMYB30gydF4y2Ba在盐胁迫条件下的葡萄植株。每个基因单独归一化,对照处理(标准MS, 3 mM NaCl)。均值和标准差是三次独立重复的结果。内参基因(gydF4y2Ba泛素gydF4y2Ba而且gydF4y2Ba甘油醛3-磷酸脱氢酶gydF4y2Ba根据不同的实验条件进行不同的选择,在实验条件下,它们在样品之间的变化较小,并假设它们的表现类似于[gydF4y2Ba43gydF4y2Ba].gydF4y2Ba
在拟南芥中,已有研究表明gydF4y2BaAtMYB60gydF4y2Ba基因在ABA处理后迅速下调[gydF4y2Ba10gydF4y2Ba].因此,我们分析了50 μM ABA和100 μM ABA处理的葡萄叶片中基因的表达gydF4y2Ba二维gydF4y2Ba而且gydF4y2Ba2 egydF4y2Ba).如图所示gydF4y2Ba二维gydF4y2Ba, VgydF4y2BavMYB60gydF4y2Ba50 μM和100 μM ABA处理的叶片表达量均显著低于模拟处理的叶片。相反,gydF4y2BaVvMYB30gydF4y2Ba在这些条件下,暴露于激素后,其表达没有任何变化(图gydF4y2Ba2 egydF4y2Ba).进一步研究的表达gydF4y2BaVvMYB60gydF4y2Ba而且gydF4y2BaVvMYB30gydF4y2Ba为了应对渗透胁迫,我们设计了一个gydF4y2Ba在体外gydF4y2Ba长期盐胁迫实验。将节外植体垂直放置在添加3(标准)、100或200 mM NaCl的无菌MS培养基上。外植体在生长室中保持一个月,直到根和/或叶子可见并完全展开。在实验结束时,100 mM NaCl处理下的幼苗有一个小的胚根和大量的叶片花青素积累,这是植物受到胁迫的明显标志,而200 mM NaCl处理下的植株表现出更严重的症状,包括系统性萎蔫和棕色色素沉着(附加文件)gydF4y2Ba2gydF4y2Ba).在这些条件下,gydF4y2BaVvMYB60gydF4y2Ba而且gydF4y2BaVvMYB30gydF4y2Ba对盐浓度的增加有相反的反应;而gydF4y2BaVvMYB60gydF4y2Ba与对照处理相比,两种浓度下的表达量都减少了五倍,gydF4y2BaVvMYB30gydF4y2Ba在加入200 mM NaCl后,表达量增加了3倍(图gydF4y2Ba2 fgydF4y2Ba).gydF4y2Ba
活动gydF4y2BaVvMYB30gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba拟南芥转基因系中的启动子gydF4y2Ba
我们在异源模型系统中采用了报告基因方法gydF4y2Ba拟南芥gydF4y2Ba调查两者的活动gydF4y2BaVvMYB30gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba启动子。的ATG密码子上游约2 kb的区域gydF4y2BaVvMYB30gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba熔合到βgydF4y2Ba葡萄糖醛酸酶gydF4y2Ba(gydF4y2Ba格斯gydF4y2Ba)报告基因及其结果gydF4y2BapVvMYB30:格斯gydF4y2Ba而且gydF4y2BapVvMYB60:格斯gydF4y2Ba在拟南芥中引入结构gydF4y2Ba农杆菌属gydF4y2Ba-介导转化[gydF4y2Ba22gydF4y2Ba].gydF4y2Ba
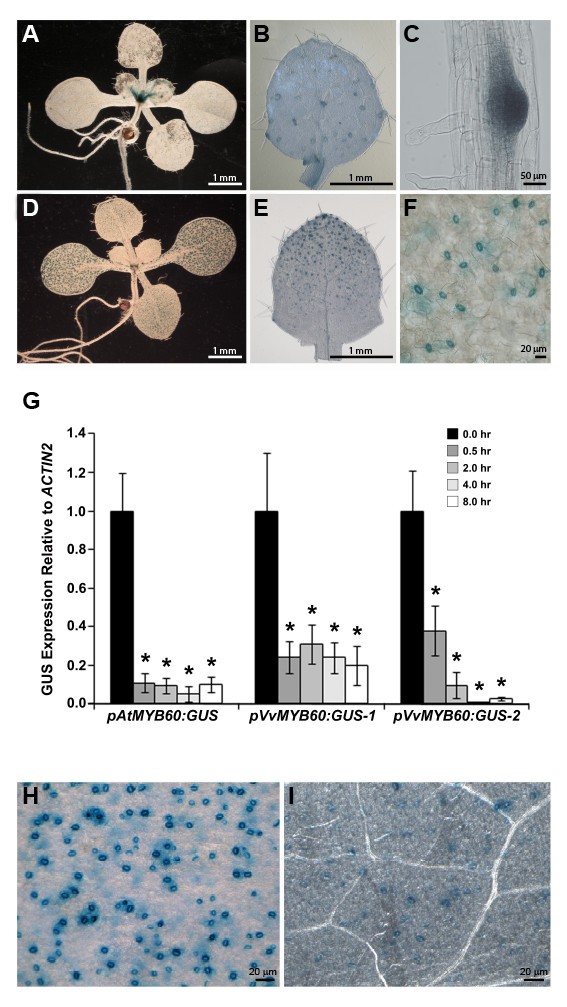
我们分别在10个独立的T3转基因株系中评估了报告基因表达的细胞和组织特异性gydF4y2Ba子:格斯gydF4y2Ba组合。Fifteen-day-oldgydF4y2BapVvMYB30:格斯gydF4y2Ba在茎尖、位于叶原基上的毛状体基部和新生侧根处均有报告基因的表达(图2)gydF4y2Ba3 a, BgydF4y2Ba而且gydF4y2Ba3 cgydF4y2Ba).在同一发育阶段,gydF4y2BapVvMYB60:格斯gydF4y2BaGUS只在分布在子叶、下胚轴和发育叶片上的保护细胞中表达(图gydF4y2Ba3 dgydF4y2Ba而且gydF4y2Ba3 egydF4y2Ba).在成熟莲座叶中未检测到报告基因的表达gydF4y2BapVvMYB30:格斯gydF4y2Ba即使植物组织在GUS溶液中长时间孵育(数据未显示)。另一方面,我们观察到保卫细胞特异性信号在成熟叶gydF4y2BapVvMYB60:格斯gydF4y2Ba植物,与幼苗中观察到的GUS剖面一致(图gydF4y2Ba3 fgydF4y2Ba).gydF4y2Ba
葡萄的活性gydF4y2BaVvMYB60gydF4y2Ba启动子在拟南芥中定位于保护细胞,并被ABA下调gydF4y2Ba.(gydF4y2Ba一个gydF4y2Ba) 15天大gydF4y2BapVvMYB30:格斯gydF4y2Ba幼苗。(gydF4y2BaBgydF4y2Ba)叶原基放大(gydF4y2Ba一个gydF4y2Ba),毛状体基部有染色。(gydF4y2BaCgydF4y2Ba后生根的细节。(gydF4y2BaDgydF4y2Ba) 15天大gydF4y2BapVvMYB60:格斯gydF4y2Ba幼苗。(gydF4y2BaEgydF4y2Ba)叶原基放大(gydF4y2BaDgydF4y2Ba),显示分化气孔染色。(gydF4y2BaFgydF4y2Ba)有关gydF4y2BapVvMYB60:格斯gydF4y2Ba成熟叶,气孔完全分化染色。(gydF4y2BaGgydF4y2Ba) qPCR分析GUS在100 μM ABA作用下的表达,在两种情况下是独立的gydF4y2BapVvMYB60:格斯gydF4y2Ba(mean±SD, n = 3).携带1.3 kb拟南芥的转基因株系gydF4y2BaMYB60gydF4y2Ba启动子与GUS熔合(gydF4y2BapAtMYB60:格斯gydF4y2Ba)作为对照。总RNA样本在指定时间点(小时)提取。使用基因特异性引物测定GUS的相对转录水平,并归一化以表达gydF4y2BaAtACTIN2gydF4y2Ba基因(At3g18780)。星号表示与未处理的对照组显著不同的值(gydF4y2BaP < 0.001gydF4y2Ba,gydF4y2Ba学习任务gydF4y2Ba).(gydF4y2BaHgydF4y2Ba)及(gydF4y2Ba我gydF4y2Ba)组织化学分析GUS在gydF4y2BapVvMYB60:格斯gydF4y2Ba叶片对ABA的反应。(gydF4y2BaHgydF4y2Ba对照叶气孔GUS染色。(gydF4y2Ba我gydF4y2Ba), 100 μM ABA处理6h后,气孔GUS染色。gydF4y2Ba
接下来,我们研究了该报告基因在成体植物花和角果中的表达。在授粉之前,gydF4y2BapVvMYB30:格斯gydF4y2Ba花显示弥漫性染色心皮和柱头组织(附加文件gydF4y2Ba3gydF4y2Ba).大多数花在受精前后均未观察到GUS的表达gydF4y2BapVvMYB60:格斯gydF4y2Ba行。在两个转基因株系中,在花丝和花药界面的雄蕊中偶尔检测到弱染色(附加文件)gydF4y2Ba3 bgydF4y2Ba).最后,我们在两种植物的种子发育过程中均未检测到报告基因的表达gydF4y2BapVvMYB30:格斯gydF4y2Ba或gydF4y2BapVvMYB60:格斯gydF4y2Ba转基因株系(附加文件gydF4y2Ba3 cgydF4y2Ba).gydF4y2Ba
内源拟南芥和葡萄的表达gydF4y2BaMYB60gydF4y2Ba基因在ABA处理后迅速下调[gydF4y2Ba10gydF4y2Ba)(图gydF4y2Ba二维gydF4y2Ba).因此,我们研究了GUS在小鼠中的表达变化gydF4y2BapVvMYB60:格斯gydF4y2Ba利用qPCR和组织化学分析,研究了该激素对外源应用的影响。一种先前描述的转基因系,在拟南芥之间进行转录融合gydF4y2BaAtMYB60gydF4y2Ba发起人、记者GUS (gydF4y2BapAtMYB60:格斯gydF4y2Ba)作为实验的对照[gydF4y2Ba10gydF4y2Ba].正如预期的那样,GUS表达的qPCR分析显示,对照组GUS转录本的积累显著而迅速地减少gydF4y2BapAtMYB60:格斯gydF4y2Ba暴露于ABA后的植物(gydF4y2BaP < 0.001gydF4y2Ba)(图gydF4y2Ba3 ggydF4y2Ba).我们观察到两个独立的GUS表达有相当的减少gydF4y2BapVvMYB60:格斯gydF4y2Ba随机选取进行qPCR实验(gydF4y2BaP < 0.001gydF4y2Ba)(图gydF4y2Ba3 ggydF4y2Ba).染色的莲座叶从所有10个gydF4y2BapVvMYB60:格斯gydF4y2Ba在ABA处理前后,证实了激素对幼苗的活性有负面影响gydF4y2BaVvMYB60gydF4y2Ba启动子(图gydF4y2Ba3 hgydF4y2Ba而且gydF4y2Ba3我gydF4y2Ba).相反,治疗gydF4y2BapVvMYB30:格斯gydF4y2Ba添加ABA的植株对该报告基因的表达没有显著影响(数据未显示)。gydF4y2Ba
保护细胞特异性基序的发生gydF4y2BaVvMYB60gydF4y2Ba启动子gydF4y2Ba
拟南芥和葡萄的保守活性gydF4y2BaMYB60gydF4y2Ba促进者,如所强调的分析相对应gydF4y2Ba子:格斯gydF4y2Ba转基因株系表明,这两个调控区域可能有共同之处gydF4y2Ba独联体gydF4y2Ba-负责守卫细胞特异性表达的元素。先前的证据表明dof型转录因子([a /T]AAAG)的DNA共识序列具有保护细胞特异性gydF4y2Ba独联体gydF4y2Ba-活性增强剂[gydF4y2Ba23gydF4y2Ba].具体来说,在同一条链上最多100 bp的区域内至少有三个[A/T]AAAG基元的簇被鉴定为假定的保护细胞特异性gydF4y2Ba独联体gydF4y2Ba-规管要素[gydF4y2Ba24gydF4y2Ba].gydF4y2Ba
拟南芥的gydF4y2BaAtMYB60gydF4y2Ba启动子包含多个[A/T]AAAG簇,其中最接近翻译起始密码子(-143 bp),是驱动保护细胞表达的必要且充分的(Cominelli,未发表结果)(附加文件)gydF4y2Ba4gydF4y2Ba).我们就这样搜寻葡萄gydF4y2BaVvMYB30gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba在翻译起始位点上游300 bp的区域,发现了[A/T]AAAG寡核苷酸发生的启动子。我们发现了一个由三个[a /T]AAAG基序组成的簇gydF4y2BaVvMYB60gydF4y2Ba启动子,位于内源性基因ATG密码子- 169bp处,这一距离相当于在其启动子中发现的守卫细胞调节元件的位置gydF4y2BaAtMYB60gydF4y2Ba.与拟南芥保护细胞缺乏活性一致的是,葡萄启动子中没有发现[A/T]AAAG簇gydF4y2BaVvMYB30gydF4y2Ba基因(附加文件)gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
基因表达的细胞特异性已经被研究了非常有限数量的葡萄基因。在这其中,gydF4y2BaVvSIRKgydF4y2Ba,编码一个KgydF4y2Ba+gydF4y2Ba通道,已报道在保卫细胞中特异性表达[gydF4y2Ba25gydF4y2Ba].有趣的是,我们发现了一个[A/T]AAAG簇上游的翻译开始密码子(-200 bp)gydF4y2BaVvSIRKgydF4y2Ba与转录方向相反(附加文件gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
拟南芥的功能互补gydF4y2Baatmyb60-1gydF4y2Ba突变体的gydF4y2BaVvMYB60gydF4y2Ba
拟南芥的零等位基因gydF4y2BaAtMYB60gydF4y2Ba基因(gydF4y2Baatmyb60-1gydF4y2Ba)显示干旱时气孔开口的本构性减少及失水减少[gydF4y2Ba10gydF4y2Ba].有趣的是,尽管与野生型相比,它对脱水的耐受性有所增加gydF4y2Baatmyb60-1gydF4y2Ba突变体对保护细胞对ABA的敏感性没有明显改变[gydF4y2Ba10gydF4y2Ba].gydF4y2Ba
我们使用gydF4y2Baatmyb60-1gydF4y2Ba研究等位基因的作用gydF4y2BaVvMYB60gydF4y2Ba在调控和养护气孔活动方面进行了探讨gydF4y2BaMYB60gydF4y2Ba葡萄与拟南芥的基因功能。为此,我们介绍了完整的长度gydF4y2BaVvMYB60gydF4y2Ba转基因突变植物的cDNA (gydF4y2Baatmyb60-C60gydF4y2Ba鉴定葡萄基因对气孔缺陷的修复能力gydF4y2Baatmyb60-1gydF4y2Ba等位基因。作为互补的对照,我们生成了第二个系列的转基因植物,其中我们对整个长度进行了转化gydF4y2BaVvMYB30gydF4y2BacDNA在gydF4y2Baatmyb60-1gydF4y2Ba背景(gydF4y2Baatmyb60-C30gydF4y2Ba行)。值得注意的是,这两个gydF4y2BaVvMYB30gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba启动子在拟南芥中显示出非常不同的活性模式(图gydF4y2Ba3a, b, c, d, egydF4y2Ba而且gydF4y2Ba3 fgydF4y2Ba).因此,对于两种葡萄中的基因进行更稳健可靠的比较gydF4y2Baatmyb60-1gydF4y2Ba背景我们使用1.3 KBgydF4y2BaAtMYB60gydF4y2Ba启动子(gydF4y2Ba10gydF4y2Ba驱动…的表达gydF4y2BaVvMYB30gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba在警卫牢房里。选择三个独立的转基因突变系,具有单一的插入位点和相当水平的转基因表达,以进一步分析每个葡萄基因(附加文件gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
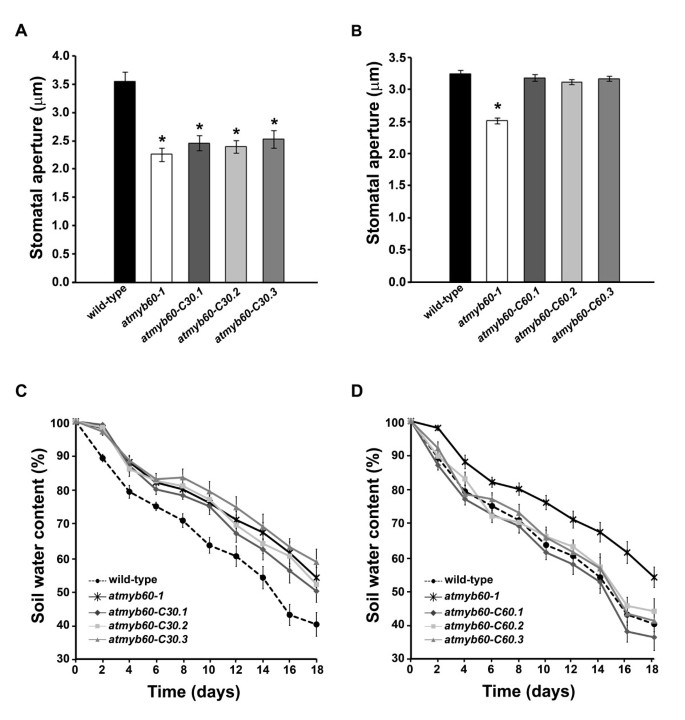
我们进行了一次gydF4y2Ba体外gydF4y2Ba评价突变系和转基因系表皮条气孔孔径的测定。与先前的报告一致[gydF4y2Ba10gydF4y2Ba],光诱导气孔开放降低gydF4y2Baatmyb60-1gydF4y2Ba与野生型相比,突变型(图gydF4y2Ba4gydF4y2Ba而且gydF4y2Ba4 bgydF4y2Ba).表达gydF4y2BaVvMYB30gydF4y2Ba基因在气孔孔径上没有表现出显著差异gydF4y2Baatmyb60-1gydF4y2Ba(图gydF4y2Ba4gydF4y2Ba).相反,所有的突变系转化与gydF4y2BaVvMYB60gydF4y2Ba基因在光诱导的气孔开放方面表现出野生型反应,表明完全互补gydF4y2Baatmyb60-1gydF4y2Ba突变(图gydF4y2Ba4 bgydF4y2Ba).gydF4y2Ba
葡萄gydF4y2BaVvMYB60gydF4y2Ba基因补充拟南芥气孔缺陷gydF4y2Baatmyb60-1gydF4y2Ba突变体gydF4y2Ba.(gydF4y2Ba一个gydF4y2Ba)及(gydF4y2BaBgydF4y2Ba)野生型的气孔孔径测定,gydF4y2Baatmyb60-1gydF4y2Ba三个独立的转基因突变系携带gydF4y2BaVvMYB30gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba)或gydF4y2BaVvMYB60gydF4y2Ba(gydF4y2BaBgydF4y2Ba)基因,在保护细胞特异性的控制下gydF4y2BaAtMYB60gydF4y2Ba启动子。测量从适应黑暗的植物中切除的表皮条,并将其暴露在光照下4小时。每个bar表示三个独立实验(n = 100个气孔/ bar)的平均值±标准差。星号表示与野生型(gydF4y2BaP < 0.001gydF4y2Ba,gydF4y2Ba学习任务gydF4y2Ba).(gydF4y2BaCgydF4y2Ba)及(gydF4y2BaDgydF4y2Ba)干旱胁迫下野生型土壤含水量的变化;gydF4y2Baatmyb60-1gydF4y2Ba三个独立的突变系与gydF4y2BaVvMYB30gydF4y2Ba基因(gydF4y2BaCgydF4y2Ba),或gydF4y2BaVvMYB60gydF4y2Ba基因(gydF4y2BaDgydF4y2Ba).在正常浇水条件下生长20天的植物因完全终止灌溉而受到干旱胁迫。为清晰起见,给出了gydF4y2Baatmyb60-C30gydF4y2Ba而且gydF4y2Baatmyb60-C60gydF4y2Ba转基因基因已经在两种不同的图表中绘制出来。每个点表示平均值±标准差(n = 20)。gydF4y2Ba
证实所得到的结果gydF4y2Ba在体外gydF4y2Ba,我们调查了两者的影响gydF4y2BaVvMYB30gydF4y2Ba而且gydF4y2BaVvMYB60在体内gydF4y2Ba,通过估算胁迫条件下的整个植物蒸腾作用。野生型,gydF4y2Baatmyb60-1gydF4y2Ba,gydF4y2Baatmyb60-C30gydF4y2Ba而且gydF4y2Baatmyb60-C60gydF4y2Ba植物种植在土壤中,花盆上覆盖锡纸以防止蒸发,这样通过气孔蒸腾发生的水分损失就可以量化。花盆定期浇水20天,随后通过终止灌溉施加干旱压力。正如预期的那样,由土壤含水量测量确定的蒸腾失水在年显著减少gydF4y2Baatmyb60-1gydF4y2Ba与野生型相比(gydF4y2BaP < 0.01gydF4y2Ba在第2、4和10天,gydF4y2BaP < 0.001gydF4y2Ba6、8、12-18天)(图gydF4y2Ba4摄氏度gydF4y2Ba而且gydF4y2Ba4 dgydF4y2Ba).与实验结果一致gydF4y2Ba在体外gydF4y2Ba检测,突变系表达gydF4y2BaVvMYB30gydF4y2Ba基因在失水方面没有表现出任何差异gydF4y2Baatmyb60-1gydF4y2Ba突变体(图gydF4y2Ba4摄氏度gydF4y2Ba).相反,在相同条件下,表示gydF4y2BaVvMYB60gydF4y2Ba基因表现出的失水速率与野生型中观察到的失水速率难以区分,从而证明完全挽救了气孔缺陷gydF4y2Baatmyb60-1gydF4y2Ba突变体(图gydF4y2Ba4 dgydF4y2Ba).gydF4y2Ba
讨论gydF4y2Ba
葡萄AtMYB60转录因子同源谱的鉴定gydF4y2Ba
MYB超家族是植物中发现的最丰富的转录因子组,在拟南芥中至少有198个成员,在水稻中至少有183个成员[gydF4y2Ba26gydF4y2Ba].在葡萄中,在第一个基因组版本中发现了108个假定的R2R3- MYB家族基因(覆盖8倍)[gydF4y2Ba12gydF4y2Ba],而使用12x版本可以找到超过125个R2R3 MYB基因(Matus,未发表的结果)。植物r2r3型MYB转录因子参与了与细胞命运、植物发育、激素反应、病原体-疾病抗性、耐旱性和耐寒性、光传感和类黄酮生物合成等许多功能相关的几个过程[gydF4y2Ba27gydF4y2Ba].MYB基因在葡萄中已被深入研究,但大多数研究都集中在参与花青素和原花青素生物合成途径调控的R2R3分支的成员,因为这些类黄酮化合物在果实组织中的积累是浆果和葡萄酒质量的关键决定因素[gydF4y2Ba28gydF4y2Ba].而聚在类黄酮生物合成官能团外的MYB基因则较少受到关注。gydF4y2Ba
这项工作展示了葡萄的鉴定gydF4y2BaVvMYB60gydF4y2Ba基因,作为拟南芥的功能同源gydF4y2BaAtMYB60gydF4y2Ba参与调控光诱导气孔孔径的基因[gydF4y2Ba10gydF4y2Ba].四方面的证据支持这一结论:gydF4y2Ba我gydF4y2Ba) VvMYB60和AtMYB60蛋白的氨基酸序列高度保守,gydF4y2Ba2gydF4y2Ba)gydF4y2BaVvMYB60gydF4y2Ba而且gydF4y2BaAtMYB60gydF4y2Ba基因在组织和细胞特异性以及对ABA的反应方面都表现出非常相似的表达谱,gydF4y2Ba3gydF4y2Ba)gydF4y2BaVvMYB60gydF4y2Ba而且gydF4y2BaAtMYB60gydF4y2Ba启动子仅在保护细胞中驱动报告基因的表达gydF4y2Ba独联体gydF4y2Ba监管元素,gydF4y2Ba4gydF4y2Ba)表达gydF4y2BaVvMYB60gydF4y2Ba在gydF4y2Baatmyb60-1gydF4y2Ba突变背景完全挽回了损失gydF4y2BaAtMYB60gydF4y2Ba函数。gydF4y2Ba
拟南芥和葡萄的MYB60蛋白结果比葡萄和拟南芥中的任何其他MYB蛋白更相似,甚至在亚群1内也是如此,这就是为什么我们将亚群1.1和1.2标记为进一步分类的原因。拟南芥和葡萄MYB60蛋白与来自亚组1的其他密切相关蛋白有两个主要特征:MYB结构域中独特的PHEEG特征,位于连接R2和R3重复序列的环中,以及所有其他归属于亚组1的MYB蛋白中存在的三个c端motif的第一个(CtM1)缺失(图1)gydF4y2Ba1 bgydF4y2Ba).值得注意的是,这两个特征在我们在其他植物基因组中发现的推定MYB60同源体中都是保守的,包括油菜、番茄、黄瓜和杨树(数据未显示)。尽管PHEEG和CtM1基基的作用尚未被描述,但有趣的是,前者的存在和后者的缺失可能有助于MYB60在保护细胞中功能的特异性。gydF4y2Ba
表达特征gydF4y2BaVvMYB60gydF4y2Ba在葡萄器官中gydF4y2Ba
此前已有研究表明,拟南芥gydF4y2BaAtMYB60gydF4y2Ba该基因在幼苗、莲座叶、茎和花中均有表达,其表达水平受到胁迫激素ABA的迅速下调[gydF4y2Ba10gydF4y2Ba].此外,公开可用的基于微阵列的基因分析实验库表明gydF4y2BaAtMYB60gydF4y2Ba在种子发育过程中短暂表达,在第7阶段种子(拐杖胚胎)中达到峰值,在成熟种子中迅速下降(植物功能基因组学生物阵列资源,gydF4y2Bahttp://bar.utoronto.ca/gydF4y2Ba).gydF4y2Ba
我们的调查gydF4y2BaVvMYB30gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba在葡萄组织中的表达表明,这两种基因都优先表达在叶子、浆果皮和种子中(图gydF4y2Ba2gydF4y2Ba).类似于gydF4y2BaAtMYB60gydF4y2Ba,与之相对gydF4y2BaVvMYB30gydF4y2Ba,表示gydF4y2BaVvMYB60gydF4y2Ba在种子发育过程中,酶的表达下调(图gydF4y2Ba2 bgydF4y2Ba).浆果皮gydF4y2BaVvMYB60gydF4y2Ba之前的表达更高gydF4y2BaveraisongydF4y2Ba,此时葡萄果实光合活性旺盛,气孔功能正常,之后气孔减少gydF4y2BaveraisongydF4y2Ba,此时气孔演化为无功能的皮孔[gydF4y2Ba29gydF4y2Ba)(图gydF4y2Ba2摄氏度gydF4y2Ba).有趣的是,在这个阶段,成熟的开始和糖的积累与浆果中ABA水平的增加有关[gydF4y2Ba30.gydF4y2Ba],这表明激素可能对…的表达有负面影响gydF4y2BaVvMYB60gydF4y2Ba在葡萄组织中。事实上,外源ABA处理叶片导致了快速下调gydF4y2BaVvMYB60gydF4y2Ba表达式(图gydF4y2Ba二维gydF4y2Ba).相比之下,激素对其积累没有任何影响gydF4y2BaVvMYB30gydF4y2Ba成绩单(图gydF4y2Ba2 egydF4y2Ba).此外,渗透胁迫引发aba介导的反应,如高浓度的NaCl,使其迅速下调gydF4y2BaVvMYB60gydF4y2Ba在葡萄组织中的表达(图gydF4y2Ba2 fgydF4y2Ba).有趣的是,最近的研究表明,低浓度的ABA应用可以引发暂时性的上调gydF4y2BaMYB60gydF4y2Ba在拟南芥幼苗中的表达[gydF4y2Ba31gydF4y2Ba].这表明的模式gydF4y2BaAtMYB60gydF4y2Ba反应渗透胁迫的表达可能相当复杂和剂量依赖。即使详细分析了调控表达的机制gydF4y2BaVvMYB60gydF4y2Ba基因延伸超出了这项工作的范围,进一步研究的表达谱将是有趣的gydF4y2BaVvMYB60gydF4y2Ba在不同的葡萄组织中对更大范围的ABA浓度做出反应。gydF4y2Ba
的gydF4y2BaVvMYB60gydF4y2Ba启动子在拟南芥保护细胞中特异性地驱动报告基因表达gydF4y2Ba
对纯化的拟南芥气孔进行报告基因分析和RT-PCR实验,清楚地表明在绿色组织中,gydF4y2BaAtMYB60gydF4y2Ba只在保卫细胞中表达[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].gydF4y2Ba
我们培育的拟南芥系含有gydF4y2Ba格斯gydF4y2Ba在标记基因的控制下gydF4y2BaVvMYB30gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba启动子建立基因表达的细胞定位。组织化学分析gydF4y2Ba格斯gydF4y2Ba在几条独立的行中表达,表明该活性gydF4y2BaVvMYB60gydF4y2Ba启动子仅限于保护细胞(图gydF4y2Ba3 d, EgydF4y2Ba而且gydF4y2Ba3 fgydF4y2Ba).这一结果与内源性表达一致gydF4y2BaVvMYB60gydF4y2Ba基因在叶片和浆果皮中表达,两者都含有气孔,而在根中缺乏表达(图gydF4y2Ba2gydF4y2Ba).拟南芥报告基因方法为研究葡萄基因表达和鉴定基因调控元件提供了高效可靠的工具[gydF4y2Ba25gydF4y2Ba].然而,我们没有观察到记者活动在发展的种子gydF4y2BapVvMYB30:格斯gydF4y2Ba而且gydF4y2BapVvMYB60:格斯gydF4y2Ba行(附加文件gydF4y2Ba3 cgydF4y2Ba).这一发现与qPCR实验的数据相反,qPCR实验表明这两种基因在葡萄种子中都有高表达(图2)gydF4y2Ba2gydF4y2Ba而且gydF4y2Ba2 bgydF4y2Ba).由于异种遗传背景,这种差异可能是人为的。然而,值得注意的是,我们没有在发育中的种子中检测到GUS活性gydF4y2BapAtMYB60:格斯gydF4y2Ba在本研究中作为阳性对照,尽管在这些器官中内源性拟南芥基因的高表达[gydF4y2Ba32gydF4y2Ba].可以提出不同的假设来解释大脑活动的缺乏gydF4y2BaAtMYB60gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba种子中的促进子。首先,gydF4y2Ba独联体gydF4y2Ba-负责内源性基因种子表达的元件可能位于本工作所考虑的调控基因组区域之外。然而,科米内利和同事报告说,完整的5'和3'gydF4y2BaAtMYB60gydF4y2Ba基因间区,克隆的上游和下游gydF4y2Ba格斯gydF4y2Ba基因,不驱动报告基因在种子中的表达[gydF4y2Ba10gydF4y2Ba].或者,表达gydF4y2BaAtMYB60gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba在种子中可能由基因内调控元件介导。gydF4y2Ba独联体gydF4y2Ba-作用基序位于内含子中,已被证明是建立转录因子(如MADS-box)正确表达域所必需的gydF4y2Ba无性生殖的gydF4y2Ba基因(gydF4y2Ba33gydF4y2Ba].最有趣的是,在不同的植物物种中,种子特异性增强子已被定位于种子表达基因的内含子区[gydF4y2Ba34gydF4y2Ba].最后,发现gydF4y2BaAtMYB60gydF4y2BamRNA与从保护细胞纯化的多核糖体相关,而不是从其他植物组织纯化的多核糖体[gydF4y2Ba35gydF4y2Ba],为在种子中调控MYB60表达的翻译水平提供了可能。显然,还需要做更多的工作来解开gydF4y2Ba独联体gydF4y2Ba-调节元件gydF4y2BaMYB60gydF4y2Ba在种子中的表达,以及揭示该基因在这些器官中的功能。然而,合理的结论是,气孔特异性的活动gydF4y2BaVvMYB60gydF4y2Ba启动子在拟南芥中反映了葡萄保护细胞中内源基因的表达。gydF4y2Ba
而身份的gydF4y2Ba独联体gydF4y2Ba的表达式所需的作用元素gydF4y2BaAtMYB60gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba在种子中仍然难以捉摸,它们在气孔中的表达最有可能受到调控,在gydF4y2Ba独联体gydF4y2Ba,通过DOF识别DNA基序。我们确定了一组[a /T]AAAG DOF靶点,靠近gydF4y2BaVvMYB60gydF4y2Ba翻译起始密码子(附加文件gydF4y2Ba4gydF4y2Ba).这种簇被描述为特定的保护细胞gydF4y2Ba独联体gydF4y2Ba-在不同植物物种中的调控元件,包括拟南芥和马铃薯[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].[A/T]AAAG基序在保护细胞特异性中的发生gydF4y2BaVvMYB60gydF4y2Ba而且gydF4y2BaVvSIRKgydF4y2Ba葡萄促进剂进一步支持了葡萄的保护gydF4y2Ba独联体gydF4y2Ba-而且,可能,gydF4y2Ba反式-gydF4y2Ba在远亲植物物种中直接表达保护细胞的机制。有趣的是,广泛的开花植物物种的强保护也被报道为其他细胞特异性gydF4y2Ba独联体gydF4y2Ba-图案,如根毛特定gydF4y2Ba独联体gydF4y2Ba-元素(RHEs) [gydF4y2Ba36gydF4y2Ba].gydF4y2Ba
VvMYB60gydF4y2Ba的函数正交正交向量gydF4y2BaAtMYB60gydF4y2Ba
VvMYB60的能力充分补充,两者gydF4y2Ba在体外gydF4y2Ba而且gydF4y2Ba在活的有机体内gydF4y2Ba,气孔缺陷表现为gydF4y2Baatmy60-1gydF4y2Ba突变明确表明,VvMYB60是拟南芥AtMYB60转录因子的同源基因。重要的是,gydF4y2BaVvMYB30gydF4y2Ba基因产品,其中共享47%的身份gydF4y2BaVvMYB60gydF4y2Ba,没有补足gydF4y2Baatmyb60-1gydF4y2Ba突变。这一结果与功能研究一致,这些研究表明,尽管AtMYB30和AtMYB60氨基酸序列高度同源,但这两种蛋白质发挥着两种不同的功能作用。在拟南芥中,AtMYB30介导油菜素类固醇诱导的基因表达[gydF4y2Ba15gydF4y2Ba]和病原体引起的过敏反应[gydF4y2Ba16gydF4y2Ba],而在干旱条件下,AtMYB60正调控光诱导的气孔开放和水分损失[gydF4y2Ba10gydF4y2Ba].gydF4y2Ba
总的来说,我们的研究结果表明VvMYB60在葡萄保护细胞活性和蒸腾速率的调节中发挥作用。气孔导度是葡萄的一个关键性状,直接决定了不同基因型的等水/各向异性行为。这些差异是由于营养组织中气孔对蒸发需求的控制,而不是气孔密度[gydF4y2Ba37gydF4y2Ba].水分亏缺对ABA代谢和信号传导的影响也有品种特异性差异的描述[gydF4y2Ba38gydF4y2Ba].各向异性的品种,如黑比诺,气孔调节不充分,蒸腾速率和气孔导度较高,而等水的品种,如设拉子,气孔导度值要低得多[gydF4y2Ba39gydF4y2Ba].从这个角度来看,调查自然发生的变化将是有趣的gydF4y2BaVvMYB60gydF4y2Ba等位基因,并建立它们对不同葡萄品种和栽培品种气孔活性差异的贡献。gydF4y2Ba
结论gydF4y2Ba
VvMYB60gydF4y2Ba可能是下游生物技术应用的有价值的目标。虽然葡萄是一种高产的适应水分胁迫的植物,但利用分子靶点工程或培育具有增强气孔反应的新品种是提高水分利用效率并可能减少病原体通过气孔渗透的一种有吸引力的方法[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].gydF4y2Ba
方法gydF4y2Ba
系统发育重建和自举分析gydF4y2Ba
使用基于ClustalW算法的AlignX的BLOSUM矩阵(间隙打开和扩展惩罚分别为10和5)进行对齐gydF4y2Ba®gydF4y2Ba模块来自Mega4 Software [gydF4y2Ba42gydF4y2Ba].在MEGA4中使用邻居连接法(neighbor Joining Method, NJ)构造了一棵有根树,并用MEGA3进行了验证。通过100个重复的自举分析评估树节点(成对删除、均匀率和泊松校正选项)。公开可用的序列通过NCBI从Genbank收集(gydF4y2Bahttp://www.ncbi.nlm.nih.gov/gydF4y2Ba).的完整编码序列所对应的cdnagydF4y2BaVvMYB30gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba分别从PN40024基因组DNA和叶片cDNA中扩增,采用以下引物组合:VvMYB30F1-VvMYB30R3和Vv60L2F4-Vv60L2R4(引物序列见下文)。gydF4y2Ba
葡萄器官野外取样及核酸提取gydF4y2Ba
葡萄藤(gydF4y2Ba葡萄gydF4y2Bal .简历。赤霞珠(Cabernet Sauvignon)是从智利Maipo山谷的一个商业葡萄园收集的,并在液氮中冷冻以提取RNA。对于葡萄莓皮和种子的取样,在果实发育期间,每两周从三株植物中收集9个葡萄串,从果坐果后两周开始,到果坐果后八周结束gydF4y2BaveraisongydF4y2Ba.从所有葡萄组织中分离总RNA,如所述[gydF4y2Ba43gydF4y2Ba].对于cDNA合成,使用StrataScript使用随机六聚体引物反转录1 μg总RNAgydF4y2Ba®gydF4y2Ba逆转录酶(Stratagene)根据制造商的说明。gydF4y2Ba
ABA和盐处理实验gydF4y2Ba
在ABA处理下,幼叶gydF4y2Ba葡萄gydF4y2Ba简历。赤霞珠是从两个月大的植株上剪下来的gydF4y2Ba在体外gydF4y2Ba分别置于添加50 μM、100 μM ABA(+/-)的培养皿中gydF4y2Ba独联体gydF4y2Ba,gydF4y2Ba反式gydF4y2Ba阿坝;SIGMA),溶解在100%乙醇中,或与等量的100%乙醇(模拟溶液)。在20°C的光照下(120 μmol mgydF4y2Ba-2gydF4y2Ba证券交易委员会gydF4y2Ba-1gydF4y2Ba),每两小时从每个处理中收集三片叶子用于RNA提取。gydF4y2Ba
对于盐处理,节外植体gydF4y2Ba葡萄gydF4y2Ba简历。将赤霞珠垂直放置在添加了3mm NaCl(标准)、100 mM NaCl或200 mM NaCl的无菌MS培养基上,并在生长室(20°C;16小时光周期)。实验结束后,收集完整的植株进行RNA提取。gydF4y2Ba
葡萄组织中基因表达的定量比较gydF4y2Ba
分离基因的相对转录定量是通过实时RT-PCR,使用BrilliantgydF4y2Ba®gydF4y2BaSYBRgydF4y2Ba®gydF4y2Ba绿色QPCR主试剂试剂盒(Stratagene)和Mx3000P检测系统(Stratagene),如制造商手册所述。引物qPCR_VvMYB30fw (5'-CTCAAGTCCCTCTCACAATG-3')、qPCR_VvMYB30rev (5'- tgtcaattaggtcttcttgttttgttc -3')、qPCR_VvMYB60fw (5'-TTGAGTACGAAAACCTGAATGAT-3')、qPCR_VvMYB60rev (5'- ggagggttgtgcttcttcttctgat -3')进行扩增和qPCR定量gydF4y2BaVvMYB30gydF4y2Ba(81 bp)和gydF4y2BaVvMYB60gydF4y2Ba(121 bp)。放大gydF4y2Ba泛素gydF4y2Ba(99 bp)或gydF4y2Ba甘油醛3-磷酸脱氢酶gydF4y2Ba(gydF4y2BaG3PDHgydF4y2Ba)基因进行归一化[gydF4y2Ba44gydF4y2Ba],这取决于它们在每个实验条件下的表达变化。根据Matus进行PCR条件、各基因标准定量曲线及相关基因表达量计算gydF4y2Ba等gydF4y2Ba.[gydF4y2Ba45gydF4y2Ba].gydF4y2Ba
拟南芥转基因系的质粒构建、生成和分析gydF4y2Ba
要生成gydF4y2BapVvMYB30:格斯gydF4y2Ba利用引物VvMYB30F3 (5'- aagcttctgacgcagttcaaccatc -3')和VvMYB30R4 (5'-TCTAGAGGTGGCCTCCCCTTGGCT-3'),从葡萄基因组DNA (Pinot noir, PN40024)中扩增出一个翻译起始密码子上游2173 bp的区域,该引物包含一个HindIII位点和一个XbaI位点。HindIII-XbaI片段克隆于gydF4y2BauidAgydF4y2BapBI101.3二进制矢量(Stratagene)的编码序列。同样,2239 bp假定gydF4y2BapVvMYB60:格斯gydF4y2Ba启动子用引物Vv60F3 (5'-AAGCTTATGAGAGGTCGTATAAGTA-3')和Vv60R3 (5'-TCTAGAGGCCTTCCTATGGCTT-3')扩增,引物中含有一个hinindiii位点,引物中含有一个XbaI位点,PCR片段在pBI101.3载体中克隆。的gydF4y2BaVvMYB30gydF4y2Ba用引物VvMYB30F1 (5'-GGATCCATGGGGAGGCCACCTTG-3')和VvMYB30R3 (5'-GATATCTAGAAGAGCTGAGCAGTGTCCT-3')扩增PN40024叶片cDNA,获得全长cDNA,该引物含有一个BamHI位点和一个EcoRV位点。全长gydF4y2BaVvMYB60gydF4y2Ba引物Vv60L2F4 (5'-GGATCCATGGGAAGGCCTCCTTGCTGTG-3')扩增cDNA,引物Vv60L2R4 (5'-GAGCTCTCAGAATATTGGAGAGAGTTGATCC-3')扩增cDNA,引物含有一个BamHI位点。扩增的cdna测序,然后克隆到pPZP221二进制载体的修改版本中,包含1.3 kbgydF4y2BaAtMYB60gydF4y2Ba推广人和gydF4y2Ba号gydF4y2Ba终结者(Galbiati,未出版)。中介绍了所有结构gydF4y2Ba拟南芥gydF4y2Ba(Col-0)gydF4y2Ba农杆菌属gydF4y2Ba-介导的转化,如所述[gydF4y2Ba22gydF4y2Ba].在含抗生素的培养基上选择转化系,用PCR方法确认转基因的存在。用于转基因表达分析,用RNeasy Mini Kit (Qiagen)分离总RNA,用RT Superscript II Kit (Invitrogen)反转录。采用引物对:Vv30F2 (5'-GGATCCATGGGAAGGCCTCCTTGCT-3')和Vv30R2 (5'-AAGTCTGACAGTGATGAGAGGAGC-3')进行了25个周期的半定量rt - pcr;Vv60F2 (5'-CTCCTTGCTGTGATAAAGTTGGTAT-3')和Vv60R2 (5'- attcaggttttttcgtactcaagaatg -3')。控制gydF4y2BaAtACTIN2gydF4y2Ba基因(At3g18780) [gydF4y2Ba46gydF4y2Ba]使用引物AtACT2F (5'-GTGTTGGACTCTGGAGATGGTGTG-3')和AtACT2R (5'-GCCAAAGCAGTGATCTCTTTGCTC-3')进行扩增。选择纯合子T3系进行GUS染色和功能互补分析。gydF4y2Ba
拟南芥生长、ABA处理及GUS表达分析gydF4y2Ba
种子在100ml商业漂白剂和3ml 37% HCl存在的密封室中表面消毒过夜,并在含有Murashige和Skoog培养基、1% w/v蔗糖和0.8% w/v琼脂的培养皿中发芽。在100 μmol m的光照条件下(光照16 h /暗8 h)生长gydF4y2Ba-2gydF4y2Ba证券交易委员会gydF4y2Ba-1gydF4y2Ba)在受控生长室中,温度为22°C。ABA处理:将植株转入添加3% w/v蔗糖和0.5 g/l MES的MS液体培养基中,添加100 μM ABA (+/-)gydF4y2Ba独联体gydF4y2Ba,gydF4y2Ba反式gydF4y2Ba阿坝;SIGMA),溶解在100%乙醇中,或与等量的100%乙醇(模拟溶液)。为了检测GUS活性,将组织在37℃、0.5 mg/ml x -葡萄糖醛酸、0.1% Triton X-100和0.5 mM铁氰胺中孵卵6小时,置于100 mM磷酸盐缓冲液中(pH为7)。用70%乙醇清除组织,使用徕卡M205 FA立体镜或徕卡DM2500光学显微镜检查。采用引物qPCR_GUSF1 (5'-TACGGCAAAGTGTGGGTCAATAATCA-3')和qPCR_GUSR1 (5'-CAGGTGTTCGGCGTGGTGTAGAG-3')对葡萄样品进行GUS表达的qPCR分析。GUS表达用对照归一化gydF4y2BaAtACTIN2gydF4y2Ba基因(At3g18780) [gydF4y2Ba46gydF4y2Ba],用引物qPCR_AtACT2fw (5'-TGCTTCTCCATTTGTTTGTTTC-3')和qPCR_AtACT2rev (5'-GGCATCAATTCGATCACTCA-3')扩增。gydF4y2Ba
气孔孔径和失水测量gydF4y2Ba
在30 mM KCl、10 mM MES-KOH、pH 6.5、22℃条件下光照(300 μmol mgydF4y2Ba-2gydF4y2Ba证券交易委员会gydF4y2Ba-1gydF4y2Ba) 4 h。用徕卡DM2500光学显微镜和LAS图像分析软件测量气孔孔径。对于干旱实验,种子在单独的罐子里发芽,每个罐子里都含有相同数量的预湿润土壤。植物定期灌溉20天。在停止浇水之前,罐子上盖上锡纸,以减少土壤的蒸发。每隔一天在同一时间称量罐子,持续18天。处理结束时,在65°C下干燥3天,以确定干重。含水量估计为[(WtgydF4y2BangydF4y2Ba-德国之声)/ (WtgydF4y2Ba0gydF4y2Ba-DW)] × 100,其中WtgydF4y2BangydF4y2Ba=第n天锅的总重量;DW =锅干重,WtgydF4y2Ba0gydF4y2Ba=第0天锅的总重量。gydF4y2Ba
参考文献gydF4y2Ba
Chaves M, Zarrouk O, Francisco R, Costa J, Santos T, Regalado A, Rodrigues M, Lopes C:亏灌下的葡萄:生理和分子数据的提示。学报学报,2010,105(5):661-676。10.1093 / aob / mcq030。gydF4y2Ba
唐尼M,杜库兹廉N, Krstic M:栽培实践和环境对葡萄和葡萄酒类黄酮组成的影响:最近的研究综述。中国生物医学工程学报,2006,27(3):357 - 366。gydF4y2Ba
罗维索罗,王晓明,张晓明,等:水分胁迫对葡萄全株水分导度和脱落酸根-茎流动的影响。植物学报,2002,29(5):1349-1356。gydF4y2Ba
罗德里格·ML, Chaves MM,温德勒R, David MM, Quick P, Leegood R, Stitt M, Pereira JS:水分胁迫下葡萄叶片渗透调节与碳同化的关系。中国植物学报,1993,20(3):309-321。10.1071 / PP9930309。gydF4y2Ba
Flexas J, Barón M, Bota J, Ducruet J, Gallé A, Galmés J, Jiménez M, Pou A, Ribas-Carbó M, Sajnani C,等:干旱葡萄杂种Richter-110 (V. berlandieri × V. rupestris)在水分胁迫适应和恢复过程中的光合限制。实验学报,2009,60(8):2361-2377。10.1093 / jxb / erp069。gydF4y2Ba
水胁迫下田间葡萄光合作用的气孔和非气孔限制。植物营养学报,1999,26(5):421-433。10.1071 / PP99019。gydF4y2Ba
王志强,王志强,王志强,等:植物保护细胞脱落酸信号与抗旱性的关系。自然科学,2001,42(1):1 - 4。10.1038 / 35066500。gydF4y2Ba
郭志刚,张志刚,张志刚,等:水稻叶片气孔运动与抗旱性的转录因子研究。中国生物工程学报,2010,1(1):1-5。10.4161 / trns.1.1.12428。gydF4y2Ba
谢忠,王磊,谢志刚,王志刚,王志刚,王志刚。植物气孔发育调控因子FLP/MYB88在非生物胁迫响应中的作用。植物学报,2010,32(5):344 - 344。10.1111 / j.1365 - 313 x.2010.04364.x。gydF4y2Ba
Cominelli E, Galbiati M, Vavasseur A, Conti L, Sala T, Vuylsteke M, Leonhardt N, Dellaporta SL, Tonelli C:一种调控气孔运动和植物耐旱性的保卫细胞特异性MYB转录因子。动物学报,2005,15(13):1196-1200。10.1016 / j.cub.2005.05.048。gydF4y2Ba
Velasco R, Zharkikh A, Troggio M, Cartwright DA, Cestaro A, Pruss D, Pindo M, FitzGerald LM, Vezzulli S, Reid J,等:一个杂合子葡萄品种基因组的高质量一致性序列。PloS ONE。2007, 2 (12): e1326-10.1371/journal. peer .0001326。gydF4y2Ba
Matus JT, aquaa F, Arce-Johnson P:葡萄MYB R2R3亚家族的分析揭示了葡萄和拟南芥基因组中与葡萄酒品质相关的扩展分支和保守的基因结构组织。中国生物医学工程学报,2008,8:(82)。gydF4y2Ba
Kranz HD, Denekamp M, Greco R, Jin H, Leyva A, Meissner RC, Petroni K, Urzainqui A, Bevan M, Martin C,等:拟南芥R2R3-MYB基因家族成员的功能特征分析。植物学报,1998,16(2):366 - 366。10.1046 / j.1365 - 313 x.1998.00278.x。gydF4y2Ba
王峰,连红,康春,杨华:光敏色素B参与介导红光诱导拟南芥气孔开放。分子植物学报,2010,3(1):246-259。10.1093 / mp / ssp097。gydF4y2Ba
Li L, Yu X, Thompson A, Guo M, Yoshida S, Asami T, Chory J, Yin Y:拟南芥MYB30是BES1的直接靶点,与BES1协同调控油菜素类固醇诱导的基因表达。植物学报,2009,32(2):366 - 366。10.1111 / j.1365 - 313 x.2008.03778.x。gydF4y2Ba
Raffaele S, Vailleau F, Leger A, Joubes J, Miersch O, Huard C, Blee E, Mongrand S, Domergue F, Roby D: MYB转录因子调节超长链脂肪酸生物合成,激活拟南芥超敏细胞死亡反应。植物学报,2008,20(3):752-767。10.1105 / tpc.107.054858。gydF4y2Ba
Seo P, Park C:拟南芥myb96介导的脱落酸信号通过促进水杨酸生物合成诱导病原菌抗性反应。植物保护学报,2010,36(2):471-483。10.1111 / j.1469-8137.2010.03183.x。gydF4y2Ba
徐萍,向芳,乔敏,朴杰,李艳,金松,李艳,朴伟,朴c:拟南芥MYB96转录因子在干旱胁迫响应中介导脱落酸信号。中国生物医学工程学报,2009,31(1):379 - 379。10.1104 / pp.109.144220。gydF4y2Ba
Agarwal M, Hao Y, Kapoor A, Dong CH, Fujii H,郑X,朱建科:一种R2R3型MYB转录因子参与CBF基因的低温调控和获得性耐寒性。中国生物医学工程学报,2006,29(4):457 - 457。10.1074 / jbc.M605895200。gydF4y2Ba
丁智,李松,安旭,刘霞,秦宏,王东:拟南芥MYB15转基因表达增强了对aba的敏感性和抗旱性。中国基因工程学报,2009,36(1):17-29。10.1016 / s1673 - 8527(09) 60003 - 5。gydF4y2Ba
梁杨,杜波,杜波,王晓明,王晓明,王晓明,王晓明,王晓明。拟南芥R2R3-MYB转录因子AtMYB61在拟南芥中的调控作用。动物学报,2005,15(13):1201-1206。10.1016 / j.cub.2005.06.041。gydF4y2Ba
Clough S, Bent A:花浸:农杆菌介导的拟南芥转化的简化方法。植物学报,1998,16(6):735- 738。10.1046 / j.1365 - 313 x.1998.00343.x。gydF4y2Ba
Plesch G, Ehrhardt T, Mueller-Roeber B: TAAAG元件的参与提示Dof转录因子在保护细胞特异性基因表达中的作用。植物学报,2001,28(4):455-464。gydF4y2Ba
Galbiati M, Simoni L, Pavesi G, Cominelli E, Francia P, Vavasseur A, Nelson T, Bevan M, Tonelli C:基因陷阱系鉴定拟南芥气孔保护细胞中表达的基因。植物学报,2008,32(5):366 - 366。10.1111 / j.1365 - 313 x.2007.03371.x。gydF4y2Ba
Pratelli R, Lacombe B, Torregrosa L, Gaymard F, Romieu C, Thibaud JB, Sentenac H:一种编码保护细胞K(+)通道的葡萄基因在葡萄果实中发挥发育调控作用。植物营养学报,2002,26(2):366 - 366。10.1104 / pp.010529。gydF4y2Ba
C闫辉,Y晓远,H坤,L美华,吉刚,G兆峰,L志强,Z云飞,肖晓,W晓明,Q晓明,等:拟南芥MYB转录因子超家族:与水稻MYB家族的表达分析及系统发育比较。植物分子生物学,2006,60(1):107-124。10.1007 / s11103 - 005 - 2910 - y。gydF4y2Ba
Dubos C, Stracke R, Grotewold E, Weisshaar B, Martin C, Lepiniec L:拟南芥MYB转录因子。植物科学进展,2010,15(10):573-581。10.1016 / j.tplants.2010.06.005。gydF4y2Ba
Waterhouse A:葡萄酒酚类物质。中国科学(d辑),2002,27(1):1-3。10.1111 / j.1749-6632.2002.tb02903.x。gydF4y2Ba
布兰科M,普林R,贝克E:葡萄果实气孔的结构和元素组成。植物营养学报,2004,18(4):357 - 357。gydF4y2Ba
Gambetta G, Matthews M, Shaghasi T, McElrone A, Castellarin S:糖和脱落酸信号同源物在葡萄成熟开始时被激活。植物学报,2010,32(1):319 - 319。10.1007 / s00425 - 010 - 1165 - 2。gydF4y2Ba
吴杰,权勇,金俊,卢华,洪松,李华:MYB60在干旱胁迫下拟南芥气孔调节和根系生长中的双重作用。植物分子生物学学报,2011,27(1):1- 3。10.1007 / s11103 - 011 - 9796 - 7。gydF4y2Ba
Winter D, Vinegar B, Nahal H, Ammar R, Wilson G, Provart N:用于探索和分析大规模生物数据集的“电子荧光象形文字”浏览器。公共科学学报,2007,2:e718-10.1371/journal.pone.0000718。gydF4y2Ba
Sieburth LE, Meyerowitz EM: AGAMOUS控制区的分子解剖显示,空间调节的顺式元件位于基因内。中国生物医学工程学报,1997,9(3):355- 366。gydF4y2Ba
Kim M, Kim H, Shin J, Chung C, Ohlrogge J, Suh M:芝麻微粒体油酸去饱和酶的种子特异性表达受SeFAD2启动子中负顺式调控元件和5'-UTR内含子中增强子的组合特性控制。中国生物医学工程学报,2006,27(4):351-368。10.1007 / s00438 - 006 - 0148 - 2。gydF4y2Ba
张志刚,张志刚,张志刚,张志刚,张志刚。拟南芥低氧胁迫下细胞优先级变化的研究进展。《美国国家科学院学报》上。2009, 106(44): 18843-18848。10.1073 / pnas.0906131106。gydF4y2Ba
金德伟,李士生,崔珊珊,袁sk,许玉凯,赵敏,朴毅,赵洪涛:不同根毛分布模式被子植物根毛细胞特异性顺式元件的功能保护。植物细胞学报,2006,18(11):2958-2970。10.1105 / tpc.106.045229。gydF4y2Ba
罗吉尔,李志强,李志强,李志强。夜间蒸腾作用对葡萄各向异性的影响。实验学报,2009,60(13):3751-3763。10.1093 / jxb / erp217。gydF4y2Ba
Deluc L, Quilici D, Decendit A, Grimplet J, Wheatley M, Schlauch K, Mérillon J, Cushman J, Cramer G:水分亏缺改变了影响赤霞珠和霞多丽葡萄果实重要风味和品质性状的代谢途径。中国生物医学工程学报,2009,29 (3):344 - 344gydF4y2Ba
舒尔茨H:水力结构的差异解释了两个大田栽培葡萄品种在干旱期间的近等水和各向异性行为。植物细胞环境学报,2003,26(8):1393-1405。10.1046 / j.1365-3040.2003.01064.x。gydF4y2Ba
Allegre M, Heloir MC, Trouvelot S, Daire X, Pugin A, Wendehenne D, Adrian M:葡萄气孔参与诱导性霜霉病的保护吗?植物与微生物相互作用,2009,22(8):977-986。10.1094 / mpmi - 22 - 8 - 0977。gydF4y2Ba
Pou A, Flexas J, Alsina Mdel M, Bota J, Carambula C, de Herralde F, Galmes J, Lovisolo C, Jimenez M, ribasc - carbo M,等:干旱对干旱适应葡萄杂种Richter-110 (V. berlandieri × V. rupestris)水分利用效率的调控。中国生物医学工程学报,2008,32(2):313-323。10.1111 / j.1399-3054.2008.01138.x。gydF4y2Ba
Tamura K, Dudley J, Nei M, Kumar S: MEGA4:分子进化遗传学分析(MEGA)软件版本4.0。分子生物学杂志,2007,10(8):1596-1599。gydF4y2Ba
Reid K, Olsson N, Schlosser J, Pengù F, Lund S:葡萄果实发育过程中实时RT-PCR内参基因的分析。中国生物医学工程学报,2006,6:27-10.1186/1471-2229-6-27。gydF4y2Ba
陈晓明,陈晓明,陈晓明,等:设拉子和霞多丽葡萄果实黄酮醇合成酶基因的表达及合成。德国葡萄酒,2003,9(2):110-121。10.1111 / j.1755-0238.2003.tb00261.x。gydF4y2Ba
Matus JT, Loyola R, Vega A, Pena-Neira A, bordu E, Arce-Johnson P, Alcalde JA: myb介导的葡萄果皮花青素和黄酮醇合成的转录调控实验学报,2009,60(3):853-867。10.1093 / jxb / ern336。gydF4y2Ba
Nishimura T, Yokota E, Wada E, Shimmen T, Okada K:一个干扰F-actin聚合的拟南芥ACT2显性阴性突变揭示了其在根发育中的独特功能。植物生理学报,2003,44(11):1131-1140。10.1093 /卡式肺囊虫肺炎/ pcg158。gydF4y2Ba
确认gydF4y2Ba
我们感谢Michael Handford(智利大学)对手稿进行了严格的审查。这项工作得到了FONDECYT 1100709、智利水果联盟、CORFO-Innova 07genome 01、植物功能基因组学千年细胞核(P06-009-F)、意大利“Progetto AGER, bando vitticoltura da Vino”(SERRES, 2010-2105)和意大利米兰Umberto Veronesi基金会il Progresso delle science的部分支持。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
作者的贡献gydF4y2Ba
MG和JTM参与了这项研究的构思,起草了手稿,进行了葡萄基因组搜索和MYB60样基因及其启动子序列的克隆。MG、PF、FR、LC和EC,对拟南芥转基因株系进行了生产和分析。JTM进行了系统发育研究,并与PC和CM一起进行了测试gydF4y2BaVvMYB60gydF4y2Ba而且gydF4y2BaVvMYB30gydF4y2Ba表达gydF4y2Ba葡萄gydF4y2Ba器官和实验条件。CT和PAJ参与了对手稿重要知识内容的批判性修改,并最终批准了即将出版的版本。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
Massimo Galbiati, José Tomás Matus对这项工作做出了同样的贡献。gydF4y2Ba
电子辅助材料gydF4y2Ba
12870 _2011_922_moesm1_esm.jpeggydF4y2Ba
附加文件1:推导的基因结构gydF4y2BaAtMYB60gydF4y2Ba,gydF4y2BaVvMYB30gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba.方框代表外显子,黑线代表内含子。ATG开始密码子的位置被指示(黑色箭头)。通过比较扩增的基因组片段和cDNA片段的序列,推导出外显子和内含子的基因组织和大小。黄色和绿色框分别代表编码R2和R3重复序列的外显子序列。(jpeg129kb)gydF4y2Ba
12870 _2011_922_moesm2_esm.jpeggydF4y2Ba
附加文件2:在NaCl浓度不断增加的条件下生长的葡萄苗的表型变化治疗开始一个月后拍照。(jpeg70 kb)gydF4y2Ba
12870 _2011_922_moesm3_esm.tiffgydF4y2Ba
附加文件3:gydF4y2Ba葡萄的活性gydF4y2BaVvMYB360gydF4y2Ba而且gydF4y2BaVvMYB60gydF4y2Ba携带启动子的拟南芥花和角果中的启动子:GUS融合gydF4y2Ba.(gydF4y2Ba一个gydF4y2Ba) GUS基因在gydF4y2BapVvMYB30:格斯gydF4y2Ba花位于心皮和柱头组织(箭头)。(gydF4y2BaBgydF4y2Ba)最gydF4y2BapVvMYB60:格斯gydF4y2Ba除了在花药花丝远端(箭头)有染色的两条独立系外,其余花均未表现出GUS活性。(gydF4y2BaCgydF4y2Ba)gydF4y2BapVvMYB60:格斯gydF4y2Ba角果在发育种子(Bars = 1 mm)中不表达GUS。(tiff 2mb)gydF4y2Ba
12870 _2011_922_moesm4_esm.jpeggydF4y2Ba
附加文件4:[A/T]AAAG基序在位于该基因翻译起始密码子上游的300 bp调控区中出现gydF4y2BaAtMYB60gydF4y2Ba,gydF4y2BaVvMYB30gydF4y2Ba,gydF4y2BaVvMYB60gydF4y2Ba而且gydF4y2BaVvSIRKgydF4y2Ba基因。+链上的[A/T]AAAG核苷酸以黄色突出显示,而-链上的[A/T]AAAG核苷酸以淡蓝色突出显示。预测的TATA方框以斜体显示并以绿色突出显示,ATG密码子以深蓝色突出显示。包含[A/T]AAAG基序簇的序列(定义见正文)以粗体和下划线显示。(jpeg390kb)gydF4y2Ba
12870 _2011_922_moesm5_esm.tiffgydF4y2Ba
附加文件5:gydF4y2Ba用于基因互补的转基因株系的生成和选择gydF4y2Baatmyb60-1gydF4y2Ba拟南芥突变体(gydF4y2Baatmyb60-C60gydF4y2Ba而且gydF4y2Baatmyb60-C30gydF4y2Ba)gydF4y2Ba.(gydF4y2Ba一个gydF4y2Ba)及(gydF4y2BaBgydF4y2Ba),互补测试中使用的结构的示意图表示(不按比例)。(gydF4y2BaCgydF4y2Ba)及(gydF4y2BaDgydF4y2Ba)、转基因基因表达的RT-PCR分析(gydF4y2BaVvMYB60gydF4y2Ba而且gydF4y2BaVvMYB30gydF4y2Ba)在三个独立的纯合子T3中转化gydF4y2Baatmyb60-1gydF4y2Ba行。(), lane 1 =gydF4y2Baatmyb60-C60-1gydF4y2Ba;2号车道=gydF4y2Baatmyb60-C60-2gydF4y2Ba;3号车道=gydF4y2Baatmyb60-C60-3gydF4y2Ba;4号车道=gydF4y2Baatmyb60-1gydF4y2Ba;5号道= dHgydF4y2Ba2gydF4y2Bao . (gydF4y2BaDgydF4y2Ba),道1 = dHgydF4y2Ba2gydF4y2BaO;2号车道=gydF4y2Baatmyb60-C30-1gydF4y2Ba;3号车道=gydF4y2Baatmyb60-C30-2gydF4y2Ba;4号车道=gydF4y2Baatmyb60-C30-3gydF4y2Ba;5号巷=gydF4y2Baatmyb60-1gydF4y2Ba.拟南芥的gydF4y2BaAtACTIN2gydF4y2Ba基因(At3g18780)作为对照。(tiff 7mb)gydF4y2Ba
作者提交的图片原始文件gydF4y2Ba
下面是作者提交的原始图片文件的链接。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(gydF4y2Bahttps://creativecommons.org/licenses/by/2.0gydF4y2Ba),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
加尔比亚提,M.,马图斯,j.t.,弗朗西亚,P.。gydF4y2Baet al。gydF4y2Ba葡萄保卫细胞相关的转录因子VvMYB60参与气孔活动的调控,在ABA和渗透胁迫下表达差异。gydF4y2BaBMC植物生物学gydF4y2Ba11,gydF4y2Ba142(2011)。https://doi.org/10.1186/1471-2229-11-142gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/1471-2229-11-142gydF4y2Ba
关键字gydF4y2Ba
- 保卫细胞gydF4y2Ba
- 贝瑞皮肤gydF4y2Ba
- AtMYB60基因gydF4y2Ba
- 葡萄基因gydF4y2Ba
- VvMYB60基因gydF4y2Ba