- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
橄榄雌蕊发育过程中钙行为的全器官分析(gydF4y2Ba齐墩果欧洲公司gydF4y2Ba作为一种工具来确定植物有性繁殖的关键事件gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba11gydF4y2Ba, 文章编号:gydF4y2Ba150gydF4y2Ba(gydF4y2Ba2011gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
雌蕊是其中发生不同的类型,产地,和功能的细胞之间的多种相互作用的地方。CagydF4y2Ba2+gydF4y2Ba是植物和动物的关键信号分子之一。尽管有许多关于CA的研究gydF4y2Ba2+gydF4y2Ba期间花粉雌蕊相互作用,其构成的植物生理学的主要议题之一,研究对Ca信令gydF4y2Ba2+gydF4y2Ba花形成过程中雌蕊的动态很少。本研究的目的是分析研究的内容gydF4y2Ba原位gydF4y2BaCa的本地化gydF4y2Ba2+gydF4y2Ba在整个花卉发育过程中,在橄榄雌蕊的整个器官水平。gydF4y2Ba
结果gydF4y2Ba
结果表明,Ca含量发生了显著变化gydF4y2Ba2+gydF4y2Ba橄榄雌蕊发育过程中的水平和分布。在花蕾中,最低水平的可检测的CagydF4y2Ba2+gydF4y2Ba被观察到。随着花卉开发,加利福尼亚州gydF4y2Ba2+gydF4y2Ba雌蕊数量依次增加,在花药开裂后达到最高。当花药和花瓣凋落时,雌蕊各部分的钙含量显著下降,但没有完全下降。gydF4y2Ba原位gydF4y2BaCagydF4y2Ba2+gydF4y2Ba定位显示在柱头上的逐渐积累,并且朝向风格进一步膨胀和花药开裂后卵巢。在花后阶段,钙gydF4y2Ba2+gydF4y2Ba信号柱头表面上减少,但在钙卵巢特定累积仅观察到在四个胚珠中的一个。超微结构定位证实Ca的存在gydF4y2Ba2+gydF4y2Ba在胞内基质中,并通过柱头乳头分泌的渗出物。gydF4y2Ba
结论gydF4y2Ba
这是第一个分析橄榄雌蕊发育过程中钙含量的报告。根据我们的结果gydF4y2Ba原位gydF4y2Bafluo - 3am注射钙定位是跟踪被子植物雌蕊发育过程中雌蕊成熟程度和有性生殖钙依赖事件空间组织的有效工具。Ca的逐渐增加gydF4y2Ba2+gydF4y2Ba橄榄雌蕊由我们开发出池时反映雌蕊成熟程度。CagydF4y2Ba2+gydF4y2Ba花朵开花的分布反映了花粉 - 耻骨相互作用,刺激相,施肥和耻骨衰老的钙的时空关系。gydF4y2Ba
背景gydF4y2Ba
花的发育导致了功能性雄性和雌性生殖器官的形成(分别是花药和雌蕊)。在花期,花完全开放,花药开裂,释放花粉粒。当花粉粒落在接受花粉的柱头上并发芽,形成一个花粉管并通过雌蕊的孢子体组织生长时,就开始了受精期。最后,花粉管到达雌配子体,释放2个精子细胞,与胚囊的目标细胞融合,实现双受精。这个过程的结果是形成二倍体胚和三倍体胚乳,构成种子。因此,雌蕊是不同类型、起源和功能的细胞之间发生多种相互作用的地方[gydF4y2Ba1gydF4y2Ba].gydF4y2Ba
钙以游离、松散结合和结合阳离子的混合物的形式存在于生物体内。Ca的不同状态gydF4y2Ba2+gydF4y2Ba与它在细胞代谢中的活性密切相关[gydF4y2Ba2gydF4y2Ba那gydF4y2Ba3.gydF4y2Ba].约束的池gydF4y2Ba2+gydF4y2Ba是不可溶解的,主要用作结构成分。松散绑定的CagydF4y2Ba2+gydF4y2Ba池具有较低的亲和力,是大多数细胞类型中钙的主要形式[gydF4y2Ba3.gydF4y2Ba].这个加利福泳池gydF4y2Ba2+gydF4y2Ba通常位于细胞壁和细胞细胞器中或与使用CA的特定蛋白质相关联gydF4y2Ba2+gydF4y2Ba作为辅酶或调节CA.gydF4y2Ba2+gydF4y2Ba浓度(gydF4y2Ba4.gydF4y2Ba].免费加利福尼亚州gydF4y2Ba2+gydF4y2Ba是动植物体内的关键信号分子之一[gydF4y2Ba5.gydF4y2Ba],并参与多种信号转导途径,这些途径是许多细胞间和细胞内相互作用的基础[gydF4y2Ba6.gydF4y2Ba那gydF4y2Ba7.gydF4y2Ba].gydF4y2Ba
钙在progamic阶段起着花粉雌蕊相互作用的重要作用[gydF4y2Ba8.gydF4y2Ba].研究钙gydF4y2Ba2+gydF4y2Ba花粉管生长过程中的信号传递有很多,是植物生理学的主要课题之一[gydF4y2Ba9.gydF4y2Ba].迄今为止,已经证明了CAgydF4y2Ba2+gydF4y2Ba是花粉正常萌发、花粉管生长、花粉管引导和配子融合的关键因子[gydF4y2Ba10gydF4y2Ba-gydF4y2Ba13gydF4y2Ba].因此,已经证明,生长花粉管占用的CagydF4y2Ba2+gydF4y2Ba来自培养基的离子[gydF4y2Ba14gydF4y2Ba和CagydF4y2Ba2+gydF4y2Ba离子积聚在花粉管的顶区,形成了特性尖端到基部梯度gydF4y2Ba15gydF4y2Ba].在雌蕊中,最佳CAgydF4y2Ba2+gydF4y2Ba花粉萌发所需的浓度由柱头提供[gydF4y2Ba16gydF4y2Ba-gydF4y2Ba19gydF4y2Ba].大多数关于CA角色的研究gydF4y2Ba2+gydF4y2Ba在花期开始时,在雌蕊中进行[gydF4y2Ba19gydF4y2Ba-gydF4y2Ba22gydF4y2Ba].然而,对CA的研究gydF4y2Ba2+gydF4y2Ba花形成过程中雌蕊的动态很少。gydF4y2Ba
CA的荧光成像gydF4y2Ba2+gydF4y2Ba得到广泛应用,主要是在动物细胞中,通过使用不同的荧光探针[gydF4y2Ba23gydF4y2Ba].最常用的装入Ca的技术gydF4y2Ba2+gydF4y2Ba-敏感染料在植物样品中的应用有载酸法、电穿孔法和微注射法[gydF4y2Ba24gydF4y2Ba-gydF4y2Ba26gydF4y2Ba].然而,上述方法的主要局限性如下:(1)样品中染料的应用面积相对较小,仅限于单细胞,(2)细胞壁中存在酯酶,可能水解染料酯[gydF4y2Ba27gydF4y2Ba那gydF4y2Ba28gydF4y2Ba].到目前为止,唯一的研究成功加载了CAgydF4y2Ba2+gydF4y2Ba-敏感染料注入整个植物器官gydF4y2Ba等gydF4y2Ba.[gydF4y2Ba28gydF4y2Ba].他们分析了Ca的胞内定位gydF4y2Ba2+gydF4y2Ba完整的小麦根系中含有氟-3的乙酰氧甲基酯。gydF4y2Ba
到目前为止有关于橄榄雌蕊钙行为的报道。这项研究的目的是分析的内容和免费本地化和钙的松散结合池gydF4y2Ba2+gydF4y2Ba在橄榄的雌蕊中,从前后花病后期开始。以前,我们提供了橄榄雌蕊组织的详细细胞学和组织学描述[gydF4y2Ba29gydF4y2Ba那gydF4y2Ba30.gydF4y2Ba].橄榄的雌蕊由湿柱头、实心花柱和双房子房组成,每房室有2个胚珠。然而,只有一个胚珠(或两个在特殊情况下)将被受精,因为大多数橄榄种子只有一个胚胎[gydF4y2Ba31gydF4y2Ba].我们还报告了此处的成功注射了CAgydF4y2Ba2+gydF4y2Ba- 敏感染料Fluo-3进入花序作为一个有用的工具gydF4y2Ba原位gydF4y2BaCagydF4y2Ba2+gydF4y2Ba定位在完整的雌蕊。gydF4y2Ba
结果gydF4y2Ba
实验设计gydF4y2Ba
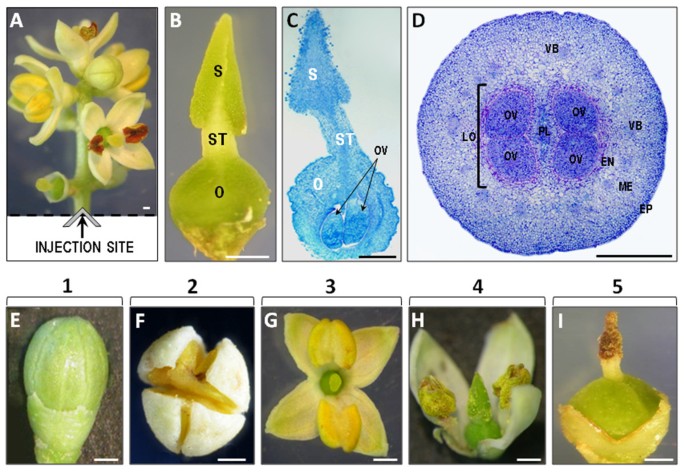
原位gydF4y2Ba检测到CA.gydF4y2Ba2+gydF4y2Ba将fluo - 3am染料直接注射在切开部位的花序梗上,如图所示gydF4y2Ba1gydF4y2Ba.在每个发育阶段,雌蕊由双裂的湿柱头组成;一个简短的风格;和一个圆形的卵巢(图gydF4y2Ba1 bgydF4y2Ba).卵巢包围2个loculi分离通过大幅胎盘,并且每个loculus包含2个胚珠(图gydF4y2Ba1 cgydF4y2Ba和gydF4y2Ba1 dgydF4y2Ba).在花的物候混合居群中,我们选择了橄榄花的5个主要发育阶段进行进一步的实验(图gydF4y2Ba1E-IgydF4y2Ba):绿色芽(第1阶段;图gydF4y2Ba1 egydF4y2Ba);开放的花朵(阶段2;数字gydF4y2Ba1 fgydF4y2Ba);开放的花,花瓣最近分开;可见雌蕊和黄色,鼓胀,和完整的花药(第3期;数字gydF4y2Ba1克gydF4y2Ba);开放的花有开裂的花药(阶段4;数字gydF4y2Ba1 hgydF4y2Ba);没有花盆和花瓣的花朵(第5阶段;图gydF4y2Ba1我gydF4y2Ba).gydF4y2Ba
实验设计和材料厂gydF4y2Ba.(A)实验设计:荧光CagydF4y2Ba2+gydF4y2Ba指示剂是直接注射到花序梗后,刚刚从树上收获。(B)从开放花中收获的橄榄雌蕊的形态(阶段2)。(C)经固定和亚甲基蓝染色后的开放花成熟雌蕊的纵切面。(D)花药开裂的成熟雌蕊经固定和亚甲基蓝染色后的子房横切面。gydF4y2Ba(E-IgydF4y2Ba用立体显微镜观察橄榄花的发育阶段。(E)第1阶段,绿花蕾;(F)第2阶段,花朵开放;(G)第3期,开放的花具鼓胀的黄色花药;(H)第4期,开放的花具开裂的花药;(I)第5期,花无花药和花瓣,柱头褐色,子房厚。EN -内果皮,EP -表皮,ME -中果皮,O -子房,OV -胚珠,LO -房室,P -胎座,S -柱头,ST -花柱,VB -维管束。条= 0.5毫米。gydF4y2Ba
CagydF4y2Ba2+gydF4y2Ba橄榄花发育过程中花器官的含量gydF4y2Ba
比较雌蕊CagydF4y2Ba2+gydF4y2Ba与花的其他部分相关,我们分析了CagydF4y2Ba2+gydF4y2Ba橄榄花发育的全过程。CagydF4y2Ba2+gydF4y2Ba成份(μg·微升gydF4y2Ba-1gydF4y2Ba)的分离花器官的提取物如图所示gydF4y2Ba2gydF4y2Ba.在绿花蕾期(阶段1),雌蕊,花药,和花瓣含有类似的低量的CagydF4y2Ba2+gydF4y2Ba,除花萼处钙含量略高外(图gydF4y2Ba2gydF4y2Ba).当萼片变成白色(第2阶段),CA池gydF4y2Ba2+gydF4y2Ba在所分析的花器官相似,在之前的发育阶段观察到的(图gydF4y2Ba2gydF4y2Ba).然而,Ca有所下降gydF4y2Ba2+gydF4y2Ba观察花萼的含量。当花完全开放(第3期)时,雌蕊中Ca含量显著升高gydF4y2Ba2+gydF4y2Ba比其他花器官(图gydF4y2Ba2gydF4y2Ba).与以前的发育阶段相比,雌蕊Ca增加了2倍以上gydF4y2Ba2+gydF4y2Ba在这个阶段观察到池。在花药开裂的时候(第4期),约为1gydF4y2Ba2+gydF4y2Ba雌蕊中的内容是所有花卉器官中最高的(图gydF4y2Ba2gydF4y2Ba).与绿芽期(第2阶段)相比,钙含量增加了6倍以上,与花药膨胀期(第3阶段)相比,钙含量增加了3倍以上gydF4y2Ba2+gydF4y2Ba也发现了在花药中(图gydF4y2Ba2gydF4y2Ba),而在花瓣和花萼中,与第3阶段没有显着差异(图gydF4y2Ba2gydF4y2Ba).花药损失(第5阶段),在钙强烈降低之后gydF4y2Ba2+gydF4y2Ba含量在剩余的花器官中所示,除了花萼,其在钙遭受轻微增加gydF4y2Ba2+gydF4y2Ba浓度(图gydF4y2Ba2gydF4y2Ba).对于雌蕊,这种减少超过与所发现的比较在阶段4 3倍。gydF4y2Ba
的变化在橄榄雌蕊的Ca的更详细的分析gydF4y2Ba2+gydF4y2Ba池是使用雌蕊的分离部分进行的:耻辱的风格和卵巢(图gydF4y2Ba2 bgydF4y2Ba).在第一阶段,Ca的最低池gydF4y2Ba2+gydF4y2Ba,具有相似的CAgydF4y2Ba2+gydF4y2Ba在两个雌蕊部分(柱头与花柱和子房),观察到。在花的开花期(从第2期到第4期),CagydF4y2Ba2+gydF4y2Ba池逐渐增加,并在花药裂开后达到最大值(第4阶段)。在最新分析的阶段(第5阶段)显着降低了CAgydF4y2Ba2+gydF4y2Ba在雌蕊(柱头和花柱)的上部被观察到的水平,并在卵巢(图gydF4y2Ba2 bgydF4y2Ba).gydF4y2Ba
荧光原位检测CagydF4y2Ba2+gydF4y2Ba在橄榄雌蕊gydF4y2Ba
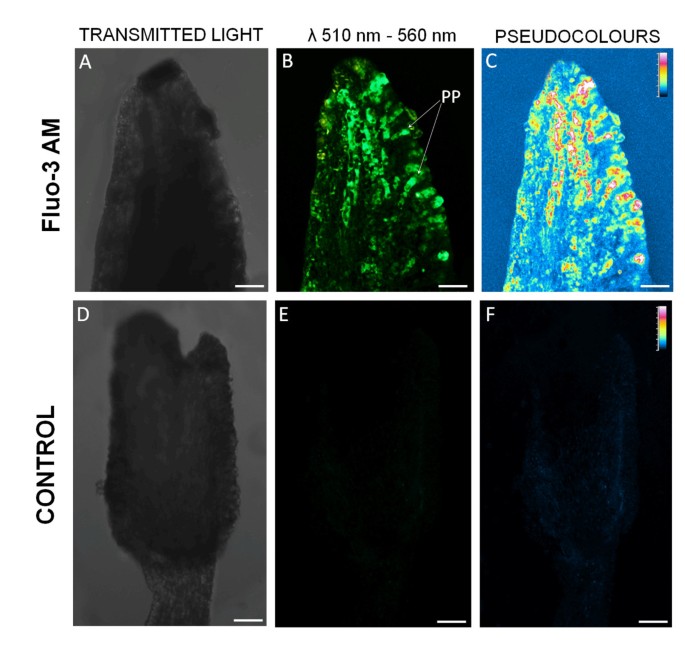
为了沿着橄榄雌蕊中的自由钙离子的动态,荧光指示剂Fluo-3M直接注入花序。为了确认存在于掺入的Fluo-3 AM的情况下,将橄榄雌蕊发出的荧光与从对照章节中取出的雌蕊的注入的尾圈进行比较(图gydF4y2Ba3.gydF4y2Ba).共聚焦显微镜下的详细分析显示,经fluo - 3am处理的雌蕊与对照雌蕊的信号水平存在显著差异。注射fluo - 3am后柱头表面可见绿色荧光,大部分附着在乳头细胞上(图)gydF4y2Ba3 cgydF4y2Ba).控制雌蕊是几乎不含绿色荧光(图gydF4y2Ba3 d-fgydF4y2Ba).gydF4y2Ba
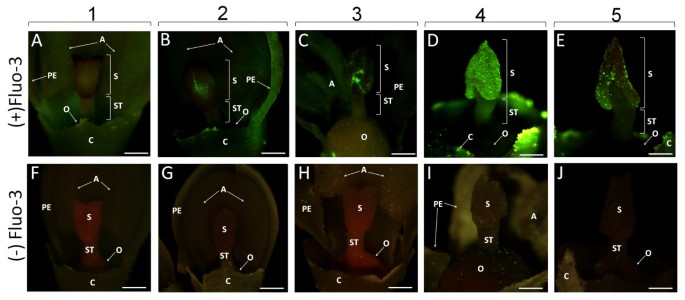
最初,CagydF4y2Ba2+gydF4y2Ba使用ePiforegence立体显微镜分析开发雌蕊的外部部分的分布。在橄榄花发育的不同阶段分析的所有样品都显示出相同的荧光模式(图gydF4y2Ba4.gydF4y2Ba).绿色花蕾的雌蕊(阶段1)几乎没有荧光信号(图)gydF4y2Ba4gydF4y2Ba).在第2阶段,我们观察到仅位于耻骨表面的某些区域的绿色信号(图gydF4y2Ba4B.gydF4y2Ba).在凝结花茎(第3阶段)的露天花中,绿色荧光在耻骨表面上更加膨胀,但荧光模式不均匀(图gydF4y2Ba4CgydF4y2Ba).在花药开裂(第4阶段),强烈的绿色荧光延伸到柱头的完整表面(图gydF4y2Ba4D.gydF4y2Ba).当橄榄花失去花瓣和花药时(第5阶段),荧光标记仅在柱头表面的某些区域观察到(图)gydF4y2Ba4EgydF4y2Ba).对照花的雌蕊或其他花部分未观察到绿色荧光(图)gydF4y2Ba4 f jgydF4y2Ba).gydF4y2Ba
钙的检测gydF4y2Ba2+gydF4y2BaFluo-3 AM在橄榄花发育过程中对雌蕊的影响gydF4y2Ba.在蓝光下使用立体显微镜(488nm)获得图像。上行中的显微照片显示从注入的花序[(+)Fluo-3]中取出的芽/花,而下则从每个相应的发育阶段显示控制芽/花[( - )氟-3]。(a)绿色花蕾(第1阶段):颗粒中实际上没有标记存在。(b)白花芽(第2阶段):标签出现在耻骨表面的一些区域。(c)与镀川花的花朵(第3阶段):可区分的绿色荧光位于颗粒的外部。(d)具有解除阴茎的花(第4阶段):强标签分布在整个柱形表面。绿色荧光也从溜癖组织发出。(e)没有萼片和花瓣的花(第5阶段):标记仅限于耻骨表面的小区域。(F-J)检测的发展阶段的控制(1-5)。 No green fluorescence can be detected in any analyzed stage. A - anthers, C - calyx, O - ovary, PE - petals, S - stigma, ST - style. Bars = 0.5 mm.
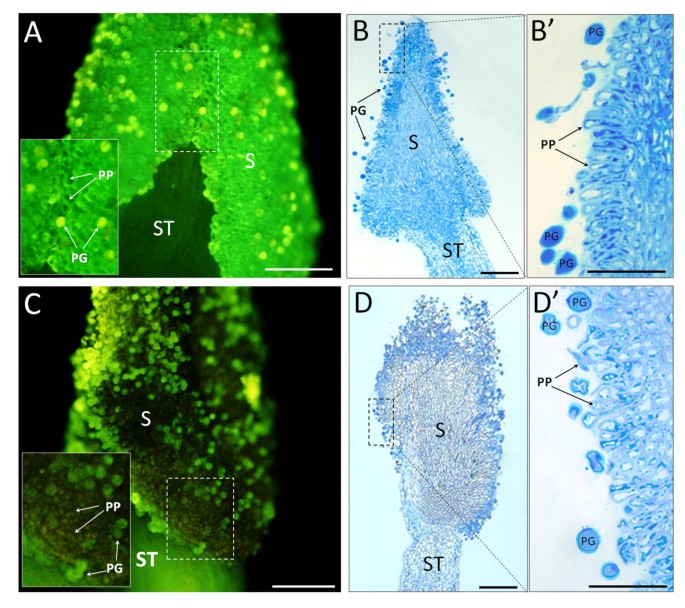
在阶段4和5,它们是对性植物繁殖事件高度显著在开花植物,还进行雌蕊所并入的Fluo-3 AM的本地化的更详细的分析(图gydF4y2Ba5.gydF4y2Ba和gydF4y2Ba6.gydF4y2Ba).花药开裂后(第4阶段),整个柱头表面显示强烈的绿色标记,与乳头细胞表面相关(图)gydF4y2Ba5AgydF4y2Ba,插图)。用亚甲基蓝色的组织化学染色证实,在该阶段,柱头由径向定向的乳头细胞组成,并用花粉晶体覆盖,使浅荧光呈黄色表面的一些区域(图gydF4y2Ba5B.gydF4y2Ba和gydF4y2Ba5B”gydF4y2Ba).阴性对照的花粉外壁总是发出黄色的自荧光(未显示)(图)gydF4y2Ba5AgydF4y2Ba).在花瓣脱落后(第5阶段),绿色荧光的强度大大降低,仅局限于柱头表面的一些外围部分(图)gydF4y2Ba5CgydF4y2Ba).在这个阶段,乳头状变性发生,如亚甲基蓝染色部分所观察到(图gydF4y2Ba5DgydF4y2Ba和gydF4y2Ba5D”gydF4y2Ba).gydF4y2Ba
CagydF4y2Ba2+gydF4y2Ba橄榄花开发的阶段4和5的外柱区域的本地化(右侧面板)和结构特征(左侧面板)gydF4y2Ba.(a)在与软化的阴茎(第4阶段)的花中,在整个授粉耻辱的表面存在强标记。在更高的放大率(插图)下,可以观察到大部分标记以厚层的形式附着在乳头状细胞上。柱塞上存在的花粉晶粒的淡黄色荧光是可见的。(B和B')柱形表面由外部取向的,真空的乳头细胞组成。耻骨上存在许多花粉颗粒。(c)在没有萼片和花瓣(第5阶段)的花的雌蕊中,一些乳头细胞存在弱标记。在附着于柱形表面的花粉晶粒中观察到淡黄色荧光。(D和D')可以在整个柱形表面上观察到乳头细胞的退化。许多花粉晶体仍然附着在耻骨表面上。 Bars = 100 μm.
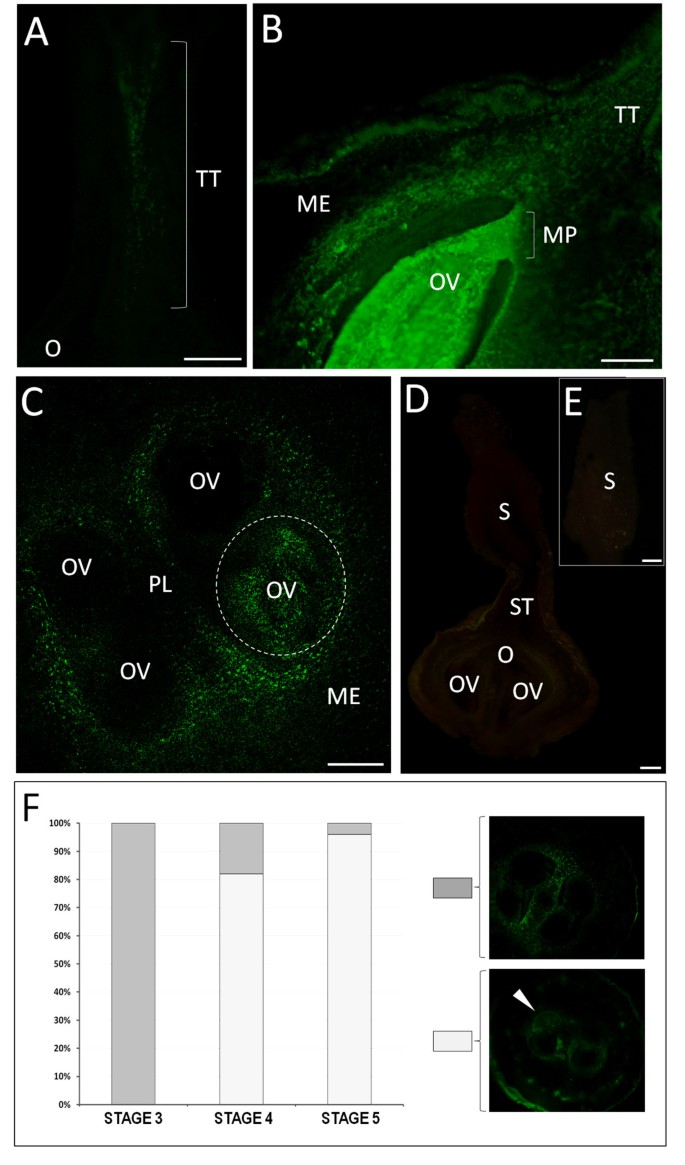
CagydF4y2Ba2+gydF4y2Ba从花药开裂的花中雌蕊内部的检测gydF4y2Ba.(A)在纵向切口样式,绿色荧光的累积存在于发射束的面积。(B)在所述下花柱和子房,标记位于发射道和周围的loculus;更强的绿色荧光是定位于胚珠的整个区域,从珠孔区域开始。(C)横向卵巢部分。强烈绿色荧光是在区域直接包围2个loculi并且仅在存在于卵巢(标有虚线区域)4个胚珠1可见。其余的胚珠显示无信号。(d)控制反应。在一个不与的Fluo-3喷射的纵向切口雌蕊,没有绿色荧光可以在雌蕊的任何部分来检测。(E)控制的雌蕊柱头。 No green fluorescence is present in the papillae cells or in the attached pollen grains. ME - mesocarp, MP - micropylar region, O - ovary, OV - ovule, PG - pollen grain, PL - placenta, S - stigma, ST - style, TT - transmitting tract. Bars = 100 μm. (F) Graph comparing the percentage of ovaries where none of the ovules showed labelling with those where specific accumulation of Ca2+gydF4y2Ba在第3、4、5期的4颗胚珠中,只有1颗被发现。gydF4y2Ba
在雌蕊第4期的花柱中,沿着传递组织的标记最强烈,而其余花柱组织的染色较低(图4)gydF4y2Ba6AgydF4y2Ba和gydF4y2Ba6B.gydF4y2Ba).在子房中,最强的信号是从珠孔区开始的胚珠gydF4y2Ba6B.gydF4y2Ba).在横向切割卵巢观察的Fluo-3AM定位模式的显着特点,在阶段4和5(图gydF4y2Ba6CgydF4y2Ba).在子房的4个胚珠中,只有1个可见到绿色荧光(图)gydF4y2Ba6CgydF4y2Ba,以虚线标示的区域)。强烈的标记也出现在直接围绕2腔室和内果皮区域。在对照反应中,从注射溶液中忽略了荧光-3 AM染料,结果显示雌蕊的任何部分都没有荧光(图)gydF4y2Ba6D.gydF4y2Ba和gydF4y2Ba6e.gydF4y2Ba).在第4期的20个子房中有16个子房有flu3 - am,在第5期的20个子房中有19个子房有flu3 - amgydF4y2Ba6f.gydF4y2Ba).gydF4y2Ba
钙的超微结构定位gydF4y2Ba2+gydF4y2Ba在发展中雌蕊的柱头组织gydF4y2Ba
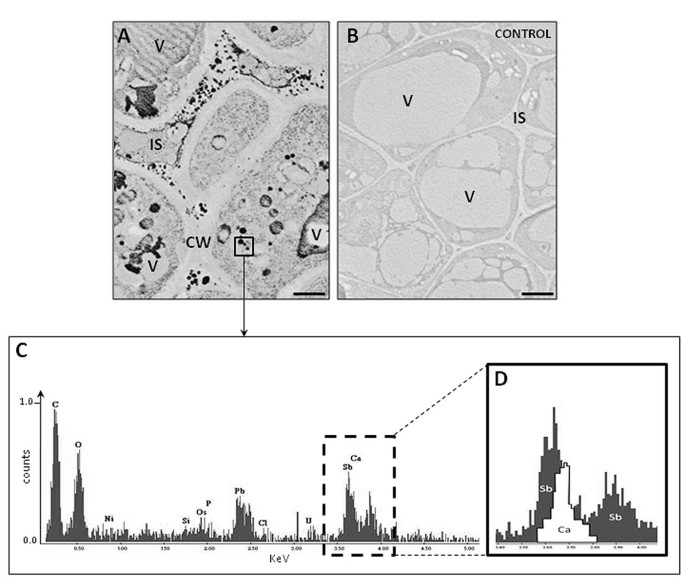
研究钙的亚细胞分布gydF4y2Ba2+gydF4y2Ba离子,我们使用焦锑酸盐的方法,这是用来定位自由和松散结合的钙。该方法在橄榄雌蕊不同组织的细胞中发现了许多电子致密的沉淀物。沉淀主要分布在大液泡和细胞间隙(图)gydF4y2Ba7AgydF4y2Ba).在没有添加焦锑酸盐的固定材料的控制部分,电子密度的沉淀物没有发生(图)gydF4y2Ba7B.gydF4y2Ba).能量色散X射线光谱(EDX)显示的Sb和Ca的峰高电子密度的析出物为基础的分析(图gydF4y2Ba7C.gydF4y2Ba和gydF4y2Ba7D.gydF4y2Ba),证实这些沉淀包括Ca[Sb(OH)]gydF4y2Ba6.gydF4y2Ba]gydF4y2Ba2gydF4y2Ba,聚锑酸盐技术的反应产物。gydF4y2Ba
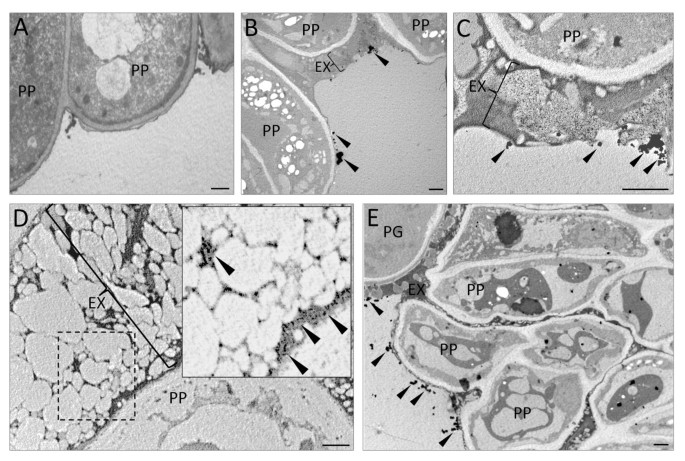
特别有趣的是沉淀的发展雌蕊的柱头表面上的分布。在绿色花蕾,没有可检测到的CagydF4y2Ba2+gydF4y2Ba离子在乳头细胞以及在柱头表面(图观察gydF4y2Ba8AgydF4y2Ba).在花分脉开始(第2阶段)开始,我们发现乳头细胞的外表面上的一些电子致密沉淀物和耻骨渗出物(图gydF4y2Ba8B.gydF4y2Ba).当花朵开放时(第3阶段),乳头渗出层中有丰富的细而厚的沉淀物(图)gydF4y2Ba8CgydF4y2Ba).在花药开裂时,当渗出液丰富时,在非均匀的渗出液基质上观察到大量的Ca/Sb沉淀(图)gydF4y2Ba8D.gydF4y2Ba).花瓣和花药脱落后(第五阶段),乳突细胞表面出现沉淀,可见明显的退化迹象(图5)gydF4y2Ba8EgydF4y2Ba).gydF4y2Ba
CA的亚细胞定位gydF4y2Ba2+gydF4y2Ba在发育橄榄雌蕊的耻骨表面gydF4y2Ba.(A)柱头包围在绿色花芽(阶段1)的雌蕊的表面。没有电子致密沉淀物所用的柱头表面上或在乳头细胞中找到。(B)在花开放(阶段2)的开头柱头乳头:几的Ca /锑的析出物是局部乳头细胞壁(箭头)的外表面上。(C)柱头一个完全开放的花与肿胀花药的乳头(阶段3):具有丰富电子致密沉淀物渗出物厚层存在于外柱头表面上。(d)一富渗出物层的放大区域(插图,标有虚线区域)柱头表面上存在于花药开裂(阶段4)的时间。众多,小的Ca /锑沉淀物位于仅在所述流出物(箭头)的电子致密基体。(E)在一个花的花瓣没有和花药(阶段5)柱头,钙/锑沉积物较不丰富的和主要存在退化乳头细胞和花粉粒(箭头)的表面上;PG - 花粉粒,PP - 乳头细胞,EX - 渗出物。条= 1微米。gydF4y2Ba
讨论gydF4y2Ba
在这里,我们使用荧光显微镜gydF4y2Ba原位gydF4y2BaCa的本地化gydF4y2Ba2+gydF4y2Ba在氟-3次注射到花序后完整橄榄雌蕊中的离子。Fluo-3 Am,类似于其他钙指示剂(如来自Fura系列或Indo-1)的其他钙指标,必须引入检查的细胞中,并且该步骤是测量细胞内Ca的先决条件gydF4y2Ba2+gydF4y2Ba利用显微成像技术。为了将这种染料注入完整的雌蕊中,我们将氟-3溶液直接注入橄榄的花序中。到目前为止,这是第一个使用Ca的报告gydF4y2Ba2+gydF4y2Ba- 乙酰氧基甲基酯形式的染料,以跟随CAgydF4y2Ba2+gydF4y2Ba行为在植物生殖器官。橄榄雌蕊的细胞内的染料的存在指示如下内容:(1)的染料溶液的用量为足以穿透花序梗,全花和花器官的组织。(2)引入到花序组织的Fluo-3酯的浓度是足够的,以消除由细胞壁水解酶的Fluo-3的酯水解的先前报告的潜在的问题[gydF4y2Ba27gydF4y2Ba那gydF4y2Ba28gydF4y2Ba].gydF4y2Ba
据我们所知,文献中没有关于Ca的报道gydF4y2Ba2+gydF4y2Ba在Angiosperms开发期间,整个雌蕊的内容。大多数关于CA的研究gydF4y2Ba2+gydF4y2Ba在雌蕊组织中,集中于全成熟时期,并且经常限制在雌蕊的定义部分,特别是耻辱和卵巢[gydF4y2Ba4.gydF4y2Ba那gydF4y2Ba16gydF4y2Ba那gydF4y2Ba21gydF4y2Ba那gydF4y2Ba32gydF4y2Ba].gydF4y2Ba
众所周知,CAgydF4y2Ba2+gydF4y2Ba参与多种细胞内和细胞间的信号传导途径[gydF4y2Ba2gydF4y2Ba那gydF4y2Ba33gydF4y2Ba].在橄榄花发育的早期阶段分析(1级),钙的水平gydF4y2Ba2+gydF4y2Ba相当低。这可能是因为在这个阶段花蕾紧闭和任何外部生物和非生物因素几乎隔绝。此外,在这个阶段,花芽的主要任务是完成花药和雌蕊的生长和成熟。因此,在花芽的柱头的信号传导事件的强度是低的。如在花发育进展发生,从而导致逐渐花瓣变白和花开口(阶段2),增加钙gydF4y2Ba2+gydF4y2Ba观察到水平,与其在耻辱中的外观并行。在这个时候橄榄花的发展,我们观察到以下内容:(1)乳头基细胞和(2)脂质,果胶,阿拉伯半乳酰蛋白的积累和耻骨组织中的其他组分的开始的开始[gydF4y2Ba29gydF4y2Ba那gydF4y2Ba30.gydF4y2Ba].耻骨组织的代谢活性的这种增加需要加强信令事件,其中CAgydF4y2Ba2+gydF4y2Ba被认为是关键人物。在花发育的这个阶段,我们发现Ca/Sb沉淀在柱头细胞的液泡中以及它们之间的细胞内空间中积累。柱头表面是花粉与柱头之间进行信号交换的主要场所。CagydF4y2Ba2+gydF4y2Ba离子在接受柱头中比在非接受表面中更丰富[gydF4y2Ba16gydF4y2Ba那gydF4y2Ba34gydF4y2Ba-gydF4y2Ba36gydF4y2Ba].钙的最高水平gydF4y2Ba2+gydF4y2Ba在授粉时在橄榄柱组织中观察到积累。因为在橄榄中,耻辱受接受性与授粉时间密切相关,我们的结果支持CA之间的正相关gydF4y2Ba2+gydF4y2Ba橄榄液中柱塞渗出物和接受状态的水平[gydF4y2Ba30.gydF4y2Ba].因此,我们提出掺入氟-3AM的荧光强度的级别可以用作耻骨接收度的潜在标记。gydF4y2Ba
CA的强烈减少gydF4y2Ba2+gydF4y2Ba在雌蕊发育的最后阶段,雌蕊的聚集与柱头组织的降解是一致的。柱头的衰变是花衰老过程的第一步,该过程涉及结构、生化和分子变化,导致程序性细胞死亡(PCD) [gydF4y2Ba37gydF4y2Ba-gydF4y2Ba39gydF4y2Ba].花的衰老也被认为是由包括钙离子在内的几个信号通路调控的gydF4y2Ba2+gydF4y2Ba.Ca的存在gydF4y2Ba2+gydF4y2Ba在花期结束时柱头分泌物中可能提示该阳离子对衰老过程的开始是必要的[gydF4y2Ba39gydF4y2Ba].的确,塞拉诺gydF4y2Ba等gydF4y2Ba.[gydF4y2Ba40gydF4y2Ba]报道,在橄榄花发育的最新阶段,一旦耻辱完全棕色,乳头虫细胞由于花粉和乳头柱细胞之间的不相容性反应而表现出PCD症状。在我们看来和根据我们的结果,乳头细胞死亡是其发展方案和加利福尼亚州的后果gydF4y2Ba2+gydF4y2Ba在这些细胞中观察到的积累可能是耻辱期间的PCD标志之一。gydF4y2Ba
在花柱钙显著变化gydF4y2Ba2+gydF4y2Ba在花药开裂时(第4阶段)也观察到CagydF4y2Ba2+gydF4y2Ba在风格中标记与耻骨和授粉的接受阶段暂时相关,因为耻辱表面被许多花粉颗粒覆盖。它支持传输组织在CA中的参与gydF4y2Ba2+gydF4y2Ba输送花粉管生长。众所周知,花粉管的生长需要钙gydF4y2Ba2+gydF4y2Ba来自胞外环境的离子gydF4y2Ba体外gydF4y2Ba和gydF4y2Ba体内gydF4y2Ba条件(gydF4y2Ba22gydF4y2Ba那gydF4y2Ba41gydF4y2Ba].的确,CagydF4y2Ba2+gydF4y2Ba在风格中曾经报道过gydF4y2Ba矮牵牛织布达gydF4y2Ba[gydF4y2Ba18gydF4y2Ba]和在烟草[gydF4y2Ba19gydF4y2Ba].钙的含义gydF4y2Ba2+gydF4y2Ba在花粉管生长并在progamic阶段的指导也已报道在其他物种[gydF4y2Ba7.gydF4y2Ba那gydF4y2Ba22gydF4y2Ba那gydF4y2Ba19gydF4y2Ba那gydF4y2Ba42gydF4y2Ba那gydF4y2Ba43gydF4y2Ba].在已经授粉的花朵(第5阶段),耻辱和溜溜溜山池gydF4y2Ba2+gydF4y2Ba与第4阶段相比,相比之下减少了较低的可检测的CAgydF4y2Ba2+gydF4y2Ba沿着橄榄花柱的繁殖过程表明此时花粉管通过花柱组织的生长已经完成。gydF4y2Ba
钙的最显着特点gydF4y2Ba2+gydF4y2Ba在卵巢中观察到在授粉(阶段4)和受精(阶段5)的时间在橄榄雌蕊分布。CagydF4y2Ba2+gydF4y2Ba观察到特异性积累在卵巢中存在的四个胚珠之一中,而剩余的胚珠显示出没有标记。在第4阶段的卵巢中超过80%的卵巢和阶段50%以上的卵巢观察到这种定位模式。已经确定了微水含有高水平的CAgydF4y2Ba2+gydF4y2Ba,与生育力密切相关,可能充当用于生长花粉管引诱[gydF4y2Ba4.gydF4y2Ba].在gydF4y2Ba尼古利亚娜gydF4y2Ba和gydF4y2Ba石墨gydF4y2Ba, CagydF4y2Ba2+gydF4y2Ba当花粉管到达时,珠孔区域的浓度达到峰值[gydF4y2Ba32gydF4y2Ba那gydF4y2Ba44gydF4y2Ba].Chudzik和Snieżko [gydF4y2Ba45gydF4y2Ba]提出这样的Ca积累gydF4y2Ba2+gydF4y2Ba可以用作胚珠接收性的标记。实际上,在第4阶段,gydF4y2Ba原位gydF4y2Ba胚珠钙的积累gydF4y2Ba2+gydF4y2Ba从珠孔区开始观察。然而,这种特殊的“单胚珠”CagydF4y2Ba2+gydF4y2Ba标签仍然在花发育的花后级(5级)当大多数的鲜花被成功受精的观察。根据前述观察,在橄榄只有1或2(在特殊情况下)胚珠受精[gydF4y2Ba31gydF4y2Ba,我们认为观测到的CagydF4y2Ba2+gydF4y2Ba本地化模式可能表明哪些胚珠将受精或已经受精。gydF4y2Ba
众所周知,导致果实形成的受精后事件包括组织发育方案的变化,这致力于不同类型细胞之间的连续交换信号[gydF4y2Ba46gydF4y2Ba].CagydF4y2Ba2+gydF4y2Ba已经被证明在卵细胞活化等过程中起着关键作用[gydF4y2Ba20.gydF4y2Ba那gydF4y2Ba47gydF4y2Ba,配子融合[gydF4y2Ba20.gydF4y2Ba那gydF4y2Ba48gydF4y2Ba或胚囊变性[gydF4y2Ba44gydF4y2Ba那gydF4y2Ba49gydF4y2Ba].鉴于此,我们建议钙gydF4y2Ba2+gydF4y2Ba荧光可以用作多卵巢中受精胚珠的特定标志物。然而,钙水平在这种卵子受精后可以保持高,因此需要进一步的实验来阐明哪种解释是正确的。gydF4y2Ba
结论gydF4y2Ba
本报告描述如下首次:(i)所述的Ca动力学gydF4y2Ba2+gydF4y2Ba在雌蕊发育的整个器官水平;(ii)特定的CagydF4y2Ba2+gydF4y2Ba子房中只有一个胚珠的标记,可能是即将受精或已经受精的;(iii)柱头衰老与Ca密切相关gydF4y2Ba2+gydF4y2Ba离子;和(iv)引入Ca标签gydF4y2Ba2+gydF4y2Ba-敏感染料作为花期柱头接受能力的有用标记。综上所述,我们建议Ca的逐渐增加gydF4y2Ba2+gydF4y2Ba结果表明,在橄榄雌蕊发育过程中,CagydF4y2Ba2+gydF4y2Ba在器官水平上的分布可以作为植物有性生殖发生在雌蕊的基本事件的标记(图)gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
花序采集于2010年和2011年5、6月gydF4y2Ba齐墩果欧洲公司gydF4y2BaL.树木,简历。皮革,种植在格拉纳达省(西班牙)。仅使用5种选择的开发阶段的完美花(伴随着雌蕊和雄蕊)进行实验。gydF4y2Ba
雌蕊,花药,花瓣,花萼从花蕾解剖/花这些发育阶段,立即用液氮冷冻,并储存在-80℃。此外,对于分析研究,从不同的发育阶段雌蕊分成两个部分,柱头风格和卵巢,用刀片。将该物质冷冻并储存在-80℃。gydF4y2Ba
钙的定量gydF4y2Ba2+gydF4y2Ba内容gydF4y2Ba
CagydF4y2Ba2+gydF4y2Ba使用钙比色测定试剂盒(BioVision, Mountain View, CA)测定含量,并遵循制造商的说明。简单地说,将每个不同发育阶段的花器官(带有花柱的柱头、子房、花药、花瓣或花萼)的10mg用试剂盒提供的50 μl钙检测缓冲液均质。样品在10000 ×离心gydF4y2BaggydF4y2Ba,并用于进一步的实验上清液。根据制造商的说明,20μl的每种样品与设置有在96孔板中的试剂盒中的试剂一起温育。Ca量gydF4y2Ba2+gydF4y2Ba采用BioRad iMark Microplate Reader (Bio-Rad, Hercules, CA, USA)测量,以每孔575 nm的光密度(OD)表示。加上清20 μl,每孔充超纯水至终体积150 μl。以对照组在575 nm处的OD值为背景。最后一个CagydF4y2Ba2+gydF4y2Ba剂量根据制造商的方案计算,并以μg / μl的样品给出。使用已知量的钙制备了标准曲线gydF4y2Ba2+gydF4y2Ba标准包括在试剂盒中。三个独立的实验使用2010和2011(N = 6)的花期期间收集材料上进行。计算平均值和标准偏差值,并用SigmaPlot软件(SYSTAT,软件,德国)绘制。gydF4y2Ba
染料注入gydF4y2Ba
CagydF4y2Ba2+gydF4y2Ba敏感的荧光染料fluo-3AM(在二甲亚砜[DMSO] 1-1mM溶液)购自Invitrogen(分子探针,Eugene,OR,USA)购买。20μM的Fluo-3AM酯,0.1%(V / V)的Nonidet P-40(西格玛奥德:完整的花序(长度,2〜3厘米)刚刚从橄榄树收获后,用含有如下的溶液中立即注入Aldricht,圣路易斯,MI,USA),和超纯水。所述的Fluo-3AM酯从1mm的Fluo-3AM的在DMSO中的储备溶液加入。在培养液中的最终DMSO浓度为约1%(V / V)。注射直接进入做在切割位点的花序梗,如图gydF4y2Ba1gydF4y2Ba.通过使用微注射器(体积,200μl)和细针(直径,60μm)(Bionovo,Legnica,Poland),在Leica epfloorespercorcopemM165FC(Leica Microsystems GmbH,Germany)下进行整体注射程序。进入每个花序,注射100μl染料溶液。用100μl含有1%DMSO(v / v)的100μl溶液,0.1%Nonidet P-40(v / v)和超纯水注入控制样品。在培养皿中在含有超纯水浸泡的滤纸中,在室温下在室温下孵育2小时。从花序中沉积到注射部位的花蕾和花,并使用显微镜作为整体或纵向或横向部分进行分析。从两个连续开花季节的每个发展阶段的十个芽/花卉被用来分析。gydF4y2Ba
光学显微镜gydF4y2Ba
雌蕊在4%多聚甲醛(w/v)和2%戊二醛(v/v)中固定,在0.1 M cacodylate buffer (pH 7.5)中,4℃过夜。固定后,在卡可酯缓冲液中洗涤数次,在乙醇系列中脱水,在-20°C紫外光下包埋在Unicryl树脂中。半薄切片(1 μm)采用Reichert-Jung ultra tracut E切片机。切片置于biobon涂层载玻片上,用0.05% (w/v)亚甲基蓝和0.05% (w/v)甲苯胺蓝混合染色,分析雌蕊各发育阶段的组织学特征[gydF4y2Ba50.gydF4y2Ba].使用蔡司Axioplan (Carl Zeiss, Oberkochen, Germany)显微镜进行观察。显微照片使用progress C3数码相机和progress CapturePro 2.6软件(Jenoptic, LaserOptic Systems GmbF, Germany)获得。gydF4y2Ba
表面荧光和激光共聚焦扫描显微镜gydF4y2Ba
FLUO-3荧光通过使用落射荧光立体显微镜(莱卡M165FC;徕卡,斯海姆,德国)激发后监测用的光的波长460-500配备有由徕卡成像软件控制的数字相机(徕卡,斯海姆,德国).发射的荧光在510nm以上的波长进行检测。自体荧光(主要由于叶绿素和其它颜料和次级代谢物的存在下),分离,并以红色显示。使用Nikon C1共聚焦显微镜(Nikon,日本)用Ar-488激光源和不同水平的倍率(4×〜20×)获得的雌蕊组织内的Fluo-3荧光的高清晰度图像。小针孔尺寸(30μm)的组合使用有低倍率,干目标。光学切片捕获为Z系列图像并处理使用软件EZ-C1金版本2.10构建240(尼康)。在的510-560纳米的发射波长范围内只得到的荧光信号,并记录在绿色。gydF4y2Ba
钙的超微结构定位gydF4y2Ba2+gydF4y2Ba
CagydF4y2Ba2+gydF4y2Ba定位是cytochemically通过使用罗德里格斯加西亚和Stockert [的焦锑法分析在雌蕊组织gydF4y2Ba51.gydF4y2Ba].雌蕊在含5% (w/v)焦锑酸钾[(KgydF4y2Ba2gydF4y2BaHgydF4y2Ba2gydF4y2Ba某人gydF4y2Ba2gydF4y2Ba)7·4hgydF4y2Ba2gydF4y2BaO]和2%(w / v)锇氧化锇在pH 7.5时。固定后,将雌蕊组织在乙醇系列中脱水并嵌入EPON树脂中。使用超薄的微电机(Reichert-Jung,Germany)获得超薄部分,并安装在200目的涂层镀镍网上。雌蕊固定相同,但在没有聚酰氨酸的情况下,用作对照。使用JEM-1011透射电子显微镜(JEOL,Japan)进行观察。gydF4y2Ba
焦锑沉淀存在于超薄上碳涂覆的镍网格部分配备在格拉纳达大学,格拉纳达,西班牙的科学仪器中心的能量色散X射线(EDX)检测器的STEM PHILIPS CM20显微镜下检查。gydF4y2Ba
缩写gydF4y2Ba
- 问:gydF4y2Ba
-
乙酰氧基甲基gydF4y2Ba
- DMSO溶液:gydF4y2Ba
-
二甲亚砜gydF4y2Ba
- OD:gydF4y2Ba
-
光密度gydF4y2Ba
- 纤毛运动:gydF4y2Ba
-
程序性细胞死亡。gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
花粉-雌蕊的相互作用。在植物生理学百科全书。卷17。编辑:Linskens HF, Heslop-Harrison J. new series,施普林格,Berlin;1984:508 - 608。gydF4y2Ba
- 2.gydF4y2Ba
植物细胞中的钙调控及其在信号转导中的作用。植物营养与肥料学报,1995,26(6):591 - 598。10.1146 / annurev.pp.46.060195.000523。gydF4y2Ba
- 3.gydF4y2Ba
赵Ĵ,郁FL,梁SP,周C,杨HY:在卵细胞,合子和水稻两种单细胞原胚钙分布的变化(gydF4y2Ba栽培稻gydF4y2Bal .)。植物研究,2000,14:331-337。gydF4y2Ba
- 4.gydF4y2Ba
葛丽丽,谢春涛,田海清,田海清:被子植物受精过程中钙的功能和分布。中国生物医学工程学报。2007,31(4):457 - 461。10.3732 / ajb.94.6.1046。gydF4y2Ba
- 5。gydF4y2Ba
Putney JW:钙信号CRC压力机;2006年,ISBN-13:978-0-8493-2783-4。gydF4y2Ba
- 6。gydF4y2Ba
主勋爵,罗素SD:植物授粉和施肥机制。ANN Rev Cell Dev Biol。2002,18:81-105。10.1146 / annurev.cellbio.18.012502.083438。gydF4y2Ba
- 7。gydF4y2Ba
Boavida LC,维埃拉AM,贝克尔JD,费若JA:配子体的相互作用和有性繁殖:植物是如何使一个受精卵。int j dev biol。2005年,49:615-632。10.1387 / ijdb.052023lb。gydF4y2Ba
- 8。gydF4y2Ba
王志强,王志强:钙在植物受精中的作用。细胞生物学杂志。2006,2:244-253。gydF4y2Ba
- 9。gydF4y2Ba
Holdaway-Clarke TL,Hepler PK:对花粉管的控制增长:离子梯度和助焊剂的作用。新植物。2003,159:539-563。10.1046 / J.1469-8137.2003.00847.x。gydF4y2Ba
- 10.gydF4y2Ba
Malhó R, Read ND, Pais MS, Trewavas AJ:胞质游离钙在po\ len管生长重定向中的作用。植物学报1994,5:331-341。10.1111 / j.1365 - 313 x.1994.00331.x。gydF4y2Ba
- 11.gydF4y2Ba
Hepler PK:花粉管顶端生长:钙引导。植物科学进展,1997,2:79-80。10.1016 / s1360 - 1385(97) 88385 - 9。gydF4y2Ba
- 12.gydF4y2Ba
张刚,刘志强,刘志强。开花植物有性生殖过程中的钙信号。植物生理学杂志,1997,1:75-83。gydF4y2Ba
- 13.gydF4y2Ba
Antoine AF,Faure Je,Dumas C,FeijóJA:细胞质CA的差异贡献gydF4y2Ba2+gydF4y2Ba和CagydF4y2Ba2+gydF4y2Ba涌入配子融合和蛋激活玉米。自然细胞生物。2001年,3:1120-1123。10.1038 / ncb1201-1120。gydF4y2Ba
- 14.gydF4y2Ba
Jaffe La,Weisenseel MH,Jaffe LF:花粉管不断增长的尖端内钙积累。J细胞BIOL。1975,67:488-492。10.1083 / JCB.67.2.488。gydF4y2Ba
- 15.gydF4y2Ba
皮尔森ES,米勒DD,DA卡拉汉,范阿肯Ĵ,克特G,赫普勒PK:花粉管生长过程中提示本地化钙进入波动。Dev Biol。1996年,174:160-173。10.1006 / dbio.1996.0060。gydF4y2Ba
- 16。gydF4y2Ba
bednarska e:通过在樱草属officinalis l中发芽花粉从耻辱的钙吸收。gydF4y2Ba假叶树gydF4y2Ba《植物学报》1991,4:36-38。gydF4y2Ba
- 17。gydF4y2Ba
王志强,王志强。矮牵牛花粉-雌蕊相互作用的钙离子研究。II。CA的本地化gydF4y2Ba2+gydF4y2Ba离子和钙gydF4y2Ba2+gydF4y2Ba- atp酶在未授粉的雌蕊。细胞生物学杂志。1995,33:43-52。gydF4y2Ba
- 18。gydF4y2Ba
王志强,王志强。矮牵牛花粉-雌蕊相互作用的钙离子研究。3CA的本地化gydF4y2Ba2+gydF4y2Ba-ATP酶授粉雌蕊。的Folia Cytochem Cytobiol。1995年,33:125-132。gydF4y2Ba
- 19。gydF4y2Ba
葛丽丽,谢春涛,田海清,黄志强:烟草花粉萌发和花柱中钙离子的分布。植物学报,2009,22:87-96。10.1007 / s00497 - 009 - 0094 - 3。gydF4y2Ba
- 20.gydF4y2Ba
Digonnet C,Aldon d,勒杜克N,迪马C,Rougier L:在受精花植物钙瞬变的第一个证据。发展。1997年,124:2867至2874年。gydF4y2Ba
- 21.gydF4y2Ba
克里斯托夫ZO,IMIR T,伊姆雷·K:授粉受精过程中蓝猪耳胚珠钙分布的变化。原生质。1999年,208:149-155。10.1007 / BF01279085。gydF4y2Ba
- 22.gydF4y2Ba
赵军,杨海英,Lord EM:百合花柱传粉后钙水平升高。acta botanica sinica(云南植物研究),2004,16:259-263。10.1007 / s00497 - 003 - 0193 - 5。gydF4y2Ba
- 23.gydF4y2Ba
Paredes RM,Etzler JC,Watts LT,Zheng W,Lechleiter JD:化学钙指标。方法。2008,46:143-151。10.1016 / J.YMET.2008.09.025。gydF4y2Ba
- 24.gydF4y2Ba
Callaham da,Hepler PK:植物细胞中游离钙的测量。细胞钙:一种实用的方法。编辑:McCormack JG,COBBOLD PH。1991年,牛津大学出版社,纽约,383-410。gydF4y2Ba
- 25.gydF4y2Ba
阅读ND, Allan WTG, Knight H, Knight MR, Malho R, Russell A, Shacklock PS, Trewavas AJ:植物和真菌细胞胞质游离钙的成像和测量。北京航空航天大学学报(自然科学版)。10.1111 / j.1365-2818.1992.tb01507.x。gydF4y2Ba
- 26.gydF4y2Ba
在高等植物中,钙离子作为细胞内的第二信使。Adv Bot Res. 1996, 22: 45-96。gydF4y2Ba
- 27.gydF4y2Ba
软木RJ:用五重峰-2 AM的应用,在植物细胞的细胞质测量游离钙问题。植物细胞环境。1986年,9:157-160。10.1111 / j.1365-3040.1986.tb01580.x。gydF4y2Ba
- 28。gydF4y2Ba
张文华,Rengel Z,郭杰:细胞内钙的测定gydF4y2Ba2+gydF4y2Ba在完整小麦根的细胞中:低温下氟-3的乙酰氧基甲基酯加载。工厂J.998,15:147-151。10.1046 / J.1365-313x.1998.00188.x。gydF4y2Ba
- 29。gydF4y2Ba
Serrano I, Suárez C, Olmedilla A, Rapoport HF, Rodríguez-García MI:橄榄雌蕊的结构组织和细胞化学特征(gydF4y2Ba齐墩果欧洲公司gydF4y2BaL.)CV。皮夸尔在花期。性别植物精华2008年,21:99-111。10.1007 / s00497-008-0075-γ。gydF4y2Ba
- 30.gydF4y2Ba
苏亚雷斯C:Caracterizaciónestructuralêhistoquímica德尔pistilo杜兰特LA FASEprogámicaËimplicación德pectinasŸ的AGP连接拉斯Interacciones银行POLEN,pistilo恩gydF4y2Ba齐墩果欧洲公司gydF4y2Ba博士论文,西班牙格拉纳达大学;2009。gydF4y2Ba
- 31.gydF4y2Ba
拉波鲍特HF:锦城ÿmorfología。在萨尔瓦多cultivo德尔橄榄。5版。Editedby:巴兰科d,费尔南德斯埃斯科瓦尔R,拉略L.安达卢西亚委员会ý芒迪-新闻报,安达卢西亚;2004:37-62。gydF4y2Ba
- 32.gydF4y2Ba
田海平,田海平,田海平gydF4y2Ba烟草gydF4y2BaL.足底。1997年,202:93-105。10.1007 / s004250050107。gydF4y2Ba
- 33.gydF4y2Ba
Trewavas A, Malhó R: CagydF4y2Ba2+gydF4y2Ba信号在植物细胞:大网络!CurrOp植物BIOL。1998年,1:428-433。10.1016 / S1369-5266(98)80268-9。gydF4y2Ba
- 34.gydF4y2Ba
李志强,李志强,李志强,等gydF4y2Ba2+gydF4y2Ba离子未授粉和授粉湿(gydF4y2Ba矮牵牛织布达gydF4y2Ba园艺。)和无水(gydF4y2BaHaemanthus albiflosgydF4y2Bal .)耻辱。acta botanica sinica(云南植物研究),2005,43(4):449 - 454。gydF4y2Ba
- 35.gydF4y2Ba
张金生,杨海英,朱丽,童华:向日葵柱头、花柱和珠孔中钙的超细胞化学定位。植物学报,1995,37:691-696。gydF4y2Ba
- 36.gydF4y2Ba
张金生,杨海英,朱丽,童华:棉花雌蕊花粉管轨迹中钙的超细胞化学定位。植物学报。1997,39:121-125。gydF4y2Ba
- 37.gydF4y2Ba
Lovell Ph,Lovell PJ,Nichols R:矮子在矮牵牛衰老中耻辱的重要性(gydF4y2Ba矮牵牛织布达gydF4y2Ba).安·伯特。1987,60:41-47。gydF4y2Ba
- 38.gydF4y2Ba
关键词:矮牵牛(Petunia),花衰老,抗衰老作者简介:林志刚,1987年生。gydF4y2Ba
- 39.gydF4y2Ba
花衰老的整合信号。概述。植物学报。2007,2:437-445。10.4161 / psb.2.6.4991。gydF4y2Ba
- 40。gydF4y2Ba
不亲和花粉和柱头乳头细胞的程序性细胞死亡标志gydF4y2Ba齐墩果欧洲公司gydF4y2BaL.自由授粉。植物营养与肥料学报,2010,29(4):531 - 534。10.1007 / s00299 - 010 - 0845 - 5。gydF4y2Ba
- 41.gydF4y2Ba
Brewbaker JL,Kwack BH:钙离子在花粉萌发和花粉管生长中的重要作用。我是J机器人。1963年,50:859-865。10.2307 / 2439772。gydF4y2Ba
- 42.gydF4y2Ba
毛建强,陈媛媛,苗艳:花粉管生长途径中的钙离子定位gydF4y2Ba芸苔栗鸟gydF4y2Ba.ACTA博特仙。1992年,34:233-236。gydF4y2Ba
- 43.gydF4y2Ba
富兰克林-童VE:授粉中的信号传递。植物生态学报。1999,2:490-495。10.1016 / s1369 - 5266(99) 00017 - 5。gydF4y2Ba
- 44.gydF4y2Ba
田海红,朱洪,罗素德:黄花菊胚珠和胚囊中钙的变化gydF4y2Ba石墨zeylanicagydF4y2BaL.性植物代表2000,13:11-20。10.1007 / PL009837。gydF4y2Ba
- 45.gydF4y2Ba
钙离子的存在是薄珠状胚珠接受能力的一个特征gydF4y2Ba雪花莲gydF4y2BaActa bioologica sinica, 2003, 45: 133-141。gydF4y2Ba
- 46.gydF4y2Ba
Hiscock SJ,艾伦AM:多种细胞信号通路调节花粉柱头相互作用:寻求共识。新植物。2008年,179:286-317。10.1111 / j.1469-8137.2008.02457.x。gydF4y2Ba
- 47.gydF4y2Ba
利用图像分析和共聚焦激光扫描显微镜技术研究玉米离体卵细胞、融合产物和受精卵的特征。受精卵。1995,3:57-64。gydF4y2Ba
- 48.gydF4y2Ba
福雷JE,Digonnet C,大仲马C:一个gydF4y2Ba体外gydF4y2Ba系统为玉米配子的粘接和熔接。科学。1994年,263:1598年至1600年。10.1126 / science.263.5153.1598。gydF4y2Ba
- 49.gydF4y2Ba
Christensen CA,戈尔希希,棕色RH,琼斯LG,Brown J,Shaw MJ Drews GN:拟南芥中的Synergid细胞死亡需要线粒体GFA2。植物细胞。2002,14:2215-2232。10.1105 / TPC.002170。gydF4y2Ba
- 50。gydF4y2Ba
汉弗莱CD Pittman FE:一种简单的亚甲基蓝蓝色li碱性品红染色用于环氧包埋组织切片。生物技术组织化学。1974,49:9-14。10.3109 / 10520297409116929。gydF4y2Ba
- 51。gydF4y2Ba
Rodríguez-García MI, Stockert JC:植物细胞核仁中焦锑酸盐-锇反应产物的定位。中国科学:地球科学,2003,21(4):457 - 461。10.1016 / s0022 - 5320(79) 80018 - 0。gydF4y2Ba
确认gydF4y2Ba
这项工作得到了Consejería de Innovación、Ciencia y Empresa de la prix de Andalucía和Fondo Europeo de Desarrollo Regional (FEDER)在“Proyectos de Excelencia”框架下的支持[P06-AGR- 01791和P10-CVI5767]。西班牙科学与创新部也通过该项目[AGL2008-00517]为这项研究提供了基础,并向J.D.R. KZ提供了奖学金。KZ还感谢CSIC提供了JAE-DOC资助。我们感谢肯奇塔Martínez-Sierra提供的出色技术援助。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
附加信息gydF4y2Ba
作者的贡献gydF4y2Ba
MIRG构思了这项研究。JDA和AJC监督了实验。KZ和JDR进行了实验,并对本文做出了同样的贡献。CS进行了组织化学研究。六位作者讨论了研究结果并编写了手稿。所有作者阅读并批准了最终的手稿。gydF4y2Ba
作者的原始提交的图像文件gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(gydF4y2Bahttps://creativecommons.org/licenses/by/2.0.gydF4y2Ba),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
Zienkiewicz, K., Rejón, j.d., Suárez, C。gydF4y2Baet al。gydF4y2Ba橄榄雌蕊发育过程中钙行为的全器官分析(gydF4y2Ba齐墩果欧洲公司gydF4y2BaL.)作为确定性植物繁殖中关键事件的工具。gydF4y2BaBMC植物BIOL.gydF4y2Ba11,gydF4y2Ba150(2011)。https://doi.org/10.1186/1471-2229-11-150gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
公认gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/1471-2229-11-150gydF4y2Ba
关键字gydF4y2Ba
- 花粉管gydF4y2Ba
- 植物的器官gydF4y2Ba
- 花药开裂gydF4y2Ba
- 丑恶的表面gydF4y2Ba
- Micropylar地区gydF4y2Ba