摘要
背景
提高α-生育酚含量是提高作物营养价值的重要育种目标。已经进行了一些努力来提高大豆中α-生育酚的含量[甘氨酸最大(l)稳定。]through transgenic technology by overexpressing genes related to α-tocopherol biosynthesis or through changes to crop management practices. Varieties with high α-tocopherol content have been identified in soybean germplasms. The heritability of this trait has been characterized in a cross between high α-tocopherol variety Keszthelyi Aproszemu Sarga (KAS) and low α-tocopherol variety Ichihime. In this study, the genetic mechanism of the high α-tocopherol content trait of KAS was elucidated.
结果
通过QTL分析和在KAS与日本品种ICHIHIME之间的横跨之间的群体中的精细映射,我们确定了γ-TMT3的编码γ-生育酚甲基转移酶,作为KAS高α-生育酚浓度的候选基因。在编码区发现多个核苷酸多态性,包括两个非同义突变γ-TMT3但α-生育酚浓度的差异均不受一姬和KAS的影响。因此,我们将研究重点放在转录调控上γ-TMT3在种子和叶子的生长过程中。F5杂合子的一个株系γ-TMT3是自花传粉。在后代中,植物在γ-TMT3选择位点进行进一步评估。的表达水平γ-TMT3在纯合子植物的种子和叶片发育方面都较高γ-TMT3从内等位基因。α-生育酚在种子发育过程中的高表达量与α-生育酚含量密切相关。我们获得了含有GUS基因的转基因拟南芥植株γ-TMT3来自KAS或一姬的发起人。GUS酶活性测定结果表明γ-TMT3KAS的启动子高于一姬。
结论
遗传变异γ-TMT3,在确定α-生育酚浓度中起主要作用,为大豆种子中生育酚生物合成的调控提供了重要信息。这些知识将有助于育种项目开发高α-生育酚含量的大豆新品种。
背景
维生素E家族包括生育酚(α、β、γ和δ形式)和生育三烯醇(α、β、γ和δ形式)。所有亚型都具有脂质抗氧化活性,而α-生育酚在哺乳动物中具有最高的维生素E活性[1,2].维生素E在食品和油脂中被广泛用作抗氧化剂,在家禽和牛的饲料中被用作营养添加剂,以改善肉质,在人类饮食中作为补充剂,以帮助预防癌症和心血管疾病等疾病。随着人们对功能性食品的兴趣和对肉制品的需求不断增加,市场规模预计将进一步扩大。约85%的商用维生素E是通过化学反应合成的[3.].这种维生素E通常包括天然产生的RRR-α-生育酚和7-立体异构体作为二级产物,其生物活性仅为天然α-生育酚的50%-74% [4].因此,在农作物和蔬菜中增加天然维生素E的产量非常重要[2].
大豆(甘氨酸最大(l)是一种主要的粮食、石油和动物饲料作物。在种子加工中,生育酚是与油脂馏分一起提取的。生育酚含量仅占油脂的1.5%左右;然而,生育酚对氧化稳定性至关重要[5].由于生育酚有助于提高种子的营养价值和大豆油的氧化稳定性,提高大豆中生育酚的含量将提高其市场价值。在普通大豆品种中,种子生育酚的主要形式为γ-生育酚和δ-生育酚,分别占总生育酚的60% ~ 70%和20% ~ 25%。大豆种子中α-生育酚的比例通常低于总生育酚的10% [1,6,7].已经有人通过基因工程来改善大豆维生素E。拟南芥的VTE4基因编码γ-生育酚甲基转移酶(γ-TMT),该酶催化α-生育酚生物合成的最后一步(图)1);过度的VTE4大豆种子中α-生育酚含量升高至总生育酚含量的75%。当VTE4coexpressed了VTE3,编码甲基-6-phytyl-1,4-苯醌(MPBQ)-甲基转移酶(图)1), α-生育酚增加到总生育酚的95%以上,维生素E活性增加到非转基因大豆水平的5倍[6].与此同时,过度的白苏子仅γ-TMT就可使α-生育酚增加到总生育酚的90%以上[8].一些研究已经表明其他生育酚形式的重要性。例如,γ-生育酚可以预防炎症或改善肾功能,这与它的抗氧化活性不同[9,10].这些研究促使我们寻找天然的生育酚变体,它们可能有独特的特征。这些变异可能使培育α-生育酚含量范围广泛(占总生育酚的10%至90%)的大豆品种成为可能,并为特定目的培育大豆品种。
高等植物生育酚的生物合成途径.生育酚由极性色酚环和由均质酸和二磷酸植基衍生的亲脂戊基链组成。莽草酸途径产生均质酸,而2- c -甲基-d-赤藓糖醇-4-磷酸(MEP)途径产生植基二磷酸。植基转移酶(Phytyl transferase, HPT)催化植基二磷酸与均质酸的反应,产生生育酚生物合成途径的共同前体甲基-6-植基-1,4-苯醌(MPBQ)。MPBQ-甲基转移酶(MPBQ- mt)在MPBQ上添加一个甲基烷基,生成2,3-二甲基-6-phytyl- plasoquinol (DMPBQ)。MPBQ和DMPBQ分别被生育酚环化酶(TC)环化,形成δ-生育酚和γ-生育酚。生育酚生物合成的最后一步是δ-生育酚和γ-生育酚的甲基化,分别生成β-生育酚和α-生育酚。这些反应是由γ-生育酚甲基转移酶(γ-TMT)催化的。
生育酚存在于高等植物的叶子、茎、花瓣、种子和绿藻中[1,11].虽然α-生育酚通常是叶片中的主要形式,但在种子中,生育酚的组成也有不同的变化[1].例如,在大豆、油菜籽(芸苔属植物显著)和拟南芥(拟南芥),大多数生育酚为γ-生育酚或δ-生育酚;向日葵(向日葵)及红花(Carthamus tinctorius)种子中,α-生育酚含量占总生育酚含量的95%以上[12,13].据报道,在玉米(0.9 ~ 6.5 μg 100 mg)等作物中,α-生育酚含量(每100 mg种子粉中α-生育酚重量[μg])和浓度(α-生育酚占总生育酚的百分比)均有变化-1)、向日葵(>野生型占95%,突变体<10%)、红花(>野生型占85%,突变体<15%)、油菜籽(α/γ-生育酚比值为0.54 ~ 1.70)和模式植物拟南芥[12- - - - - -16].先前的研究表明,大豆中也存在变异。通过对1000多份大豆种质资源的分析,鉴定出3个α-生育酚浓度为20% ~ 30%的大豆品种Keszthelyi aprozemu Sarga (KAS)、Dobrogeance和Dobrudza 14 Pancevo [7].这些品种的α-生育酚含量较典型品种高,说明α-生育酚含量是一个稳定的性状[7].利用中国(禾丰25)和加拿大(OAC Bayfield)大豆品种进行QTL分析,发现4个生育酚含量的QTL位于B2、C2、D1b和I连锁群中,分别对应于第14、6、2和20号染色体。然而,这些qtl中涉及的因果基因尚未确定[17].
在前人的研究中,我们用F2由KAS和一个典型品种一姬(Ichihime)杂交得到的群体[18].典型品种的α-生育酚浓度小于生育酚总量的10% [6].这里和我们之前的研究[18], α-生育酚浓度定义为α-生育酚与总生育酚的比值,α-生育酚含量定义为每100 mg大豆籽粉中α-生育酚的质量(μg)。α-生育酚高浓度性状的广义遗传力估计为0.645 [18].K连锁群(9号染色体)上的两个SSR标记Sat_167和Sat_243与α-生育酚浓度密切相关[18].分析了生育酚形态间的关系;α-生育酚浓度与总生育酚含量无显著相关,而γ-生育酚和α-生育酚浓度呈较强的负相关[18].
α-生育酚浓度与γ-生育酚浓度呈较强的负相关关系,提示可能是参与α-生育酚生物合成途径的一个主要基因导致了这一性状[18].生育酚是由两种前体,均质酸(HGA)和植基二磷酸生物合成的。这两个前体被HGA植基转移酶缩合,生成MPBQ。MPBQ被甲基化成2,3-二甲基-6-phytyl-1,4-苯醌(DMPBQ)。MPBQ和DMPBQ分别被生育酚环化酶转化为δ-生育酚和γ-生育酚。生育酚生物合成途径的最后一步是γ-生育酚甲基转移酶(γ-TMT)对δ-生育酚和γ-生育酚进行甲基化,分别生成β-生育酚和α-生育酚(图)1) [1].
为阐明高α-生育酚性状的遗传基础,利用典型品种一姬(Ichihime)与高α-生育酚品种KAS杂交获得的群体进行了α-生育酚浓度的QTL分析和精细定位。的γ-TMT3与拟南芥高度相似VTE4基因,定位在一个约75 kb的QTL区域内。的表达水平γ-TMT3α-生育酚在KAS基因型植物种子发育中表达量较高,且表达量的升高与α-生育酚含量的增加相关。同时也证明了瞬态活性γ-TMT3KAS的启动子高于一姬。
结果
α-生育酚高浓度性状QTL定位
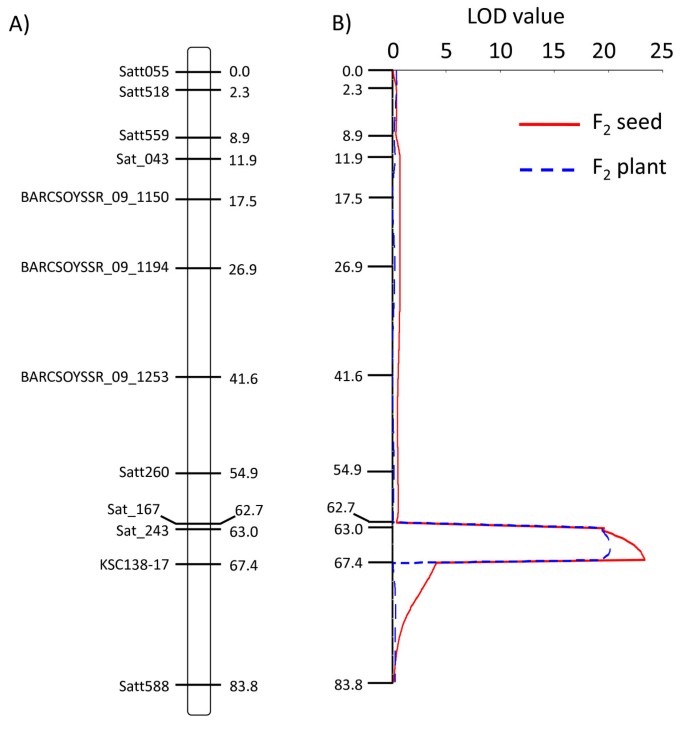
以α-生育酚浓度为20% ~ 30%的大豆品种KAS与α-生育酚浓度<10%的日本品种一姬(Ichihime)杂交,获得分离群体为122 F2植物(18].这些植物是在北海道大学的温室里种植的3.每个F的种子2并对其生育酚成分进行了分析。利用152个多态性SSR标记构建了一姬与KAS的分子连锁图谱。该连锁图谱覆盖了大豆基因组的3401 cM,由20个连锁群组成,与20对大豆染色体对应。
QTL分析采用两个群体。第一人口(此后,F2种子种群”)2一姬× KAS杂交后代的种子;在该群体中,使用半种子法分析生育酚浓度(见材料和方法)。第二种人口(“F2植物种群”)2通过测定植物的生育酚含量和浓度,对其进行了评价2:3种子。采用MapQTL5进行多重QTL作图(Multiple QTL Mapping, MQM)分析,采用1000排列检验确定每个性状的QTL阈值[19].
α-生育酚浓度仅检测到1个QTL。QTL位于连锁群K(9号染色体)上。MQM分析表明,Sat_243和KSC138-17之间的区间与α-生育酚浓度相关性较强,LOD值为23.4,表型变异(PVE)为55.8%(图)2、表1).在我们之前的研究中[18], α-生育酚浓度与γ-生育酚浓度之间存在较强的相关性。因此,不仅对α-生育酚进行了QTL分析,还对γ-生育酚和δ-生育酚进行了QTL分析。这是为了阐明生育酚亚型之间的关系,并鉴定决定生育酚组成的基因。QTL位于Sat_243和KSC138-17之间,与γ-生育酚浓度(LOD = 11.5, PVE = 32.8%)和δ-生育酚浓度(LOD = 5.0, PVE = 16.1%)相关。
的F2分析了生育酚浓度和含量的qtl。在分析F2还检测种子群,用于α-生育酚浓度(LOD = 20.2,PVE = 55.0%),γ-生育酚浓度(LOD = 16.7,PVE = 48.7%)和δ-生育酚浓度(LOD = 4.8,PVE = 17.0%)).此外,该QTL还负责α-生育酚含量(LOD = 20.6,PVE = 56.5%)和γ-生育酚含量(LOD = 5.24,PVE = 17.9%)。对于δ-生育酚浓度,在连杆组M(染色体12)的间隔SAT_244和SAT_033中检测另一种QT1,LOD值5.26和PVE 22.5%。但是,在f中未检测到该QTL2种子分析。
据报道,在中国品种(禾丰25)与加拿大高α-生育酚品种(OAC Bayfield)杂交分离群体的QTL分析中检测到4个生育酚浓度和含量的QTL [17].而在本研究中,未检测到这些区域的QTL。这一事实表明,在KAS中导致高α-生育酚浓度的遗传因素可能与OAC Bayfield中不同。
QTL区域候选基因的鉴定
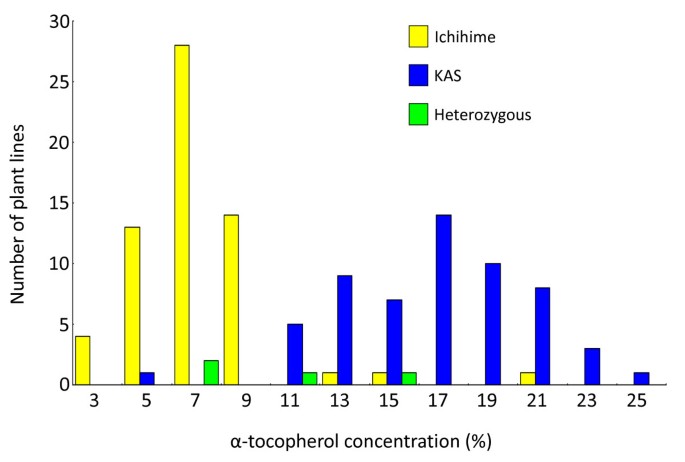
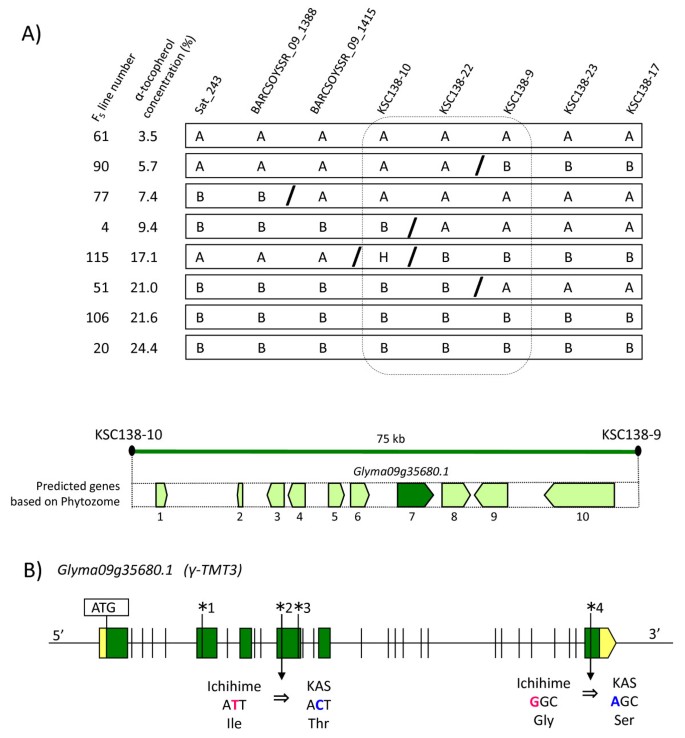
为鉴定第9染色体上的候选基因,利用F5行。F5线条是从F衍生出来的2采用单种子下降法的植物。研究了α-生育酚在F5线条如图所示3..α-生育酚浓度几乎与KSC138-17标记基因型共分离(图)3.).F5利用新近开发的位于Sat_243和KSC138-17之间的SSR标记进行基因分型(图)4).精细定位显示,导致KAS中α-生育酚高浓度的候选基因可能位于KSC138-10和KSC138-9之间的区域,对应约75 kb的基因组序列(图)4).
通过精细定位选择重组植株的基因型和基因结构γ-TMT3.(A)信息丰富的F5用于精细映射的QTL植物线,负责高α-生育酚浓度。每个标记的ichihime纯合基因型和Kas纯合基因型分别由“A”和'B'表示。杂合基因型由'h'表示。'/'表示重组位置。有助于高α-生育酚浓度的区域由虚线盒包围。仅针对这些信息线分析KSC138-9基因型。KSC138-10和KSC138-9之间的间隔对应于染色体9上的75kb序列区域9.基于来自植物血红素数据库的信息,该区域包含10个预测基因。箭头的基因和数字的箭头对应于表2中的数字。(b)。基因结构Glyma09g35680.1(γ-TMT3).绿色矩形和绿色矩形之间的空间分别代表外显子和内含子。黄色矩形表示5'-UTR区域,黄色箭头表示3'-UTR区域。竖线代表一姬和KAS之间的遗传多态性(插入-缺失,SNPs)。外显子的核苷酸多态性用竖线和数字表示,如表3所示。编号为2和4的多态性是非同义核苷酸替换;对应的氨基酸变化(一姬到KAS)显示在取代位点下面。
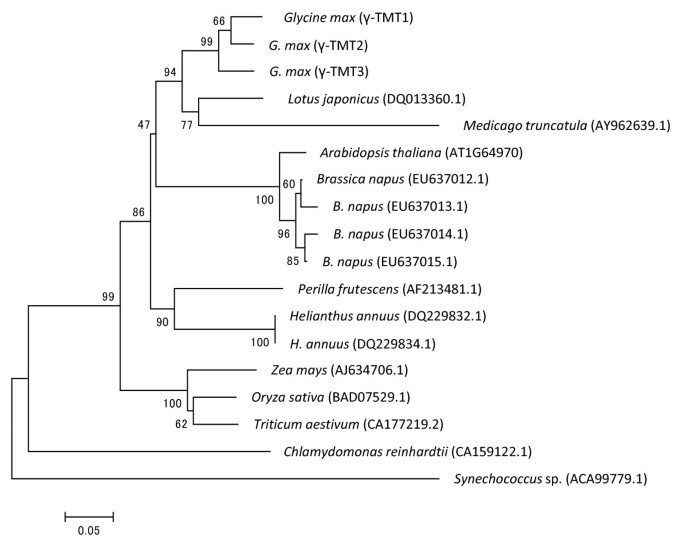
基于Phytozome数据库中的大豆基因组信息[20.],有10个预测基因位于9号染色体的KSC138-10和KSC138-9之间的QTL区域(见表)2,图4).其中Glyma09g35680.1与拟南芥γ-TMT编码基因具有81.8%的肽相似度,VTE4[21].在网上进一步分析发现,在大豆基因组中还存在另外两个编码γ-TMT的基因:Glyma12g01680.1和Glyma12g01690.1。他们预测的多肽相似度VTE4分别为81.4%和68.9%,两个基因均位于连锁群H(第12号染色体)上,基因组序列为4 kb。有趣的是,已知两个串联的γ-TMT基因可以调节向日葵中α-生育酚的生物合成[13].但在大豆中未发现与Glyma12g01680.1和Glyma12g01690.1串联的H连锁群中α-生育酚生物合成的QTL。根据Phytozome数据库的基因组信息[20.], Glyma12g01680.1和Glyma12g01690.1以及Glyma09g35680.1周围的基因组区域之间不存在保守的同源性。然而,在本研究中,我们无法确定这些区域是否彼此同源。
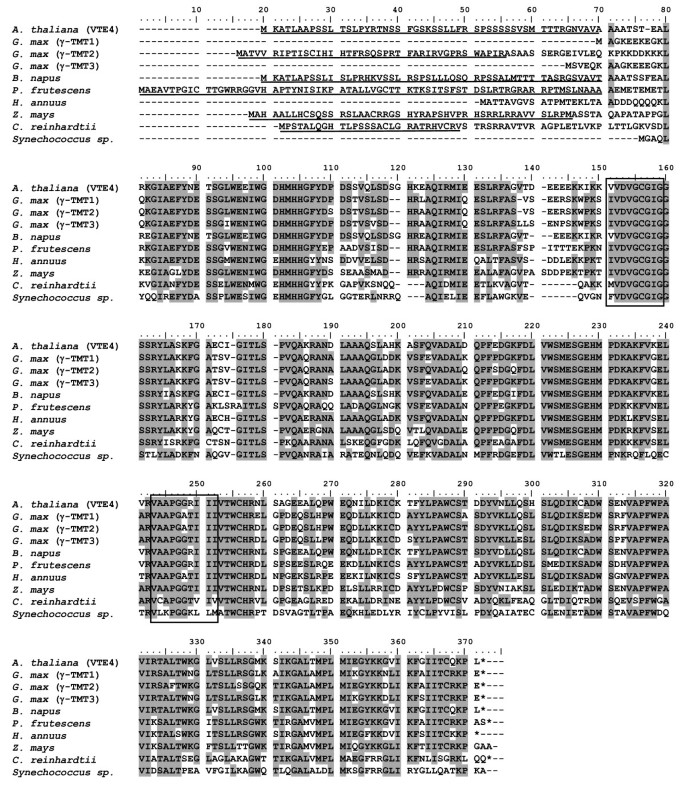
Glyma12g01680.1和Glyma12g01690.1与基因组序列相同(γ-TMT1和γ-TMT2(Ujiie,未发表数据)。因此,Glyma12g01680.1和Glyma12g01690.1被命名为γ-TMT1和γ-TMT2,分别。Glyma09g35680.1被指定为γ-TMT3.根据预测的氨基酸组成,三个γ-TMTs被分为一个系统发育组,这是双子叶中发现的γ-TMTs簇的一部分(图)5).
除n端外,大豆中的三个γ-TMTs与其他几种植物中的γ-TMTs具有很高的氨基酸相似性(图)6).质体被认为是α-生育酚生物合成的场所[11],因此利用亚细胞定位预测程序搜索了三个γ-TMT蛋白中存在质体过境肽信号。根据氯磷分析结果,在γ-TMT2中预测了质体过境肽,但在γ-TMT1或γ-TMT3中没有预测(图)6).
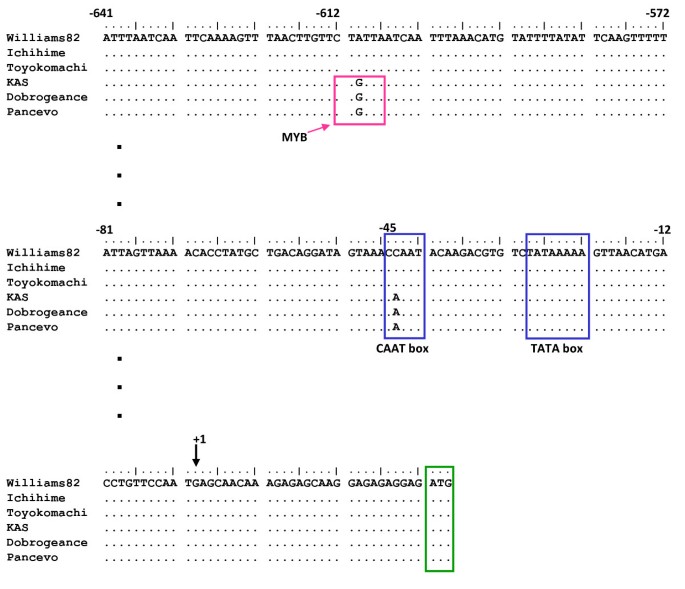
在本研究中,在同一个位点(K连锁群)检测到了负责α-生育酚浓度和γ-生育酚浓度的qtl,这有力地支持了之前报道中所描述的α-生育酚浓度和γ-生育酚浓度之间的负相关[18].根据生育酚的生物合成途径(图1), γ-TMT在确定α-生育酚和γ-生育酚的相对浓度中起关键作用。因此,我们关注的是人物的刻画γ-TMT3基因。根据Phytozome数据库,γ-TMT34.3 KB长,由6个预测外显子组成。基因组约5.5 kb的基因组区域,包含γ-TMT3基因及其5′上游区域在一姬和KAS中均有测序。在外显子和内含子中共检测到26个核苷酸多态性(图)4 b).外显子中的两个核苷酸替换导致氨基酸改变。它们似乎不是与高α-生育酚浓度有关的核苷酸多态性,因为Williams 82在这两个位置具有相同的核苷酸,与一姬的α-生育酚浓度相同(见表)3.).因此,5'-上游区域的转录起始位点γ-TMT3比较了高α-生育酚与典型大豆之间的差异。对6个α-生育酚含量较高的品种(KAS、Dobrogeance和Dobrudza 14 Pancevo)和典型品种(Ichihime、Toyokomachi和Williams 82)的5'-上游区域进行了约1.2 kb的测序。序列比对发现,两组间存在10个单核苷酸多态性(SNPs)。其中两个SNPs位于基因转录调控区域:一个MYB结合位点和一个CAAT box,分别位于Williams 82的预测转录起始位点的-612和-46位置(图)7).高α-生育酚大豆的CAAT盒基序为“CAAAT”,而典型大豆的CAAT盒基序为“CCAAT”。“CAAAT”是CAAT盒的规范序列,但“CAAAT”motif也被认为是哺乳动物的CAAT盒motif [22,23].另一方面,MYB结合位点(CTGTTA)仅在高α-生育酚大豆中存在。该motif在玉米和拟南芥中被MYB转录因子识别[24].
α-生育酚浓度与表达水平的关系γtmt基因
的表达水平γ-TMT3α-生育酚浓度与α-生育酚浓度相关的基因多态性存在于γ-TMT3.
F5-24,f5异质近亲繁殖家庭(HIF) [25它是基因组周围区域杂合子的γ-TMT3并且几乎整个基因组的纯合子被用来产生植物的纯合子γ-TMT3一姬基因组区和KAS基因组区;这些分别被称为一姬线和KAS线。三系为一姬等位基因纯合子(F524-10 F524-14, F5-24-15)和3个株系为KAS等位基因纯合子(F524 - 7 F524-18, F524-22)生成的。分别在开花后30、40和50 d采集发育中的种子。
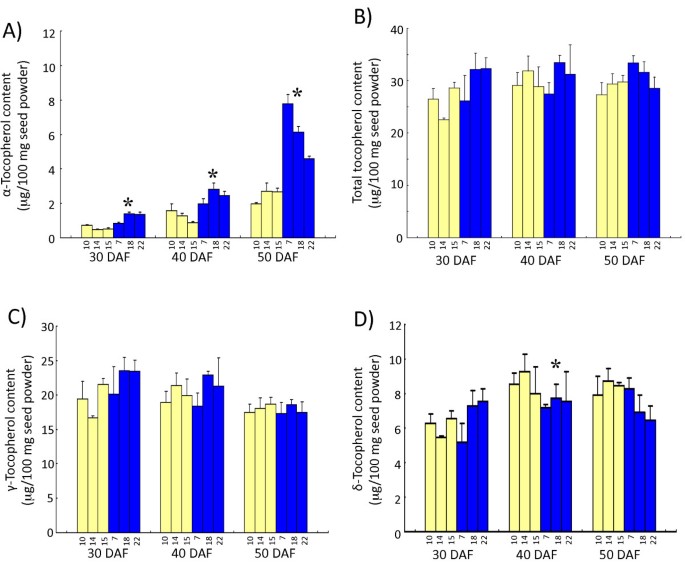
如图所示8,α-生育酚浓度向种子成熟增加。在所有发展阶段,KAS系中α-生育酚浓度明显高于ICHIHIME线(P< 0.05)。在30-DAF种子中,KAS株系的α-生育酚含量是一姬株系的1.2 ~ 2.4倍。一姬株系与KAS株系在种子成熟过程中差异较大。在50 DAF时,KAS株系的α-生育酚浓度高达一姬株系的3倍。无显著性差异(P<0.05)在ICHIME线和KAS线之间的γ-生育酚浓度(图8 b).与其他生育酚形式相比,KAS株系的δ-生育酚浓度显著降低(P< 0.05)8 c).
在种子发育的各个阶段,KAS株系的α-生育酚含量均显著高于一姬株系(图)9),在50 DAF时差异最大,与α-生育酚浓度变化趋势相同。相比之下,总生育酚含量没有显著性变化(P< 0.05)的变化(图9 b).由此可见,α-生育酚浓度的增加主要是由于α-生育酚含量的增加。在其他形式的生育酚中,γ-生育酚含量在种子成熟过程中略有下降,而δ-生育酚含量在40 DAF之前上升,然后在成熟过程中下降(图)9 c和9 d).显著差异(P40 DAF期δ-生育酚含量与一姬株系相比差异不大,但不显著(P50 DAF期δ-生育酚含量也显著高于KAS株系和一姬株系。无显著差异(Pγ-生育酚含量在任何发育阶段均< 0.05)9 c).
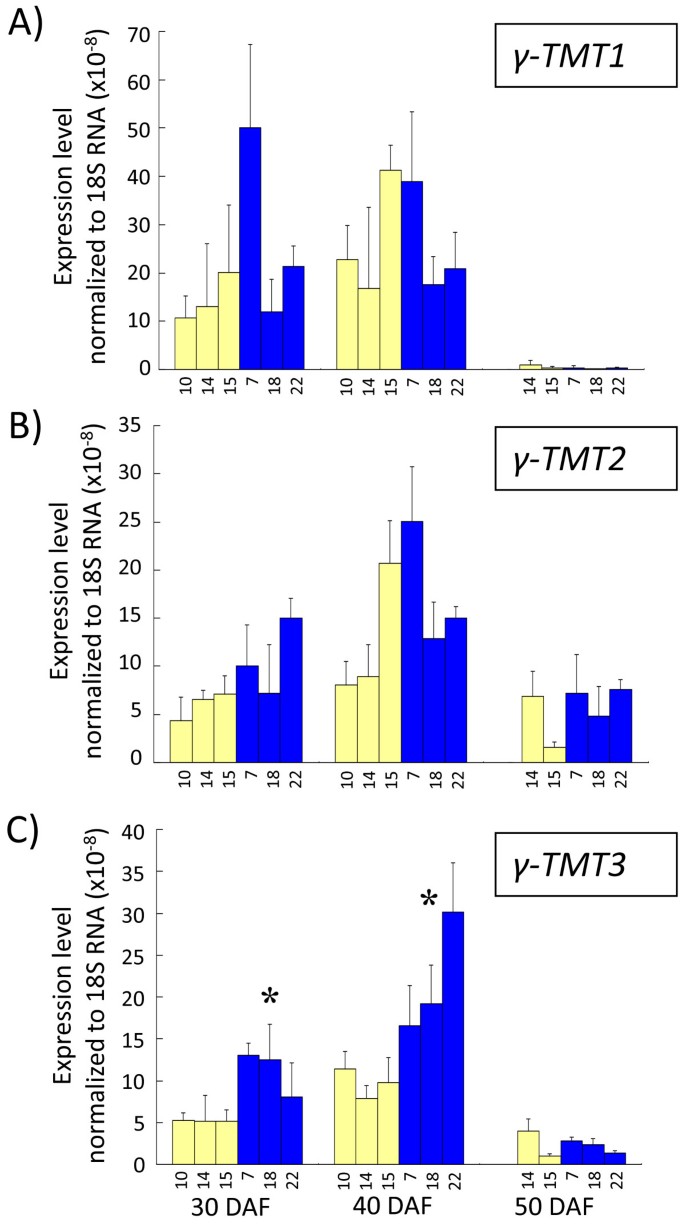
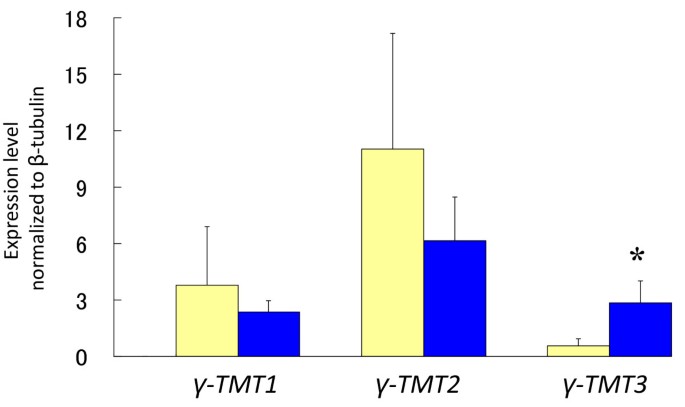
的表达水平γ-TMT1,γ-TMT2和γ-TMT3通过定量RT-PCR对种子发育的三个阶段进行评价(图10).在基因表达分析中作为内参基因的18S rRNA的表达为表达水平进行归一化[26].这三个的表达式γtmt基因在40 DAF时达到最高水平,种子大小达到最大值。γ-TMT1和γ-TMT2显示无差异(P< 0.05)。γ-TMT3显示显著差异(P在30和40 DAF时,一姬株系与KAS株系的表达量均< 0.05)。的表达水平γ-TMT3在30和40 DAF时,是一姬株系的1.5 ~ 3倍(P< 0.05)。表达水平的γ-TMT1,γ-TMT2,γ-TMT3对一姬和KAS完全展开的叶片进行了分析。有趣的是,转录水平γ-TMT3在KAS叶片中也高于一姬叶片,这与在种子发育中观察到的模式相同(图)11).
基因表达分析γ-TMT1(一),γ-TMT2(B)γ-TMT3(C)在种子发育期间.利用表4所示的基因特异性引物,对30个、40个和50个正在发育的DAF种子的总RNA进行定量RT-PCR。黄条代表hif衍生的纯合子一姬系(F524-10 F524-14, F5-24-15)和蓝条代表hif衍生的纯合子KAS系(F524 - 7 F524-18, F524-22)。对30个DAF种子和40个DAF种子,6个株系均进行分析524-14 F524-15 F524 - 7 F524-18, F524-22)。转录水平与内部对照18s核糖体RNA的值归一化。值为3次重复的平均值±SD。星号表示Ichihime基因型组与KAS基因型组差异显著(置信区间95%)。
的活动γ-TMT3一姬和KAS的发起人
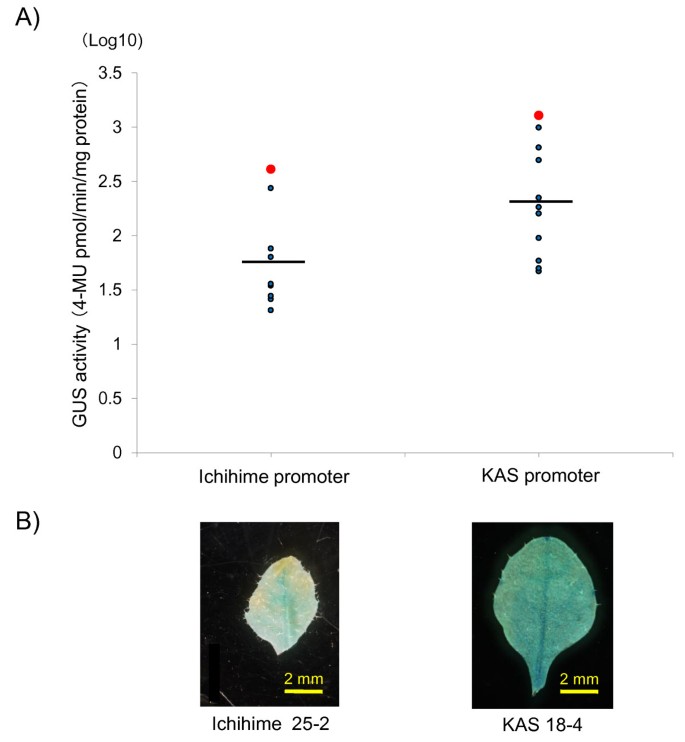
由于表达水平γ-TMT3在叶子和种子发育方面都是不同的(图11),我们测量了γ-TMT3转基因拟南芥的启动子在控制下表达GUS报告基因γ-TMT3来自KAS或一姬的发起人。10 T2植物携带γ-TMT3一姬和11 T2植物携带γ-TMT3KAS启动子如图所示12个一个和12 b.携带转基因植株中GUS活性的平均值γ-TMT3KAS启动子为385.5 pmol 4-MU min-1毫克-1蛋白,而一姬启动子转化子的平均值为100.53 pmol 4-MU min-1毫克-1蛋白质。对对数变换数据进行F检验分析,表明活性γ-TMT3KAS启动子显著高于一姬启动子(F = 7.170,P= 0.015)。
讨论
γ-TMT3高α-生育酚浓度的候选基因是KAS吗
在之前的研究中,K连锁群(9号染色体)上的两个SSR标记Sat_243和Sat_167与α-生育酚浓度密切相关。本研究证实了Sat_243和KSC138-17区间的QTL与α-生育酚浓度、γ-生育酚浓度、α-生育酚含量和γ-生育酚含量相关。QTL正调控α-生育酚浓度和α-生育酚含量,负调控γ-生育酚浓度和γ-生育酚含量(见表2)1),表明候选基因与γ-生育酚转化为α-生育酚直接相关。使用F进行精细映射5行显示γ-TMT3定位于QTL区域。本研究着重于分子表征γ-TMT3基因。
通过序列分析和基因表达分析,发现该基因的核苷酸多态性γ-TMT3启动子区可能增加γ-TMT3α-生育酚在油菜种子发育中的作用,与油菜种子中α-生育酚的高浓度有关。瞬时GUS检测1.2 kb启动子区γ-TMT3来自KAS和一姬也支持我们的观点γ-TMT3KAS和Ichihime之间的表达可能至少部分归因于启动子序列的差异,尽管我们不能排除某些顺式元件影响γ-TMT3表达位于转录起始位点上游1.2 kb外。
其中2个多态性位于转录因子结合基序中5'-上游区域γ-TMT3高α-生育酚大豆基因(图7).第一个突变位于CAAT盒中,它作为基因表达的增强剂。CAAT盒的典型序列是“CCAAT”,即一姬中发现的序列。KAS类型为“CAAAT”,不是典型的,但被认为是鼠标中的功能性CAAT盒[22].目前,我们还没有任何关于CAAT盒突变可以增强基因表达的报道。第二个突变在KAS启动子中产生了MYB结合位点;在拟南芥咖啡酸o -甲基转移酶基因启动子中也发现了相同的序列(“CTGTTA”)[24].在拟南芥中,“CTGTTA”motif被玉米MYB转录因子ZmMYB31和ZmMYB42识别[24].进一步分析独联体-元素将提供这些多态性是否有助于启动子活性的改变的信息。
大豆生育酚含量及浓度的调节
本研究的生育酚含量分析为大豆中生育酚含量和浓度的调控提供了重要信息。40 DAF时,KAS株系δ-生育酚含量低于一姬株系。γ-生育酚含量在KAS株系和一姬株系间无显著差异。由于γ-生育酚和β-生育酚的峰不能用本研究的分析方法分离出来,因此认为β-生育酚含量的增加可能掩盖了γ-生育酚含量的减少。因此,γ-TMT3可以催化γ-生育酚和δ-生育酚分别转化为α-生育酚和β-生育酚(图)1).在KAS系中δ-生育酚减少和α-生育酚增加也提出了γ-TMT3是否也能催化MPBQ甲基化为DMPBQ的问题。据报道,拟南芥γ-TMT (VTE4)对MPBQ无活性在体外[27].在大豆中,γ-TMTs与MPBQ- mts之间的氨基酸序列相似性不大,说明大豆γ-TMTs可能对MPBQ不具有活性。进一步分析γ-TMT3的酶活性和底物特异性将为进一步了解γ-TMT3的生化特性提供信息。
γ-TMT蛋白功能分化的可能性
γ-TMT1、γ-TMT2和γ-TMT3蛋白氨基酸相似性均超过90%,并有两个SAM结合域(见图)6),表明它们都具有催化γ-生育酚向α-生育酚转化的γ-TMT活性。这说明了三个γtmt基因(γ-TMT1,γ-TMT2,γ-TMT3)在叶片和发育中的种子中表达,并合成和积累α-生育酚(图10,图11).然而,研究表明,表达水平的变化γ-TMT3单独可以将α-生育酚浓度和α-生育酚含量增加到典型大豆(图)的2.4倍(图8,9).如果γ-TMT1或γ-TMT2突变也能增强α-生育酚的积累,这些基因金字塔γtmt变异将使我们能够开发α-生育酚浓度或含量高于KAS的大豆新品种。γ-TMT1、γ-TMT2和γ-TMT3多肽在其nh2端区存在差异(见图)6),尽管它们与其他几种植物中发现的γ- tmt具有高度的氨基酸相似性(图)6).有趣的是,在γ-TMT1和γ-TMT3中没有质体信号肽的预测在网上分析。已知α-生育酚定位并在质体中合成[11],而参与其生物合成的酶则定位于质体内[11,28].进一步分析γ-TMT1和γ-TMT3的亚细胞定位,可能进一步阐明γ-TMT蛋白调控大豆α-生育酚生物合成的功能多样性。
结论
在这项工作中,我们鉴定了一个负责高α-生育酚浓度的遗传调控的QTL。该QTL除调节α-生育酚浓度外,还影响γ-生育酚浓度和δ-生育酚浓度。因此,推测该QTL背后的基因调控生育酚的浓度。通过良好的映射,γ-TMT3被鉴定为高α-生育酚性状的候选基因。γ-TMT3编码γ-生育酚甲基转移酶,催化γ-生育酚甲基化为α-生育酚。的表达γ-TMT3在种子发育过程中,KAS株系的萌发率高于一姬株系。与此同时,γ-TMT3KAS叶片的表达量高于一姬。综上所述,启动子区多态性对基因型的影响较大γ-TMT3α-生育酚在KAS中的表达,导致较高的α-生育酚浓度。瞬态活动分析γ-TMT3启动子显示了KAS的活性γ-TMT3启动子含量高于一姬γ-TMT3启动子。在本研究中,也证明了在启动子区域的遗传变异γ-TMT3α-生育酚与大豆种子中α-生育酚含量及浓度有关。
方法
植物材料和生长条件
总共140华氏度2利用一姬与KAS杂交产生的种子进行QTL定位。将每颗种子的远端部分剪掉,用于生育酚浓度分析。F22005年,种子在日本北海道大学(43°0′n, 141°21′e)的温室里的商业盆栽土壤(Katakura Chikkarin Co., Ltd., Japan)中种植。从每株植物中采集10粒种子并进行膨化处理,用于生育酚浓度分析。每棵植物的叶子都被采摘下来,立即在液氮中冷冻,并在-30°C保存,直到提取DNA。
在发育种子中基因表达和生育酚定量分析中,使用hif衍生品系。低氧诱导因子(F5-24)为杂合子γ-TMT3基于侧翼SSR标记的基因型分析。植株自交获得了一姬或KAS标记等位基因的纯合子系γ-TMT3轨迹。采用三对一姬等位基因纯合子(24- 10,24 - 14,24 -15)和三对KAS等位基因纯合子(24- 7,24 - 18,24 -22)进行分析;这些线条分别称为一姬线和KAS线。所有品系均于2008年6月在北海道大学实验农场种植。分别在开花后30 d、40 d和50 d取样。种子立即在液氮中冷冻,-80°C保存,直到基因表达和生育酚含量分析。
生育酚的提取和高效液相色谱分析
从成熟种子中提取生育酚,采用反相高效液相色谱法(HPLC)进行分析等.[18].
F2种子,用剃刀刀片切断种子的远端部分并切成比特。将10mg样品称量并在室温下以300μl80%乙醇在300μl80%乙醇中超声处理10分钟。向样品中加入己烷(600μL)以进行萃取。在使用冷藏离心机(Eppendorf离心机5417R,Eppendorf)以13,000rpm以13,000rpm离心5分钟,将样品静于离心5分钟。上部(己烷)相转移到HPLC小瓶(Waters Corp.,Japan)中。在HPLC系统(Hitachi Lachrom Elite,Hitachi High-Technologies Corp.,Japan)中进行了分析,其中inertsil ODS-3反相栏(3.0 mm×250 mm,日本GL Sciences)。将柱温保持在40℃,并在等离子条件下进行分离25分钟。溶剂A是乙腈,溶剂B是甲醇,溶剂A与溶剂B的比例为75:25(v / v)。流速0.5 ml/min。在295nm的波长下检测到生育酚。
F3.由F衍生的种子2从每棵植物中提取五颗种子,将其膨胀并磨成细粉。种子粉(50毫克)称入15毫升试管中。粉末在1ml 80%乙醇水溶液中室温超声15分钟。4°C孵育30分钟后,在Tomy RL-100离心机(Tomy Seiko Co., Japan)中以2500 rpm离心10分钟。上相转移到高效液相色谱瓶中。分析采用高效液相色谱系统(Hitachi LaChrom Elite, Hitachi High-Technologies Corp, Japan),与F2种子分析。柱温保持在40℃,分离时间为25 min,流动相为乙腈:甲醇,体积比为90:10 (v/v)。流速0.5 ml/min。在295 nm波长处检测生育酚。每次分析进行两次。
生育酚的提取和发育种子的定量是根据以前开发的程序进行的[29经过几处修改。20mg冻干的种子粉在1ml冷丙酮中搅拌。室温超声20 min,超声后4℃孵育30 min。离心2次,13000 rpm,每次10 min,使用冷冻离心机(Eppendorf离心机5417R, Eppendorf)。将上面的溶液转移到一个HPLC小瓶中。采用日立LaChrom Elite进行分析,采用反相柱(Inertsil ODS-3, 4.6 mm × 250 mm)。柱温保持在40℃。以乙酸乙酯:75%甲醇为流动相,体积比为50:50 (v/v),在等晶条件下进行分析。采用波长为295 nm的紫外光检测生育酚。每次分析进行三次。
以dl-tocol (Tama生化有限公司)的峰面积计算样品中的生育酚含量。日本)。在提取用的80%乙醇或丙酮中加入dl-Tocol,浓度为3 μg/ml。
基因分型
从每个F出发2对植物进行采样并在-30℃下储存直至DNA提取。根据Dwiyanti所述的CTAB方法进行基因组DNA分离[18].在700 μl十六烷基三甲基溴化铵(CTAB)提取缓冲液中加入约0.2 g液氮研磨的叶片组织。60℃孵育30min后,与700 μl氯仿异戊醇(24:1 v/v)混合,在Tomy MR150 (Tomy Seiko Co., Japan)冷冻离心机中10,000 rpm离心5min。将水溶液转移到1.5 ml试管中,与500 μl冷异丙醇混合沉淀核酸。粗核酸在Tomy MR150 (Tomy Seiko Co., Japan)冷冻离心机中以10,000 rpm离心5 min。用150 μl 70%乙醇洗涤核酸颗粒,蒸发剩余液体。然后将球团溶解在TE缓冲液中。RNA被氯化锂沉淀,如[18].以总DNA约20ng为模板进行PCR分析。
从大豆共识连锁图谱中选择SSR标记[30.以覆盖所有大豆连锁群,并检测一姬与KAS之间的多态性。基于大豆基因组数据库Phytozome [20.]和大豆SSR数据库BARCSOYSSR_1.0 [31].对148个SSR标记进行了基因型分析2植物。通过使用先前描述的PCR程序扩增每个标记的DNA带[18].扩增产物分别在3%琼脂糖S (Wako Pure Chemical Industries, Ltd)、4% NuSieve琼脂糖S (Cambrex Bio Science Rockland, Inc)或10%聚丙烯酰胺凝胶上分离。用溴化乙酯对凝胶进行染色,并在紫外光下拍摄DNA条带。
遗传定位和QTL分析
根据122 F的152个SSR标记的基因型绘制了连锁图谱2使用MapManager QTX构建植物[32].使用Kosambi函数在Centimorgans(CM)中计算地图距离。
对α-生育酚浓度、γ-生育酚浓度和δ-生育酚浓度进行QTL分析2种子和F2植物。F2对植物α-生育酚和γ-生育酚进行了QTL分析。通过排列分析(1000次)确定全基因组最低显著LOD阈值评分。根据分析结果,LOD评分超过2.8的qtl视为有效位点。初始QTL作图采用MapQTL 5.0中提供的区间作图(IM)方法[19].在同一程序中,利用MQM方法将QTL的侧边标记作为辅助因子进行QTL定位。
良好的映射
F5植物是由F2用单种子下降法种植。这些F52007年6月在日本北海道大学实验农场(北纬43度0分,东经141度21分)种植了这些植物。每株10粒种子膨化后进行生育酚浓度分析,每株叶片进行DNA基因分型。生育酚的定量方法与F3.种子。采用CTAB法从叶片中提取DNA。
六个SSR标记(表4)以鉴定QTL所在区域的重组子。这些标记的基因型在F5植物。PCR反应混合物为20 ng DNA、1 μl 10× PCR缓冲液(TaKaRa)、0.25 mM dNTP混合物(TaKaRa)、0.2 μM正向引物、0.2 μM反向引物和0.5个单位TaqDNA聚合酶(TaKaRa)总体积为10 μl。PCR反应如下:95℃初始变性5分钟;依次为95°C 30 s、58°C 30 s、72°C 30 s 35个循环;然后在72°C下进行最后一步延伸7分钟。PCR产物在10%丙烯酰胺凝胶上分离,在紫外光照下观察条带。
系统发育分析和质体过境肽预测
从Phytozome数据库中获得γ-TMT1、γ-TMT2和γ-TMT3的氨基酸序列[20.].蓝藻γ-TMT同源物的氨基酸序列(聚球藻属sp. PCC 7002 [ACA99779.1]),绿藻(衣藻reinhardtii[CA159122.1]),植物(Lotus对虾(DQ013360.1),Medicago truncatula[AY962639.1],拟南芥[AT1G64970],向日葵[DQ229832.1和DQ229834.1],油菜[EU637012.1, EU637013.1, EU637014.1.]。EU637015.1],玉米[AJ634706.1],水稻(栽培稻[BAD07529.1],小麦(小麦l .) [CA177219.2]白苏子[AF213481.1])从TAIR [33]和ncbi genbank [34].序列由MEGA 4.0软件中的ClustalW功能进行比对[35].采用MEGA 4.0软件中的neighbor-joining方法构建蛋白质系统发育树[35].为了确定蛋白质之间的距离,进行了1000次bootstrap(重采样)测试。利用氯磷1.1进行质体过境肽预测[36].
基因克隆及测序
采用CTAB法分离高α-生育酚大豆品种(KAS、Dobrogeance和Dobrudza 14 Pancevo)和典型大豆品种(Ichihime、Toyokomachi和Williams 82)的基因组DNA。引物对的设计基于γ-TMT3(Glyma09g35680.1)基因组信息[20.].γ-TMT3扩增片段采用以下PCR条件:95℃初始变性5分钟;接下来是35个循环,95°C 30 s,退火温度30 s, 72°C 1 min;然后在72°C下延伸7分钟。PCR产物在1%琼脂糖S凝胶中分离(Wako Pure Chemical Industries, Ltd)。从凝胶中取出预期的扩增产物,用乙醇沉淀并连接到pGEM-T Easy载体(Promega Corp.)。将含有DNA片段的载体转化为大肠杆菌应变JM109。过夜培养后,用Wizard SV Plus Minipreps (Promega Corp.)分离质粒。DNA片段用大染料终结者循环测序试剂盒3.1 (Applied Biosystems)处理,反应条件如下:使用ABI PRISM 3130遗传分析仪(应用生物系统)对DNA片段进行测序,并使用BioEdit Sequence Alignment Editor对序列进行比对[37].
RNA提取
在氯化锂沉淀过程中,从正在发育的种子或叶子中提取总RNA [38经过几处修改。将冷冻组织(约200 mg)在液氮中研磨成细粉,加入150 μl的tris -饱和酚(pH 8.0)和500 μl的提取缓冲液(10 mM Tris-HCl pH 7.5, 1 mM EDTA pH 8.0, 100 mM NaCl, 1% SDS)。这种混合物被彻底磨碎了。向样品中加入300 μl氯仿异戊醇(24:1 v/v),旋转溶液,在冷冻离心机(HITACHI Himac CF15RX II, Tokyo, Japan)中离心(15,000 rpm, 10 min, 4℃)分离水层和有机层。将水相转移到1.5 ml的试管中。氯仿:异戊醇处理两次。加入0.3体积的10 M氯化锂沉淀RNA。4°C保存过夜后离心(15000rpm, 4°C)。RNA颗粒被放在冰上打开的试管中干燥。将RNA颗粒重悬于RNase游离水中。
用DNA酶I处理从重悬的颗粒中去除DNA。在RNA溶液中加入10个单位的DNase I (TaKaRa)和DNase I缓冲液。37℃孵育30min,在0.3 M乙酸钠和2.5体积乙醇存在下再次沉淀RNA。RNA颗粒被干燥,并再次悬浮在RNase游离水中。
定量rt - pcr分析
每条cDNA从1 μg总RNA中合成,使用M-MLV逆转录酶系统(Invitrogen),根据说明书使用随机六聚体引物。合成后,用4体积的无核酸酶水稀释1体积的cDNA。
定量RT-PCR反应在20 μl体积内进行,体积中包含5 μl cDNA,每个引物12.5 mol, 2× SYBR Premix Ex Taq II (Applied Biosystems)。反应在DNA引擎Opticon3 (MJ Research Inc.)中进行,条件如下:95°C for 20 s, 58°C for 20 s, 72°C for 20 s, 40个循环。熔融曲线分析验证了扩增的特异性。的表达式级别γtmt基因被归一化到18个rRNA水平用于发育种子分析,并被归一化到β-微管蛋白水平用于叶片分析。每一种都使用了引物γtmt基因,18秒rRNA和β-微管蛋白总结在表中5.
启动子序列的生物信息分析
上游1.3 kb区域γ-TMT3从Ichihime, Toyokomachi, Williams 82, KAS, Dobrogeance和Dobrudza 14 Pancevo分析。使用PLACE程序分析了这些区域的调控要素[39]及PLANTCARE [40].
转基因拟南芥的产生受GUS基因的控制γ-TMT3启动子
转录起始位点上游1.2 kb区域γ-TMT3从一姬和KAS中扩增启动子,克隆到PCR中®8 /千瓦/威尼斯平底渔船®载体(Invitrogen)。测序质粒。将启动子片段插入植物表达载体PMDC100中[41含有β-葡萄糖醛酸酶(GUS)报告基因的[42].这个结构被引入根癌土壤杆菌应变EHA105。拟南芥生态型哥伦比亚植物用农使用花浸方法隐藏表达向量[43].
GUS组织化学和活性分析
转基因拟南芥GUS组织化学分析2用含1mg ml染色液浸泡植株-15-溴-4-氯-3-吲哚基-β-d-glucuronide (X-Gluc)的合成44].将浸泡后的叶片抽真空10分钟,在37°C孵育过夜。染色处理后,用99.5%乙醇漂洗去除叶绿素。
对于Gus活性测定,从T的叶子中提取粗蛋白2提取液中加入50 mM磷酸钠(pH 7.0)、10 mM EDTA (pH 8.0)、0.1% SDS和0.1% Triton X-100。16 μl的提取物与50 μl的1 mM 4-甲基伞形酰基-β-混合D-glucuronide (4-MUG)和34 μl提取缓冲液,37℃孵育0、30、60 min,加入200 μl 0.2 M碳酸钠终止反应。用Wallac ArvoTM 1420多标记计数器(Perkin Elmer)测定了反应生成的4-甲基umbellliferone (4-MU)的荧光。使用Quick Start™Bradford Protein Assay Kit (Bio-Rad Laboratories)测定提取物中的蛋白质含量。GUS活性表达为pmol 4-MU·min-1·毫克的蛋白质。
加入号码
本文中的序列数据可以在GenBank/EMBL/DDBJ数据库中找到,登录号如下:Ichihimeγ-TMT3启动子(AB617792)内γ-TMT3启动子(AB617793) Toyokomachiγ-TMT3启动子(AB617794), Williams 82γ-TMT3启动子(AB617799)内γ-TMT3编码序列(AB617795)γ-TMT3编码序列(AB617796)γ-TMT3基因组AB617797和一姬γ-TMT3基因组(AB617798)。
参考文献
- 1.
Bramley PM, Elmadfa I, Kafatos A, Kelly FJ, Manios Y, Roxborough HE, Schuch W, Sheehy PJA, Wagner K-H:维生素E.科学食品农业。2000,80:913-938。10.1002 / (SICI) 1097 - 0010 (20000515) 80:7 < 913:: AID-JSFA600 > 3.0.CO; 2 - 3。
- 2.
Herbers K:转基因植物的维生素生产。植物营养与肥料学报。2003,19(4):429 - 434。10.1078 / 0176-1617-01024。
- 3.
王永华:生育酚合成相关蛋白的核酸序列分析。国际专利申请WO 01/79472。2001.
- 4.
陈志强,陈志强。豆油的功能和总含量的遗传变异。植物营养与肥料学报。2009,31(4):531 - 534。10.1104 / pp.109.146282。
- 5.
天然和全外消旋α -生育酚在人体中的生物利用度和效力:一种争议。中国科学(d辑),2000,39(6):514 - 514。10.1007 / s003940070010。
- 6.
Van Eenennaam AL, Lincoln K, Durrett TP, Valentin HE, shwmaker CK, Thorne GM, Jiang J, Baszis SR, Levering, Aasen ED, Hao M, Stein JC, Norris SR, Last RL:从拟南芥突变体到大豆油的工程维生素E含量。acta botanica sinica, 2017, 36(5): 772 - 772。10.1105 / tpc.015875。
- 7.
Ujiie A, Yamada T, Fujimoto K, Endo Y, Kitamura K: α-生育酚高含量大豆品种的鉴定。植物营养与肥料学报,2005,32(5):531 - 534。10.1270 / jsbbs.55.123。
- 8.
Tavva VS, Kim YH, Kagan IA, Dinkins RD, Kim KH, Collins GB:过表达α-生育酚的大豆种子α-生育酚含量增加白苏子γ生育酚甲基转移酶基因。植物营养与肥料学报,2007,26(4):451 - 457。
- 9.
Christen S, Woodall AA, Shigenaga MK, Southwell-Keely PT, Duncan MW, Ames BN: γ-生育酚诱捕致突变性亲电试剂,如NOx和补体α-生育酚:生理学意义。美国国家科学院学报。1997年,94:3217 - 3222。10.1073 / pnas.94.7.3217。
- 10.
Jiang Q, Christen S, Shigenaga MK, Ames BN: gamma-生育酚,美国饮食中维生素E的主要形式,值得更多的关注。美国临床营养学杂志,2001,74:714-722。
- 11.
Munné-Bosch S, Alegre L:植物中生育酚和生育三烯醇的作用。中国生物医学工程学报,2002,21:31-57。
- 12.
红花突变体的鉴定和遗传特征与改良生育酚谱。植物育种。2005,24(4):459-463。10.1111 / j.1439-0523.2005.01150.x。
- 13.
Hass CG, Tang S, Leonard S, Traber MG, Miller JF, Knapp SJ:向日葵中三个非等位相互作用的甲基转移酶突变产生新的生育酚(维生素E)谱。中国生物医学工程学报。2006,13:767-782。10.1007 / s00122 - 006 - 0320 - 4。
- 14.
Marwede V,GUL MK,Becker HC,Ecke W:QTL控制冬季油菜中的生育酚含量的映射。植物育种。2005,124:20-26。10.1111 / J.1439-0523.2004.01050.x。
- 15.
罗奇福德,王继杰,王继杰,王继杰,王继杰:提高玉米中维生素E水平的研究。中国农业科学,2002,21:1918-1988。
- 16.
作者:李文杰,李文杰,李文杰,李文杰,李文杰,李文杰,李文杰,李文杰。玉米籽粒维生素E水平自然变异的遗传基础研究拟南芥.美国国家科学院学报。2006年,103:18834 - 18841。10.1073 / pnas.0606221103。
- 17.
李辉,刘辉,韩艳,吴晓霞,滕伟,刘刚,李伟:不同环境下大豆籽粒维生素E含量QTL的鉴定。中国科学:地球科学。2010,30(4):497 - 503。10.1007 / s00122 - 010 - 1264 - 2。
- 18.
Dwiyanti MS, Ujiie A, Thuy LTB, Yamada T, Kitamura K:大豆种子α-生育酚高含量的遗传分析。植物学报。2007,57:23-28。10.1270 / jsbbs.57.23。
- 19.
Van Ooijen JW: MapQTL®5、用于绘制实验群体数量性状位点的软件。编辑:Kyazma BV。荷兰瓦赫宁根;2004:。
- 20。
Phytozome。[http://www.phytozome.net/soybean.php]
- 21。
Shintani D, DellaPenna D:通过代谢工程提高植物的维生素E含量。科学。1998,282:2098-2100。
- 22。
Sakata-Takatani K, Matsuo N, Sumiyoshi H, Tsuda T, Yoshioka H:在小鼠前α 1(V)胶原蛋白基因(Col5a1)的核心启动子中鉴定了一个功能性cbf结合ccaat样motif。生物医学杂志。2004,23:87-99。10.1016 / j.matbio.2004.03.003。
- 23。
转录因子CCAAT/增强结合蛋白家族的生物学作用。中国生物医学工程学报。1998,27(4):531 - 534。10.1074 / jbc.273.44.28545。
- 24.
Fornalés,sonbol fm,Maes T,Capellades M,PuigdomènechP,Rigau J,Caparrós-Ruiz D:玉米和拟南芥的下调肉桂酸O-甲基转移酶基因的两个新的玉米R2R3-MYB转录因子。植物生态学报。2006,32(6):593 - 598。10.1007 / s11103 - 006 - 9058 - 2。
- 25.
异质近交系(HIF)分析:一种开发数量性状位点不同的近等基因系的方法。应用计算机学报,1997,5:1005-1011。10.1007 / s001220050654。
- 26.
Liebault M, Thibivilliers S, Bilgin DD, Radwan O, Benitez M, Clough SJ, Stacey G:大豆基因表达正常化的四个内参基因的鉴定。植物遗传资源学报,2008,29(1):44-54。10.3835 / plantgenome2008.02.0091。
- 27.
Cheng Z, Sattler S, Maeda H, Sakuragi Y, Bryant DA, DellaPenna D:高度分化的甲基转移酶催化蓝藻和光合真核生物中生育酚和质体醌合成的保守反应。acta botanica sinica(云南植物学报),2003,30(5):593 - 598。10.1105 / tpc.013656。
- 28.
陈志强,陈志强,陈志强,等:菠菜叶绿体外膜和内膜中戊基醌类化合物的定位和合成。生物化学学报。1985,38:290-299。10.1016 / 0003 - 9861(85) 90167 - 5。
- 29.
Wang S, Kanamaru K, Li W, Abe J, Yamada T, Kitamura K: α-生育酚和叶黄素在大豆种子中可能同时富集(G甜菜碱马克斯(l)稳定)。植物营养与肥料学报。2007,27(6):489 - 494。10.1270 / jsbbs.57.297。
- 30.
宋庆杰,Marek LF, Shoemaker RC, Lark KG, Concibido VC, Delannay X, Specht JE, Cregan PB:一种新的大豆整合遗传连锁图谱。《中国科学:地球科学》2004年第9期。10.1007 / s00122 - 004 - 1602 - 3。
- 31.
宋庆杰,贾广发,朱玉玲,Grant D, Nelson RT,黄安义,Hyten DL, Cregan PB:大豆SSR基序丰度和候选多态性SSR标记(BARCSOYSSR_1.0)的开发。作物科学,2010,50:1950-1960。10.2135 / cropsci2009.10.0607。
- 32.
Manly KF, Cudmore RH, Meer JM: Map Manager QTX,用于基因图谱绘制的跨平台软件。《哺乳动物基因组》,2001,12:930-932。10.1007 / s00335 - 001 - 1016 - 3。
- 33.
拟南芥信息资源(TAIR)。[http://www.arabidopsis.org/index.jsp]
- 34.
国家生物技术信息中心。[http://www.ncbi.nih.gov]
- 35.
Tamura K, Dudley J, Nei M, Kumar S: MEGA4:分子进化遗传学分析(MEGA)软件版本4.0。生物科学进展。2007,24:1596-1599。10.1093 / molbev / msm092。
- 36.
基于神经网络的叶绿体转运肽及其裂解位点预测方法。中国生物医学工程学报。1999,8:978-984。10.1110 / ps.8.5.978。
- 37.
Hall TA: BioEdit:一个用户友好的生物序列比对编辑器和分析程序,Windows 95/98/NT。核酸学报。1999,41:95-98。
- 38.
Napoli C, Lemieux C, Jorgensen R:将嵌合查尔酮合成酶基因引入矮牵牛中,可导致反式同源基因的可逆共同抑制。acta botanica sinica(云南植物学报),2010,29(2):429 - 434。
- 39.
- 40.
PLANTCARE。[http://bioinformatics.psb.ugent.be/webtools/plantcare/html/]
- 41.
用于植物基因高通量功能分析的门户克隆载体。植物生理学报。2003,33(3):462-469。10.1104 / pp.103.027979。
- 42.
含内含子的β-葡萄糖醛酸酶(GUS)报告基因在烟草中的构建和表达植物营养与肥料学报。2000,31(4):513 - 518。
- 43.
克劳SJ,弯曲AF:花卉浸:Arazacterium介导的Arabidopsis Thaliana的简化方法。工厂J. 1998,16:735-743。10.1046 / J.1365-313x.1998.00343.x。
- 44。
GUS融合:β -葡萄糖苷酶在高等植物中作为敏感和通用的基因融合标记。中国海洋大学学报(自然科学版),1997,6:3901-3907。
确认
本研究得到了日本文部科学省科学研究资助项目19380001的资助。农林渔业先进技术利用项目,18063我们要感谢Satoshi Watanabe博士在开发SSR标记用于精细定位方面提供的有用建议。我们要感谢柴山女士、石本女士和浅野女士的技术援助。
作者信息
隶属关系
相应的作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
MSD参与了所有实验的构思、设计和执行。TY负责精细定位和基因表达分析。遗传多态性分析采用质谱分析。JA参与了定位群体的遗传分析。KK负责种子含量评估,参与实验构思。所有作者都对手稿的撰写做出了贡献。所有作者阅读并批准了最终的手稿。
作者为图像提交的原始文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Dwiyanti, m.s., Yamada, T., Sato, M.。et al。γ-生育酚甲基转移酶基因的遗传变异是提高大豆种子中α-生育酚含量的重要原因。BMC植物杂志11,152(2011)。https://doi.org/10.1186/1471-2229-11-152
收到了:
接受:
发表:
关键字
- 简单序列重复标记
- 十六烷基三甲基溴化铵
- 总生育酚
- 表型变异解释
- 十六烷基三甲基溴化铵法