摘要
背景
谷物淀粉中的淀粉酱淀粉素比的操纵已被鉴定为具有新功能性质的淀粉的主要靶标。在小麦中,据报道,转基因方法的淀粉分支酶基因的沉默导致直链淀粉含量增加,占总淀粉的70%,表现出新颖和有趣的营养特征。
在这项工作中,淀粉分枝酶IIA(SBEIIa)的功能已经通过耕地瞄准面包小麦。已经使用PCR产物的高分辨率熔化筛选了EMS诱变的小麦群,以鉴定编码六倍体基因组中靶酶的三种同源基因中的功能性SNP。
结果
结果共鉴定出56个、14个和53个新等位变异SbeIia-A.,Sbeiia-B和Sbeiia-D..通过生物信息方法评估突变对蛋白质结构和功能的影响。针对三种同源中的每一个鉴定出含有非感觉或剪接位点突变的两个推定的零等位基因SBEIIa基因;QRT-PCR分析显示其基因表达的显着降低,导致含淀粉含量增加。与对照相比,不同单零同源均允许分离双核突变体的双核突变体,显示均匀含量高达21%。
结论
耕作已成功地用于产生新的等位基因SBEIIa已知在小麦中控制直链淀粉含量的基因。单个和双重SBEIIa基因型已发现直链淀粉含量显著增加。
背景
储备淀粉代表小麦粉的主要成分,其构成小麦核的大约60-70%,并由两种称为淀粉糖和淀粉素的葡聚糖聚合物的混合物化学组成,代表总淀粉的20-30%和80-70%,分别。两种葡聚糖聚合物在其聚合程度和分支中不同:支链基本上是线性的(DP <104支链淀粉是高度分枝的(DP 105-106).两种葡聚糖聚合物与淀粉的功能性有不同的贡献,并且已经鉴定为具有新型物理化学性质的淀粉的主要靶标的淀粉/淀粉菌蛋白比的调节。特别是,由于其独特的营养特性,以及其技术特征,高淀粉淀粉是越来越多的需求,并且其技术特征在于在食品以及非食品领域开放新的应用[1- - - - - -5].
营养学家和食品工业越来越关注具有高淀粉淀粉的谷物,因为衍生的食物具有增加的抗性淀粉,其具有与肠内的膳食纤维类似的作用,保护重要的饮食相关疾病[4].淀粉生物合成的增加的了解是测定改变淀粉中的直链淀粉量的有效方法的必要先决条件。已经鉴定了几种淀粉酶作为调节淀粉/淀粉菌素比的关键因子。
两种淀粉聚合物由不同途径从共同的底物,Adp-葡萄糖合成。直链淀粉生物合成涉及单一酶,GBSSI(颗粒结合淀粉合酶I),称为蜡质蛋白。相反,支链淀粉的支化结构是更复杂的生物合成机制的结果,涉及几种酶:不同类型的淀粉合酶(SSS)通过催化α-1,4葡糖苷键的形成促进葡聚糖链的伸长;淀粉分支酶(SBE)将α-1,6链路引入葡聚糖骨架;脱支酶(DBES)从葡聚糖链中除去多余的枝,有助于最佳填充淀粉颗粒的半结晶结构[6,7].
控制小麦淀粉组成的方法涉及经典和生物技术策略。对siia(也称淀粉颗粒蛋白-1,SGP-1)和SBEIIa基因的沉默是目前提高直链淀粉含量的两种成功策略。由于淀粉颗粒蛋白很容易通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测到,因此通过筛选自然种质和突变群体,可以识别多个缺失三种可能的SGP-1亚型之一的突变系[8,9].没有SSIIa已被发现会导致面包中直链淀粉的显著增加[10.](高达35%)及硬粒小麦[11.(高达45%)。小麦中存在两类SBE, SBEI和SBEII;后者包括两种亚型,SBEIIa和SBEIIb。据报道,SBEI的损失对淀粉组成的影响不大[12.].SBEIIa和SBEIIb已经表征并发现基因位于同源群2染色体的长臂上[13.].SBEIIa已被证明是最丰富的亚型,主要存在于胚乳提取物的可溶性部分,而SBEIIb更多地在淀粉颗粒中出现[14.].
通过使用RNA干扰(RNAi)来沉默目标基因的所有拷贝的能力使得两种不同的SBEII亚型的作用和功能得以阐明。沉默的SBEIIa和SBEIIb面包小麦的同源基因家族显示,只有SBEIIa亚型的缺失与转基因株系中直链淀粉比例的高增加有关(高达总淀粉的70%)[15.].尽管RNAi现在已被证明在面包和硬粒小麦的高直链淀粉系生产中有效[15.,16.[仍然没有完全接受转基因技术,仍未完全接受,遇到来自公众和政府的抵抗力。
在过去的60年里,经典诱变技术在作物育种中得到了广泛的应用,最近又作为一种有效的方法重新出现,利用和修改控制作物重要性状的基因的功能。化学诱变处理提供了一种有效的工具来产生目标生物基因组的高密度突变,尽管在多倍体中,一个基因的多个副本的存在是正向遗传学方法检测有价值性状的有趣表型的主要限制。然而,最近在突变序列水平检测方面的发展,加上基因组和EST序列数据的可用性增加,导致了一种新的反向遗传学策略的发展,称为TILLING(靶向诱导基因组局部病变)[17.].这项技术是在拟南芥上开发的,但现在已经成功地应用于包括小麦在内的几种作物,其中与淀粉特性相关的性状已经被成功地定位。斯莱德等等。[18.]确定共246个小说蜡状(GBSSI)等位基因与不同同源性的空突变体杂交产生蜡质表型。同样,Sestili等等。[9]鉴定出在三种同源物中存在的等位基因变异增加SSIIa通过分析面包小麦品种华彩的突变群体,利用正向遗传学和TILLING的结合。最近,Uauy等等。[19.]使用改进的耕作方法检测到新的等位基因变异SBEIIa和SBEIIb四倍体和六倍体小麦的基因。
用于检测用于耕作中使用的DNA多态性的最熟悉的方法是基于核酸核酸酶的异拷贝错配裂解测定[17.].一种替代技术,高清晰度的熔化™(HRM),从DNA解链分析的现有技术的组合导出与新一代的dsDNA的荧光染料[20.]也可以使用。这种方法的敏感性和特异性的用于检测从基因组DNA的PCR产物的突变,并在最近在TILLING [已成功地应用于21.,22.].
在本研究中,TILLING已经被用于定位编码SBEIIa酶的基因,旨在开发具有高直链淀粉含量和新型淀粉功能的非转基因小麦基因型。
结果
耕作的最佳基因组区域选择
通过对SNP检测中的最佳敏感性的优化敏感性要求,耕种多倍体物种复杂化。作为三个SBEIIa同源性在编码序列中共享高相似性,比较三种基因的内部区域以鉴定序列多态性,以促进等位基因特异性PCR引物的设计。还选择用于耕种的PCR扩增子以满足某些条件。由于我们的主要目的是鉴定靶向基因中的功能突变,评估潜在扩增子的外显子密度,以便在编码序列中选择尽可能富有的片段。考虑到通常由EMS处理通常诱导的过渡突变的类型(G→A; C→T),用于选择耕作片段的进一步标准是寻找有害SNPS(影响剪接位点或引入止轭密码子的突变)的概率(G→A; C→T)。
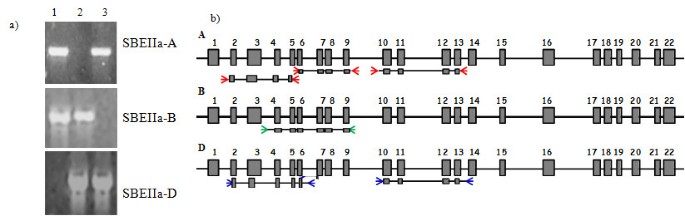
选择用于耕作分析的基因组区域如图所示1B..扩增子的长度在1700 ~ 2200 bp之间变化。基因的三个不同区域被选择SbeIia-A.homoeoallele,两Sbeiia-D.一个for.Sbeiia-B.针对每个靶标设计了基因组的引物对,并使用同源族组2染色体的D-基因组发育替代线进行验证,通过JOPPA和Williams在杜兰瓜小麦品种兰登生产[23.](图1A).
HRM检测snp
别处描述了EMS-诱变的面包小麦群[24.].简单地说,这是来自英国春小麦品种Cadenza的种子,用0.6%或0.9% EMS溶液处理过夜,然后生长至成熟。从每个M1植物和每个耳朵的一粒播种以产生m2种群约4500个独特品系。从单株叶中分离到基因组DNA2植物和米3.种子被收获并存档。M2将DNA样本进行双重汇总,并筛选目标区域的突变(A(II-V),一个(VI-IX.),一个(X-XIII);B(IV-IX);D(族化合物) e D(X-XIII)ofSBEIIa(图1B.).
考虑到其特殊的基因组结构,选择HRM作为检测靶基因中SNP的最合适的方法。SBEIIa每个基因包含22个外显子,大小在40 ~ 240 bp之间,跨越10 kb的区域;此外,每个外显子由大小达1kbp的内含子分隔。为了限制内含子中检测到的突变数量,并注意到HRM对较小的片段(100-400 bp)的分析最敏感,我们选择生成每个覆盖单个外显子区域的HRM扩增子。由于很难为每个外显子设计同等位基因特异性的引物,因此采用嵌套PCR方法获得适合HRM分析的最佳扩增子。第一轮,同等位基因特异性PCR片段,如上所述,在2中作为模板nd圆形PCR,引物对每一个包含外显子。2nd在每个目标外显子两侧的内含子中设计圆形引物,定位剪接位点约5-20个核苷酸,得到大小为100 ~ 350 bp的HRM PCR扩增产物。
HRM分析优化
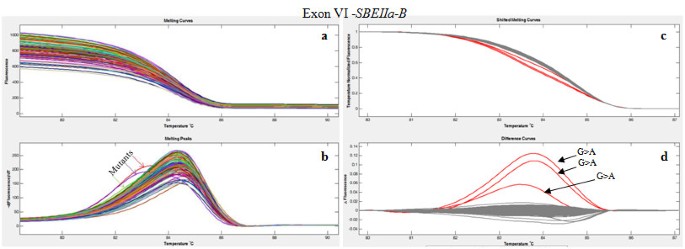
人力资源管理技术的原理是基于dsdna特异性插入染料在温度诱导DNA双链变性过程中的荧光变化。当样品的温度缓慢升高时,HRM仪器可以实时监测荧光变化。虽然同源双工DNA中snp的检测是可能的,但异源双工DNA中不匹配碱基的存在所造成的不稳定性增加了敏感性,产生了一条熔体曲线,其特征通常是在比野生型同源双工DNA更低的温度下荧光丧失[20.].在TILLING分析中,杂双链来自野生型和突变型扩增子的熔化和重新退火,在PCR前通过对基因组样本进行双重池处理产生。
对于每一对第二轮引物,我们都进行了PCR条件的优化和后续的HRM步骤,注意到LCgreen Plus染料的存在增加了引物Tm,从而提高了PCR反应的最佳退火温度。对扩增子熔体曲线的分析也证实了PCR的特异性。虽然通过对比ΔF/T曲线可以检测到突变的存在(图2,面板d)由HRM软件生产的,观察DF / DT曲线(图2(图b)已被证明对进一步确认突变有用。事实上,与正常扩增物相比,异质双工在较低温度下表现出dF/dT曲线明显偏移。所有扩增子均在75°C- 95°C的温度范围内进行了分析;覆盖外显子II和外显子V的两个扩增子在更高的温度下进一步分析,以优化其GC丰富域的分析(数据未显示)。
新的等位基因变体SbeIia-A.,SBEIIa-B和SBEIIa-D同性恋者
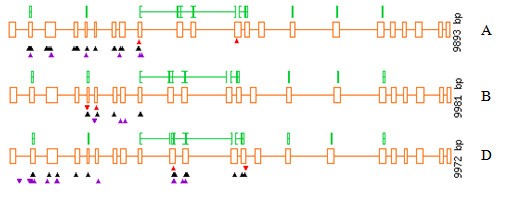
从TILLING文库的基因组DNA的筛选是鉴于与此六倍体小麦EMS-诱变群体相关联的高突变密度对两个折叠池进行。在表1对这三个基因分别分析的植物数量和确定的突变体数量SBEIIa-A, SBEIIa-B和Sbeiia-D.报告。突变密度计算公式为:(扩增子总大小)×(筛选株数)/(鉴定突变数)。在53个新的等位基因中(加上3个重复的突变)SBEIIa-一个其中36个是错义突变,15个是沉默突变,2个是截断突变。50个新的等位基因(加上3个重复的突变)被鉴定为SBEIIa-D其中错义突变34个,沉默突变14个,剪接突变1个,非义突变1个。在14本小说中SBEIIa-b等位基因10是错误的,1个截断和1个剪接结突变(表2,3.).扩增子A中鉴定的18个假定突变体(X-XIII)除一个无意义的等位基因位于外显子XII外,没有测序特征。
我们估计总体突变密度为每40 kb筛选1个突变。所有被鉴定的突变都显示为C→T或G→A型的转变,正如EMS处理所预期的那样,EMS通过G残基的烷基化作用。基因型分别为C2907T和G5158ASbeIia-A.分别在外显子IX和XII中的等位基因被称为SbeIia-A.-1和SbeIia-A.-2;这两个基因型为Sbeiia-B被命名为Sbeiia-B-1(G1948A,外显子VI无意义突变)和Sbeiia-B-2(G1916A,3'Intron V的剪接部位);D基因组等位基因的突变体C3693T(外显子X中的非敏感突变)和G5335A(Intron XIII的5'接合位点)分别命名Sbeiia-D.-1和Sbeiia-D.-2.
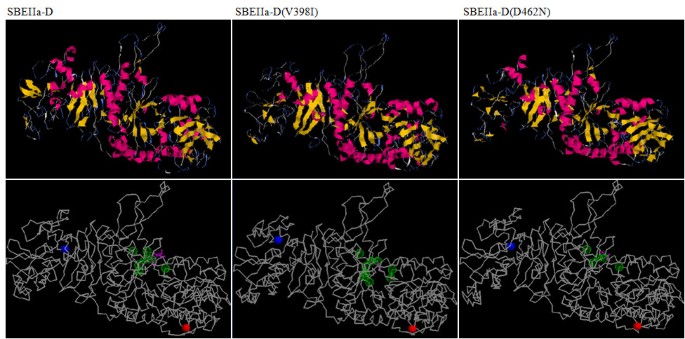
非同义SNP导致蛋白质中的氨基酸变化,可以影响蛋白质功能与不同的范围。为了评估所识别的错误感觉突变的效果,基于Web的程序Parsesnphttp://www.proweb.org/parsesnp/已被使用(表3.;数字3.).ParseNNP利用两种不同的生物信息工具,PSMM(定位刻划基质)和SIFT(分选免受耐受性的分类),其预测氨基酸取代是否基于序列同源性和氨基酸的物理性质影响蛋白质功能[25.].对未发现的非同义突变的PARSENP分析SbeIia-A.,Sbeiia-B和Sbeiia-D.导致的4,1和8错义突变,分别被预测为对蛋白质的功能严重的影响鉴定。对于四组蛋白变体SBEIIa-A(P206S), SBEIIa-A(A208V), SBEIIa-B(A205V)和SBEIIa-D(A201T)由EMS处理诱导的氨基酸变化位于糖原分支酶系列的N-末端结构域的区域中,据报道对转移的葡聚糖链的尺寸是必不可少的,并且还为催化活性的[26.].氨基酸改变H362Y,G374R,G390S,V398I和D462N,用于SBEIIA-D蛋白质,全部局部化(α/β)8α-淀粉酶家族相关酶的桶催化结构域。通过与糖原分支酶的晶体结构同源性鉴定了3个SBEIIa蛋白的二级结构和催化残基大肠杆菌,分支酶家族的模型蛋白[27.].上的这些信息的基础上,已经确定的是,氨基酸改变G390S和D462N在两条链的局部β3和分别的β4的(α/β)8桶域;H362Y邻近已知参与催化的Tyr361残基,而V398I位于Asp396和His401之间,也直接参与酶活性。
为了更详细地研究上述新的SBEIIa变异,将氨基酸序列提交到i-Tasser程序中http://zhanglab.ccmb.med.umich.edu/I-TASSER/[28.预测蛋白质的三维结构和功能。通过比较未突变和突变的SBEIIa蛋白的模拟三维结构,大多数情况下突出了底物结合位点模式和蛋白质二级结构的差异。在图4我们以SBEIIa-D为例(V398I):虽然在野生型蛋白质残留物398中涉及(α/β)的β3链8域,在突变的蛋白质中,它处于线圈结构。此外,该程序预测了正常和突变蛋白质的底物结合位点的不同模式:在SBEIIA-D中预测的七个结合位点预测,在SBEIIA-D(V398I)六个残基是保守的和两个新的残基导致参与底物结合(图4).相反,在SBEIIa-D(D462N)突变导致正常SBEIIa蛋白中参与结合和催化活性的7个氨基酸中的2个失去,分别是Arg465和Asp467。
分析SBEIIa-敲除突变体的转录本
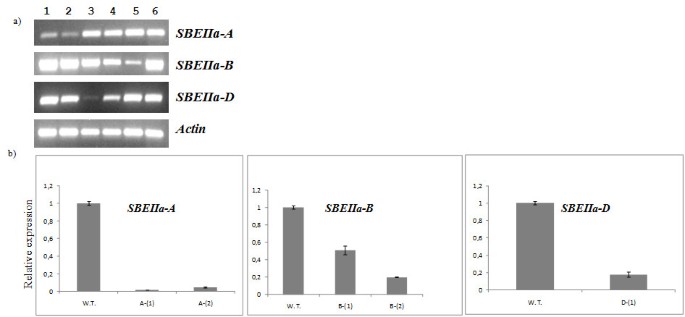
三的表达SBEIIa基因在5个推定敲除突变体的纯合子系中进行了评估,SBEIIa-一个-1,SBEIIa-一个-2, SBEIIa-B-1,SBEIIa-B-2和SBEIIa-D-1.所有这些等位基因都是无感的突变体与外Sbeiia-B-2,这是一种剪接现场突变。通过比较三个编码区域来设计等位基因特异性QRT-PCR引物对SBEIIa基因。在某些情况下,通过三种基因之间的小诱导提供特异性;否则基于其3'末端的序列多态性设计引物。通过PCR验证了引物的特异性在Langdon D-基因组发育替代线的基因组DNA上验证。半定量和实时QRT-PCR实验在纯合突变株中的未成熟种子(18dPa)分离的总RNA上进行,以研究表达水平SBEIIa基因受到假定的敲除突变的影响SBEIIa单零基因型。
数字5的急剧下降SbeIia-A.在两个无意义突变系的转录SbeIia-A.-1和SbeIia-A.-2与野生型基因型相比。类似的效果在Sbeiia-B-2和Sbeiia-D.-1基因型,显示了转录水平的严重下降,由于剪接和非意义突变,分别在基因表达。在一个案例中,Sbeiia-B-1,基因序列中过早的止挡密码子的存在并未导致其转录物的强烈减少。还研究了每个突变基因型,用于表达两种剩余的野生型同源拷贝SBEIIa.没有明显的差异,在这种情况下,检测出相对于野生型植物。
通过Real Time RT-PCR对5个推定敲除突变体的基因沉默程度进行了量化(图)5 b).我们注册在两对基因表达的作用最强SbeIia-A.零线,SbeIia-A.-1和SbeIia-A.-2:靶等位基因的转录水平分别降低到野生型对照的1.7%和3.3%。在其他零基因型中发现了较弱的效应:B等位基因,Sbeiia-B-1(无意义)和Sbeiia-B-2(接头位点)被发现,分别以野生型水平分别为20%和12%表示Sbeiia-D.发现等位基因减少了8.5倍Sbeiia-D.-1基因型。
为了探讨剪接结(S.J.)突变(Intron v)对基因转录的影响(3'S.j.j.j.j.j.j.j.j.j.j.j.j.j.j.j.j.j.j.japs II至Ix的引物用于将转录物分离出来Sbeiia-B-2突变体。PCR扩增出两个大小不同的条带:更大的产品显示包含V基因内区,而较小的一个被发现包含删除前七核苷酸第六外显子,内含子的存在V在更长的记录显示,在3 '剪切位点突变的基因内区V造成错误的拼接Sbeiia-B.在较短的片段中发现的外显子VI的删除可能是由于选择替代接头网位,定位5个核苷酸下游正常的S.J.网站。此前在植物中发现了最后一个机制[29.,30.],并通过剪接体的局部扫描来解释,剪接体可以根据序列环境选择最佳的内含子3'剪接位点[31.].在该结处的未成熟mRNA剪接将导致框架移位突变导致生产过早止芯密码子。
估计直链淀粉含量,总淀粉和种子重量
为了检测Null突变的表型效果SBEIIa基因,在三个单一突变体中测量淀粉糖含量SBEIIa-一个-1, SBEIIa-B-1和SBEIIa-D-1(表4).我们的结果表明,对于正常基因型,三种基因型中的三种基因型中的直链淀粉含量增加。
双零线SBEIIa(SBEIIa-一个-1B-1, SBEIIa-一个-1D-1, SBEIIa-B-1D-1),通过杂交的单空基因型和选择F2材料和方法中所述的后代。两种零同源物的功率相关的结果与野生型相比包含17% - 21%的直链淀粉含量(表4).此外,100粒重的单、双零基因型与对照相比差异不显著,但总淀粉含量在单、双零基因型中降低了2% ~ 8%(表1)4).
讨论
在过去的二十年中,食品科学家突出了淀粉的修改,作为营养和工业用途的谷物产品赋予附加值的主要目标[7].在小麦中利用天然存在的变异以产生具有新特性的淀粉[8,32.].在多倍体中,突变在单一同源物中的突变常常通过固有的遗传冗余来掩盖;因此,对突变的前瞻性遗传筛查需要基于有效的上酶或分子标记的筛选。此外,天然群体中大多数靶基因座的突变短缺使得鉴定期望的基因型缓慢过程[32.].对于蜡状和SGP-1,可以区分三种同源基因的单个蛋白质产物的测定的可用性导致了用于改变小麦中淀粉功能的完整单零突变体的鉴定[10.,32.,33.].然而,基于自然遗传变异的育种计划的负面方面是称为联系阻力的现象。因此,需要广泛的回复,以消除从外来父母材料继承的不良角色,使得繁殖计划耗时消耗。
在这项工作中,耕种是旨在识别新型遗传变异的工具SBEIIa轨迹。在TILLING理想变异通过饲养员或研究者从而减少拖动的遗传选择的商业品种内产生,虽然回交仍然需要以除去过量的突变可能影响其他字符。在多倍体作物TILLING的一个缺点,相对于其他的反向遗传学方法,如RNA干扰,是突变编码靶蛋白质的基因的所有功能拷贝结合的需要。三大金字塔零等位基因目前正在进行,包括与Cadenza的回交,我们的目标是在两年内完成这项任务。另一方面,TILLING鉴定出的突变体不被认为涉及基因操作,而且相对不受公众和立法的关注,而且与需要生产转基因植物的RNAi不同,它可以立即引入育种计划并在田间进行测试。如果在二倍体物种中,化学诱变使其有机会很容易地检测到与关键基因突变相关的表型变化,那么多倍体对突变具有更高的耐受性,从而在种群中具有更高的密度。这为通过筛选实际数量的突变个体来识别靶基因中的各种突变提供了可能性。
耕作的SBEIIa基因导致生产大型等位基因系列,这不仅是淀粉改性的宝贵资源,而且还用于研究靶向酶中的结构功能关系。发现SBES含有三个结构域:氨基末端结构域,羧基末端结构域和中央催化结构域[27.,34.].n端区域对确定链长很重要,是最大酶活性所必需的[26.,35.].在这项工作中的蛋白质变体在SBE的功能结构域,其特征在于突变酶已被鉴定,并通过能够预测蛋白质结构和功能的氨基酸取代的作用生物信息学工具进行分析。
尽管已经发现了一些可能影响酶活性的误义突变,但小麦的多倍体特性阻止了对这些表型等位变异的即时评估。因此,从作物育种的角度来看,值得关注的突变是那些已知的可以防止基因完全表达的突变,如无意义和剪接位点定位的多态性。为了提高敲除突变体的检测频率,我们仔细选择了具有丰富密码子CAA、TGG、CAG和CGA的基因区域。溺爱的应用程序http://www.proweb.org/coddle/有助于评估基因序列中截断突变频率;然而,我们发现通过人工序列分析可以更准确地选择片段。最终筛选出的基因片段大小大于CODDLE限制的基因片段(最大可达1500 bp)。
一般来说,基因snp的有效检测依赖于特异性PCR产物的产生,因此需要开发同源等位基因特异性引物。在小麦中,获取目标基因的全序列数据可能是一项重大挑战,尽管随着霰弹枪和完全组装的序列数据的出现,这一挑战可能在未来几年内大大缓解。我们能够通过识别这三个基因间存在的多态性来设计等位基因特异性引物对SBEIIa基因。在某些情况下,寡核苷酸被设计成相应的indel多态性;然而,利用正向和反向引物中的3'端SNP也有可能开发出特异性引物对。另外,最近的一项研究表明,可能使用非同源等位基因特异性PCR检测多倍体中的突变[21.,尽管在我们手中这导致了灵敏度的降低。
高分辨率融化最近已被应用于包括番茄和小麦在内的植物品种的耕作[21.,22.,36.].它是一种封闭的基于PCR的检测方法,不需要进一步的PCR扩增;与其他耕作方法(如Cel1消化法)相比,这在成本和节省时间方面具有显著优势[37.].在我们的工作中,人力资源管理的选择是强烈建议考虑的结构SBEIIa基因,含有许多小外显子(43-242bp),由尺寸的内含子打断。由于HRM最适合分析高达400 bp的碎片[38.]这让我们允许我们瞄准个人外显子SBEIIa基因。虽然基于Cel1酶切的传统TILLING可以分析更大的扩增子(最高1500 bp),但结果是可以检测到内含子区域的突变,不包括内含子剪接位点的突变,这些突变不会影响蛋白质功能[18.].
人力资源管理允许在双重基因组DNA池中有效检测snp。本研究中所使用的小麦群体突变频率高,不需要进行深度汇集以提高筛选的吞吐量。我们发现每40 kb的突变密度为1个SNP,这与之前的报告一致[36.引用了通过传统的基于细胞1的耕作法筛选相同小麦群体的类似结果。
Hofinger等等。[37.]最近报道HRM在检测距PCR引物距离小于20 nt的突变时效率较低。我们的数据与这一假设一致;事实上在某些情况下PCR引物设计的距离小于10的核苷酸从5’和3’端外显子所提出的人力资源管理软件制造商提供的引物设计,这个条件可以检测到突变的数量有限的外显子剪接网站分析。鉴于此,我们只在剪接位点上检测到两个突变,而且在这两种情况下,引物的设计距离外显子的末端至少20 nt。
四种无感性基因型SbeIia-A.-1, SBEIIa-A-2, SBEIIa-B-1和SBEIIa-D-1提出一个定位于前12个外显子的过早终止密码子SBEIIa抑制含有功能蛋白(α/β)的基因8对于酶活性桶催化结构域是至关重要的。另外,两种基因型Sbeiia-B-2和Sbeiia-D.-2存在剪接连接突变,分别位于外显子VI的5'端和外显子XIII的3'端,通过引入过早终止密码子,阻止了SBEIIa酶催化结构域的正确翻译。
无意义突变对植物基因表达的影响的研究是一个探索较少的课题[39.,40].我们发现,基因序列中的无意义突变与对照基因型中转录水平的可检测下降相关。此外,剪接结点突变Sbeiia-B-2也与基因表达的显着降低有关。对于每个突变基因型,我们测试了所有三种同源的表达水平SBEIIa拷贝发现,只有无意义突变(或剪接位点突变)的基因表达水平急剧下降。齐藤和中村[41用于]报道了类似的结果Wx-A1-突变体以基因序列的过早止血密码子特征。赞助人等等。[42据报道,通过诱变衍生的大麦蜡状突变体的表征,其中过早的止动密码子与蛋白质产品的不存在相关;在这种情况下,发现突变等位基因的转录物水平类似于野生型。朱镕基发现了类似的结果等等。[43用于小麦突变体,通过化学诱变获得的,缺乏所述高分子量麦谷蛋白亚基Bx14由于过早终止密码子的存在。在我们的敲除突变体检测转录物水平的降低表明质量控制防止非功能性的或有害的截短的蛋白质,其先前已经描述并且被称为无义介导的mRNA降解(NMD)的积累的机构的干预[44].虽然这一机制在哺乳动物中有广泛的特征,但其在植物中的作用方式却知之甚少。哺乳动物的NMD发生在包含内含子的基因中,当过早终止密码子位于最后一个外显子-外显子连接的上游55个核苷酸或更多[45].据报道,在植物中,NMD在无内含子基因的情况下也起作用[46从而表明,在哺乳动物中,支配这一机制的规则是不同的;然而,有报道称,在植物中含有一个位于最后一个外显子-外显子连接上游的55个核苷酸的提前终止密码子的几个基因受到NMD的影响[41,47- - - - - -49].
我们所有的敲除突变基因型都在最后一个外显子-外显子连接上游的55个核苷酸处出现过早终止密码子,因此符合哺乳动物NMD的共识。虽然在我们所有的基因型中都检测到突变基因的转录水平下降,但下降的程度在5个基因型中有所不同。特别是突变体SBEIIa- b-1突变等位基因的转录水平没有明显下降。类似的例子在文献中也有报道[42,43表明NMD是一个复杂的机制,需要进一步阐明其在植物中的作用方式。
在对照中估计直链淀粉含量,三种非感应基因型,其可获得种子的种子和衍生自交叉的双重突变体。由于多倍体中的基因冗余施加的补偿,单次突变体中的直链淀粉含量的适度增加可能是可能的,类似于Miura和Sugawara报道的50)和Konik-Rose等等。[51与淀粉生物合成有关的其他基因。由3个单零突变体杂交得到的3个双零株系直链淀粉含量也进一步增加。此外,我们的结果表明,淀粉含量在单和双零的集合适度下降SBEIIa基因型与种子重量损失不相关。这种差异可能是由于麦克里利所报道的估算高直链淀粉谷物总淀粉的方法的局限性等等。[52].
结论,正如之前在小麦中发现的控制直链淀粉含量的其他基因[10.,53,则直链淀粉含量在三重零中会有更高的增长SBEIIa小麦。
结论
这三种基因都有新的等位变异SBEIIa面包小麦中的同种型,代表功能性基因组学研究和小麦改善的宝贵资源。特别是一套完整的单张空SBEIIa在分子和表型水平上鉴定并表征了小麦线。零等位基因的基因表达导致含有NMD机制的干预,以防止产生非官能蛋白的干预。三种单且双零基因型的组表明直链淀粉含量的增加,当可用三零线时,可以进一步增加。完整的空线将用于繁殖活动,旨在增加小麦终点产品中的抗性淀粉水平。
方法
植物材料
ems诱变的春面包小麦cv Cadenza的生产已经在前面描述过[9,24.].
引物设计
利用ClustalW软件对3个基因序列进行比对http://www.ebi.ac.uk/clustalw.利用PRIMER 3程序设计TILLING基因特异性引物和等位基因特异性引物。利用硬粒小麦品种Langdon的同源2组染色体d -基因组二体替换系验证了PCR引物的TILLING分析[23.].根据Tai和Tanksley的报告,从0.2 g绿色组织中提取基因组DNA [54].在表中报告了引物对5.
PCR反应引物评估进行了50μl最后卷使用50 - 100 ng的基因组DNA, 1×红色Taq ReadyMix PCR反应混合(1.5 U Taq DNA聚合酶,10毫米Tris-HCl,氯化钾50毫米,1.5毫米MgCl2, 0.001%明胶,0.2毫米核苷酸)和0.5μM的两个引物。检测引物的扩增条件包括:94°C初始变性5分钟,94°C 1分钟,62-67°C 1分钟,72°C 1分钟,35个循环,72°C最后孵育5分钟。
筛选耕作图书馆
通过嵌套的PCR策略产生分析在耕种中的扩增子。1圣圆形PCR在10μl体积中使用10ng的双倍合并基因组小麦DNA,5μl热拍摄™Mastermix(Cadama Medical Ltd),0.5μm引物。PCR程序是:97°C,5分钟;(97°C,30秒; 62-67,30秒; 72°C为1.5-2分钟)x 38循环;72℃,10分钟。96孔板用于筛选。
对于人力资源管理,1圣圆形PCR反应稀释60倍,以1 μl为模板nd一轮PCR。2nd轮PCR反应如下:稀释后的DNA模板1 μl (1:60);5 μl Hot Shot™Mastermix (Cadama Medical Ltd);1 μl LCGreen +;0.5 μM引物6).所用的PCR程序为:97℃,5分钟;(97℃,30秒; 60℃,20秒; 72℃,20-30 S)×39个循环;72℃,10分钟。最终的延伸步骤后,PCR扩增子在95℃下进行30秒中变性和再退火在25℃持续1分钟。双方1圣和2nd轮PCR反应覆盖10 μl矿物油(Sigma-Aldrich M5904)以防止样品蒸发。2nd对96孔Frame-Star板(4titude Ltd, Surrey, UK)进行了圆形pcr。
光扫描仪高分辨率熔化
96孔板(2ndPCR)用于使用LightScanner仪器(爱达荷州科技公司)HRM。使用从75℃至95的温度范围内将样品加热通常℃。对于含有高GC区域的扩增子进一步分析的温度范围内下进行从85℃至98℃,以SNP检测保证最佳分辨率。
利用仪器自带的LightScanner软件进行数据分析。熔化曲线按照制造商的说明进行了归一化。通过人力资源管理获得的结果可视化为微分曲线ΔF/T,显示各自样品相对于参考样品的荧光的相对差异。F/T归一化曲线显示,随着温度的升高,PCR扩增子变性过程中,每个样品的荧光值都在降低。如制造商说明书所述,ΔF > 0.05被认为是显著的;此外,还观察了熔化曲线的形状和dF/T曲线沿温度轴的位置,并将其作为区分假阳性和真实突变体的标准。确定为假定突变体的样本被选择,扩增子从池中的每个个体中重新扩增,用于测序。DNA序列分析由一家商业测序服务公司(Eurofins MWG Operon, Ebersberg, Germany)进行。的PARSESNPhttp://www.proweb.org/parsesnp/应用用于评估由突变等位基因编码的蛋白质变体。
半定量逆转录酶-聚合酶链反应
在劳德康省 - 清卢卡州报道,从未成熟的种子(18 dPA)中提取总RNA等等。[55经过一些修改。起始原料为0.1 g,所有缓冲液和溶液体积稀释1至10。对于逆转录酶介导的PCR研究,从1 μg总RNA中使用寡核苷酸(dT)引物和上标逆转录酶III (Invitrogen)合成cDNA。每个cDNA取20份作为模板进行PCR扩增。最终体积为20 μl,使用1个单位的Ex-Taq (Takara)、1× buffer、0.2 mM的dNTPs、0.5 μM的引物进行PCR反应。扩增条件包括98°C初始变性步骤,然后在98°C 10秒,58°C 1 min, 72°C 1 min, 35个循环,然后在72°C最后延伸5 min。SBEIIa-一个[EMBL: HE591389] (5 'accagtatgtttcacggaaacac3 ';5 'caccttgtacttcccaggcc3”),SBEIIa-B[EMBL: FM865435] (5 'atatcgtggtatgcaagagttcgac3 ';5 'caagaaagagcgcggccta3”),SBEIIa-D[GenBank登录号:AF338431](5'gaggaagataaggtgatcatcctca3 '; 5'caaagagtgcatcgtcagagtcc3')。小麦肌动蛋白基因的扩增[GenBank登录号:AB181991]作为用于转录扩增参考和使用的引物具有以下序列:(TaACTINF)5'-aagagtcggtgaaggggact-3' 和(TaACTINR)5- ttcatacagcaggcaagcac- 3' 。
隔离的Sbeiia-B剪接突变体的mRNA序列
利用同源等位基因特异性引物5'gacttggcggccactcca 3'和基因特异性引物5'ctctggtcgtttaggttgaggatg 3'从cDNA中分离到基因转录本。
实时RT-PCR(QRT-PCR)
在20μL体积中使用上述CDNA的一种微升的cDNA。对于每个样本,三种技术复制用于PCR扩增。PCR反应由10μLIQ™SYBR绿色Supermix 2×(Bio-rad)组成,其含有缓冲液,DNTPS和SYBR Green I.反应中的前正寡脱氧寡核苷酸引物的浓度为500nm的所有基因兴趣。使用QRT-PCR实验使用iCycler智商(Bio-Rad实验室,大力神,CA1,美国)。扩增条件如下:初始95°C 15 min, 95°C 30 s, 60°C 1 min, 72°C 1 min各40个循环。
相对表达分析采用2-ΔΔct方法(56](Applied Biosystems公司用户公告号2-P / N 4303859)。计算和统计分析是由基因表达宏™1.1版(Bio-Rad实验室,大力士,CA,USA)进行。靶和管家基因的效率通过qRT-PCR对RNA模板的连续稀释液在100倍的范围内确定[57,结果相似(数据未显示)。扩增产物通过凝胶电泳和测序验证引物特异性。每个基因的相对表达量都是在每个时间点的转录水平较最低转录水平增加了1倍。在半定量RT-PCR中,肌动蛋白作为管家基因。
双核选择SBEIIa突变体
双核SBEIIa系是通过杂交获得的SbeIia-A.1-,SBEIIa-B1 -和sbeiia-d1-.采用CAPS或dCAPS引物进行PCR,筛选F2子代双零纯合株系,然后进行特异性限制性内切酶反应。dCAPs引物由dCAPs Finder应用程序设计[57].酶切PCR扩增产物在琼脂糖凝胶(2%)上用溴化乙锭染色以显示条带。
使用的引物和限制性内切酶如下:SbeIia-A.1-(Fw taaatcctcagtgactctggtcgtttaggttgaggattgattgattgattcaccttctaa, Rv aagtgacatatgcattaattcaccttctaa;Xba);Sbeiia-B1- (FW CTGGAGCGCATGTACGTCTTAAC,RV CACCATATCATCCTGAAAAGATCG; MFEI);Sbeiia-D.1-(FW gaggcagtgggcatgtgaaagtc,rv ccaaagcttgcatagtatgaatgctcctggattgccattgtcg; sali)
直链淀粉和总淀粉含量的测定
直链淀粉含量(占总淀粉的百分比)是用碘量法测定的,如Chrastil所报道的[58]用“面团球”法从全面粉中提取淀粉[59].种子是从地里生长的植物中获得的。所有材料均采用了三种生物复制和六种技术复制。
用马铃薯直链淀粉(Fluka 10130)和蜡质小麦支链淀粉混合制成标准曲线。采用Megazymes Total starch Assay Kit (AA/AMG, Megazyme Pty Ltd., Wicklow, Ireland)测定籽粒总淀粉含量。
参考文献
- 1。
SOH HN,SISSON MJ,特纳米:淀粉颗粒尺寸分布和升高的直链淀粉含量对杜兰姆面团流变学和意大利面烹饪质量的影响。谷物化学。2006,83:513-519。10.1094 / CC-83-0513。
- 2。
Waring S:抗性淀粉在食品中的应用。2005年,(http://eu.foodinnovation.com/pdfs/functresist.pdf]
- 3.
Chanvrier H,Appelqvist IAM,鸟AR,吉尔伯特E,Htoon A,李Z,Lillford PJ,洛佩兹-鲁维A,Morell的MK,摘心DL:功能性质和挤出产品的淀粉消化:新颖升高的直链淀粉小麦的处理。ĴAGRIC食品化学。2007年,55:10248-10257。10.1021 / jf0718650。
- 4.
Sajilata Mg,Singhal Rs,Kulkarni Pr:抵抗淀粉:审查。包括重新加入食品SCI食品安全。2006,5:5-17。
- 5.
Freire A, Podczeck F, Veiga F, Sousa J:淀粉基涂料用于结肠特异性输送。第二部分:高直链淀粉玉米淀粉膜的理化性质和体外药物释放。中国生物医学工程学报。2009,31(4):587-594。10.1016 / j.ejpb.2009.02.010。
- 6.
从细菌糖原到淀粉:了解植物淀粉颗粒的生物发生。《植物学报》,2003,54:207-233。10.1146 / annurev.arplant.54.031902.134927。
- 7.
石头B,莫雷尔MK:碳水化合物。在小麦,化学和技术.. 4。编辑:汗K,休夫利公关。AACC国际圣保罗MN; 2009:299-362。
- 8.
小麦淀粉粒蛋白的遗传变异及其编码基因的染色体定位。《中国科学院院刊》1996年第1期。10.1007 / BF00225757。
- 9.
通过诱变产生淀粉生物合成相关基因的新等位变异。生物技术学报。2010,25:145-154。10.1007 / s11032 - 009 - 9314 - 7。
- 10。
Yamamori M,Fujita S,Hayakawa K,Matsuki J,Yasui T:遗传消除淀粉颗粒蛋白,SGP-1,小麦的淀粉1种,具有明显高淀粉的改变的淀粉。您的App Genet。2000,101:21-29。10.1007 / S001220051444。
- 11.
Lafiandra D, Sestili F, D’ovidio R, Janni M, Botticella E, Ferrazzano G, Silvestri M, Ranieri R, DeAmbrogio E:硬粒小麦淀粉成分的改性方法。谷物化学。2010,87(1):28-34。10.1094 / cchem - 87 - 1 - 0028。
- 12.
Regina A, Kosar-Hashemi B, Li Z, Rampling L, Cmiel M, Gianibelli MC, Konik-Rose C, Larroque O, Rahman S, Morell MK:小麦中淀粉分枝酶i的多种亚型:缺少主要的Sbe-I亚型并不改变淀粉表型。植物营养与肥料学报。2004,31:591-601。10.1071 / FP03193。
- 13。
Rahman S, Regina A, Li Z, Mukai Y, Yamamoto M, Kosar-Hashemi B, Abrahams S, Morell MK:淀粉分支酶基因的比较揭示了异构体之间的进化关系。小麦基因组供体中淀粉分枝酶IIa基因的特征。植物生理学报。2001,25(4):514 - 524。
- 14.
Regina A, Kosar-Hashemi B, Li Z, Pedler A, Mukai Y, Yamamoto M, Gale K, Sharp PJ, Morell MK, Rahman S:淀粉分支酶IIb在小麦中低水平表达。胚乳与其他谷物相比并在非同生位点编码的胚乳。植物营养学报。2005,22(2):489 - 494。10.1007 / s00425 - 005 - 0032 - z。
- 15.
Regina A, Bird A, Topping D, Freeman S, Barsby T, Kosar-Hashemi B, Rahman S, Morell MK: RNA干扰产生的高直链淀粉小麦改善了大鼠肠道健康指数。美国科学院。2006年,103:3546 - 3551。10.1073 / pnas.0510737103。
- 16.
Sestili F,Janni M,Doherty A,Botticella E,D'Ovidio R,Masci S,Jones H,Lafiandra D:通过沉默的沉默增加了杜兰姆小麦的直链淀粉含量SBEIIa基因。植物营养与肥料学报。2010,30(4):514 - 514。
- 17.
陈建平,陈志刚,陈志刚:植物功能基因组学的研究进展。植物生理学报。2000,23(4):439-442。10.1104 / pp.123.2.439。
- 18.
关键词:小麦,耕作,反基因,非转基因,抗逆性生物工程学报,2005,23:75-81。10.1038 / nbt1043。
- 19.
acta optica sinica, 2017, 29 (5): 973 - 976 . acta optica sinica, 2017, 32 (5): 973 - 976 . acta optica sinica, 2017, 32 (5): 973 - 976 . acta optica sinica, 2017, 32 (5): 973 - 976 . acta optica sinica, 2017, 32(5): 973 - 976。中国生物医学工程学报。2009,9:115-10.1186/1471-2229-9-115。
- 20.
WITTWER CT,REED GH,GUNDRY CN,Vandersteen JG,PRYOR RJ:通过使用LCGREEN的扩增子熔化分析的高分辨率基因分型。Clin Chem。2003,49:853-860。10.1373 / 49.6.853。
- 21。
董志强,陈志强,陈志强:利用高分辨率熔解分析和突变检测仪同时检测小麦3个同源基因的突变。植物学报。2009,33(6):593 - 598。
- 22。
Gady ALF, Hermans FWK, Van de Wal MHBJ, Van Loo EN, Visser RGF, Bachem CWB:两种高通量技术在一个新应用中的实现,检测大EMS突变植物种群中的点突变。植物学报。2009,5:13-10.1186/1746-4811-5-13。
- 23。
四倍体小麦的二组代换系和非整倍体分析。基因组学。1988,30:222-228。10.1139 / g88 - 038。
- 24。
基于健康谷物计划的面包小麦突变群体农艺性状和形态性状多样性研究。中国科学(d辑:地球科学)。10.1007 / s10681 - 010 - 0149 - 4。
- 25。
关键词:生物信息学,蛋白质功能,氨基酸变化,生物信息学核酸学报2003,31(4):593 - 598。10.1093 / nar / gkg509。
- 26.
陈志强,陈志强,陈志强,等。玉米胚乳分支酶I和II嵌合酶的构建及其活性研究进展。中国生物化学杂志。1997,27(4):489 - 494。
- 27.
Abad MC, Binderup K, Rios-Steiner J, Arni RK, Preiss J, Jeiger JH: x射线晶体结构大肠杆菌分支酶。J Biol Chem。2002,277:42164-42170。10.1074 / JBC.M205746200。
- 28.
Zhang Y:I-Tasser服务器用于蛋白质3D结构预测。BMC生物信息学。2008,9:40-10.1186 / 1471-2105-9-40。
- 29.
Lal S, Choi J, Curtis Hannah L: AG双核肽终止内含子在玉米胚乳中是重要的,但并不总是必需的前mrna剪接。植物营养与肥料学报。1999,20(1):65-72。10.1104 / pp.120.1.65。
- 30.
棕色JWS:拟南芥内含子突变和前mRNA拼接。工厂J. 1996,10:771-780。10.1046 / J.1365-313x.1996.10050771.x。
- 31.
史密斯CJW,CHU TT,Nadal-Ginard B:AGS之间的扫描和竞争涉及哺乳动物内含子中的39个拼接站点选择。Mol细胞Biol。1993,13:4939-4952。
- 32.
Yamamori M,Nakamura T,Kuroda A:淀粉 - 颗粒结合蛋白含量的变化在几个日本常见小麦中的含量(小麦(2).中国科学:地球科学。10.1007 / BF00046051。
- 33。
二倍体、四倍体和六倍体小麦的蜡质蛋白。植物育种。2002,121:1-5。10.1046 / j.1439-0523.2002.00662.x。
- 34。
淀粉酶家族的蛋白质工程:催化机制、底物特异性和稳定性。植物学报25:141-157。
- 35。
陈志强,陈志强,陈志强:玉米分枝酶II氨基末端的聚合酶链反应随机突变分析。生物化学学报。2001,32(4):461 - 468。10.1006 / abbi.2000.2179。
- 36。
Parry Maj,Madgwick PJ,Bayon C,Dathall K,Lopez啊,Baudo M,Rakszegi M,Hamada W,Al-Yassin A,Oubbou H,Labhilili H,Phillips A:突变发现作物改善。J Exp Bot。2009,60:2817-2825。10.1093 / JXB / ERP189。
- 37。
高分辨率熔解分析技术在大麦新等位基因鉴定中的应用。应用电子学报。2009,19:851-865。10.1007 / s00122 - 009 - 1094 - 2。
- 38.
Reed GH, Wittwer CT:高分辨率熔融分析单核苷酸多态性扫描的敏感性和特异性。中国临床化学杂志。2004,30(4):548 - 554。10.1373 / clinchem.2003.029751。
- 39.
柴XL,王ZY,张JL,香MM:内含子1引线的异常剪接的异构5' UTR和在中间直链淀粉含量的水稻品种减少蜡质基因的表达。植物杂志1998,14:459-465。10.1046 / j.1365-313X.1998.00126.x。
- 40。
植物功能基因组学中的单核苷酸突变。《生物医学杂志》,2003,54:375-401。10.1146 / annurev.arplant.54.031902.135009。
- 41.
Saito M, Nakamura T:在二粒小麦中发现的两个点突变零Wx-A1等位基因。Al Appl Genet。2005,110:276-282。10.1007 / s00122-004-1830-6。
- 42.
Patron NJ, Smith AM, Fahy BF, Hylton CM, Naldrett MJ, Rossnagel BG, Denyer K:低直链淀粉品种胚乳中直链淀粉积累模式的改变是由于单个颗粒结合淀粉合酶I等位基因突变,5'-非编码区缺失。植物生理学报。2002,30(4):427 - 434。10.1104 / pp.005454。
- 43.
朱云峰,李永文,陈勇:高分子量谷蛋白的制备与表征1BX14-缺陷突变体在普通小麦。植物育种。2005,24(4):421-427。10.1111 / j.1439-0523.2005.01145.x。
- 44.
健康和疾病中无意义介导的mRNA衰减。《中国科学院院刊》1998,8:193 -1900。
- 45。
Maquat LE: nonsense介导的mRNA衰减:剪接,翻译和mRNP动力学。细胞生物学杂志。2004,5:89-99。
- 46。
Jofuku KD,氏氏氏菌,戈德伯格RB:框架突变可防止kunitz胰蛋白酶抑制剂mRNA积聚在大豆胚胎中。植物细胞。1989,1:427-435。
- 47。
陈志强,陈志强,陈志强,等。拟南芥HY8基因位点编码光敏色素a。植物学报。1998,5:1081-1088。
- 48。
拟南芥AUX1基因:一个研究植物mRNA处理的模型系统。植物生态学报。1998,36(4):493 - 497。10.1023 /: 1005961303167。
- 49。
Isshiki M, Yamamoto Y, Satoh H, Shimamoto K: nonsense介导的水稻蜡质mRNA的衰变。植物营养与肥料学报。2001,25(4):489 - 498。10.1104 / pp.125.3.1388。
- 50。
Miura H,Sugawara A:蜡质基因在小麦淀粉糖合成的剂量效应。Al Appl Genet。1996,93(7):1066-1070。10.1007 / BF00230126。
- 51。
李志伟:淀粉合酶IIa基因对小麦籽粒、蛋白质和淀粉含量的影响。应用电子学报。2007,11:1053-1065。10.1007 / s00122 - 007 - 0631 - 0。
- 52。
Mcottarly BV,Solah V,Gibson TS:谷物面粉和产品中总淀粉的定量测量。j麦片sci。1994年,20:51-58。10.1006 / JCRS.1994.1044。
- 53.
Nakamura T, Yamamori M, Hirano H, Hidaka S, Nagamine T:糯小麦(无直链淀粉)的生产。《中国科学院院刊》1995年第4期。10.1007 / BF02191591。
- 54.
一种快速、廉价的从脱水植物组织中分离总DNA的方法。植物学报1991,8:297-303。
- 55.
Laudencia-Chingcuanco DL, Stamova BS, You FM, Lazo GR, Beckles DM, Anderson OD:利用cDNA微阵列对小麦颖果发育的转录分析。植物营养与肥料学报。2006,32(6):641 - 646。
- 56.
利用实时荧光定量PCR技术对相关基因表达数据进行分析-ΔΔct方法。方法。2001,25:402-408。10.1006 / meth.2001.1262。
- 57。
Neff MM,Neff JD,Chory J,Pepper AE:DCAPS,单核苷酸聚合物的遗传分析简单技术。族族分析:实验应用拟南芥遗传学。植物学报1998,14:387-392。10.1046 / j.1365 - 313 x.1998.00124.x。
- 58。
Chrastil J:改善了淀粉或面粉中的直链淀粉的比色测定。Carboohydr Res。1987,159:154-158。10.1016 / s0008-6215(00)90013-2。
- 59。
Vansteelandt J,Delcour Ja:工业意大利面加工过程中杜兰姆小麦淀粉(Triticum)的物理行为。ĴAGRIC食品化学。1988,46:2499-2503。
确认
这项研究部分由欧洲委员会的共同体第六框架计划健康谷物项目(Food- CT-2005-514008)提供资金支持。它反映了作者的观点,社区不承担任何使用本出版物和AGER从种子到面食部分中包含的信息的责任。
作者信息
从属关系
相应的作者
附加信息
作者的贡献
EB对突变体进行了TILLING分析、分子和生物信息学特征分析,并与FS和DL共同起草了论文。AHL协同优化人力资源管理分析。AP提供EMS小麦种群和人力资源管理耕作平台。EB、FS、AP、DL编辑稿件。DL负责协调工作。所有作者阅读并批准了最终的手稿。
作者为图像提交的原始文件
权利和权限
开放访问本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0.)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用本文
波提塞拉,塞斯蒂利,F,埃尔南德斯-洛佩兹,A。等等。小麦EMS诱导突变的高分辨率熔解分析Sbella基因。BMC植物杂志11,156(2011)。https://doi.org/10.1186/1471-2229-11-156
收到了:
接受:
发表:
关键词
- 直链淀粉
- 过早停止密码子
- 淀粉糖内容
- 高分辨率熔化
- 高分子量谷蛋白亚基