摘要
背景
属Fragaria.包括倍性水平从二倍体(2n= 2x= 14)到十倍体(2n= 10x= 70)。荧光原位采用5S和25S rDNA探针杂交,收集细胞遗传学信息,阐明不同类群在多倍性水平上的基因组差异,并探索核糖体RNA基因在多倍体化过程中的进化Fragaria..
结果
二倍体征征的根尖细胞由不同强度的两种5s和625s的RDNA杂交信号键化,为属植物中的比较提供基线。在三个特殊的二倍体基因型中,F. Nilgerrensis.(CFRA 1358和CFRA 1825)和f . vesca“黄色奇迹”中发现了2个5S和4个25S rDNA位点,但丢失位点不同。在一个三倍体中,5S和25S rDNA信号分别为3个和9个F.×BIFRA在3个四倍体中分别为4个和12个,是典型二倍体模式的1.5×和2×倍。在六倍体F.moschata.,发现6个5S rDNA位点的比例倍数,但25S rDNA位点的数量比预测的18个位点的比例倍数少1或2个。在八倍体中,只有2个5S rDNA位点和10个25S rDNA位点。在两个十倍体中,5S和25S rDNA信号分别为4个和15个f . virginiana亚普。platypetala.,六和十二英寸f . iturupensis.
结论
在二倍体Fragaria.物种,RDNA站点号的一般一致性意味着节约基因组组织,但是高度可变的25s信号尺寸和强度和两个现场损失的情况表明同源物和非同源物之间的RDNA拷贝数的并行高动态。较低倍率下降率的RDNA位点数的普通保护,但在较高的倍率水平下标记的部位数量减少,表明在多倍化和/或独立进化途径期间的RDNA位点的复杂演变x而草莓的倍性更高。位点数比较表明,天然八倍体的基因组组成有共同之处,而两个不同的十倍体的遗传来源是独立的。
背景
草莓属Fragaria.属于蔷薇科,蔷薇科是一个重要的经济植物科,包括大约24种,主要分布在欧洲、亚洲、北美和南美的温带[1,2].在历史上,基本染色体数为7 (x= 7)和存在多个水平的倍性,从二倍体到八倍体,在该属已被记录在1926年[3.,4].直到最近,一个自然发生的十倍体细胞型(2n= 10x= 70),通过染色体计数和流式细胞术发现[5]在地理上孤立的物种f . iturupensis,最初被描述为八倍体(2n= 8x= 56) (6].此外,CFRA 110的加入F.弗吉尼亚州亚普。platypetala.经染色体计数发现为十倍体[7].目前,十二二倍体(2n= 2x= 14), 5个四倍体(2n= 4x= 28),单个六倍体(2n= 6x= 42)f . moschata,三八倍体(2n= 8x= 56)种,包括主要栽培种F.×ananassa以及它的直接八倍体祖先:f . chiloensis和f . virginiana[8]和一个decaploid(2n= 10x= 70)f . iturupensis是公认的1,5,9,10].此外,变异倍性和奇数倍性已经在两个杂交类群中被发现:五倍体/六倍体/六倍体(2n= 5x/ 6.x/ 9.x= 35/42/63)F.×bringhurstii[11]和二倍体/三倍体(2n= 2x/ 3.x= 14/21)F.×BIFRA[12].高电平(> 4x)多倍体都被认为至少部分具有异源多倍体基因组组成;然而,起源是自倍体还是异倍体的分类还没有在四倍体水平上解决[13].
非同位素原位杂交(ISH)在1985年植物中引入[14],基于荧光的技术(FISH)随后成为对重复DNA序列和多拷贝基因家族进行物理定位的常规方法[15和其他DNA序列上的染色体[16],以及对单个染色体的识别(例如,[17])。核糖体RNA (rRNA)基因由于其高拷贝数、特定的染色体位置和不同植物群体之间高度的序列保守性,已成为最广泛的探测位点[18,19].在真核生物中,包括更高的植物,核18s,5.8s和25 / 28s rrnas(植物中25s;哺乳动物28s)[20.,21通过在特定染色体位点聚集在特定染色体位点的RDNA重复单位编码的45s转录物。5S rRNA由位于不同染色体位点的不同基因簇的转录结果[22].
以往关于草莓细胞遗传学的报道大多局限于染色体计数,由Ichijima发起[3.]和龙眼[4],以及近年来传统的核型分析[7,23- - - - - -26].在现代分子细胞遗传学领域,其中荧光原位杂交(FISH)技术发挥着关键作用,在草莓上的研究一直很少。利用rDNA探针进行FISH的可行性最早由Lim建立[27]在二倍体草莓中,由Shulaev等人确认。[28,但这项技术还没有扩展到多倍体的遗传和细胞学上更为复杂的基因组Fragaria.物种。作为一个跨越倍性水平从二倍体到十倍体的属Fragaria.为研究多倍体进化过程中发生的染色体rDNA阵列的进化变化提供了一个以前未被开发的机会,并将有助于确定多倍体草莓物种的基因组组成的持续努力。此外,我们预计本文的研究将有助于蔷薇科比较分子细胞遗传学的进一步发展,因为草莓是蔷薇科最发达的模式生物之一[29].
本工作的目的是描述基因组分布的5S和25S rDNA阵列Fragaria.物种,并评估与多倍化相关的RDNA站点数量的变化Fragaria..
结果
通过荧光可视化5S和25S rDNA网站的数量原位每个研究分类单元的一个或多个亲本的杂交显示(表)1).对于每种加入,观察到具有良好染色体差和杂交信号的至少五种细胞。在包括二倍体和多倍体的所有物种中,5S rDNA位点全部位于短染色体臂的近端区域,并且25s的RDNA位点全部局部化染色体区域。rDNA类型的站点数量在每个级别的倍率范围内都是一致的,下列例外情况下。如下所述,五个二倍体细胞型小于典型的二倍体细胞型呈现的25s信号的数量。25s信号的强度和尺寸模式显示了二倍体内的可变性。此外,在两个六倍倍增型之间观察到25s位点数的差异f . moschata(CFRA 157和CFRA 376)基因型。最后,两个Decaploid Taxa在5S和25S场网站中彼此不同。
二倍体中5S和25S rDNA位点的基因组分布
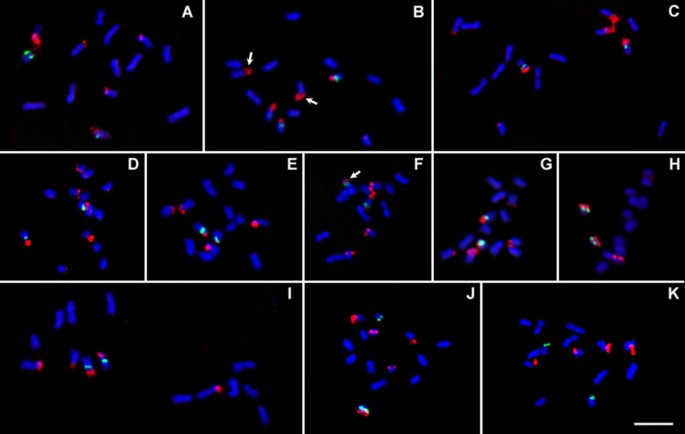
在大多数二倍体遗传中,rDNA位点的分布模式是共同的,涉及三对染色体。在这个模式中(图1 a-1g,图2)在3对染色体上定位了6个25S rDNA位点,其中1对染色体上还标记了一对5S rDNA位点。在这三对染色体中,我们将被25S rDNA信号“单标记”的中等大小的亚稳心染色体对命名为“M对”。其余2对标记染色体(S1和S2)在7对染色体中最小,为亚中或亚端中心染色体。在这两对小染色体中有一对25S rDNA信号,以下称为“S1对”(小的,“单标记”对),而同时具有25S和5S位点的小的,“双标记”对被称为“S2对”(图2)2).
在二倍体鱼Fragaria.具有5S(绿色信号)和25秒(红色信号)RDNA探针的基因型.答:F. Bucharica.(CFRA 520);B:f .效果(CFRA 1947);C:f . vesca亚普。vesca.“夏威夷4”;D:f . daltoniana(CFRA 1685);艾凡:f . pentaphylla“GS34”;F:f .冬青(CFRA 333);旅客:F.Iinumae.(CFRA 1850);H:F. Nilgerrensis.(CFRA 1358);我:f·培(CFRA 1862);珍:F.vesca.亚普。美国“Pawtuckaway”(CFRA 1948);凯西:f . vesca亚普。vesca.'黄色奇迹'。箭头显示在DAPI占有下可见的卫星的位置。棒=5μm。
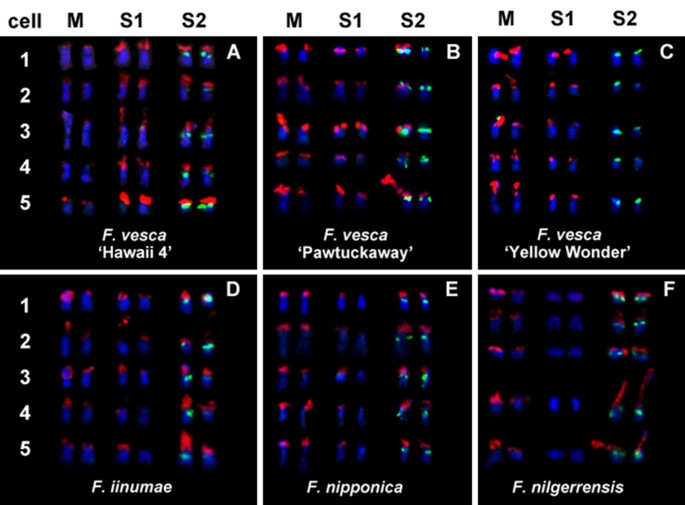
二倍体的5s(绿色)和25秒(红色)RDNA位点的可变分布模式Fragaria.基因型.从6个二倍体细胞中分别选出5个细胞(编号1-5),这些细胞表现出不同的rDNA位点分布模式。仅显示(或“预期”显示)rDNA FISH信号的染色体(M:中等大小的一对由25S rDNA信号“单标记”;S1:由25S rDNA信号“单标记”的小对;S2:小对的25S和5S rDNA信号均为典型的“双标记”)。所代表的模式f . vesca'夏威夷4'在这里(一个)是由大多数二倍体共享的典型典型(6 = 2m + 2s1 + 2s2)Fragaria.分类群,虽然在非常张开的附加过程中观察到明显不同的模式B.5 = 2M+2S1+1S2,例外为6 = 2M+2S1+2S2;C.4 = 2M + 2S1;D.6 = 2M+2S1+2S2除5 = 2M+1S1+2S2外;E.5 = 2 m + 1 s1 + s2;F.4 = 2 m + 2 s2。在每个细胞内,细胞间的分布模式是一致的,除了f . vesca“Pawtuckaway”和F.Iinumae..在f . vesca“Pawtuckaway”(B), S2对在细胞1到4中只显示一个25S rDNA信号,而在细胞5中显示两个信号。在F.Iinumae.(D), S1对在细胞1至3中显示两个不同的25S rDNA信号,在细胞4中显示一个不同的微弱信号,在细胞5中仅显示一个信号。
除了大多数二倍体草莓共享的典型模式外,还发现了一些涉及25S位点数量减少的独特模式(图)2).通常携带5S和25S的S2对在所有检查的细胞中缺少两个同源物上的25S鱼信号f . vesca亚普。vesca.“黄色奇迹”,将此加入只有四个25s信号以及两个5s信号(图1 k和2摄氏度).在二倍体的过程中,只有“黄色奇迹”没有25秒和5S rDNA信号标记的任何染色体(表1).在一个平行的情况下,通常是单个标记的S1对缺少两个同源物上的25s鱼信号(图1 h和2 f)F. Nilgerrensis.(CFRA 1358和CFRA 1825)。比较的是,在所有检查的细胞中只缺少S1对的一个同源物缺少25s信号f·培(CFRA 1862,数字1我和2 e).而且,尽管观察到六种25s信号F.Iinumae.(1850年CFRA图1克), S1对中的一个成员的信号在细胞之间是可变的,从非常小的(图中的细胞1到3)二维)到非常弱(图中的单元格4)二维),甚至是看不见的(图中的细胞5二维).最后,在f . vesca亚普。美国'Pawtuckaway'(CFRA 1948)S2对的一个成员在26个细胞中有24个24个信号(图1 j和2 b),而在其他两个细胞中,S2同系物均有25S信号(如图中5号细胞)2 b).
在大多数二倍体材料中,三个25S rDNA位点之间以及每个25S位点的同源物之间的信号大小和强度存在显著差异。(数据1和2).然而,在三对典型标记的染色体中,没有一对在二倍体遗传过程中始终具有最亮或最弱的25S信号。例如,在f . vesca“夏威夷4”M对上的25s RDNA鱼信号比S1和S2对上的较弱性显着较小,因此显示了“次要M - 主要S1 - 主要S2”模式(图2);而在f·培S1对显示最小和最弱的25s RDNA信号,从而呈现“主要M - 次要S1 - 主要S2”模式(图2 e).“主要”和“次要”和“次要”25s rdNA信号的分配模式的这种变异性不仅在不同的二倍体物种之间观察,而且在亚种(例如,“次要M - 主要S1 - 主要S2”之间观察到f . vesca亚普。vesca.'夏威夷4'与“主要的M - 专业S1 - 主要S2”f . vesca亚普。美国“Pawtuckaway”,数字2和2 b),甚至在亚种中的不同载体之间(例如,f . vesca亚普。vesca.“夏威夷4”和“大调M -大调S1 -无S2”f . vesca亚普。vesca.“黄色的奇迹”,数字2和2摄氏度).另一方面,在单个登录中,被检查的单元之间的分配模式通常是一致的(图)2).相反,在某些二倍体的中期染色体制备中,一到两个随体和次级缢痕是转录活性rDNA位点的细胞学标记(见图)1)和与“主要”或“次要”鱼信号进行各种各样。
多倍体的5秒和25s rdNA位点
F.×BIFRA是一种自然产生的杂种物种,涉及二倍体和三倍体细胞类型[12].染色体计数显示,GS104为三倍体。三倍体中5S和25S rDNA位点的数量F.×BIFRA分别是三,九个(图3).3个5S rDNA位点均与25 rDNA信号共定位。其中1个5S rDNA信号明显大于2个。
鱼类多倍体Fragaria.具有5S(绿色信号)和25秒(红色信号)RDNA探针的基因型.答:F.×BIFRA'GS104'(2n= 3x= 21);B:F. Corymbosa.(CFRA 1911, 2n= 4x= 28);C:f .股薄肌“GS31”(2n= 4x= 28);D:f . tibetica'GS28'(2n= 4x= 28);艾凡:f . moschata(CFRA 157, 2n= 6x= 42);F:f . moschata(CFRA 376, 2n= 6x= 42);旅客:f . chiloensis亚普。lucida.(CFRA 1691, 2n= 8x= 56);H:f . virginiana亚普。glauca(CFRA 1992,2n= 8x= 56);我:f . virginiana亚普。platypetala.(CFRA 110,2n= 10x= 70);珍:f . iturupensis(CFRA 1841, 2n= 10x= 70)。棒=5μm。
这三种四倍体物种的rDNA位点数量相同,其中5S rDNA为4个,25S rDNA为12个(图)3 b-3d).这些数字是大多数二倍体中检测到的2个5S和6个25S位点的两倍,四倍体中的每个5S rDNA位点都与一个25S rDNA位点共定位。虽然rDNA位点的数量和位置在四倍体中严格一致,但位点间的信号大小和强度存在差异。在f .股薄肌(图3 c) 和f . tibetica(图3 d)、25S rDNA位点在三个同源染色体组之间的信号强度无明显差异,而在F. Corymbosa.(CFRA 1911,图3 b),四组染色体中一个“单标记”组的25S rDNA位点比其他两组具有更大的信号。同时,在总共4个5S rDNA位点中F. Corymbosa.两个比另外两个更大更强壮。
在六倍体物种中f . moschata,对两份入选材料(cfra157和cfra376)进行检测。尽管25S rDNA位点是大多数二倍体的3倍,但只有17个(在CFRA 376,图3 f)或16 (cfra157,图3 e)被检测到。发现六种5S rDNA位点在两种过程中预期,但其中一个并不与25秒的rDNA站点共定,并且一对5S位点总是比两对换乘所的两对更大且更加密集。
我们调查了七个代表三个亚种的八倍体f . chiloensis和三个亚种f . virginiana发现,每个八大屈曲的分类株共享共同5s和25s的rDNA站点数,分别为2和十个(只在这里显示两个代表性分类群的数据)3 g和3 h).在大多数二倍体中,5S和25S rDNA位点的这些数字都远低于预期倍数(分别为8和24)。此外,未观察到双标记染色体。
野生基因型(CFRA 110)f . virginiana亚普。platypetala.经染色体计数发现为十倍体[7].我们在同一加入中的工作证实了CFRA 110的倍倍增性表征,通过显示有丝分裂的70染色体。鱼类研究检测到分布在18次染色体上的四个5岁和十五次RDNA部位,其中一个是25s和5s rDNA信号的双标记(图3我).在F.Iturupensis.,在该属中发现的其他天然类百分比物种,六个5s和12个25s rDNA位点在18次染色体上检测到,并且没有双重染色体(图3 j).两种Decaploids也在5S RDNA站点之间呈现可变信号尺寸和强度。
讨论
在许多植物中进行了通过鱼进行核糖体RNA基因的分子细胞遗传学分析,但在许多植物中进行了研究,涵盖了广泛的多倍体系列并包含在属内的大部分物种非常罕见。在草莓属中Fragaria.,在我们初次报告之前f . vesca亚普。vesca.Shulaev等人的“夏威夷4”[28,只有一个未指明的二倍体物种的加入,f . vesca,已经研究过[27].在本研究中,研究了12个已知的二倍体物种以及几种多倍体征集的九个用于RDNA部位的基因组分布。总共,我们通过鱼将5s和25s rdNA簇的染色体定位扩展到代表25个分类群(种类和亚种)的33种载体,从二倍体到Decaploid中覆盖倍增性水平。
在所有的Fragaria.在本研究的物种和亚种中,5S rDNA信号显示在染色体短臂的近端区域,而25S rDNA信号显示在染色体的末端区域,表明rDNA位点的染色体位置是高度保守的Fragaria..然而,如下面所详细说明的,在二倍体类群中观察到信号强度的显著变化,并且在倍性水平内和倍性之间观察到有趣的信号丢失实例和模式。
2倍体草莓种间5S和25S rDNA位点的典型和异常分布规律
在二倍的征集中,通过鱼分析观察两种5岁和625岁的RDNA部位(图1)通常与先前的发现一致f . vesca[27,28].因此,在二倍体水平上,一个基本(x= 7)Fragaria.基因组是通过一个5s轨迹的可检测存在和三个25s基因座的可检测存在,使得一个染色体由近端5s rdna轨迹和末端25s rdna轨迹“双标记”,并且两个染色体是“单标记的”终端25s rdna loci(图2).通过对其典型性的合理推断,所描述的模式可能代表祖先的模式Fragaria.基因组。
在二倍体中,与典型模式最大的背离是两个不同的rDNA位点丢失的例子,每一个都涉及一个不同的位点。首先,S1对的25S rDNA信号的缺失导致了两种dna的加入F. Nilgerrensis.只有4个25S信号(如图中的cfra1358)2 f).这种分歧的F. Nilgerrensis.卢梭- gueutin等人的系统发育研究表明,它是一个分化良好的进化单元。[13和Harrison等人[30.],也由于其与其他杂交产生的杂种不育性Fragaria.物种(31].第二,f . vesca“黄色奇迹”也只显示了4个25S信号,但位点损失来自S2对(图)2摄氏度),也使得“黄色奇迹”在二倍体类群中具有明显的区别,包括其他被研究的基因型f . vesca亚普。vesca..因此,从六到四个中减少25s的rdNA位点数至少发生了两倍的二倍体中的两次Fragaria..
在25s rdna鱼信号的大小和强度中也检测到多态性,我们将其描述为“主要”(大而强)和“微生物”(小弱)信号,不同的代表征纳税中的不同基因座之间。在三种通常标记的染色体对中,没有一对横跨二倍体基因型的最亮或最低亮25s信号一致。因此,与典型的RDNA位点分布的典型模式相反,染色体对中25s rdNA信号强度的分配模式在二倍体基因型中变化,在一定程度上排除了典型。此外,在许多二倍体基因型中的同源25s RDNA位点之间观察到信号强度和/或存在的多态性。信号缺少一个但不是通常标记对的两个成员发生在三种情况下:f·培(图2 e),F.Iinumae.(图二维)和基因型('pawtuckaway')f . vesca亚普。美国(图2 b).在单独制备的载玻片上一致地看出同源物之间的后一种变化模式,表明这种可变性不是由于实验伪影。基于可用数据,推测同源物之间的不平衡信号强度是最终基因座损失的前兆的可能性,它将过早,从典型六到四到四到四到四点的减少25秒的网站数。但是,上面概述的所有变化都表明二倍体中的25s rdna阵列Fragaria.以动态的状态存在。
草莓二倍体25S rDNA阵列的特性:位点数和染色体位置的保存与拷贝数的动态
由于鱼被认为是半定量技术[32,可以合理地预期杂交信号的大小和强度是目标序列拷贝数的指标。由此可见,25S rDNA信号强度在二倍体中存在多态性Fragaria.可能意味着不同rDNA位点的重复拷贝数不同。25S rDNA信号的丢失可能是由于整个位点的完全消除,或者可能只是由于在各自位点上的25S rDNA重复序列的大部分拷贝的丢失,导致信号减弱或留下太少的重复序列无法被FISH检测到。这种结果可能是由于染色体短臂中含有rdna片段的自发缺失[33]或不平等的过境,这可能导致来自不同网站的重复的损失(和/或增益)[34].
任何rDNA位点都是与其他染色体上的其他rDNA位点具有序列同源性的DNA延伸[35].因此,可以通过在有丝分裂中期在有丝分裂中期的rDNA染色体似乎是非随机相关的影响,支持两种同源和非症状位点之间的rDNA簇的物理缔合。36].人们普遍认为,基因与高度重复序列的关联会增加不平等交换的机会。草莓rDNA位点的远端染色体位置可能会促进这种关联,从而导致不平等交换和rDNA重复重复/缺失,从而导致同源位点和非同源位点之间的拷贝数发生变化(增加或减少)。同源位点间和同源位点内杂交信号的大小多态性可以用这些事件来解释。另一方面,在不同位点之间发生的体细胞交换可以使rDNA的同质化和拷贝数的变化发生得特别快[36].因此,建议草莓中的RDNA重复是合理的,因为它们的终端位置和位点之间的潜在高度的关联是高度动态的状态。然而,尽管部位之间的拷贝数的表观高动态的RDNA部位数和染色体位置的高度保守,但至少可以指示草莓物种中的保守基因组组织,至少适用于涉及RDNA位点的染色体段。
当基因组中存在一对以上的18S-25S rDNA位点时,一些位点可能是不活动的[34].当站点处于活动状态时,通常可见辅助收缩。一旦基因灭活(沉默),即使序列仍然存在和鱼类可检测到序列也消失37].在草莓中,卫星在以前的核型研究中的五个二倍体物种中的一小一对染色体上报道了[23,24].在我们的研究中,在某些二倍体的中期染色体制备中,有时可以看到一或两个随体和次级缢痕(图)1),且无论信号大小,均与25S rDNA FISH信号相关。在一些植物的报道中,可以形成核仁组织区域(NORs)并产生大而强的FISH信号的活性rDNA簇被描述为主要位点,而没有转录活性但仍然被FISH检测为弱信号的rDNA簇被描述为次要位点(例如,大麦)[38].到目前为止,草莓rDNA的全部或部分位点是否被积极转录并形成nor有待于进一步研究。结果部分中的术语“主要/次要位点”并不是指rDNA位点的转录活性,而只是指相对信号亮度。
rDNA位点数量在低(3x- 6x)多倍体草莓
杂种的三倍体细胞型F.×Bifera.以前推断出拥有一个副本f . vesca基因组和两个副本f .冬青基因组[12].在这个三倍体细胞型中观察到的3个5S和9个25S rDNA位点构成了其两个二倍体祖细胞中两个rDNA位点的简单倍数。一个更大更强的5S rDNA位点可能来自f . vesca,而两个较小的来自f .冬青,考虑到两个捐赠者提供的亚因子的拷贝数。
在三个四倍体中,5S和25S rDNA位点数的倍数(图3 b-3d)与全基因组拷贝数的增加(即,与典型的二倍体相比,四倍体具有两倍多的染色体,两倍于检测到的5S和25s RDNA位点)。迄今为止,在这些四倍体中尚未解决自动或各种多倍体来源的交替可能性[13].已经提出了分别重叠的地理区域发生的各个二倍体物种作为推定的祖先。由于二倍体中RDNA位点的高度保守的基因组分布模式,没有基于RDNA鱼数据的四倍体的推定祖先识别特异性物种。然而,这些四倍体之间的轨迹之间的25s RDNA信号强度的可变分配至少意味着二倍体血统F. Corymbosa.可能与两者都不同F.股薄肌要么f . tibetica.Lundberg等人[39]建议F. Corymbosa.是一种异源四倍体。5S rDNA信号的大小多态性F. Corymbosa.在我们的工作中观察到的情况可能支持这一假设。
在六倍体物种中f . moschata6个5S和18个25S rDNA位点是大多数二倍体的3倍。实际上,有6个5S rDNA位点出现了明显的FISH信号,但25S rDNA位点出现了1 ~ 2个明显的FISH信号,分别为:F.moschata.cfra376和cfra157基因型(图3 e和3 f).f . moschata被证明是一个全多肽,其亚血统捐助者包括f . vesca和f .冬青,是由DNA分子研究提出的[13,39,40].在f . vesca在美国,一些基因型(如“Yellow Wonder”和“Pawtuckaway”)的25S rDNA位点少于6个。因此,在一个六倍体中,25S rDNA的位点数少于18个也就不足为奇了f . vesca小于6个25S rDNA位点的基因型参与其起源。或者,在六倍体产生期间或之后,一个或两个rDNA位点可能因其大部分或全部重复序列的丢失而减少或丢失。当Rousseau-Gueutin等人[13研究了两个低拷贝基因序列,用于构建系统发育树Fragaria.物种,他们联系F.moschata.二者皆是f . vesca和f .冬青在基于基因序列分析的树中GBSSI-2,但没有发现两者之间有什么联系f . moschata和f .冬青在树上达哈该基因的一个同源副本的物理消除被认为是一个可能的原因。
157年基因型CFRA 5的6 5 s rDNA网站硝唑25 s rDNA网站,这意味着失去一个25 s rDNA网站(如果后者假设上面所讨论的是真的)发生的六个“double-marked染色体和第二个“single-marked染色体。这两条染色体不可能是同源的,表明25S rDNA位点的消除可以同时发生在非同源染色体上。因此,在位点数高的物种中,rDNA拷贝的丢失可以非常迅速地进行,因为这种事件有很多发生的机会。这一推测得到了八倍体和十倍体草莓的支持,其中预期有8个5S和24个25S rDNA位点,预期有10个5S和30个25S rDNA位点,但实际观测到的数量要少得多。
八倍体草莓rDNA位点数量显著减少
这两个野生八倍体物种都包括多个亚种。在这项工作中,我们检查了三个亚种f . chiloensis而且f . virginiana, 分别。在所有这些亚种中,5s和25s的rDNA位点的数量是一致的,并且与典型的二倍体数量的比例倍数相比,观察到两种RDNA的RDNA位点数的强烈降低。RDNA站点数量的强劲减少可能归因于两个因素。首先,从低倍倍增性祖先遗传的超过一半的RDNA站点可能未能参与其他核心染色体中发生的关联,其中通过不平等交叉和基因转化率均质化可以保持其DNA序列的同源性因此他们的转录功能。因此,对一些RDNA阵列的丧失易感性可能只是仅仅达到RDNA位点的高初始数量。尽管预期RDNA网站数与基因组大小相关,但是只有在某个阈值下的限制数量的RDNA位点可以与同源性相关,并且该低数量可以足以支持正常的细胞活性。因此,超出该限制或必要号码的额外网站将受到缺乏均化力量的突变的积累,并受到消除。
第二种可能性是核仁显性,正如Navashin最初所描述的[41]在某些物种中Crepis.这种现象偶尔会发生在天然的全多倍体以及合成间隙杂交中[42.,显示了18S、5.8S和25S rRNA编码基因的独家转录活性,这些基因属于亲本基因组中的一个,同时缺乏来自另一个亲本基因组的rDNA的表达[43.].然而,亲代rDNA重复类型中的一种从杂交基因组中移除的速度有多快,以及通过何种进化力量,目前仍未解决。如果草莓的核仁优势也发生,那么rDNA位点的丢失可以解释为这些位点的转录活性的丧失。
作为RDNA部位损失的解释,如果RDNA位点的关联仅在从二倍体祖先的子集之间出现,则基于核仁优势的假设可以与高初始拷贝数的结合集成。虽然八倍体草莓的基因组组成尚未完全阐明[44.],推定的贫民捐助者,包括祖先f . vesca和F.Iinumae.已得到多个核基因DNA序列数据系统发育分析的有力支持[1,13],而在ITS核序列构建的系统发育树中[45.],F.Iinumae.不与任何八大胶质聚集,而是对所有其他人的姐妹种类。随着核包含在45s的RDNA单位中,推测RDNA位点损失可以是亚因特异性的,并且RDNA从祖先重复F.Iinumae.亚基因组在祖先八倍体建立期间或之后丢失。
Davis等人[46.]发现两个八倍体品种的基因组大小明显缩小了12%至16%,而预期一个二倍体基因组大小为四倍。这种体型的缩小可能是由于发生在八倍体起源期间或之后的一些事件,如DNA片段的丢失[46.].八倍体中rDNA位点的显著丢失可能是更广泛的DNA片段丢失的一部分,也可能是通过一种单独和独特的机制发生的。
高倍性草莓的起源
所有八大型亚种中,5s和25s rdna的相同网站数F.chiloensis和f . virginiana建议野生八倍体种与基于不同DNA序列的系统发育分析所提出的,非常有可能与常见的基因组组成甚至具有共同的祖先共享。13,30.,45.].此外,八倍体物种和亚种之间的5S和25S rDNA位点数的保护表明,观测到的水平的现场丧失可能是一种早期事件,前面是来自常见的八大醇祖先的各种八倍增藻株。的起源F.moschata.与八伏骨谱系相比,可能遵循独立的,也许更新的进化途径f . moschata仍然“维护”其大部分RDNA网站。
四种5S和15岁25s RDNA部位的存在表明CFRA 110的DECAPLOID细胞型F.弗吉尼亚州亚普。platypetala.起源于八倍体和二倍体物种之间的三种杂种的加倍,这可能是f . virginiana美洲的一个亚种f . vesca分别由于CFRA 110的北美地理收集遗址。因此,这种Defaploid细胞型可以由来自的两种5s和525s的RDNA位点组成f . vesca以及来自八倍体祖先的两个5S和十个25S rDNA位点。而在十倍体中,5S rDNA的位点数为6,25S rDNA的位点数为12f . iturupensis不符合八倍体和二倍体简单组合的起源模型。在这样的起源中,十倍体预计5S位点较少(4个),25S位点较多(15或16个),如十倍体CFRA 110中所见。相反,rDNA的位置编号在f . iturupensis表明与CFRA 110相比,这个十倍体物种的起源不同,而且可能更复杂。
利用rDNA标记鉴定单个染色体
由于极小的尺寸(即,草莓0.61-1.85μm)[25形态上的微小分化Fragaria.FISH提供的染色体特异性标记对于单个染色体的鉴定是必需的,并且对于在物种间和多倍体中追踪同源或同源染色体是至关重要的。
先前的RDNA鱼技术进行了f . vesca使具有三对标记染色体的二倍体草莓核型的构建成为可能[27].最近在我们的实验中获得了确认结果f . vesca“夏威夷4”(28].对于大多数的加入F.vesca.,我们提供的数据与之前的两项研究一致。在三对带有rDNA标记的染色体中,有一对为25S和5S rDNA双标记,另外两对为单标记,可根据其所携带的25S位点大小和/或信号强度的不同来区分。在一个二倍体的补体中,除了最大的一对染色体外,其他八对染色体在同源性匹配方面仍然具有挑战性,这对染色体在大多数细胞中可以根据其大小分组。到目前为止,各种基因组资源f . vesca包括FOSMID库[47.]映射和注释的fosmid克隆[10], BAC图书馆[48.以及“夏威夷4号”基因组草案[28]已经成立。组装已锚定到遗传联系地图成七个假瘤瘤。这些都为开发新的染色体特定探针提供了良好的机会,可以扩大核型分辨率的范围Fragaria..
我们建立了几种FOSMID克隆,用于鉴定除了标记的RDNA中的更多染色体f . vesca(未发表的数据)。可以构建草莓中的综合分子核型。通过在用于染色体鉴定的25s和5S rDNA探针之间找到序列同源性,并且支架映射到“夏威夷4”连锁图的假瘤组,染色体对标有25秒和5S rDNA位点,另一个小染色体对单曲标记为25秒分别对应于假色血体VII和假粒组血体VI的rDNA信号[28].其他探针的开发,七连杆组或pseudochromosomes将分配到每个特定的染色体,因此任何感兴趣的序列定义在某个pseudochromosome正常值可以验证真正沿着染色体的协助下chromosome-specific地标在综合分子核型。
Rosaceae家族中的RDNA网站号码
FISH已经在蔷花科的几个属中进行了rDNA位点的物理定位,但在这些属中很少有物种被检测。总的来说,在二倍体蔷薇属植物中检测到的25S rDNA位点数量为2个罗莎和rubus parvifolius.)[49.- - - - - -52.)、4 (49.或六(在李古鲁乌斯)[53.- - - - - -55.].苹果马吕斯x家庭),其中显示一个相对较新的全基因组复制[56.的染色体数目非常高,为2n= 34在罗西阿,在其中观察到八种25s rdna遗址[57.].对于5S rdNA,除了用于的大多数本身之外,已经观察到两种二倍体的恒定数量。李古鲁乌斯[53.,54.] 和罗莎[50.,52.],发现了四个网站。就染色体地位而言,所有罗萨斯物种在内Fragaria.显示出相似的分布模式,25S rDNA重复序列聚集在末端区域,而5S rDNA位点聚集在染色体间质和近端区域。然而,5S和25S rDNA的“双重标记”在Fragaria.仅报道为二倍体李春乌斯底皮[54.和五倍体狗牙蔷薇[50.].玫瑰科的比较分子细胞遗传学分析将受益于针对多个染色体位置的保守序列位点的额外探针的发展。
结论
本报告描述了第一个比较基因组组织的分子细胞学研究Fragaria.,并揭示了在这种经济上重要的属中,在物种和倍率水平中以及25s RDNA重复的动态中保守的程度,以及25s RDNA重复的程度。每个基本基因组拷贝,一个近端5s和三个终端25s rdna loci很大程度上但在二倍体中没有均匀地保守(2x)和较低的多倍体(3x, 4x和6x),但高倍多倍体的位点数显著减少(8x10.x).基于rDNA位点共享的基因组分布模式,rDNA的共同起源Fragaria.octoploids建议;然而,在最近发现的两个十倍体中所看到的明显不同的模式表明,它们是独立起源的。在蔷薇科,Fragaria.是第一个进行了系统分子细胞遗传学研究的属,从而为其他蔷薇属的基因组研究提供了一个比较器,例如,可以揭示多倍体后rDNA位点进化的共同或不同趋势。
方法
植物材料
隶属于25个分类单元(种和亚种)Fragaria.被采样了(表1).其中包括12个二倍体类群,一个三倍体细胞型F.×BIFRA,三种四倍体物种,六倍体f . moschata,七只八倍增蛋白株和两种卵黄素脂肪。总共有33种基因型属于17Fragaria.物种进行。的地理分布Fragaria.描述于folta和davis [1]悍马等人。[58.].
DNA分离和探针制备
采用改进的CTAB方法从0.1 g未展开叶组织中分离出总基因组DNA [59.].基于25S rDNA,设计了用于25S rDNA PCR扩增的引物拟南芥蒂利亚纳[60.],其序列为:25SF - 5'ACGGACCAAGGAGTCTGACATG;和25SR - 5'CGCTTTCACGGTTCGTATTCG。利用基因组DNAf . vesca以“Yellow Wonder”为模板,PCR在94℃初始变性3分钟,然后94℃变性30秒,55℃变性20秒,72℃变性2分钟,72℃最终延伸10分钟。产品通过乙醇沉淀纯化,并用生物素-16- dutp进行镍转译反应进行标记(罗氏诊断公司,印第安纳波利斯,印第安纳州)。5S rDNA引物和布朗和卡尔森的一样[61.]根据草莓的5S rDNA序列的修饰f . vesca“夏威夷4”(28],它们的序列是:5SP1 - 5'GAGGGAGATGCAACACGAGGCC;和5sp2 - 5'cggatgatgatgatcataccca。使用模板DNA通过PCR进行标记反应f . vesca“黄色奇迹”和dNTPs混合DIG-11-dUTP(罗氏诊断公司,印第安纳波利斯,印第安纳州)。反应最初在94°C条件下变性3分钟,然后进行30个循环,94°C条件下变性30秒,50°C条件下变性20秒,72°C条件下变性1分钟,然后72°C条件下变性10分钟。
染色体制备与荧光原位杂交
草莓根尖的预处理按照Nathewet等人的描述进行[25].然后用0.075 M KCl简单冲洗根尖,用3:1甲醇:醋酸在4°C下固定至少24小时。固定根尖在2%纤维素酶'Onozuka' RS(日本养乐多本社,东京)和0.05% Macerozyme R-10(日本养乐多本社,东京)中37℃消化20 min,转移到0.075 M KCl中10 min。然后在4℃下用3:1甲醇:醋酸固定根尖。染色体扩散是由Liu等人描述的涂片方法进行的[18[并将载玻片储存在-80°C直至鱼分析。使用刘等人的方法进行了鱼实验。[62.].简单地说,用RNase (100ng /ml在2xSSC中)和pepsin(0.01%在10mm HCl中)对载玻片进行预处理,然后用70%甲酰胺在80°C下变性3分钟。25S和5S rDNA探针在2xSSC, 50%去离子甲酰胺,10%右旋糖酐硫酸盐在90°C变性8分钟,然后应用于变性玻片,在37°C杂交过夜。杂交后洗涤后,使用链霉亲和素cy3 (Sigma)和anti-DIG-FITC检测信号(罗氏诊断公司,印第安纳波利斯,印第安纳州)。载玻片在含有2 μg/ml 4',6-二氨基-2-苯基吲哚(DAPI)的Vectashield (Vector Laboratories)中安装和反染色。使用ZEISS Axioplan 2成像荧光显微镜,配备AxioCam MRm CCD相机(德国耶拿卡尔蔡司)和AxioVision 4.8.1软件(德国耶拿卡尔蔡司)。这些图像是用Adobe软件分析的®Photoshop®CS3只处理了颜色对比和均匀亮度。至少有5个有丝分裂中期补体进行了评分。
作者的信息
两位作者都在美国NH 03824新罕布什尔大学的新罕布什尔大学生物科学系。
参考文献
- 1.
Folta Km,戴维斯TM:草莓基因和基因组学。CRIT Rev Plant Sci。2006,25:399-415。10.1080 / 07352680600824831
- 2.
Staudt G:草莓生物地理学、遗传学与系统学。Acta photonica sinica, 2009, 42(4): 461 - 466。
- 3.
Ichijima K:细胞学和遗传学研究Fragaria..遗传学。1926,11:590-604。
- 4.
Longley AE:染色体及其在草莓分类中的重要性。J Agri Res。1926,15:559-568。
- 5。
悍马KE, Nathewet P, Yanagi T:十倍体在草莓属iturupensis(蔷薇科)。中国科学(d辑:地球科学),2009,29(6):713-716。10.3732 / ajb.0800285。
- 6。
Staudt G:草莓属iturupensis他是奥斯塔辛的新主人。威尔德诺维亚。1973,7:101-104。
- 7。
陈志强,王志强,王志强,等:野生草莓八倍体和十倍体的核型分析Fragaria.(蔷薇科)。细胞学杂志,2010,31(5):497 - 498。10.1508 / cytologia.75.277。
- 8。
丹诺通用:草莓:历史,繁殖和生理.纽约:霍尔特、莱因哈特和温斯顿;1966.
- 9。
Hummer Ke,Hancock JF:草莓基因组学:植物史,培养,传统育种和新技术。在Rosaceae的遗传学和念珠菌中。编辑:Folta Km,Gardiner SE。纽约:Springer; 2009:413-435。
- 10。
王华,姚强,张强,Tombolato-Terzić D:草莓靶向基因社区的检测。植物营养与肥料学报。2010,29(6):751 - 756。10.1186 / 1471-2229-10-81。
- 11.
美国草莓种的分类学和地理分布:属分类研究Fragaria.(蔷薇科:Potentilleae)。加州大学植物学出版物,伯克利;199981。
- 12.
Staudt G, DiMeglio LM, Davis TM, Gerstberger P:Fragaria.×BIFRADuch.:起源和分类。Bot Jahrb Syst。2003,125:53-72。10.1127 / 0006-8152 / 2003/0125-0053。
- 13.
卢梭- gueutin M, Gaston A, Aïnouche A, Aïnouche ML, Olbricht K, Staudt G, Richard L, benoys - rothan B:追溯多倍体的进化史Fragaria.草莓(L.):低拷贝核基因系统发育分析的新见解。中国科学:地球科学。2009,32(5):513 - 514。10.1016 / j.ympev.2008.12.024。
- 14.
Rayburn Al,Gill BS:使用Biotin标记的探针在小麦染色体上映射特定的DNA序列。j hered。1985,76:78-81。
- 15.
江j,吉尔bs:非目的地原位杂交和植物基因组图谱:前10年。基因组学。1994,37:717-725。10.1139 / g94 - 102。
- 16。
江j,吉尔bs:现状和荧光的未来原位杂交(鱼类)在植物基因组研究中。基因组。2006,49:1057-1068。10.1139 / g06-076。
- 17。
KATO A,LAMB JC,Birchler Ja:使用重复DNA序列作为玉米体细胞染色体鉴定的探针染色体涂料。Proc Natl Acad Sci USA。2004,101:13554-13559。10.1073 / PNAS.0403659101。
- 18。
刘B,陈C,李X,陈R,歌曲W:45s rdNA在30个分类学各种植物物种中的中期染色体的物理映射。j hortic sci biotech。2005,80:287-290。
- 19。
Maluszynska J,Heslop-Harrison JS:属的分子细胞遗传学拟南芥:原位rDNA位点的定位,硫代杂类甲苯二甲酸中的染色体数和多样性。Ann Bot。1993,71:479-484。10.1006 / anbbo.1993.1063。
- 20.
SUMNER AT:核仁组织者(NORS)。在染色体条带中。Editedby:Sumner A. London:Unvin Chyman Ltd;1990年:187-205。
- 21.
Pederson T,Politz JC:核仁和翻译的四个核糖蛋白。J细胞BIOL。2000,148:1091-1095。10.1083 / JCB.148.6.1091。
- 22。
植物基因组的比较组织:从序列和标记到染色质和染色体。植物学报。2000,12:617-635。
- 23。
岩subo Y, Naruhashi N:三种植物的核型Fragaria.(蔷薇科)。细胞学杂志。1989,54:493-497。10.1508 / cytologia.54.493。
- 24。
iwatsubo y,naruhashi n:karyotypes草莓属nubicola和f . daltoniana.细胞学杂志。1991,56:453-457。10.1508 / cytologia.56.453。
- 25。
杨志强,杨志强,杨志强,等:野生二倍体、四倍体和六倍体草莓的核型分析,Fragaria.(蔷薇科)。细胞学杂志。2009,34(5):564 - 572。10.1508 / cytologia.74.55。
- 26。
田志强,田志强,田志强:八倍体草莓有丝分裂染色体的染色方法改进。Sci Hortic-Amsterdam。2009年,120:431 - 435。10.1016 / j.scienta.2008.11.027。
- 27。
林琪:核型与核糖体基因定位Fragaria Vesca.Acta photonica sinica, 2004, 39(4): 441 - 446。
- 28。
Shulaev V,萨金特DJ,克劳赫RN, Mockler TC, Folkerts O, Delcher,贾斯瓦尔P, Mockaitis K,斯通,鬃毛SP,伯恩斯P,戴维斯TM, Slovin JP,巴希尔N,赫楞RP,埃文斯C,哈金斯T, Kodira C, B Desany Crasta或者,詹森房车,艾伦AC,迈克尔•TP塞图巴尔JC, Celton J,碧玉D,里斯G,威廉姆斯KP,霍尔特SH, Ruiz罗哈斯胡安Jairo,Chatterjee M,刘B,席尔瓦H, Meisel L, Adato, Filichkin SA Troggio M,中提琴R,清道夫T,王H, Dharmawardhana P J,拉贾R,牧师高清,科比DW,福克斯,Givan SA威廉LJ, Naithani年代,克里斯托费尔,Salama DY,卡特J,赫罗纳EL, Zdepski,王W, Kerstetter RA,施瓦布W, Korban党卫军,大卫J, Monfort涉嫌,Denoyes-Rothan B,阿鲁P,Mittler R, Flinn B, Aharoni A, Bennetzen JB, Salzberg SL, Dickerman AW, Velasco R, Borodovsky M, Richard E, Veilleux RE, Folta KM:林地草莓(Fragaria Vesca.).中国科学(d辑),2011,43:109-118。10.1038 / ng.740。
- 29。
Shulaev V, Korban SS, Sosinski B, Abbott AG, Aldwinckle HS, Folta KM, Iezzoni A, Main D, Arús P, Dandekar AM, Lewers K, Brown SK, Davis TM, Gardiner SE, Potter D, Veilleux RE:玫瑰科基因组学的多个模型。植物营养与肥料学报。2008,27(4):457 - 461。10.1104 / pp.107.115618。
- 30。
关键词:草莓,叶绿体DNA,限制性片段Fragaria.SPP。)分类群。J Amer SoC Hort SCI。1997,122:63-68。
- 31。
Dowrick GJ,Williams H:物种在Fragaria John Ornehortultulululation的Genus Crosss;1959,9-10。
- 32。
Maluszynska J,Heslop-Harrison JS:RDNA Loci的物理映射芸苔属植物物种。基因组学。1993,36:774-781。10.1139 / g93 - 102。
- 33。
张D,唱T:培养中核糖体RNA基因的物理映射(芍药,芍药科)原位杂交:系统发育和协调进化的意义。中国海洋大学学报(自然科学版)。10.2307 / 2656583。
- 34。
Weiss-Schneeweiss H,Stuessy TF,Siljak-Yakovlev S,Baeza CM,Parker J:南美南美物种的核型演变Hypochaeris(菊科Lactuceae)。植物生态学报。2003,29(4):489 - 494。10.1007 / s00606 - 003 - 0026 - x。
- 35.
Thomas HM, Harper JA, Morgan WG:大的染色体重排正在草地上发生Lolium rigidum.染色体res。2001,9:585-590。10.1023 /答:1012499303514。
- 36.
Hanson Re,Islam-Faridi Mn,Percival EA,Crane CF,Ji Y,Mcknight Td,Betelly DM,价格HJ:四倍体棉中的5S和18S-28S RDNA基因座(Gossypium分子和假定的二倍体祖先。染色体杂志。1996,105:55-61。10.1007 / BF02510039。
- 37.
Maluszynska J,Hasterok R,Weiss H:RRNA基因 - 他们在植物中的分发安序。在植物细胞遗传学中。编辑:马苏斯扎斯卡J. Cieszyn,波兰;1998年:75-95。
- 38.
Taketa S, Harrison GE, Heslop-Harrison JS: 9个野生动物中5S和18S-25S rDNA的比较物理映射大麦物种和细胞型。Al Appl Genet。1999,98:1-9。10.1007 / S001220051033。
- 39。
张强,张志强,张志强,等Fragaria.基于单/低拷贝核基因间区RGA1-Subtilase。蕨属(蔷薇科)的系统学和多倍体进化。斯德哥尔摩大学,瑞典;2011, 1-31,博士论文,Lundberg M。
- 40.
LIN J,DAVIS TM:LONG PCR异渗痰的S1分析:叶绿体吲哚多态性的检测Fragaria..应用电子学报。2000,101:415-420。10.1007 / s001220051498。
- 41.
Navashin M:杂交引起的染色体改变及其对某些遗传问题的轴承。细胞学。1934年,5:169-203。10.1508 / cytologia.5.169。
- 42.
Reeder RH:动物和植物中核仁优势的机制。J细胞BIOL。1985,101:2013-2016。10.1083 / JCB.101.5.2013。
- 43.
Pikaard CS:核仁占优势的表观学。趋势类型。2000,16:495-500。10.1016 / s0168-9525(00)02113-2。
- 44.
戴维斯,盾牌我,张Q,霹雳果tćd,班洁茨·jl,pontaroli ac,王h,姚q,sanmiguel p,folta km:一个检查草莓中的检查基因社区。BMC植物生物学2010,10:81-112。
- 45.
王志强,王志强,王志强,等Fragaria.(Rosaceae)从非编码核和叶绿体DNA序列推断。SYST BOT。2000,25:337-348。10.2307 / 2666646。
- 46。
Davis TM, Denoyes-Rothan B, Lerceteau-Köhler E:草莓。植物基因组定位与分子育种研究。第四卷水果和坚果。编辑:Kole C. Heidelberg: Springer-Verlag Berlin;2007:189 - 205。
- 47。
张强,张志强,张志强,张志强,张志强,张志强。水稻核基因组中基因含量与分布的关系Fragaria Vesca..植物遗传资源学报。2009,2:93-101。10.3835 / plantgenome2008.09.0007。
- 48。
Bonet J, Girona EL, Sargent DJ, Muñoz-Torres MC, Monfort A, Abbott AG, Arús P, Simpson DW, david J:细菌人工染色体库的建立和鉴定Fragaria Vesca..BMC研究笔记。2009,2:188-192。10.1186 / 1756-0500-2-188。
- 49。
Fernández-Romero MD, Torres AM, Millán T, Cubero JI, Cabrera A:该亚属若干种核糖体DNA的物理定位罗莎.应用电子学报。2001,103:835-838。10.1007 / s001220100709。
- 50.
林志强,王志强,王志强,等:长期奇数多倍体在稳定性五倍体中的进化意义狗牙蔷薇刘志强,王志强。遗传多样性研究进展[j] .遗传学报,2005,29(4):451 - 457。10.1038 / sj.hdy.6800648。
- 51.
Ma Y, Islam-Faridi MN, Crane CF, Ji Y, Stelly DM, Price HJ, Byrne DH:原位核糖体DNA杂交至玫瑰染色体。j hered。1997,88:158-161。
- 52。
Mishima M,Ohmido N,Fukui K,Yahara T:在多倍体演化过程中的RDNA基因座的网站数变化的趋势地榆(蔷薇科)。中国生物医学工程学报。2002,32(4):457 - 461。10.1007 / s00412 - 001 - 0175 - z。
- 53。
Reldor E,Románm,garcíae,perera e,arúsp,naranjo t:rdna基因的物理映射建立了杏仁的核型。Ann Appl Biol。2004,144:219-222。10.1111 / J.1744-7348.2004.TB00336.x。
- 54。
Maghuly F, Schmoellorl B, Temsch EM, Laimer M:两个樱桃砧木45S和5S基因的基因组大小、核型和FISH物理定位李春乌斯底皮和李属incisaxserrula.中国生物工程学报,2010,31(4):489 - 494。10.1016 / j.jbiotec.2010.06.022。
- 55。
Yamamoto M, Shimada T, Haji T, Mase N, Sato Y:桃18S核糖体RNA基因的物理定位碧桃(l)批)染色体通过荧光原位杂交。育种科。1999年,49:49-51。
- 56。
Velasco R,Zharkikh A,Comuourtit J,Depouttit J,Delya A,Cestaro A,Kalyanaraman,Fontana P,Bhatnagar Sk,Troggio M,Pruss D,Salvi S,Pindo M,Baldi P,Castelletti S,Cavaiuolo M,CopPola G,Costa F,Cova V,Dal Ri A,Goremykin V,Komjanc M,Longhi S,Magnago P,Malacarne G,Malnoy M,Micheletti D,Moretto M,Perazzolli M,Si-Ammour A,Vezzulli S,Zini E,Eldredge G,Fitzgerald LM,Gutin N,Lanchbury J,Macalma T,Mitchell JT,Reid J,Reid J,Wardell B,Kodira C,Chen Z,Desany B,Niazi F,Palmer M,Koepke T,Jiwan D,Schaeffer S,Krishnan V,Wu C,ChuVT,国王圣,Vick J,TAO Q,MRAZ A,Stormo A,Stormo K,Bogden R,Ederle D,Stella A,Vecchietti A,Kater MM,Masiero S,Lasserre P,LespinaSse Y,Allan AC,Bus V,Chagnéd,crhurstrn,Gleave Ap,Lavezzo E,Fawcett Ja,Proost S,RouzéP,斯里克L,Toppo S,Lazzari B,Hellens RP,Durel C,Gutin A,Bumgarner Re,Gardiner SE,Skolnick M,egholm M,Van de Peer Y,Salamini F,Viola R:驯化苹果的基因组(马吕斯x家庭Borkh)。中国科学(d辑:地球科学)2010,42:833-841。10.1038 / ng.654。
- 57。
果树育种中的细胞遗传学研究——苹果染色体核糖体RNA基因的定位(马吕斯x家庭Borkh)。Al Appl Genet。94:322-324。
- 58。
悍马KE, Bassil N, Njuguna W:Fragaria..野生作物亲属:基因组和育种资源,温带水果。编辑:Kole C. Heidelberg:Springer-Verlag Berlin;2011年:17-44。
- 59.
一种用于序列行走和模拟挖掘的增强方法:TOPO®Vector-Ligation PCR。BMC Res Notes. 2010, 3: 61-66。10.1186 / 1756-0500-3-61。
- 60.
未冻结的I,Gruendler P:5.8s和25s rRNA基因的核苷酸序列和来自的内部转录间隔物拟南芥蒂利亚纳.核酸学报1990,18:4011-10.1093/nar/18.13.4011。
- 61.
棕色克,卡尔森je:两种云杉中编码18s-5.8s-26s rRNA和5s rRNA的基因的分子细胞源性(Picea.).《中国科学院院刊》1997,95:1-9。10.1007 / s001220050526。
- 62.
刘b,张某,张y,lan t,qi l,歌曲w:四个分子细胞遗传学分析落叶双色荧光物种原位杂交和DAPI条带。int j植物sci。2006,167:367-372。10.1086 / 499317。
确认和资金
作者感谢Kim Hummer博士(USDA ARS国家克隆种质资源库,科瓦利斯,俄勒冈州)对这份手稿的批判性评论,感谢Melanie E Shields的编辑协助,感谢Elizabeth Poulsen对草莓FISH方案的初步探索。这项研究得到了USDA-CSREES NRI植物基因组基金2008-35300-04411的支持。部分资金由新罕布什尔农业实验站提供。这是科学贡献号2460。
作者信息
从属关系
通讯作者
额外的信息
作者的贡献
BL设计并进行了研究,并起草了手稿。TMD构思了这项研究并帮助起草了手稿。这位作者都读到并批准了最终手稿。
作者的原始提交的图像文件
权利和权限
本文在BioMed Central Ltd.的许可下发布了这是一个开放的访问文章,根据Creative Commons归因许可(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
刘志强,刘志强,刘志强。核糖体RNA基因的克隆与表达。生物信息学与生物信息学Fragaria.(蔷薇科)。BMC植物BIOL.11,157(2011)。https://doi.org/10.1186/1471-2229-11-157
已收到:
接受:
发表:
关键字
- rDNA网站
- RDNA信号
- 二倍体加入
- 核仁占优势
- 二倍体分类单元