抽象的
背景
由细菌病原体引起的柑橘类溃疡病黄citri无性系种群。citri (Xcc)有在高温、雨水、潮湿和多风的条件下为细菌的传播提供了有利的环境,成为地方病。Xcc在许多柑橘品种上具有致病性,但在柑橘亲缘品种上引起不亲和反应Fortunella玛格丽塔Swing(金橘),以一种非常明显的延迟坏死反应的形式出现。我们已经开发了消减文库,丰富的序列表达在金桔叶片在疾病的早期和晚期。随后对分离的差异表达转录本进行测序。我们的研究结果表明,利用微阵列表达谱可以帮助确定以前未被描述的基因的作用,并阐明植物的致病反应相关机制。这可以被认为是一个案例研究,在柑橘的亲戚,高通量技术被利用来了解防御机制Fortunella.和柑橘在分子水平。
结果
从健康和感染的金桔RNA群体中提取的测序金桔文库(ESTs)的cdna被用来制作这个微阵列.在3054个中,在定制阵列上的选定基因,317在XCC挑战的金刚植物中差异表达(P <0.05),与嘲弄接种的植物相比。该研究确定了不相容的相互作用的组分,例如活性氧物质(ROS)和编程的细胞死亡(PCD)。还鉴定了常见的防御机制和许多抗性基因。此外,存在相当数量的差异调节基因,数据库中没有同源物。这可能是Kumquat响应柑橘疾病或柑橘新防御机制而受到Kumquat采用的专门基因的指示。
结论
Kumquat Xcc响应基因的功能分类显示,响应于XCC接种,响应于Kumquat转录组中的许多抗反应性代谢以及许多耐药响应特异性基因。分析基因表达谱以组装Kumquat / XCC系统中的分子相互作用的综合和包容性图像。这是为了阐明与Kumquat叶中的过敏反应表型相关相关的分子机制。这些数据将用于在柑橘类物种中进行比较,以评估手段以增强对细菌疾病的宿主免疫应答。
背景
柑橘树易受多种疾病的影响,对经济造成不同程度的影响。其中最严重的经济损失之一是柑橘溃疡病(有时称为亚洲柑橘溃疡病)引起的黄citri无性系种群。citri,(同义词,Xanthomonas Axonopodis.PV。citri菌株a;XAC-A)。XCC是一种生物养殖细菌植物病原体,属于该属Xanthomonas.变形菌纲α-细分v。对柑橘溃疡病的敏感性因柑橘类型和亲缘不同而不同,但大多数商业种植柑橘类型是对Xcc敏感的宿主[1].疾病症状包括植物的绿色空中部位以及水果上的溃疡病变;感染可能导致叶面和果实脱落,从而降低受影响树木的生产率。此外,由于瑕疵水果可以收获但在新鲜市场上没有销售,可能会降低盈利能力。
植物已经进化出多种防御机制来抵御病原体的攻击[2].不可或缺的植物先天免疫系统的第一个分支是由病原体相关分子模式(PAMPs)触发的,如脂多糖(LPSs)、肽聚糖和细菌鞭毛蛋白,以及真菌的几丁质和葡聚糖。第二个分支利用R(抗性)基因编码的核苷酸结合位点-富亮氨酸重复序列(NBS-LRR),命名为效应触发免疫(ETI) [3.].这Xanthomonas.SPP。植物细菌病原体已经进化了独特的发病机制,以避免主机识别和抑制寄主防御[4,5].细菌效应蛋白通过细菌III分泌系统(TTS)递送到植物细胞中,以逃避不同植物监测系统的识别[6].总的来说,这些效应源导致宿主或敏感性以及改变宿主响应。抗性植物中ETI的基本要素是局部细胞崩溃或感染部位的过敏反应(HR),以限制病原体的生长[7,8].这是不亲和植物与病原菌(有时是非寄主)相互作用中抗病反应的共同特征[9,10].某些Xanthomonas.SPP。效应蛋白,例如Ptha / AVRBS3对于引发柑橘类溃疡至关重要,如果本身在宿主细胞内表达,pthA足以引起柑橘类溃疡病的症状[11- - - - - -15].然而,与此同时,其他最近的研究表明,其他类型的蛋白质通过XCC TTS注射,并不一定会改变对柑橘的病原体的生理和转录反应[8,10,16,17].
系统获得性抗性(SAR)的某些基因已被鉴定为植物防御机制研究的标记[18,信号和激素途径之间的串扰也被提出[19- - - - - -21].因此,植物抗性与一个复杂的防御通路网络的激活有关,因此寄主植物对微生物攻击的反应预计将导致整个植物基因表达模式的急剧变化[22,23].
金橘(Fortunella.柑橘属植物的近亲,据报道对柑橘溃疡病具有高度的田间抗性[1].以前,当两种植物以高浓度的XCCR攻击时,我们在葡萄柚和金刚素中显示出鲜明对比的表型,并且在高浓度的XCCR(OD600nm = 0.3)[24].西柚 (柑橘天堂金花蛇Macf。简历。Duncan),被认为对该细菌高度敏感,表现出溃疡病变发展的特征序列。最初的损伤出现在水浸泡,随后发展为一个凸起的软木状形式;每一个这样的病变都是新的细菌接种物的蓄水池。接种后10 ~ 21天可见细菌渗出物。与此相反,PCD在金桔叶片中以HR的形式出现,在接种溃疡病致病菌3-5天后。只有坏死病变被观察到,随着时间的推移,细菌种群显示出一种“无毒的”不相容的生长模式,细菌增殖在坏死发展时停止[8,25].
近年来,随着基因组学、蛋白质组学和生物信息学的进步,新的工具已经开发出来,这些工具对检查病原体:宿主相互作用的复杂性有特别的效用[22,26- - - - - -28].本研究的目的是检测金桔溃疡病早期(6-72 hpi)差异表达基因的同时表达谱变化,特别是那些先前涉及pcd相关反应的基因,如HR。
结果与讨论
本研究通过对金桔与Xcc互作过程中差异表达基因的鉴定,试图揭示金桔抗性机制的本质。之前,我们从xcc接种的叶片和mock接种的叶片中构建了金桔抑制消减杂交(kim quat suppression subtractrac杂交(SSH) cDNA文库[24].由于SSH可以对罕见的目标序列进行差异扩增,因为它消除了两种样品中发现的更丰富的共同管家cDNA转录本,因此该技术有潜力发现相关的cDNA序列。在正向(接种-模拟)和反向(接种-模拟)两个方向进行减法,然后对得到的cdna进行测序。用初步筛选的宏数组来确定差异表达基因的减除文库的富集(数据未显示)。
微阵列实验设计
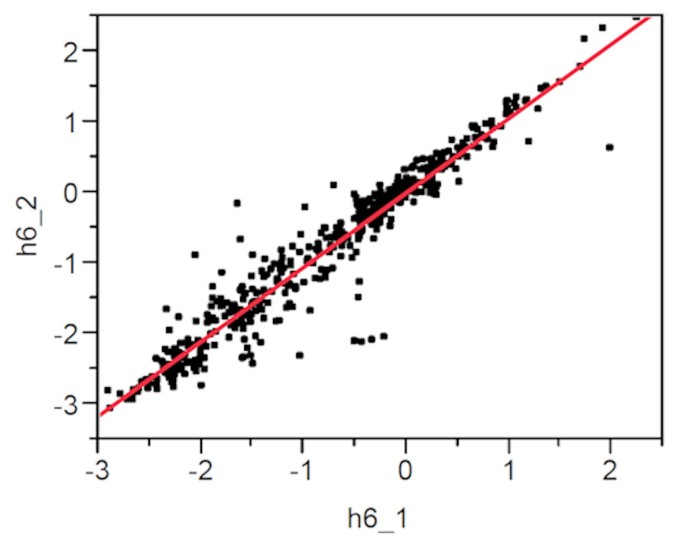
Kumquat微阵列芯片杂交数据被评估了所有时间点的总信号强度和表达比的一致性,导致芯片排除不一致的结果。数字1是一个散点图,显示了xcc诱导靶标(cy5标记)和模拟接种的非感染靶标(cy3标记)的两个不同生物复制杂交的m值,证实了高数据一致性水平(R2= 0.921)。
功能注释及全局基因表达的概述
B2GO计划[29]对NCBI中通过eBLAST同源性搜索获得的条目分配GO (Gene Ontology)术语。查询集与NCBI数据库的相似性的一般视图、e值截断点的分布以及具有相似序列的物种分布在附加文件中显示1,2,3..由于通过在本体论术语上应用注释规则(AR)来执行Go注释,因此,GO注释分数比常规BLAST E值更直观。另外,通过应用提取信息名称的语言处理算法来获得查询序列描述,并避免诸如“假设蛋白质”或“表达蛋白质”的低内容术语。使用BLAST2GO套件默认参数,提供了GO注释(附加文件)提供1042个探针4).阵列上的大约25%的成绩单不会显示与公共数据库中存在的蛋白质相似性。其中一些可以代表柑橘或金刚素谱系的独家基因,但是这些无表序列的一部分可能代表低质量或3'URR序列。在其他小型EST项目中报告了类似百分比的未知序列[30.- - - - - -32.],因此可以认为这种模式是这种方法的特征。由于柑橘基因组序列现在是可用的,未来的研究将有丰富的柑橘基因组序列信息,可以用来识别金橘特有的以及涉及多种防御机制的新柑橘基因[28].
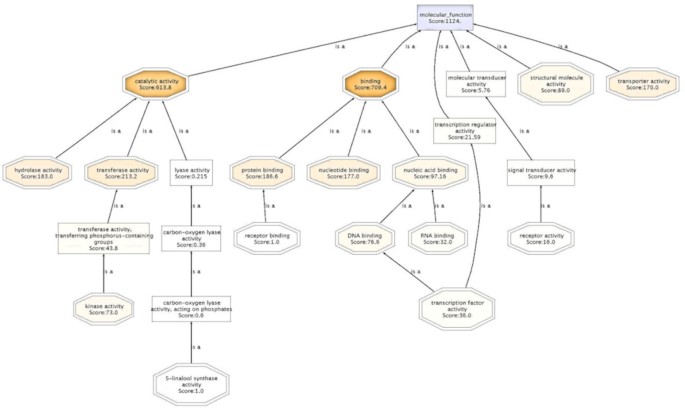
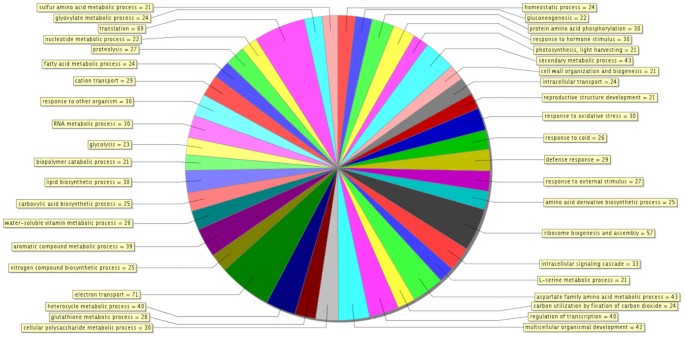
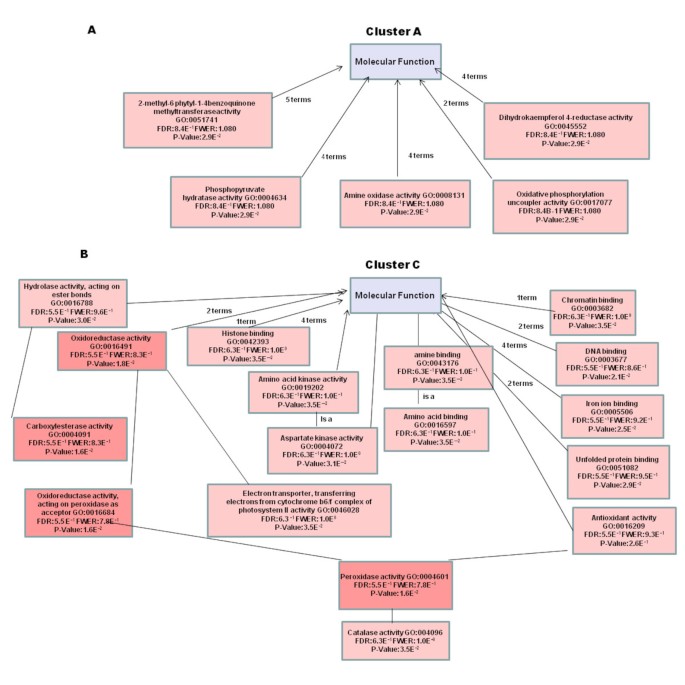
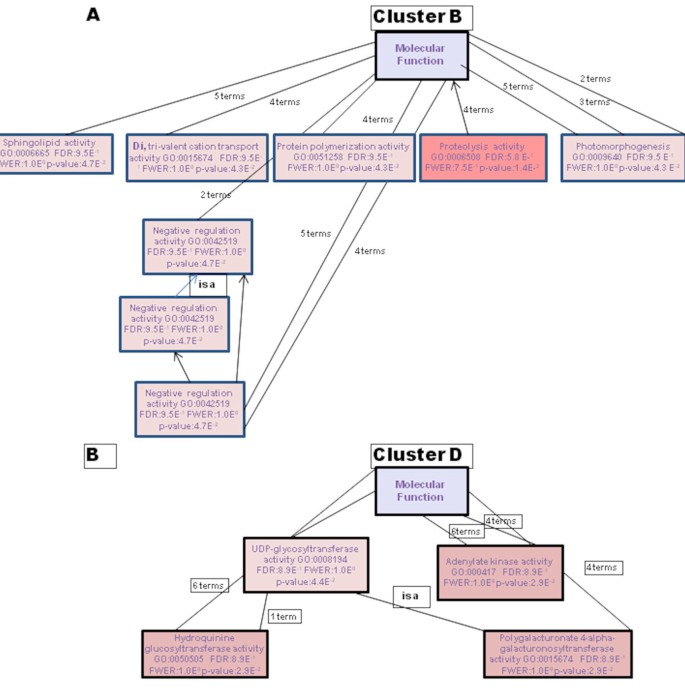
基因本体学分析提供了XCC / Kumquat相互作用的极其信息的快照。一组序列的基因本体的分层结构可以通过定向的非循环图(DAG)作为树被视为树[33.].例如,在图中提出的DAG中示出了与KumQuat对XCC感染的响应的网络的分子函数2.图中展示了Seq筛选器控制的树,该筛选器组织要显示的节点数量。Seq是子GO项上注释的不同序列的数量。总体而言,数据集中不同序列的生物学意义在三个GO基因类别中得到了最好的说明;生物过程(图3.)底层分子函数(附加文件5),以及蛋白质定位的细胞室(附加文件6).
Kumquat转录变化响应XCC感染
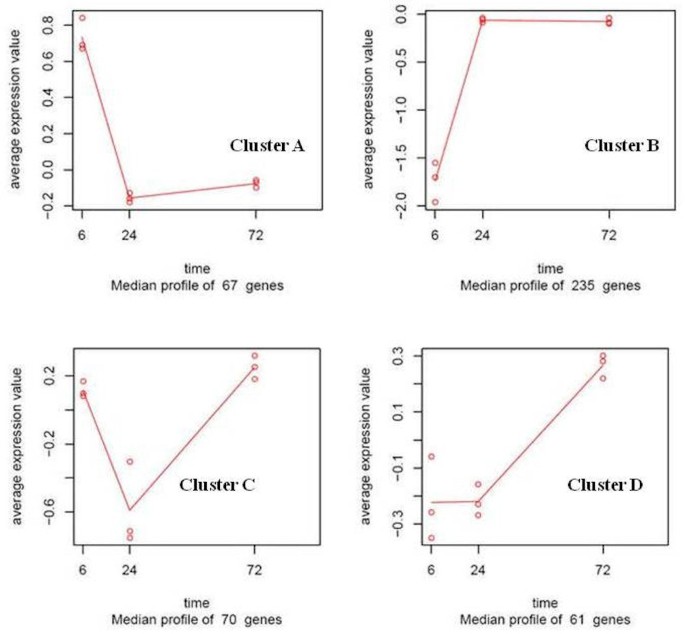
数据的一个重要方面是,对于许多基因来说,转录丰富度随时间点而变化,一些基因只在一两个时间点上调或下调(图)4).使用两种方法来识别基因表达的模式。第一的;ASCA-Gene分析方法显示,数据中的大多数总变异性与时间相关的变化有关[34.].根据ASCA,选择了289个探针作为差异表达,其中172个处于统计学显著水平(附加文件7).此外,时间相关的变化可以被分成两个主要变异图案。一种图案(占20%的变化)代表的基因,其表达水平在6 HPI的水平上以24 HPI发生显着变化,然后在72处恢复到类似于起始值(或甚至相反方向上的值)的值HPI。然而,主要模式(80%的时间相关变化)表明了6至24hpi之间的强基因表达变化,然后在72hpi下保存表达水平。这表明对感染的最强烈反应发生在6至24hpi,大多数基因长达3天,较小的百分比恢复为初始值。
第二种方法,maSigPro分析,显示317个探针在整个时间内的差异表达,(调整后的p值< 0.05和R2型号合适> = 0.6;附加文件8).将两种方法的结果组合成433探针,然后使用更严格的条件过滤以提供独特的结果。促进了联盟而不是两种方法的交叉点,因为这两种方法揭示了数据的不同方面,因此是互补的。ASCA-基因方法侧重于共享基因表达的变化,以找到重要基因,而Masigpro独立处理基因,并评估显着的时间依赖性变化。虽然ASCA-Gene方法可能会错过一些表达模式是罕见但重要的基因,但这些基因将被基因 - 明智的Masigpro方法捕获。或者,Masigpro可以错过具有不那么明显的变化的基因,如果它们的配置文件在数据集中丰富,可以通过ASCA-基因恢复。两种方法的使用共同导致鉴定437个差异表达基因312,其具有可接受的p值,可根据其表达模式分成4个簇(图5额外的文件9).该划分的标准如下。根据ASCA分析,我们获得了变异的主要模式:簇模式A表明6hPI和24 HPI之间表达的强烈变化,然后在时间72 HPI保持。与24hPI或72 HPI相比,簇B模式由6HPI差异表达的基因组成。对于每个模式,计算每个时间点在每个时间点的每个基因的平均值的相关性计算出ASCA-基因所示的谱的每一点;随后将基因分成4个簇,取决于是否在正面或负方向上变化的表达水平。在这种分析中,基因不能简单地被分类为诱导或压制,因为这取决于考虑的时间点;例如,在24hPI中抑制簇模式C中的基因,然后在72 HPI诱导。
转录物的功能分类强调了KCC感染的KumQuat响应中的关键元素
基于植物微生物相互作用期间改变的基因谱的假设可以与症状,基因本体论和注释相关,我们相信XCC代表细菌病原体如何操纵宿主系统的典型例子,以其先前阐明的学习 [3.,4,11,35.,36.].下一段中讨论的所有具体文本的信息见表1.Cernadas.等.接种'Pera'甜橙与Xcc,这导致典型的溃疡病的柑橘类型,或Xanthomonas Axonopodis.PV。AurantifoliiC型(Xaa),它只在墨西哥酸橙上产生症状,然后对甜橙植物进行详细的转录分析[36.].由于研究方法的不同,该研究中的分析不能与我们的研究直接进行比较,但以下是一些概括说明。
在XCC感染的Kumquats中显着表达基因内的功能分布表明,最高数量的转录物(〜30%)与应力,电子传输和/或氧化应激相关有关(如图所示)3.),XCC植物免疫系统的早期调节变化的指示。早期的研究,例如Cernadaset al。,已经有了同样的看法[36.].对每个确定的聚类进行功能分析,要么研究氧化石墨烯项的分布,要么进行富集分析,以查看是否有显著代表性的功能类别。在6 hpi到24 hpi之间,共137个基因发生下调,占显著表达基因的30%以上。他们中的大多数被归入A组和C组(图)6).这些簇中的两种基因的表达水平在24hpi下达到最小的表达水平,然后达到次要(聚类A)或主要(簇C)回收72 HPI(表1).例如,A聚类的硫氧还蛋白f基因同源物(KLLFI3-F09)在24 hpi水平轻微下降后,表达量增加了72 hpi,达到最高表达量(+1.8倍)。这lipoxygenase gene homologue (KSLFII1-F07) that belongs to cluster C was 1.5 fold down-regulated at 6 hpi followed by a 3 fold increase in expression when compared to the its expression level at 6 hpi sample. Genes in Cluster A and C were frequently related to oxidative stress response. Most of the activity for genes in these clusters is located in the mitochondria, the cell membrane and the chloroplast (Figure6).聚类B是最大的聚类,包含了235个表达水平在6 - 24 hpi之间上调后持续表达至72 hpi的基因(图)5,图7A).群集D包含61个成员,其具有低至24 HPI的低稳态表达,随后上调(图5,图7B.).该簇包括基因,例如糖基转移酶样基因(KSLFI7-F12),其介导从活化的核苷酸糖转移糖基残基与受体分子(糖蜜),确定植物的多样性,活性和化学复杂性的关键机制天然产品。在植物中,UGTs(尿苷二磷酸糖糖基转移酶)通常使用UDP-葡萄糖和偶尔UDP-XELOYS用于苯基丙酮糖酮糖的葡糖糖化。Albrecht和Bowman [37.]使用UGT和其他糖基转移酶作为前瞻性遗传工程候选者,由于它们在柑橘Tristeza病毒(CTV)以及Trifoliate橙子中的柑橘黄龙(HLB)中的重要作用和耐受性枳壳trifoliataL. RAF。)。酚类主要通过苯丙砜途径在植物中合成,并将其掺入许多重要的化合物中,包括植物激素,副代谢物,参与压力,防御反应和异卵酸等异丙酚(如除草剂)[38.].此外,苯基丙素途径的中间体,例如对香豆酸、咖啡酸、阿ferulic酸和芥子酸,以及途径的衍生物,包括类黄酮苷元和苷,显示出抗菌活性[39.,40].
Kumquat转录变化响应XCC感染
活性氧与活性氧清除
为了维持体内平衡和克服活性氧的破坏作用,sod(超氧化物歧化酶)与不同H2O2-Scavenging酶被认为对确定o的水平至关重要2-和H2O2在植物细胞[41.,42.].因此,在抗氧化状态和产生ROS的过程之间存在着持续的相互作用。ROS在叶绿体、过氧化物酶体和线粒体中产生,以应对生物和非生物胁迫[43.,44.].因此,在库姆扎/ XCC相互作用期间显着控制并协调产生ROS的不同酶的表达。例如,在甲酸脱氢酶(FDH; kllri2-G05)中,通过6hPI,胺氧化酶(KSLFI3-G05)的6 HPI,胺氧化酶(KSLFI3-G05)上调为1.5倍。有助于合成H.5倍2O2在6和24 hpi时,Xcc刺激的次级代谢物分别下调1.5倍和1.6倍(见表2)1).同时,XCC接种的金刚植物过表达基因与ROS清除有关,以限制植物的接种部分的损伤,在这种情况下叶子。例如,Kumquats中的表达在6 HPI时升高〜1.5倍,并在24 hpi和72 dpi稳定(表1).以前在感染的番茄中观察到相同的现象葡萄孢菌,是宿主产生ROS增加的标志,这是对感染的防御反应的一部分[45.].此外,虽然一些与蛋白酶抑制剂和内肽酶活性相关的基因(如蛋白酶抑制剂同源物(KLLFI2-D02))的表达被细菌抑制,其他丝氨酸型内肽酶抑制剂,如atp依赖的离子蛋白酶(KSLFIV1-H05)早在接种Xcc后6 hpi时就上调了>2倍。在同样的情况下,氧化还原耦合抗坏血酸-谷胱甘肽循环,已知负责过氧化物解毒[46.],在库姆纳特数据集中被6 HPI压抑;实例包括脱氢血脂还原酶(KslRI1-F02)和谷胱甘肽过氧化物酶(Kllfii3-G07)。抗坏血酸和谷胱甘肽是在其他循环中具有作用的非酶促抗氧化分子,包括合成和在某些情况下调节黄酮类化合物,生物碱,酚类化合物,α-生育酚和类胡萝卜素的那些,所有这些都有助于清除ROS [47.].当在某些条件下抗坏血酸过氧化物酶(APX)水平高于正常时,脱氢血晶酸还原酶活性是不可或缺的,以确保保存减少抗坏血酸的形式。除了某些类型的胰蛋白酶抑制剂外还可催化植物反应[48.].一项类似的研究可能为比较两种植物中一些感兴趣的基因表达谱提供一个平台,以研究xanthomonas和葡萄柚的亲和相互作用。
积累证据表明蛋白质泛素化和降解,蛋白质周转的最后步骤,参与了植物防御反应。最近的一些研究已经研究了U-Box E3泛素连接酶在PTI(PAMPS-触发的免疫)中的可能作用,ETI(效应触发的免疫)以及植物细胞死亡和防御[49.,50].本研究在金橘正向减法文库中分离到6个泛素化途径相关基因,如泛素结合酶ucb7 (CSL1-A02);随后将对感染后的表达水平进行更多的调查。其他参与蛋白质水解过程的诱导基因存在于A、B和C簇中。
参与光合作用的基因
在微阵列数据集(Rubisco小和大亚基)中观察到在6HPI下在6HPI下表达含有1,5-双磷酸羧酶/氧酶的明显下调,然后在24hpi下达到最大表达的表达增加,然后在鲁斯科小和大亚基;kllfiii3-g09和kslrii2-f01)(表1).Rubisco是叶片中最丰富的蛋白质,是植物细胞中能源生产的主要来源。前面显示了光合作用的减少拟南芥使用后应在3小时内离开p .两而在48 h后,强毒株的光合速率较低[51].大多数挑战金刚叶的光合作用机械在6 HPI中抑制,包括叶绿素A / B结合蛋白(KILFIII3-A06和KILFIII3-E08)。在前24小时内,三个光合作用相关基因差异下调。在PTO介导的抗性中,抑制了30个光合作用相关基因和12个编码叶绿体相关蛋白的基因[52].这些结果表明,病原菌侵染后,植物降低光合势诱导HR的发生。此外,Quirino等人[53表明HR和衰老是两个涉及生化相似性和重叠的程序。这项研究强化了防御反应和衰老之间存在联系的观点。显然,Xcc/金桔相互作用中光合作用相关基因的下调代表了植物适应性的成本,能量资源被重新定向到防御反应。
细胞壁改造
Xcc接种金桔后,与细胞壁重塑和快速膨胀相关的多种基因如内切葡聚糖酶均下调。该壁松蛋白的金橘同源物(KLLFI2-C10)的表达水平不显著。另一方面,与细胞壁重组相关的基因,如木葡聚糖内转糖基化酶/水解酶(XET,一种参与细胞壁延伸和重组的酶),被24hpi显著上调(KSLFIII1-H08)。在‘Pera’甜橙中,对两种细菌接种的反应的主要差异是Xcc强烈上调几种细胞壁重塑酶,而Xaa上调与内切葡聚糖酶抑制剂和木质素生物合成相关的基因。我们在金橘植株上观察到的一个现象是当接种低浓度的细菌(Xcc)时,叶片上出现几分钟的坏死斑点。在我们的条件下,没有观察到叶片脱落或水浸损伤。值得一提的是,尽管Cernadas等人使用了相对较高浓度的Xaa (OD600 nm = 0.6,是我们使用金桔Xcc时的两倍),但在接种了Xaa的甜橙中只记录到了没有随后出现坏死的柱[24].使用光学显微镜,我们之前已经显示了金刚叶中的叶片坍塌,然后用XCC接种后叶脱落72小时。或者,来自接种叶片的葡萄柚叶片细胞显示出肿大(肥大)和分裂(增生),然后升高呈圆形病变,其升高并开发成白色或黄色海绵篇脓疱。然后将这些脓疱变暗并加厚成棕色卡布溃疡病变[24].脓疱的形成和肥大以前与PthA效应有关尼古利亚娜·宾夕法尼亚州[35.].或者,积累番茄XTH(Xyloglucan内甘油糖苷酶/水解酶lexth1.)寄生虫附着后6小时的蛋白质为作用提供了证据XTH在与不相容的番茄相关的防御反应 -cuscuta.如Albert等人所述[54].
抗性基因及相关蛋白
金桔/Xcc相互作用中的大多数差异表达基因也在植物-昆虫相互作用中被发现[55],非宿主阻力[56和r基因介导的抗性[52,表明不同类型的抗性机制之间存在高度的趋同。PR3(几丁质酶)(KFII1-B11)和ß-半乳糖苷酶(BG1) (KRI2-D05)基因同源物的表达量被适度激活;基因芯片和实时荧光定量PCR (qRT-PCR)数据显示,两个基因分别上调了2倍和1倍6个hpi,但均下调了24个hpi(见表)2额外的文件10).几丁质酶表达是一种植物防御策略,通常用于对抗真菌和昆虫的壁成分[57].根据QRT-PCR,Kumquat Chitinase基因>以6 HPI上调2倍,然后在24hpi下抑制它,然后其表达增加。其他研究还报道了几丁质酶响应细菌病原体的诱导,但它们的功能是不知道的[58].
有趣的是,Kumquat Pr1(发病机制 - 相关基因1)基因同源物的表达水平通常是在病原体感染后通常上调的水杨酸诱导的全身获得的抗性(SAR)的标志物,在感染的样品中较早较低与对照模拟接种样品相比,如6 HPI(Kllfii2-A04)(根据微阵列结果和未发布的数据)。PR1启动子的下游W箱序列的区域先前显示在外防相关基因表达中作为负顺式作用元件[59].这意味着XCC感染后Kumquat中的拟南芥和其他分枝叶植物的不同基础防御反应和SAR调节机制。在柑橘中鉴定的PR基因在它们对不同病原体的反应中变化,如本研究所示,并且其他来自PR基因家族的不同成员的表达水平的变化依赖于不同的Elicitor的性质[60- - - - - -62].植物中绝大多数PR基因在生物胁迫下的生物学活性尚未被揭示。更有趣的是,根据微阵列的结果,Xcc感染后,许多与其他防御相关基因(如NDR1基因(KLLFII2-E03))同源物的表达水平也受到了抑制。
已知LRR蛋白是早期信号转导级联反应的一部分,涉及病原体Avr产物的识别[63].已知已知是具有不同荷尔蒙防御途径(例如转录因子,受体和受体样激酶)的一部分的同源物的序列被发现在XCC接种之后在库姆氏酸中差异表达。
金桔PCD的主要分子特征
在接种Xcc后,金桔转录组中同时表达了一些与已知抗性反应特异性基因同源的基因,以下列出并讨论:
- (一世)
kslfi3-c10是同源的HSR203J.这是一个羧酸酯酶(CXE)基因,先前在烟草和病原菌之间的不亲和相互作用中有牵连Ralstonia solanacearum..它的启动子非常迅速,并且特别激活响应于HR诱导细菌接种而响应各种压力条件,并且强烈依赖于合(病原菌的过敏反应和致病性)基因[64].已经提出,其表达应该是响应于不同病原体的程序性细胞死亡的有用标记。
- (2)
Kllri2-B05与DND1(Dearing No Death 1)分享同源性,其编码循环核苷酸门通道,其允许通过CA2 +,K +和其他阳离子通过。这拟南芥芥DND1.突变体未能响应于无毒病原体感染而产生人力资源死亡[65].
- (3)
在编程的细胞死亡或细胞凋亡中,细胞色素C从线粒体的膜间空间释放到细胞质中[66,67].一旦进入细胞质,它就会激活caspases(半胱氨酸天冬氨酸特异性蛋白酶),这是一种杀死细胞的蛋白质[68].已知的两种关键蛋白质是动物,胱天蛋白酶和Bax-Inhibitor1基因同源物,在我们的数据集中被识别。根据我们的数据,在金橘胁迫的叶片中,具有caspase活性的同源物KLLRI2_A12被6 hpi轻微上调。Bax是Bcl2家族的一员,通过抑制caspases激活所需的适配器,发挥调节作用防止细胞凋亡[54].一个金刚的同源物Bax-Inhibitor1显示基因(KILFIII2-E06),响应于先前所示的XCC挑战,将略微上升6HPI。如前所述拟南芥Bax抑制剂-1(atbi-1),在对受植物病原体挑战的植物进行差异筛选时分离假单胞菌含油[69].在同样的情况下,Bax抑制剂已被证明能触发线粒体和线粒体的细胞色素c释放体外和体内在动物。
- (iv)
内肽酶抑制剂通常是诱导的茉莉酸相关防御途径的一部分,在叶片受伤、病原体或草食动物损伤时积累[26].蛋白酶和内胚酶抑制剂之间的拮抗相互作用被认为是细胞死亡控制机制[70].李et al ., 2008)拟南芥丝氨酸蛋白酶(Kunitz trypsin)抑制剂(KTI1)参与调控植物与病原互作中的PCD [71.].ATKTI1基因的RNAI沉默导致叶片组织与PCD引发的真菌毒素Fumonisin B1(FB1)或无毒的细菌病原体渗透后的病变发育假单胞菌含油pv番茄DC3000携带avrB (Pst avrB)。胰蛋白酶抑制剂(KSLFIII1-H12和KLLFIII3-F03)和奇迹蛋白丝氨酸型内肽酶抑制剂(FI2-A05)序列在原始的早期减法文库中被发现,它们代表了早期感染时表达的转录本(30分钟pi-24 hpi)。KLLFIII3-F03 (trypsin homologue)基因6 hpi表达显著抑制,KSLIII1-H12表达轻微抑制,24 hpi表达上调2倍。这两个基因的作用机制还有待进一步研究。
抑制防御反应
对相当数量的基因进行了非常明显的下调,记录了6个HPI,其可能是由XCC效应器施加的防御抑制(簇A和C;图6和6B.).已经显示出以前认为XCC利用III型分泌系统(T3S)将不同的效应蛋白注入柑橘植物,以避免宿主识别和随后进行制备/挥发触发的免疫。细菌效应蛋白抑制植物防御,包括基础防御,基因抗性和非形状抗性。没有任何SAR基因转录物的积累,包括PR1,一种用于增强防御的标志物;另外,SA防御途径中的一些其他关键元件被抑制。另一方面,S-腺苷-1-甲硫氨酸:苯甲酸水杨酸羧基甲基转移酶基因(Kllri2-CO 3)在Kumquat叶中的上调至少1倍,响应于XCC接种,通过6hPI叶上调6 HPI;已知基因在植物防御响应中发挥作用[72.].此外,发现SA结合蛋白2(SABP2 Kllri2-G01),属于水解酶超级家族的脂肪酶蛋白,在6hPI中以至少2倍上调;先前发现该基因是烟草中的植物免疫应答所必需的[73.].
实时定量聚合酶链反应验证
使用Taqman基因表达测定对所提出的微阵列数据集进行验证,用于阵列上的许多同源物。涉及植物防御的基因,包括碱性亮氨酸拉链转录因子(KILFII2-C05),推定的胰蛋白酶蛋白(CHI1)(KllRI2-D05),一种推定的抗病患者富含蛋白质(CSL1-D05),受体如蛋白激酶等受体(Kllri2-H10),选择蛋白质(KILFII1-B11)和推定的丝裂丝糖苷活化蛋白(CSL2-A02)的β半乳糖苷酶用于使用Q RT-PCR验证。如表所示2和附加文件10, qRT-PCR数据与芯片结果相关,证实了所有分析基因的上调或下调,尽管与预期一样,qRT-PCR更敏感。
结论
在本研究中,af·玛格丽塔自定义微阵列代表1024个ungenes被用来研究对接种的响应x axonopodisPV。citri.在XCC接种的金刚植物中观察到延迟HR,在XCC接种的金刚植物中观察到,其中噬菌体呈指数增长,其次是突然的叶片组织塌陷(坏死没有溃疡病变)2-5天后接种后[24].在AvrXv3效应和RxvT3 R蛋白介导的番茄T3抗性反应中观察到一个类似的延迟HR [74.].目前的金橘分析允许同时研究已知与XCC感染引起的HR相关的多种生物过程和细胞室与多种生物学过程和细胞室相关的表达。发现大量基因在感染后被差异表达。涉及库姆扎的防御机制的大多数基因似乎与在包括氧化爆发,蛋白质降解和光合作用的调节的现象中的现象相关,以及与氧化突发相关的ROS的生产。一个非常独特的观察是,一些防御基因如Pr1和NDR1在Kumquats中下调,响应于XCC接种,目前正在进行检查的现象。除了在ROS生产中涉及和编程的细胞死亡中涉及的基因的激活外,细菌种群的显然似乎是一种抗性的反应和急剧下降,似乎是一个以上柑橘的普遍机制没有相关抗性基因的细菌病原体尚未鉴定[24,36.].未来的工作将比较抗病和易感柑橘品种的基因反应差异。
方法
植物材料和细菌接种
Fortunella玛格丽塔不悦之色。本研究中所有的实验都使用了长津金桔。在试验时,植物大约有2年的幼苗,并在受控条件下在佛罗里达农业部(Gainesville, FL, USA)植物工业部的检疫温室设施中饲养。根据Lund等人的研究,一组六种金桔植物的叶子被细菌培养物渗透。75.].使用的细菌菌株是黄citri无性系种群。citri一种;迈阿密X04-59(XCC)。将接种为5×108cfu / ml。使用类似无菌自来水作为对照的类似植物进行嘲笑。从两套植物中使用的叶片用于随后的实验。
微阵列平台
Kumquat MicroArray芯片是在佛罗里达大学(Gapesville,FL,USA)的开发和印刷。阵列包括从4个以前构建的Nagami Kumquat前向和反叶减法cDNA文库中选择的阵列。使用以不同间隔收集的叶片组织提取的RNA构建cDNA文库,与XCC(见下文)收集并汇集到早期和后期库集中以捕获广谱的差异表达的转录物[24].利用通用引物对随机选取的5'端和3'端进行DNA测序,分别获得了早叶减影库2788个克隆和晚叶减影库1655个克隆的序列信息。
初始数据集减少到总共2304个转录物,根据与GenBank数据库中的蛋白质序列对准相似性选择。基于质量和长度选择序列。除了50 cDNA控制元素之外,数据集包括2254 kumquat ests,其包含738个Contigs和1516单身。每个探头都是在阵列上的3个位置印刷,使用全墨径微阵列(基因机,San Carlos,CA,USA),使得所有克隆在每个幻灯片上有3个技术复制,共产生6912个斑点。如Heller等人所述进行了印刷后的滑动处理。(1997)[76.]有一些修改。简而言之,实施了顺序烘焙和UV交联的组合,其中在没有真空的干燥箱中在80℃下将载玻片烘烤80分钟。然后将载玻片在0.1%SDS中洗涤两次,每次3分钟去除任何未结合的DNA。
实验计划
为了识别在金橘中被认为有差异表达的基因,我们设计了一个利用金橘/Xcc病理系统的时间-过程实验。使用6株独立的Xcc或模拟接种金桔植株;每一株植物都被认为是一个独立的生物复制。柑桔溃疡病是一种非系统性疾病,因此,采用5 × 10处理,每个金桔植株独立渗透6 ~ 10片叶片8cfu /毫升Xcc。所有从健康的模拟或接种(感染)叶片的Xcc分离的RNA样本都是独立处理的。观察到的差异基因表达不太可能是由使用的压力渗透接种方法引起的,因为该因子是通过完全相同的方法处理模拟接种植株来正常化的。
接种和模拟接种的植株在接种后的特定时间点按指定的条件收获单株叶片;3个时间点用于芯片实验,5个时间点用于后续的实时PCR检测。在微阵列实验中,选择6 hpi、24 hpi和72 hpi三个时间点是基于接种后这些时间点之前检测到的内部细菌种群,以及在接种后3-5天金橘叶片脱落的知识。此外,前期实验表明,Xcc接种后30分钟就有一些转录本差异表达。最后,RNA产量和细胞转录本的丰度随着叶片接近PCD总量而下降,这已经被其他研究证实[53].时间点分别为0和120 hpi,用于实时PCR检测。健康的模拟接种和xcc接种叶片样品立即在液氮中冷冻。对于每个时间点,根据制造商的方案,使用RNeasy色谱柱(QIAGEN, Valencia, CA, U.S.A.)提取总RNA。使用分光光度计和BioAnalyzer 2100(安捷伦技术公司,帕洛阿尔托,CA)评估RNA纯度、浓度和质量。
荧光探针、杂交和扫描
在与探针杂交玻片之前,玻片在含有5× SSC、0.1% SDS和1%牛血清白蛋白的溶液中,在42℃下预杂交45分钟,以消除探针与玻片的非特异性结合。玻片用MilliQ RNase游离水洗涤,然后用异丙醇每片洗涤一次,然后风干。切片保持在杂交温度,直到加载探针。利用Genisphere (Hatfield, PA, USA) 3DNA Array50进行cDNA标记®表达阵列检测试剂盒根据制造商的总RNA的协议。对于从独立植物(生物复制)分离的每个时间点125μg的无DNA的总RNA(生物复制),每次均线接种和通过ambion逆转录酶分开接种和感染的叶样样品的逆转录(Ambion; Lajolla,CA)。在基因氏菌DT引物的存在下。如下进行两步杂交。在48℃下进行的第一种杂交过夜,含有10μl浓缩的cDNA(热变性探针),使用Cy5-RT引物捕获序列或Cy3-RT引物捕获序列,在基因孢子基础上使用Cy3-RT引物捕获序列制成杂交缓冲液。进行三次连续的后杂交洗涤,首先在2×SSC,0.2%SDS在55℃下进行10分钟,然后在室温下最终在0.2×SSC中最终在0.2×SSC中进行10分钟。使用2.5μLCy3或Cy5树枝状聚合物,2μL高端差分缓冲液和58μL杂交缓冲液进行第二杂交(添加染料)。对于每个时间点,用Cy-3标记来自三种单独植物的三种模拟接种样品,用Cy-5标记XCC感染的样品,两者均为相同的阵列杂交。在初级杂交后比较早期进行后杂交洗涤,将0.1ml二硫代噻钛(DTT)加入第一和第二洗涤溶液中以减少荧光染料的氧化。
cDNA微阵列的建立和质量控制
使用内部控制探针和非特定控制元件确定检测灵敏度水平的控制措施。将人类基因组DNA,绿色荧光蛋白基因和λ对照模板DNA片段作为阴性对照。另外,CDNA先前涉及病原体防御,例如PR1和NPR1拟南芥,来自柑橘的NDR1,在阵列上印刷3次,以测试微阵列方法检测基因表达变化的能力。这些被认为是特异性阳性对照。此外,分析的每个基因的微阵列比率归一化针对18秒的微阵列比标准化。
转录组数据分析
使用安捷伦的特征提取软件(Agilent Corp., Palo Alto, CA)分析微阵列数据。数据已上载至统计平台R [77.]用于统计分析,利用蕾丝包用于预处理。数据是低换的,然后在阵列之间进行缩放[78.].根据复制信号的一致性,为每个时间点实验选择两个阵列幻灯片。表达的折叠差异计算为:28Verage比率(2到平均比率的功率)。认为平均比为1.0或更高的CDNA被认为是差异表达的,其表示表达1.5倍或更高的差异。使用两种不同的方法进行统计分析。通过Masigpro方法分析时间依赖性基因表达变化[79.].随后对数据进行ASCA-基因分析,所述ASCA-GENE分析结合了ANOVA和多元方法,以鉴定与不同实验因素相关的基因表达的主要和次要模式[34.].统计学分析鉴定了许多选择的基因,其进一步分为簇。
关于阵列中表示的EST的功能信息由BLAST2GO分析使用默认参数获得[29].Blast2GO使用Blast和一个详细的注释算法将基因本体(GO)、酶代码和InterPro功能标签分配给一组未特征序列[27].通过应用包括在扩展算法的Blast2Go中包括的功能性富集(Fe)方法来完成这些簇的功能表征。FE方法评估哪些功能类别在与更广泛的列表中的一组基因内过度代表,在这种情况下,整个金刚阵列。最后,使用PCA-Masigfun方法研究了各种诱导的转录变化作为整体的功能类[80].此方法组合了主成分分析和MasigPro来表征与蜂窝函数相关联的“表达式配置文件”。来自此工作的序列数据已存放在NCBI Genbank数据库库中(http://www.ncbi.nlm.nih.gov/GenBank/index.html)使用Bankit Dbest数据库,并获得了登录号。[Genbank:GW687757至GW690680]。(请参阅附加文件11).
实时定量PCR
金橘叶用XCC渗透(5×108每毫升CFU),然后将总RNA从接种的叶片0,6,24,72,120hPI中分离出微阵列和定量实时PCR实验,如前所述在“实验计划”中所述。
使用TRIzol试剂(Invitrogen公司,Carlsbad,CA, U.S.A.)根据制造商说明分别在每个时间点分离总RNA。根据制造商的说明,使用RNeasy Plant Mini Kit (Qiagen, Valencia, CA)进一步纯化RNA样本,包括DNase TURBO (Ambion, Austin, TX, U.S.A.)处理。然后使用显微分光光度法(Nanodrop Technologies, Inc., Wilmington, DE)评估RNA的质量和数量。用Applied Biosystems (High Capacity cDNA Reverse Transcription Kit pn4368813, 4374966)从1 μg总RNA中合成cDNA。然后使用TaqMan基因表达分析来验证金橘微阵列中特定基因子集的转录本积累水平。反应在ABI Prism7900 HT序列检测器(应用生物系统公司,福斯特市,美国)中进行。采用Primer Express 3.0软件(Applied Biosystems)设计qRT-PCR引物,数据以Taqman核糖体RNA对照标准化,同时以金桔18S核糖体基因作为内部对照,每个实时PCR反应均与18S引物平行进行。对于内部控制,一些基因,例如肌动蛋白显示不一致。令人惊讶的是,18s在整个相互作用过程中显示出了一致性,这在微阵列中被注意到,随后被Realtime PCR (RT-qPCR) 18s表达曲线证实。qRT-PCR分别在50℃2分钟,95℃10分钟,95℃15秒,60℃1分钟循环40次。
参考文献
- 1.
柑橘溃疡病的病原及其影响。在线植物健康进展,2002。
- 2.
Głowacki S, Macioszek V, Kononowicz A:作为植物先天免疫基础的R蛋白。细胞,分子生物学通讯。2010,1-24。
- 3.
植物的免疫系统。自然科学学报。2006,444(7117):323-329。10.1038 / nature05286。
- 4.
王志强,王志强,王志强,等。植物抗氧化活性的研究进展。中国生物防治学报,2006,26(3):427 - 434。10.1094 / mpmi - 19 - 0342。
- 5.
杨B,Sugio A,白色FF:通过AVRXA7的重复和C末端区域的改变来避免宿主识别,Xanthomonas oryzae PV的III型效应器。oryzae。Mol植物微生物相互作用。2005,18(2):142-149。10.1094 / mpmi-18-0142。
- 6.
Alfano JR, colmer A:植物致病菌的III型(Hrp)分泌途径:harpin、Avr蛋白的转运与死亡。微生物学通报,2003,22(4):427 - 434。
- 7。
陈志强,陈志强,陈志强,等。植物自交不亲和与天然免疫的关系。应用生态学报,2017,29(3):591 - 598。植物营养学报,2008,17(3):513 -514。10.1111 / j.1469-8137.2008.02403.x。
- 8。
gotig N, Garavaglia BS, Daurelio LD, Valentine A, Gehring C, Orellano EG, Ottado J: Xanthomonas axonopodis pv。柑橘使用一种植物利钠肽样蛋白来改变宿主的稳态。美国国家科学院学报。[j] .地球科学进展,2012,30(4):457 - 461。10.1073 / pnas.0810107105。
- 9。
Bestwick CS,Brown IR,Bennett MH,Mansfield JW:莴苣细胞过敏反应期间过氧化氢积累的定位假单胞菌含油光伏phaseolicola.植物细胞。1997,9(2):209-221。
- 10.
关键词:拟南芥,环核苷酸门控通道2,先天免疫,死亡没有仁慈,钙也没有仁慈植物学报,2007,19(3):1081-1095。10.1105 / tpc.106.045096。
- 11.
Shiotani H, Fujikawa T, Ishihara H, Tsuyumu S, Ozaki K: pthA同源物Xanthomonas Axonopodis.PV。citri负责宿主特异性的毒性抑制。中国生物医学工程学报。2007,31(4):531 - 534。10.1128 / JB.01790-06。
- 12.
Brunings AM, Gabriel DW:Xanthomonas Citri:打破了表面。植物营养与肥料学报。2003,4(3):141-157。10.1046 / j.1364-3703.2003.00163.x。
- 13.
Romer P,Hahn S,Jordan T,Strauss T,Bonas U,Lahaye T:植物病原体识别通过Pepper BS3抗性基因的启动子激活介导。科学。2007,318(5850):645-648。10.1126 / Science.1144958。
- 14。
杨B,白色FF:AVRBS3 / PTHA系列III型效果的各种成员是大米细菌枯萎病中的主要毒力决定因素。Mol植物微生物相互作用。2004,17(11):1192-1200。10.1094 / mpmi.2004.17.11.1192。
- 15.
段艳萍,安志刚,郭志刚,郭志刚:植物细胞中一个单一的、宿主特异性的细菌致病性基因的表达诱导细胞分裂、扩大和死亡。植物与微生物的分子相互作用。1999,12(6):556-560。10.1094 / MPMI.1999.12.6.556。
- 16.
tasik L, Borin PF, Khater LC, Ramos CH: Xanthomonas axonopodis pv三种假想分泌伴侣蛋白的克隆和鉴定。citri。中国生物医学工程学报,2017,32(2):363-369。10.1016 / j.pep.2007.01.011。
- 17.
白FF, Potnis N, Jones JB, Koebnik R: Xanthomonas的III型效应。植物病理学杂志。2009,10(6):749-766。10.1111 / j.1364-3703.2009.00590.x。
- 18。
Schenk PM,Kazan K,Anyners JM,Anderson JP,Simpson Rs,Wilson Iw,Somerville SC,Maclane DJ:拟南芥中的系统基因表达在与Alternaria Brassicicola不相容的互动过程中。植物理性。2003,132(2):999-1010。10.1104 / pp.103.021683。
- 19。
Spoel Sh,Dong X:在植物免疫反应期间使荷尔蒙串扰感。细胞宿主微生物。2008,3(6):348-351。10.1016 / J.chom.2008.05.009。
- 20.
Lorenzo O,Piqueras R,Sanchez-Serrano JJ,Solano R:乙烯响应因子1整合来自乙烯和茉莉酸盐途径的信号。植物细胞。2003,15(1):165-178。10.1105 / TPC.007468。
- 21.
不同的植物激素通过很大程度上不重叠的转录反应调控相似的过程。生物技术学报。2006,27(3):467-475。10.1016 / j.cell.2006.05.050。
- 22.
Glazebrok J:使用微阵列分析来解剖植物防御反应。方法Mol Biol。2007,354:121-130。
- 23.
Leon-Reyes A, Spoel SH, De Lange ES, Abe H, Kobayashi M, Tsuda S, Millenaar FF, Welschen RA, Ritsema T, Pieterse CM:乙烯调节NPR1在水杨酸和Jasmonate信号之间的交叉对话中的作用。植物杂志。2009。
- 24.
Khalaf AA,Moore Ga,Jones JB,Gmitter FG:对Nagami Kumquat对溃疡病的新见解。生理和分子植物病理学。2007,71:240-250。10.1016 / J.PMPP2008.03.001。
- 25.
A:植物中的细菌病原体:靠墙的生活。acta botanica sinica(云南植物学报). 1996,8(10):1683-1698。
- 26。
Alba R,Fei Z,Payton P,Liu Y,Moore S1,Debbie P,Cohn J,D'Ascenzo M,Gordon JS,Rose JK等人:EST,cDNA微阵列和基因表达分析:解剖植物生理学的工具和发展。工厂J.2004,39(5):697-714。10.1111 / J.1365-313x.2004.02178.x。
- 27。
Gotz S, Garcia-Gomez JM, Terol J, Williams TD, Nagaraj SH, Nueda MJ, Robles M, Talon M, Dopazo J, Conesa A:使用Blast2GO组件的高通量功能注释和数据挖掘。核酸学报2008,36(10):3420-3435。10.1093 / nar / gkn176。
- 28.
Talon M,Gmitter FG:柑橘基因组学。int j植物基因组学。2008,2008:528361。
- 29.
Conesa A,Gotz S,Garcia-Gomez JM,Terol J,Talon M,Robles M:Blast2Go:功能基因组学研究中的注释,可视化和分析的通用工具。生物信息学。2005,21(18):3674-3676。10.1093 / Bioinformatics / BTI610。
- 30.
小科恩、马丁·GB:假单胞菌含油PV。番茄III型反应器AVRPTO和AVRPTOB在番茄中促进乙烯依赖性细胞死亡。工厂J.2005,44(1):139-154。10.1111 / J.1365-313x.2005.02516.x。
- 31.
Desikan R,S Ah-M,Hancock JT,Neill SJ:通过氧化应激调节拟南芥转录组。植物理性。2001,127(1):159-172。10.1104 / pp.127.1.159。
- 32.
帮派博士,王家,达达维加,纳姆·凯,西蒙·杰恩,洛克基·e:甜罗勒亚苯基丙烯储存和生物合成的调查。植物理性。2001,125(2):539-555。10.1104 / pp.125.2.539。
- 33.
Conesa A,Gotz S:Blast2Go:植物基因组学中功能分析的综合套件。int j植物基因组学。2008,2008:619832。
- 34.
Nueda MJ,Conesa A,Westerhuis Ja,Hoefsloot HC,Smilde Ak,Talon M,Ferrer A:发现Anova-SCA的时间课程微阵列实验中的基因表达模式。生物信息学。2007,23(14):1792-1800。10.1093 / Bioinformatics / BTM251。
- 35.
关键词:细菌效应,植物转录因子,细胞大小调节因子中国科学:地球科学。10.1126 / science.1144956。
- 36.
柑橘溃疡病病原Xanthomonas axonopodis pv与甜橙相互作用的转录分析。柑橘和轴索足黄单胞菌。aurantifolii。acta botanica sinica(云南植物学报),2008,29(5):531 - 534。10.1111 / j.1364-3703.2008.00486.x。
- 37.
Albrecht U,Bowman KD:敏感和耐受性柑橘对Candidatus Libibacter Asiaticus感染的转录响应。植物科学。2011年。
- 38。
Ross J,Li Y,Lim E,Bowles DJ:高等植物糖基转移酶。基因组Biol。2001,2(2):评论3004。
- 39。
德克松:天然产品和植物疾病抵抗力。自然。2001,411(6839):843-847。10.1038 / 35081178。
- 40。
Mugford ST, Qi X, Bakht S, Hill L, Wegel E, Hughes RK, Papadopoulou K, Melton R, Philo M, Sainsbury F, et al .:在燕麦中合成抗菌化合物和抗病所需的丝氨酸羧肽酶样酰基转移酶。植物学报,2009,21(8):2473-2484。10.1105 / tpc.109.065870。
- 41。
王志强,王志强,王志强,等:植物与微生物早期相互作用过程中的活性氧。acta botanica sinica(云南植物学报),2010,52(2):195-204。10.1111 / j.1744-7909.2010.00933.x。
- 42。
托雷斯马:在生物互动中的ros。Physiologia plantarum。2010,138(4):414-429。10.1111 / J.1399-3054.2009.01326.x。
- 43.
De Pinto MC,Paradiso A,Leonetti P,De Gara L:在防御和细胞死亡之间的十字路口的十字路口中过氧化氢,一氧化氮和细胞溶质抗坏血酸过氧化物酶。工厂J.2006,48(5):784-795。10.1111 / J.1365-313x.2006.02919.x。
- 44.
研究了氧化应激的信号转导机制。中国生物医学工程学报,2002,21(4):427 - 434。10.1093 / jexbot / 53.372.1227。
- 45.
Kuzniak E,Sklodowska M:效果葡萄孢菌番茄叶片线粒体抗氧化谱的感染。J Exp Bot。2004,55(397):605-612。10.1093 / JXB / ERH076。
- 46.
Halliwell B,Foyer Ch:抗坏血酸,金属离子和超氧化物。Biochem J. 1976,155(3):697-700。
- 47.
氧化还原稳态和抗氧化信号:应激感知和生理反应之间的代谢界面。植物学报。2005,17(7):1866-1875。10.1105 / tpc.105.033589。
- 48.
Trumper S,Follmann H,Haberlein I:一种新型 - 脱氢血醇还原酶从菠菜叶绿体与植物胰蛋白酶抑制剂同源。费用。1994,352(2):159-162。10.1016 / 0014-5793(94)00947-3。
- 49.
拟南芥U-BOX17的E3泛素连接酶活性及其烟草同源物ACRE276的功能是细胞死亡和防御所必需的。植物学报,2006,18(4):1084-1098。10.1105 / tpc.105.039198。
- 50。
Trujillo M,Ichimura K,Casais C,Shirasu K:拟南芥中泛骨泛素连接酶三联体的粘性触发免疫的负调节。Curr Biol。2008,18(18):1396-1401。10.1016 / J.Cub.2008.07.085。
- 51。
(2)拟南芥的光合作用和库代谢受紫丁香毒强、毒株侵染的影响不同。植物学报。2006,22(1):1-12。10.1007 / s00425 - 006 - 0303 - 3。
- 52。
Mysore ks,d'ascenzo md,他x,martin gb:番茄中抗病基因Pto的过度表达诱导基因表达的变化与人和果蝇中的免疫应答相似。植物理性。2003,132(4):1901-1912。10.1104 / pp.103.022731。
- 53。
Quirino BF,NOH YS,Himelblau E,Amasino RM:叶片衰老的分子方面。趋势植物SCI。2000,5(7):278-282。10.1016 / s1360-1385(00)01655-1。
- 54。
Albert M, Werner M, Proksch P, Fry SC, Kaldenhoff R:在番茄对植物寄生虫Cuscuta reflexa的防御反应中表达了修饰细胞壁的木葡聚糖内转糖基化酶/水解酶LeXTH1。植物生物(Stuttg)。[j] .环境科学学报,2004,6(4):402-407。10.1055 / s - 2004 - 817959。
- 55。
Zhu-Salzman K,Salzman Ra,Ahn Je,Koiwa H:高粱防御决定簇对饲料蚜虫的转录调节。植物理性。2004,134(1):420-431。10.1104 / pp.103.028324。
- 56.
关键词:大豆脓疱病(Xanthomonas axonopodis pv),辣椒(Capsicum annuum L.),非寄主抗性,基因芯片甘氨酸)。功能整合基因组学。2004,4(3):196-205。
- 57.
Brunner F,Stintzi A,Fritig B,Legrand M:烟草三碱基酶的底物特异性。工厂J.998,14(2):225-234。10.1046 / J.1365-313x.1998.00116.x。
- 58.
植物几丁质酶的调节和功能。中国生物医学工程学报。2003,27(3):427 - 434。
- 59.
李志强,李志强,李志强,等:拟南芥PR-1基因表达调控序列的功能分析。植物学报,1998,16(2):223-233。10.1046 / j.1365 - 313 x.1998.00288.x。
- 60.
Mitsuhara I,Iwai T,Seo S,燕川哇,kawahigasih,Hirose s,Ohkawa Y,Ohashi Y:1219米PR1家族基因的特征表达响应病原体感染,伤害和国防相关信号化合物(121/180).分子遗传学和基因组学:MGG。2008,279(4):415-427。10.1007 / s00438-008-0322-9。
- 61.
Campos Ma,Rosa DD,TeixeiraJéc,Targon MLPN,Souza AA,Paiva LV,STACH-Machado博士,Machado Ma:柑橘基因系列:基于ESTS方法的器官特异性生物和非生物诱导表达表达型材。遗传学和分子生物学。2007,30:917-930。10.1590 / S1415-47572007000500020
- 62。
Li C-W,Su R-C,Cheng C-P,您S-J,Hsieh T-H,Chao T-C,Chan M-T:番茄Rav转录因子是AP2 / Erebp介导的防御途径中涉及的枢轴调节剂。植物生理学。2011,156(1):213-227。10.1104 / pp.111.174268。
- 63。
Dodds Pn,Lawrence Gj,Ellis JG:少于富含亮氨酸的重复β-链/β转基质的六个氨基酸变化,确定了亚麻中P和P2耐锈性特异性之间的差异。植物细胞。2001,13(1):163-178。
- 64。
研究表明,hsr203J是一种快速、高定位、特异的烟草抗病基因。植物学报,1994,5(4):507-521。10.1046 / j.1365 - 313 x.1994.5040507.x。
- 65。
引用本文:刘志强,刘志强,刘志强,刘志强:拟南芥dnd1“防御,无死亡”基因编码一个突变的环核苷酸门控离子通道。美国国家科学院学报。中国海洋大学学报,2000,97(16):9323-9328。10.1073 / pnas.150005697。
- 66。
绿色博士,芦苇JC:线粒体和细胞凋亡。科学。1998,281(5381):1309-1312。
- 67。
Logan DC:动态的植物线粒体。细胞与发育生物学学报。2010,21(6):550-557。10.1016 / j.semcdb.2009.12.010。
- 68.
Martinou J-C,Desagher S,Antonsson B:细胞色素C从Mitochondria释放:全部或全无。NAT细胞BIOL。2000,2(3):E41-E43。10.1038 / 35004069。
- 69.
AtBI-1是Bax抑制剂-1的植物同源物,可以抑制Bax诱导的酵母细胞死亡,并在损伤和病原体侵袭过程中迅速上调。植物学报,2000,21(4):393-399。10.1046 / j.1365 - 313 x.2000.00690.x。
- 70.
Hoeberichts FA,Woltering EJ:植物编程细胞死亡的多个介质:保守细胞死亡机制和植物特定调节剂的相互作用。生物。2003,25(1):47-57。10.1002 / BIES10175。
- 71.
李家,布拉迪尔G,Palva等:Kunitz胰蛋白酶抑制剂:植物病原体和拟南芥中的Fumonisin B1触发的细胞死亡拮抗剂。莫尔植物。2008,1(3):482-495。10.1093 / MP / SSN013。
- 72.
Xu R, Song F, Zheng Z: OsBISAMT1基因编码s -腺苷- l-蛋氨酸:水杨酸羧甲基转移酶。中华民族大学学报(自然科学版),2006,33(3):223-231。10.1007 / s11033 - 005 - 4823 - x。
- 73.
Kumar D, Klessig DF:高亲和力水杨酸结合蛋白2是植物天然免疫所必需的,具有水杨酸刺激的脂肪酶活性。美国国家科学院学报。[j] .地理科学进展,2019,38(4):457 - 461。10.1073 / pnas.0307162100。
- 74。
可怕的A,Bonshtien A,Balaji V,Debbie P,Martin GB,Sessa G:番茄基因的鉴定和表达分析在阻力响应期间差异调节Xanthomonas Campestris.PV。果酱.植物营养与肥料学报。2004,17(11):1212-1222。10.1094 / MPMI.2004.17.11.1212。
- 75。
Lund St,Stall Re,Klee HJ:乙烯调节番茄病原体感染的敏感性。植物细胞。1998,10(3):371-382。
- 76。
Heller RA, Schena M, Chai A, Shalon D, Bedilion T, Gilmore J, Woolley DE, Davis RW:利用cDNA微阵列技术发现和分析炎症相关基因。美国国家科学院学报。[j] .地球科学进展,2019,32(6):643 - 648。10.1073 / pnas.94.6.2150。
- 77。
Smyth GK, (ed): Limma:微阵列数据的线性模型。纽约:施普林格;2005.
- 78。
杨毅,杜代,路易P,林DM,彭V,Ngai j,速度Tp:cDNA微阵列数据的归一化:解决单一和多个滑动系统变化的鲁棒复合方法。核酸RES。2002,30(4):E15-10.1093 / NAR / 30.4.E15。
- 79。
Conesa A, Nueda MJ, Ferrer A, Talon M: maSigPro:一种在时间过程微阵列实验中识别显著差异表达谱的方法。生物信息学。2006,22(9):1096-1102。10.1093 /生物信息学/ btl056。
- 80.
Nueda MJ, Sebastian P, Tarazona S, Garcia-Garcia F, Dopazo J, Ferrer A, Conesa A:时间过程微阵列数据的功能评估。BMC生物信息学。2009,10(增刊6):S9-10.1186/1471-2105-10-S6-S9。
确认和资金
本研究部分由柑橘研究和教育中心(CREC)是支持的,弗雷德里克Gmitter博士,佛罗里达柑橘生产研究咨询委员会,佛罗里达州柑橘(FDACS合同号67),“彼得McClure,董事长“。
我们非常感谢来自佛罗里达柑橘种植者Hariot女士和barnette先生的慷慨资金和智力支持。帮助完成这项工作的小巴尼·格林。
我们还要感谢Henry Baker教授和临时主席,Hassan Badrane博士(医学:佛罗里达大学分子遗传学和微生物学系)在微阵列设备方面提供的帮助。我们还要感谢Jeffrey Jones博士和Vicente Febres博士对手稿的客观评论。
作者信息
从属关系
相应的作者
附加信息
作者的贡献
AK进行了分子遗传学研究,参与了数据分析,并起草了手稿。AC在JD监督下进行B2GO统计分析。FG参与了该研究的设计,此外,作者之间的协调和手稿的审查。GM参与了实验设计并审阅了手稿。所有作者阅读并批准了最终的手稿。
电子补充材料
图S1
附加文件1:。年代查询集与NCBI数据库的相似性。(PDF 3 KB)
12870_2011_947_moesm4_esm.xlsx.
附加文件4:表S1。Kumquat与每个基因本体类别的序列ID,说明和注释进行分发分析。(XLSX 103 KB)
12870 _2011_947_moesm5_esm.tiff
附加文件5:图S4。一个Masigpro富集的多级饼图,说明在统计学上显着的分子功能的分布(在单个t检验中的P <0.025)Kumquat在芯片上表达基因。(TIFF 950 KB)
12870_2011_947_moesm6_esm.tiff.
附加文件6:图S5。芯片中金桔表达基因的细胞成分在maSigPro中的分布具有统计学意义(单t检验P < 0.025)。(TIFF 638 KB)
12870 _2011_947_moesm7_esm.xlsx
附加文件7:表S2。asca选择的差异表达基因,在统计学显著水平,包括p值,M值。(XLSX 29 KB)
12870_2011_947_moesm8_esm.xlsx.
附加文件8:表S3。差异表达的masigpro选择的基因列表,包括p值,M值。(XLSX 28 KB)
12870_2011_947_moesm9_esm.xlsx.
附加文件9:表S4。统计上显着的Masigpro + ASCA所选基因的组合分析(P值≤0.05)。(XLSX 35 KB)
图S6
附加文件10:。定量实时PCR(QRT-PCR)分析六种选定的金橘EST(AAM60932 ABM67698,AA089566,AAK81874,AAC35981,AAV91900)在KUMQUAT接种Xanthomonas Axonopodis.PV。citri菌株采用(5 × 108cfu/ml)。分别在0、6、24、48、72和120 hpi下对接种和模拟接种植株的叶片组织进行取样。(平均三次独立的生物复制)。(TIFF 126 KB)
12870 _2011_947_moesm11_esm.xlsx
附加文件11:表S5。本研究的序列数据已存入NCBI Genbank数据库[Genbank: gw687757 ~ GW690680]。(XLSX 94 KB)
作者为图像提交的原始文件
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署名许可协议(http://creativeCommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
卡拉夫,a.a., Gmitter, f.g., Conesa, A。et al。Fortunella玛格丽塔转录重编程由黄citri无性系种群。citri.BMC植物BIOL.11,159(2011)。https://doi.org/10.1186/1471-2229-11-159
收到了:
接受:
发表:
关键字
- 基因本体论
- 过敏的反应
- 抑制消减杂交
- 甜橙
- 柑橘橘树根枯病病毒