摘要
背景
重离子诱变是公认的强大的技术来产生新的突变体,尤其是在高等植物。重离子束显示出高线性能量转移(LET),从而更有效地诱导比其它诱变技术DNA双链断裂。以前,我们确定最有效的重离子LET(LET最大:30.0 kevμm-1)拟南芥通过分析让突变诱导的效果诱变。但是,用vet的重离子诱导的突变DNA的分子结构最大仍不清楚。对突变DNA结构的了解将有助于重离子束诱变技术的有效开发。
结果
干拟南芥用LET对碳(C)离子辐照种子最大剂量400戈瑞的和为22.5千电子伏左右LET-1剂量为250戈瑞或450戈瑞比较了对突变频率和DNA结构变化的影响。为了描述突变DNA的结构,我们筛选了特征明确的突变体细长的下胚轴(HY.),无毛(GL.),并通过高分辨率熔解曲线、PCR和测序分析确定突变体中的突变DNA。C离子与LET诱导的突变频率最大比22.5 kevμm高2倍-1和类似于突变频率先前由甲磺酸乙酯诱导的。我们确定了22点突变的DNA结构。超过80%引起C离子与两个让突变为碱基取代或小于100bp的缺失/插入。其他突变参与大型重排。
结论
带LET的C离子最大表现出高的突变效率,主要诱导碱基替换或小的缺失/插入,其中大多数为无效突变。这些微小的改变可以通过单核苷酸多态性(SNP)检测系统确定。因此,C离子带有LET最大可以与SNP检测系统一起作为高效的逆向遗传系统有用,并且对前向遗传和植物育种有益。
背景
突变诱导是用于分析基因功能和育种的强大工具。在用于诱导突变的诱变中,化学诱变剂如乙基甲磺酸酯(EMS),或电离辐射如X射线或γ射线,在植物科学中特别受欢迎。EMS可以产生点突变,主要是G / C-TO-A / T过渡,高频[1那2].这种点突变很容易被突变检测系统检测到,如CEL1核酸酶分析或高分辨率熔化曲线(HRM)分析[3.那4.].与单核苷酸多态性(SNP)检测系统相结合,ems介导的突变是一种强大的反向遗传学方法,称为基因组中的靶向诱导局部病变(TILLING) [5.-9.].由于EMS具有诱导突变的特性,因此在正向遗传中产生漏泄等位基因方面也非常有用。相比之下,x射线和γ射线相对随机地诱发DNA损伤,并引起多种类型的突变,包括碱基替换、缺失和染色体改变[10那11].尽管X射线和γ射线适合于产生零突变,但是由X射线和γ射线引起的突变频率低于由EMS获得的突变频率。
重离子束被认为是一种新的强大的诱变剂,因为它们能够以相对较低的剂量诱导高频率的突变,几乎所有植物都能存活,而且它们诱导广泛的表型,而不影响其他植物特征[12那13].重离子束的这些特性有利于诱变育种。在日本,用重离子束培育了30多个植物品种[14那15].重离子束包括由离子促进剂(例如回旋加速器或同步rotron)产生的加速离子。重粒子束的注鉴定的物理特性是加速颗粒在沿粒径沿局部区域密集密集地沉积它们的能量。这与γ射线和X射线突出不同,X射线稀疏地将其能量稀疏地沉积在大型靶向体积中。局部沉积能量的程度由线性能量转移表示(让;每单位长度传递的能量,Kevμm-1).而让γ射线和X射线是在0.2和2.0千电子伏左右-1分别为在生物学研究范围中使用的重离子束的从22.5千电子伏LET微米-1至4000千电子伏左右-1在RIKEN RI-光束工厂(RIBF)16].众所周知,高let辐射比低let辐射具有更强的生物效应。重离子束的LET可由离子种类选择,并取决于离子对电荷和速度的特性。当需要高LET时,选择较重的、高荷电的低速离子。
基于放射生物学的考虑,有人认为重离子束主要诱导双链断裂[17那18].重离子束照射后的DNA双链断裂的高收率揭示通过在动物和植物细胞的实验[19那20.].因此,虽然重离子诱导的DNA改变的测序分析是有限的,但重离子辐照可能会造成重大的DNA损伤。Shikazono等报道,约有一半的突变是由LET为101-124 keV μm的碳(C)离子诱导的-1太小改变,包括碱基置换和相对小的插入/缺失(下100bp的),而另一半则重排如易位,倒位,和比较大的插入/缺失(超过100个碱基)21].这些结果表明,重离子照射诱导广泛的突变。
在先前的研究中,我们发现,LET值影响在M白化突变发生率2生成30 keV μm-1是最有效的LET值拟南芥诱变[22].这种高效率的LET(称为LET最大)不仅有利于正向遗传和育种,也有利于反向遗传[23].然而,有助于让Let的有效诱变的机制最大辐照尚不清楚。因为必须根据实验目的或靶基因适当地选择诸如EMS,γ射线和重离子束的诱变,所以了解由C离子诱导的突变的性质也很重要最大.在本研究中,我们研究了突变诱导与重离子辐照参数(包括辐照离子粒子数和LET)之间的关系。我们还测定了由LET辐照引起的敲除突变体的突变最大in.答:芥作为表征C离子诱导突变性质的第一步。
结果
粒子数和LET对突变频率的影响分析
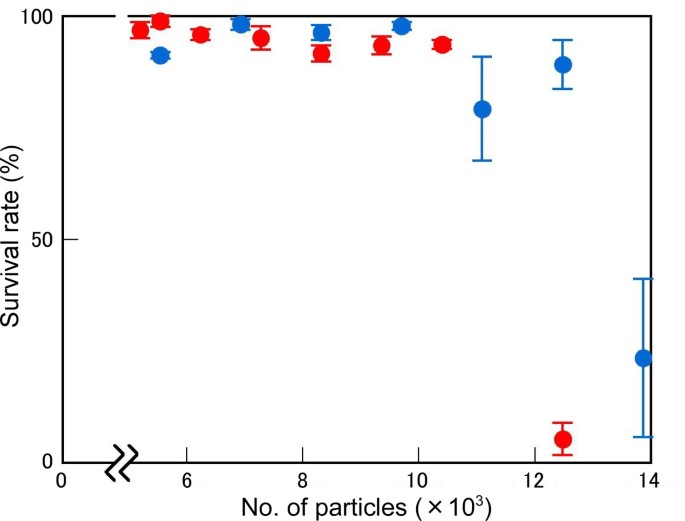
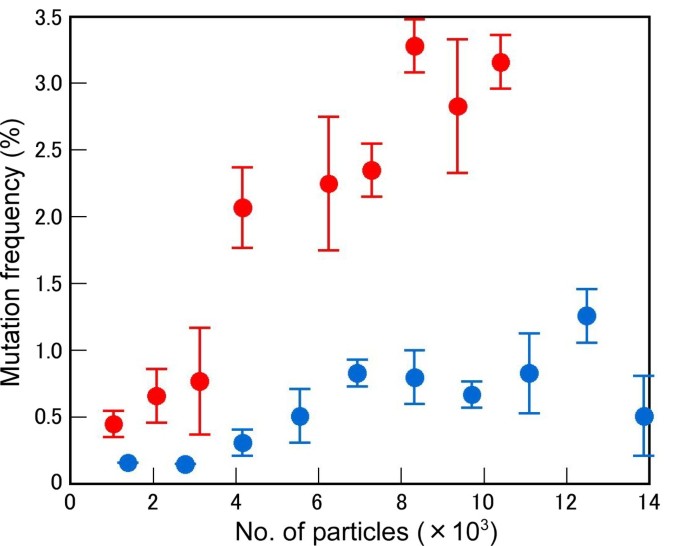
为了提高重离子辐照的突变效率,需要研究辐照离子粒子数和LET值对突变效率的影响。离子粒子的数量可以决定每个细胞核中DSB的数量,而LET值可能会影响DSB诱导的效率(见Discussion)。在之前的研究中,我们发现了碳离子辐照与LET最大突变比22.5kevμm更高的突变频率-1[22].为了更准确地证实LET和粒子数的影响,应用了50 - 600 Gy剂量的c -离子辐照;M1在m中的一代和白化病2衡量了一代。基于种子具有1的特异性的假设和核的尺寸为100μm的假设来计算每种细胞核的离子颗粒数量2(见方法)。剂量(在GY中)与Let(在Kevμm中成比例-1)和被辐射粒子的数量。在LET为30.0 keV μm时,碳离子的影响-1存活率大于22.5 keV μm时的存活率-1(图1).对于LET为30.0 keV μm的C离子-1,每100μm约12,500颗粒2被需要引起致死性,而在22.5千电子伏左右-1超过14,000的粒子每100μm2被要求。该LET值必须在M上的突变频率更惊人的效果2比M一代1一代(图2).碳离子,具有30.0kevμm-1在最有效粒子数(8320 / 100 μm)时,产生了3.28%的白化病发生率2).C离子的LET值为22.5 keV μm-1只生产了1.26%的白化病率,即使在最有效的粒子数(每100μm12,480)2).在22.5 keV μm之间,LET效应对突变频率的影响存在差异-1和30.0 kevμm-1是明显的,特别是在超过4 000个粒子的辐照下,这表明粒子数量对获得高突变频率也很重要。这些结果表明,碳离子的LET值为30.0 keV μm-1与22.5 keV μm有不同的突变效应-1并提出了这样一个问题:这些辐射条件导致了哪些DNA改变?
用LET验证C离子的突变效率最大
当细长的下胚轴(HY.),无毛(GL.)突变体在m中筛选2三种条件下C-离子照射后生成:LET的22.5千电子伏左右-1在250 Gy的剂量(每100μm为6,9332),22.5千电子伏左右-1剂量为450戈瑞(每100 μm 12,480)2)和30.0 keV μm-1剂量为400戈瑞(8,320 / 100 μm)2).比较了这些条件下的突变频率和突变dna的结构。当HY.和GL.突变体表征得很好,并确定了对各种表型的原因进行了确定[24-31].因此,这些突变体以前曾被用于类似的突变DNA分析[21那32那33].筛查29595 M2植物揭示了C离子诱导了23个突变体,使30.0keVμm-1在400 GY的剂量。突变频率具有30.0keVμm-1约为其他照射条件下的两倍(表1).这些结果支持前述数据,其中C离子具有30.0keVμm-1是更有效的突变诱导比那些具有22.5千电子伏左右-1.
c离子辐照引起DNA结构突变的特征
为研究c -离子辐照引起的分离突变体的DNA结构,对分离突变体的DNA进行HRM、PCR和测序分析HY.和GL.表型(见方法)。在33个HY.和GL.分离突变体,鉴定了18个独立突变系。这是因为从同一批次中分离出来的突变体被认为来自于同一个M1植物。以确认划分在相同突变品系的所有突变体具有相同的DNA突变,所有来自同一批次得到的突变体的,通过PCR和测序分析证实。由于鉴定突变体线的数量是有限的,也包括在DNA中的突变的表征如下突变体:分生组织改变计划(amp)1,pinoid(pid)1,黄色杂色(var)2(见方法)(34-36].
鉴定的DNA突变列于表中2.共鉴定出22个突变。18个独立突变中的17个HY.和GL.突变线成功确定。此外,两个突变AMP1基因中有两个突变PID1基因,和一个突变VAR2基因被确定。c离子诱导的突变包括碱基替换、缺失、插入和易位。在22个等位基因中,只有4个出现了重排,包括易位和大规模缺失;这些在高剂量辐照突变体(400 Gy和450 Gy)中检测到。18个突变体的碱基替换或缺失/插入小于100 bp2和3.).在具有基础取代的四个等位基因中,三个是横向,一个是过渡。其中,只有一种等位基因(C-27-GL1)具有畸形突变(D→N),而其他等位基因具有非致盲突变,导致C-末端截短的蛋白质产生。总共21个等位基因是零突变体。不阐明C-27-GL1等位基因是否均未阐明,尽管C-27-GL1突变体的表型类似于含氟突变体的表型GL1.(数据没有显示)。22.5 keV μm诱导突变的大小和类型-1和30.0 kevμm-1LET并没有不同。结果表明,碳离子的let值分别为22.5和30.0 keV μm-1主要是由于小的改变,而大多数的诱导突变是无效突变体。
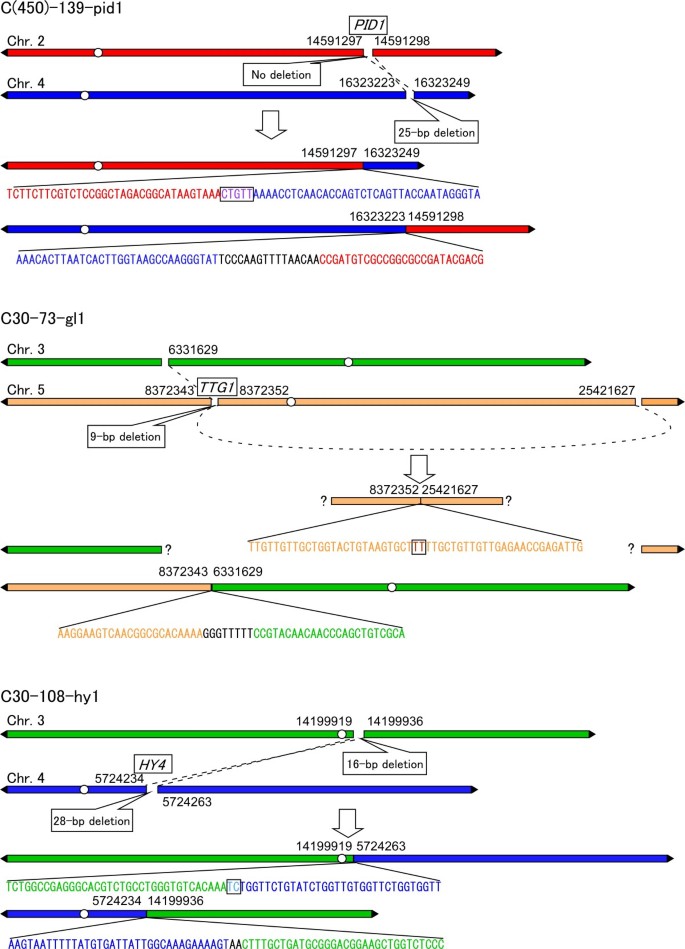
检测到两个相互易位和一个复杂的重排(图3.).对于复杂的重排(C30-73-GL1),只有一个断点处TTG1通过尾PCR检测基因。突变体中的其他可能的辐射诱导的断点不能通过任何PCR分析确定。然而,在具有重排的突变体中成功地鉴定了五点断裂点。在五个断点中,四个含有的删除(范围从9到28 bp),一个没有删除,没有任何重复(图3.).这五个断点被修复,导致六个重新连接的地点。其中半数位点具有短序列同源性(微同源性;而另一半则插入DNA片段(3-16 bp),称为填充DNA [37].表格中列出了十四个简单删除的网站3..这些重新加入的八个位点中的八个均显示1-3个BP微型学。
讨论
在这项研究中,我们在通过允许的22.5kevμm诱导C离子照射引起的敲除突变体中的突变频率和结构的突变频率和结构-1或30.0 keV μm-1(LET最大).突变频率为C-离子与30.0千电子伏左右LET-1高于22.5kevμm的C离子-1,如白化突变的频率所示(图2),HY.和GL.突变体(表1).虽然确定的突变体数量太小,但对于准确的统计分析,HY.和GL.与LET诱导C离子的30千电子伏左右的突变频率-1与EMS(0.87‰)诱导的相似,比X射线引起的2.5倍(0.32‰)[38].相比之下,C离子诱导的突变DNA的结构具有22.5keVμm-1或30.0 keV μm-1几乎是相同的。在这两种情况下,所确定的突变的超过80%太小改变和其余的是重排(表2).由于影响某一关键基因的大改变可能不会传递给M,因此在修复辐射诱导的损伤后出现的大基因改变的比例可能高于本研究中观察到的比例2一代(39].22个突变的dna中有21个为空突变,因为这些突变导致帧移位或无义突变。辐射诱发的碱基取代的实际比例可能高于本研究中检测到的,因为有些可能代表了目前筛查中无法识别的沉默突变。通过CEL1核酸酶分析或HRM分析可以检测到碱基替换和小的缺失/插入。事实上,在这项研究中发现的大多数突变都是由人力资源管理确定的(见方法)。根据我们的结果,我们建议在LET下的c -离子辐照最大可用于有效TILLING获得无效突变体。
诱变剂必须根据实验目的或靶基因选择。碳离子辐照在诱变的几个方面具有潜在的优势。首先,c离子辐照比EMS更实用。EMS处理组织或植株有时是费时的,因为它的渗透能力。另一方面,c离子的辐照时间短;对被吸收的种子、组织和幼苗只需要几秒钟的辐照,而对干燥的种子则需要几分钟的辐照。事实上,通过c离子束辐照组织培养或植株,已经培育出20多个不同植物品种的新品种。其次,c离子辐照可能有利于诱导截断突变而不是产生等位序列,因为我们的数据表明小indel突变比碱基突变发生得更频繁。为了产生等位基因序列,EMS诱导碱基替换是有用的。最后,通过选择合适的LET值(见下文),c -离子辐照可能具有诱导所需大小的缺失的潜力。 To clarify the beneficial characteristics of mutation induction by C-ion irradiation, whole-genome investigation of mutations such as missense and silent mutations is needed.
LET为30.0 keV μm的C离子诱导的碱基替换或小的缺失/插入和重排等微小变化的比例-1或22.5 keV μm-1更类似于由低辐射(电子)引起的,而不是在101-124kevμm诱导的辐射(电子)诱导-1让(表4.).在转基因小鼠的辐照实验中,LET值为21.3 keV μm的C离子的辐照比例与此相似-1优先诱导小的改变(68%),γ射线(71%)[40].Suzuki等。报告说,大,小的缺失比例C离子之间差异为39千电子伏左右让-1和124千电子伏左右-1在人体细胞辐照实验中[41].这些数据表明,C离子的中度LET(约30千电子伏左右-1)可能对来自C离子的DNA改变具有不同的影响,具有101-124kevμm-1.然而,在22.5 keV μm之间,断点的结构相似-1或30.0 keV μm-1)和以前的研究(101-124 kevμm-1) [21].在本研究中,重排的六个断点中的五个具有缺失,而没有断点包含复制(图3.).先前的研究表明,在LET为101-124 keV μm的条件下,C离子诱导的断点-1优选具有缺失(11的17),而通过电子引起的断点倾向于具有重复(6出来的8)21].这些结果意味着,DSB生产和修理的C离子照射后的处理为22.5千电子伏左右让-1或30.0 keV μm-1可能与101-124 keV μm相似-1.因此,30.0千电子伏左右-1表现为低LET辐射和101-124 keV μm之间的中等LET-1.
以前,我们没有明确的答案对20kevμm的C离子的问题-1与其他LET值相比,LET可以诱导更高的突变频率。目前的研究表明,在22.5 keV μm的c -离子辐照下,突变dna的结构没有差异-130kev μm-1.因此,在这两种条件下,DSB修复过程可能是相同的,虽然一个LET依赖性DNA修复途径存在的可能性不能排除。在这些照射条件之间的突变频率的差异的一个可能的解释是在DSB生产效率差。虽然为22.5 LET辐射的颗粒数千电子伏左右-1大于30.0 keV μm-1, 22.5 keV μm-1没有诱导高于30.0kevμm的突变频率-1(图2).因此,很可能为30.0 keV μm-1与22.5 keV μm相比,C离子诱导dsb的效率更高-1C离子。对于LET值超过30.0 keV μm的C离子-1,突变频率不高于LET最大(30 kevμm-1) [22].在这些辐照条件下,粒子数不足以产生与LET值为30 keV μm相同的突变效应-1.例如,每100μm辐射为4,000颗粒2在61.5kevμm-1,吸收剂量达到约400倍,此时1植物无法存活[22].综上所述,我们的结果表明,在重离子束辐照下,要获得最高的突变效率,需要适当的LET值和适当的粒子数。
另外,DSB质量的差异可能是22.5 keV μm突变诱导效率差异的一个可能的解释-1和30.0 kevμm-1.蒙特卡罗计算表明,高let辐射比低let辐射诱导出更高比例的复杂dsb [42那43复杂的dsb很难修复[44那45].来自蒙特卡罗计算的数据均良好的实验测量在动物和植物中高温辐射后的短DNA片段的更高产量的实验测量[20.那46].因此,很可能被C诱导DNA双链断裂的质量与30.0千电子伏左右LET离子-1可能比C离子诱导的稍微复杂稍微复杂22.5kevμm-1,并且复杂的DSB可能难以修复,尽管具有约30.0kevμm的更详细的理论和实验数据-1需要澄清这一假说。
目前的数据表明,突变的DNA的结构所造成的C-离子照射22.5千电子伏左右让-1或30.0 keV μm-1与LET值为101 ~ 124 keV μm的c离子辐照诱导的结果不同-1.in.慢生根瘤菌百脉,铁离子辐照(LET 640 keV μm)-1)与C离子诱导的缺失相比,诱导较大的缺失(让23kevμm-1) [47].这些结果增加了突变DNA的结构可能是通过选择一个合适的LET值来控制的可能性。为了实现这一目标,需要进一步的不同let辐照条件下的实验数据,以及对dsb质量的理论分析。
结论
C离子在让最大结果表明,突变效率高于LET为22.5 keV μm的突变效率-1,具有与EMS类似的效率。为了实现具有重离子束照射的这种效率,必须优化允许和粒子数。in.拟南芥,30.0 kevμm-1400 GY(每100μm8,3202)为最有效剂量。C离子在让最大和22.5 kevμm-1主要诱导均匀突变。超过80%的零突变是基础取代或小缺失/插入,其可以通过SNP检测系统(例如Cel1核酸酶测定或HRM分析)来检测。结论是C离子,具有30.0keVμm-1可能适合作为强大的耕作技术与SNP检测系统一起产生零突变体。
方法
辐照处理
干燥的种子答:芥哥伦比亚生态型(Col-0中)包装在一塑料袋中,以获得种子的单层。所述种子用照射12C.6+离子(22.5kevμm-1或30.0 keV μm-1在Riken Ri-Beam厂中使用E5梁线,50 GY至500 GY的剂量范围。离子加速高达1.62 GEV,在此时让令人价值12C.6+离子为22.5 keV μm-1.的LET值12C.6+调节至30.0 keV μm-1通过降低离子的速度。为了降低离子速度,离子要通过一组吸收剂[48].所有LET值都是在种子后面计算的。辐照米1种子被浸在1%次氯酸钠surface-sterilised 10分钟,用无菌水清洗5次,孵化0.7% agar-containing Murashige和斯女士(MS)中补充了维生素和3%蔗糖在黑暗中在4°C诱导vernalisation 4 d。随后,种子在22℃长日照条件下(16 h光照,8 h黑暗)培养。长出真叶的幼苗被移植到13 × 9厘米的塑料托盘中2)包含的土壤。十一秧苗在温室中长日照条件下种植在各托盘并生长在22℃。米2在每个托盘中收集所有植物的种子,并作为一批处理。
植物存活和DNA突变粒子效应分析
辐照M的百分比存活的测量1种子和在M白化发生率2如先前所述进行生成[22].对每个令的价值进行至少三个以不同剂量照射的独立实验。为了估计每个细胞核的颗粒数,计算每种剂量的颗粒的数量,用于100μm的水面积2如前所述,具有1的比重[49].
突变筛选和突变基因的鉴定
从M.2一代,细长的下胚轴(HY.),无毛(GL.)通过萌发筛选突变体2种子在MS琼脂培养基上。米2展示的植物HY.和GL.分离成表型。使用DNEasy植物迷你试剂盒(Qiagen,Hilden,德国)在萌发后四周从分离的突变体和野生型植物中纯化基因组DNA。使用针对推定的突变基因的引物进行纯化的DNA进行HRM分析(hy1,hy2,hy3,HY4.对于HY.突变体;GL1,GL2,TTG1对于GL.突变体;见附加文件1).人力资源管理分析在LightCycler 480 (Roche Diagnostics, Penzberg, Germany)上进行,反应混合物中包含10 ng野生型DNA、10 ng突变型DNA、0.5 mM引物和3 mM MgCl2在的LightCycler 480高分辨率熔解万事达含有ResoLight染料(Roche Diagnostics)上调节至10微升用PCR级水的总体积。反应条件在95℃下由活化步骤为10分钟,随后为95℃50个循环保持10秒,65℃达阵至55℃下进行10秒(0.5℃循环-1)和72°C 10 s。在HRM步骤之前,将产物加热至95℃,使1分钟冷冻至40℃,1分钟。HRM分析在65°C至95°C的范围内进行,在4.4°C的范围内-1以每度25个收购。所有反应均在复制(重复或一式三份)在96孔板中进行。当正信号被认定时,扩增的片段使用Big Dye终止v测序。3.1循环测序试剂盒(Applied Biosystems公司),并用相同的引物与用于HRM分析3730XL DNA分析仪(Applied Biosystems)上。当编码区的全部或部分不能被扩增,使用侧翼TAIL-PCR序列分析进行[50].用于侧翼序列分析的引物在附加文件中列出2.因为数量有限HY.和GL.突变系鉴定,突变诱导另外三个特征良好的形态突变,即分生组织改变计划(amp)1[34],松开(pid)1[35],和黄色杂色(var)2[36],被分离,通过PCR或HRM分析测定它们的突变基因并使用特异性引物测序(参见额外的文件1和2).米3.获得突变体的种子,并对突变体的表型进行分析3.对植物进行分析,以确定突变体的表型是否遗传。
参考资料
- 1.
序列依赖的烷基DNA加合物的形成:方法、结果和生物学相关的综述。中国科学(d辑:地球科学)10.1016 / 0027 - 5107 (90) 90157 - y。
- 2.
Greene EA,Codomo Ca,Taylor Ne,Henikoff JG,Till Bj,Reynolds Sh,Enns LC,Burtner C,Johnson Je,Odden Ar,Comai L,Henikoff S:来自大规模反向遗传筛选的化学诱导突变的谱in.拟南芥.遗传学。2003,164:731-740。
- 3.
陈志强,陈志强,陈志强:诱导突变的靶向筛选。生物技术学报。2000,18:455-457。10.1038/74542。
- 4.
WITTWER CT,REED GH,GUNDRY CN,Vandersteen JG,PRYOR RJ:通过使用LCGREEN的扩增子熔化分析的高分辨率基因分型。Clin Chem。2003,49:853-860。10.1373 / 49.6.853。
- 5.
Till BJ, Reynolds SH, Weil C,施普林格N, Burtner C, Young K, Bowers E, Codomo CA, Enns LC, Odden AR, Greene EA, Comai L, Henikoff S: TILLING诱导玉米基因点突变的发现。植物学报。2004,4:12-10.1186/1471-2229-4-12。
- 6。
Till BJ, Cooper J, Tai TH, Colowit P, Greene EA, Henikoff S, Comai L:水稻耕作化学诱导突变的发现。植物学报。2007,27:19-10.1186/1471-2229-7-19。
- 7。
Cooper JL, Till BJ, Laport RG, Darlow MC, Kleffner JM, Jamai A, El-Mellouki T, Liu S, Ritchie R, Nielsen N, Bilyeu KD, Meksem K, Comai L, Henikoff S: TILLING技术在大豆诱导突变检测中的应用。植物生态学报。2008,8:9-10.1186/1471-2229-8-9。
- 8.
Cooper JL,Till Bj,Laport RG,Darlow Mc,Kleffner Jm,Jamai A,El-Mellouki T,Liu S,Ritchie R,Nielsen N,B内卢卡,Meksem K,Comai L,Henikoff S:一种改进的耕作方法来检测四倍体和六倍体小麦的诱导突变。BMC植物BIOL。2009,9:115-10.1186 / 1471-2229-9-115。
- 9.
雪莉BW, Hanley S, Goodman HM:电离辐射对植物基因组的影响:两个分析拟南芥透明测试突变。植物学报。1992,4:333-347。
- 10.
Cecchini E, Mulligan BJ, Covey SN, Miner JJ: γ辐照诱导的缺失突变的特征拟南芥.突变res。1998年,401:199-206。10.1016 / S0027-5107(98)00009-8。
- 11.
Morita R, Kusaba M, Iida S, Yamaguchi H, Nishio T, Nishimura M: γ辐射诱导水稻突变的分子特征。中国生物医学工程学报。2009,31(4):591 - 598。10.1266 / ggs.84.361。
- 12.
王凯,裴春华,王凯,吉田:重离子束诱导的抗逆性突变体。光子学报,2000,39(4):454 - 454。
- 13.
塔卡卡A,Shikazono N,Hase Y:离子束对致死性,突变率和突变表型的突变表型的突变表型的生物学作用研究。j radiat res。2010,51:223-233。10.1269 / JRR.09143。
- 14.
宫崎K,铃木K,磐K,久住T,阿部T,吉田S,福井H:在蓝猪耳的帧间特异性杂交引起的重离子束照射花色素突变。种植转基因。2008年,23:163-167。
- 15.
Kanaya T,Saito H,Hayashi Y,Fukunishi N,Ryuto H,Miyazaki K,Kusumi T,Abe T,Suzuki K:重离子束诱导的马鞭草的无菌突变体(马鞭草×矮牵牛),并改善开花习性。植物科学学报。2008,25(4):491 - 497。10.5511 / plantbiotechnology.25.91。
- 16。
Ryuto H,Fukunishi N,林Y,市田H,阿部T,加濑男,矢野Y:用于RIKEN生物样品重离子束照射设施。种植转基因。2008年,25:119-122。10.5511 / plantbiotechnology.25.119。
- 17。
沃德·约翰:DNA损伤的复杂性:与生物学后果的相关性。国际放射学杂志。1994,6:427-432。10.1080 / 09553009414551401。
- 18.
Goodhead DT:重离子辐射生物效应的分子和细胞模型。环境科学与技术。1995,34:67-72。10.1007 / BF01275208。
- 19.
Hoglund E, Blomquist E, Carlsson J, Stenerlow B:不同线性能量转移辐射诱导的DNA损伤:初始破碎。中华放射学杂志。2000,32(6):539-547。10.1080 / 095530000138556。
- 20.
横田Y,山田S,Hase的Y,Shikazono N,鸣海I,田中A,井上L:在烟草线性能量转移BY-2原生质体中的DNA双链断裂和DNA片段化模式的初始产率取决于照射氦,碳和氖离子。Radiat水库。2007年,167:94-101。10.1667 / RR0701.1。
- 21.
Shikazono N, Suzuki C, Kitamura S, Watanabe H, Tano S, Tanaka A:碳离子诱导的突变分析拟南芥.J Exp Bot。2005,56:587-596。10.1093 / JXB / ERI047。
- 22.
Kazama Y, Saito H, Yamamoto YY, Hayashi Y, Ichida H, Ryuto H, Fukunishi N, Abe T:重离子束辐照的let依赖效应拟南芥.种植转基因。2008年,25:113-117。10.5511 / plantbiotechnology.25.113。
- 23.
Shitsukawa N,Ikari C,Shimada S,Kitagawa S,Sakamoto K,Saito H,Ryuto H,Fukunishi N,Abe T,Takumi S,Nasuda S,Murai K:Einkorn小麦(小麦属植物monococcum)突变体保持营养阶段,是由缺失引起的VRN1基因。基因工程学报。2007,32(1):1 - 7。10.1266 / ggs.82.167。
- 24.
Koornneef M,Rolff E,Spruit CJP:光抑制缺口伸长的遗传控制拟南芥(l)heynh。z pflanzenphysiol。1980,100:147-160。
- 25.
reidjw, Nagpal P, Poole DS, Furuya M, Chory J:红色远红光受体光敏色素b基因突变改变细胞伸长和整个生理反应拟南芥发展。植物学报。1993,5:147-157。
- 26.
Ahmad M,Cashmore AR:HY4.基因的答:芥编码一种具有蓝光感受器特性的蛋白质。《自然》1994,366:162-166。
- 27.
Muramoto T,Kohchi T,Yokota A,Hwang Ih,Goodman HM:the拟南芥光致突变体HY1.由于质体血红素加氧酶突变而导致光敏色素生物合成不足。acta botanica sinica(云南植物学报),1999,11(4):457 - 461。
- 28。
Kohchi T,Mukougawa K,Frankenberg N,Masuda M,Yokota A,Lagarias JC:rapidopsisHY2.基因编码光敏色素合成酶,铁氧还原蛋白依赖的胆绿素还原酶。植物学报。2001,13:425-436。
- 29。
沃克AR,戴维森PA,博洛涅西 - 温菲尔德交流,詹姆斯CM,斯里尼瓦桑N,布伦德尔TL,阿尔泽特JJ,标记MD,灰色JC:在透明的外种皮GLABRA1调节拟南芥中毛细血管分化和花青素生物合成的基因座编码WD40重复蛋白。植物细胞。1999,11:1337-1350。
- 30.
Oppenheimer DG,Herman Pl,Sivakumaran S,ESCH J,Marks MD:aMYB拟南芥叶毛状体分化所需的基因在托叶中表达。细胞。1991,67:483-493。10.1016 / 0092 - 8674(91) 90523 - 2。
- 31.
Rerie WG,费德曼KA,商标MD:本GLABRA2基因编码在正常毛状体发育所需的homeo域蛋白拟南芥.基因开发。1994年,8:1388-1399。10.1101 / gad.8.12.1388。
- 32.
Bruggemann E, Handwerger K, Essex C, Storz G:快速中子产生突变体的分析拟南芥HY4轨迹。植物学报,1996,10:755-760。10.1046 / j.1365 - 313 x.1996.10040755.x。
- 33.
碳离子诱导突变体的DNA重排拟南芥.遗传学报。2001,27(4):489 - 498。
- 34.
Helliwell CA, Chin-Atkins AN, Wilson IW, Chapple R, Dennis ES, Chaudhury A:拟南芥AMP1基因编码一个假定的谷氨酸羧肽酶。acta botanica sinica(云南植物学报). 2001,13(4):457 - 461。
- 35.
王志刚,王志刚,王志刚:蛋白激酶对生长素反应的调控作用PINOID.细胞。2000,100:469-478。10.1016 / s0092-8674(00)80682-0。
- 36.
武市K,Sodmergen村田男,本吉男,坂本王:黄色的斑叶(VAR2)基因座编码FtsH同源物,FtsH是一种atp依赖的蛋白酶拟南芥.植物细胞生理。2000,41:1334-1346。10.1093 / PCP / PCD067。
- 37.
Gorbunova V, Levy AA:植物如何维持生计:DNA双链断裂修复。植物科学进展。1999,4:263-269。10.1016 / s1360 - 1385(99) 01430 - 2。
- 38.
Koornneef男,Dellaert LW,范德华维恩JH:EMS-并在拟南芥(L.)Heynh各个基因座辐射诱导的突变频率。mutatres。1982年,93:109-123。10.1016 / 0027-5107(82)90129-4。
- 39.
内藤K,草场男,Shikazono N,高野T,田中A,Tanisaka T,西村L:传染性和非传播突变诱导的通过照射拟南芥花粉含有伽马射线和碳离子。中国生物医学工程学报。10.1534 / genetics.104.033654。
- 40。
增村K,国也K,黑部T,福冈男,Yatagai楼Nohmi T:在GPT增量转基因小鼠重离子诱导的突变:通过重离子,X射线和γ射线辐射诱发突变谱的比较.环境mol umagen。2002年,40:207-215。10.1002 / em.10108。
- 41。
铃木男,渡边男,金井T,加濑Y,Yatagai女,加藤T,松原S:细胞死亡,突变诱导和在人类细胞中染色质的损害LET依赖性照射加速碳离子。进阶空间研究。1996年,18:127-136。
- 42.
Ottolenghi A,Merzagora男,Tallone L,杜兰特男,Paretzke HG,威尔逊WE:由质子和α粒子产生链断裂的端结构的蒙特卡罗模拟:DNA双链断裂的质量。Radiat ENVIRON生物物理学。1995年,34:239-244。10.1007 / BF01209749。
- 43.
Alloni D,Campa A,Belli M,Esposito G,Facoetti A,Friedland W,Liotta M,Mariotti L,Paretzke Hg,Ottolenghi A:DNA碎片光谱的辐射质量依赖性的蒙特卡罗研究。Radiat水库。2010,173:263-271。10.1667 / RR1957.1。
- 44.
Blocher D: DNA双链断裂修复决定了α粒子的RBE。中华放射学杂志。1998,16(4):457 - 461。10.1080 / 09553008814552201。
- 45.
Pastwa E,Neumann Rd,Mezhevaya K,Winters Ta:辐射诱导的DNA双链断裂的修复取决于辐射质量和双链断裂的结构复杂性。Radiat水库。2003,159:251-261。10.1667 / 0033-7587(2003)159 [0251:Roridd] 2.0.co; 2。
- 46.
粒子辐照诱导的DNA双链断裂的非随机分布。中华放射学杂志。1996,17:493-503。10.1080 / 095530096144680。
- 47.
市田H,松山T,Ryuto H,林Y,Fukunishi N,阿部T,科巴T:由离子束照射引起的微生物的突变的分子表征。mutatres。2008年,639:101-107。10.1016 / j.mrfmmm.2007.10.009。
- 48.
Ryuto H, Abe T, Fukunishi N, Kase M, Yano Y:日本理化研究所生物样品的重离子束辐照系统。生物工程学报。2006,2:88-93。10.1166 / jbn.2006.014。
- 49.
生物系统对低let和高let辐射的剂量反应。物理和生物系统对低let和高let辐射的微剂量响应2006。编者按:Horowitz Y. 2006,英国牛津:Elsevier, 1-73。
- 50。
柳YG,光川N,Oosumi T,Whittier的RF:拟南芥T-DNA通过热不对称拟南芥的有效分离和映射插入结交错PCR。植物杂志1995年,8:457-463。10.1046 / j.1365-313X.1995.08030457.x。
确认
我们感谢riken研究资源中心的大脑科学研究所进行DNA测序。该实验在Ribf由Riken Nishina Center和东京CNS运营的Ribf进行。我们还承认,中国研究生的实习计划,受到riken的Sichun地震的影响。该工作得到了利用农业,日本农业,林业和渔业部的农业,林业和渔业的先进技术,社会基础设施技术发展计划从riken和下一代世界领先的研究人员提供资金计划的研究项目的补助金,由日本科技政策委员会发起,从日本社会促进TA促进科学。来自教育,文化,体育,科学技术部的科学研究(NO.20780009和第2370070至Yk),还支持这项工作。来自日本的教育,文化,体育,科学技术部以及RIKEN的特别博士后研究计划(到yk)。
作者信息
从属关系
相应的作者
附加信息
作者的贡献
TA构思了该研究,设计了研究,协调项目并获得了光束时间。YK和TA参与了分子遗传分析的设计。YK,Th,HS,SO,YH和TA进行C离子照射。YK,Th,HS,YL,以及进行突变体筛选。YL和所以参加了种植植物。YK,TH和YL进行了分子遗传分析。YK和TA主要负责起草和修订与共同作者的贡献的稿件。所有作者均阅读并批准最终手稿。
作者的原始提交的图像文件
权利和权限
开放获取本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
Kazama,Y.,Hirano,T.,Saito,H.等等。高效重离子诱变的特征拟南芥.BMC植物杂志11,161(2011)。https://doi.org/10.1186/1471-2229-11-161
收到了:
接受:
发表:
关键词
- 突变频率
- 线性能量转移
- 乙甲烷磺酸盐
- 乙甲烷磺酸盐
- 高突变频率