摘要
背景
我们之前已经证明了拟南芥AtmyB60蛋白质是气孔开口所需的R2R3MYB转录因子。AtMYB60在保卫细胞中特异表达,并被植物激素ABA在转录水平下调。
结果
研究其分子机制AtMYB60表达,通过缺失和突变分析分析其启动子。通过研究不同版本的AtMYB60推动者:: GUS记者在转基因植物中的融合我们能够展示一个模块化的组织AtMYB60启动子。特别是我们定义了:足以赋予报告基因的促进细胞特异性活动的最小启动子;在最小启动子中组合于确定保护细胞特异性表达中的簇中不同DOF结合位点的不同作用;负责促进保护细胞活性的启动子区域;一种促进区域,其负责ABA的阴性转录调节。此外,从单一和多个突变体的分析,我们可以排除一组DOF蛋白的参与,称为CDF,已经表现为它们的开花时间,在调节中AtMYB60表达。
结论
这些发现揭示了基因在保卫细胞中的表达调控,并为调控基因在保卫细胞中的表达提供了新的启动子模块,为生理学研究和未来的生物技术应用提供了有用的工具。
背景
陆地植物吸收二氧化碳进行光合作用,通过气孔蒸腾失去水蒸气,气孔存在于叶和茎的表面。毛孔的打开和关闭是由周围两个保卫细胞的膨胀驱动的体积变化介导的,它们的压力是根据环境和激素提示动态调整的。在响应非生物胁迫,如干旱或高盐,植物最快速的反应之一是关闭气孔,由激素脱落酸(ABA)介导,以防止蒸腾过度水分流失(综述在[1])。
气孔活性的遗传操纵是一种有望的方法,以降低作物的水需求,并提高压力条件下的生产力[2].正确的气孔响应工程需要使用保卫细胞特异性启动子或鉴定保卫细胞特异性突变体,以避免对植物生长和产量的不良副作用。
通过不同的方法,已分离出几种具有保卫细胞特异性基因表达或增强保卫细胞基因表达的启动子:3.- - - - - -9];大规模基因或增强剂 - 陷阱屏幕[10.- - - - - -12.].此外,转录组学和蛋白质组学研究还确定了其他候选者[13.- - - - - -16.].尽管如此,这些启动子的大多数都不是保护细胞特异性,因为它们在其他细胞类型中推动了报告基因的表达,包括血管组织[6,10.,17.,18.],花器官[8,9或含淀粉的细胞[5],大大减少真正的防护细胞特异性全尺寸启动子的数量[3.,10.,14.,19.,20.].最重要的是,对保护细胞特异性启动子的详细实验分析仅在很少的情况下进行了[11.,12.,14.].
一个真正的保卫细胞特异性启动子驱动拟南芥的表达AtMYB60(At1g08810)基因10.,19.,21.,22.].我们之前有过AtMYB60在保护细胞中表达[10.],该基因完整的5'和3'基因间基因组区分别克隆到报告基因的上游和下游,能够驱动保卫细胞的特异性表达[10.,19.].保护细胞特异性AtMYB60促销员也被纳迦展示等.(2009)和Meyer等人(2010),他们使用这个启动子来补充mrp5-1在保卫细胞中特异性表达atmt12蛋白,在保卫细胞中特异性表达atmt12蛋白。
关于启动子的信息很少独联体-调控保卫细胞特异性表达的元素[8,10.- - - - - -12.,14.,16.].dof结合位点已被建议在此类监管中发挥作用[8,10.- - - - - -12.].DOF(与一种手指的DNA结合)蛋白质是植物特异性转录因子,参与光,植物激素和病原体信号和应答以及种子发育(通过[23.])。[T/A]AAAG dof结合位点介导保卫细胞基因表达的作用仅在马铃薯上得到实验证实KST1.基因(8].然而,在拟南芥中,dof基序在控制保卫细胞表达中的作用仍存在争议[10.- - - - - -12.].该研究在马铃薯上进行了KST1.启动子(8],并对几个守护细胞特异性拟南芥启动子进行生物信息学分析[10.]建议存在DOF的簇独联体-Elements,而不是它们的绝对数量,对促进促销员区域赋予卫生细胞特异性是重要的[10.].然而,DOF结合位点在拟南芥中驱动细胞表达的作用以及集群组织的假设仍有实验研究。
保卫细胞特定的AtMYB60启动子提出了几个DOF簇,使之成为一个理想的模型来检验DOF簇对保护细胞特异性表达的重要假设。此外,AtMYB60表达是由不同环境线索如光,暗和干旱胁迫[调制19.,暗示着不同的存在独联体-控制这些转录反应的元素。在这份报告中,我们的目标是孤立独联体-负责的元素AtMYB60保护细胞特异性表达。我们产生了带有截断或诱变的转基因拟南芥株系AtMYB60启动子版本融合到格斯报告基因。利用组织化学和表达分析的结合,我们能够确定最小启动子的必要和充分的驱动保卫细胞特异性表达。使用同样的工具,我们也能够绘制出aba介导的抑制所需的区域。
结果
In-silico的分析AtMYB60启动子
在之前的研究中,我们证明了完整的5'和3'AtMYB60基因间基因组区-克隆的上游和下游β-glucoronidase(格斯)报告基因,可以特异性驱动拟南芥幼苗和成体植物气孔中GUS的活性[19.].在其他类型的细胞或无气孔的组织中未检测到GUS信号[19.].
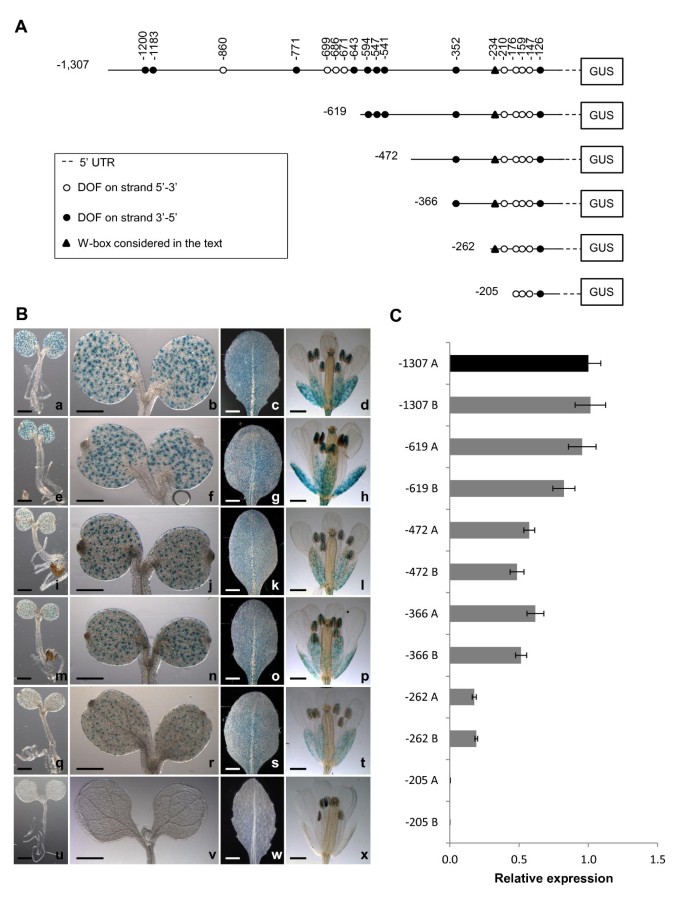
调查可能的独联体-起调节作用的元素AtMYB60表达,我们调查了上游的基因组区域AtMYB60使用PLACE软件发现已知转录因子结合位点的翻译起始密码子[24.].我们的分析在[A / T] AAAG主题中产生了显着的浓缩AtMYB60[A/T]AAAG寡聚体在整个拟南芥基因组基因间区域的平均分布(P < 0.01)1).有趣的是,这些[A/T]AAAG基序已经被证明参与了马铃薯钾通道保卫细胞表达的调控KST1.基因(8].此外,dof型转录因子结合所需的[A/T]AAAG基序簇[25.,在不同的保卫细胞特异性启动子中有过多的代表性[6,10.,12.].加尔比亚蒂和他的同事们特别指出,它是保卫细胞特异性的cis元素,位于100bp区域内同一链上的至少3个[a /T]AAAG基序的簇[10.].使用Galbiati和合作者(2008)之前描述的标准,我们发现在5'基因间区域有三个保卫细胞特异性簇AtMYB60基因(图1),建议保护细胞特异性表达的保守机制。
5'区核苷酸序列AtMYB60基因.核苷酸在左侧编号,翻译起始位点为+1。ATG用粗体表示。5' UTR是小写字母。dof绑定位点是灰色框,文本中考虑的w框是白色框。由Galbiati和同事(2008)定义的dof结合位点簇被强调。CAAGTTG motif被描述为假定的独联体- ABA抑制因子([16.])点缀下划线。
鉴定AtMYB60核心启动子
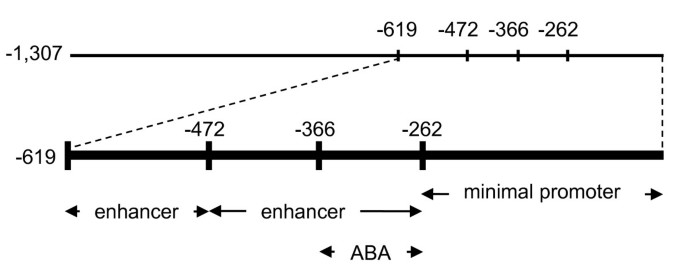
来获得更多关于独联体- 调节的元素AtMYB60结果表明,拟南芥转基因细胞系的翻译起始密码子上游具有完整的1,307 bp的5'基因间区格斯(构造-1307::格斯,图2A).对15个独立T2细胞系的GUS染色分析表明,该区域包含所有的独联体-报告基因在气孔中表达所需的作用元件(图2B.),而在其他细胞类型或无气孔组织中未检测到GUS信号(附加文件1).
缺失分析AtMYB60上游地区.A,不同的缺失的示意图AtMYB60上游区域融合到格斯报告基因。显示了文本中描述的不同DOF结合位点和W字箱的位置。B,幼苗中Gus活性的组织化学测定,莲座叶和植物花卉用-1,307 ::格斯(模拟),-619::格斯(情况),-472::格斯(我),-366::格斯(mp), -262::格斯q - t) (-205::格斯(u-x)结构。对具有相同结构的独立品系的分析显示了相同的GUS染色模式。除-205行::外,所有行样品在染色液中孵育16小时。格斯,染色延长至48小时。秤条代表1毫米。C,相对表达水平格斯报告基因在不同的转基因源系中覆盖-1,307 ::格斯(-1,307 A和B), -619::格斯(-619 A和B), -472::格斯-366::格斯(-366 A和B), -262::格斯(-262 A和B)或-205::格斯(-205 A和B)结构。用Real Time RT-PCR分析每个构建的两个株系。-1,307 A行转录量任意设为1(黑色列),用于归一化每行的相对表达水平。的ACTIN2基因(At3g18780)作为对照。
接下来,我们对-1,307 bp基因组区域进行了一系列5'的缺失,以确定在保卫细胞中表达所需的最小序列长度(图)2A).这些截断启动子(融合到格斯基因)稳定地转移至拟南芥和10至15个独立的T 2转基因系进行详细分析。的1307 bp的区域的至位置-619(构建体的远端部分的缺失-619 ::格斯)、-472 (-472::格斯),或-366(-366 ::格斯)从ATG密码子,没有改变记者在位于营养和花动器官的保护细胞中的表达(图2B.).进一步的缺失(到位置-262)表明262bp近端区域足以推动记者在气孔中的表达(图2B.).然而,去除-262 bp和-205 bp之间的区域(construct -205::格斯)完全消除了保卫细胞的GUS活性(图2B.).转基因系携带-205::格斯融合在任何其他细胞类型中都没有显示GUS染色,甚至在延长染色后(长达48小时,图)2B.).这一发现表明,位于-262和-205位置之间的57 bp区域包含独联体-elements在气孔保卫细胞中的表达是必不可少的。基于这些结果,我们定义了ATG密码子的-262 bp的区域作为上游的最小启动子AtMYB60基因。
彻底调查在数量上的差异格斯不同缺失行之间的表达:报告结构,我们确定了相对数量格斯定量RT-PCR (qRT-PCR)。分别对来自两个具有代表性的独立细胞系(A和B)的mRNA样本进行分析(图)2C).窝藏1,307bp 5'代亚基地区或-619删除融合给记者,并没有显示出他们的任何显着差异格斯成绩单积累。相反地,缺失到位置-472和-366得到两倍的降低在格斯表达式与-1,307::格斯行,而将其删除至-262位置会导致5倍的下降(图2C, p < 0.01)。这些结果表明,在基因组ATG的-619 ~ -472 bp和-472 ~ -262 bp之间存在一个或多个具有增强子功能的序列AtMYB60.与组织化学分析结果一致,qRT-PCR实验未发现显著性差异格斯成绩单在携带-205线积累::格斯融合。
的定点突变AtMYB60核心启动子
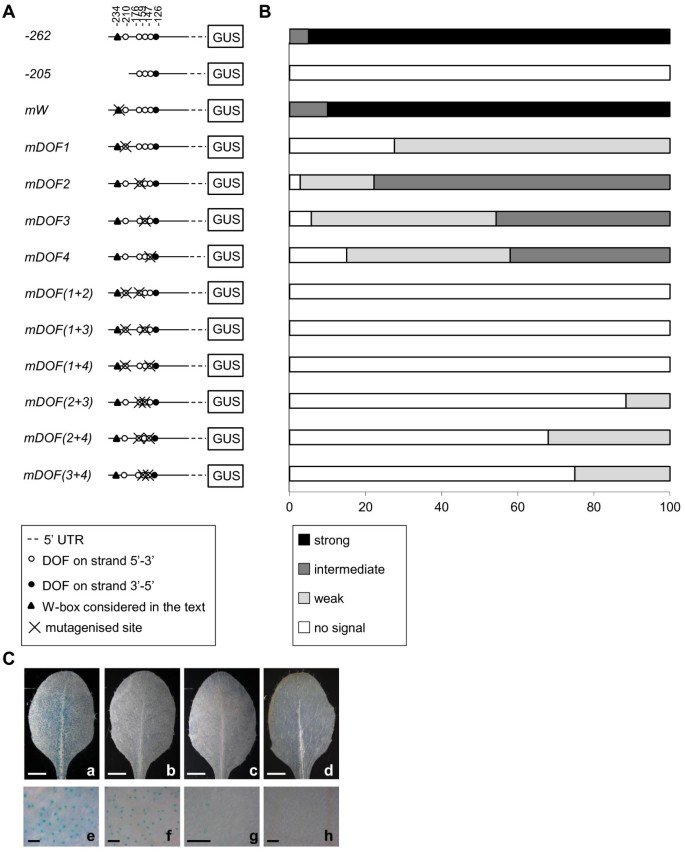
启动子删除实验表明AtMYB60最小启动子区域(结构-262::格斯)包含所有独联体式作用以维持在保卫细胞的报告基因的表达所需要的元件。该区域包围[A / T] AAAG簇接近所述的ATG密码子,其由四个AAAAG DOF结合位点(图1和3A).此外,在该区域中识别的地方软件是单个W字幕,对应于Wrky转录因子的结合位点[26.],位于[A/T]AAAG集群的上游(图3A).强调个体的功能意义独联体- 在中存在AtMYB60最小的启动子,我们评估了靶向核苷酸取代的影响格斯表达式(图3A).最小启动子通过PCR产生突变版本并融合格斯和至少30个T2独立的转基因株系对每个突变的启动子::格斯组合进行目视评分和分类,以反映其相对保卫细胞特异性GUS染色。图中提供了每个类别的典型示例3C.
我们首先测试了单个W-box的作用独联体- 用非功能性TTGAA图案更换共识序列TTGAC [27.].行携带突变W-盒(兆瓦:格斯)显示出相似的水平格斯表达的野生型启动子,这表明在保卫细胞中W-框不向介导基因表达(图3B.).接下来,我们制作了突变启动子,其中[A/T]AAAG簇内的单个DOF基序转化为不相关的CGCGA序列。相对于ATG的最远端AAAAG位点失活(以下简称DOF1.)导致…的急剧减少格斯表达(mdof1.::格斯构造,图4 b).30%的线路携带mdof1.::格斯构造没有显示格斯表达,而其余70%仅表现出微弱的染色,因此表明了一个至关重要的作用DOF1.在调节AtMYB60保卫细胞表达(图3B.).第二、第三或第四近端AAAAG位点(以下简称DOF2.,DOF3.和DOF4.,分别),导致减少格斯表达,虽然比一个在一个较小程度上DOF1.(图4 b,M.DOF2 :: GUS.,mDOF3:格斯和mDOF4:格斯植物)。特别是,30个都没有mDOF2:格斯近70%为中表达,25%为弱表达,其余5%未显示任何GUS染色(图)3B.).通过对强、中、弱株系的分析,得到了可比较的分布mDOF3:格斯和mDOF4:格斯植物(图3B.).
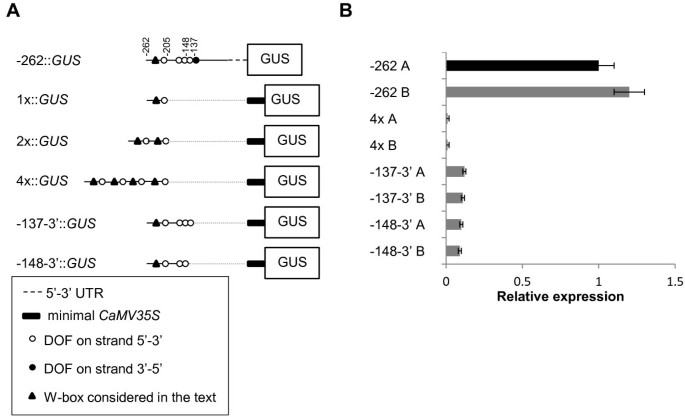
57 bp序列寡聚化和3′缺失AtMYB60核心启动子.A,结构示意图。在4 x::格斯构建-262 ~ -205区间的57 bp片段,与上游最小启动子CaMV 35S(该方案中最小35S,位于-46 ~ +1区间)融合格斯报告基因。在结构-137-3'::格斯和148 - 3 '::格斯,3' 删除的版本AtMYB60最小启动子与CaMV 35S的相同部分融合。(B)相对表达水平格斯报告基因在不同的转基因株系中。用Real Time RT-PCR分析每个构建的两个株系。-1307 A行转录量任意设为1(黑色列),用于归一化每行的相对表达水平。的ACTIN2基因作为对照。符号在图2中所描述的相同。虚线表示删除的区域AtMYB60最小启动子序列。
为了确定dof结合位点是否在气孔中发挥加性作用,我们制作了第二系列启动子,其中两个AAAAG基序同时突变。突变的DOF1.和DOF2.(MDOF(1 + 2):: GUS),DOF1.和DOF3.(MDOF(1 + 3):: GUS)或DOF1.和DOF4.(MDOF(1 + 4):: GUS)完全失活,最小的启动子,如格斯在所有的MDOF(1 + 2):: GUS,MDOF(1 + 3):: GUS和MDOF(1 + 4):: GUS行分析(图3B.).有趣的是,并发突变DOF2.和DOF3.(参数(2 + 3)::格斯)导致了保护细胞中启动子活性的强烈失活,但仍不完全失活参数(2 + 3)::格斯线显示在气孔记者的弱表达。同样地,伴随失活或者DOF2.和DOF4.或者DOF3.和DOF4.没有完全消除格斯保卫细胞表达(图3B.).在一起,这些结果表明,位于中的推定[A / T] AAAG DOF结合位点AtMYB60启动子是介导其在保卫细胞中的表达所必需的。
单个DOF簇足以驱动保卫细胞的低表达
我们的删除分析AtMYB60启动子显示-262和-205位点之间的57bp区域是气孔保卫细胞中基因表达的关键区域(图)2).这个区域包含DOF1独联体-元素用于保卫细胞表达,如图突变分析结果所示(图3.).为了建立这个57 bp的区域是否足以保卫细胞激活的表达,我们融合的一个(1X ::格斯构造),二(2x ::格斯)和四个串联拷贝(4X ::格斯)57个BP片段到最小值CaMV35S启动子(28.上游;上游格斯报告基因(图4),有效地重建包含一个、两个或四个副本的人工自由度簇DOF1.元素。然而,即使经过长时间染色(数据未显示),我们也没有在每个结构产生的30个独立稳定的转化子中观察到GUS活性。这些数据通过对携带4x基因的独立品系的qRT-PCR分析得到了证实:格斯融合(图4 b),显示资讯科技的多元化DOF1.网站本身不足以驱动保卫细胞中的基因表达。这可能是由于在最小启动子的背景下,不同自由度元素的组织和/或空间分布不当造成的。为了验证这个假设,我们做了两个3'缺失AtMYB60最小启动子:-148-3'::格斯和137 - 3 '::格斯包含分别在最小近侧融合的最近似簇的前三个和四个DOF结合位点的构建体CaMV35S启动子(图4 b).我们最初的组织化学分析没有发现任何GUS阳性株系(数据未显示)。为了证实这一结果,我们还对15个独立的株系进行了qRT-PCR分析。有趣的是,15行中有8行显示了低但重要的水平格斯与最小启动子全长比较(图)4 b).这些结果表明,含有三个或四个DOF结合位点的簇的存在足以驱动防护细胞中的GUS活性,即使在非常低的水平。这一发现意味着其他独联体-元件位于-137位置下游,对最小启动子的全部功能是必需的。
保护单元相关CDF1,CDF2,CDF3和CDF5 DOF型转录因子不规范AtMYB60表达气孔
目标诱变实验AtMYB60启动子证明[A / T] AAAG DNA共识基序是必不可少的独联体-调控中的作用要素AtMYB60在保卫细胞中的表达。因此,他们的同源DOF蛋白代表最有可能的候选者为反式- 传出因素。由于拟南芥基因组含有36个DOF编码基因[23.,参与调控的候选DOF转录因子AtMYB60表达应符合两个标准:它们应在保卫细胞中表达,其基因功能的丧失应消除或显著下调的表达AtMYB60在这个单元格类型中。
的循环自由度因子1(CDF1, At5g62430)基因,参与调控光周期开花,已被证明在维管组织和保卫细胞中高度表达[29.].因此,我们调查的表达AtMYB60基因在功能上的缺失CDF1-R.等位基因。如附加文件所示2我们没有发现积累的显着差异AtMYB60成绩单在纯合子CDF1-R.与野生型相比。
值得注意的是,在光周期开花中,CDF1与其他三个DOF蛋白冗余作用,即CDF2 (At5g39660)、CDF3 (At3g47500)和CDF5 (At1g69570) [30.],属于同一系统发育组II [31.].同样到CDF1,启动子::格斯分析显示,CDF2,CDF3和CDF5在保护细胞中强烈表达。
因此我们分析了的表达式AtMYB60单身,双重,三重和四点提供以确定这些额外的候选CDF蛋白的可能作用。至于CDF1-R.突变体的表达水平AtMYB60在cdf2-1,cdf3-1和cdf5-1单个突变体(附加文件2).同样的,AtMYB60在任何双、三或四突变组合中,表达均未发生改变,这表明,尽管这四个CDF蛋白在保卫细胞中表达,但它们并没有发生变化反式监管机构的AtMYB60气孔中的表达(附加文件2).
启动子区域的鉴定是负ABA响应
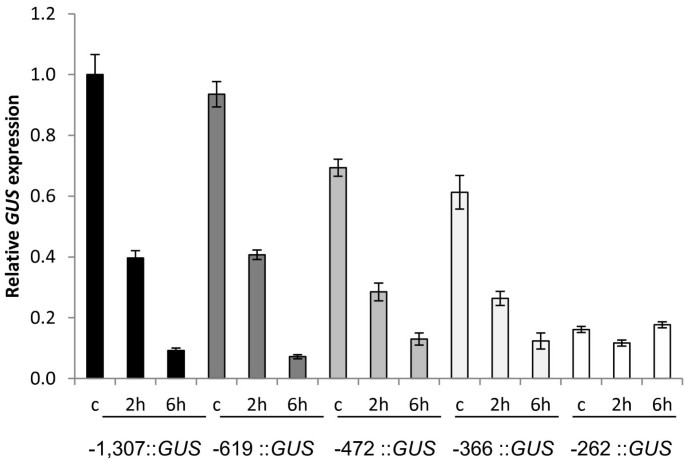
我们之前报道过转录本的积累AtMYB60通过激素ABA的外源应用迅速下调基因,这在调节基因表达时在响应干旱胁迫时发挥着基本作用[19.].确定aba介导的启动子区域AtMYB60我们将ABA应用于上述基因序列缺失的转基因品系AtMYB60启动子(图2).定量RT-PCR分析也显示了类似的下降格斯转基因株系中携带全长以及-619、-472和-366的转录水平::格斯融合(图5).下调节的动力学格斯转录本与内源性基因的转录本具有可比性AtMYB60[19.],说明-619、-472和-366启动子维持着ABA转录下调的序列。此外,这些结果表明,CAAGTTG基序,存在于AtMYB60-619和-613之间的启动子(图中下划线下划线1),以及最近被描述为在ABA-抑制的基因[过多16.,在aba依赖性抑制中没有显著作用AtMYB60表达。相反,定量RT-PCR实验上携带-246不同的独立行执行::格斯构建表明,最小的启动子序列缺乏负责ABA负责的区域,因为这些线没有显示出变化格斯如图所示5.
综合这些数据表明,尽管最小的启动子维持独联体-保卫细胞表达所必需的-元素,缺乏介导ABA负调控的基序,对ABA不敏感。因此,我们认为-366 ~ -262区间含有ABA下调所需的元素。
讨论
已经描述了很少的防护细胞特异性启动子[3.,10.,14.,19.,20.].独立研究表明AtMYB60启动子可以被认为是保卫细胞特异性的,足以驱动保卫细胞中报告基因的特异性表达[19.,21.].此外,该启动子还被用于补充保卫细胞中的突变表型[21.],并专门在保卫细胞中研究亚细胞定位[22.].在这项研究中,我们确定的AtMYB60最小启动子是必要的和足够的驱动保卫细胞特异性表达。
需要DOF结合站点AtMYB60保卫细胞表达
我们的在网上分析确定了三个DOF站点集群(图1).初始删除研究揭示了最近端的DOF群集的突出作用(相对于ATG起始密码子)。定向诱变的诱变表明,最远端末端结合位点(DOF1.位置-210,图3.)与同一群集的其他DOF图案相比,在驱动器单元表达式中发挥重要作用(DOF2.在-176位置,DOF3.在-159年和DOF4.在-147年,图3.).这些其他的DOF元素起到了部分相加的作用,这些位点和位点的联合突变清楚地证明了这一点DOF1.导致GUS活动急剧减少的网站(图3.).因此,DOF结合位点是根据我们先前制定的DOF群集假设介导保护细胞表达的关键决定因素[10.].一个类似的DOF介入的建议独联体-元素来源于Gardner及其同事(2009)的工作,他们在一个控制保卫细胞表达的区域中识别了DOF基序。其他作者在保卫细胞特异性pGC1启动子中发现了一个富含DOF结合位点的区域,尽管单个DOF位点的突变并不影响启动子的活性[14.].有趣的是,葡萄的启动子中存在一个DOF簇组织VvMYB60基因,推定的同源词AtMYB60,表明种群结构在种群间演化过程中是守恒的AtMYB60直接同源(32.].Plesch和他的同事(2001)报告了马铃薯中DOF基序组织的结果KST1.启动子在保护启动子的细胞特异性活性的控制中强调了该模块更普遍的进化保守性。
虽然我们不能排除其他未知转录因子可能与那些相互作用的可能性独联体-元素,自由度因子表示可能的候选者为AtMYB60监管机构。结合我们的结果得出的最简洁的假设表明,DOF蛋白作为正调节因子AtMYB60.马铃薯的StDOF1蛋白已经被证明可以结合在体外的保卫细胞特异性启动子KST1.[8,而没有任何拟南芥DOF蛋白的数据。在拟南芥中景深基因,CDF1,CDF2,CDF3,CDF5(CDFs)在保卫细胞中表达[29.].但是,单身和多重提供突变体显示的野生型图案AtMYB60排除了他们参与的可能性AtMYB60调节(附加文件2).大部分拟南芥景深基因在保卫细胞中表达[33.,34.这样做可能是多余的,就像在这个家族的成员中已经证明的那样[30.].所有这些方面都无助于确定明显的候选人AtMYB60监管机构。我们正试图找出景深参与调控的基因AtMYB60通过分析其在保护细胞中优先表达的基因突变体中的表达(http://bbc.botany.utoronto.ca/efp/cgi-bin/efpWeb.cgi[33.])。
多个独联体-要素参与加强AtMYB60保卫细胞表达
转录格斯从ATG到定位-262的5'基因间区域的不同缺失,只在保卫细胞中赋予GUS活性(图)2和额外的文件1).这些启动子区的活性与检测到的明显差异AtMYB60利用现有的微阵列分析数据揭示种子中的基因表达[33.,34.正如最近报道的那样,[35.].一种解释这种不一致性的假设可能是在完整的5'和3'基因间区域的侧翼之外存在其他调控区域AtMYB60编码序列。例如,内含子序列可能参与了这种调控,正如之前在不同植物基因中所证明的那样([36.]及参考文献)。
而保卫细胞的特异性表达则始终由功能维持AtMYB60启动子变异,表达水平变化很大。除dof结合位点外,其他独联体-元素需要提升AtMYB60表达。实际上,人为DOF1.单个或多个拷贝中重复的结合位点不能驱动保卫细胞的表达(图)4).合并整个近端DOF簇(例如-137-3'::格斯)导致小但重要的防护细胞转录活动。因此,其他独联体最小促进剂的全部活性需要在位置下游--137。众所周知独联体除DOF结合位点以外的元素涉及保护细胞表达的调节。在防护细胞特异性的情况下AtPDR3在ATG密码子上游的1000-BP区域中鉴定了基因NO [A / T] AAAG簇,表明存在其他调节单元的存在[10.].
模块化组织AtMYB60启动子
在这项研究中,我们还调查的调控AtMYB60启动子活性对ABA的响应。ABA处理诱导拟南芥基因表达的整体变化[16.,37.- - - - - -40].转录组分析显示,ABA的基因表达也在保护细胞中进行了广泛调节[13.,14.,16.].而独联体- 在功能上表现出对ABA的响应(对于审查,请参阅[41.]),那些对ABA的响应负调节在很大程度上是未知。甲CAA [G / C] TTG基序已经被证明是过度代表在ABA-压抑基因的启动子,从而提出了这样的作用[16.,39.].的AtMYB60启动子包含一个CAAGTTG基序,位于ATG的-619和-613之间,但我们的研究结果并不支持其作为ABA响应负调控因子的作用。相反,位置-366到-262之间的区域包含aba介导抑制图的全部要求5和6.它已经提出了进化可能青睐的机制分化为ABA下调而不是上调,使更多的困难ABA任何压抑的主题,实现统计意义[16.].我们的数据可能为阐明ABA抑制机制提供了一个有价值的模型系统。
我们的数据建议模块化组织AtMYB60启动子总结于图6.通过序列删除分析,我们定义了AtMYB60最小启动子,足以诱导保护细胞特异性活性(构建-262::格斯,图2).在保卫细胞中,需要一个位于-262和-205位点之间的57 bp区域来确定GUS活性(图)2A).我们还确定了两个地区,增强了一种增强的表达格斯-619 bp -472 bp和-472 bp -262 bp之间的基因(图52B.和2C).除了为这种模块化组织提供一些证据外,我们的工作表明,不同的部分AtMYB60启动子可能证明可用于操纵保护细胞中的基因表达,其可能获得不同水平的表达。此外,最小的启动子(其活性不受ABA的影响)可用于保护细胞中的靶基因的无关表达
有趣的是,全长和最小的启动子都保持其在异源系统中的保护细胞特异性活性,例如作物种类番茄和烟草(Francia,个人通信),从而表明在不同植物中保护这种细胞特异性调节机制物种。此外,初步结果表明了AtMYB60最小的启动子可以与其他人相结合独联体-调控模块,以产生功能性保卫细胞特异性嵌合启动子(Francia,个人通讯)。作为一个整体,我们的数据表明,全长和最小AtMYB60启动子提供了一种有价值的工具,可以在保护细胞中操纵基因表达,用于生理学研究和下游生物技术应用。
结论
我们的工作为[A/T]AAAG元素参与调控提供了有力的证据AtMYB60表达,说明其功能集群组织。未来的工作将集中于分析调控这一机制的候选DOF转录因子。最后我们确定了一个区域AtMYB60ABA负调控所需的启动子,为发现新的启动子提供了可能独联体-elements对于这种调节。
方法
植物材料
描述的所有植物材料都在Col-0加入中。的CDF1-R.line (35S::CDF1-RNAi #23)由Takato Imaizumi提供[29.].的cdf2-1,cdf3-1和cdf5-1无效等位基因是T-DNA插入线。单倍,双倍,三倍和四倍提供突变体以前已经被描述过[30.].
建设AtMYB60启动子:格斯融合
5'-基因间基因组区上游缺失AtMYB60质粒p1.3-2.2 PCR扩增产生::格斯,上文所述[19.],使用不同的正向引物和单个反向引物。向前和反向引物结合了一个h第三,Bam嗨,分别。将PCR片段克隆到pCR4-TOPO载体(Invitrogen Corporation, Carlsbad, CA)中,剪切欣dIII和BamHI和结扎的上游uidA编码序列在pbi101.3二进制矢量(clontech,帕洛阿尔托,加州,美国)。所得质粒更名为-1307 ::格斯-619::格斯,-472 ::格斯-366::格斯-262::格斯-205::格斯(图2).
嵌合启动子包含不同的3'-缺失片段AtMYB60最小启动子和46-bp的CaMV 35S启动子由来自-46放大CaMV 35S启动子的序列1产生的[28.从质粒pBI121 (Clontech, Palo Alto, CA, USA)中,使用正向引物35SXba包含aXba我网站和反向底漆35sbamBamHI网站。将PCR产物克隆到pCR4-TOPO载体和Xba我- - - - - -BamHI片段克隆到pBI101.3载体(重命名为35Smin-pBI101.3)。表中-262 ~ -137和-262 ~ -148的区域AtMYB60通过PCR从质粒p1.3-2.2 ::通过PCR扩增最小启动子格斯,使用反向引物P60R6和P60R7结合A.XbaI位点和单个正向引物p60F3欣dIII网站。将相应的PCR产物克隆到pCR4-TOPO载体中欣dIII-Xba将I片段克隆到35Smin-pBI101.3载体中,得到-137-3'::格斯和148 - 3 '::格斯分别是载体(图3.).
嵌合启动子包含不同的区域拷贝在-262和-205AtMYB60通过合成该序列的一种拷贝,使用前底漆P60F3与a的副本获得启动子欣DIII网站和反向引物P60R3Xba我的网站。PCR产物克隆到pCR4-TOPO载体中欣dIII-XbaI片段连接到35Smin-pBI101.3载体(construct 1x::格斯).利用引物p60F3和p60R5b生成了该区域的第二个拷贝欣DIII网站;片段欣dIII-欣dIII被克隆到结构1x::格斯,生成结构2x::格斯.以该质粒为模板,利用引物p60F11和p60R3合成-262 -205序列的另外两个拷贝Xba我的网站。片段Xba我- - - - - -Xba我被克隆到质粒2x::格斯,以生成4x::格斯.所有寡核苷酸序列见表1.对PCR产物进行测序,并通过酶切验证片段进入最终载体的正确方向。
定点诱变分析
使用MegapRimer方法产生不同DOF位点的基础突变[42.].突变版本的AtMYB60从质粒p1.3-2.2中PCR扩增出最小启动子不同的巨引物::格斯,采用正向引物mp60DOF1F1、mp60DOF2F1、mp60DOF3F2和mp60DOF4F2,单一反向引物p60R5。将巨引物凝胶纯化,在质粒p1.3-2.2上进行第二次PCR反应::格斯用底漆p60f3。将PCR产物克隆到PCR4-TOPO中并在使用限制性位点克隆到PBI101.3载体之前测序欣dIII和Bam嗨生成以下构造:mdof1.::格斯,mdof2.::格斯,mdof3.::格斯,MDOF4.::格斯.为了产生多个突变位点,第二个PCR扩增的模板是已经携带第一个突变位点的质粒。在构造准备的情况下兆瓦::格斯无需采用巨引物法,因为诱变位点位于最小启动子的5'端,用引物mp60WRKYF1和p60R5进行单一PCR反应,然后克隆PCR产物,过程已描述。
所有寡核苷酸序列见表1.
拟南芥的转化与生长条件
使用野生型哥伦比亚(Col-0)植物农杆菌肿瘤术菌株GV3101携带上述结构物,采用花浸法[43.].在卡那霉素上选择转化品系,并选择单插入品系进行进一步分析。在长日照条件下(16小时光照;在100 μmol m的光照下8小时-2证券交易委员会-1),在22°C的生长室。种子在含有Murashige和Skoog培养基、1% w/v蔗糖和0.8% w/v琼脂的培养皿中萌发,用于幼苗分析,或直接在土壤上萌发,用于成体植物器官分析。ABA处理如前所述[19.].
GUS活性测定及组织化学染色
为了检测GUS活性,组织在-20℃90% (v/v)丙酮中固定2小时,37℃孵育16-48小时,在0.05% (w/v) X-glucoronic acid, 0.1% (v/v) Triton X-100和0.5mM ferrocyanidine中50 mM磷酸盐缓冲液(pH 7)中,随后在70% (v/v)乙醇中清除。用水合氯醛:甘油:水溶液(8:1:2,v/v)清除幼苗和花朵。使用Leica M205 FA立体显微镜(Leica Microsystems GmbH Wetzlar,德国)和Zeiss Axiophot D1显微镜(Carl Zeiss MicroImaging, LLC Thornwood, New York, USA)检测样品。用徕卡LAS软件2.8.1版本记录立体显微镜图像。显微镜图像由AxioCam MRc5相机(蔡司)使用AxioVision程序(5.0版)记录。
基因表达定量
RNA分离、逆转录、qRT-PCR反应和数据分析如前所述[30.].格斯使用引物Gusrt-F1和GUSRT-R1分析表达,ACTIN2基因(引物ATACT2F, ATACT2R)作为归一化参考。AtMYB60表达在不同的提供使用引物QRT-MYB60-F和QRT-MYB60-R分析突变体。PP2A相对应的基因,AT1G13320(引物PP2a-F和PP2a-R)作为归一化参考[44.].所有引物序列见表1.
参考文献
- 1。
王志强,王志强,王志强:细胞信号转导网络的研究进展2和加利福尼亚州2+信令。Annu Rev植物Biol。2010,61:13.11-13.31。
- 2。
作者简介:王志强,王志强,王志强:植物保护细胞脱落酸信号转导与抗旱能力的研究。自然。2001,410:327-330。10.1038 / 35066500。
- 3.
Gray JE, Holroyd GH, van der Lee FM, Bahrami AR, Sijmons PC, Woodward FI, Schuch W, Hetherington AM: HIC信号通路将CO2感知与气孔发育联系起来。自然科学。2000,408:713-716。10.1038 / 35047071。
- 4。
Kopka J, Provart NJ, Muller-Rober B:土豆保卫细胞通过碳代谢和膨压调节相关基因表达的复杂变化对干燥的土壤作出反应。植物学报1997,11:871-882。10.1046 / j.1365 - 313 x.1997.11040871.x。
- 5.
Muller-Rober B, La Cognata U, Sonnewald U, Willmitzer L:马铃薯adp -葡萄糖焦磷酸化酶启动子的截短版本在转基因植物中指定保卫细胞选择性表达。植物学报。1994,6:601-612。
- 6.
拟南芥钾通道基因在保卫细胞中的表达。植物营养与肥料学报。1995,19(4):451 - 457。10.1104 / pp.109.2.371。
- 7.
陈志强,王志强,王志强,等。拟南芥脱氢酶基因的克隆与表达分析。植物营养与肥料学报。2001,22(4):489 - 494。10.1023 /: 1006469128280。
- 8.
Plesch G,埃尔哈特T,的Mueller-Roeber B:TAAAG元件的参与提出了的Dof转录因子在保卫细胞特异性基因表达的作用。植物J. 2001,28:455-464。
- 9.
Terryn N, Arias MB, Engler G, Tire C, Villarroel R, Van Montagu M, Inze D: rha1,一个编码拟南芥小GTP结合蛋白的基因,主要在发育中的保卫细胞中表达。植物学报。1993,5:1761-1769。
- 10.
Galbiati M,Simoni L,Pavesi G,Cominelli E,Francia P,Vavasseur A,Nelson T,Bevan M,Tonelli C:基因陷阱线识别在气孔保护细胞中表达的拟南芥基因。工厂J. 2008,53:750-762。10.1111 / J.1365-313x.2007.03371.x。
- 11.
Gardner MJ, Baker AJ, Assie JM, Poethig RS, Haseloff JP, Webb AA: GAL4 GFP增强子诱捕系用于分析气孔保卫细胞发育和基因表达。中国生物医学工程学报,2009,30(6):591 - 598。
- 12.
Plesch G,Kamann E,Mueller-roeber B:调节保护细胞特异性基因表达的调节序列的克隆。基因。2000,249:83-89。10.1016 / s0378-1119(00)00150-5。
- 13。
Leonhardt N,Kwak JM,Robert N,Waner D,Leonhardt G,Schroeder Ji:拟南芥保护细胞的微阵列表达分析和隐性脱落酸过敏蛋白磷酸酶2C突变体的分离。植物细胞。2004,16:596-615。10.1105 / TPC.019000。
- 14。
杨Y,哥斯达黎加A,莱茵哈特N,西格尔RS,施罗德JI:有较强的拟南芥保卫细胞启动子的分离及其作为一种研究工具的潜力。植物的方法。2008年,4:6-10.1186 / 1746-4811-4-6。
- 15.
赵志,张伟,Stanley BA, Assmann SM:拟南芥保卫细胞功能蛋白质组学揭示气孔信号通路。acta botanica sinica, 2017, 36(5): 759 - 762。10.1105 / tpc.108.063263。
- 16.
Wang RS, Pandey S, Li S, Gookin TE, Zhao Z, Albert R, Assmann SM: aba调控的拟南芥保卫细胞转录组的共同和独特元素。基因组学杂志。2011,12:216-10.1186/1471-2164-12-216。
- 17.
拟南芥保卫细胞和韧皮部异母细胞特异性表达硫糖苷葡萄糖水解酶1 (myrosinase)。植物营养与肥料学报。2002,32(4):591 - 598。10.1104 / pp.010925。
- 18.
梁YK,Dubos C,Dodd Ic,Holroyd GH,Hethington Am,Campbell MM:AtmyB61,R2R3-Myb转录因子控制拟南芥拟南芥气孔孔径。Curr Biol。2005,15:1201-1206。10.1016 / J.Cub.2005.06.041。
- 19.
Cominelli E,Galbiati M,Vavasseur A,Conti L,Sala T,Vuylsteke M,Leonhardt N,Dellaporta SL,Tonelli C:特异性保护细胞的MYB转录因子调节气孔运动和植物干旱耐受性。Curr Biol。2005年,15:1196-1200。10.1016 / J.Cub.2005.05.048。
- 20。
李志强,李志强,李志强:拟南芥保卫细胞启动子的基因诱捕法鉴定。植物学报,2008,3:684-686。10.4161 / psb.3.9.5820。
- 21。
agy R, Grob H, Weder B, Green P, Klein M, freet - barrand A, Schjoerring JK, Brearley C, Martinoia E:拟南芥atp结合盒蛋白AtMRP5/AtABCC5是一种高亲和力肌醇六磷酸转运蛋白,参与保护细胞信号传导和植酸盐储存。中国生物医学工程学报。2009,29(4):434 - 434。10.1074 / jbc.M109.030247。
- 22。
meal S, Mumm P, Imes D, Endler A, Weder B, Al-Rasheid KA, Geiger D, Marten I, Martinoia E, Hedrich R: AtALMT12是拟南芥保卫细胞气孔运动所需的R型阴离子通道。植物学报,2010,63:1054-1062。10.1111 / j.1365 - 313 x.2010.04302.x。
- 23。
Yanagisawa S: Dof结构域蛋白:与植物特有的不同现象相关的植物特异性转录因子。植物营养与肥料学报。2004,32(4):489 - 494。10.1093 /卡式肺囊虫肺炎/ pch055。
- 24。
的地方。植物顺式调控DNA元件数据库。[http://www.dna.affrc.go.jp/PLACE/]
- 25。
Yanagisawa S,Schmidt RJ:DOF转录因子的识别序列之间的多样性和相似性。植物J. 1999,17:209-214。10.1046 / J.1365-313x.1999.00363.x。
- 26。
Eulgem T,Rushton PJ,Robatzek S,SomssiCh IE:植物转录因子的腕骨副家族。趋势植物SCI。2000,5:199-206。10.1016 / s1360-1385(00)01600-9。
- 27。
于东,陈超,陈志:WRKY DNA结合蛋白在NPR1基因表达调控中的重要作用。acta botanica sinica(云南植物学报). 2001,13(4):427 - 434。
- 28。
Velten的Ĵ,莫雷KJ,Cazzonelli CI:转录增强活性的植物病毒基因间DNA序列重复。病毒学J. 2005,2:16-10.1186 / 1743-422X-2-16。
- 29。
FKF1 F-box蛋白介导了拟南芥中CONSTANS抑制因子的循环降解。《科学》,2005,39(4):413 - 417。10.1126 / science.1110586。
- 30.
Fornara F, Panigrahi KC, Gissot L, Sauerbrunn N, Ruhl M, Jarillo JA, Coupland G:拟南芥DOF转录因子可冗余地减少CONSTANS的表达,并在光周期开花反应中起关键作用。开发细胞。2009,17:75-86。10.1016 / j.devcel.2009.06.015。
- 31.
Yanagisawa S:植物转录因子Dof家族。植物科学进展,2002,7:555-560。10.1016 / s1360 - 1385(02) 02362 - 2。
- 32.
Galbiati男,马特斯JT,法国P,鲁斯科尼楼佳能P,麦地那C,孔蒂L,Cominelli E,托内利C,阿尔塞 - 约翰逊,P:小道消息保卫细胞相关VvMYB60转录因子参与气孔活动的调节和响应于ABA和渗透胁迫差异表达。BMC植物BIOL。2011年,11:142-10.1186 / 1471-2229-11-142。
- 33.
冬季D,Vinegar B,Nahal H,Ammar R,Wilson GV,荣誉NJ:一个“电子荧光象形文字”浏览器,用于探索和分析大规模生物数据集。Plos一个。2007,2:E718-10.1371 / journal.pone.0000718。
- 34.
拟南芥eFP浏览器。[http://bbc.botany.utoronto.ca/efp/cgi-bin/efpWeb.cgi]
- 35。
吴je, Kwon Y, Kim JH, Noh H, Hong SW, Lee H: MYB60在干旱胁迫下拟南芥气孔调控和根系生长中的双重作用。植物生态学报。2011,32(4):491 - 497。10.1007 / s11103 - 011 - 9796 - 7。
- 36。
Schauer SE, Schluter PM, Baskar R, Gheyselinck J, Bolanos A, Curtis MD, Grossniklaus U: Intronic调控元件决定了拟南芥AGAMOUS-LIKE6亚家族成员的不同表达模式。植物学报,2009,59:987-1000。10.1111 / j.1365 - 313 x.2009.03928.x。
- 37。
Seki M, Ishida J, Narusaka M, Fujita M, Nanjo T, Umezawa T, Kamiya A, Nakajima M, Enju A, Sakurai T, et al .:利用全长cDNA微阵列检测ABA处理下约7000个拟南芥基因的表达模式。功能基因组学。2002,2:282-291。10.1007 / s10142 - 002 - 0070 - 6。
- 38。
Zeller G,Henz SR,Widmer CK,Sachsenberg T,Ratsch G,Weigel D,Laubinger S:使用全基因组平铺阵列分析的拟南芥转录组的应激诱导的变化。工厂J. 2009,58:1068-1082。10.1111 / J.1365-313x.2009.03835.x。
- 39。
Choudhury A,Lahiri A:拟南芥中脱落酸度调节蛋白的比较分析。植物BIOL。2011,13:28-35。10.1111 / J.1438-8677.2010.00340.x。
- 40.
松井A,石田Ĵ,两泽T,望月Y,上沼E,远藤TA,冈本男,Nambara E,中岛男,川岛M等:使用干旱,寒冷,高盐度和ABA处理的条件下的拟南芥转录组分析平铺阵列。植物细胞生理。2008年,49:1135年至1149年。10.1093 / PCP / pcn101。
- 41.
Shinozaki K, Shinozaki K:渗透和冷胁迫响应启动子中顺式作用调控元件的组织。植物科学进展,2005,10:88-94。10.1016 / j.tplants.2004.12.012。
- 42。
Kammann M, Laufs J, Schell J, Gronenborn B:利用聚合酶链反应(PCR)进行DNA快速插入突变。核酸学报1989,17:5404-10.1093/nar/17.13.5404。
- 43。
Clough SJ,弯曲AF:花卉浸:农杆菌介导的拟南芥转化的简化方法。工厂J.998,16:735-743。10.1046 / J.1365-313x.1998.00343.x。
- 44。
Hong Sm,Bahn Sc,Lyu A,Jung Hs,Ahn JH:拟南芥转录标准化开始池的鉴定和测试。植物细胞生理。2010年,51:1694-1706。10.1093 / PCP / PCQ128。
致谢
这项工作得到了意大利“Progetto Ager,Bando Viticoltura da Vino”(Serres 2010-2015)的支持,由Biogesteca 15083 / RCC项目,由地区伦巴第亚洲和Agrisost项目资助,由Condazione Umberto veronesi资助的Persialo Persle资助Scienze,米兰,意大利。
作者信息
隶属关系
相应的作者
额外的信息
作者的贡献
EC开展了启动子 - 记者质粒,植物转化并起草了手稿。EC,AA和LC进行转基因拟南芥分析。FF进行提供突变分析。CT,MG和GC构思了该研究,参与了其设计和协调。MG,LC和FF有助于起草稿件。所有作者均阅读并批准最终手稿。
作者为图像提交的原始文件
权利和权限
本文在BioMed Central Ltd.的许可下发布了这是一个开放的访问文章,根据Creative Commons归因许可(http://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
科米内利,加尔比亚蒂,阿尔伯蒂尼et al。dof结合位点还有助于保护细胞的特异性AtMYB60启动子。BMC植物杂志11,162(2011)。https://doi.org/10.1186/1471-2229-11-162
收到了:
接受:
发表:
关键字
- 保卫细胞
- 最小启动子
- 嵌合启动
- 操纵基因表达
- AAAG主题