摘要
背景
了解谷物对环境条件的适应是植物科学有助于应对气候变化带来的挑战的关键领域之一。温度和日照长度是温带谷物开花的主要环境调节因子和适应因子。控制大麦开花时间以响应环境线索的主要基因是VRNH1,VRNH2,VRNH3,PPDH1,PPDH2(候选基因HvFT3).这些来自春化和光周期途径的基因在促进开花方面表现出复杂的相互作用,这些作用仍未被完全理解。特别是,PPDH2其作用被认为局限于短光周期促进开花的能力。来自生物多样性、生态地理学、农学和分子遗传学等领域的证据被结合起来,以获得更完整的关于植物的潜在作用的概述PPDH2大麦的环境适应性。
结果
占主导地位的PPDH2等位基因在春大麦品种中广泛存在,但在春化要求较强的现代冬季品种中偶有发现。然而,来自伊比利亚半岛的老地方品种也有春化需求,它们拥有这种等位基因的频率比现代冬大麦品种高得多。在不满足冬季品种春化要求的田间条件下,冬季品种春化优势明显PPDH2等位基因促进开花,即使在增加光周期超过12小时。这一假设得到了春化反应基因型表达分析的支持。的显性等位基因PPDH2表达,这与增强的VRNH1而且VRNH3表达式。这两个基因的表达是诱导开花所必需的。因此,无论是在野外还是在可控条件下,PPDH2有促进开花的作用。
结论
显性的,祖先的,等位基因PPDH2在南欧大麦种质中普遍存在。显性等位基因的存在与早期表达有关VRNH1开花早。我们建议PPDH2促进冬季栽培品种在所有非诱导条件下开花,即在未满足其春化要求的植物中在短日照或长日照下开花。这一机制被认为是大麦对地中海条件适应综合征的一个组成部分。
背景
温度和光周期是调节冬粮开花时间的主要环境因素[1,2].大麦(大麦vulgareL.)被归类为长日植物,这意味着当暴露在日长增加时,它会更早开花。大麦的某些基因型需要在冬季(春化)长时间暴露在寒冷中,以加速茎尖从营养发育到生殖发育的转变[3.].这种对春化的要求和对光周期的敏感性的结合确保了开花推迟到冬季之后以避免霜冻损害,但随后随着春季白昼长度的增加而迅速开花,从而避免了夏季的热和水胁迫[4].
小麦和大麦品种根据其开花行为分为冬季和春季两种生长习性。前者需要长时间暴露在低温下才能开花,而后者不需要暴露在低温下就能迅速开花。遗传学研究揭示了三个基因之间的上位关系,VRNH1,VRNH2,VRNH3,控制对春化的响应[5,6].冬季生长习性取决于隐性等位基因的组合VRNH1而且VRNH3显性等位基因在VRNH2[5].具有这些基因的其他等位基因组合的基因型在不同程度上表现出春季生长习性。在大麦种质的农艺分类中,第三类品种称为兼性品种[7],其品种表现出抗寒性,但不需要春化。
的活动VRNH1是开花所必需的[8].VRNH1作为开花的促进剂,由春化作用诱导,并调节茎尖向生殖阶段的过渡[9].等位变异在VRNH1已被描述,主要与第一个内含子内的缺失有关[10- - - - - -12].这些缺失被认为是与不同等位基因相关的不同春化要求的原因。在未春化的植物中,基因缺失会导致该基因水平的差异VRNH1转录本和等位基因变异导致不同的开花时间[13,14].
VRNH2是延缓开花直至植物春化的花抑制因子[5,15].等位基因多样性在VRNH2源于三个基因簇的存在或缺失(ZCCT-H) [7].的零等位基因VRNH2对应于隐性春季等位基因,与快速开花有关[7,16,17].日长的长短是决定水平的主要因素VRNH2表达,高水平的表达出现在长时间的时段[15,18,19].
HvFT1,候选基因VRNH3的同音词开花位点t基因(英国《金融时报》)拟南芥[20.,21].强有力的证据表明VRNH3在温带谷物中作为春化和光周期途径的整合者,在促进开花中发挥核心作用[6,9,22].最近,小说VRNH3通过分析序列多态性及其表型效应,已经确定了表现出不同适应效应的等位基因[23].
两个主要的光周期反应基因,PPDH1而且PPDH2,已在大麦中报道[1,24].PPDH1对长光周期敏感,并在长日照下加速开花[25].HvFT3被确定为候选基因PPDH2,它被描述为一种对短光周期有反应的基因[21,22].目前能确定的只有两个HvFT3(PPDH2)等位基因存在,其中一个为null [14,31].然而,不能排除在栽培大麦中也存在额外的等位基因。显性等位基因为功能性等位基因,由4个外显子组成,在短时间内开花发育较快。隐性等位基因是一个被截断的基因,仅保留外显子4的3'部分[22],并在短天数下产生开花延迟(附加文件1).
这些基因之间相互作用的复杂性和强度表明它们共享相同的调控网络[26- - - - - -28].VRNH1,VRNH2,VRNH3形成一个反馈调节回路[6].VRNH1可能是春化信号的主要目标2].的水平VRNH2转录因子在短时间内被下调,在高水平的VRNH1表达式[19].的表达VRNH2通过抑制表达延迟开花VRNH3[9].春化后,转录VRNH2减少,这有利于上调VRNH3在春天漫长的白昼里,并引发了开花[4,6].这很可能是下调VRNH2是由VRNH1.光周期反应基因也参与了开花的促进。占主导地位的PPDH1等位基因通过上调来加速开花VRNH3在漫长的日子里[9].PPDH2被认为是上调的VRNH3短日条件下的表达式[22].此外,表达PPDH2已在短时间内检测到[21,22],在漫长的日子里VRNH2转录本减少[14].
由于这些相互作用的结果,大麦对环境信号的表型反应是复杂的。在一些与春化反应相关的研究中发现了这些开花时间基因的自然等位基因变异[9,11,29],光周期[21,30.],或两者同时[31,32].这种自然变异可能与对不同环境条件的适应有关。
在本文报道的研究中,我们进一步研究了表达和相互作用的模式VRN而且产后抑郁症大麦春化反应品种的基因选择。这些品种代表了不同的等位基因组合VRNH1, VRNH3,PPDH2主导的PPDH1而且VRNH2遗传背景。的地理分布PPDH2对代表栽培品种和地方品种的大量大麦种质资源进行了等位基因分析。此外,可能的作用PPDH2以冬季栽培品种为研究对象,分析了它们对不同时间春化处理的响应。
结果
的分布PPDH2驯化大麦中的等位基因
我们调查了PPDH2等位基因在162个不同地理来源的大麦品种的样本(附加文件2)和159个来自西班牙大麦核心系列(SBCC)的西班牙本地自交系[33].在等位基因组成的基础上,根据株系的季节性生长习性对株系进行分类VRNH1而且VRNH2(表1).为了扩大样本,我们纳入了先前发表的另外202个大麦品种的结果[21,31].的显性等位基因PPDH2大部分春季品种(206个品种中有189个)存在基因,而大部分冬季品种(140个品种中有102个)存在隐性基因(null)。ppdH2等位基因(表1).兼性基因型,特征是在VRNH1,和一个空等位基因(vrnH2)VRNH2,没有显示出如此明显的遗传差异,大约一半(18个栽培品种中的7个)携带显性(功能)。PPDH2等位基因(表1).值得注意的是,SBCC地方品种的等位基因分布与商业品种不同。大多数冬季西班牙长种(140种中的127种)都携带了功能PPDH2等位基因(表1).140个冬季SBCC地方品种都携带显性等位基因VRNH2而且PPDH1但拥有两个不同的等位基因VRNH1.根据术语VRNH1Hemming等人提出的等位基因[13],其中93个地方种族获胜VRNH1-647株开花时间较早VRNH1-4等位基因(14].PPDH2在携带VRNH1-6而且VRNH1-4等位基因。野生型隐性VRNH1在西班牙本土人种中没有检测到等位基因。
长光周期下低温诱导的基因表达
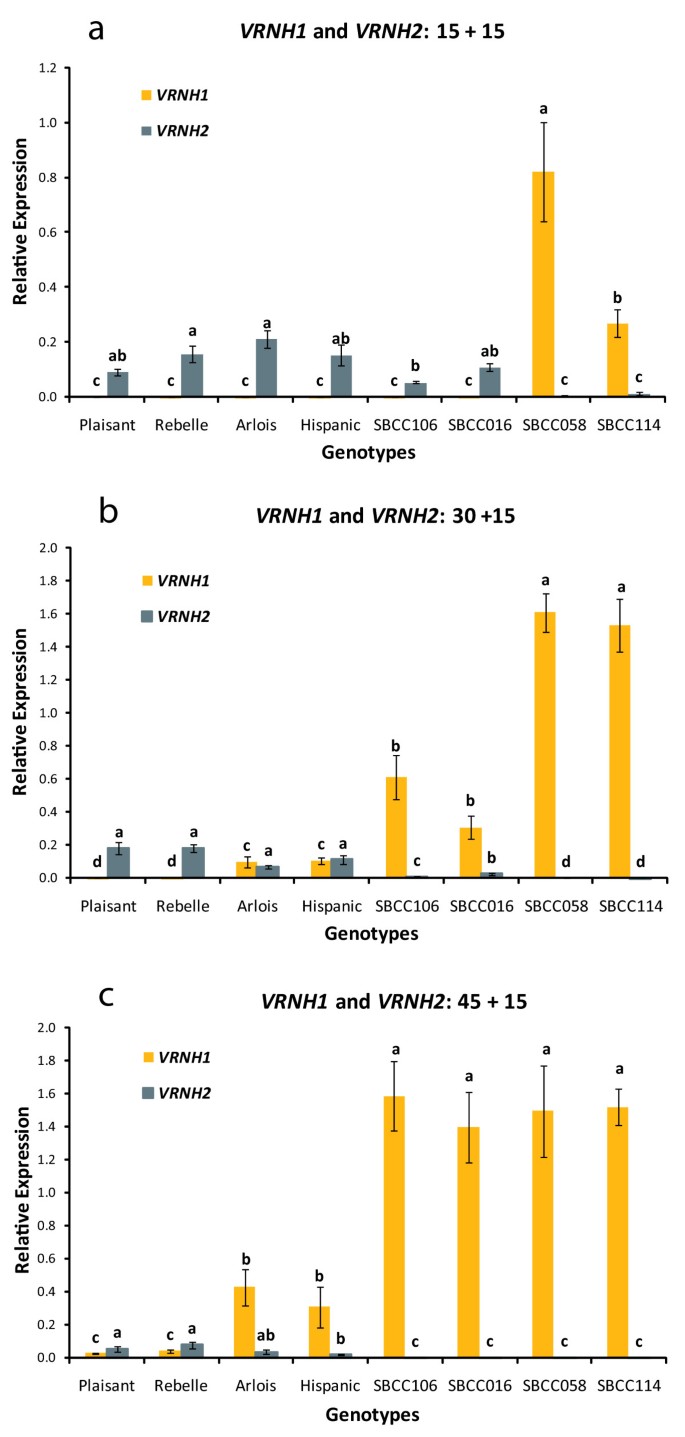
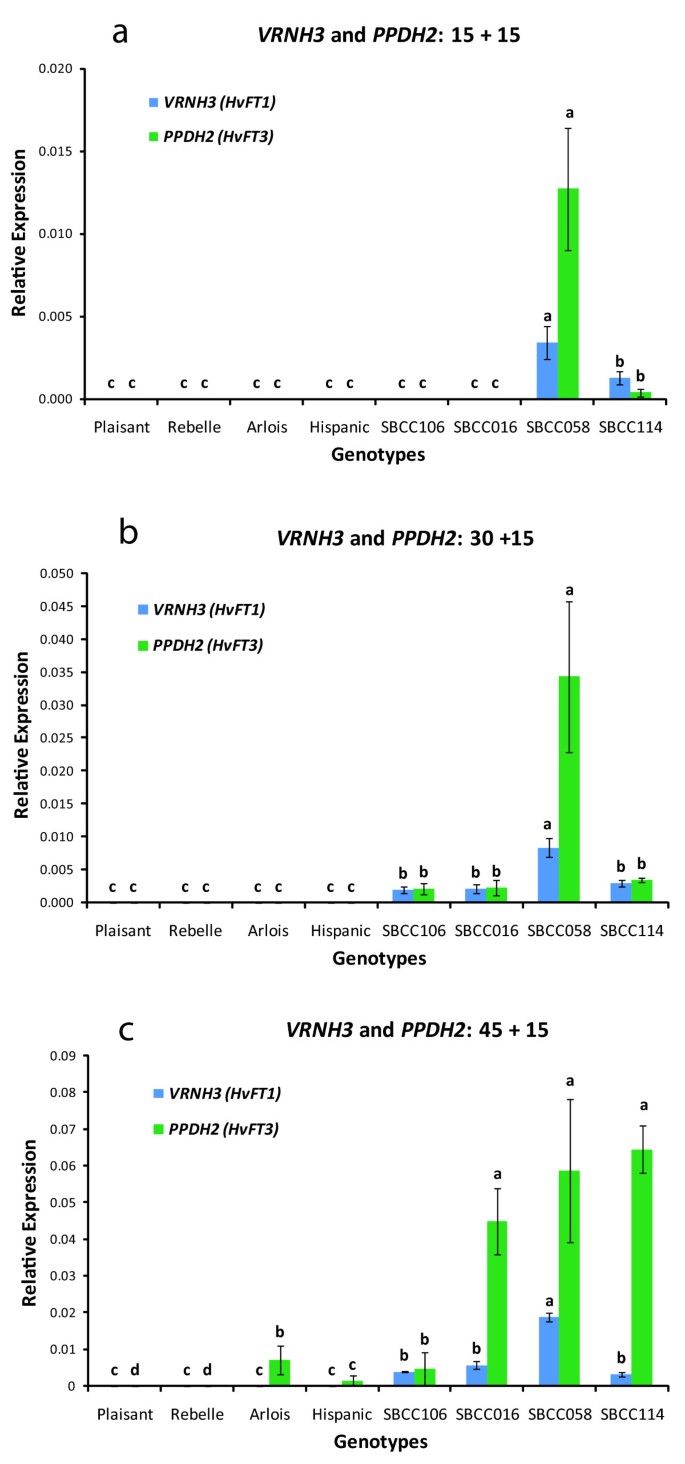
研究了4个典型冬季品种和4个西班牙地方品种的8个大麦品系春化和光周期反应基因的表达(表1)2).在短日照条件下,将这些品系暴露于增加长度的低温处理(15、30或45天),在每种情况下,在长日照条件下(16小时光照)生长15天。所有的基因型都携带VRNH2还有长光周期敏感等位基因PPDH1这使得观察这些基因与其他春化和光周期基因之间可能的相互作用成为可能。采用定量反转录PCR (qRT-PCR)检测春化和光周期反应基因表达谱;数据1而且2).基因型和处理之间的表达差异VRNH1,VRNH2,VRNH3,PPDH2.尽管表达式数据PPDH1也进行了分析,其表达方式未见图1而且2因为它在所有治疗和基因型中都一直很高,因此对观察到的反应的可变性没有贡献。
在所有基因型中,VRNH1随着春化处理时间的延长,表达量逐渐增加VRNH1等位基因很明显。冷处理15 d后,VRNH1仅在内含子1(等位基因)缺失较大~4 KB的基因型中检测到表达VRNH1-4),即SBCC058及SBCC114(图1).的水平VRNH1在SBCC058中表达明显高于SBCC114(图2)1).春化30 d后,VRNH1在5个基因型中检测到表达(图1 b).VRNH1只有在冷处理45 d后,才检测到所有基因型的表达1 c).表达量最高的是VRNH1-4而且VRNH1-6等位基因(即SBCC106和SBCC016)最低,野生型隐性冬季等位基因最低vrnH1由普莱桑特、雷贝尔、阿洛伊斯和西班牙人携带。尽管这四个品种携带相同的基因VRNH1等位基因,他们表现出差异VRNH1表达式(图1 c).
虽然所有的线路都带着主动VRNH2等位基因,其表达差异观察(图1得了),并依赖于VRNH1等位基因。四个品种中携带vrnH1等位基因,表达VRNH2Plaisant和Rebelle组比Arlois和Hispanic组高得多,除了最短的冷处理(图1).
SBCC058的含量最高VRNH3所有条件下的表达式(图2 a - c).春化15 d后,VRNH3仅在SBCC058和SBCC114中检测到(图2).VRNH3SBCC106和SBCC016在冷处理30 d后才检测到表达2 b).在实验条件下,VRNH3在携带野生型冬季等位基因的4个品种中未检测到表达vrnH1.
的表达PPDH2均在携带该基因的所有基因型中检测到,即除Plaisant和Rebelle外的所有基因型均检测到(图2 a - c).的水平PPDH2表达随春化时间的延长而增加(图2 a - c),尽管不同基因型的增加速度有所不同。冷处理15 d后,只有SBCC058表达显著PPDH2.在SBCC114, SBCC106和SBCC016中,PPHD2春化30 d后检测到表达,但Arlois或Hispanic直到冷处理45 d后才检测到表达(图2 a - c).
的影响VRNH3,PPDH1,PPDH2不同春化处理对冬季品种抽穗期的影响
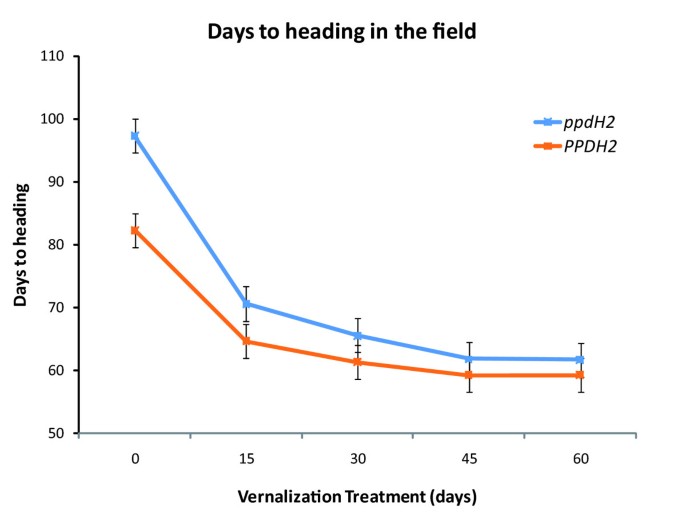
为了评估主要的春化和光周期反应基因在自然条件下对开花时间的可能影响,我们分析了70个冬季栽培品种从种植到抽穗的时间,这些品种暴露在5个不同的春化时期(从0到60 d),然后于3月25日移植到匈牙利Martonvásár的田间th,对应日长为12 h 25 min。大麦系及其主要花期基因的遗传构成在附加文件中列出3..所有的株系都携带在VRNH2.虽然已经报道了候选基因的多态性ZCCT-H家庭),VRNH2似乎在冬大麦中相当保守,通常假设只有两个等位基因[12].我们评估了两者之间的差异PPDH1,PPDH2,VRNH3等位基因作为春化持续时间的函数(表3.).这是可能的,因为在这三个基因组合的8个类别中,每个类别都有足够的个体来进行分析。虽然栽培品种呈现出三种不同VRNH1等位基因(都表现出对春化的反应),它们在样本中的分布如此不均匀(60vrnH1,五VRNH1-6,五VRNH1-4),以至于在分析中不可能把它作为一个额外的因素。3个基因均对花期有显著影响。平均来说,显性等位基因在PPDH1使开花时间提前4 dPPDH2开花时间提前6 d,基因型为TC单倍型VRNH3提前2天开花。不同春化时间对开花时间的影响与冬季基因型的预期一致。
在本分析中,两者之间存在显著的相互作用PPDH2并对不同的冷处理进行了检测(图3.).移栽前低温处理可缩短抽穗时间,但春化处理超过30 d后,缩短时间不显著PPDH2等位基因与未完全春化的植物开花时间提前有关(冷处理0或15 d;数字3.).
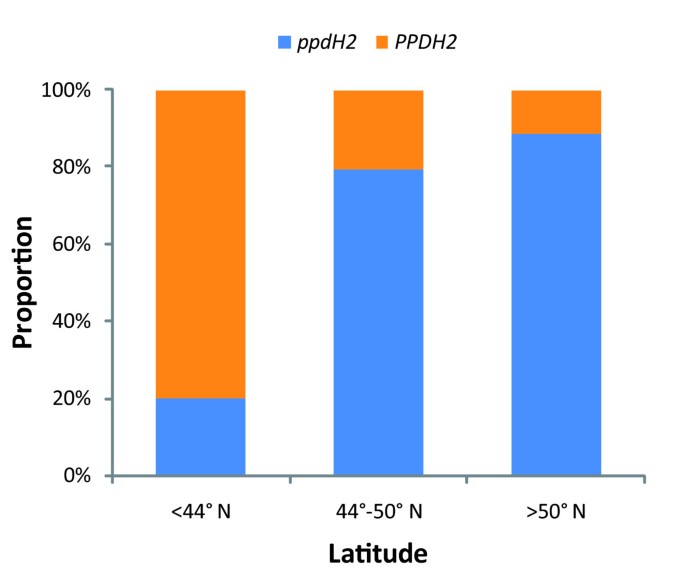
我们还分析了125个冬大麦品种的地理分布,并根据它们的预测表型进行了完整的分析HvFT3基因,并根据纬度分为三类。的PPDH2在南纬地区冬季栽培品种中,显性等位基因占优势,而隐性等位基因所占比例较低ppdH2在高纬度地区更大(图4).
讨论
抽穗期是大麦适应不同栽培地区和种植季节的重要性状。传统上,根据开花习性将栽培品种分为春季型、兼性型和冬季型。这是一种基于表型行为的农艺分类。这是一种有用的简化,总结了在遗传水平上更复杂和多样化的一系列反应。对谷物光周期和春化途径相关基因的研究不断提供新的信息,揭示了品种适应的本质以及单个品种携带的光周期和春化基因组合所产生的表型反应的多样性。
PPDH2大麦种质资源不是随机分布的吗
栽培大麦在其原产地以外的传播是由表型变异的发生所驱动的,这种表型变异是由新的多位点开花时间单倍型的出现所引起的VRNH1,VRNH2,PPDH1,PPDH2[32].突变VRNH1允许种植大麦从中纬度地区扩展到低纬度和高纬度地区,在这些地区春季类型很常见[29,32,34].大麦通过几种途径进入欧洲[34];其中一条向北,然后向西,经过巴尔干半岛,另一条向西南,然后穿过北非,通过西班牙到达欧洲。在第一种情况下,环境条件(漫长的冬季,比地中海地区更短的白天)有利于隐性等位基因PPDH2所以它的频率在冬季显著增加。在后一种情况下,祖先的形式不是从冬季大麦中挑选出来的,这正是西班牙本土的情况。
在中纬度地区,包括北非、南欧、尼泊尔、中国和日本,春大麦和冬大麦都有种植。然而,在这些地区,二分农艺分类不足以描述所发现的春化响应范围VRNH1起着核心作用。等位基因多样性在VRNH1已被几位作者描述过[11- - - - - -14].这种多样性是基因第一个内含子缺失或插入的结果,并与从严冬到春季类型的春化反应的等级有关。一般来说,删除量越大,所需的春化周期越短。
虽然,最初,野生大麦携带光周期反应等位基因PPDH1而且PPDH2(显性等位基因)、突变等位基因、驯化前无反应等位基因[32].无反应的表象ppdh1等位基因使得大麦种植传播到更北方的地区[30.].关于PPDH2,一些作者已经指出优势等位基因在春季品种中普遍存在,而在冬季品种中相对稀缺[21,31].在目前的研究中,我们只对冬季类型进行了研究,我们发现,占主导地位PPDH2等位基因在低纬度地区(<44°N)出现频率较高,在高纬度地区不出现。显性等位基因在伊比利亚半岛(35-44°N)种植的大量冬季本地人种中也普遍存在。这种模式是显著的,因为纬度低于北纬44°的地区几乎包括整个地中海地区。在这个地区,大麦主要在秋季播种,在很大程度上使用冬季品种。
的适应作用PPDH2通过对关键农艺性状的影响证实。它最初被鉴定为冬春大麦组合中的短光周期数量性状位点[1,35].它的影响在地中海纬度地区尤其大,在那里它已被确定为影响开花的主要QTLEam6[35,36].在地中海条件下,它还通过花期间接影响粮食产量[37].
PPDH2在冬季品种中,春化途径介导表达
基因表达的分析可以提供指示的作用PPDH2以及相互作用的基因。为了对地中海地区有意义,我们选择用冬季基因型进行这项研究,这与以往的研究不同[21,22的影响PPDH2关于春季基因型。
光周期反应基因与春化反应基因的表达具有很强的相互作用[6,26,28].长光周期诱导VRNH2表达式[19],然后抑制表达VRNH3[9),PPDH2[14].目前公认的模型认为,在秋季和冬季(低温和短日照),春化诱导VRNH1表达和短光周期下调VRNH2表达式[2,19].随后,在春天,VRNH1相对较高,如果春化足够快得多。虽然春天的长光周期条件有利于VRNH2表达式,VRNH2是被压抑的表达VRNH1.一旦春化要求得到满足,VRNH3表达是由长时间的工作引起的[9],之后植物就不可逆转地开始繁殖发育。
在我们的表达分析中,我们比较了三种不同的VRNH1等位基因。在每个检测的时间点上,携带全长内含子的四个冬季品种的表达水平低于携带两种不同缺失的四个SBCC品系。如先前建议的[19],春化未阻断诱导VRNH2在长时间冷处理15或30 d后,检测到日数的增加。一次VRNH1表达出来了,它就可以开始压抑了吗VRNH2表达式。然而,在携带严冬等位基因的4个冬季品种中,观察到的反应差异VRNH1是意想不到的。其中两个品种(Plaisant和Rebelle)表现如预期;需要较长时间(45 d)的冷诱导来检测VRNH1表达式。有趣的是,对于另外两个品种(Arlois和西班牙),我们检测到表达VRNH1仅冷处理30 d后,45 d后转录水平进一步升高。这四个品种携带相同的,隐性等位基因在VRNH1而且VRNH3,显性等位基因在VRNH2而且PPDH1.在被研究的基因中,它们只在PPDH2,这使我们想到该基因可能在早期诱导VRNH1表达式。然而,我们不能排除其他基因可能对这种诱导负责的可能性。
在之前的研究中,我们没有检测到VRNH3在长光周期下不进行春化处理(SBCC058和Plaisant)或在短光周期下进行春化处理(SBCC058、SBCC106和Plaisant)时,这些基因型在某些基因型中的表达情况有所不同[14].在冬季基因型中,需要一段时间的冷诱导VRNH3如已报道的野生型,长时间的工作可以诱导表达vrnH1冬季等位基因[9].在本研究中,我们纳入了代表几个隐性等位基因的品种VRNH3,因为我们之前有证据表明,这些品种在田间的抽穗期可能会产生差异[23].之间的不同表达VRNH3等位基因只在基因中缺失最大的一对染色体上被检测到VRNH1(SBCC058及SBCC114)。TC等位基因比AG等位基因表现出更高的表达,与之前研究报道的方向相同[23].然而,在VRNH3在SBCC016和SBCC106之间表达,在位点上表现出相同的多态性VRNH3其中SBCC114和SBCC058属属。要么是实验的持续时间不足以揭示可能的差异,要么是目前尚未解释的其他基因影响了这一途径。
尽管表达PPDH2在短光周期下是更高的,我们和其他作者[14,22据报道PPDH2长光周期下的表达。的表达PPDH2在所有携带显性等位基因的基因型中都在某个时间点被检测到PPDH2,与白天长短无关。冬季基因型,VRNH2必须缺席或明显后退(要么是因为在短时间内缺乏诱导,要么是因为表达的压抑VRNH1)PPDH2被表达。
PPDH2在非诱导条件下促进开花,不受光周期影响
另一个问题是关于角色的性质PPDH2.PPDH2已提出影响茎尖分生组织由营养性向生殖性转变的促进作用,最终影响开花。然而,支持这一假设的两个实验提出了不同的作用模式PPDH2.一方面[21],有人提议HvFT3(PPDH2)代替HvFT1(VRNH3)作为诱导短日(8小时)开花的触发因子,但其表达不足以诱导向生殖期过渡。他们没有发现HvFT1(VRNH3)光照8 h诱导,即使在分生组织发生转变后也未发生诱导。另一项研究[22],得出结论说HvFT3在短时间内(本次为12小时)起促花作用,但通过诱导HvFT1(VRNH3).因此,似乎证明了PPDH2促进短日照下开花,但其作用机制尚不清楚。刚刚报道的实验使用了不同的基因型,更重要的是,不同的日长。基因诱导的差异可能是由于这些基因表达所需的临界日长阈值不同造成的。在任何情况下,这些研究中测试的所有基因型都是春系,而相互作用PPDH2在冬季春化途径中,基因型在基因表达水平上仍未被探索。
通过同时研究开花反应基因的表达,我们观察到VRNH1而且PPDH2都表达过了VRNH3在所有6个春化反应基因型测试。我们的结果与Higgins等人提出的比较模型一致。[28].在这个方案中,PPDH2促进VRNH1短日条件下的表达式。我们建议PPDH2对冬季栽培品种具有更普遍的作用,并在所有非诱导条件下促进开花,即在没有满足其春化要求的植物中,在短日照或长日照下。
这一假设得到了现场试验观察的支持。我们试验的起航日期为5月10日th直到7月13日th.植株经历的光周期由移栽时的12 h 25 min增加到第一个基因型抽穗时的14 h 53 min,并持续增加到6月21日的15 h 58 min圣.因此,植株的大部分生长期都发生在远高于12 h的光周期内PPDH1而且PPDH2开花,这与这两个基因在12 h光周期下发现的同时效应一致[38].在每年的这段时间(5 - 7月),甚至更早,在温带地区进行的实验中,长日照对抽穗期的影响可以通过其对抽穗期的影响来检测PPDH1[39].
携带优势种的冬季基因型抽穗期明显较早PPDH2等位基因比具有隐性等位基因的品种要高。这种差异在没有春化或只经历过短暂寒冷期的植物中尤其明显。所使用的70个基因型可能在早发性上表现出一些内在差异本身这可能解释了一些可以归因于PPDH2作为主要因素。然而,头球的差异是由PPDH2随着春化时间的增加而逐渐减少。这种相互作用PPDH2且春化处理时间相当可靠,且与处理作用一致PPDH2上面的建议。其他作者[40]也报道了PPDH2在较长光周期下的开花时间,但只有在同步光周期和热周期的应用下,并且在开花时存在特定的等位基因配置PPDH1而且VRNH1位点。
冬季基因型通常在冬季暴露于充分春化的地区栽培。因此,这些基因型不需要表达其他促进开花的基因。相比之下,在春季品种中,PPDH2可以促进开花,保证及时完成这样一个短暂的生命周期。然而,在对春化要求较低的冬季品种中,例如那些适应传统上冬季温和的地理区域的品种,例如地中海气候,存在PPDH2可能有助于在春化要求尚未完全满足时诱导开花(在伊比利亚半岛的自然条件下,这是一种并不罕见的现象)。这可以解释为什么大多数SBCC冬季线携带优势PPDH2等位基因。SBCC冬季线路适应了典型的地中海温和冬季,那里的温度不是很低。如果冷期不足以满足这些基因型的春化要求,PPDH2是否可以作为一种补偿机制来加速开花,并确保开花发生在最佳时间,可能在敏感的影响之前PPDH1是明显的。在一些大麦和小麦品种中,春化的要求可以部分或完全通过暴露于短光周期来取代[18,41,42].这种现象被称为短日春化现象[42冬季等位基因在大麦基因型中已被报道VRNH1而且VRNH2和占主导地位的PPDH2[1,35].在这些基因型中,可以发生两种短日长日诱导开花的过程[18].这种双重机制存在于许多物种中,包括许多Festucoideae[43].金和海德[43,提出“……作为一种进化机制,替代短日/春化初级诱导系统的多功能性提供了一种美丽的安全机制,在冬季寒冷不足的情况下,短日作为备选方案。”的参与VRN2Dubcovsky等人已经提出了这种机制的遗传基础[18],因为“光周期和春化信号的收敛在VRN2基因,为短日处理和春化处理的互换性提供了可能的解释。”
支配者的存在PPDH2在春化不可避免地年复一年发生的条件下,等位基因是不必要的,因为它在更北纬的地区很常见。事实上,其他作者声称,显性等位基因的存在PPDH2不是冬大麦的理想特征[44,45],因为这会导致花期过早[21],会造成不良的农艺后果,包括抗冻性的丧失。对于严冬品种来说,这可能是真的vrnH1等位基因加上显性基因VRNH2)在偏北纬地区。无效的、晚开花的等位基因更适合于秋季播种的品种,因为它能使植物更长时间地处于营养生长阶段[46],可能是通过维持耐低温基因的表达[47].在这些研究的基础上,消极农艺效应占主导地位PPDH2应该研究等位基因,特别是与耐寒性有关的等位基因。然而,一个主要的PPDH2等位基因可能是在冬季不那么寒冷的地理区域栽培的品种的一个很好的选择。伊比利亚半岛大麦地方品种的适应综合征似乎是一种合适的组合VRNH1显性等位基因PPDH1,以确保开花将在温度上升过高之前发生,并以一个主导PPDH2确保植物生长即使在没有完全春化的年份也不会太迟。
结论
同时研究参与春化和光周期途径的主要基因是至关重要的,因为这可以更准确地解释这些基因的相互作用和功能,并阐明它们在开花诱导中的作用。
的核心作用有广泛的共识VRNH1大麦开花进程的控制。然而,不同的开花时间反应似乎是由其他春化和光周期基因上的等位基因所调节的VRNH2,VRNH3,PPDH1,PPDH2.在这些基因中,PPDH2可能在调节方面有重要作用VRNH1特别是在较长的光周期下,通过上调VRNH1表达和间接减少了花开花落的时间。
PPDH2在广泛的冬季基因型中,对抽穗期有很强的影响。的显性等位基因PPDH2在未满足春化要求的植物中,在长日照条件下加速开花。存在PPDH2在SBCC的大多数冬季地域性来源系中,表明该等位基因可以促进对冬季温和的地理区域的适应,如地中海环境。
我们也建议PPDH2 -本研究提出的依赖机制可以与受控制的机制互补PPDH1.敏感的PPDH1等位基因是典型的冬季品种和PPDH2多见于春季栽培品种。这两种机制在不同环境下促进开花。此外,在地中海环境中,这两种机制可以结合起来,以促进最佳条件下的开花。
方法
基因分型
一套162个大麦基因型(附加文件1)和来自SBCC的159个地方品种的春化基因分型(VRNH1,VRNH2,VRNH3)和光周期(PPDH1而且PPDH2)先前所述的基因[14,23].对每个加入的单株进行基因分型,部分在ARI-HAS(匈牙利),部分在EEAD-CSIC(西班牙)。
基因表达分析
植物材料
选择了8个大麦冬季基因型,以评估参与温度和光周期响应的5个主要基因的表达差异。基因型包括法国品种Rebelle ((Barbarrosa × Monarca) × Pirate)、Plaisant (Ager × Nymphe)、西班牙品种Mosar × (Flika × Lada)和Arlois(未知谱系),以及来自当地品种的四个自交系,属于SBCC [33].研究的基因型有不同VRNH1-VRNH3等位基因组合和均可归类为“冬季”基因型。基因型可以分为四对,每对都有相同的基因型VRNH1等位基因,由第一个内含子的长度来定义。每对定义的基础上VRNH1结构为多态的VRNH3(表2),由内含子1中的单核苷酸多态性(SNPs)定义,如先前报道[20.],并由启动子区域的indels [23].所有基因型均携带一种活性VRNH2敏感等位基因在PPDH1,和所有的携带PPDH2除Rebelle和Plaisant外的其他功能等位基因(表2).
植物生长条件
为了进行表达研究,将8种基因型的种子播种在花盆中,并在19±1°C、光照16小时/暗8小时的光照周期下在阳光照射的温室中发芽。播种后10天,植株达到双叶期(Z12, Zadoks鳞片[48])后,将幼苗移至生长室,在短光周期(光照8 h /暗16 h)、弱光强(12 μmol m)条件下,在7±1℃的条件下光照15、30和45 d-2年代-1).春化后,在光照强度为220 μmol m、光照周期为16 h /8 h的条件下,依次移栽到温度为22±1℃的附加生长室中-2年代-1,在那里保存15 d,然后收获整个幼苗,不包括根组织。收获发生在光明期的中期。每个采样时间点和基因型采集4株植物,并作为4个生物重复处理。
RT-PCR和real-time PCR分析
RNA的提取和cDNA的制备遵循先前报道的方法[14].对所有采集的样品进行qRT-PCR检测。扩增在20 μl反应中进行,其中SYBR Green Quantimix Easy SYG Kit (Biotools, Madrid, Spain) 10 μl,每个引物0.3 μM, 4 mM MgCl2,表达cDNA 4 μl,对应总RNA 300 ng。反应在ABI7500实时PCR系统(应用生物系统公司)上进行。骑行条件VRNH1,VRNH2,VRNH3,肌动蛋白,PPDH2在95°C下为6分钟,然后在95°C下为15秒,在60°C下为15秒,在72°C下为50秒,然后立即进行熔化曲线程序(60-95°C)。在72°C下的延伸步骤和熔化曲线程序期间获得荧光数据。对于每种cdna -引物组合,每个样品进行两次相同的反应(技术重复)。水平的肌动蛋白表达也被定量在同一运行作为内部控制。对4个生物重复序列进行了分析,结果显示出相似的趋势。表达水平的计算使用ABI 7500软件包(应用生物系统公司)。将各时间点的基因表达归一化为肌动蛋白.
基因表达差异的统计分析
利用SAS中方差分析(ANOVA)程序评估基因型和处理之间相对表达的差异[49].用于分析每种治疗和基因型的变量为ΔCT(CT肌动蛋白- CT目标基因)。这个变量比更常用的2更受欢迎——ΔCT由于对其用于统计分析所表达的担忧[50].方差分析模型包括生物复制、基因型、治疗和基因型与治疗的相互作用。基因型和处理被认为是固定因素。生物重复序列及其与其他因子的相互作用所产生的变异性被用作检验基因型和治疗及其相互作用的误差项。对方差分析中有显著性的主要影响进行多均值分离,采用最小显著性差异(LSD)检验(P < 0.05)。分析中包含的每个值都是两次技术重复的平均值,以防止读数的轻微波动和小的移液误差。
春化处理后冬季品种的田间试验
一组70个冬大麦基因型对春化的敏感性和随后的开花行为(附加文件)3.)进行评估。根据前面描述的程序,使用Martonvásár Phytotron(匈牙利)施加春化期[51].在温度为3℃、光照周期为8 h /暗光照周期为16 h、弱光强(12-13 μmol m-2年代-1).3月25日,春化后的幼苗被人工移栽到匈牙利Martonvásár的田间th,当时平均光周期为12小时。对两株植物进行了基因型和处理评估。对于每株植物,开花天数(Z49, Zadoks scale [48)被得分。试验在100 d后终止。未抽穗的植株按150 d抽穗。
现场试验的统计分析
采用方差分析(ANOVA)分析离抽穗天数的差异。VRNH3,PPDH1,PPDH2以春化处理为固定主要因素。复制被嵌套成基因型。在Genstat 13 (VSN International, Hemel Hempstead, UK)中进行方差分析,使用限制性最大似然(REML)来解释每个细胞中不相等的单位数。双向交互也包括在模型中。考虑到所有的冬季栽培品种都携带冬季生长习性的等位基因组合VRNH1而且VRNH2,统计分析中未考虑这两个基因。所有VRNH1等位基因被聚集,因为种群在这个位点上非常不平衡(60个基因型携带隐性基因vrnH1等位基因,五附身VRNH1-4,其中五个包含VRNH1-6),纳入这个因素意味着分析无法进行。
参考文献
- 1.
Laurie DA, Pratchett N, Bezant JH, Snape JW:冬春大麦开花时间5个主要基因和8个数量性状位点的RFLP定位大麦芽l .十字架。中国生物医学工程学报,1995,38:575-585。10.1139 / g95 - 074。
- 2.
崔维琪,李志刚,李志刚,李志刚,李志刚:MADS盒基因对小麦春化诱导开花的调控作用。美国国家科学院。2003, 30(4): 457 - 457。10.1073 / pnas.1635053100。
- 3.
Flood RG, Halloran GM:小麦春化反应基因作用的性质和持续时间。王志强,2004,34(3):363-368。
- 4.
李志刚,李志刚,李志刚,李志刚。水稻春化诱导开花的分子生物学研究。植物科学进展,2007,12:352-357。10.1016 / j.tplants.2007.06.010。
- 5.
高桥R,安田S:大麦早熟性和生长习性的遗传学研究。大麦遗传学2。编辑:Nilan RA华盛顿州立大学出版社,普尔曼,华盛顿州;1971:388 - 408。
- 6.
李春华,李春华,李春华,等。植物开花过程的调控。植物学报,2009,12:178-184。10.1016 / j.pbi.2008.12.010。
- 7.
Karsai I, szcs P, Mészáros K, Filichkina T, Hayes PM, Skinner JS, Láng L, bedz: TheVRN-H2基因座是兼性冬生大麦开花时间的主要决定因素大麦芽L.测绘人口。应用理论与实践,2005,30(1):1 - 4。10.1007 / s00122 - 005 - 1979 - 7。
- 8.
Trevaskis B:中心角色VERNALIZATION1谷物春化反应中的基因。植物学报,2010,37:479-487。10.1071 / FP10056。
- 9.
Hemming MN, Peacock WJ, Dennis ES, Trevaskis B:低温和白天长度的线索被整合来调节开花位点t在大麦。植物科学学报,2008,27(3):359 -366。10.1104 / pp.108.116418。
- 10.
傅东,闫琳,李文杰,李文杰,李文杰,李文杰,李文杰,等VRN-1与大麦和小麦的春季生长习性有关。中国生物医学工程学报,2005,27(3):344 - 344。10.1007 / s00438 - 004 - 1095 - 4。
- 11.
Cockram J, Chiapparino E, Taylor SA, Stamati K, Donini P, Laurie DA, O'Sullivan DM:欧洲大麦种质春化位点的单倍型分析VRN-H1等位基因和主导冬季VRN-H1 / VRN-H2多位点单体型。理论与应用,2007,29(3):344 - 344。10.1007 / s00122 - 007 - 0626 - x。
- 12.
沈振聪P, Skinner JS, Karsai I, custa - marcos A, Haggard KG, Corey AE, Chen THH, Hayes PM:验证VRN-H2 / VRN-H1大麦的上位论模型揭示了大麦中内含子长度的变异VRN-H1可能解释了春化敏感性的连续统。中国生物医学工程学报,2007,27(3):344 - 344。10.1007 / s00438 - 006 - 0195 - 8。
- 13.
Hemming MN, Fieg S, Peacock WJ, Dennis ES, Trevaskis B:与大麦抑制相关的区域(大麦芽)VERNALIZATION1冷诱导不需要基因。中国生物医学工程学报,2009,28(3):344 - 344。10.1007 / s00438 - 009 - 0449 - 3。
- 14.
Casao MC, Igartua E, Karsai I, Lasa JM, Gracia MP, Casas AM:大麦春化和日长响应基因的表达分析(大麦芽l)表示VRNH2是压抑者PPDH2(HvFT3)在漫长的白天。实验研究学报,2011,29(3):344 - 344。10.1093 / jxb / erq382。
- 15.
Yan L, Loukoianov A, Blechl A, Tranquilli G, Ramakrishna W, SanMiguel P, Bennetzen JL, Echenique V, Dubcovsky J:小麦VRN2基因是一种因春化而下调的开花抑制因子。科学通报,2004,30(3):344 - 344。10.1126 / science.1094305。
- 16.
陈晨,闫玲,陈晨,等。水稻水稻等位基因变异的分子特征分析VRN-H2大麦春化位点。动物遗传学报,2005,15:395-407。10.1007 / s11032 - 005 - 0084 - 6。
- 17.
von Zitzewitz J, szcs P, Dubcovsky J, Yan L, Pecchioni N, Francia E, Casas A, Chen THH, Hayes PM, Skinner JS:大麦春化基因的分子和结构特征。植物化学学报,2005,29(4):449-467。10.1007 / s11103 - 005 - 0351 - 2。
- 18.
Dubcovsky J, Loukoianov A, Fu D, Valarik M, Sanchez A, Yan L:光周期对小麦春化基因调控的影响VRN1而且VRN2.中国生物医学工程学报,2006,30(4):489 - 489。10.1007 / s11103 - 005 - 4814 - 2。
- 19.
Trevaskis B, Hemming MN, Peacock WJ, Dennis ES:HvVRN2响应白昼长度,而HvVRN1受春化和发育状态的调节。植物科学进展,2006,30(4):457 - 457。10.1104 / pp.105.073486。
- 20.
闫玲,傅东,李晨,Blechl A, Tranquilli G, Bonafede M, Sanchez A, Valarik M, Dubcovsky J:小麦和大麦春化基因VRN3的正交系英国《金融时报》.美国国家科学院。2006, 30(4): 457 - 457。10.1073 / pnas.0607142103。
- 21.
福雷,希金斯J,特纳A,劳里DA:开花位点t类似大麦中的基因家族大麦芽.遗传学报,2007,27(3):344 - 344。10.1534 / genetics.106.069500。
- 22.
Kikuchi R, Kawahigashi H, Ando T, Tonooka T, Handa H:大麦PEBP基因的分子和功能特征揭示了它们在开花过程中作用的多样化。中国生物医学工程学报,2009,29(3):344 - 344。10.1104 / pp.108.132134。
- 23.
Casas AM, Djemel A, Ciudad FJ, Yahiaoui S, Ponce LJ, Contreras-Moreira B, Gracia MP, Lasa JM, Igartua E:HvFT1(VrnH3)驱动西班牙大麦的纬度适应。应用物理学报,2011,29(3):344 - 344。
- 24.
李志刚,李志刚,李志刚,李志刚:水稻2号染色体短臂光周期反应基因的遗传分析大麦vulgare.遗传与遗传学报,1994,27(3):366 - 366。10.1038 / hdy.1994.85。
- 25.
Turner A, Beales J, Faure S, Dunford RP, Laurie DA:伪响应调节器Ppd-H1提供大麦对光周期的适应。科学通报,2005,30(3):344 - 344。10.1126 / science.1117619。
- 26.
葛丽萍,张志刚,张志刚,张志刚,张志刚。植物季节性开花响应的分子生物学研究进展拟南芥还有麦片。学报学报,2009,39(3):344 - 344。10.1093 / aob / mcp063。
- 27.
Shimada S, Ogawa T, Kitagawa S, Suzuki T, Ikari C, Shitsukawa N, Abe T, Kawahigashi H, Kikuchi R, Handa H, Murai K:小麦叶片开花时间基因的遗传网络APETALA1 / FRUITFULL例如基因,VRN1的上游开花位点t.植物学报,2009,38(3):344 - 344。10.1111 / j.1365 - 313 x.2009.03806.x。
- 28.
杨晓明,杨晓明,张晓明:植物开花时间通路的比较基因组学研究Brachypodium distachyon作为温带草的模型。公共科学学报,2010,5:e10065-10.1371/journal.pone.0010065。
- 29.
谢正东,李志刚,李志刚,李志刚:大麦春化需求的自然变异:东亚地区大麦冬季生长习性的数量变异及其适应性。中国生物医学工程学报,2011,27(3):344 - 344。10.1093 /卡式肺囊虫肺炎/ pcr049。
- 30.
Jones H, Leigh FJ, Mackay I, Bower MA, Smith LMJ, Charles MP, Jones G, Jones MK, Brown TA, Powell W:基于群体的重测序揭示了栽培大麦的开花时间适应性起源于新月沃土以东。中国生物医学工程学报,2008,25:2211-2219。10.1093 / molbev / msn167。
- 31.
custa - marcos A, szcs P, Close TJ, Filichkin T, Muehlbauer GJ, Smith KP, Hayes PM:大麦生长习性和花序基因的全基因组SNPs和重测序:不同大小和结构种质阵列关联定位的意义。BMC基因组学杂志,2010,11:707-10.1186/1471-2164-11-707。
- 32.
野生大麦和栽培大麦开花时间位点的遗传变异。植物资源学报,2011,29(3):344 - 344。10.1017 / S1479262111000505。
- 33.
Igartua E, Gracia MP, Lasa JM, Medina B, Molina-Cano JL, Montoya JL, Romagosa I:西班牙大麦核心系列。中国农业科学,2004,27(4):489 - 497。10.1023 /: 1008662515059。
- 34.
von Bothmer R, Sato K, Komatsuda T, Yasuda S, Fischbeck G:栽培大麦的驯化。大麦的多样性。编辑:Bothmer R von, Hintum T van, Knüpffer H, Sato K.阿姆斯特丹:ElsevierScience;2003:9-27。
- 35.
Cuesta-Marcos A, Igartua E, Ciudad FJ, Codesal P, Russell JR, Molina-Cano JL, Moralejo M, szcs P, Gracia MP, Lasa JM, Casas AM:地中海环境下春冬大麦杂交抽穗期QTL评价动物遗传学报,2008,21:455-471。10.1007 / s11032 - 007 - 9145 - 3。
- 36.
Boyd WJR, Li CD, Grime CR, Cakir M, Potipibool S, Kaveeta L, Men S, Kamali MRJ, Barr AR, Moody DB, Lance RCM, Logue SJ, Raman H, Rea BJ:春大麦抽穗时间变异影响因素的常规和分子遗传分析(大麦芽L)在温和的冬季生长季节生长的基因型。德国农业科学,2003,29(4):457 - 457。10.1071 / AR03014。
- 37.
Cuesta-Marcos A, Casas AM, Hayes PM, Gracia MP, Lasa JM, Ciudad F, Codesal P, Molina-Cano JL, Igartua E:受抽穗期影响的地中海大麦产量QTL植物科学学报,2009,29(3):344 - 344。10.1111 / j.1439-0523.2008.01510.x。
- 38.
Sameri M, Pourkheirandish M, Chen G, Tonooka T, Komatsuda T:大麦光周期响应和非响应开花时间QTL的检测。育种科学,2011,61:183-188。10.1270 / jsbbs.61.183。
- 39.
Cuesta-Marcos A, Casas AM, Yahiaoui S, Gracia MP, Lasa JM, Igartua E:大麦小群体间互联抽穗期QTL的联合分析。动物遗传学报,2008,21:383-399。10.1007 / s11032 - 007 - 9139 - 1。
- 40.
Karsai I, szcs P, kszegi B, Hayes PM, Casas AM, bedz Z, Veisz O:光周期和热周期对大麦开花时间的影响:一种遗传表型学方法。应用物理学报,2008,39(2):379 - 379。10.1093 / jxb / ern131。
- 41.
Evans LT:一些冬小麦品种的短日诱导花序形成。中国植物学报,1997,26(4):457 - 457。
- 42.
罗伯华,夏默菲尔德RJ,库柏JP,埃利斯RH:大麦开花的环境控制(大麦芽L). I光周期限制长日响应、光周期不敏感相位以及低温和短日春化的影响。安Bot-London。1988, 32(3): 344 - 344。
- 43.
King RW, Heide OM:季节开花与进化:达尔文的遗产。植物学报,2009,36:1027-1036。10.1071 / FP09170。
- 44.
Muñoz-Amatriaín M, Cistué L,熊勇,Bilgic H, Budde AD, Schmitt MR, Smith KP, Hayes PM, Muehlbauer GJ:冬麦芽大麦的结构和功能表征。应用理论与实践,2010,30(3):344 - 344。10.1007 / s00122 - 009 - 1225 - 9。
- 45.
von Zitzewitz J, Cuesta-Marcos A, Condon F, Castro AJ, Chao S, Corey A, Filichkin T, Fisk SP, Gutierrez L, Haggard K, Karsai I, Muehlbauer GJ, Smith KP, Veisz O, Hayes PM:大麦抗寒性的遗传学:全基因组关联映射的视角。植物基因组学报,2011,4:76-91。10.3835 / plantgenome2010.12.0030。
- 46.
潘A, Hayes PM,陈峰,陈thh, Blake T, Wright S, Karsai I, Bedö Z:大麦抗寒性成分的遗传分析(大麦芽l .)。应用理论与实践,2004,19(3):379 - 379。
- 47.
Fowler DB, Breton G, Limin AE, Mahfoozi S, Sarhan F:光周期和温度对低温诱导大麦基因表达的调控作用。中国农业科学,2001,27(4):457 - 457。10.1104 / pp.010483。
- 48.
Zadoks JC, Chang TT, Konzak CF:谷物生长阶段的十进制编码。杂草法案1974,14:415-421。10.1111 / j.1365-3180.1974.tb01084.x。
- 49.
SAS Institute: SAS/STATTM用户指南Release 6.03版。Cary: SASInstitute, Inc;1998.
- 50.
Yuan JS, Reed A, Chen F, Stewart CN:实时PCR数据的统计分析。中国生物医学工程学报,2006,27(4):457 - 457。
- 51.
Karsai I, Hayes PM, Kling J, Matus IA, Mészáros K, Láng L, bedz, Sato K:水稻开穗期组成性状的遗传变异大麦芽无性系种群。spontaneum以受控环境为特征的接入物。作物科学,2004,44:1622-1632。10.2135 / cropsci2004.1622。
鸣谢及资助
本研究由西班牙科技部的AGL2007-63625、AGL2010-21929和HH2008-0013、欧洲区域发展基金和匈牙利科学研究基金(OTKA NK72913)资助。SBCC的种质资源由RFP2004-00015-00-00和RFP2009-00005-00-00项目资助。MCC获得了CSIC I3P博士预科奖学金的支持。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
手稿的想法是在AMC、MCC、EI和IK之间的讨论中产生的。MCC、EI和AMC构思了基因表达研究并参与了设计;IK和OV设计并进行了现场实验;MCC分析基因表达;IK和AMC进行基因分型并提出纬度分析;IK在田间试验中对表型进行评分;EI进行统计分析;MPG和OV提供了将结果置于农艺背景下的解释;世纪挑战公司起草了手稿;IK、EI、AMC对草案进行了彻底的修改。 All authors read and approved the final manuscript.
M Cristina Casao, Ildiko Karsai对这项工作做出了同样的贡献。
电子辅助材料
短日敏感性
附加文件1:。的性质和功能的描述PPDH2等位基因,与之前的文献报道相比。(doc 32kb)
本研究的大麦品种特征
附加文件2:。原产国,行号,出现的等位基因VRNH1,VRNH2,VRNH3,PPDH1,PPDH2提出了。(xls50kb)
纳入田间试验的冬大麦品种
附加文件3:。原产国,行数,生长习惯,出现的等位基因VRNH1,VRNH2,VRNH3,PPDH1,PPDH2,并介绍了信息的来源。(xls 30kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
卡索,m.c., Karsai, I., Igartua, E。et al。大麦适应暖冬的作用PPDH2.BMC植物生物学11日,164(2011)。https://doi.org/10.1186/1471-2229-11-164
收到了:
接受:
发表:
关键字
- 冷处理
- 显性等位基因
- 大麦品种
- 光周期短
- 冬大麦