摘要
背景
对于以大米为主食的人群来说,大米是膳食中镉(Cd)摄入量的主要来源。了解Cd是如何通过整个植物体进入谷物的,对于将水稻中的Cd浓度尽可能降低到最低水平,以减少相关的健康风险是必要的。在本研究中,我们可视化和定量分析了不同Cd浓度的典型水稻品种从根到籽粒的实时动态。我们使用正电子107Cd示踪剂和一种创新成像技术,正电子发射示踪成像系统(PETIS)。特别是,本工作首次实现了一种直接和实时显示培养中根系吸收Cd的新方法。
结果
图像分析和定量分析揭示了供试水稻品种根系Cd含量随时间变化曲线的不同模式(粳稻型)表现出快速的饱和曲线,而3个高cd积累品种(籼稻型)在30 min内出现峰值107补充Cd,随后急剧减少,导致根系中Cd浓度维持在较低水平。这种Cd动态差异可能与OsHMA3转运蛋白有关,该蛋白参与了Cd在根液泡中的储存,而在高Cd积累品种中不起作用。PETIS分析结果表明,Cd积累量高的品种具有Cd从根部向地上部转移快、Cd向穗部转移快、穗部Cd积累量高的特点。经过Cd浓度最高的茎节部分。
结论
这是利用PETIS(一种实时成像方法)首次成功地可视化和量化了Cd从根到完整植株中Cd浓度不同的完整植株的差异。
背景
镉(Cd)对农业有重要影响,因为从受污染的粮食作物中过量摄入镉可导致人类中毒。高剂量镉暴露对肾脏毒性特别大,并导致肾近端小管功能障碍[1].在日本,itai-itai以脊椎和腿骨疼痛为特征的疾病(肾骨软化症)被认为是一种由饮用水和谷物(主要是大米)的过量镉污染引起的慢性毒性。此后,日本根据1969年制定的《食品卫生法》,对大米中的Cd污染进行了监测,以防止其流向日本消费者。尽管如此,大米的Cd污染仍然严重威胁着日本人民和世界上其他以大米为主食的人口,因为大米是镉的主要饮食来源。了解镉是如何被水稻根吸收并随后运输到稻米中的,对于尽可能降低大米中的镉浓度,从而降低镉对人类健康的风险是必要的。
植物根系是Cd从土壤溶液中吸收的第一个入口点,从生理和遗传研究的角度对Cd进入根系的过程进行了很好的综述[2].含有可饱和动力学的剂量依赖性过程已经显示在几种综殖种植物的根源中,包括稻米[3.- - - - - -5].镉吸收的饱和特性可能由载体介导的系统控制,水稻遗传研究表明,铁(Fe)转运体OsIRT1和OsIRT2以及锌(Zn)转运体OsZIP1可介导根系对镉的吸收[6,7].Cd一旦进入根细胞,它通过根共浆向木质部的移动就会受到液泡隔离的限制[8].同时,Cd向木质部的质外体移动也会受到Cd胁迫下根系内胚层木质层发育的限制[2].近年来研究发现,不同水稻品种的籽粒Cd含量不同,根-茎Cd通过木质部转运速率的差异受磷的影响1 b- atp酶转运体OsHMA3,参与根液泡中Cd的封存[9,10].Cd在木质部的加载是由AtHMA2和AtHMA4介导的拟南芥[11,12].在水稻中,异体表达的功能测定OsHMA2研究表明,该基因是控制水稻Cd木质部装载的一个很好的候选基因[8].Cd从韧皮部卸载的过程也被认为是决定籽粒中Cd含量的关键因素,因为Cd通过韧皮部进入发育中的籽粒[13,14].Tanaka等人。[15当用相对高的CD水平处理水稻植物,在水培中的1μMCC中处理米植物时,将91-100%的水稻谷物中的CD沉积来自植物谷物。使用昆虫激光法,Kato等人。[16]收集了三个水稻品种最膨大叶片鞘中的韧皮部汁液,发现这些品种韧皮部汁液中的镉浓度与其籽粒镉浓度密切相关。如上所述,化学和遗传分析为eve提供了许多建议目前,需要通过对完整植物在营养期和生殖期中的镉运动进行全身和实时观察来提供全面的信息,以了解导致不同品种间镉浓度差异的整个植物系统。
一般来说,放射性同位素示踪剂是分析植物体内物质数量的空间分布或时间变化的有用工具。109Cd已被广泛用于可视化Cd在植物组织中的分布[17,18].例如,奇诺[17]观测到同位素Cd (109Cd和115米籽粒中Cd含量较低,叶片中Cd含量最低。然而,通过放射自显影只能得到Cd在给定时刻的静态分布。近年来,正电子发射示踪成像系统(PETIS)被用于研究完整的活体植物的各种生理功能[19,20.].该系统不仅可以像摄像机一样实时监测示踪剂在活体植物中的运动,还可以自由选择感兴趣区域(ROI),对感兴趣物质的运动进行定量分析。将该系统应用于几种禾草作物,利用正电子发射示踪剂研究了金属的吸收和转运52铁[21],52锰(22),而62锌(23].最近,Fujimaki等人[24]建立了利用正电子发射的Cd实时成像系统107Cd示踪剂和PETIS。采用连续图像法捕捉了粳稻(品种Nipponbare)营养和生殖阶段地上部Cd的运动,并定量分析了地上部Cd运移速度等参数。然而,由于高放射性培养液的干扰,一种直接成像地下部分的方法仍有待开发,该方法应能提供有关根系吸收的宝贵信息。
在这项研究中,我们将PETIS应用于我们的两个目标:实现对培养液中根系吸收镉的直接观察,并明确描述高镉积累品种和低镉积累品种之间从培养到籽粒的镉动态差异。
结果
根107不同水稻品种对镉的吸收
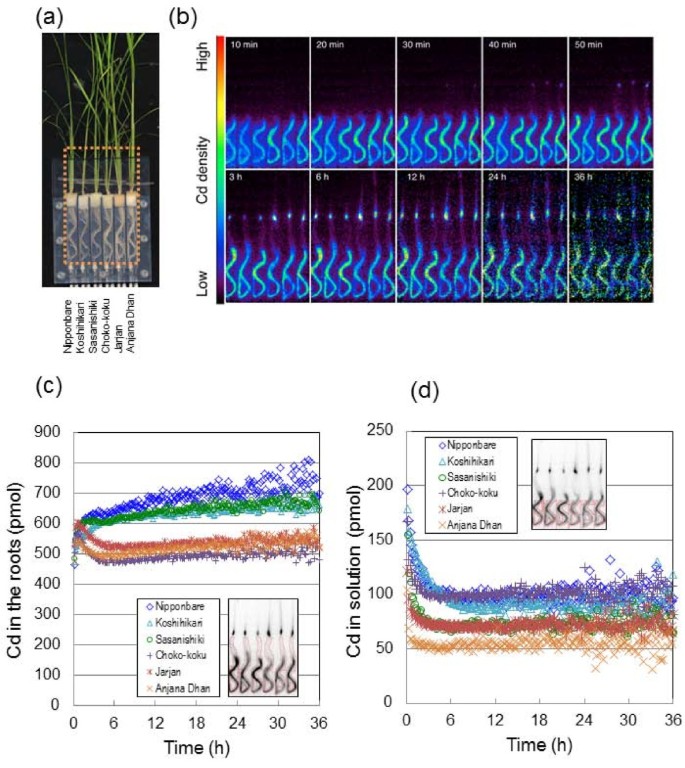
数字1显示了营养阶段不同水稻品种根系对Cd吸收的图像和分析。PETIS探测器集中在根上监测它们107Cd动力学(图1);提取根的ROI数据进行定量分析;在ROI内Cd积累的时间-过程曲线为总Cd (pmol)量,由放射性Cd和非放射性Cd之和组成(图)1 c).一个实时Cd动态的动画电影在根是可用的(附加文件1).获得了36小时的根CD分布的串行图像(图1 b).根对镉的吸收仅在处理后进行107提供Cd(图1 b和1 c),无论品种类型如何。该动力学可以反映在根细胞壁的牙胚间隔内的Cd和随后通过质膜吸收到细胞质中的结合,如二价和三价阳离子的根吸收模式所见[25].在这三个籼稻水稻品种(Choko koku、Jarjan、Anjana Dhan),被归类为在其谷粒和芽中具有显著高的镉浓度(本文统称为“高镉”)籼稻根中的镉含量在暴露于镉的30分钟内达到峰值107直到5 h点,监测Cd的下降情况(图)1 c).为粳稻水稻品种(Nipponbare, Koshihikari, Sasanishiki)的谷粒和秧苗中Cd浓度较低(这里统称为“低Cd”)粳稻在日本裸和Sasanishiki根系中Cd含量在约1 h达到峰值后趋于平稳或略有增加。越光根系Cd含量出现延迟峰值。在这项研究中,107只有在成像开始时才提供Cd,几乎所有的107培养液中的镉在大约5小时内被所有品种的根吸收(图1 d).因此,图中观测到的高原1 c表明Cd在根中被固定,而不是从培养液中不断流出,因此这表明低Cd粳稻与高Cd品种相比,品种在根组织中保留Cd的能力更强籼稻品种。
成像107镉在不同水稻品种上的转移
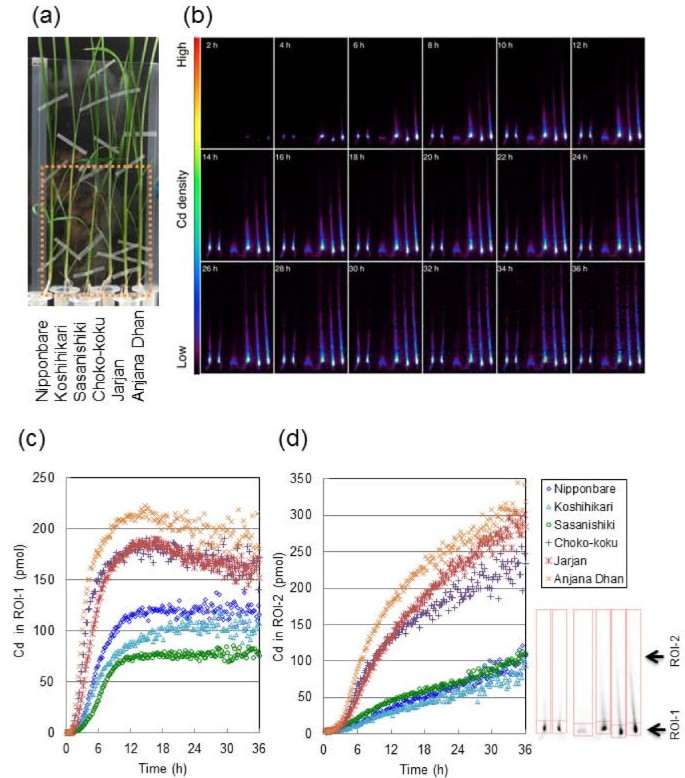
数字2显示了6个水稻品种营养阶段的Cd运输的图像和分析。视场(FOV)聚焦于拍摄(图)2),并连续监测每个品种Cd运动的图像36 h(图2 b)。Cd dynamics的动画将显示在附加文件中2.Cd首先出现并开始在茎的下部(茎基部)或非伸长的茎部积累[26],显示密集107Cd信号为所有品种。Cd含量在ROI-1(茎基)和ROI-2(叶鞘和叶片)中的时间-历程曲线如图所示2摄氏度和二维,分别。时,ROI-1中的Cd在1h内开始积累107在10小时内,特别是在高Cd的情况下,Cd的含量显著增加籼稻品种。ROI-1中Cd含量显著高于高Cd组籼稻较低cd的品种多粳稻10 h后,所有品种的Cd含量均达到顶峰,但高Cd品种的Cd含量略有下降籼稻品种。与ROI-1中Cd的积累模式不同,ROI-2(叶鞘和叶片)中Cd的含量持续线性增加,直到试验结束。高Cd组的Cd含量相差约3倍籼稻品种和低cd粳稻品种。
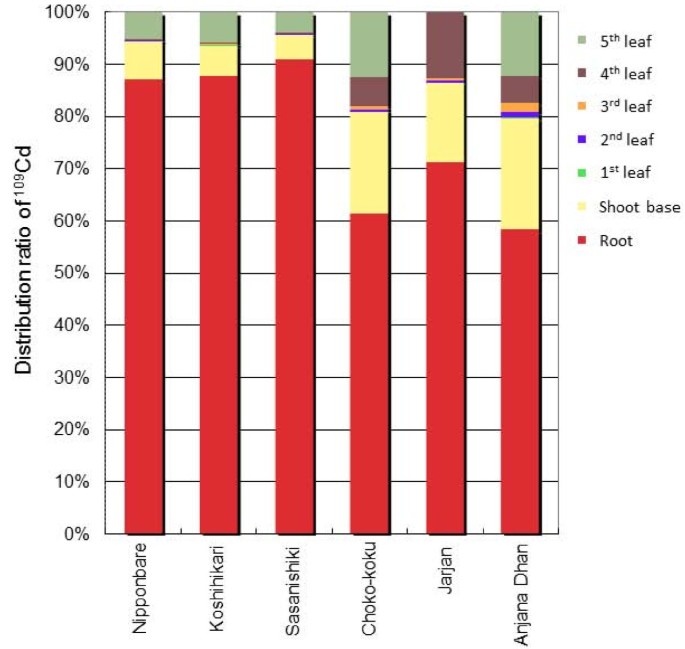
PETIS实验结束后,进行放射自显影,获得植物营养阶段各部位Cd的静态分布(附加文件)3.),计算各部位总Cd的分布比例(图3.).大约90%的CD吸收粳稻水稻品种在根中积累Cd,而在根中积累Cd的比例仅为60 ~ 70%籼稻水稻品种分布在根内。在茎部,Cd在茎基处积累的比例最高;这大约占植物体内高Cd总Cd的15-20%籼稻而低cd品种的产量小于10%粳稻品种。茎基Cd含量约为总茎基Cd含量的50%,各品种间差异不大。在叶片(叶鞘和叶片)中,Cd主要分布在幼叶中,即第4和第5叶,说明Cd从根向茎基部移动后优先向新叶移动。
水稻营养期镉在全株中的分布比例.经过PETIS实验和充分的衰变107在试验装置内,进行了自放射线照相,获得了静态的Cd109Cd分布在每个工厂的部分(附加文件3.),109计算Cd比值。
成像107不同水稻品种的镉转移到穗部的研究
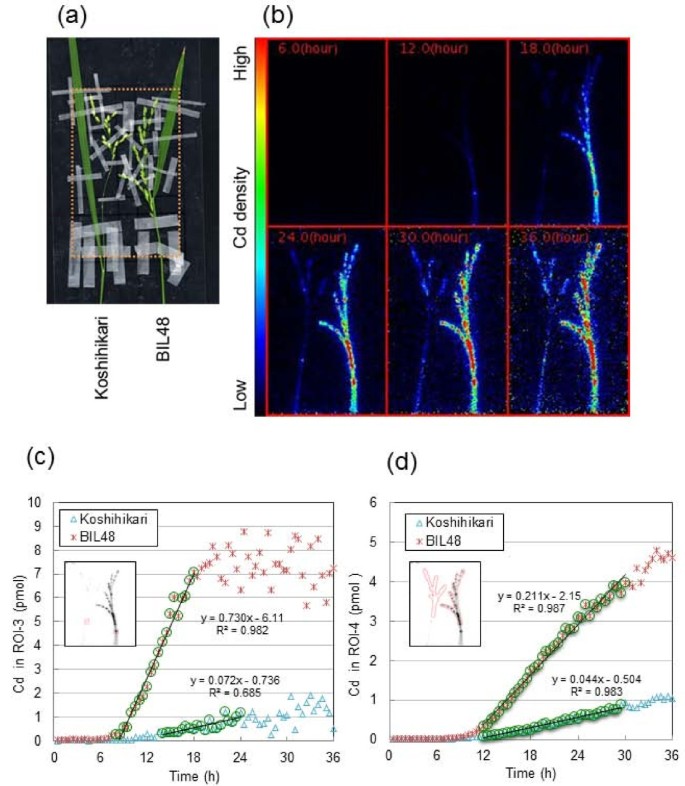
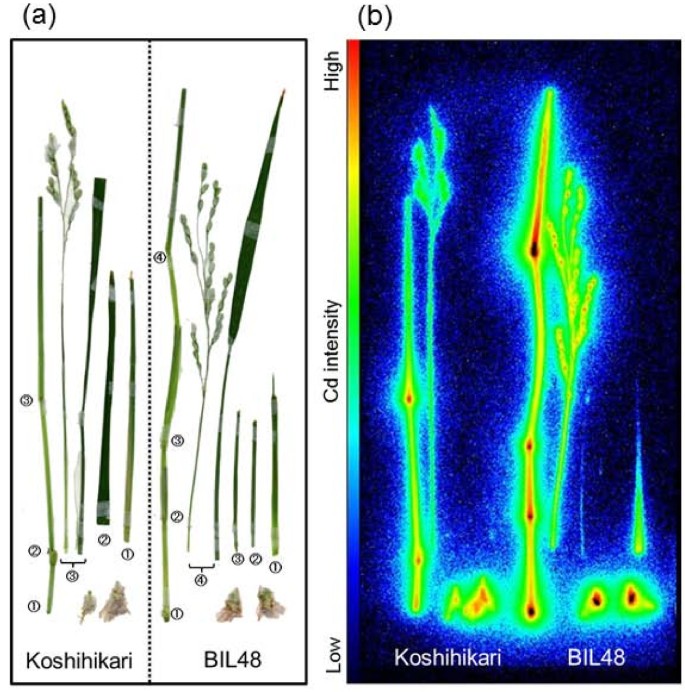
数字4显示了Cd进入越光和回交自交系48 (BIL48)穗部的成像和定量分析。利用BIL48作为高Cd积累基因,是因为它拥有一个来自Jarjan的高Cd积累的主要数量性状位点(QTL),遗传背景为Koshihikari [27],短日处理与越光同步穗头。FOV聚焦在圆锥上(图4),并连续监测Cd进入穗部的图像36 h(图4 b).Cd胁迫12 h内在穗的茎、轴和颈节中出现最高强度的Cd,尤其是BIL48107Cd补充。Cd在BIL48的小穗中在18 h后表现出强烈的存在,并在36 h时逐渐增加。107越光的Cd强度在整个实验过程中都较低。两株旗叶均未发现Cd积累。这些图像的动画电影也可用(附加文件4).定量分析Cd在ROI-3(穗颈节)和ROI-4(穗)中的积累时间过程如图所示4摄氏度和4 d,分别。Cd在ROI-4中的积累(图4 d)因为Koshihikari和BIL48之间的颖片总数不同,所以计算为每个颖片的Cd量(见图)4).初始递增斜率(图4摄氏度和4 d用线来描述Cd在相应ROI中初始到达的动力学。采用拟合线的x截距作为Cd脉冲理论“前沿”的到达时间,与检测限无关。Cd到达ROI-3(图4摄氏度),然后以平缓的线性坡度累积至36h。在Cd累加器BIL48中,Cd在补充Cd后的8.4 h到达ROI-3,然后在18 h急剧线性增加,最终在约7-8 pmol时达到平台。在ROI-4(图4 d), Cd在11.4 h到达越光,然后浓度以平缓的斜率线性增加。BIL48, Cd ROI-4到达10.2 h和不断增加的陡坡36 h。茎长度的基础上(Koshihikari 68.1厘米和67.4厘米BIL48)和估计到达时间圆锥花序(11.4 h Koshihikari为10.2 h BIL48), Cd运输速度计算是6.0厘米-1为越光和6.6 cm h-1BIL48。PETIS试验结束时,ROI-4中Cd积累量在BIL 48中约为Koshihikari的5倍。
两种植物在PETIS实验后均进行放射自显影(图)5和5 b).两株植株从基部到顶部的每个节段都有很强的Cd积累。此外,两株植株的茎、轴和穗中均存在Cd。这些部位的Cd信号在BIL48中明显强于越光。在BIL48中每个颖片的中部,也就是子房发育的地方,Cd信号明显增强。而在叶片中,即使在高镉蓄能器BIL48中,也未检测到Cd的信号或弱信号。
讨论
改良PETIS用于根的直接成像
长期以来,人们一直认为在技术上不可能直接同时观察放射性示踪剂处理过的培养和根,因为传统的成像方法没有足够广泛的检测范围,不能接受这种对比。在这项研究中,我们主要改进了三个方面:1)使用带有扁平、浅隔间的根箱,允许探测器聚焦于根部;2)采用简单的营养液,避免Cd与其他矿物质在根系吸附部位的竞争;3)通过考虑PETIS的动态范围,确保在定量测量中应用足够的放射性同位素活性。这些技术改进首次实现了对整个植物体的实时Cd动态的直接可视化,即从根到谷粒。
利用改进后的系统分析Cd的时变分布,以表征Cd在水稻品种中随籽粒Cd浓度变化的动态差异。
不同镉浓度水稻品种根际镉吸收和根-茎间转运的动态特征
根区Cd量的时间历程(图)1 c)在前30 min表现出相似的曲线,且均呈快速上升趋势,但随时间的变化,各品种间的变化趋势有较大差异。三个low-Cd粳稻品种表现出温和的饱和曲线,而三个品种的镉含量较高籼稻品种数量急剧下降(图1 c).我们认为图中的曲线1 c反映了根系四个连续功能的组合:对根外质层的吸附、对根共质体的吸收、在细胞质或液泡内的滞留和木质部的装载。在前30 min的快速增长可能反映了对外根质质体的吸附,说明这一过程在所有6个品种中是相似的。随后急剧下降后30分钟内出现高cd籼稻品种应归因于同时发生的两种现象。如图所示,一种是从培养到根部的Cd供应的耗竭1 d二是Cd从根向木质部的有力转移。相比之下,低cd的柔和饱和曲线粳稻栽培品种应表明从根部转移的Cd量很低,因为这些品种也存在从培养中消耗Cd的情况(图)1 d).因此,不同的能力之间低cd粳稻品种和高cd籼稻将CD从根组织转移到木耳中的栽培品种可能导致在地下部分中观察到的CD动力学的最重要特征。
这种差异很可能取决于水稻是否固有地保留了具有功能的OsHMA3,这是一种参与根液泡中Cd存储的膜转运蛋白。所有高镉籼稻本研究中使用的品种显示OsHMA3功能缺失,导致根液泡无法隔离Cd [9,10,28].我们的结果表明,在根和Cd之间的30分钟内,ω3损失Ohhma3进入根部液泡的根部液泡中的CD转移到Xylem(图1 c).这一结果与之前的研究一致,即Cd在水稻根系中从培养体向木质部径向运输所需时间小于10 min [24].这个转移过程在5小时内完成(图)1 c),这说明根外质外质通过吸收向共质体的协调运输,以及共质体的木质部装载,在根外质外质快速吸附后发生。而且,30min后在低cd中缺乏下降粳稻品种(图1 c)这表明,根液泡中的固存功能比木质部负载更有效。这些快速动态似乎是水稻特有的,因为之前的一项研究[29]结果表明,在镉暴露后至少4天,不同粒径镉浓度的硬粒小麦近等基因系之间的根系镉浓度差异才被观察到。应该注意的是,根系镉吸收的动力学曲线是在有限的镉(包括107本研究可视为一种脉冲馈电实验。得到的曲线自然与连续供应Cd的根的曲线不同。要点是,脉冲进给实验提供了动力学的快照(时间差异),连续进给的结果可以描述为它们的集成。事实上,这项研究的结果与我们之前从镉污染土壤中持续生长的水稻基因型获得的结果非常一致[5];低Cd组根系Cd浓度较高粳稻栽培品种的cd含量高于高cd品种籼稻品种。
在天线部分,107Cd在非伸长的茎基部有很强的存在(图)2 b),其中包含具有复杂维管束结构的密集节[30.].其他金属,如铁、锰和锌,也被证明在该地区的禾科作物中优先积累[21- - - - - -23],指定为“交通管制中心”[31]或“歧视中心”[32],并在将根部溶解于每个空中组织的溶质中起重要作用。在时间课程数据中,低CD和高CD水稻品种之间的芽碱中CD量的定量差异(图2摄氏度),这与不同品种将Cd转入木质部的能力不同是一致的。此外,高cd品种在峰值后(约15 h)略有下降(图)2摄氏度)表明Cd从茎基(ROI-1)到茎上部分(ROI-2)的流动性较高。这种趋势似乎也受到了OsHMA3基因在茎基中的表达,尽管据报道在茎中的表达水平比在根中的表达水平低得多[10].木质部薄壁组织细胞,具有大液泡,位于增大的木质部的中心,在增大的节的椭圆形束中[26].木质部薄壁组织和转移细胞在溶质从蒸腾流的选择性吸收和向茎尖运输中起重要作用[30.,33].如果oshma3功能在高CD中的木质薄膜细胞中有缺陷籼稻在栽培品种中,Cd更容易通过蒸腾流向上移动到叶鞘和叶片上部,而木质部薄壁组织细胞的截留减少。但总体而言,36 h后,Cd在茎基中最终积累的比例约为总茎基中Cd积累的50%,各品种间差异不大(图2)3.).这可能表明,尽管Cd在木质部的装载量存在较大差异,但不同品种间的遗传差异对其木质部卸载功能的影响不大。Cd暂时沉积在茎基部,似乎优先转移到最年轻的发育叶片中(图3.).Zn的优先易位[34]和Fe[21在谷类作物中也有报道。在之前的一项研究中发现52蒸馏法对大麦幼苗叶片的处理可严重抑制铁向幼嫩叶片的转运,使韧皮部失去活性,但木质部的运输没有发生活性,这表明铁主要通过韧皮部向幼嫩叶片转运[21].富士吉玛等。[24[展示CD从枝碱移动到冠状根部,它们分裂并远离与CD溶液直接接触,表明CD从拍摄底座中的节点中的kylem转移到韧皮柱中。这些发现表明,最年轻的叶片中的优先和高CD积累,特别是对于高CD品种,可以通过在射击底部的CD的CD的CD-to-Phloem转移后的韧皮肌中的高水平Cd来部分解释为高CD品种观察到高CD信号。
谷物CD浓度不同的水稻品种胶质堆中CD积累的动态特征
高CD蓄能器BIL48工厂的颈部节点的CD累积图案与拍摄基底的节点的CD累积图案相对应得很好,显示特征陡峭和线性增加,随后的CD累积平台模式(图2摄氏度和4摄氏度).因此,穗颈节点可能参与分配Cd到各小穗的交通控制中心。结果表明,镉在两株水稻穗部呈线性积累模式107Cd达到了各自的穗部,尽管植株间的累积水平有很大差异(图)4 d).富士吉玛等。[24]将Cd在灌浆期通过茎部的长距离运输速度量化为5.4±0.4 cm h-1在低镉品种Nipponbare中,在本研究中,估计为6.0 cm h-1为低cd品种越光,其值似乎相似。Cd蓄能器BIL48的Cd运移速度为6.6 cm h-1)的速度比越光略快。然而,不同基因型之间Cd运输速度的差异可能很小。相反,在Cd积累到穗部的坡地上观察到显著的差异(约5倍)。因此,这一结果表明,根系Cd动态的差异也影响了Cd在水稻品种中长距离运输到穗部的浓度。
有趣的是,在PETIS实验中,在36 h时,两种植物的旗叶中均未发现Cd的分布107Cd提供给出现耳朵的基因型(图)4 b和5).与此相反,两株伸长茎的所有节均积累了显著的Cd,尤其是与旗叶和穗相连的最上面节I。节点I在从根到旗叶或穗的溶质分布中起作用[26,33].放射自显影结果表明,节点I的Cd优先向发育的穗部转移,而不优先向发育的旗叶转移,但节点I决定Cd去向的方法尚不清楚。水稻谷粒硅运输提出了从扩大参与inter-vascular转移维管束分散维管束,通过木质部薄壁细胞中转移细胞桥节点我,和一个相关转运体inter-vascular转移已被确定(35].节I弥散的维管束聚集在节间I,形成大的维管束,连接到穗组织[26,35].利用同步加速器微x射线荧光光谱仪和电子探针微分析仪,在节点I大维管束的韧皮部检测到Cd (Yamaguchi et al. 2011,已提交)。此外,有报道称,Cd的木质部到韧皮部的转移发生在水稻的节中[24[糙米中Cd输送的主要途径是phloem [15,16].我们的研究和这些报道在很大程度上表明,Cd在节间I木质部向韧皮部转移后,通过节间I大维管束的韧皮部,韧皮部中的Cd浓度可能影响水稻籽粒中Cd积累的基因型差异。
在水田中,水稻主要生长在淹没条件下,由于土壤pH升高、氧化还原电位降低,生物有效Cd受到限制。日本稻田在营养生长阶段普遍建议在中季排水,以避免因连续减土而引起的根腐病。此外,稻穗出苗后,稻田经常进行早期排水,以方便机械收获。因此,水稻不是持续暴露于土壤中高生物有效Cd,而PETIS数据通过有限的Cd(包括107Cd)的供应可能是稻田排水后水稻营养期和抽穗期Cd动态的描述。
因此,PETIS是综合评价Cd从根系到籽粒的动态变化和预测Cd在完整植株中运输生理过程的一种非常有效的工具。图像和动力学数据清楚地显示了水稻品种活体植株中Cd的差异动态。镉的动态可能受到许多生理和生化步骤的影响,其中涉及多个基因控制镉的动态。例如,利用不同的定位群体,在3、4、6、7、8和11号染色体上检测到了水稻Cd积累的主要qtl [36- - - - - -38提示水稻镉转运的基因型变异受多基因控制。在本研究中,我们碰巧选择了三个高cd的籼稻基于以前筛查与许多水稻品种中的CD积累有关的数据,携带oshma3非功能等位基因的栽培品种[5].在不久的将来,我们打算分析携带除OsHMA3以外的其他相关基因改变的高Cd品种的Cd动态。该实验系统适合于对镉转运相关基因进行详细的功能分析。
结论
利用PETIS首次直接观察了Cd在培液中根系对Cd的吸收,表征了Cd在根组织中的连续运输过程,并描述了高Cd积累和低Cd积累水稻品种间Cd从根到籽粒的实时动态差异。Cd在根中的滞留量、从根向茎部的转运率和向穗部的长距离转运率有明显的差异。我们的研究明确地将水稻品种的基因功能差异与在活的有机体内在水稻植株中Cd从培养物通过根向茎的移动。
方法
植物材料
在营养苗期试验中,我们选用6个水稻品种(奥雅萨苜蓿由三部分组成籼稻水稻品种(Choko-koku, Jarjan, Anjana Dhan)的籽粒和秧苗中Cd含量显著高粳稻来自日本的品种(日本裸、Koshikari、Sasanishiki),其籽粒和芽中的镉浓度较低[5].灌浆期采用越光和越光与Jarjan衍生的BIL (BIL48)进行试验。BIL48具有负责地上部Cd高积累的主要QTL [27]。将种子在32°C的去离子水中浸泡2天,然后转移到漂浮在20 L 1/2强度Kimura B溶液上的尼龙网中。完整的营养溶液由0.36 mM(NH4)2所以4, 0.36 mM Ca3.)2·4H2O、 0.54毫米MgSO4h·72O, 0.18 mM KNO3., 0.18 mM KH2阿宝4, 40 μM Fe(III)-EDTA, 18.8 μM H3.薄3., 13.4 μM MnCl2·4H2O, 0.32 μM CuSO4h·52O、 0.3μmZnSO4·4H20.03 μM (NH .4)6莫7O24·4H2木村B溶液已被广泛用于种植水稻[5].每周更换一次溶液,每天调整pH至5.2。6个品种的幼苗在日光温室中生长2-3周,进行营养阶段试验。
播后3周,将Koshihikari和BIL48移栽于木村B全量溶液中,在生长室中生长至抽穗期。采用光周期8 h、昼夜温度30°C/25°C、相对湿度70%、光强400 μmol m的短日处理2年代-1以同步Koshihikari和BIL48的首耳出现。灌浆期试验中,首穗出穗后第9天检测Koshihikari,第5天检测BIL48。
107Cd示踪和PETIS成像
的107Cd同位素是按照Fujimaki等人的方法生产的[24].在高崎离子加速器(日本原子能机构)的一个回旋加速器上,一束17 MeV高能质子束以2 μA的电流轰击了一枚银箔。的107用氯化银纯化辐照靶中的镉2加入2 M HCl后的沉淀反应。最后,7.6-60.2 MBq的107根据下面所述的试验,向每个试验工厂投喂Cd。
PETIS成像实验采用Fujimaki等人的方法[24,以观察根系吸收Cd的动态变化。首先,将高187mm ×宽120mm ×深10mm的亚克力根箱分成6个单元,每个单元为高187mm ×宽17.5 mm ×深10mm。设计这个盒子的目的是将探测器集中在经过放射性示踪剂处理的培养液的根表面,以便同时观察多个根。根盒由两部分组成:一块带有分隔单元的亚克力板和一块用于覆盖的亚克力板(图)1).用外科胶带将试验植物的下部叶鞘固定在板上,根置于每个细胞室中,由带小孔的塑料板支撑,并用平板覆盖。用螺钉将板和平板完全密封,并将培养液倒入每个细胞室。第二,为了避免镉和其他矿物质(如锌、铁和锰)在根系的吸附部位发生竞争,从而防止镉动态的空间分辨率降低,将用于成像的培养基改为0.5 mM CaCl2而不是Fujimaki等人使用的全强度营养液[24].最后,考虑到PETIS的广泛动态范围,我们使用根盒中的简单溶液确定了足够用于根成像的放射性同位素的数量。这些改进使直接和同时观察放射性示踪剂处理的培养和根。将植株驯化在0.5 mM的CaCl中2溶液(pH 5.2)放置24小时后,开始处理107Cd补充实验。溶液被不断地曝气,当植物吸收水分时,通过自动从蓄水池中提供新鲜的溶液,使表面水平低于茎基和根部之间的边界几厘米。纯化1070.1 μM浓度的镉和非放射性镉同时作为载体提供给0.5 mM CaCl2植物生长的溶液。植物被放置在PETIS装置(改良的PPIS-4800;滨松光电,滨松,日本)。同时检测到一对衰变的正电子发射的湮灭γ射线,并确定发射点为两个入射点的中点。发射点的重复确定重建了示踪剂分布的静态图像。每帧为4分钟,即获得一张足够质量的静态图像所需的时间单位,采集540帧(36 h),生成序列时间过程成像。在根、非伸长茎基部(茎基部)和穗部设置探测器,监测各部位Cd的动态变化。探测器头部视场的典型尺寸为宽12 cm、高19 cm,空间分辨率约为2 mm。所有PETIS实验均在生长室内进行,温度为30℃,湿度为70%,光照持续,密度为400 μmol m2年代-1.
PETIS数据的定性和定量分析
为了定性和定量地确定植物体内Cd的动态,利用NIH Image J 1.42软件重建PETIS仪器获得的数据集(http://rsb.info.nih.gov/ij).由于该软件可以从图像数据中自由选择感兴趣区域(ROI),因此可以计算出107从数据中提取每个ROI内随时间变化的Cd。Cd在ROI内积累的时间历程曲线表示Cd总量,包括放射性Cd和非放射性Cd之和。所有PETIS实验都进行了2 ~ 3次,本文给出了具有代表性的数据。
放射自显影术
在生产过程中107Cd, gamma-ray-emitting109CD也以小比例(约1/3000)产生。这个同位素的半衰期越来越长(461天)107Cd (6.5 h),在PETIS实验中被植物吸收,但PETIS仪器没有检测到,因为它不是正电子发射器。在充分衰变后107Cd在测试工厂内,它们被分成几个部分,并以盒式磁带的形式放在显像板上(富士,东京,日本)。曝光几天后,使用生物成像分析仪(BAS-1500, fujiffilm, Tokyo, Japan)扫描成像板,获得用于检查的自动放射成像图像109Cd在植物体内的分布。用井型伽玛计数器(ARC-7001;日本东京Aloka株式会社)。
参考
- 1.
川田,铃木:水稻中镉含量、镉日摄入量及肾脏中镉积累的研究进展。《职业卫生》,1998,40:264-269。10.1539 / joh.40.264。
- 2.
李志强,李志强,李志强,等。镉对根际土壤镉胁迫的响应研究进展。中国生物医学工程学报,2011,32(4):421 - 427。10.1093 / jxb / erq281。
- 3.
关键词:镉,硬粒小麦,近等基因系,镉吸收与转运植物学报。2004,4:4-10.1186/1471-2229-4-4。
- 4.
HART JJ,Welch RM,Norvell WA,Sullivan La,Kochian LV:镉绑定,摄取和静脉幼苗在面包和硬质小麦品种的完整幼苗中表征。植物理性。1998,116:1413-1420。10.1104 / pp.116.4.1413。
- 5.
Uraguchi S, Mori S, Kuramata M, Kawasaki A, Arao T, Ishikawa S:通过木质部根系向地上部转运Cd是决定水稻地上部和籽粒镉积累的主要过程。中国海洋大学学报(自然科学版)。10.1093 / jxb / erp119。
- 6.
铁缺乏促进了铁对镉的吸收和转运2+在水稻中转运蛋白OsIRT1和OsIRT2。植物营养与肥料学报,2006,32(4):469 -469。10.1111 / j.1747-0765.2006.00055.x。
- 7.
陈志强,陈志强,陈志强:水稻锌转运体的金属选择性和基因表达。植物营养与肥料学报。2003,33(4):426 - 434。10.1104 / pp.103.026815。
- 8.
Nocito FF,Lancilli C,Dendena B,Lucchini G,Sacchi GA:镉在水稻根系中的保留受镉的有效性、螯合作用和易位的影响。植物细胞环境,2011,34:994-1008.10.1111/j.1365-3040.2011.02299.x。
- 9.
Miyadate H, Adachi S, Hiraizumi A, Tezuka K, Nakazawa N, Kawamoto T, Katou K, Kodama I, Sakurai K, Takahashi H, et al: OsHMA3, A P1 b型atp酶通过液泡外排影响水稻根-茎间镉转运。新植绿醇。2011,189:190-199。10.1111 / j.1469-8137.2010.03459.x。
- 10.
黄长发,安藤,马建富:水稻镉积累的基因限制。美国国家科学院学报。2010年,107:16500 - 16505。10.1073 / pnas.1005396107。
- 11.
王玉梅,王玉梅,王玉梅,王玉梅,王玉梅。拟南芥中P-type ATPase转运体对锌平衡的影响。acta botanica sinica(云南植物研究),2004,16(4):427 - 434。10.1105 / tpc.020487。
- 12.
威廉姆斯,米尔斯:P1 b- atp酶-植物中具有多种功能的古老过渡金属泵家族。植物科学进展,2005,10:491-502。10.1016 / j.tplants.2005.08.008。
- 13.
陈飞,吴芳,董军,文泽恩,张刚,王飞,黄玉伟,魏凯:大麦籽粒中镉的转运与积累。植物营养学报。2007,27(6):762 - 762。10.1007 / s00425 - 007 - 0610 - 3。
- 14.
田中K, Fujimaki S, Fujiwara T, Yoneyama T, Hayashi H:水稻韧皮部液中镉含量(奥雅萨苜蓿L.)用含镉的营养液处理。植物营养与肥料学报,2003,29(4):489 - 498。10.1080 / 00380768.2003.10410014。
- 15.
田aka K, Fujimaki S, Fujiwara T, Yoneyama T, Hayashi H:水稻中镉运输中韧皮部贡献的定量估算(奥雅萨苜蓿l .)。植物营养与肥料学报,2007,33(4):453 - 457。10.1111 / j.1747-0765.2007.00116.x。
- 16.
Kato M, Ishikawa S, Inagaki K, Chiba K, Hayashi H, Yanagisawa S, Yoneyama T:水稻韧皮部汁液中镉浓度的可能化学形式和品种差异(奥雅萨苜蓿l .)。植物营养与肥料学报,2010,29(6):836 - 841。10.1111 / j.1747-0765.2010.00514.x。
- 17.
重金属在水稻体内积累过程中吸收时间与内部转运途径的关系。植物营养与肥料学报,2003,21(4):457 - 461。
- 18.
Ohya T, Iikura H, Tanoi K, Nishiyama H, Nakanishi TM:109不同pH条件下大豆对Cd的吸收与转运acta radianal nucleatologica sinica, 2005, 29(4): 497 - 503。10.1007 / s10967 - 005 - 0711 - z。
- 19.
Fujimaki:正电子发射示踪成像系统(PETIS),一种最先进的植物生理学成像工具。电池新技术,2007,8:404-413。
- 20.
Kiser MR, Reid CD, Crowell AS, Phillips RP, Howell CR:利用正电子放射示踪剂探索植物代谢物的运输。中国科学(d辑:地球科学),2008,29(2):429 - 434。10.2976/1.2921207。
- 21.
冢本T, Nakanishi H, Uchida H, Watanabe S, Matsuhashi S, Mori S, Nishizawa NK:52用正电子发射示踪成像系统(PETIS)监测大麦中的铁转运:铁通过韧皮部直接从根转移到幼叶的证据。植物营养学报。2009,30(4):457 - 461。10.1093 /卡式肺囊虫肺炎/ pcn192。
- 22.
冢本T, Nakanishi H, Kiyomiya S, Watanabe S, Matsuhashi S, Nishizawa NK, Mori S:52用正电子发射示踪成像系统监测大麦中的锰移位。植物营养与肥料学报,2006,29(6):717-725。10.1111 / j.1747-0765.2006.00096.x。
- 23.
Suzuki M, Tsukamoto T, Inoue H, Watanabe S, Matsuhashi S, Takahashi M, Nakanishi H, Mori S, Nishizawa NK:脱氧核糖核酸(deoxymugine酸)增加锌缺乏水稻植株的锌转运。植物生态学报。2008,32(6):691 - 698。10.1007 / s11103 - 008 - 9292 - x。
- 24.
藤崎实S,Suzui N,Ishioka NS,Kawachi N,Ito S,Chino M,Nakamura S:追踪从培养到小穗的镉:完整水稻植株中镉吸收、运输和积累的无创成像和定量表征。植物生理学。2010,152:1796-1806。10.1104/pp.109.151035。
- 25.
植物对镉的吸收、转运和沉积机制。土壤和植物中的镉。编辑:McLaughlin MJ, Singh BR。1999,杜德雷希特:克鲁尔学术出版社,85:125-150。
- 26.
Chonan N:茎。水稻植物科学-形态学-。编辑:那津男,星川K. 1993,东京:Nosan Gyoson Bunka kykai (Nobunkyo), 1: 187-221。
- 27.
田口盐原F, Kojima Y, Ebitani T, Kuramata M, Yamamoto T, Yano M, Ishikawa S:水稻镉积累QTL的检测与土壤镉的有效提取。植物营养与肥料学报,2011,31(4):457 - 461。10.1270 / jsbbs.61.43。
- 28.
马建峰:高镉积累水稻品种紫薯的生理、遗传和分子特性研究。中国生物医学工程学报。2011,32(6):691 - 698。10.1093 / jxb / erq383。
- 29.
不同镉浓度硬粒小麦近等基因系镉吸收、转运和储存特性的研究。植物营养学报,2006,32(2):457 - 461。10.1111 / j.1469-8137.2006.01832.x。
- 30
田国华:水稻植株形态发生的研究。8.茎矮部维管束的形态。作物学报,2003,23(4):451 - 457。10.1626 / jcs.44.61。
- 31.
Gunning BES, Pate JS:转移细胞。植物超微结构的动态研究。编辑:Robards AW。1974年,纽约:麦格劳-希尔,441-480。
- 32.
森:禾本科植物的铁转运。Met Ions Biol Syst。编辑:Sigel A, Sigel H. 1998,纽约:Marcel Dekker, 35: 215-237。
- 33.
田国华:水稻植株形态发生的研究。7.茎营养节中维管束的形态。作物学报,2003,43(4):491 - 498。10.1626 / jcs.43.389。
- 34.
赵志刚,王志刚:利用放射自显影技术研究水稻营养节点锌的转运途径。植物营养与肥料学报,2003,19(4):531 - 534。(在日本)
- 35.
马建芳:水稻根际硅转运蛋白的研究进展。acta botanica sinica, 2009, 31(4): 497 - 503。10.1105 / tpc.109.069831。
- 36.
控制糙米镉含量的数量性状位点的染色体区域(奥雅萨苜蓿).新植物。2005,168:345-350。10.1111 / J.1469-8137.2005.01516.x。
- 37.
稻作中镉在水稻籽粒和植株地上部分积累的不同转运途径。生物技术学报。2009,9:8-10.1186/1471-2229-9-8。
- 38.
(Ueno D, Kono I, Yokosho K, Ando T, Yano M, Ma JF:水稻镉易位的主要数量性状位点(奥雅萨苜蓿).新植物学报,2009,33(4):457 - 461。10.1111 / j.1469-8137.2009.02784.x。
确认
这项工作得到了创新生物科学基础研究活动促进计划(PROBRAIN to SI)的部分支持1).我们感谢H. Suto先生(日本东京核服务有限公司)在辐照方面提供的技术援助107Cd生产;Masashi Itoh先生(日本秋田县农林水产研究中心)提供“竹子国”种子;国家农业生物科学研究所(NIAS)的Masahiro Yano和Fumio Taguchi-Shiobara博士提供了BIL48种子。粳稻品种Jarjan和Anjana Dhan的种子由日本NIAS的基因库提供。
作者信息
从属关系
相应的作者
补充资料
作者的贡献
如果1nsns和SF发起并协调了这项研究。如果1, MI, TA, MK准备实验植物,参与PETIS成像。NS,坐,如果2北韩和顺丰生产了107Cd示踪剂并进行PETIS成像。NS和SIT对PETIS获得的图像数据集进行处理。如果1在NS和SF的协助下起草了手稿所有作者都对结果进行了讨论,并对初稿进行了评论,阅读并批准了最终稿。
Satoru Ishikawa,Nobuo Suzui同样地贡献了这项工作。
电子辅料
12870_2011_950_moesm3_esm.tiff.
补充文件3:补充Cd 36小时后植物营养阶段脱落部分的放射自显影。Nipponbare。B, Koshihikari。C, Sasanishiki。D, Choko-koku。E Jarjan。F,小河Dhan。(TIFF 493 KB)
12870 _2011_950_moesm4_esm.mov
附加文件4:动画电影107灌浆期Koshihikari和BIL48的穗部Cd积累。(MOV 2 MB)
作者为图像提交的原始文件
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署名许可协议(http://creativeCommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Ishikawa, s.s, suzuki, n.s, Ito-Tanabataet al。水稻品种镉动态差异的实时成像与分析(奥雅萨苜蓿)使用正电子107Cd示踪剂。BMC植物杂志11,172(2011)。https://doi.org/10.1186/1471-2229-11-172
收到了:
接受:
发表:
关键字
- 水稻品种
- 射击基础
- 籼稻品种
- 木质部薄壁细胞
- 大的维管束