摘要
背景
NAC结构域转录因子启动次生细胞壁生物合成拟南芥通过激活许多转录调节剂和生物合成基因来激活纤维和血管。NAC家庭成员SND2.是纤维次生细胞壁形成的主要调控因子SND1的间接靶点。之前的一项研究表明,过度表达SND2.产生次级细胞壁厚度的纤维细胞特异性增加拟南芥并且这种蛋白质能够转化纤维素合成酶8.(CesA8)启动子。然而,所有的基因都是由SND2.未知,其过度表达对细胞壁化学的影响仍未探索。
结果
我们中SND2.in.拟南芥并对纯合子系的茎化学性质、生物量和纤维次生细胞壁厚度进行了分析。表示上调的线CesA8进行全转录组基因表达谱分析。我们发现了与纤维素、木聚糖、甘露聚糖和木质素聚合相关的生物合成基因上调的证据,这些基因与天然基因的显著共表达一致SND2.转录本根据公共微阵列存储库。仅检测到细胞壁的化学变化。转录因子myb103,除了SND1.,上调SND2.-OVEREXCRUCTING植物,并且我们检测到最近提出的信号转导机械组分的基因的上调,提出引发二次细胞壁形成。几种纯合的T4和嗜血性T1转基因系与发音SND2.过表达水平表明对纤维壁沉积产生不利影响,这可能是间接归因于过度的过表达,而不是共抑制。相反,过度表达SND2.in.桉树茎导致纤维横截面细胞面积增加。
结论
这项研究支持功能SND2.在加入纤维素和半纤维素生物合成基因的调节中,添加到木质素聚合和信号传导中。SND2似乎占据了二级细胞壁转录网络中的从属但中央层。我们的结果揭示了表型差异SND2.木本之间过度表达和草本茎和强调在转录因子研究表达的阈值的重要性。
背景
植物纤维构成纸浆,纸和生物能源生产的有价值的可再生资源[1].在Angiosperms中,包含次级木耳的两种原理硬化细胞类型是Xylem血管,其促进水和木质纤维的运输,这提供了机械强度并构成了大部分木质生物量[2].木材的密度和化学组成,纤维和容器的长度,直径和壁厚,和轴向和径向实质甚至比例严重影响纸浆产率,消化率和质量,虽然每个的相对重要性因物种[变化3.那4.].
在使高血管植物中的Xyloyesis期间,纤维区分血管挂钩,细长,并沉积氧化的二次电池壁(SCW)。SCW形成与不同形式的编程细胞死亡相关联[5.那6.].SCW生物聚合物的生物合成致力于致力于(丰度令)纤维素[7.那8.],半纤维素[9.]和木质素[10.那11.].补充这一点,在过去六年多的转录网络基本SCW生物合成已经被破译,主要是利用拟南芥蒂利亚纳和Zinnia Elegans.叶绿角到气管元素在体外转系统[12.那13.].参与继发性Xylem形成的基因主要在转录水平上进行调节,诱惑SCW转录网络的中心意义[14.].与网络相关的转录因子(TFS)的操纵具有通过改变大量生物合成基因的调节来提高纤维性能的可能性。
久保et al。[15.首先将NAC结构域TFS与血管相关的NAC-Domable7(VND7)和VND6分别为SCW形成在原型和半藻血管中的“母激活剂”。稍后认为VND6和VND7功能冗余,足以满足所有血管SCW形成[16.那17.].在木质部纤维中,也发现了类似的转录主开关。NAC家族蛋白SECONDARY WALL- associated NAC DOMAIN1 (SND1)和NAC SECONDARY WALL增厚促进因子1 (NST1)冗余激活拟南芥纤维(在某种程度上,还有角钢阀)SCW形成[18.-22.].在其他具有次生壁的细胞类型中,如花药的内皮,NST1也被发现激活SCW的发育,在这种情况下NST2是冗余的[23.].总之,这些研究支持NAC转录因子作用作为SCW形成在纤维和容器主体的活化剂,在每种情况下不同的组合作用。
一些研究表明,SND1, NST1, VND6和VND7激活了一个保守的、级联转录网络,具有但不限于各种NAC, MYB和同源域转录因子(综述于[13.那24.])。SND1,NST1,NST2,VND6和VND7调节一组重叠的目标[21.那25.],由NST2的能力支持,VND6和VND7补充snd1 nst1双突变体当纤维细胞中异位表达[26.那27.].因此,它们被统称为次级壁NACs (swn) [26.].在SWNS的下游目标中,SND3.和myb103由SND1 / NST1和VND6 / VND7直接激活[21.那25.-27.], 虽然SND3.并未始终被检测为VND6/VND7的直接靶标。SND2.间接地通过SND1 / NST1 [调节21.那28.],但存在通过VND6 / VND7调控的证据。的损失 - 和增益的功能突变SND2.,但有趣的是SND3.和myb103,生产的纤维特异性表型21.].而主导压抑[29.显著降低了纤维特异性SCW的厚度,个体的过表达myb103那SND2.和SND3.增加束间纤维和木纤维的SCW厚度,对血管无明显影响。茎中葡萄糖、木糖和甘露糖细胞壁糖的减少发生在显性抑制myb103那SND2.或者SND3..相反,所有三种TFS都可以反式激活SCW纤维素相关的CesA8半纤维素的基因启动子,但不能代表(IRX9.)或木质素(4CL1)的生物合成[21.].
规定和功能SND2.可以以草本和木本植物不同,特别是在其具有纤维细胞的更大的比例比茎草本植物的木本组织。这可以通过基因家族膨胀和专业化在木本植物[来促进30.].多达四个推定SND2.直系同源基因杨树存在由于NAC家族的显著扩张[31.,其中的一些谬误可能在杨树[32.].发现所有四个推定的直脑都被发现优先表达在开发Xylem和Phloem纤维中[31.].一个假定的直系基因的过度表达,PopNAC154,导致杨树高度降低,树皮与木质部比例增加,但对SCW厚度无明显影响[31.].这种明显的冲突SND2.过度表达表型拟南芥[21.说明了SND2同源物的调节功能在草本植物和木本植物之间可能存在差异。
观察到SND2.过表达导致SCW形成增强拟南芥纤维和其潜在的调节纤维素基因是重要的发现,因为证据支持类似转录网络调节纤维SCW发展在被子植物树木的存在[13.那33.那34.].但是,生物学功能的几个方面SND2.在可以确定基因的生物技术潜力之前仍有待解决。尚未确定SND2的全球目标,并且尚未确定转录网络中的位置。SND2调节纤维素,但不是Xylan和木质素生物合成基因的发现基于来自每种途径的单个代表性基因[21.].需要对SND2靶点有更深入的了解,才能自信地否定其对半纤维素和木质素生物合成的调控。钟的分析也不清楚et al。[21.] 无论SND2.过度表达总是导致纤维SCW厚度增加,都在拟南芥在木本征集。最后,效果SND2.尚未报道细胞壁化学的过度表达。
我们的目的是进一步确定其地位和调控作用SND2.纤维SCW转录网络中,并确认的表型效应SND2.过度表达拟南芥和桉树植物。我们的目标是,以确定在差异表达的基因SND2-过度抑制植物,并确定整体效果拟南芥发展和生物量产生,以及纤维SCW形成在拟南芥和桉树.我们描述了SND2在纤维SCW发育中的新调控作用,并提出了SND2在转录网络中调控SCW形成的模型。
结果
全转录表达谱的SND2.-overexpressing拟南芥植物
SND2以前被证明能使CesA8基因启动子拟南芥原生质体[21.].为了识别SND2调节的其他基因在Planta.,我们中SND2.in.拟南芥通过克隆来植物SND2.编码序列进入过表达载体pMDC32 [35.].我们把这个结构引入A. Thaliana.COL-0植物和随机选择的三种纯合T4系(A,B和C),来自本文的T1转基因植物池表示为“SND2-OV”。我们确认了SND2.使用RT-QPCR分析(附加文件)在T4 SND2-OV线上强烈上调1,图S1)。然后我们测试了T4 SND2-OV线条以获取初步证据CesA8使用RT-QPCR分析在较低花序茎中的上调。有趣的是,排队(“SND2-OV(a)”)专门显示证据CesA8上调(未显示),因此选择转录组分析。
以确定哪些基因表达差异是由于SND2.过度表达拟南芥茎,将SND2-OV(a)植物的转录组与野生型底部100mm的底部100mm的转录组进行了比较。高质量的总RNA(RQI> 9.3)从八周历史型野生型和SND2-OV(A)植物茎的三个生物学重复中分离出来,并标记为与安捷伦4×44K杂交的cDNA拟南芥转录组阵列。将显着表达的基因(DEG)鉴定为低于0.05和折叠变化> |±1.5 |的实验假发现率的基因(DEG)。该分析鉴定了相对于野生类型的SND2-OV(A)中的总共155个上调和68个下调基因(附加文件2).
为了在deg中识别过度代表的基因本体(GO)类,GOToolBox资源[36.使用过度测量测试(Benjamini和Hochberg校正)询问拟南芥信息资源(37.]注释集。显著富集生物过程(P.<0.01)揭示了DEGS的在(次级)细胞壁组织和生物发生,碳水化合物代谢,信令和响应于刺激主导作用(附加文件3.,表S1)。
推定SND2目标的识别
SND2.优先表达于木质部[21.那38.].我们假设SND2的目标将是共表达与内源性SND2.转录物。通过观察所选择的表达模式,探讨了SND2-OV(A)中鉴定的DEG的组织特异性表达(折叠变化> |±1.5 |)拟南芥使用Genevestigator V3 [组织39.]解剖聚类工具。在分析时,Genevestigator数据库总计374个公开可用的微阵列研究拟南芥,包含6290个样本。我们的SND2-OV(a)数据集中的223个基因,190由高质量ATH1 22K阵列上的独特探头组表示。基于4422阵列的结果,在26个组织中检查了这些基因的内源性表达,并根据其绝对表达谱对基因进行分级簇。大多数基因没有符合单一表达模式,只有〜9%的基因显示表达谱明显类似于原生的基因SND2.转录本,即在含scw的组织中优先表达(附加文件)1,图S2)。因此,大多数基因因结果差异表达SND2.过表达没有通常用含有SCW-组织相关。
以前报道了由细胞壁相关NAC TFS的异位过表达产生的新靶标[40].在我们的研究中可能会出现类似的现象,因为大部分取样的转基因茎中包含的组织SND2.天然不是自然表达的。这可以解释与之共同表达的少量比例SND2.在附加文件1,图S2。为了避免这种可能性,我们严格定义的假定真实目标SND2.作为那些也是SND1调节基因的子集,后者通过微阵列分析鉴定SND1.-overexpressing拟南芥ko的植物et al。[28.].引用的研究中的植物(〜8.5周)和采样的组织(较低50毫米花序茎)的年龄类似于我们的实验。SND2.,一个已知的SND1间接目标[21.,是snd1过表达植物茎中TF上调最强烈的[28.],进一步证明我们的方法。
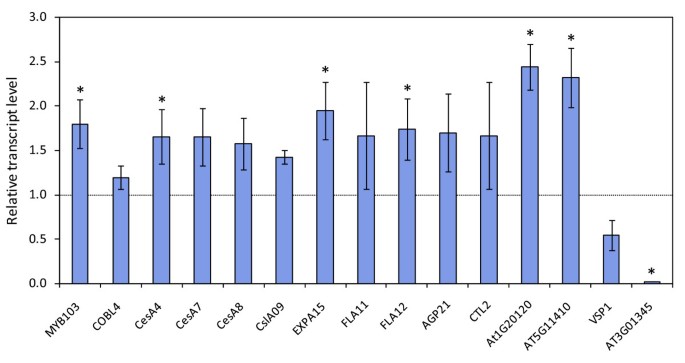
我们提取的基因共同向柯et al。[28.]的数据和我们的显著SND2-OV(A)的微阵列数据,而不倍数变化滤波。七个十五基因的两个数据集之间共享,在此表示为“SND2∩Ko”,其中〜79%的在一致的方向(被调节表1).在他们之中,参与转录的基因,(辅助)细胞壁的生物合成,细胞壁的膨胀和变形例中,碳水化合物代谢,应激反应和未知功能的蛋白是突出(表1).有显着的木质素单体的生物合成基因没有差异表达。
我们独立计算了SND2.通过鉴定与本地有关的基因SND2.使用表达式钓鱼[在AtGenExpress加扩展组织设置公共微阵列数据成绩单41.],采用严格的皮尔逊相关系数阈值(R > 0.90)。与SCW生物合成相关的基因(如次级壁)中国极限运动协会那IRX基因)以及先前涉及SCW调节的TFS(myb103那SND1.),是31个被发现与之共同表达的基因之一SND2.(表2),支持一个角色SND2.在SCW调节。的基因22在SND2∩Ko数据是差异表达的(表2).
在ATH1 22K阵列上表示的75个SND2∩ko基因跨越Genevistigator V3进行分层聚类拟南芥解剖学数据库(39.]来分析它们的组织特异性。除了一个基因(AT5G24780)外,所有基因都找到了独特的探针。一簇(a)包含31个基因,它们优先以类似的方式表达SND2.,即在花序节和茎,莲座茎和木质部,和角质部(图1).的13个基因(b)另一簇出现在花序茎和节点,莲座茎,偶尔幼苗的下胚轴,根碑和含花药的雄蕊,所有这些都含有的SCW在一定程度上表现出优先的表达。因此,与原来的SND2-OV(A)的数据集,在数据集中SND2∩Ko基因的高得多的百分比(59%)显示在含有的SCW组织优先表达。与AtGenExpress共表达分析相结合,这些数据支持的作用SND2.在SCW规则和SND2∩ko数据集的有效性,作为SND2的最有可能的直接或间接目标。
ATH1 22K阵列中代表的SND2∩KO基因的绝对转录物丰度拟南芥组织和器官.Genevestigator V3 (39.使用用于微阵列数据挖掘和解剖聚类分析工具来显现,并根据它们的组织特异性表达模式聚簇的基因。组织/器官中被分层交错,和在其上的数据是基于阵列的数目在括号中表示。绝对成绩单值表示为它们的表达可能性的百分比(E.P.),其中E.P.是平均的跨所有阵列的给定探针组杂交信号的前1%。簇(a)中,以红色突出显示,是由31个基因,其中包括SND2.(*),在组织和器官中优先表达SND2.表示。簇(b)中包括的13个基因中,其显示花序优先表达的茎和节点,莲座茎,并且在一些情况下,雄蕊,幼苗根的下胚轴和/或脉管系统(碑)。
通过RT-QPCR分析验证了微阵列结果。我们根据八周龄SND2-ov(A)和野生型植物的茎分离的微阵列RNA(图2).所有RT-qPCR的轮廓同意与微阵列数据,以及7个基因均显著(P.<0.05)上调(包括CesA4那expa15.那FLA12和myb103).我们还确认了内源性SND2.SND2-OV(A)茎的转录组无显著变化,而总转录组无显著变化SND2.SND2-OV(A)茎的转录本丰度(转基因和内源性转录本的总和)是野生型的180倍(未显示)。我们在一项独立试验中获得了从植物中选择的基因的类似结果1,图S3)。
在组成思考表达时,我们对花序茎干发育的时间效应感兴趣。因此,我们在四周的年龄上进行了SND2-OV(A)和野生型植物的第二次微阵列分析,采样花序茎〜120毫米。在21个上调和24个下调的DEG中,没有SND2∩KO候选者存在,也不是任何SCW生物合成相关基因(附加档案4.).这一结果表明,附加的共调节器(多个),只有四个星期后表达,需要SND2至纤维SCW调节功能。
的影响SND2.超表达上拟南芥SCW厚度,生物质和SCW组合物
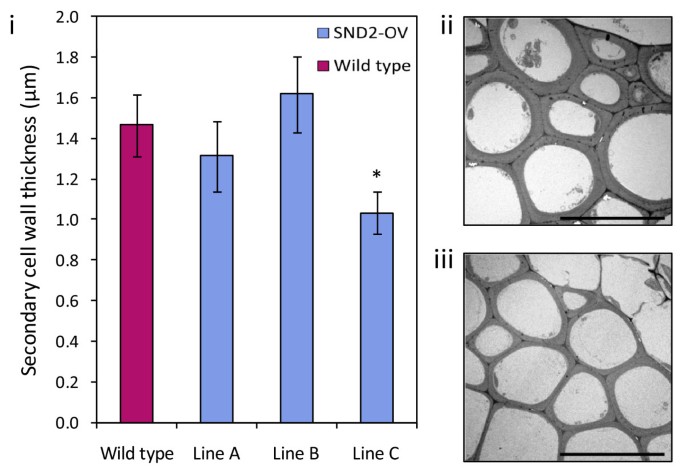
钟et al。[21.]之前报道过SND2.过表达在眶纤维(IF)中显着增加了SCW厚度拟南芥花序梗。然而,在我们的纯合子SND2-OV株系中,扫描电子显微镜(SEM)显示A和B株系的纤维壁厚度没有显著变化,而C株系的scw明显比野生型更薄(图)3.).这些结果在使用光学显微镜的独立试验中转载(附加文件1,图S4)。
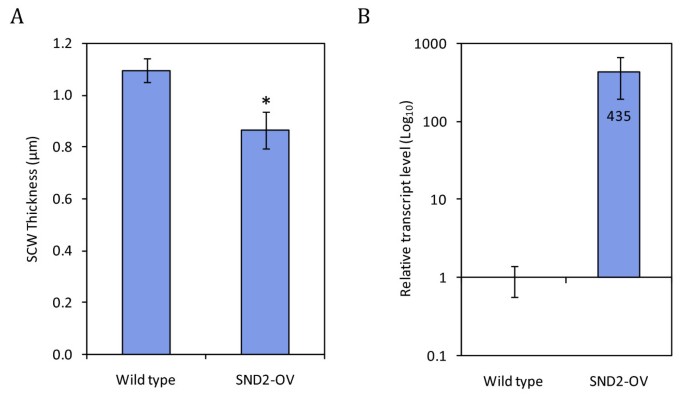
在光镜下测定了7株T1 SND2-OV和8株野生型植株的花序茎的纤维SCW厚度。有代表性的显微照片见附加文件1,图S5。T1线路表现一个显著(21%,P.<0.02)平均值如果SCW厚度(图)降低(图4A)类似于SND2-OV线C和SND2.主导抑制表型以前报道[21.].内源性和转基因结合的SND2.T1植物的转录物丰度超过野生型植物的〜435倍,将共抑制作为表型的解释(图4B.).虽然可以在没有明显的相关性SND2.转录性丰富和SCW厚度,我们的数据确认强大SND2.过表达减少了IF SCW厚度。
的影响SND2.如果T1代杆中壁厚的过度表达.(a)8周龄野生型和T1代SND2-OV茎if的平均SCW厚度。有代表性的光学显微镜图像显示在附加文件1,图S5。误差条表示八种野生型平均值的标准误差,七种T1植物(每株植物测量26-48纤维)。*基于同性恋双尾学生T检验的野生型显着不同(P.< 0.02)。(b)相应的转录本丰度的总SND2.6个野生型和6个用于SCW测定的SND2-OV T1植株下茎的转录本,通过RT-qPCR测定。引物对定量内源性和转基因SND2.成绩单。总计SND2.转录物是〜435倍相对于野生型,在这里表示的日志10.规模。通过针对三种对照基因的标准化获得校准的归一化相对量(CNRQ)值。误差栏表示六植物平均值的标准误差。
我们假设SND2.过表达可以影响整体花序茎生物质,而不管SCW厚度如何。称量为八周历至八周龄T4 SND2-OV线A,B和C的整个花序茎以确定总生物质产量。只有在最过度抑制的线路中,SND2-OV线C,生物质与野生型显着不同,其中新鲜和干生物量减少(附加文件1,图S6)。这是尽管事实上,所有SND2-OV线出现了表型正常,并没有表现出阻滞或矮化(结果未显示)。在其他文件生物质能概况1,图S6分别与用于每个相应行中的IF SCW厚度分布协议(图3.),表明IF SCW厚度和生物量产量,和过度因此具有负面影响之间的直接关系SND2.过表达对生物量产量。
花序的化学组成茎通过Klason木质素分析和以下完整酸水解单糖的定量研究。SND2-OV(A)显示出在总木质素(标称但统计学显著2.5%的相对减少表3.那P.= 0.03)。这可能是由于不溶性木质素的减少(见表)3.).没有变更在葡萄糖和木糖的相对丰度是明显的,并且仅甘露糖和鼠李糖在线路A中显著增加(P.<0.05)分别为7.4%和5.4%(表4.).我们还量化了SND2-OV线C的化学组成,以研究纤维壁厚降低时的SCW组成。然而,木质素和单糖含量对野生型没有变化(未显示)。
诱导的体细胞过度表达SND2.in.桉树茎部门
与诸如的草本年度相比拟南芥在木质部形成过程中,木本多年生植物的碳分配比例较大。因此我们检验了拟南芥snd2Xylem纤维特征的过度表达桉树由体细胞诱导部门分析[树42.].用pcambia1305.1构建体转化茎(含有β-Glucuronidase或'Gus的报告基因)过表达SND2..在195-210天之后采集树干,通过GUS报告染色在横断面上识别转基因区域,并在扫描电镜分析前蚀刻以圈定转基因区域(附加文件)1,图S7)。
纤维尺寸是从SEM显微照片测量为11个基因扇区和相邻的野生型扇区的之间的百分比变化SND2-过表达基因构建体,以及仅表达GUS报道九空载体对照(EVC)扇区。纤维细胞区域(即平均纤维横截面面积)在相比EVC扇区SND2-OV扇区被显著增加(表5.那P.= 0.042),这表明SND2.影响纤维发展桉树.纤维细胞壁面积和管腔面积,其包含纤维细胞区域,在被轻微增加SND2.-过表达扇区相对于EVC扇区,但这些个体参数的差异没有统计学意义。然而,由于细胞壁面积的增加SND2-过表达行业接近显著(P.= 0.066),可以合理地认为纤维细胞面积的增加主要是由于细胞壁面积的增加而不是管腔面积的贡献。中纤维细胞面积的测量拟南芥T4和T1的SND2-OV株系与野生型无显著差异(未显示)。
讨论
一个角色SND2.在规范中拟南芥纤维SCW的形成以前是由将其作为SND1的间接靶点的研究提出的,SND1是纤维SCW形成的主要调节剂[18.那20.-22.那28.].在启动子转移试验中,SND2.涉及纤维素的调节(CesA8),但在调节半纤维素和木质素生物合成中的作用似乎不太可能[21.].特别有趣的发现是SCW厚度的特异性纤维细胞的增加SND2.由主要抑制线的纤维SCW厚度降低,镜像是组成的过表达,镜像厚度下降[21.].SND2中提出的作用拟南芥纤维SCW的形成尚未被独立验证,完整的SND2调控基因尚未阐明。为了解决这个问题,我们对纯合子进行了微阵列分析SND2.过度抑制线,SND2-OV(A),其也表现出显着上调的CesA8基因。
已经证明,当异位表达时,转录因子可以激活新的靶标。班尼特描述了一个引人注目的例子et al。[40用于转录因子NAC调节根冠初生细胞壁修饰。在过表达引起茎异位木质化和SCW基因的异位表达[40].我们的微阵列结果可能包括SND2的直接和间接靶点,以及由于异位过度表达而误解的基因SND2..到SND2的判别本地目标,我们定义了由SND1 [调节的基因的一个子集(SND2∩Ko)28.[还发现在本研究中表达差异(表1).我们推断出获得SND1的目标子集是一种稳健的方法,用于降低异位噪音,因为SND2.是由SND1间接但强烈激活的[21.那28.因此,本机SND2目标应成为SND1目标的子集。进一步支持将这些七十五个基因定义为推定的SND2靶标的发现,该发现是共调节(R> 0.9)的大部分(71%)基因SND2.在一个大型AtGenExpress微阵列实验纲要中,SND2∩Ko集合被包括在内(表2).最近,钟et al。[43.]证实杨树反式激活CesA4那CesA8, GT43和GT47家族基因启动子由杨树同源同源SND2.,提供了第三条证据SND2.SCW的调节作用相关基因。
所述SND2∩Ko集(表1)主要包括参与SCW生物合成、转录调控和信号转导的基因。在scw相关基因中,CesA4那CesA7和CesA8参与SCW纤维素生物合成[44.-46.].COBL4和它的直向同源物也似乎参与在SCW纤维素的形成[47.那48.],最近是一个同源物毛滴经的双折射那TBL3.(AT5G01360),显示出影响通过在果胶甲酯化的改变[二次纤维素沉积和可能的SCW结构49.].哲水蚤那IRX8.和IRX10SCWS中的木聚糖生物合成需要[50.-53.].IRX15和IRX15L,编码功能上冗余的DUF579蛋白,最近被证明是正常木聚糖生物合成所必需的[54.那55.],但在SND2-OV(A)茎中只有前者表达上调(表1)1).PGSIP1和UXS3.用木聚糖合成酶的共表达,具有很好的证据支持了木聚糖α-葡萄糖醛酸的功能PGSIP1[56.]和UDP-XELOSE合成酶功能UXS3.[57.那58.].如前所述[21.],SND2.没有激活Xylan相关的IRX9.基因在这项研究中,也没有激活木质素相关4CL1.LAC4和LAC17编码漆酶,一种与SCW木质素聚合有关的酶组[59.].LAC4和LAC17由木质素特异性TFS MyB58和MyB63监管[60.[最近也显示出影响矛盾拟南芥木质部,与LAC17具体涉及IFs中的g -木质素聚合[61.].我们的结果(表1)因此表明了额外的作用SND2.在调节褐煤中不同于单醇素生物合成的。
几个课题组在SND2∩Ko集被上调(表1).ANAC019调节生物和非生物应激反应[62.那63.].AT4G17245是一个功能未知的C3HC4环型锌指基因。然而,至少有一个C3HC4基因,AT1G72220,此前已被发现与SCW的形成有关[47.].我们观察到的上调RAP2.6L,乙烯反应因子参与芽再生和非生物胁迫应答[64.那65.].的upregulationSND1.和myb103在SND2(OV)植物意外。SND1,纤维中SCW生物合成的主激活剂[18.那20.-22.那28.,预计是SND2在转录网络中的上游。这似乎也很直观SND2.徒的下游myb103,因为SND2.是SND1的间接目标,而myb103是一个直接的目标SND1.[21.].正反馈回路可能存在通过其上调SND2.,或另一个tf(表1),促进SND1.表达式。
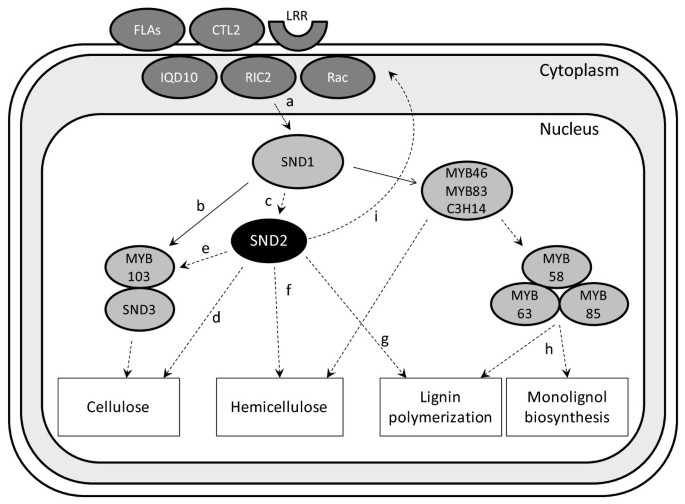
最近,提出了一种基于哺乳动物信号模型的信号转导途径,用于SCW生物合成拟南芥和水稻(图4中[56.])。SND2∩KO中的差异表达基因包括编码该机器的主要蛋白的那些(表1),即FLA11 / FLA12那CTL2(AT3G16920),LRR激酶(AT1G08340),RAC(AT2G36570),IQ(IQD10,AT3G15050)和RIC(AT1G27380)。几丁质酶样2(CTL2),其缺乏几丁质酶或几丁质结合活性[66.],可能与互动FLA11 / 12以类似的方式,以几丁质酶的哺乳动物样蛋白质SI-CLP的与fasciclin结构域的跨膜受体的相互作用,Stabilin-1 [56.那67.].另外两个激酶(AT1G09440和AT1G56720,表1)也可能会被参与这一信号级联。基于这些发现,我们提出了SND2的转录网络纤维SCW沉积底层中的作用的订正模型(图5.).在这种模式下,SND2直接或间接上调与此信令机械相关联的基因。这种监管关系的性质仍有待解决。
提出了snd2介导的IFs SCW调控模型.实线表示已知的蛋白质- dna直接相互作用。虚线表示直接或间接的蛋白质- dna相互作用。主调节因子SND1是由Oikawa提出的信号转导途径激活的et al。[56.(a). SND1直接激活的转录myb103和SND3.(b)和间接激活SND2.通过未知的中间体(C; [21.])。SND2激活纤维素,合成塞萨s,直接(d)或通过激活myb103(e)中,这是已知的激活SCW纤维素基因,CesA8[21.].SND2调节半纤维素基因(f;表1),独立于SND1直接目标所起的类似作用MYB46那MYB83或者C3H14[76.-78.].SND2通过激活木质素聚合基因在木质素化中发挥作用LAC4和LAC17(g;表1),但它不调节单醇生物合成基因,因为MyB58,MyB63和MyB85(H)的情况是[21.那60.].SND2激活gpi锚定的转录FLA11 / FLA12那CTL2和信号转导途径(I)的其他部件,这导致的上调SND1.(a)。
尽管相关的生物合成基因上调,但我们没有观察到每单位质量的葡萄糖(即纤维素)或木糖(即木聚糖)含量的相对增加(见表)4.).两者之间可能没有直接的关系塞萨表达和纤维素含量,如证明的那样SND1.过度表达[28.].然而,我们发现的茎显著在SND2-OV(A)通过分别7.4%和5.4%,增加了甘露糖和鼠李糖含量(表4.).甘露糖的增加可以通过上调来解释CslA9(表1),因为CSLA蛋白编码β-甘露甘露合成酶[68.那69.].据报道,耳环和甘露糖类因SND1.过度表达[28.].
虽然我们发现对纯合SND2-OV线A和B中的纤维SCW厚度没有影响,但相对于野生型,线C的纤维SCW厚度显着且可重复地降低(图3.;额外的文件1,图S4)。因为直线C是最高的SND2.纯合线中的转录物丰度(附加文件1,图S1),我们证实了使用多个T1SND2.-Overxpressing线条,与SND2.转录量远高于SND2-OV(A),强SND2.过度表达可降低光纤SCW厚度(图4.).这种表型类似于主要的抑制表型SND2.,而不是过表达表型,先前报道了[21.].然而,由于稳定表达SND2.所有转基因素中的转录物(附加文件1,图S1;figure4.),这不能通过共抑制来解释。有趣的是,已观察到类似的悖论SND1.过度表达[20.那28.[据报道,该转录活化剂的过量水平有间接抑制作用。我们认为这种现象可以归因于基因剂量效应,其中一个TF蛋白的化学计量增加导致多蛋白质复合物的摩尔产率降低,更高的不完全中间体的产量(由Birchler审查et al。[70])。这种现象也可以解释的意见,即CesA8上调限于最温和的SND2.-Overxpressing Line,SND2-OV(A)。值得注意的是,我们研究中的转基因素表达SND2.至少一个数量级大于Zhong报告的纤维壁厚度增加的细胞系的~16倍表达水平et al。[21.].这可能是由于双重而不是单身,Camv 35s.启动子在pMDC32矢量驱动SND2.本研究过度表达。因为我们未能识别SND2-OV线路SND2.大量在16倍的范围内,我们无法排除那个有限SND2.过表达可能增加纤维SCW厚度。
有趣的是,当我们过度拟南芥snd2in.桉树Xylem(表5.),我们观察到与此前报告的更好一致的表型拟南芥[21.].SND2.过度表达桉树显著增加的纤维细胞区,可能是由于增加的细胞壁面积(表5.).因为我们对SND2.在多个独立事件中的过度表达拟南芥和桉树对比不仅相互对比,而且与中钟的相比et al。[21.],我们的结果表明的表型效应SND2.功能获得突变本质上是可变的。积极的影响SND2.超表达上桉树光纤发展可能是更大宽容的结果桉树与高丰度SND2和/或SND2协同调节水平的木质部,因为更多的碳分配到SCW生物合成桉树而不是拟南芥.或者,SND2.转录水平保持适度桉树,使用诱导的躯体扇区分析技术无法探索的可能性。
除了SND2丰在适当水平的要求拟南芥,共调节器(S)的空间和时间表达是进一步的要求。的纤维限制SCW表型SND2.观察过过度表达拟南芥由钟et al。[21.]示出了在空间上调节的共调节器(一个或多个),用于SND2的要求激活其目标,其中据推测也以纤维中表达。我们的研究结果支持这一观察。由于这样的事实,没有一个基因的八周的差异表达(表1),第四周差异表达的茎(附加文件4.),我们进一步认为共调节因子是受时间调节的,并且共调节因子的时间调节可能是限制SND2在4周内激活其天然靶基因能力的限制性因素。
结论
我们的结果表明SND2.调节参与纤维素,甘露甘露植物和木聚糖生物合成,细胞壁改性和木质素聚合的基因,但不是单甘氨酸生物合成。SND2还促进了相对少量的TFS的上调,其中包括myb103和SND1..我们牵连SND2.在提出SCW发展的信号转导途径的机械意外调节中[56.],并提出一个模型,其中SND2在转录调控网络中处于从属但中心的位置(图5.),并可能间接正向反馈到更高的调控和信号通路。我们的数据支持的作用SND2.但我们的研究表明,在过表达水平过高时,SND2.如果SCW沉积,则对此产生负面影响。这种现象需要进一步调查。我们假设这一点SND2.过表达能增加SCW沉积过表达的有限范围内,在另外的丰度调节蛋白的部分依靠。然而,我们表明,SND2.过度表达具有增强纤维开发的潜力桉树树木,一个重要的商业林业作物。
方法
植物生长条件
拟南芥蒂利亚纳哥伦比亚(col0)植物在挪威Jiffy Products International AS的泥炭苔藓袋中生长,人工光照16 h,湿度为~22°C和~75%,每周施肥。在适用的情况下,在将幼苗转移到泥炭藓袋之前进行~14天的湿霉素选择。植物的年龄包括湿霉素选择期。
发育过度表达构建和转化
编码序列SND2.(AT4G28500)扩增(正向引物,5'-ATGACTTGGTGCAATGACCGTAG-3' ,反向引物5'-TTAAGGGATAAAAGGTTGAGAGTCAT-3' )从拟南芥蒂利亚纳COL-0花序干细胞cDNA。通过Mineelute凝胶提取试剂盒(Qiagen,valencia,CA),并根据制造商的说明(Invitrogen,Carlsbad,CA),凝胶用凝胶纯化凝胶纯化。将测序的插入刀片转移到PMDC32和PCAMBIA1305.1 [35.]使用网关LR Clonase™II酶混合物(Invitrogen)。将构建体引入农杆菌肿瘤术PMDC32和PCAMBIA1305.1的菌株LBA4404和AGL1,其次是农杆菌 -介导的变换拟南芥蒂利亚纳Col-0。表面灭菌后,在含20 μg/ml潮霉素b的0.8%琼脂上选择转基因种子,在4℃人工分层2-4天,然后在22℃人工光照下萌发。
微阵列分析
试验8周,选用T4幼苗,用潮霉素处理2周,泥炭藓袋处理6周。在为期四周的试验中,没有选择;纯合子T4种子直接在泥炭藓上萌发。在4周和8周的实验中,每3个生物重复分别由10或6株植物组成。当日08:30 - 11:00采集茎组织,液氮速冻-80°C保存。从初生花序茎底100 mm处提取的总RNA经Qiagen (RNase-free DNase Set)处理,利用内含子跨引物PCR检测基因组DNA污染。使用Experion™仪器(Bio-Rad Laboratories, Inc.)对RNA完整性进行定量。根据非洲基因技术中心(ACGT)微阵列设施的规定进行cDNA合成和花青素染料偶联(可在http://www.microarray.up.ac.za/MA008_indirect_labelling_version3.pdf).
微阵列杂交使用拟南芥蒂利亚纳4×44K DNA微阵列V3(安捷伦科技圣克拉拉,CA),按照制造商的说明书,描述,但具有的cDNA代的cRNA。染料掉期采用正确的荧光偏见。玻片用扫描的轴突4000B的GenePix仪(Axon仪器,福斯特市,CA,USA)。使用轴突的GenePix Pro软件(V6.0)中提取,并将其导入LIMMA(线性模型用于微阵列数据)功能[71.].数据在r中的r标准化,如crampton所述et al。[72.],具有基于SND2-OV(A)和野生类型之间的比较的线性模型,独立地分析每个时间点。显着的DEG被定义为具有P的那些C.值<0.05,其中PC.为错误发现率。所有微阵列实验的原始数据文件均可从基因表达文集中获得http://www.ncbi.nlm.nih.gov/projects/geo/,加入号为GSE29693。
在选定的差异表达的基因进行表达的解剖荟萃分析拟南芥在genevinvestigator V3公共微阵列数据库中,通过层次聚类(Pearson相关)对组织进行分析[39.].仅选择高质量的ATH1 22K阵列和对单个基因具有高度特异性的探针,用于分析。
逆转录定量聚合酶链反应(RT-QPCR)分析
通过Experion TM分析评估从下花序茎中提取的总RNA的质量(Bio-Rad Laboratories,Hercules,CA)评估。第一链用的是Improm-II™逆转录酶cDNA合成试剂盒(Promega,麦迪逊,WI)执行从基因组不含DNA的RNA合成cDNA,并使用RNeasy Mini试剂盒(Qiagen)进行cDNA的纯化。使用的LightCycler 480系统RT-qPCR反应进行定量[45个循环95℃变性(10秒),60℃退火(10秒)和72℃延伸(15秒)](罗氏有限公司,巴塞尔,瑞士)。用于每个基因目标的引物序列在附加文件中列出3.表S2。的LightCycler 480软件诉1.5.0。(罗氏公司)用于二阶导数的最大值的计算和熔解曲线分析。用Biogazelle qBasePLUS进行统计分析[73.].
显微镜
对于光学显微镜,初级花序茎的下〜5mm在甲醛/戊二醛缓冲液(分别为3.5%和0.5%v / v)中,最多5天,然后在嵌入LR White™之前在乙醇系列中脱水树脂。用甲苯胺蓝色可视化0.5μm厚度的茎切片。使用imagej软件进行显微照片测量(国家健康研究院,http://rsbweb.nih.gov/ij/),使用用于细胞面积测量多边形工具。对于SEM,90纳米厚的环氧树脂包埋标本进行成像以下甲醇钠,1分钟[蚀刻74.]在5kV使用LEO 1455 VP-SEM仪器(卡尔蔡司,德国)。
木质素与细胞壁糖分析
将8周大的转基因和野生型植株的完整花序茎剥去角状叶和茎状叶并干燥(100°C, 24小时)。将多达24株植株的茎汇集在三个生物重复中。细胞壁糖和Klason木质素分析基本上按照Coleman的描述进行等[75.,采用高效液相色谱法(Dionex CarboPac PA1 4 × 250 mm)测定碳水化合物浓度。进行了三次技术重复。
诱导躯体部门分析(ISSA)
如前[所述进行ISSA42.经过一些修改。两个杂交无性系各有11个分株,巨桉X.大肠camaldulensis和大肠camaldulensisX.蓝桉,在形态和生长良好的基础上,在初夏选择10个1 cm2在每个植物上创建了Cambial Windows。农杆菌肿瘤术AGL1封存了包含的PCAMBIA1305.1拟南芥snd2CDS和β-Glucuronidase或'Gus'报告基因注入牙盖窗口中。植物在接种后受精,并以与此前描述的相同条件保持在玻璃料中[42.]直到收获。195-210天后从主干中切除壁挂窗,除去韧皮肌部分,剩余的木质组织用0.1m Napo洗涤两次4.缓冲液(pH 7)。转基因领域被GUS记者染色鉴定。十一SND2.- 分析了一定抑制和九种空载体对照部门。在1-3毫米的嵌段中切除转基因扇区3.(从悬浮型到缠绕的实质)使用单个边缘剃刀刀片,使得当在纵向切线平面上观察时,扇区靠近块的中间。然后横穿扇区的中间切割块以暴露扇区的横向表面,然后在SEM分子上安装导电粘合剂。通过用剃刀刀片蚀刻Gus报道染色的边界,通过蚀刻Gus报道器染色的边界来描绘转基因扇区。在SEM成像之前,嵌段被干燥过夜。使用Quanta环境扫描电子显微镜(Fei,Hillsboro,Oregon)进行细胞形态测量,以研究细胞壁厚度,细胞壁区域(细胞壁总量),细胞面积和腔区域的变化。图像拍摄两种转基因扇区的和直接相邻的非转基因组织,20到50的细胞从所述形成层表面,采用低真空模式。然后使用免费图片-J分析图像http://rsbweb.nih.gov/ij/每显微照片测量十纤维。对于细胞壁厚度,每个细胞壁的三个测量的平均值用于细胞壁厚度计算,而对于剩余性能,每根纤维的一个值就足够了。为每个扇区和其非转基因对照组织计算平均值,并转化为百分比变化值。百分比变化值之间SND2.过表达扇区和空载体控制(EVC)与学生的T检验有统计评估。
缩写
- DEG:
-
差异表达基因(年代)
- EVC:
-
空载体对照
- 罗斯福:
-
假发现率
- 去:
-
基因本体论
- 如果:
-
interfascicular纤维
- ISSA:
-
诱导躯体部门分析
- NST:
-
Nac二次壁增厚促进因子
- 标准铜线:
-
二级细胞壁
- SEM:
-
扫描电子显微镜
- SND:
-
次要壁相关NAC域
- SWN:
-
次壁NAC:TF:转录因子
- VND:
-
血管相关的NAC域。
参考文献
- 1。
Hinchee MAW, Mullinax LN, Rottmann WH:木质生物质和专门种植的树木作为可再生能源的原料。可持续生产能源和副产品的植物生物技术。编辑:Mascia PN, Scheffran J, Widholm JM。施普林格柏林,海德堡,2010,66:155-208。10.1007 / 978 - 3 - 642 - 13440 - 1 - _7。
- 2。
ploion C, Leprovost G, Stokes A:树木中的木材形成。植物营养与肥料学报。2001,27(4):413 - 423。10.1104 / pp.010816。
- 3.
奥纳T,园田T,伊藤K,柴田男,玉井Y,小岛Y,大岛Ĵ,横S,吉泽N:在细胞和纸浆性能之间的关系的研究桉树由内树性质变化的研究。木材科学与技术。2001年,35(3):229-243。10.1007 / s002260100090。
- 4.
Ramirez的男,Rodriguez的Ĵ,Balocchi C,Peredo男,Elissetche JP,门东萨R,巴伦苏埃拉S:的化学成分和木材解剖学桉树球液克隆:变型和关系与污染性和手抄品属性。作者:王莹,中国化学与技术CHINESE。2009,29(1):43-58。10.1080 / 02773810802607559
- 5。
Courtois-Moreau CL, Pesquet E, Sjödin A, Muñiz L, Bollhöner B, Kaneda M, Samuels L, Jansson S, Tuominen H:木质部纤维细胞死亡的独特程序杨树茎。工厂J.2009,58(2):260-274。10.1111 / J.1365-313x.2008.03777.x。
- 6。
特纳,Gallois P,棕色D:气管元素分化。Annu Rev植物Biol。2007,58:407-433。10.1146 / annurev.arplant.57.032905.105236。
- 7。
纤维素合成酶和合成拟南芥.分子植物。2011,4(2):199-211。10.1093 / MP / SSQ079。
- 8。
Guerriero G,Fugelstad J,Bulone V:我们真正了解高等植物中的纤维素生物合成真正的了解。中国综合植物生物学杂志CHINESE。2010年,52(2):161-175。10.1111 / J.1744-7909.201010.00935.x。
- 9。
Scheller HV,Ulvskov P:半纤维素。Annu Rev植物Biol。2010,61:10.11-10.27。
- 10。
Chapple C:重写木质素路线图。植物营养与肥料学报。2002,5:224-229。10.1016 / s1369 - 5266(02) 00257 - 1。
- 11.
Vanholme R,Morreel K,Ralph J,Boerjan W:Lignin Engineering。CurrOp植物BIOL。2008,11(3):278-285。10.1016 / J.PBI.2008.03.005。
- 12.
福田H,Komamine A:建立一种从叶片中分离的单细胞进行气囊元素分化的实验系统Zinnia Elegans..植物理性。1980年,65:57-60。10.1104 / pp.65.1.57。
- 13。
Zhong R,Lee C,YE Z-H:转录网络调节二次细胞壁生物合成的进化守恒。趋势植物SCI。2010,15(11):625-632。10.1016 / j.tplants.2010.08.007。
- 14。
Du J,GREOVER A:二次生长和木材形成的转录调节。中国综合植物生物学杂志CHINESE。2010年,52(1):17-27。10.1111 / J.1744-7909.201010.00901.x。
- 15.
Kubo M, Udagawa M, Nishikubo N, Horiguchi G, Yamaguchi M, Ito J, Mimura T, Fukuda H, Demura T:原生木质部和后生木质部导管形成的转录开关。基因工程学报,2005,19:1855-1860。10.1101 / gad.1331305。
- 16。
山口男,久保男,福田H,出村T:血管相关NAC-DOMAIN7涉及所有类型的木质部导管的在分化拟南芥“根与芽”。植物学报,2008,55:652-664。10.1111 / j.1365 - 313 x.2008.03533.x。
- 17。
山口男,纳迪亚G,五十岚H,大谷男,中野Y,莫蒂默JC,西久保N,久保男,片山Y,挂川K,Dupree的P,出村T:血管相关NAC-DOMAIN6(VND6)和VND7有效地诱导转到下的感应系统的控制木质部导管分子。植物理性。2010,153:906-914。10.1104 / pp.110.154013。
- 18。
Mitsuda N,IWase A,Yamamoto H,Yoshida M,Seki M,Shinozaki K,Ohme-Takagi M:NAC转录因子,NST1和NST3,是在木质组织中形成二级墙的关键调节因子拟南芥.植物细胞。2007,19:270-280。10.1105 / TPC.106.047043。
- 19。
MITSUDA N,OHME-TAKAGI M:NAC转录因子NST1和NST3通过在建立组织标识后促进二次壁形成,通过促进部分冗余的方式调节POD碎片。工厂J. 2008,56(5):768-778。10.1111 / J.1365-313x.2008.03633.x。
- 20。
Zhong R,Demura T,Ye Zh:SND1,NAC结构域转录因子,是纤维中二级壁合成的关键调节因子拟南芥.植物学报,2006,18(11):3158-3170。10.1105 / tpc.106.047399。
- 21。
钟锐,李超,周俊,麦卡西RL,叶志辉:一组参与调控次生细胞壁生物合成的转录因子拟南芥.植物细胞。2008,20:2763-2782。10.1105 / TPC.108.061325。
- 22。
钟R,理查森EA,叶Z-H:二NAC结构域转录因子,SND1和NST1,冗余地在纤维次生壁合成的调控功能拟南芥.Planta。2007年,225(6):1603年至1611年。10.1007 / s00425-007-0498-γ。
- 23。
Mitsuda N, Seki M, Shinozaki K, Ohme-Takagi M: NST1和NST2的NAC转录因子拟南芥调节次壁加厚,并且需要脱裂。植物细胞。2005,17:2993-3006。10.1105 / TPC.105.036004。
- 24。
梅泽T:肉桂/木质素单体途径。植物化学评价。2009年,9(1):1-17。
- 25。
ohashi-ito k,oda y,fukuda h:拟南芥血管相关NAC-DOMAIN6直接调节支配木质部分化期间程序性细胞死亡和次生壁形成的基因。植物细胞。2010,22:3461-3473。10.1105 / tpc.110.075036。
- 26。
钟R,李C,叶Z-H:的NAC主开关在次生壁的直接目标全局分析拟南芥.分子植物。2010年,3(6):1087年至1103年。10.1093 / MP / ssq062。
- 27。
Yamaguchi M, Mitsuda N, Ohtani M, Ohme-Takagi M, Kato K, Demura T: VASCULAR-RELATED NAC-DOMAIN 7直接调控木质部导管形成的广泛基因的表达。植物学报,2011,66:579-590。10.1111 / j.1365 - 313 x.2011.04514.x。
- 28。
Ko J-H,Yang Sh,Park Ah,Lerouxel O,Han K-H:ANAC012,植物特异性NAC转录因子家族的成员,负调节木质纤维发育拟南芥蒂利亚纳.工厂J. 2007,50(6):1035-1048。10.1111 / J.1365-313x.2007.03109.x。
- 29.
Hiratsu K,满田N,松井K,奥默-高木L:的SUPERMAN节目的最小抑制结构域,所述DLELRL六肽是必要的和足够的转录的抑制的鉴定拟南芥.生物化学学报。2004,31(1):172-178。10.1016 / j.bbrc.2004.06.115。
- 30.
Tuskan GA,DiFazio S,Jansson的S,BohlmannĴ,格里戈里耶夫I,赫尔斯滕U,帕特南N,拉尔夫S,Rombauts S,Salamov A,沙因Ĵ,Sterck L,Aerts A,Bhalerao RR,Blaudez d,Boerjan W,布伦甲那Brunner A, Busov V, Campbell M, Carlson J, Chalot M, Chapman J, Chen G-L, Cooper D, Coutinho M, Couturier J, Covert S: The genome of black cottonwood,Populus Trichocarpa.(托。&灰色)。中国科学(d辑):地球科学(英文版)。10.1126 / science.1128691。
- 31。
格兰特EH,藤野T,啤酒EP,布伦纳AM:NAC的表征在血管细胞分化的控制牵连结构域转录因子拟南芥和杨树.植物学报。2010,32(3):437 - 442。10.1007 / s00425 - 010 - 1181 - 2。
- 32。
胡R,齐G,香港Y,香港d,高Q,周G:在NAC域转录因子基因家族的综合分析Populus Trichocarpa..BMC植物BIOL。2010,10:145-
- 33。
McCarthy RL, Zhong R, Fowler S, Lyskowski D, Piyasena H, Carleton K, Spicer C, Ye Z-H:杨树MYB转录因子PtrMYB3和PtrMYB20参与了次生壁生物合成的调控。植物生理学报。2010,51(6):1084-1090。10.1093 /卡式肺囊虫肺炎/ pcq064。
- 34。
钟R,利C,叶Z-H:的杨木相关NAC结构域转录因子的功能特性。植物理性。2010,152:1044年至1055年。10.1104 / pp.109.148270。
- 35。
Curtis MD,Grossniklaus U:用于基因的高通量功能分析的网关克隆向量在Planta..植物理性。2003,133:462-469。10.1104 / pp.103.027979。
- 36。
Martin D,Brun C,Remy E,Mouren P,Thieffr D,Jacq B:Gotoolbox:基于基因本体学基因数据集的功能分析。基因组Biol。2004,5:R101-10.1186 / GB-2004-5-12-R101。
- 37。
Rhee Sy,Beavis W,Berardini TZ,陈G,Dixon D,Doyle A,Garcia-Hernandez M,Huala E,Lander G,Montoya M,Miller N,Mueller La,Mundodi S,Reiser L,Tacklind J,Weems DC,吴y,xu我,yoo d,yoon j,张p:the拟南芥信息资源(TAIR):一个模型生物数据库,提供了一个集中的、有组织的网关拟南芥生物学,研究资料和社区。核酸RES。2003年,31(1):224-228。10.1093 / NAR / gkg076。
- 38。
赵c,克雷格·jc,petzold he,dickerman aw,啤酒ep:xylem和phloem从二级组织转录om拟南芥根下胚轴。植物理性。2005年,138:803-818。10.1104 / pp.105.060202。
- 39。
Hruz T,Laule O,Szabo的G,Wessendorp楼布罗伊尔S,Oertle L,Widmayer P,Gruissem W,齐默尔曼,P:Genevestigator V3:用于转录的荟萃分析的参考表达数据库。进阶生物信息学。2008年,2008年:420747-
- 40.
Bennett T, Toorn Avd, Sanchez-Perez GF, Campilho A, Willemsen V, Snel B, Scheres B: SOMBRERO, BEARSKIN1,和BEARSKIN2调节根冠成熟拟南芥.植物细胞。2010年,22:640-654。10.1105 / TPC.109.072272。
- 41.
Toufighi K,贝迪SM,奥斯汀R,Ly的E,Provart NJ:植物学阵列资源:E-Northerns,表达垂钓,和启动子分析。植物J. 2005,43:153-163。10.1111 / j.1365-313X.2005.02437.x。
- 42。
wang h, wang h, wang h, wang h, wang h: β-微管蛋白对植物次生纤维细胞壁中纤维素微纤丝取向的影响。植物学报2007,51:717-726。10.1111 / j.1365 - 313 x.2007.03176.x。
- 43。
Zhong R,McCarthy RL,Lee C,Ye Z-H:在杨树木形成过程中调节二级墙体生物合成的转录程序分析。植物理性。2011,157:1452-1468。10.1104 / pp.111.181354。
- 44。
Taylor N,Laurie S,Turner S:纤维素合成需要多种纤维素合成酶催化亚基拟南芥.植物细胞。2000,12:2529年至2539年。
- 45。
Taylor N,Scheible W-R,Cutler S,Somerville C,Turner S:The不规则的XYLEM3轨迹拟南芥编码所需的次生细胞壁合成中的纤维素合酶。植物细胞。1999年,11:769-779。
- 46。
泰勒NG,豪厄尔斯RM,Huttly AK,维K,特纳SR:互动三个不同的CesA蛋白纤维素合成所必需之中。Proc Natl Acad Sci USA。2003年,100(3):1450至1455年。10.1073 / pnas.0337628100。
- 47。
布朗d,Zeef L,埃利斯Ĵ,古达克R,特纳S:在新基因的鉴定拟南芥使用表达分析和反向遗传参与二次细胞壁形成。植物细胞。2005,17:2281-2295。10.1105 / TPC.105.031542。
- 48。
Sato K, Suzuki R, Nishikubo N, Takenouchi S, Ito S, Nakano Y, Nakaba S, Sano Y, Funada R, Kajita S, Kitano H, Katayama Y:水稻细胞壁结构缺陷突变体的分离拟南芥COBL4ortholog.BC1.调节次级细胞壁组分的沉积所需的。Planta。2010年,232:257-270。10.1007 / S00425-010-1171-4。
- 49。
Bischoff V, Nita S, Neumetzler L, Schindelasch D, Urbain A, Eshed R, Persson S, Delmer D, Scheible W-R:毛滴经的双折射和它的同系物AT5G01360需要在纤维素生物合成的编码特定工厂DUF231蛋白拟南芥.植物理性。2010,153:590-602。10.1104 / pp.110.153320。
- 50。
Brown DM, Zhang Z, Stephens E, Dupree P, Turner SR: IRX10和IRX10-like的特性揭示了glucuronoxylan生物合成的重要作用拟南芥.工厂J.2009,57(4):732-746。10.1111 / J.1365-313x.2008.03729.x。
- 51。
佩尼亚男,钟R,周G-K,理查德森E,奥尼尔男,Darvill A,纽约W,叶Z-H:拟南芥不规则xylem8和不规则的XYLEM9: glucuronoxylan生物合成复杂性的意义。植物学报。2007,19:549-563。10.1105 / tpc.106.049320。
- 52。
Persson的S,Caffall K,Freshour G,Hilley男,鲍尔S,波因德克斯特P,哈恩男,Mohnen d,萨默维尔C:将拟南芥不规则xylem8突变体缺乏血糖醛毒氧基和同源肌炎,这对于二级细胞壁完整性至关重要。植物细胞。2007,19:237-255。10.1105 / TPC.106.047720。
- 53。
吴阿-M,Rihouey C,Seveno男,HörnbladE,SK辛格,松永T,石井T,Lerouge P,马钱答:拟南芥IRX10和IRX10- like糖基转移酶在次级细胞壁形成过程中葡糖醛酸聚糖的生物合成至关重要。植物学报,2009,57(4):718-731。10.1111 / j.1365 - 313 x.2008.03724.x。
- 54。
布朗d,怀特曼R,张Z,Gomez的LD,Atanassov I,Bukowski的J-P,Tryfona T,McQueen的梅森SJ,Dupree的P,特纳S:拟南芥基因不规则的木耳(IRX15),IRX15L是在次生细胞壁木聚糖正常沉积必需的蛋白质编码含有DUF579-。植物杂志2011,66(3):401-413。10.1111 / j.1365-313X.2011.04501.x。
- 55。
IRX15和IRX15- l蛋白的DUF579结构域影响木聚糖的合成拟南芥.植物学报,2011,66(3):387-400。10.1111 / j.1365 - 313 x.2010.04475.x。
- 56。
及川A,乔希HJ,雷尼EA,埃伯特B,Manisseri C,Heazlewood JL,勒HV:一个综合方法的识别拟南芥并参与木聚糖和次生壁发育的水稻基因。Plos一个。2010年,5(11):e15481-10.1371 / journal.pone.0015481。
- 57。
HARPER AD,BAR-PELED M:UDP-木糖的生物合成。一种小说的克隆与表征拟南芥基因家族,UXS.,编码可溶和推定膜结合的udp -葡萄糖醛酸脱羧酶亚型。植物营养与肥料学报。2002,30(4):489 - 494。10.1104 / pp.009654。
- 58。
OKA T,Jigami Y:重建德诺维从本征的udp -葡萄糖合成udp -葡萄糖醛酸和udp -木糖酿酒酵母酿酒酵母.FEBS J. 2006,273:2645-2657。10.1111 / J.1742-4658.2006.05281.x。
- 59。
Mattinen M-L,Suortti T,Gosselink R,Argyropoulos DS,Evtuguin D,SuurnäkkiA,Jong Ed,Tamminen T:不同木质素的聚合通过漆酶。生物资源。2008,3(2):549-565。
- 60.
周Ĵ,利C,锺R,叶Z-H:MYB58和MYB63是木质素生物合成途径中次生细胞壁形成过程中的转录激活因子拟南芥.植物细胞。2009,21(1):248-266。10.1105 / TPC.108.063321。
- 61.
Berthet S,德蒙特-Caulet N,波兰特B,Bidzinski P,CézardL,变的Bris PL,Borrega N,埃尔韦Ĵ,Blondet E,Balzergue S,拉皮埃尔C,Jouanin L:的破坏LACCASE4和17.导致组织特异性改变对木质化拟南芥蒂利亚纳茎。植物学报。2011,23(3):1124-1137。10.1105 / tpc.110.082792。
- 62.
bu q,江h,李c-b,zhai q,zhang j,wu x,sun j,谢q,li c:角色的角色拟南芥蒂利亚纳NAC转录因子ANAC019和ANAC055调节茉莉酸信号的防御反应。细胞res。2008年,18:756-767。10.1038 / cr.2008.53。
- 63.
Tran L-SP,Nakashima K,Sakuma Y,Simpson SD,Fujita Y,Maruyama K,Fujita M,Seki M,Shinozaki K,Yamaguchi-Shinozaki K:隔离和功能分析拟南芥应激诱导的NAC转录因子与干旱响应的结合独联体- 元素在早期响应脱水胁迫1启动子。植物细胞。2004,16:2481-2498。10.1105 / TPC.104.022699。
- 64.
Che P,Lall S,Nettleton D,Howell Sh:拍摄期间的基因表达程序拟南芥组织培养。植物理性。2006年,141:620-637。10.1104 / pp.106.081240。
- 65.
Krishnaswamy S,Verma S,Rahman MH,Kav NNV:四个Apetala2-Family基因的功能表征(RAP2.6那RAP2.6L那DREB19和DREB26.)在拟南芥.植物生态学报,2011,36(5):591 - 598。10.1007 / s11103 - 010 - 9711 - 7。
- 66。
赫尔曼C,Porco S,Verbruggen N,布什DR:几丁质酶样蛋白CTL1在改变根系系统响应于多种环境条件时起作用。植物理性。2010,152:904-917。10.1104 / pp.109.149849。
- 67。
Kzhyshkowska J, Mamidi S, Gratchev A, Kremmer E, Schmuttermaier C, Krusell L, Haus G, Utikal J, Schledzewski K, Scholtze J, Goerdt S:新型stabilin-1相互作用几丁质酶样蛋白(SI-CLP)在选择性激活的巨噬细胞中上调并通过溶酶体途径分泌。血液。2006,107(8):3221-3228。10.1182 / - 2005 - 07 - 2843血。
- 68。
Dhugga Ks,Barreiro R,Whittor B,SteCca K,Hazeboek J,Randhawa Gs,Dolan M,Kinney Aj,Tomes D,Nichols S,Anderson S,Anderson P:瓜尔籽β-甘露甘露合酶是纤维素合成酶超基因家族的成员。科学。2004,303:363-366。10.1126 / Science1090908。
- 69。
Liepman A, Nairn C, Willats W, Sørensen I, Roberts A, Keegstra K:功能基因组分析支持纤维素合成酶类A基因家族成员的功能保持,并表明甘露聚糖在植物中的不同作用。植物营养与肥料学报。10.1104 / pp.106.093989。
- 70。
Birchler Ja,Riddle Nc,Auger DL,Veitia Ra:基因调节中的剂量平衡:生物意义。趋势类型。2005,21(4):219-226。10.1016 / J.tig.2005.02.010。
- 71。
Wettenhall JM,史密斯GK:limmaGUI:用于微阵列数据的线性模型的图形用户界面。生物信息学。2004年,20(18):3705-3706。10.1093 /生物信息学/ bth449。
- 72。
Crampton BG, Hein I, Berger DK:水杨酸可以抵抗一种生物营养锈病病原体,小麦substriata,在珍珠小米(Pennisetum blaucum.).分子植物病理学。2009年,10(2):291-304。10.1111 / j.1364-3703.2008.00532.x。
- 73。
Hellemans J,Mortier G,Paepe Ad,Speleman F,Vandesompele J:QBase相对量化框架和软件,用于管理和自动分析实时定量PCR数据。基因组Biol。2007,8:R19-10.1186 / GB-2007-8-2-R19。
- 74。
Mayor HD, Hampton JC, Rosario B:一种简单的方法从环氧包埋组织中去除树脂。生物物理与生化细胞学杂志。1961,9:909-910。10.1083 / jcb.9.4.909。
- 75。
Coleman HD,Park J-Y,Nair R,Chapple C,Mansfield SD:RNAi介导的抑制P.-Coumaroyl-CoA 3'-羟化酶在杂交杨树中影响木质素沉积和可溶性次生代谢。Proc Natl Acad Sci USA。2008,105(11):4501-4506。10.1073 / pnas.0706537105。
- 76。
KO J-H,KIM W-C,HAN K-H:MYB46的异位表达鉴定了次壁生物合成中涉及的转录调节基因拟南芥.植物杂志2009年,60(4):649-665。10.1111 / j.1365-313X.2009.03989.x。
- 77。
麦卡锡RL,钟R,叶Z-H:MYB83是SND1的直接靶且在次生细胞壁生物合成的调节与MYB46冗余作用拟南芥.植物细胞生理。2009,50(11):1950-1964。10.1093 / PCP / PCP139。
- 78。
Zhong r,Richardson EA,Y Z-H:MyB46转录因子是SND1的直接目标,并调节二级墙体生物合成拟南芥.植物营养与肥料学报。2007,19(4):489 - 498。10.1105 / tpc.107.053678。
致谢和资助
感谢James Wesley-Smith of Kwazulu-Natal电子显微镜装置大学,用于在比勒陀利亚大学(UP)大学的非洲基因科技微阵列基因科学镍级,以寻求数据分析,以及数据分析L'Zanne Jansen Van Rensburg(UP)为核心墙体化学分析提供帮助。Martin Ranik(UP)克隆了编码序列SND2.并转化拟南芥蒂利亚纳.这项工作由萨皮和Mondi通过比勒陀利亚大学的森林分子遗传学(FMG)项目资助,并进一步得到南非工业人力资源计划(THRIP)和国家研究基金会(NRF)的资助。以及澳大利亚研究委员会(ARC)联合拨款LP0668943给墨尔本大学。
作者信息
隶属关系
通讯作者
额外的信息
作者的贡献
SGH开展试点工作,并起草了手稿。EM,DKB和AAM协助与稿件的起草工作,设想该项目,并在研究设计和监督帮助。AVS和GB进行诱导体部门分析实验。所有的作者都审查和批准了手稿。
电子补充材料
12870_2011_972_moesm2_esm.xls.
附加文件2:SND2-OV(A)与野生型(8周)的微阵列数据,fold change > |±1.5|。SND2-OV A系茎在8周时与野生型相比有显著差异表达的基因列表,其fold change值大于1.5。(XLS 104 KB)
12870 _2011_972_moesm4_esm.xls
附加文件4:微阵列数据SND2-OV(A)与野生型(4周)。与野生型相比,SND2-OV A系4周茎秆显著差异基因列表。(XLS 41 KB)
作者的原始提交的图像文件
权利和权限
开放访问本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
Hussey, s.g., Mizrachi, E., Spokevicius, A.V.et al。SND2.,一种NAC转录因子基因,调节参与二次细胞壁发育的基因拟南芥纤维和纤维增加小区区域中桉树.BMC植物BIOL.11,173(2011)。https://doi.org/10.1186/1471-2229-11-173
收到:
接受:
发表:
关键字
- 二级细胞壁
- 逆转录定量聚合酶链反应
- 花序茎
- 二次细胞壁形成
- 纤维壁厚