摘要
背景
植物根系是吸收土壤水分和养分、感知和转导土壤水分亏缺信号的重要器官。目前对水稻干旱胁迫转录组的认识大多依赖于干旱条件下不同遗传背景的比较研究。更可靠的方法是使用具有共同遗传背景但在初始缺水条件下对干旱胁迫抗性水平不同的近等基因系(NILs)。在这里,我们检测了IR64背景下的两对耐干旱的NILs。我们获得了不同程度干旱胁迫下水稻NILs根系的基因表达谱,有助于识别与干旱胁迫相关的基因及其机制。
结果
全球基因表达分析表明,约55%的水稻根系基因在干旱胁迫下表达差异。NILs中差异表达基因(DEGs)的数量随着缺水程度的增加而增加,从轻度缺水到重度缺水,表明更多的基因受到干旱胁迫的影响。基因本体(GO)检测和生物通路分析表明,耐旱NILs IR77298-14-1-2-B-10和IR77298-5-6-B-18的激活基因主要参与次生代谢、氨基酸代谢、刺激反应、防御反应、转录和信号转导,下调基因参与光合作用和细胞壁生长。我们还观察到赤霉素(GA)和生长素串音调节耐受性NILs侧根的形成。
结论
对两对具有相同遗传背景(约97%)的NILs的转录组分析显示,其基因表达谱存在显著差异,可以有效地揭示与耐旱相关的基因。与中等耐旱的IR77298-5-6-B-18和其他敏感的NILs相比,耐旱的IR77298-14-1-2-B-10在干旱胁迫处理中显示出更多的用于细胞生长、激素生物合成、细胞转运、氨基酸代谢、信号、转录因子和碳水化合物代谢的deg。因此,在两条宽容系中,不同的机制正在实现宽容。
背景
缺水是当今农业面临的最紧迫的问题之一。在许多国家,农业用水约占淡水总使用量的70%。为了满足不断增长的人口的需要,必须用更少的水生产更多的粮食。1].大米(栽培稻L.)是世界上一半以上人口的主要食物来源。水稻种植在多种多样的环境中,从淹没的湿地到雨养的旱地[2].灌溉水稻占世界水稻面积的55%,提供全球75%的水稻产量,并消耗亚洲约90%的农业淡水资源[3.].因此,缺水是影响不同国家水稻生产的一个关键制约因素。严重干旱会严重减少水稻产量,导致灾难性的作物歉收[4].有必要提高水稻的耐旱性,以便在缺水地区实现可持续的水稻生产[5].了解潜在的生理和分子机制对于提高水稻品种对干旱易发环境的适应性是必要的[5,6].旱作和灌溉水稻抗旱性的大效应数量性状位点(QTL)的检测已取得进展[5].关于耐旱性的遗传和分子控制的信息仍然相对有限。
以往水稻抗旱性遗传研究主要基于对不同抗旱性亲本的定位群体分析[7- - - - - -9].然而,耐旱和易感种质的异质性遗传背景往往掩盖了遗传变异与耐旱表型之间的关系。更可取的方法是利用具有共同遗传背景但对干旱胁迫耐受性水平不同的遗传种群。在国际水稻研究所的干旱育种计划中,通过回交Aday selection (AdaySel)选育出一套先进回交系,由传统品种向流行品种IR64 [10].IR64是热带地区种植最广泛的水稻品种;它具有许多有价值的农艺性状,但对干旱胁迫高度敏感[11].以IR64为背景,选取两对耐旱性比较的NILs。12: a) IR77298-14-1-2-B家族:IR77298-14-1-2-B-10(高度耐旱)vs IR77298-14-1-2-B-13(敏感);b) IR77298-5-6-B-18(中等耐旱)和IR77298-5-6-B-11(高度敏感)。这些高级回交系被认为是前近等基因系,因为它们是从一个单科分离的耐旱性姐妹系。
了解耐旱性的一个重要方面是根系生长和发育对缺水条件的响应[13].根对于维持作物产量很重要,当植物生长在水分或养分供应不足的土壤中时,根就变得至关重要[14],也是应激信号感知的主要位点之一,它启动了对干旱的级联基因表达反应[15,16].先前的研究表明,植物的生长在很大程度上取决于胁迫的严重程度;轻度水分亏缺会导致叶和茎的生长受到抑制,而根可能会继续伸长[17].此外,根系结构是剖析水稻对水分亏缺反应的基因型差异的一个关键特征[13].对菜豆根部的基因表达模式进行了多种研究[18],向日葵[19),拟南芥[20.,21],玉米[22和其他植物在干旱胁迫下。旱地水稻和低地水稻的干旱胁迫基因表达谱已有报道[23,24],但这些研究主要集中在比较单一胁迫条件下苗期各基因型的基因表达谱。目前,对于生育期不同水分亏缺水平下的耐旱和敏感基因型在根系中的表达模式还不甚了解。本研究采用Agilent 4 × 44k寡核苷酸阵列系统,对干旱胁迫下产量和生理物象性状差异较大的2对水稻NILs进行了根系转录谱分析。我们的结果表明,与其他NILs相比,高耐受性NILs IR77298-14-1-2-B-10的根系中有更多的deg响应严重干旱胁迫。在耐受性NILs中,与细胞生长相关的基因大多下调,而与ABA生物合成、脯氨酸代谢、ros清除酶和碳水化合物代谢相关的基因则高度激活。虽然这两对NILs都是Aday Sel × IR64的回交后代(约97%),但它们在干旱胁迫下的基因表达谱表现出明显差异。
结果与讨论
实验设计及根系性状分析
在这项研究中,干旱胁迫是通过在播种后35天开始启动土壤干燥程序(DAS)来施加的,直到花盆达到土壤可蒸腾水分(FTSW)的目标分数[25].一些研究表明,FTSW可能与描述植物水分状态的变量有关,如正午叶片水势、叶片相对含水量和气孔导度[25,26].水状态为0.2 FTSW(重度胁迫),0.5 FTSW(轻度胁迫)和1.0 FTSW(对照)。记录单株根数、根体积、根干重、最大根长和根粗等根系特征数据。应激处理和对照处理均按随机完全区组设计(RCBD)进行4次重复。与水分充足对照相比,重度胁迫处理的单株根数(54%)、根体积(65%)和根干重(61%)显著降低;而与无胁迫相比,胁迫下的最大根长显著增加(64%),根粗略有增加(3%)1).IR77298-14-1-2-B家族的耐寒无性系在胁迫条件下的根系数量、根系粗细和根系干重均显著高于敏感无性系,而非胁迫条件下则显著高于敏感无性系。在IR77298-5-6-B家族中,仅在非胁迫条件下,耐受性NIL的生根深度显著高于易感NIL。因此,两科耐受性NILs的根深、根数、根体积和根干重均高于相应的敏感NILs。在各种假定的抗旱机制中,植物通过生长更深的根系从更深的土壤剖面中提取水分的能力是在干旱胁迫下直接影响产量的最相关特性之一[27].
微阵列表达式剖析
为了更好地了解根系抗旱性的机制,我们利用4 × 44k的微阵列系统(平台号为#;GPL7252在NCBI GEO上可用来检测繁殖阶段两对NILs在非胁迫和干旱胁迫条件下的根系表达谱。
在不同干旱胁迫处理下,NILs根系三次微阵列生物重复实验得到的deg数值比较见表2.总的来说,在干旱胁迫处理下,43494个水稻基因型中有24027个(55%)转录本在至少两种情况下上调或下调。不同基因型水稻根组织表达模式的差异表明,0.2 FTSW下的DEGs数量高于0.5 FTSW。早前也有类似报道,在高渗透处理下水稻根系中发现的DEGs数量要多于低渗透处理[28].结果还表明,在干旱胁迫处理中,有一组相对较大的基因通常被表达。0.2和0.5FTSW诱导的基因有5760个和3846个;分别有4815和3794个基因在0.2和0.5 FTSW处被普遍抑制(附加文件1).在NILs中比较了干旱胁迫处理后个体DEGs的响应方向(转录本上调或下调)(表2)2).总的来说,IR77298-14-1-2-B-10在胁迫处理和未处理之间的DEGs数量变化(上调和下调)最大。随着干旱胁迫水平的增加,deg的数量也增加,表明干旱胁迫程度的增加影响了更多的基因。由此可见,尽管这两对NILs都是Aday Sel × IR64的回交后代,但它们在干旱响应的基因表达谱上存在显著差异。
通过qRT-PCR确认芯片数据
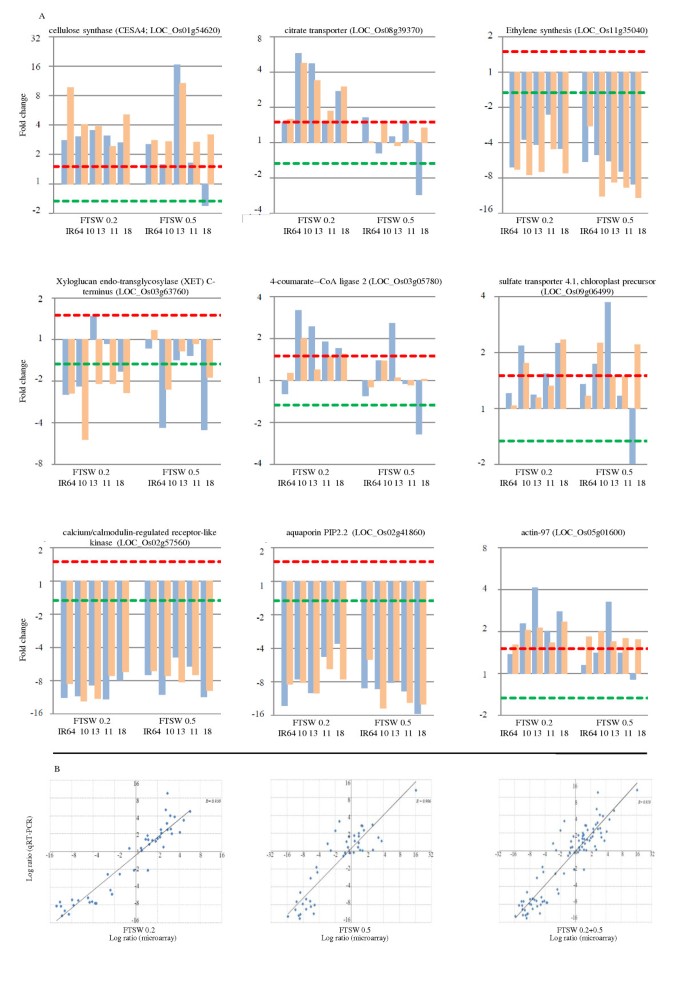
为了评估微阵列数据的准确性,我们根据附加文件中所示的生物学重要性,选择了纤维素合成酶(CESA4): LOC_Os01g54620等9个DEGs2在所有干旱胁迫处理和对照条件下,4个NILs和IR64中出现上调或下调的基因的表达谱,而轻微变化的基因则被忽略。然后,我们测试了微阵列检测的基因表达与qRT-PCR检测的基因表达的相似性(图1).我们观察到,基于三个重复的中位数计算的微阵列和qRT-PCR数据在不同的水胁迫处理和整体水胁迫条件下表现出良好的相关性(r= 0.906 ~ 0.950), qRT-PCR也检测到大多数基因表达上调或下调的基因。因此,该结果表明,通过微阵列识别的deg证实了干旱胁迫和非胁迫水稻基因型之间的实际差异。
通过qRT-PCR实验确认了在3种干旱胁迫条件下水稻NILs根系中9个选择的DEGs的表达谱,并与基因芯片数据进行了比较.(A)与qRT-PCR数据比较9个不同功能类别的deg的芯片表达模式。直方图:×轴显示不同水稻基因型用于实验即寄主和四个NILs包括10 = IR77298-14-1-2-B-10 13 = IR77298-14-1-2-B-13 11 = IR77298-5-6-B-11和18 = IR77298-5-6-B-18,严重的干旱胁迫:FTSW0.2表明20%的分数可蒸发的土壤水被认为是严重的干旱胁迫处理,和FTSW0.5表明50%的分数可蒸发的土壤水分也被视为轻度干旱胁迫处理。, Y轴表示基因表达的折叠变化,转换为log2标度,虚线为1.5倍或1/1.5倍,蓝条为3次qRT-PCR重复的中位数,橙条为3次芯片实验重复的中位数结果。(B)在不同干旱胁迫处理下,微阵列实验与qRT-PCR差异表达量之比的相关性分析。微阵列数据日志2值(X-轴)绘制与qRT-PCR日志2值(Y设在)。FTSW0.2为土壤可蒸腾水分的20%,为重度干旱胁迫处理;FTSW0.5为土壤可蒸腾水分的50%,为轻度干旱胁迫处理,FTSW0.2+0.5为总体干旱胁迫处理。
耐旱NILs的差异表达基因
对仅在耐旱基因型中发现的基因的分析对于确定与耐旱相关的假定基因是有意义的。在耐受性基因型中鉴定deg可以揭示最终导致耐受性的代谢和细胞过程[29].在这方面,我们考虑了耐受性NIL中的特异性deg与其易感姐妹NIL和易感复发亲本IR64进行比较。ir77298 - 14-1-2-2 - b -10共1264个基因,780个基因;IR77298-5-6-B-18中859和739个基因在0.2 FTSW位点特异性上调和下调,其中在ir77298 - 14-1-2-2 - b -13和IR64中分别有39和23个基因反向表达,在IR77298-5-6-B-11和IR64中分别有38和146个转录本表达3.).这些在耐受性NILs中鉴定的特异性deg中的许多先前已被证明参与非生物应激反应[23,30.].我们对这些DEGs进行了进一步分析,以研究它们在干旱胁迫下的生物学功能。
NILs差异表达基因的基因富集分析
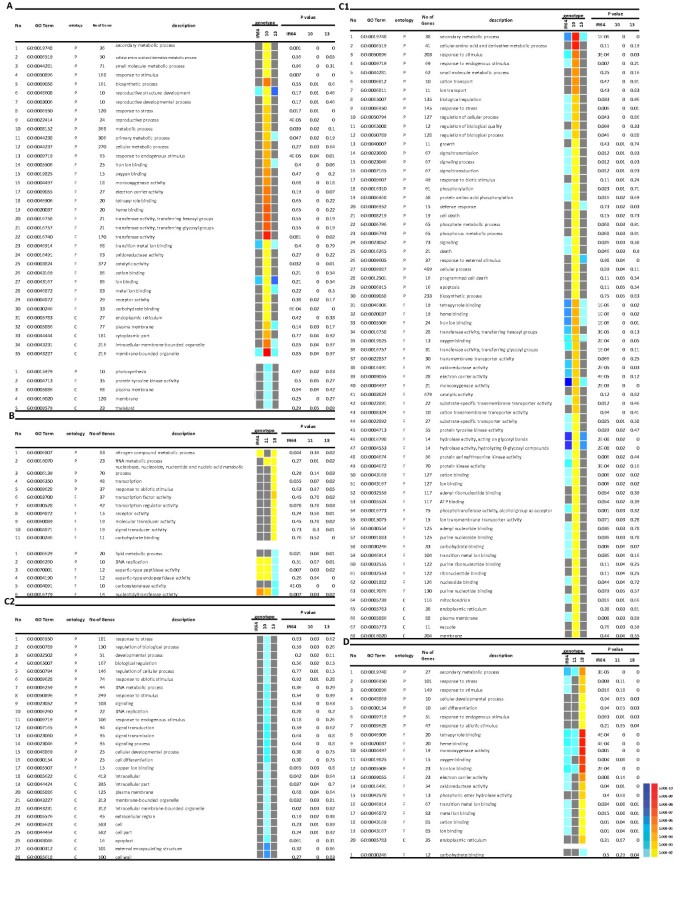
基因本体(GO)术语被广泛应用于理解微阵列差异基因表达数据的生物学意义[31].利用agriGO分析了两种干旱胁迫下耐受性NILs的特异性deg,以富集GO类别[31].数字2包括干旱胁迫下两对NILs的GO类别和特异性deg的富集分析。在IR77298-14-1-2-B-10基因上调的生物过程中,有13个GO术语显著富集,其中最显著的GO术语为“次生代谢过程”(GO:0019748)、“细胞氨基酸及其衍生物代谢过程”(GO:0006519)、“小分子代谢过程”(GO:0044281)、“刺激反应”(GO:0050896)。
水稻根系组织耐水NILs特异性表达基因本体论富集分析.该图显示了在本研究中应用的不同干旱胁迫处理(0.2和0.5 FTSW)下,使用基于agriGO的工具对耐受性NILs与易感NILs进行基因集富集参数分析(PAGE)的彩色模型。图中信息包括:GO术语,包含生物过程(P)、分子功能(F)和细胞成分(C)三个GO类别的本体,每个GO术语中注释的基因数量,GO描述,一个简单的彩色模型,其中红色系统表示上调,蓝色系统表示下调,以及调整后的P值(FDR)。在这张图中,基因型描述也是:IR =寄主10 = IR77298-14-1-2-B-10 13 = IR77298-14-1-2-B-13 11 = IR77298-5-6-B-11和18 = IR77298-5-6-B-18 (A)明确表示度在0.2 FTSW IR77298-14-1-2-B-10, (B)明确表示度在0.2 FTSW IR77298-5-6-B-18 (C1)专门激活度在0.5 FTSW IR77298-14-1-2-B-10 (C2)特别压抑的度在0.5 FTSW IR77298-14-1-2-B-10, (D)明确表示度在0.5 FTSW IR77298-5-6-B-18,彩色方柱表示在一定干旱胁迫下各因子上调/下调的表达水平。黄到红,青到蓝,灰度分别代表激活,抑制和不显著。
从分子功能上看,上调基因属于17个氧化石墨烯显著富集基因,其中“铁离子结合”(GO:0005506)、“氧结合”(GO:0019825)、“单加氧酶活性”(GO:0004497)、“电子载体活性”(GO:0009055)、“四吡体结合”(GO:0046906)、“血红素结合”(GO:0020037)是重要的氧化石墨烯显著富集基因。内质网GO术语(GO:0005783)是细胞成分中最重要的显著术语。
在IR77298-14-1-2-B-10 0.2FTSW特异性抑制基因中,有5个显著的GO: a)生物学过程:“光合作用”(GO:0015979);b)分子功能:“蛋白酪氨酸激酶活性”(GO:0004713);C)细胞成分:“类囊体”(GO:0009579)、“膜”(GO:0016020)和“质膜”(GO:0005886)。在耐药NIL IR77298-5-6-B-18中,对于0.2FTSW上调的基因,生物过程中重要的GO术语是“氮化合物代谢过程”(GO:0006807),而在分子功能方面,“转录因子活性”(GO:0003700)、“转录调节活性”(GO:0030528)和“受体活性”(GO:0004872)三个GO术语表现出显著富集。我们还发现,对于耐受性NIL中特定的抑制基因,它们被分为两个显著富集的GO术语:a)生物过程,包括“DNA复制”(GO:0006260)和“脂质代谢过程”(GO:0006629);b)分子功能,如“核苷酸基转移酶活性”(GO:0016779)和“羧酸酯酶活性”(GO:0004091)。
另一方面,在轻度干旱胁迫条件下,我们发现IR77298-14-1-2-B-10的诱导基因被划分为68个GO显著富集序列。其中一些重要的氧化石墨烯术语,如“生长”(GO:0040007)、“死亡”(GO:0016265)、“阳离子转运”(GO:0006812)、“离子转运”(GO:0006811)、“防御反应”(GO:0006952)、“程序性细胞死亡”(GO:0012501)、“信号”(GO:0023052)、“信号过程”(GO:0023046)、“细胞死亡”(GO:0008219)等,都是在轻度干旱胁迫条件下富集的氧化石墨烯术语。将IR77298-14-1-2-B-10中被抑制基因富集的GO术语分为“细胞分化”(GO:0030154)和“细胞发育过程”(GO:0048869)等16个生物过程中显著富集的GO术语。在分子功能方面,以“铜离子吸附”(GO:0005507)最为显著;在细胞成分方面,以“细胞壁”(GO:0005618)和“外部包覆结构”(GO:0030312)最为显著。氧化石墨烯富集分析表明,IR77298-14-1-2-B-10具有较高的耐旱性,这可能归因于其运输系统、信号网络和防御成分的显著上调。另一方面,IR77298-5-6-B-18表现出中等的耐旱性,调控网络和氨基酸代谢显著上调。有报道显示,在干旱和高温胁迫下,线粒体和内质网蛋白的转录本如细胞色素P450基因家族,其中与氧化应激酶相关的转录本最多,主要激活在IR77298-14-1-2-B-10中,包括铁离子结合(GO:0005506)、氧结合(GO:0019825)、单加氧酶活性(GO:0004497)、电子载体活性(GO:0009055)等拟南芥[32]、各种代谢过程和应激耐受性[33],以及水稻长期干旱胁迫[2].总的来说,GO术语富集分析表明,采用不同的干旱响应策略来获得耐旱性,这体现在两个耐旱性NILs中。
耐旱NILs根系干旱响应的生物途径分析
根据不同的生物学功能,进一步分析了两种耐旱NILs与易感NILs在抗旱性中发挥重要作用的差异。功能分类是根据不同数据库和文献中可用的代谢和信号通路组合而成的。附加文件中显示了不同功能类别中deg的不同NILs的详细比较4.我们还对IR77298-14-1-2-B-10和IR77298-5-6-B-18两个耐受性系中这些功能类别的特异表达基因进行了聚类分析3.).两个耐受性系间存在明显差异。与IR77298-5-6-B-18相比,IR77298-14-1-2-B-10被激活的基因数量更多,转录因子基因家族表达差异更大,进一步说明两个耐旱系的耐旱性是由不同的机制介导的。下面,我们将重点介绍在NILs中观察到的表达模式与对比表型相关的情况。
在严重干旱胁迫条件下,两个耐受性系与敏感系特异表达基因的比较.图中:(A)为IR77298-14-1-2-B-10特异性表达的转录物,(B)为IR77298-5-6-B-18特异性表达的转录物,分别来自细胞生长、激素生物合成、细胞转运、氨基酸代谢、活性氧(ROS)、信号和应激调节基因、碳水化合物代谢等7个功能类别。(C)和(D)表示与转录因子家族相关的转录本,这些转录本在两个耐受性株系中与敏感株系相比特异性表达。每个转录本对应的基因标识符来自MSU版本6.1的水稻寡核苷酸阵列,来自水稻基因组注释计划(RGAP) 6.1 (http://rice.plantbiology.msu.edu/).折叠变化≥1.5以红色表示(上调),折叠变化≤-1.5以绿色表示(下调),黑色表示无变化(FDR<0.05)。
细胞生长系统
在干旱胁迫下,根中的细胞扩张至关重要。扩展需要许多细胞过程的协调活动[34].在本研究中,不同基因型水稻在生育期细胞壁相关基因在0.2 FTSW下大多下调,而在0.5 FTSW下上调的基因在同一组织和基因型中数量较多(附加文件)4).类似的结果表明,在轻度干旱胁迫条件下,植物根系可以继续生长[35].这些结果表明,在生育期,严重的干旱胁迫严重影响了几乎所有水稻基因型的根系细胞扩张。而在两个耐受性NILs中,一些基因特异性上调(附加文件)5).例如,三个参与细胞壁生物合成的基因,包括两个纤维素合成酶,如family-C (CSLC-1;LOC_Os01g56130)和-E (CSLE-6;LOC_Os09g30130)和一个木葡聚糖聚焦转移酶(XG_FTase;LOC_Os02g52640)在IR77298-14-1-2-B-10中被激活。以耐受性系IR77298-5-6-B-18为例,也有3个基因CSLA-9(LOC_Os06g42020),CSLC2(LOC_Os09g25900)和XG_FTase(LOC_Os06g10980),在0.2FTSW也被特异性激活。几项研究报告说里昂证券亚家族编码(1,4)-β- d -甘露聚糖合成酶CslC基被认为编码一种酶,指导(1,4)-β- d -葡聚糖的合成,葡聚糖被认为是木葡聚糖的骨架[36- - - - - -38].研究表明,低水势会增加玉米根系中的木葡聚糖活性,这归因于在这些条件下促进根系生长的必要性[39].我们的研究结果表明,在干旱胁迫下,这些基因在耐旱水稻根尖的激活可以促进根系的生长和伸长。这与观察到的耐受性品系比敏感品系有更大的根系发育是一致的[A。亨利,个人交流。
激素的生物合成
在严重干旱胁迫(0.2 FTSW)下,许多与激素生物合成相关的基因,如脱落酸(ABA)、生长素、赤霉素和乙烯相关的基因被发现存在差异表达。总的来说,在两种干旱胁迫处理下,除赤霉素外,参与激素生物合成的转录本均上调4).我们发现与ABA生物合成相关的基因在所有水稻基因型中都被组成性激活。植物激素ABA在应对各种胁迫信号的许多方面起着核心作用[35]、干旱和高盐耐受性机制[40].一个编码β -胡萝卜素羟化酶的基因(LOC_Os03g03370)在0.2和0.5 FTSW时被相似地激活6).据报道,β-胡萝卜素羟化酶的过表达增强了植物的应激耐受性拟南芥[41].9的过度表达独联体环氧类胡萝卜素双加氧酶(数控),包括OsNCED2(LOC_Os12g42280)和OsNCED3(LOC_Os03g44380)是ABA生物合成的关键酶,本研究还在水稻基因型中观察到。在拟南芥,At-NCED3是脱水和高盐度的强烈诱导,其过表达提高了转基因植物的脱水胁迫耐受性[29,30.].
我们还发现,在不同的NILs中,参与赤霉素生物合成的基因在干旱胁迫处理下大多下调(附加文件)6).结果表明,干旱胁迫显著增加了水稻籽粒ABA的积累,显著降低了籽粒GA的含量[42].因此,抗性株系根组织中ABA生物合成的激活可能介导GA生物合成的抑制。
细胞传输系统
植物细胞通过发展不同的分子转运系统对各种各样的刺激作出反应,包括生物和非生物胁迫。在这一类别中,IR77298-14-1-2-B-10在两个干旱胁迫条件下的deg数量高于其他品系(附加文件)4).我们发现,在干旱胁迫下,编码谷氨酸受体、核碱基抗坏血酸转运蛋白和氧化还原酶的7个离子转运基因在IR77298-14-1-2-B-10中特异上调,在IR77298-5-6-B-18中特异上调。在轻度应激下,三种基因包括一种主要的内在蛋白质(MIP-TIP;LOC_Os01g10600),OEP21(LOC_Os02g58550)和氧化还原酶(LOC_Os10g02380)在IR77298-14-1-2-B-10中被激活,在IR77298-5-6-B-18中有一个核碱基-抗坏血酸转运蛋白(LOC_Os09g15170)被激活7).在大米中,表达OsTIP1; 1干旱、盐胁迫和外源ABA均增加[43].因此,耐受性NILs根系组织较高的水分吸收、水分和离子转运可能是由于上述基因的过度表达。在本研究中,我们观察到在严重的水胁迫下,与敏感的NILs相比,两个耐受性NILs中与泵、次级转运蛋白相关的几个基因被激活和/或抑制。这一结果表明,编码Na等离子转运的基因数量较多+K+, Ca2 +在高耐受性NIL(IR77298-14-1-2-B-10)中比在中等耐受性NIL(IR77298-5-6-B-18)中被激活,表明这些基因在干旱胁迫信号转导中发挥了潜在作用。
氨基酸代谢
氨基酸作为大量代谢物的前体,在植物生长和对各种胁迫的反应中具有多种功能。脯氨酸代谢是植物应对各种非生物胁迫的重要过程。耐胁迫水稻品种在胁迫处理开始后,根系中脯氨酸的积累开始得更早,且明显多于叶片[44].与易感系相比,两株耐受性NILs中脯氨酸/精氨酸代谢相关酶的基因表达均有上调和下调。在0.2FTSW胁迫下,IR77298-14-1-2-B-10的脯氨酸代谢激活基因数量高于其他品系,而在轻度干旱胁迫下,IR77298-5-6-B-18的脯氨酸代谢激活基因数量高于其他品系(附加文件)4).一些关键基因编码乙酰谷氨酸激酶(LOC_Os04g46460),醛脱氢酶(ALDH家族2和3),谷氨酸合酶(LOC_Os03g50490),这些基因参与了谷氨酸还原为Δ1-pyrroline-5-carboxylate [45],在IR77298-14-1-2-B-10中0.2FTSW(附加文件8).我们还观察到基因编码Δ1-吡咯啉-5-羧酸合成酶(P5CS;LOC_Os05g38150)和精氨酸酶(LOC_Os04g01590)在IR77298-14-1-2-B-10基因型中过表达最多。的P5CS催化谷氨酸酯转化为Δ1-吡咯啉- 5-羧酸和精氨酸酶将精氨酸转化为鸟氨酸[45].
防止氧化损伤
活性氧(ROS)控制着植物中许多不同的过程。然而,过量的ROS会产生氧化应激,抑制植物根的生长。ROS如超氧化物(O•-;2)和羟基自由基(•OH)在应激条件下积累,需要加以控制,以保持细胞大分子的完整性[46].在这项研究中,植物的主要ros清除酶和抗氧化剂包括超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、谷胱甘肽过氧化物酶(GPX)和过氧化物还蛋白(PrxR)、谷胱甘肽、谷胱甘肽在干旱胁迫处理中被激活,并且在IR77298-14-1-2-B-10中激活的数量高于其他株系(补充文件)4).这些活性氧清除剂为细胞解毒提供了一种有效的机制•-;2和H2O2并构成对抗ROS的第一道防线[47].
我们还观察到,在耐受性NILs中,超氧化物歧化酶(SOD)家族基因的表达水平较高。因此,还原超氧化物(O•-;2)在耐受性NILs中可能高于敏感品系(附加文件)9).超氧化物歧化酶将超氧化物氢转化为过氧化氢[48].之前的一项研究表明,在水稻中,干旱胁迫会增加SOD活性[23].
在本研究中,IR77298-5-6-B-18中编码OsGrx_C2.1的基因在0.2 FTSW和一个基因(OsGrx_C15)在IR77298-14-1-2-B-10中0.5 FTSW处观测到(附加文件9).据报道,OsGrx_C15在应激反应中受到抑制稻瘟病菌水稻根部的侵染[49].
我们发现IR77298-14-1-2-B-10的防御机制比其他NILs更活跃。
信号和其他非生物应激调节基因
在这一生物学类别中,分析了胁迫信号系统中重要基因的表达谱,以及其他胁迫调节基因,如伴侣基因(包括脱氢酶和胚胎发生晚期丰富基因,LEA)和其他一些重要家族的表达谱(附加文件)4).表达谱分析表明,在不同的NILs中,这类基因大多在干旱胁迫处理下被激活,且在0.2 FTSW时deg数量较高,其中大部分(38.9%)与0.5 FTSW时(18.2%)相似。一些研究报道,在干旱胁迫下,许多伴侣包括Hsp70, hsf8样[23], HSP70/DNAK,推定atp依赖Clp蛋白酶atp结合亚基[50],并且脱水和干旱胁迫也激活了脱氢酶和LEA基因成员[51,52在水稻品种中。
在不同NILs中,ABA响应、钙依赖蛋白激酶(CDPKs)、钙调磷酸酶b样蛋白相互作用蛋白激酶(CIPKs)、钙调蛋白(CML)和钙调蛋白相关的钙传感器蛋白以及受体样细胞质激酶(RLCKs)等信号转导相关基因在干旱胁迫处理下同时上调或下调4).在ABA响应基因的情况下,在所有品系中,与轻度胁迫相比,严重干旱胁迫处理下,更多的deg通常被激活,在耐受性NILs中表达水平更高(附加文件)10).结果表明,在0.2FTSW下,IR77298-14-1-2-B-10中丝氨酸/苏氨酸蛋白激酶受体前体(LOC_Os04g34330)被特异性激活。据报道,水稻根系转录丝氨酸/苏氨酸蛋白激酶受体前体(LOC_Os04g34330)在干旱胁迫下对ABA高度敏感[53].
在CDPKs家族中,它在植物Ca中起着至关重要的作用2 +-介导的信号转导[54],结果表明,与IR77298-5-6-B-18相比,在严重干旱胁迫下,耐旱系IR77298-14-1-2-B-10被激活的基因更多4).一份OsCPK15IR77298-14-1-2-B-10在严重干旱胁迫下被特异性激活;在轻度压力下OsCPK28已激活(附加文件10).据报道OsCPK15水稻根系对干旱胁迫和盐胁迫的响应[54].
我们发现,虽然这类基因的诱导是水稻生育期根系的常见反应,但在严重干旱胁迫下,IR77298-14-1-2-B-10中有大量编码伴侣基因、ABA响应基因、CDPK、钙调蛋白和RLCK基因被特异性激活。此外,更多CIPK家族成员在IR77298-5-6-B-18中被特异性激活。在轻度干旱胁迫下,IR77298-14-1-2-B-10中仅有CIPKs被激活,IR77298-5-6-B-18中仅有CDPKs、钙调蛋白和RLCKs被激活。
转录因子
转录因子(TFs)调节基因表达响应环境和生理信号。在本研究中,来自TF基因家族的2336个基因中,有1461个(62.5%)在不同的NILs中表达差异,以响应干旱胁迫。重度干旱胁迫下TF基因的差异表达量大于轻度干旱胁迫(附加文件)4).在TF基因的DEGs中,约50%(287个上调,436个下调)和35%(193个上调,323个下调)分别相似表达于0.2和0.5 FTSW。在两个耐旱NILs中,来自AP2-EREBP、bHLH、C2H2、GRAS、HB、LOB、myb相关和OFP家族的13个TF基因被相似地激活,来自ARR-B、CCAAT、FAR1、MADS、Orphans、SNF2和Trihelix家族的8个基因成员普遍被抑制。在轻度干旱胁迫下,ARF、BBR/BPC、bHLH、C2C2-CO-like、C2C2-Dof、C3H、G2-like、GeBP、GRAS、HB、NAC、SET和WRKY家族相关的16个基因和bHLH、C2C2-Dof、C2H2、FHA和OFP的6个TF转录本均出现了相似的上调和下调11).在IR77298-14-1-2-B-10中,42个和49个TF基因在严重干旱胁迫下分别特异上调和下调。高耐受力NIL中被激活的TF基因多属于AP2-EREBP(7)、bHLH(3)、bZIP(2)、C2H2(5)、FHA(2)、GNAT(4)、NAC(1)、WRKY(2)家族。在中耐受性NIL中,39个TF基因被特异性激活,36个被抑制。这些被激活的TF基因主要来自AP2-EREBP(5)、bHLH(3)、C2H2(2)、FAR1(2)、NAC(1)和WRKY (4)3.).多项研究报道AP2-EREBP、C2C2、CCAAT、bZIP、WRKY、NAC、bHLH家族在水稻抗旱性中发挥重要作用[29,55,56].总的来说,IR77298-14-1-2-B-10在重度干旱胁迫下表现出最多的响应TF基因家族,而IR77298-5-6-B-18在轻度胁迫下表现出更多的TF基因被激活,这表明IR77298-14-1-2-B-10是重度干旱胁迫下反应较强的水稻基因型,而IR77298-5-6-B-18对轻度胁迫反应较强。
碳水化合物代谢
本研究发现,在干旱胁迫下,许多与糖酵解、柠檬酸循环、淀粉-蔗糖、果糖-甘露糖代谢相关的基因表达存在差异。在不同的NILs中,这些deg主要是在干旱胁迫处理下被激活的4).碳水化合物代谢变化是应激下典型的生理生化反应。例如,我们发现在0.2 FTSW条件下,编码6-磷酸果糖激酶(LOC_Os01g09570)、醛脱氢酶(LOC_Os06g15990和LOC_Os11g08300)和己糖激酶(LOC_Os01g53930)的4个基因在IR77298-14-1-2-B-10中特异性上调12).据报道,这组活化基因在糖酵解过程中发挥重要作用[57].结果还表明,在干旱胁迫下,不同NILs中柠檬酸循环、淀粉-蔗糖和抗坏血酸-赤氨酸代谢相关基因大多被激活。这包括多种蔗糖合酶、可溶性淀粉合酶和淀粉分支酶。参与果糖-甘露糖、肌醇-磷酸代谢的基因同时上调和下调(附加文件)4).在淀粉和蔗糖代谢方面,两个编码α -淀粉酶同工酶C2 (LOC_Os06g49970)和己糖激酶-1 (LOC_Os01g53930)的基因在IR77298-14-1-2-B-10中被特异性上调。在轻度胁迫处理下,己糖激酶-1 (LOC_Os01g53930)、己糖激酶-2 (LOC_Os05g44760)和乳酸葡萄糖6-脱氢酶(LOC_Os12g25700)三个基因在两个耐受性系中被激活,其中乳酸葡萄糖6-脱氢酶是这些耐受性系所共有的(附加文件)12).
在碳水化合物代谢方面,与IR77298-5-6-B-18相比,在严重干旱胁迫下,IR77298-14-1-2-B-10中蔗糖合成、糖酵解、TCA循环、抗坏血酸和赤氨酸代谢以及果糖甘露糖代谢相关的基因被激活的比例相对较大,这表明耐旱NIL可能采取了为侧根和根毛生长预留足够碳源和能量的策略[58],乙醛解毒,以及糖的感应和信号[29].
不同水稻NILs中根系特异性DEGs
干旱胁迫导致叶片生长受到抑制,而根系则可以继续生长,并将胁迫信号传递给芽叶[17].因此,为了识别干旱胁迫下的一些组织特异性调控基因,我们研究了根和叶组织中一些生物学类别的DEGs,如细胞生长系统、激素生物合成、氨基酸代谢、转运系统和转录因子。我们发现在水稻NILs中,相对较多的根特异性基因参与了细胞生长、激素生物合成、氨基酸代谢、转运系统和转录因子等(附加文件)13).一些报道指出,干旱胁迫下根和叶组织的差异可能归因于扩张素、纤维素合成酶和木葡聚糖家族等基因的激活[34,36,37,46],它们参与了水分亏缺下根系的生长。研究还发现,NILs的根中ABA的积累水平较高,这在从根到茎的胁迫信号传递中起着至关重要的作用[29,30.,35,40].生长素相关基因在根中被特异性激活,可能调控侧根的形成[59].耐旱NILs根系中脯氨酸的积累较高,这可能是其渗透耐受性的一个指标[45,46].我们还观察到,在植物细胞中起重要作用的细胞转运对干旱和盐度等各种刺激有反应[43]在耐受性NILs的根中比在叶片组织中被更大程度地激活。许多与干旱胁迫相关的TF基因,如bzip、AP2-EREBPs、EIL、HBs,在耐受NILs的根组织中特异性表达,以响应干旱胁迫[60].其中一些TF基因如NAC (LOC_Os02g57650), SNFs (LOC_Os02g32570, LOC_Os04g47830), bZIP (LOC_Os09g13570)基因在根组织中被特异性激活。我们观察到,来自不同生物学类别的根特异性deg大多对耐受性NILs具有特异性。这些基因的表达水平在两种耐受性NILs中高于易感NILs。
结论
利用新的44K寡聚阵列综合平台和干燥法,我们确定了两对具有不同产量表现的NILs在生殖期干旱胁迫处理下根系的基因表达谱。总的来说,在所有水稻基因型中,严重干旱胁迫下的deg数量高于轻度干旱胁迫下的deg数量,这表明更多的基因受到干旱胁迫的影响。在严重胁迫下,基因型和处理之间的共同表达基因数量也更高。因此,比较一对具有不同表型的NILs可以揭示调节耐旱性的重要基因。通过比较NILs的表达模式,我们确定了重要的基因类别,这些基因的表达可以明确区分耐受性和易感基因型。
尽管这两对NILs来源于共同的背景,但它们似乎具有不同的耐受干旱胁迫的机制。作为两种耐受NILs不同生物学通路之间的连接,其对水分亏缺最早的反应可能是ABA合成相关酶基因的过表达,尤其是IR77298-14-1-2-B-10。干旱条件下基因表达模式的详细变化也支持了响应机制的差异。这些基因以及不同功能类别的关键基因成员的调控作用有待进一步研究。
根据探针集位置,我们发现IR77298-14-1-2-B-10中不同功能类别特异性激活的基因大多位于染色体1、2、4、6和9上;IR77298-5-6-B-18在干旱胁迫处理中的1、3、4和6,正如之前报道的那样。因此,本研究结果可以与QTL分析相结合,以确定水稻育种计划中有用的基因。
方法
植物材料和胁迫条件
本研究使用的植物材料是两对NILs,对比干旱胁迫和IR64下的产量。其中,一对来自IR77298-14-1-2家族,另一对来自IR77298-5-6家族[12].IR77298-14-1-2和IR77298-5-6是IRRI通过回交Aday Sel培育的耐东gro姐妹系。(产自印度的耐东gro品种)至IR64 [10],这两个品系的耐旱性也有所不同[12].IR77298-14-1-2- b -10为高产(耐旱),IR77298-14-1-2- b -13为低产(易感);同样,在IR77298-5-6家族中,IR77298-5-6-B-18是高产(中等耐旱),而IR77298-5-6-B-11在胁迫下是低产(高易感)。这4种NILs具有相似的产量潜力。此外,一对对比的NILs在基因上至少有97%相似[12].
植物材料种植在1.05米,直径18厘米的PVC管柱中,填充10公斤的土壤混合物(2土:1沙),充分施肥并在受控条件下生长(最初在温室中生长,但在施加压力前转移到phytotron)。花盆中饱和的土壤被白色塑料覆盖,中间有一个开口,以方便种植。加水管是用来给花盆浇水的。每盆移植5粒发芽前种子,三叶期减薄至2株。实验设计为随机完全区组设计(RCBD),共4次重复。
所有花盆每天灌溉两次,以保持土壤饱和。在土壤开始逐步干燥的前一天,每个花盆中的土壤都是饱和的。通过启动土壤干燥协议施加压力,从35 DAS开始,直到花盆达到目标FTSW [25].所有的花盆都被晾干,直到没有蒸腾作用或蒸腾作用可以忽略不计。在干旱期间,每天都要称这些罐子的重量,以估计蒸腾作用。(b)干旱胁迫,包括0.2 FTSW = 20%和0.5 FTSW = 50%两个干旱胁迫条件,在干燥过程中不向土壤中补充水分。在收获前,花盆须放在指定的富水处理厂。在收获时记录最大根长、根粗、根体积、总根数、根干重和茎干重。
RNA提取
采用RNeasy Maxi试剂盒(Qiagen)在繁殖期3次重复中,从1.0、0.5和0.2 FTSW处理的植物材料根尖10 mm处提取总RNA样本。根系的这部分是活跃的生长区域,是一个重要的根系部分,可以通过伸长来应对胁迫[61].采用Nanodrop (Nanodrop ND-1000;Nanodrop Technologies)和BioAnalyzer (G2938A;安捷伦科技)。在本研究的微阵列实验中,制备了60个独立的根RNA样本。
微阵列实验与数据分析
在我们的研究中,探针和阵列设计是通过安捷伦技术公司提供的eArray 4.5版本进行的https://earray.chem.agilent.com/earray/为这个自定义数组选择了43494个探针。在安捷伦科技公司的三次生物复制中,四组43494探针(4x44K微阵列格式)被吸在玻片(25 x75 mm)上。
花菁3 (Cy3)-或花菁5 (Cy5)-标记cRNA样本从850合成ng根据制造商的说明,使用低输入RNA标记试剂盒(安捷伦技术公司)检测总RNA。通过直接比较胁迫条件下和非胁迫(对照)植物在同一寡聚阵列上的转录活性,研究了胁迫植物特异性的转录组谱。用825配制杂交液ng每个Cy3和cy5标记的cRNA制剂使用原位杂交试剂盒Plus(安捷伦技术公司)。杂交和清洗微阵列载玻片按照制造商的协议。洗净后,用DNA微阵列扫描仪(G2505B;安捷伦科技)。
从图像文件中提取Cy3和Cy5的信号强度,通过秩一致性和LOWESS方法进行归一化,去除信号强度中的染料效应,采用Feature Extraction version 9.5 (Agilent Technologies)进行处理。将所有样本的信号强度转换为log2根据EXPANDER 5.0版本的分位数方法对数组幻灯片进行标准化[62].如果基因的平均信号强度至少在一种条件下为> 6,则该基因被宣布为“表达”;否则,认为该基因未表达。这些基因被认为是差异表达(DEGs),具有(i)对数2>0.585或<-0.585,以及(ii)两株植物间基因表达变化的显著性(P)≤0.05,采用配对t检验(排列,所有;FDR收集,调整Bonferroni方法)。数据处理采用Multi experimental Viewer (MeV) 4.5版本[63].在测井曲线上进行了氧化石墨烯富集分析2利用“agriGO”,在耐受性NILs中特异性表达的DEGs与易感NILs的比例[31]通过参数分析基因集富集(PAGE)方法。本研究中使用的微阵列分析输出(系列no。GSE30463)可在NCBI GEO购得[64].所有数据都符合MIAME标准。
中存在
为了验证微阵列实验的结果,采用qRT- PCR对9个不同功能类别的deg进行分析。
总RNA (160ng)经TURBO DNA-free Kit (Ambion) dna酶处理后,经iScriptTM cDNA Synthesis Kit (BIO-RAD)反转录。qRT-PCR反应混合物由KAPA SYMR FAST qPCR试剂盒(KAPA BIOSYSTEMS)和2 μl 4倍稀释的cDNA反应混合物组成,最终体积为20 μl,并加入200 nM的基因特异性引物(见附加文件)2.PCR反应采用iCycler iQ (BIO-RAD)进行,反应周期为95℃变性1 min, 58℃退火聚合20秒。进行了3次生物重复。我们使用UBC(泛素偶联酶E2)作为qRT-PCR的内参基因[65].
参考文献
- 1.
关于水和食物的挑战项目是什么?[http://www.waterandfood.org/page/What-we-do]
- 2.
Degenkolbe T, Do PT, Zuther E, Repsilber D, Walther D, Hincha DK, Köhl KI:不同水稻品种对长期干旱耐受性的表达谱分析。中国生物医学工程学报,2009,29(3):344 - 344。10.1007 / s11103 - 008 - 9412 - 7。
- 3.
Bhuiyan SI:与作物生产相关的水管理:以水稻为例。农业展望,1992,21:293-299。
- 4.
Serraj R, Kumar A, McNally KL, Slamet-Loedin I, Bruskiewich R, Mauleon R, Cairns J, Hijmans RJ:水稻抗旱性的提高。王志强。2009,30(3):41-98。
- 5.
Serraj R, McNally KL, Slamet-Loedin I, Kohli A, Haefele SM, Atlin G, Kumar A:水稻抗旱性的综合遗传与资源管理策略。植物科学,2011,14:1-14。10.1626 / pps.14.1。
- 6.
王霞,朱娟,Mansueto L, Bruskiewich R:利用QTL定位水稻抗旱性候选基因。浙江大学学报(自然科学版)2005,382-388。6 b
- 7.
李利,卢德洛,麦科奇,欧图尔JC:水稻渗透调节和脱水耐性QTL的定位。应用物理学报,1996,44(3):344 - 344。10.1093 / jxb / 47.9.1427。
- 8.
潘图万G,钟迪B,图金达T:水稻生殖期耐旱性相关数量性状位点分析。中国农业科学,2004,27(3):344 - 344。10.1104 / pp.900109。
- 9.
加藤勇,李志强,李志强,王志强,王志强。水稻水培苗期抗旱性qtl的鉴定。生态学报,2008,29(4):344 - 344。10.1007 / s10681 - 007 - 9605 - 1。
- 10.
Khush GS, Angeles E, Virk PS, Brar DS:水稻抗东谷病毒育种。中国育种杂志,2004,36:101-106。
- 11.
关玉生,Serraj R,刘帅,徐建林,Ali J,王卫伟,Venus E,朱汉林,李志康:干旱胁迫和非胁迫条件下水稻产量同时提高的研究(栽培稻l .)。应用物理学报,2010,31(4):344 - 344。10.1093 / jxb / erq212。
- 12.
Venuprasad R, Impa SM, Veeresh Gowda RP, Atlin GN, Serraj R:干旱胁迫下水稻产量的近等基因系比较。中国农学通报,2011,29(3):344 - 344。10.1016 / j.fcr.2011.04.009。
- 13.
郭达VRP,罗志刚,王志刚,王志刚:水稻根系结构与干旱响应的关系(栽培稻):旱作低地OryzaSNP表型。农学通报,2011,29(1):1 - 4。10.1016 / j.fcr.2010.10.003。
- 14.
Bengough AG, McKenzie BM, Hallet PD, Valentine TA:根伸长、水分胁迫和机械阻抗:极限应力和有益根尖性状的综述。应用实验学报,2011,32(3):344 - 344。10.1093 / jxb / erq350。
- 15.
Rabello AR, Guimarães CM, Rangel PHN, Silva FR, Seixas D, Souza E, Brasileiro ACM, Spehar CR, Ferreira ME, Mehta M:旱稻根系干旱响应基因的鉴定(栽培稻刘志强,李志强,李志强,等。中国生物医学工程学报,2008,29(3):377 - 377。
- 16.
Périn C, Rebouillat J, Brasileiro ACM, Diévart A, Gantet P, Breitler JC, Johnson AAT, Courtois B, Ahmadi N, Raissac M,等:水稻根系适应性发育基因组学的新认识。水稻遗传学V.编辑:Brar DS, Mackill DJ, Hardy B. 2007,新加坡:世界科学,117-141。
- 17.
父本B, Suard B, Serraj R, Tardieu F:一旦根系的影响被中和,水稻叶片生长和水势对蒸发需求和土壤水分亏缺具有弹性。植物细胞与环境,2010,33:1256-1267。
- 18.
Micheletto S, Rodriguez-Uribe L, Hernandez R, Richins RD, Curry J, O'Connell MA:根的比较转录谱分析菜豆acutifolius而且p .寻常的在水分亏缺压力下。植物科学学报,2007,43(3):344 - 344。10.1016 / j.plantsci.2007.08.003。
- 19.
刘晓宁,Baird WV:向日葵对干旱和盐度胁迫响应基因的差异表达。作物科学,2003,43:678-687。
- 20.
Bray EA:通常受水分亏缺胁迫调控的基因拟南芥.应用物理学报,2004,29(3):344 - 344。10.1093 / jxb / erh270。
- 21.
Dinneny JR, Long TA, Wang JY, Jung JW, Mace D, Pointer S, Barron C, Brady SM, Schiefelbein J, Benfey PN:细胞身份介导拟南芥根系对非生物胁迫的响应。科学通报,2008,32(3):344 - 344。10.1126 / science.1153795。
- 22.
Bustos D, Lascano R, Villasuso AL, Machado E, Senn ME, Cordoba A, Taleisnk E:盐胁迫和渗透胁迫对玉米根尖伸长的影响与外体O无关.2-2的水平。学报学报,2008,32(4):559 -559。10.1093 / aob / mcn141。
- 23.
王慧,张海华,李忠:水分胁迫诱导旱稻基因表达谱分析(栽培稻L. var. IRAT109)幼苗的减法表达序列标记库。中国生物医学工程学报,2007,29(4):457 - 457。10.1111 / j.1672-9072.2007.00553.x。
- 24.
Rabello AR, Guimarães CM, Rangel PHN, Silva FR, Seixas D, Souza E, Brasileiro ACM, Spehar CR, Ferreira ME, Mehta A:旱稻根系干旱响应基因的鉴定(栽培稻刘志强,李志强,李志强,等。中国生物医学工程学报,2008,29(3):377 - 377。
- 25.
辛克莱TR,勒德洛MM:土壤水分供给对4种热带豆科植物水分平衡的影响。中国植物学报,2004,26(4):529 - 529。10.1071 / PP9860329。
- 26.
杨晓东,李志刚,李志刚,李志刚:植物与土壤水分关系的研究进展(葡萄l .)。植物与土壤学报,2007,26(3):344 - 344。
- 27.
Bernier J, Serraj R, Kumar A, Venuprasad R, Impa S, Gowda V, Owane R, Spaner D, Atlin G:旱稻大效抗旱QTL qtl12.1增加水分吸收。中国农学通报,2009,29(1):1 - 4。10.1016 / j.fcr.2008.07.010。
- 28.
马涛,陈睿,于睿,曾华,张东:水稻根系对低渗透胁迫、中渗透胁迫和高渗透胁迫的整体基因组差异变化。植物物理学报,2009,31:773-785。10.1007 / s11738 - 009 - 0291 - 6。
- 29.
Hayano-Kanashiro C, Calderon-Vazquez C, Ibarra-Laclette E, Herrera-Estrella L, Simpson J:干旱胁迫和恢复灌溉对3种墨西哥地方玉米基因表达和生理响应的分析。PLoS ONE。2009, 4: e7531-10.1371/journal. peer .0007531。
- 30.
Yamaguchi-Shinozaki K, Shinozaki K:细胞反应和耐受脱水和冷应激的转录调节网络。植物学报,2006,29(4):531 - 531。10.1146 / annurev.arplant.57.032905.105444。
- 31.
杜震,周旭,凌云,张震,苏震:agriGO:农业社区GO分析工具包。中国生物医学工程学报,2010,38:W64-W70。10.1093 / nar / gkq310。
- 32.
Rizhsky L, Liang H, Shuman J, Shulaev V, Davletova S, Mittler R:拟南芥对干旱和高温胁迫的响应。中国农业科学,2004,27(4):344 - 344。10.1104 / pp.103.033431。
- 33.
Narusaka Y, Narusaka M, Seki M, Umezawa T, Ishida J, Nakajima M, Enju A, Shinozaki K:拟南芥对非生物和生物胁迫响应的串扰:细胞色素P450基因超家族基因表达的cDNA芯片分析。中国生物医学工程学报,2004,29(3):327- 332。10.1007 / s11103 - 004 - 0685 - 1。
- 34.
Dolan L, Davies J:植物根的细胞扩张。植物学报,2004,7:33-39。10.1016 / j.pbi.2003.11.006。
- 35.
杨晓明,杨晓明,杨晓明。植物抗旱耐盐性研究。植物学报,2005,24:23-58。10.1080 / 07352680590910410。
- 36.
Liepman AH, Nairn CJ, Willats WG, Sorensen I, Roberts AW, Keegstra K:功能基因组分析支持纤维素合成酶样基因家族成员之间的功能保护,并提示甘露聚糖在植物中的不同作用。植物科学进展,2007,30(3):344 - 344。10.1104 / pp.106.093989。
- 37.
Cocuron JC, Lerouxel O, Drakakaki G, Alonso AP, Liepman AH, Keegstra K, Raikhel N, Wilkerson CG:纤维素合成酶C家族的一个基因编码β -1,4葡聚糖合成酶。自然科学进展,2007,29(4):457 - 457。10.1073 / pnas.0703133104。
- 38.
Burton RA, Jobling SA, Harvey AJ, Shirley NJ, Mather DE, Bacic A, Fincher GB:纤维素合成酶样基因的遗传学和转录谱HvCslF大麦基因家族。植物科学学报,2008,29(3):344 - 344。10.1104 / pp.107.114694。
- 39.
He H, Serraj R, Yang Q:变化OsXTH干旱胁迫下水稻生殖期基因表达、ABA含量及花梗伸长。植物物理学报,2009,31:749-756。10.1007 / s11738 - 009 - 0287 - 2。
- 40.
瓦西莱夫斯卡A, Vlad F, Sirichandra C, Redko Y, Jammes F, Valon C, Frey NF, Leung J:植物脱落酸信号的研究进展。植物学报,2008,1:198-217。10.1093 / mp / ssm022。
- 41.
胡晓明,张晓明,张晓明,等。β-胡萝卜素羟化酶的表达对植物胁迫耐受性的影响拟南芥.自然科学,2002,29(3):344 - 344。10.1038 / nature00861。
- 42.
杨娟,张娟,朱强,万伟富:水分胁迫下水稻灌浆过程中激素的变化。中国农业科学,2001,27(3):344 - 344。10.1104 / pp.127.1.315。
- 43.
李文薇,彭艳红,余旭,张明明,蔡文敏,孙文文,苏华:水稻液泡膜水通道蛋白在不同胁迫下的转运功能及表达分析。植物科学学报,2008,29(3):349 - 349。10.1016 / j.jplph.2008.05.002。
- 44.
Hien DT, Jacobs M, Angenon G, Hermans C, Thu TT, Son L, Roosens NH:脯氨酸积累和Δ13个耐盐耐旱水稻品种-吡咯啉-5-羧酸合成酶基因特性研究植物科学学报,2003,26(3):357 - 357。10.1016 / s0168 - 9452(03) 00301 - 7。
- 45.
Kishor PBK, Sangam S, Amrutha RN, Laxmi PS, Naidu KR, Rao KRSS, Rao S, Reddy KJ, Theriappan P, Sreenivasulu N:高等植物脯氨酸生物合成、降解、吸收和转运的调控:对植物生长和非生物胁迫耐受性的影响。中国生物医学工程学报,2005,29(3):344 - 344。
- 46.
Ober ES, Sharp RE:根系生长对水分亏缺的响应调控。耐旱耐盐作物分子育种研究进展。编辑:Jenks MA,长谷川PM, Jain SM。2007,施普林格,多特勒支,33-53。
- 47.
Mittler R, Vanderauwera S, Gollery M, Breusegem FV:植物活性氧基因网络。植物科学进展,2004,9:490-498。10.1016 / j.tplants.2004.08.009。
- 48.
Apel K, Hirt H:活性氧:代谢,氧化应激和信号转导。植物学报,2004,29(3):344 - 344。10.1146 / annurev.arplant.55.031903.141701。
- 49.
Marcel S, Sawers R, Oakeley E, Angliker H, Paszkowski U:水稻稻瘟病菌的组织适应性入侵策略Magnaporthe oryzae.植物学报,2010,22:377 - 387。10.1105 / tpc.110.078048。
- 50.
高芳华,张海林,王宏辉,高华,李忠才:干旱胁迫下旱稻和低地稻的转录谱分析比较(栽培稻l)使用cDNA-AFLP。科学通报,2009,54:3555-3571。10.1007 / s11434 - 009 - 0524 - 5。
- 51.
肖波,黄燕,唐宁,熊龙:水稻LEA基因的过表达提高了田间抗旱性。理论与应用,2007,29(3):357 - 357。10.1007 / s00122 - 007 - 0538 - 9。
- 52.
Dehydrins:植物对脱水和低温反应的共同产物。中国生物医学工程学报,1997,30(3):357 - 357。10.1111 / j.1399-3054.1997.tb04785.x。
- 53.
李丽娟,李丽娟,李丽娟,李丽娟:基于超代表的水稻ABA响应基因的全基因组定向预测独联体共表达基因中的-motif。植物分子生物学学报,2009,29(3):344 - 344。10.1007 / s11103 - 008 - 9423 - 4。
- 54.
万斌,林毅,牟涛:水稻Ca的表达2 +依赖蛋白质激酶(CDPKs)基因。清华大学学报(自然科学版),2007,29(4):489 - 489。10.1016 / j.febslet.2007.02.030。
- 55.
向勇,唐宁,杜华,叶华,熊林:特征OsbZIP23作为基本亮氨酸拉链转录因子家族的关键成员,赋予水稻脱落酸敏感性和耐盐性和耐旱性。植物科学进展,2008,29(4):344 - 344。10.1104 / pp.108.128199。
- 56.
Khong GN, Richaud F, Coudert Y, Pati PK, Santi C, Périn C, Breitler JC, Meynard D, Vinh D, Guiderdoni E, Gantet P:转录因子对水稻抗逆性的调控。生物工程学报,2008,25:381- 381。10.5661 / bg - 25 - 381。
- 57.
吕凯,Clément-Vidal A,王晓明,王晓明,王晓明,王晓明:水稻水分蒸腾、生长和碳水化合物动态的研究进展。植物学报,2008,35:689-704。10.1071 / FP08027。
- 58.
李玲,刘超,连欣:低磷胁迫下水稻根系基因表达谱。中国生物医学工程学报,2010,27(3):344 - 344。10.1007 / s11103 - 009 - 9580 - 0。
- 59.
Farquharson KL:赤霉素-生长素串扰调节侧根形成。植物科学学报,2010,22:539 - 539 /tpc. 539。
- 60.
王东,潘勇,赵霞,朱玲,付斌,李忠:水稻干旱响应性的全基因组时空基因表达谱分析。中国生物医学工程学报,2011,29(4):344 - 344。
- 61.
樱井J,田文杰,田文杰,杨文杰,杨文杰:水稻水通道蛋白在细胞和组织中的定位及其水分转运活性。植物细胞学报,2008,49:30-39。10.1093 /卡式肺囊虫肺炎/ pcm162。
- 62.
Shamir R, Maron-Katz A, Tanay A, Linhart C, Steinfeld I, Sharan R, Shiloh Y, Elkon R: EXPANDER -用于微阵列数据分析的集成程序套件。中国生物医学工程学报,2005,26(3):344 - 344。
- 63.
Saeed AI, Sharov V, White J, Li J, Liang W, Bhagabati N, brasted J, Klapa M, Currier T,等:TM4:一种免费、开源的微阵列数据管理和分析系统。生物技术,2003,34:374-378。
- 64.
Barrett T, Troup DB, Wilhite SE, Ledoux P, Rudnev D, Evangelista C, Kim IF, Soboleva A, Tomashevsky M, Edgar R: NCBI GEO:挖掘数千万个表情配置文件-数据库和工具更新。中国生物医学工程学报,2007,35:D760-D765。10.1093 / nar / gkl887。
- 65.
贾敏,李志强,王晓明,王晓明,等:利用实时荧光定量PCR技术研究水稻内控基因的表达。生物化学学报,2006,34(3):344 - 344。10.1016 / j.bbrc.2006.04.140。
确认
这项工作得到了一代挑战计划SP2 4008.08项目的资助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
AM进行了严重干旱胁迫处理的微阵列实验,分析了数据并撰写了稿件。KS提供了轻度干旱胁迫处理的转录组数据,并有助于数据分析。HK进行qRT-PCR实验。TA还为qRT-PCR体系的建立做出了贡献。AH进行了一些计算工作。RV开发了NILs并进行了RNA提取。RS监督温室实验,参与实验设计,特别是温室干燥和植物组织取样,提供了本文所用的根系生理数据,并参与了稿件的修改。AK提供植物材料,参与实验设计和稿件修改。HL参与实验设计和稿件初稿修改。SK设计了实验,协调了项目,提供了分子分析的所有实验室设备,并帮助准备了手稿。 All authors read and approved the final manuscript.
电子辅助材料
不同基因型水稻根系在两种干旱胁迫下的常见表达基因
附加文件1:。在本表中,0.2 FTSW表示20%的土壤可蒸腾水分,认为是重度干旱胁迫处理;0.5 FTSW表示50%的土壤可蒸腾水分,认为是轻度干旱胁迫处理。10 = IR77298-14-1-2-B-10, 13 = IR77298-14-1-2-B-13, 11 = IR77298-5-6-B-11, 18 = IR77298-5-6-B-18。一个日志2> 0.585为上调基因,A对数2<-0.585为下调基因,调整后的P值(FDR) <0.05。Up =显著上调基因,down =显著下调基因。(xls4mb)
在两种干旱胁迫处理下,两种耐受性NILs均有显著性基因表达
附加文件3:。在本表中,0.2 FTSW表示20%的土壤可蒸腾水分,认为是重度干旱胁迫处理;0.5 FTSW表示50%的土壤可蒸腾水分,认为是轻度干旱胁迫处理。10 = IR77298-14-1-2-B-10, 13 = IR77298-14-1-2-B-13, 11 = IR77298-5-6-B-11, 18 = IR77298-5-6-B-18。一个日志2> 0.585为上调基因,为对数2<-0.585为下调基因,调整后的P值(FDR) <0.05。Up =显著上调基因,down =显著下调基因。(xls1mb)
12870 _2011_965_moesm4_esm.xls
附加文件4:水稻基因型根系不同功能类基因在干旱胁迫下的转录变化其中,10 = IR77298-14-1-2-B-10, 13 = IR77298-14-1-2-B-13, 11 = IR77298-5-6-B-11, 18 = IR77298-5-6-B-18。10vs18是分别在IR77298-14-1-2-B-10和IR77298-5-6-B-18中表达的DEGs的比较。共性:ALL在两种耐受性NILs中以及在所有干旱胁迫处理中的所有基因型中均表现出共同表达的DEGs。(xls 56 kb)
两种干旱胁迫下水稻基因型根系中与细胞生长类别相关的基因表达谱
附加文件5:。在本表中,0.2 FTSW表示20%的土壤可蒸腾水分,认为是重度干旱胁迫处理;0.5 FTSW表示50%的土壤可蒸腾水分,认为是轻度干旱胁迫处理。一个记录被认为是上调的,如果日志2-ratio >0.585和下调if log2-ratio <-0.585, 0.585≥log2-ratio≥-0.585认为无变化。10: IR77298-14-1-2-B-10, 13: IR77298-14-1-2-B-13, 11: IR77298-5-6-B-11, 18: IR77298-5-6-B-18。(xls 68 kb)
两种干旱胁迫下水稻基因型根系激素生物合成类相关基因表达谱
附加文件6:。在本表中,0.2 FTSW表示20%的土壤可蒸腾水分,认为是重度干旱胁迫处理;0.5 FTSW表示50%的土壤可蒸腾水分,认为是轻度干旱胁迫处理。一个记录被认为是上调的,如果日志2-ratio >0.585和下调if log2-ratio <-0.585, 0.585≥log2-ratio≥-0.585认为无变化。10: IR77298-14-1-2-B-10, 13: IR77298-14-1-2-B-13, 11: IR77298-5-6-B-11, 18: IR77298-5-6-B-18。(xls44kb)
两种干旱胁迫处理下水稻基因型根系细胞转运类相关基因表达谱
附加文件7:。在本表中,0.2 FTSW表示20%的土壤可蒸腾水分,认为是重度干旱胁迫处理;0.5 FTSW表示50%的土壤可蒸腾水分,认为是轻度干旱胁迫处理。一个记录被认为是上调的,如果日志2-ratio >0.585和下调if log2-ratio <-0.585, 0.585≥log2-ratio≥-0.585认为无变化。10: IR77298-14-1-2-B-10, 13: IR77298-14-1-2-B-13, 11: IR77298-5-6-B-11, 18: IR77298-5-6-B-18。(xl288kb)
两种干旱胁迫下水稻基因型根系氨基酸代谢类相关基因表达谱
附加文件8:。在本表中,0.2 FTSW表示20%的土壤可蒸腾水分,认为是重度干旱胁迫处理;0.5 FTSW表示50%的土壤可蒸腾水分,认为是轻度干旱胁迫处理。一个记录被认为是上调的,如果日志2-ratio >0.585和下调if log2-ratio <-0.585, 0.585≥log2-ratio≥-0.585认为无变化。10: IR77298-14-1-2-B-10, 13: IR77298-14-1-2-B-13, 11: IR77298-5-6-B-11, 18: IR77298-5-6-B-18。(xls 56 kb)
两种干旱胁迫下水稻基因型根系活性氧类相关基因表达谱
附加文件9:。在本表中,0.2 FTSW表示20%的土壤可蒸腾水分,认为是重度干旱胁迫处理;0.5 FTSW表示50%的土壤可蒸腾水分,认为是轻度干旱胁迫处理。一个记录被认为是上调的,如果日志2-ratio >0.585和下调if log2-ratio <-0.585, 0.585≥log2-ratio≥-0.585认为无变化。10: IR77298-14-1-2-B-10, 13: IR77298-14-1-2-B-13, 11: IR77298-5-6-B-11, 18: IR77298-5-6-B-18。(xls 49 kb)
两种干旱胁迫处理下水稻基因型根系信号及胁迫相关类别的基因表达谱
附加文件10:。在本表中,0.2 FTSW表示20%的土壤可蒸腾水分,认为是重度干旱胁迫处理;0.5 FTSW表示50%的土壤可蒸腾水分,认为是轻度干旱胁迫处理。一个记录被认为是上调的,如果日志2-ratio >0.585和下调if log2-ratio <-0.585, 0.585≥log2-ratio≥-0.585认为无变化。10: IR77298-14-1-2-B-10, 13: IR77298-14-1-2-B-13, 11: IR77298-5-6-B-11, 18: IR77298-5-6-B-18。(xl153kb)
两种干旱胁迫下水稻基因型根系转录因子相关基因表达谱
附加文件11:。在本表中,0.2 FTSW表示20%的土壤可蒸腾水分,认为是重度干旱胁迫处理;0.5 FTSW表示50%的土壤可蒸腾水分,认为是轻度干旱胁迫处理。一个记录被认为是上调的,如果日志2-ratio >0.585和下调if log2-ratio <-0.585, 0.585≥log2-ratio≥-0.585认为无变化。10: IR77298-14-1-2-B-10, 13: IR77298-14-1-2-B-13, 11: IR77298-5-6-B-11, 18: IR77298-5-6-B-18。(xls 579 kb)
两种干旱胁迫下水稻基因型根系碳水化合物代谢相关基因表达谱
附加文件12:。在本表中,0.2 FTSW表示20%的土壤可蒸腾水分,认为是重度干旱胁迫处理;0.5 FTSW表示50%的土壤可蒸腾水分,认为是轻度干旱胁迫处理。一个记录被认为是上调的,如果日志2-ratio >0.585和下调if log2-ratio <-0.585, 0.585≥log2-ratio≥-0.585认为无变化。10: IR77298-14-1-2-B-10, 13: IR77298-14-1-2-B-13, 11: IR77298-5-6-B-11, 18: IR77298-5-6-B-18。(xls 108kb)
12870 _2011_965_moesm13_esm.xls
附加文件13:两种干旱胁迫处理下水稻基因型根特异性DEGs与叶片组织的比较在本表中,0.2 FTSW表示20%的土壤可蒸腾水分,认为是重度干旱胁迫处理;0.5 FTSW表示50%的土壤可蒸腾水分,认为是轻度干旱胁迫处理。如果log2-ratio >0.585,则认为转录本上调(1),如果log2-ratio <-0.585,则认为转录本下调(-1),0.585≥log2-ratio≥-0.585,则认为转录本没有变化。10: IR77298-14-1-2-B-10, 13: IR77298-14-1-2-B-13, 11: IR77298-5-6-B-11, 18: IR77298-5-6-B-18。R:根组织,L:叶组织。(xl175kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
穆梅尼,A,佐藤,K,康多,H。et al。不同干旱胁迫下两对耐旱易感水稻近等基因系根系转录组谱的比较分析。BMC植物生物学11日,174(2011)。https://doi.org/10.1186/1471-2229-11-174
收到了:
接受:
发表:
关键字
- 干旱胁迫
- 耐旱
- 水稻基因型
- 干旱胁迫处理
- 严重干旱胁迫