摘要
背景
单重复R3 MYB转录因子(Single-repeat MYB)在控制毛状体模式中起重要作用拟南芥.有人提议,单重复MYBS通过用GLABRA1(GL1)竞争毛状体形成负调节结合GLABRA3(GL3 / EGL3)JOURNAL GLABRA3 /增强子,从而抑制活化剂络合物TTG1(透明TESTA GLABRA1)的形成-GL3 / EGL3-这需要激活GL1GLABRA2(GL2),其产品是滴毛组形成的正调节因子。以前我们鉴定了一种新型单重复MyB转录因子,Trichomeless1(TCl1),其通过直接抑制表达式来负调节花序茎和花梗的滴毛组形成GL1.
结果
在这里,我们分析了在皮毛图案TRICHOMELESS2(TCL2),先前未鉴定单重复MYB转录因子的作用拟南芥.我们发现TCL2与TCL1密切相关,并且像TCL1和其他单重复myb一样,TCL2与GL3相互作用。过度的TCL2敲响时达成无毛表型TCL2通过RNAi诱导花序茎和花梗上的异位毛状体形成,这是一种以前在tcl1突变体。这些结果表明,TCL2可以具有与TCL1的重叠功能,用于控制花序的培养体形成。另一方面,虽然是转录TCL2, 喜欢TCL1,不由GL1和GL3形成的活化剂复合物控制,TCL2和TCL1蛋白在氨基酸水平上具有相同的80%,表达TCL2在…控制之下TCL1启动子仅部分恢复突变表型tcl1,这意味着TCL2和TCL1不是功能完全等同。
结论
TCL2与TCL1冗余功能的控制花序上形成的皮毛,但它们不是功能完全等同。转录TCL2不是由GL1和GL3形成的激活复合物控制的,而是MIR156受控的SQUAMOSA启动子结合蛋白样(SPL)转录因子。然而,SPLs可能需要共激活物来调节其靶基因的表达,包括TCL1,尝试可能,TCL2.
背景
毛皮组贴图拟南芥由几种不同类型的转录因子控制。根据现有证据,有人提出一个R2R3 MYB型转录因子GLABRA1(GL1)1],bHLH转录因子GLABRA3(GL3)2或GLABRA3的增强子(EGL3) [3.]和wd40重复蛋白TRANSPARENT TESTA GLABRA1 (TTG1) [4,5],形成活化剂复合物TTG1-GL3 / EGL3-GL1。该激活器复合物激活表达式GLABRA2(GL2),它们编码了一个促进芽的毛细血管形成的同型肿瘤蛋白[6- - - - - -8].相同的激活络合物也诱导一些单一重复R3 MYB基因的表达。
到目前为止,共有6个基因在拟南芥已报告基因组编码单重复R3 MYB转录因子,包括TRIPTYCHON(尝试)[9,10.],任性(CPC)[11.,12.],TRICHOMELESS1 (TCL1)[13.),而尝试的增强者和CPC1,2和3.(ETC1,ETC2和ETC3 / CPL3)[14.- - - - - -18.].单重复MYB转录因子以其短序列(75-112个氨基酸)为特征,主要由单个MYB结构域组成[19.].单重复R3 MYBS可以从毛状体前体细胞移动到其相邻小区中的在结合GL3或EGL3与GL1竞争,从而抑制枝条在毛状体的形成[阻止的活化剂配合物的形成8,13.,18.,19.].这些单重复R3 MYB转录因子与GL3的结合强度以及与GL1竞争与GL3结合的能力不同。酵母三杂交试验表明,CPC是最有效的抑制剂,其次是ETC1、TRY、ETC3和ETC2 [18.].原生质体转染检测结果表明,TCL1比CPC强于CL3 [19.].
尽管过度表达这六个单重复R3转录因子中的任何一个拟南芥导致无毛表现型,这些基因的单个突变体具有不同的表现型。突变尝试毛状体群集表型的结果[9,10.],突变CPC增加毛状体数目[11.,12.]和突变TCL1使异位培养体形成在花序茎和花梗上[13.].突变ETC1,ETC2或者ETC3没有显着影响毛状体形成。然而,这些单个突变体之间的双重,三倍和高阶突变体的分析表明所有六种单重复的MYB转录因子以高冗余的方式函数,以控制培养的培养物形成拟南芥[13.- - - - - -18.,20.].
我们前期的研究结果显示,TCL1除了与GL1竞争与GL3结合外,还可以直接抑制的表达GL1[13.].有趣的是,与许多其他单重复myb不同的是TCL1不受GL1和GL3/EGL3形成的激活复合物控制。最近,人们发现microRNA156(MIR156)靶向SQUAMOSA启动子结合蛋白LIKE (SPL) 9可激活TCL1和尝试通过与他们的启动子结合的表达[21.].
在这里,我们分析了TRICHOMELESS2 (TCL2),一个以前未被描述的单重复MYB转录因子在毛状体模式形成中的作用拟南芥.我们证明TCL2,像其他单重复myb一样,负调控毛状体的形成。过度的TCL2敲响时达成无毛表型TCL2通过RNAi诱导的斑滴体形成在花序茎和花梗上,先前观察到的表型tcl1突变体。此外,我们提供的遗传学证据表明,TCL2和TCL1的功能可能并不完全相同。我们也证明了MIR156是否参与监管TCL2,而SPLs可能需要共激活物来调节其靶基因的表达,包括TCL1,尝试可能,TCL2.
结果
TRICHOMELESS2与TCL1密切相关
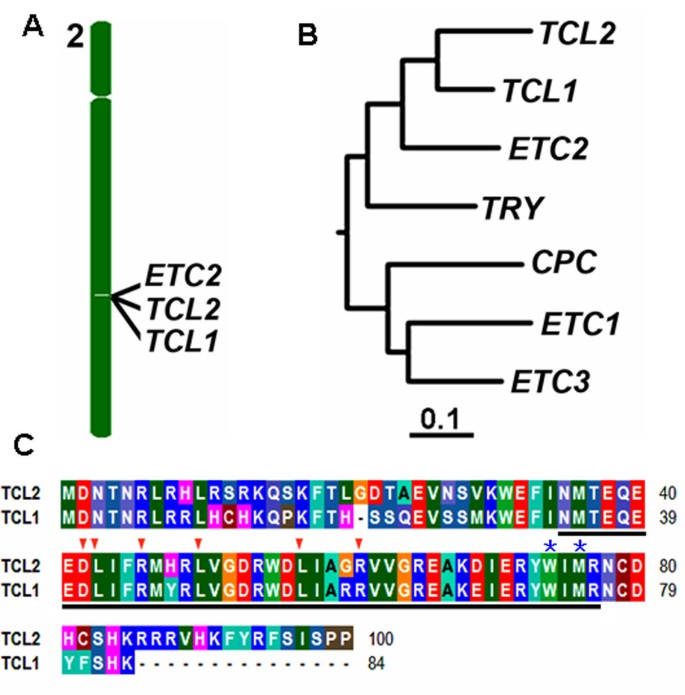
在拟南芥,到目前为止,共发现6个单重复MYB转录因子[13.].为了检查是否有任何未表征的单重复MYB转录因子,其全部氨基酸TCL1的氨基酸序列用作模板以BLAST拟南芥蛋白质数据库(http://www.ncbi.nlm.nih.gov.)。此外尝试,CPC,TCL1,ETC1,ETC2和ETC3 / CPL3以前已经报道了,我们的分析显示,这是另一个单一重复的MYB转录因子编码AT2G30424在拟南芥基因组中。编码了这种无声单重复MYB的基因被指定为TRICHOMELESS2(TCL2)。TCL2附近另外两种重复MYB基因,ETC2和TCL1,在染色体II上(图1A), 和ETC2是一个串联重复序列与基因TCL2, 尽管TCL2和TCL1被另一个基因分离At2g30430.使用全长蛋白质序列的系统发育分析显示TCL2与TCL1密切相关(图1B)。TCL2与TCL1在氨基酸水平上具有80%的同源性。如图所示1C如Tcl1和其他单一重复Mybs,TCL2还含有与R / B相互作用所需的保守氨基酸特征[D / E] L×2 [R / K]×3L×6 L×3R像BHLH转录因子[22.]并且已经显示出单重复MYB转录因子CPC的细胞对细胞运动所需的保守氨基酸[23.].
TCL2与TCL1密切相关.一个.TCL2是一个串联重复序列与基因TCL1和ETC2位于染色体II。B.7个单重复R3 MYB转录因子的系统发育分析拟南芥.使用具有默认设置的软件群集W产生使用整个氨基酸序列的系统发育树(http://www.genome.jp/tools-bin/clustalw)C.TCL2和TCL1序列比对。相同的氨基酸用相同的颜色着色。强调指出R3 MYB域,箭头表示氨基酸签名(D / E) L×2 (R / K)×3 L×6 L×3 R与R / b所需交互BHLH转录因子,和星号表明MYB域内的氨基酸,是至关重要的细胞间运动中共。
表达和TCL2的亚细胞定位
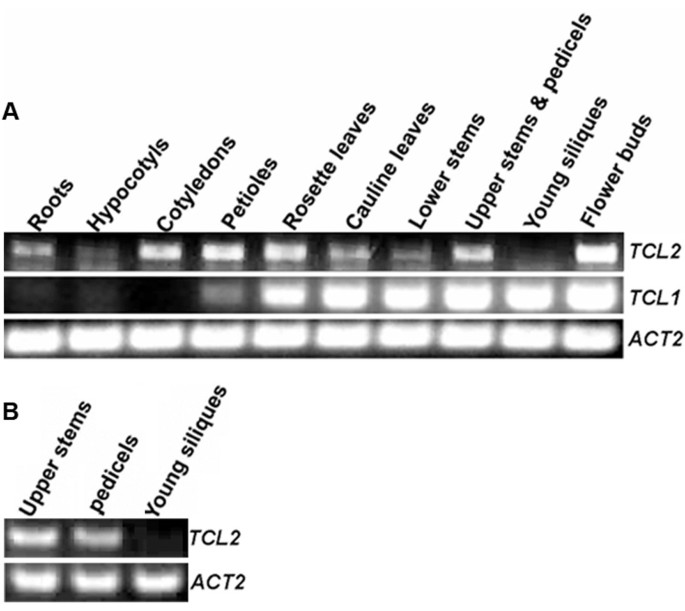
为了鉴定TCL2的功能,我们首先检测了TCL2的表达TCL2跨越各种组织和器官。我们还比较了TCL2与中TCL1因为TCL2与TCL1更密切相关,而不是在氨基酸水平的其他单一重复MYBS。收获各种组织和器官的野生型植物,RT-PCR用于检查表达TCL2和TCL1.我们发现了TCL2在除幼小三个体外的所有组织/器官中表达,在哪里TCL1非常表达(图2)。TCL2在通常不产生毛状体的器官子叶中也高度表达TCL1处于无法检测的水平(图2)。有关何时,何地和响应什么刺激的详细信息TCL2的表达,然后检索公共可用的基因表达数据库gene调查者(http://www.genevestigator.com/gv使用At2g30424作为基因ID),然而,结果表明,没有探针组可以用于所提供的基因ID中找到,这可能是因为TCL2是以前未被识别的基因,并且在为数据库提供数据的所有实验中,该基因的探针都没有被打印在微阵列上。
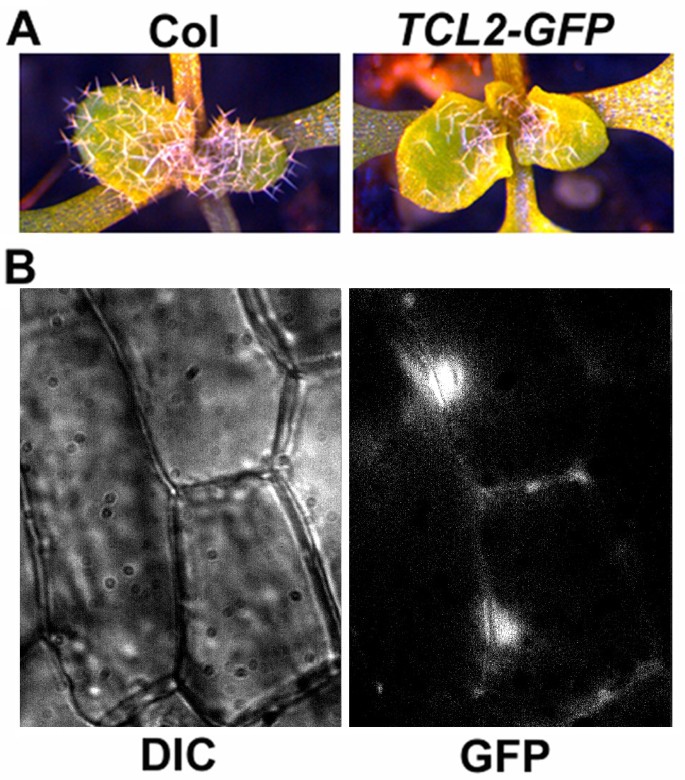
为了检验TCL2的亚细胞定位,我们产生了表达TCL2-GFP融合蛋白的转基因植物的控制之下TCL2自己的启动子,基因组DNA片段,其覆盖区域-1502至起始密码子的+1TCL2.的转基因植物产生降低的毛状体数(图3A),一种类似于的表型PTCL1: TCL1-GFP转基因植物[13.],表明毛滴数的减少是由于拷贝数的增加TCL2基因,作为过度表达TCL2显示出大大减少的培养体表型(图4)。这些结果也表明了TCL2启动子和TCL2-GFP融合蛋白很可能功能性的。通过使用所获得的转基因植物中,我们发现TCL2-GFP蛋白在表皮细胞的细胞核中观察到的主要是(图3B)。
TCL2是培养的毛肌瘤形成的负调节剂
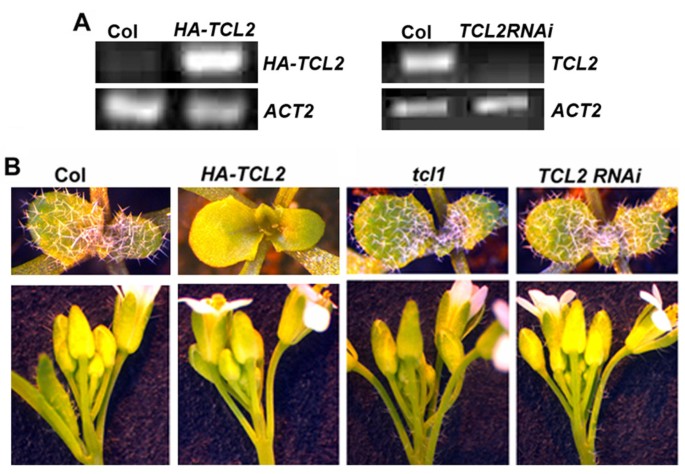
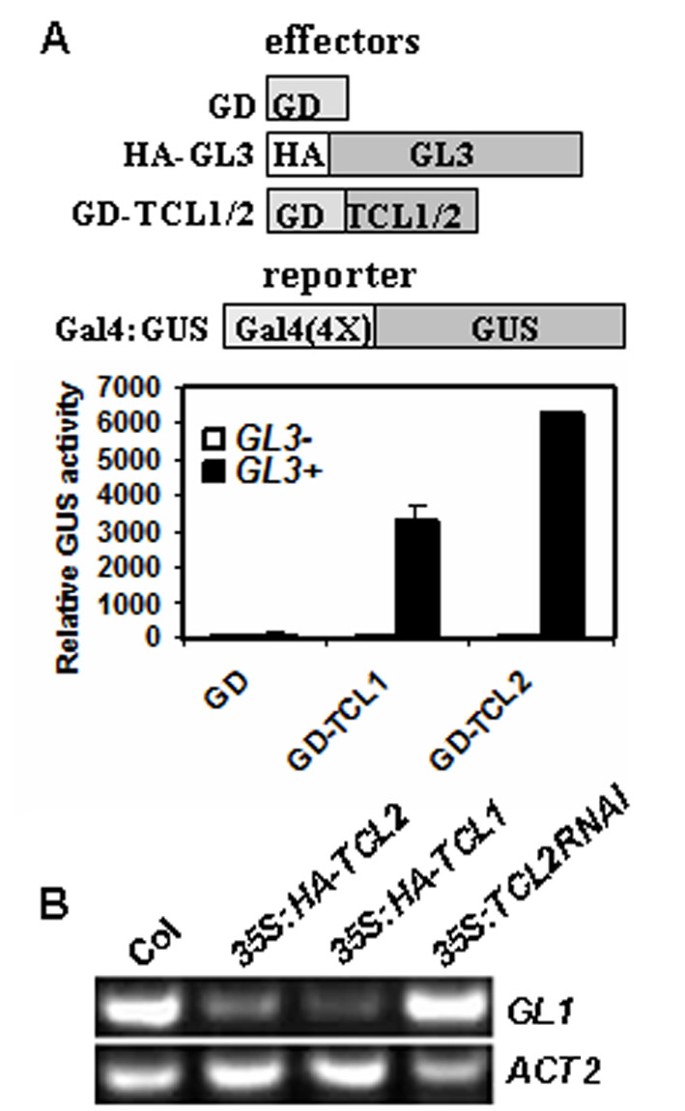
为了分析的功能TCL2在毛状体形成过程中,我们获得了过表达HA标记TCL2的转基因植株35S启动子(35S:HA-TCL2)。转录水平的TCL2通过使用RT-PCR检查哈特殊技能和TCL2特定引物(图4A)。如先前针对所有其他单重复R3 MYB转录因子观察到的,转基因植物过量表达TCL2导致无毛表型,在莲座叶、花序茎、茎生叶或花器官上没有毛状体形成(图4B.)。
为了进一步分析TCL2在培养物形成中的功能,我们寻求函数丧失的等位基因TCL2.通过搜索SALK T-DNA表达数据库,我们发现有4个与之相关的T-DNA插入突变体TCL2.然而,在所有这些四条线中,将T-DNA插入启动子区域,表达TCL2基本上不受RT-PCR检测的影响(数据未显示)。因此,所有突变体都具有野生型毛状体表型。
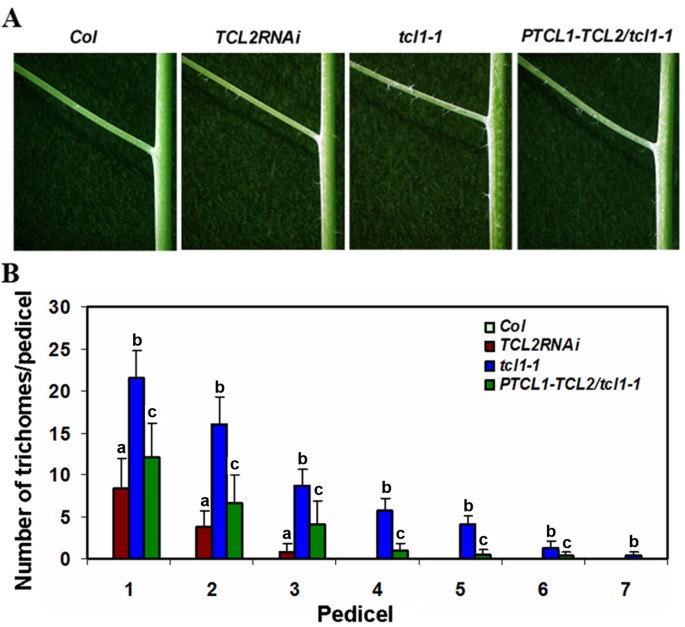
因此,我们采取了rnai方法来击倒表达TCL2.自TCL2的ORF片段相对较小,只有303 bp长,我们使用全长ORF构建RNAi结构。我们选择了三个独立的转基因株系,在花序茎和花梗上显示异位毛状体形成(图4B.),类似于tcl1突变体(13.].RT-PCR结果表明表达水平TCL2在转基因株系中显著减少(图4A),而其他单重复MyB基因的表达在很大程度上不受影响(见附加文件1),这表明所观察到的表型是由向下的表达引起的TCL2.
当我们对节间和花梗上的毛状体数量进行量化时,我们发现与tcl1突变体,有更少的节间和花梗承载异位毛TCL2RNAi突变体(图5)。
TCL2部分获救tcl1突变体毛状体表型
以前,我们确定TCL1作为花序和花梗[皮毛形成负调控的主要单重复MYB转录因子13.].的tcl1突变体在花序、茎和花梗上形成异位毛状体。在这里,我们证明了表达减少的转基因植物TCL2具有与之相似的表型tcl1(图4B.,图5)。丧失功能的突变在其他任何单一重复MYBS包括尝试,CPC,ETC1,ETC2, 和ETC3不要导致类似的花序和花序培训滴体表型如图所示tcl1突变体或TCL2RNAi行。因此,我们想进一步研究两者之间的关系TCL2和TCL1在花序茎和花梗上的毛状体形成。之间产生双突变体tcl1和TCL2RNAi突变体,然而,双突变体是难以区分的tcl1单突变(数据未显示),可能是由于单重复基因的高阶冗余功能[19.].因此,我们转向测试TCL2可以救援tcl1突变表型。产生转基因植物以表达TCL2在…控制之下TCL1启动子在A.tcl1背景 (PTCL1:TCL2 / TCL1)。我们以前的结果表明,TCL1-GFP融合蛋白在控制下的表达TCL1子完全获救tcl1毛状体表型(13.],表明TCL1使用的启动子在功能上完全可以。如图所示5, TCL2蛋白的表达TCL1推动者仅部分救出tcl1突变表型,表明TCL2在功能上相似但与TCL1控制在花序茎和花梗上的滴毛组图案中。
TCL2与GL3相互作用
已经提出的是单重复MYB转录因子控制由与GL1竞争结合GL3,从而阻断TTG1-GL3-GL1活化剂复合物的形成毛状体形成。之前我们已经证实,TRY,CPC,TCL1,ETC1,ETC2和ETC3,与使用原生质体转染系统[GL3互动19.].为了测试TCL2是否使用类似的机制控制毛状体的形成,我们测试了TCL2是否与植物细胞中的GL3相互作用。
利用原生质体瞬时表达系统检测TCL2和GL3的互作。一个Gal4-Gus.记者,与效果一起GL3和Gal4 DNA结合域(GD)融合TCL2 (gd-tcl2.)被共转染拟南芥原生质体。GD独自GD-TCL1.分别作为阴性对照和阳性对照。如图所示6,有或没有GL3,单独GD不能激活报告基因的表达。在不存在的GL3,既不GD-TCL1也不GD-TCL2激活报告基因推测的表达由于以下事实:单重复R3转录因子没有激活域。然而,在GL3的存在,无论是GD-TCL2和GD-TCL1激活报告基因,这表明在植物细胞中与GL3该TCL2相互作用。应当指出的是,GL3可以作为转录激活功能然而,单单就不能招募到al4报告基因中的DNA结合元素[20.].还观察到,在GL3存在下,GD-TCL2激活的报告基因的表达远高于GD-TCL1(图6),这意味着TCL2和GL3之间的结合亲和力可以比TCL1和GL3之间更高。
TCL2抑制了表达GL1
除了与GL1竞争结合GL3之外,我们还报告了以前认为TCL1可以直接抑制表达式GL1[13.].因为在氨基酸水平上,TCL2比任何其他单重复myb更接近于TCL1(图)1) 和TCL2RNAi花序和花梗的毛状体表型相似tcl1突变体,然后测试TCL2是否也影响表达GL1.如图所示6 b,表达水平GL1在35S:HA-TCL2幼苗,类似于35s:ha-tcl1提示TCL2也能抑制GL1.
既不是GL1-GL3激活器复合物也没有单独启动SPLTCL2
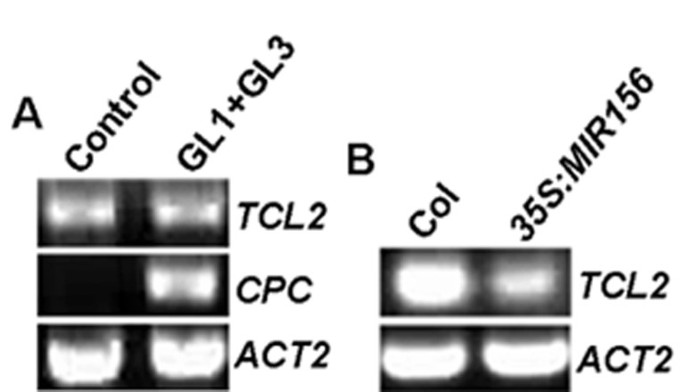
可用证据表明TTG1-GL3-GL1激活络合物均激活两者GL2以及一些单重复MYB基因。我们之前的记者表示,激活GL1和GL3是必需的,也是足够的GL2和单一重复Myb基因的子集,包括尝试,CPC,ETC1和ETC3, 但不是ETC2和TCL1[19.,20.].为了测试TCL2通过GL1〜GL3复杂调节,GL1和GL3共转染到原生质体和RT-PCR法检测的表达TCL2.的表达CPC作为阳性对照。正如所料,CPC通过GL1 + GL3被强烈诱导。然而,对于未观察到这样的活化TCL2(图7一个)。
我们想进一步研究控制活化的分子机制TCL2转录。最近,已经表明了这一点TCL1直接激活MIR156定向声压级[21.].为了探讨表达的可能性TCL2也可以由MIR156定向SPLs,检测其表达TCL2在35 s: MIR156植物。实际上,我们发现表达水平TCL2在35 s: MIR156植物显着减少(图7 b),类似于TCL1[21.].进一步测试SPLs是否可以直接激活TCL2,我们克隆了五个SPL基因,包括SPL3,SPL9,SPL10,SPL13和SPL15,在瞬时表达原生质它们,然后使用RT-PCR检查的表达TCL2.之所以选择这5个SPLs,是因为除了SPL15之外,所有的SPL15都被证明可以调节毛状体的形成[21.],而SPL15与SPL9密切相关[24.].令我们惊讶的是,没有观察到显著的变化(数据未显示)。由于在植物中的SPL的过度表达已被证明是能够诱导表达TCL1,而SPL9已被证明直接结合到的启动子区域TCL1[21.],我们测试是否表达了TCL1在转染了SPLs的原生质体中受影响。然而,我们没有看到任何显著的变化(数据未显示)。这些结果表明,单靠SPLs可能不足以激活TCL1.为了进一步探讨这种可能性,所有五个声压级克隆用GD融合,并共转染GAL4:GUS将报告基因导入原生质体,检测GUS酶活性。事实上,5个被测试的SPLs都不能激活报告基因(数据未显示)。这些结果表明,虽然SPLs可以直接结合到启动子区域TCL1,它们可能需要共激活剂来调节其靶基因的表达,包括TCL1,尝试可能,TCL2.
讨论
TCL2是培养的毛肌瘤形成的负调节剂
在这项研究中,我们分析了这个功能TCL2,以前在培养中形成的先前没有表征的单重复R3 MYB转录因子拟南芥.我们表明,TCL2, 喜欢TCL1,尝试,CPC,ETC1,ETC2和ETC3,对毛状体的形成起负调控作用。过度的TCL2在…的控制之下Camv 35s.启动子导致了无毛表型(图4)。击倒的TCL2通过RNAi (TCL2RNAi)导致花序茎和花梗上的异位培养体形成(图4),而在叶毛状体的数量和构图在很大程度上未受影响,表型相似的tcl1[13.].这些结果表明TCL2负调节培养体的形成,并且TCL2可以具有与TCL1的重叠功能,用于控制花序茎和花梗的滴毛组形成。
我们还展示了TCL2在…的控制之下TCL1启动子在A.tcl1突变背景(PTCL1:HA-TCL2 / TCL1)只能部分挽救毛状体表型tcl1突变体。毛状体仍然存在于花序梗和花梗PTCL1:TCL2 / TCL1植物,虽然频率显着降低(图5)。另一方面,表达TCL1在…的控制之下TCL1启动子的tcl1突变背景完全救出了毛滴虫表型tcl1突变体(13.].这些结果暗示,TCL2和TCL1可冗余功能上的花序梗和花梗,但它们的功能可能无法完全互换控制毛状体发育。
尽管记录TCL2在根中可以检测到(图2),所有突变体测试包括TCL2过表达,TCL2RNAi和PTCL1:TCL2 / TCL1在根毛形成方面基本上与野生型没有区别(数据未显示)。然而,我们不能排除TCL2可能在根毛形成中发挥作用的可能性,单重复myb突变的高阶组合可能有助于明确TCL2在根形成中的确切作用。
TCL2如何调节毛状体形成
以前的研究指出,滴毛组形成由活化剂/抑制剂反馈系统调节[7,10.,19.,25.].TTG1,GL1,GL3和或EGL3形成活化剂复合物(TTG1-GL3 / EGL3-GL1)发起毛状体发育通过激活GL2.相同的活化剂配合物也激活一些单重复R3 MYB转录因子基因,其产物,反过来,高下GL1结合GL3 / EGL3,从而抑制活化剂复合物的形成。我们以前的研究表明,TCL1也可以直接抑制的表达GL1,为毛状体形成的调控提供另一个负反馈回路[13.].通过使用原生质体转染系统,我们证明了TCL2与GL3相互作用(图6),提示TCL2可以阻断毛状体形成所需的激活复合物的形成(见附加文件2)。RT-PCR结果显示GL1在过表达的植物中显着减少HA-TCL2.,表示TCL2也可以抑制表达式GL1.这些结果表明,TCL2以与TCL1类似的方式调节毛状体形成(参见附加文件2)。然而,我们不能排除TCL2也可以通过其他机制调节毛状体形成的可能性,因为我们最近的结果表明单重复MYBS可以调节与GL2无关的毛状体形成[26.].
规范TCL2
可用证据支持TTG1-GL3 / EGL3-GL1活化剂复合体在调节培训的培训组中起重要作用。最近,发现几种植物激素,例如Jasmonic酸(Ja),赤霉素(气体)和细胞蛋白酶参与促进滴毛体的形成,并且该促进至少部分地通过TTG1组分的转录调节介导-GL3 / EGL3-GL1复杂[27.- - - - - -30.,进一步支持了激活复合物在调节毛状体形成中的关键作用。除了调节表达GL2为了促进毛状体的形成,激活复合物还会激活一些单重复MYB基因,提供一个负反馈回路。现有的证据表明CPC,尝试,ETC1, 和ETC3, 但不是TCL1和ETC2,通过所提出的活化剂配合物[调节19.,31.],这意味着其它途径也可以在单重复MYB基因的调控有关。最近,已经表明了这一点MIR156- 促进阶段过渡,直接激活的分裂TCL1和尝试通过与启动子结合表达这种激活是独立的GL1[21.].
利用原生质体瞬时表达系统,我们发现,表达TCL2不受TTG1-GL3/EGL3-GL1复合物调控(图7一个)。减少表达TCL2在35 s: MIR156转基因植物的建议MIR156- 特性的SPL也可能调节表达式TCL2(图7 b)。但是,当在原生质体中表达时,测试的五个SPL都不是既不引起的TCL2也不TCL1.进一步试验表明,单独声压级当由融合的DNA结合结构域招募到报告基因的启动子区域不能激活报告基因的表达。这些结果表明,可能有其他共激活因子与声压级合作规范的表达TCL1,可能TCL2(见附加文件2)。也可能是未识别的目标MIR156可能涉及调节单重复MYB基因。
结论
在本报告中,我们将TCL2鉴定为单重复MYB转录因子家族的新成员,并提供证据表明TCL2是培养的培养型发育的负调节因子。我们展示TCL2可以具有与TCL1的重叠功能来调节毛状体形成,但其功能不完全可与TCL1互换。此外,我们表明TCL2与植物细胞中的GL3相互作用,其表达不受GL3 / GL1活化剂复合物调节,以及该表达MIR156是否参与监管TCL2.最后,我们发现虽然SPLs可以直接结合到的启动子区域TCL1,他们可能需要共激活因子来调节其靶基因的表达,包括TCL1,尝试可能,TCL2.
方法
植物材料和生长条件
的tcl1突变体,35 s: MIR156和35s:ha-tcl1转基因植物在哥伦比亚-0(Col-0)背景[13.,21.].T-DNA插入线相关TCL2从索尔克研究所获得。
用于RT-PCR分析的幼苗在1/2 Murashige&Skoog(MS)培养基上生长维生素(Plantmedia)和1%(w / v)蔗糖。用于表型分析的幼苗通过在1/2 ms培养基上或将种子直接播种成土壤来获得。在约120μmolm的14/10小时的光周期下在22℃下生长植物-2年代-1.
构造
35S:GD-TCL1,35秒:HA-GL3已被描述[13.].生成HA或GD标记的构造TCL2,SPL3,9,10.,13.和15.中,对应的基因的全长度开放读框(ORF)通过使用RNA RT-PCR从10天龄光照生长的拟南芥幼苗放大,然后将PCR产物在帧克隆具有N末端HA或GD标签进入pUC19Vector在double的控制下35SCaMV增强子启动子。的PTCL2:HA-TCL2-GFP被融合克隆TCL2然后亚克隆到帕格19.在矢量的控制下TCL2自身的启动子(一个覆盖区域-1502至+1的片段的片段TCL2)。对于植物改造,相应的结构在帕格19.矢量用消化eCORI.,然后再克隆到二进制向量中PPZP211或者PPZP221[32.].
生成TCL2RNAi构造。的TCL2片段通过RT-PCR,使用正向引物5' -CAACTCGAGGATAACACCAACCGTCT-3' 和反向引物5'-CAAGAATTCAGGAGGAGAAATAGAGA-3' ,其含有经放大XHOI.和eCORI.酶在其5'端分别切割位点。将PCR产物通过消化XHOI.和eCORI.并克隆到载体中pHANNIBAL.载体含有Camv 35s.推动者和促销员n终结者置向方向。得到的质粒命名为pHANNIBAL-TCL2S.反转录引物5'-CAATCTAGAGATAACACCAACCGTCT-3'和反转录引物5'-CAAAAGCTTAGGAGGAGAAATAGAGA-3'进行RT-PCR扩增的XbaI站点和HindIII酶在其5'端分别切割位点。将PCR产物通过消化的XbaI和HindIII并克隆到pHANNIBAL-TCL2S质粒,由此产生phannibal-tcl2rnai.构造。的TCL2RNAi然后盒式磁带被取出phannibal-tcl2rnai.通过消化NotI,并亚克隆到二元载体pART27对植物转换。
系统发育分析
采用TRY、CPC、TCL1、TCL2、ETC1、ETC2和ETC3/CPL3全长蛋白序列进行系统发育分析。使用默认设置的CLUSTAL W多序列比对程序生成多序列比对和带有分支长度的树状图(http://www.genome.jp/tools-bin/clustalw)。
植物转化和转基因植物的选择
关于主要开花上有几朵成熟花的五周龄植物用于通过各种构造转变农杆菌肿瘤术GV3101使用花卉DIP方法[33.].转基因植物表型在T1代中进行了检查,并在T2确认到T4世代。上调或相应相关线路的基因的下调表达通过RT-PCR证实。对于每个构建体,获得至少三个独立的转基因系与相似的表型,并且从代表性线结果提交。
质粒DNA分离、原生质体转染及GUS活性测定
质粒DNA用Qiagen EndoFree Plasmid Maxi试剂盒(http://www.qiagen.com)。原生质体分离、转染和GUS活性测定如前所述[34.- - - - - -36.].简单地说,原生质体是从4周龄的植株莲座叶中分离出来的。效应质粒和报告质粒共转染到原生质体中,并在黑暗下培养20-22小时。使用BioTEK Synergy™HT酶标仪(http://www.biotek.com.)。的表达35 s:荧光素酶(LUC)用于标准化GUS记者的表达。使用微孔器发光计测量荧光素酶活性(http://www.turnerdesigns.com)及Promega Steady-Glo荧光素酶检测系统(http://www.promega.com/)。
显微镜
出生仅四天的幼苗就表达TCL2-GFP.在…的控制之下TCL2启动子用于检查TCL2-GFP的表达和定位,通过使用具有相位和差分干扰对比(DIC)的Leica DM-6000B直立荧光显微镜,使用连接到显微镜的Leica FW4000数码相机进行照片(http://www.leica-microsystems.com.)。
RNA分离和RT-PCR
使用RNeasy plant Mini Kit (QIAGEN, Mississauga, Ontario, Canada)从植物不同部位、幼苗或转染原生质体中分离总RNA。用2 μg总RNA,经Oligo(dT)引反转录,使用OMNISCRIPT RT Kit (QIAGEN)合成cDNA。部分用于克隆或检测相应基因表达的引物已在前面进行了描述[13.,19.],其他人如下。TCL2特异性引物(5'-CATATGGATAACACCAACCGTCT-3' 和5'-GAGCTCTTAAGGAGGAGAAATAG-3' )用于扩增TCL2的全长ORF。哈- 特异性(5'-TACCCTTACGATGTTCTCCTAC-3')和TCL2特异性(5'-GAGCTCTTAAGGAGGAGAATAG-3')引物用于检查表达式HA-TCL2..TCL2RNAi-特异性引物(5'-GTCCTCTTTCACTTTCAAATACCAATG-3'和5'-CTTAAAGCTTTTATCTTGTCC-3')检测表达TCL2在TCL2RNAi转基因植物。
参考
- 1。
Oppenheimer DG, Herman PL, Sivakumaran S, Esch J, Marks MD: Amyb拟南芥叶片毛细血管分化所需的基因在尺寸中表达。细胞。1991,67:483-493。10.1016 / 0092-8674(91)90523-2。
- 2。
佩恩CT,张楼,劳埃德AM:GL3在拟南芥中编码bHLH蛋白,该蛋白通过与GL1和TTG1相互作用调控毛状体发育。遗传学报。2000,32(4):457 - 461。
- 3。
张F,Gonzalez A,Zhao M,Payne CT,Lloyd AM:冗余BHLH蛋白的网络在所有TTG1依赖性路径中拟南芥.发展。2003,30:4859-4869。
- 4.
Galway ME, Masucci JD, Lloyd AM, Walbot V, Davis RW, Schiefelbein JW: TheTTG.需要基因来指定表皮细胞命运和细胞图案化拟南芥根。Dev Biol。1994年,166:740-754。10.1006 / dbio.1994.1352。
- 5。
沃克AR,戴维森PA,博洛涅西 - 温菲尔德交流,詹姆斯CM,斯里尼瓦桑N,布伦德尔TL,阿尔泽特JJ,标记MD,灰色JC:在透明Testa Glabra1.轨迹,其中规定皮毛分化和花青素合成的拟南芥,编码WD40重复蛋白。植物细胞。1999年,11:1337至1350年。
- 6.
Rerie WG, Feldmann KA, Marks MD: TheGLABRA2基因编码在正常毛状体发育所需的homeo域蛋白拟南芥.基因开发。1994年,8:1388-1399。10.1101 / gad.8.12.1388。
- 7.
Pesch M, Hülskamp M:拟南芥毛状体和根毛形成过程中从头创建一个二维模式。中国生物医学工程学报。2004,14:422-427。10.1016 / j.gde.2004.06.007。
- 8.
一、二、三……拟南芥毛状体模式的研究。植物生态学报。2009,12:587-592。10.1016 / j.pbi.2009.07.015。
- 9.
Schnittger A,Folkers U,施瓦布B,尤尔根G,HülskampL:一个间隔图案的产生:所述的作用TRIPTYCHON在拟南芥的毛状体模式中。acta botanica sinica(云南植物学报). 1999,11:1105-1116。
- 10。
Schellmann S,Schnittger A,Kirik V,Wada T,Okada K,Beermann A,Thumfahrt J,JürgensG,HülskampM:三联卷曲和Caprice在滴毛组和根发术期间介导侧向抑制拟南芥.EMBO J. 2002,21:5036-5046。10.1093 / EMBOJ / cdf524。
- 11.
Wada T, Tachibana T, Shimura Y, Okada K:表皮细胞的分化拟南芥由Myb同系物CPC测定。中国科学:地球科学。10.1126 / science.277.5329.1113。
- 12.
Wada T,Kurata T,Tominaga R,Koshino-Kimura Y,Tachibana T,GoTo K,Marks MD,Shimura Y,冈田K:一个积极调节器的根发发育的作用,任性, 在拟南芥根表皮细胞分化。发展。2002,129:5409-5419。10.1242 / dev.00111。
- 13。
Wang S, Kwak SH, Zeng Q, Ellis BE, Chen XY, Schiefelbein J, Chen JG: TRICHOMELESS1通过抑制毛状体模式调控GLABRA1在拟南芥.发展。2007,134:3873-3882。10.1242 / dev.009597。
- 14。
Esch JJ, Chen MA, Hillestad M, Marks MD:比较尝试和密切相关的At1g01380控制拟南芥毛状体模式的基因。植物学报,2004,40:860-869。10.1111 / j.1365 - 313 x.2004.02259.x。
- 15.
Kirik V, Simon M, Hülskamp M, Schiefelbein J: The增强的尝试和cpc1基因与TRIPTYCHON和任性在拟南芥中滴毛组和根毛细胞图案化。Dev Biol。2004,268:506-513。10.1016 / J.YDBIO.2003.12.037。
- 16。
Kirik V, Simon M, west K, Schiefelbein J, Hülskamp M:TRY和CPC 2增强器(ETC2)揭示了冗余的毛状体发育的区域,特定的控制拟南芥.植物生态学报。2004,32(4):489 - 498。10.1007 / s11103 - 004 - 0893 - 8。
- 17.
Tominaga R,Iwata M,Sano R,Inoue K,Okada K,Wada T:除了毛发形成和根毛形成外,还控制了腹部和开花的开发开发的rabidopsis样Myb 3(CPL3)。发展。2008,135:1335-1345。10.1242 / dev.017947。
- 18.
韦斯特K,Digiuni S,盖尔女,蒂莫Ĵ,斑点C,HülskampL:在毛状体发育R3单重复基因功能多样性。发展。2009年,136:1487至1496年。10.1242 / dev.021733。
- 19.
Wang S ., Hubbard L ., Chang Y ., Guo J ., Schiefelbein J ., Chen JG .:拟南芥表皮细胞模式中单重复R3 MYB蛋白的综合分析及其转录调控。植物生态学报。2008,8:81-10.1186/1471-2229-8-81。
- 20.
Wang S, Chen JG:拟南芥GLABRA2的瞬时表达分析表明,GLABRA2的激活可能需要GLABRA1和GLABRA3与GLABRA2的启动子同时结合。植物营养与肥料学报。2008,29(4):492 - 498。10.1093 /卡式肺囊虫肺炎/ pcn159。
- 21。
于宁,蔡文军,王胜,单明梅,王丽娟,陈学勇:靶向microrna156对毛状体分布的时间控制SPL基因在拟南芥蒂利亚纳.acta botanica sinica(云南植物研究),2010,22(4):593 - 598。10.1105 / tpc.109.072579。
- 22。
拟南芥MYB转录因子与R/B样BHLH蛋白相互作用的研究。植物学报2004,40:22-34。10.1111 / j.1365 - 313 x.2004.02183.x。
- 23。
Kurata T,Ishida T,Kawabata-Auai C,Noguchi M,Hattori S,Sano R,Nagasaka R,Tominaga R,Kathino-Kimura Y,Kato T:拟南芥根表皮细胞分化中Caprice蛋白的细胞到细胞运动.发展。2005,132:5387-5398。10.1242 / dev.02139。
- 24。
Schwarz S,Grande Av,Bujdoso N,Saedler H,Huijser P:MicroRNA调节的SBP-Box基因SPL9和SPL15对照拟南芥中的拍摄成熟。植物mol biol。2008,67:183-195。10.1007 / s11103-008-9310-z。
- 25。
细胞是如何知道它们长大后想成为什么样子的?拟南芥表皮图案形成的经验。植物学报,2003,54:403-430。10.1146 / annurev.arplant.54.031902.134823。
- 26。
王S,巴伦C,席费尔拜Ĵ,陈JG:毛状体和根毛图案在拟南芥调控GLABRA2和单重复MYB R3转录因子之间的不同数据的关系。新Phytolo。2010,185:387-400。10.1111 / j.1469-8137.2009.03067.x。
- 27。
甘Y,刘成,渝H,Broun病人:表皮细胞命运调控细胞分裂素和赤霉素信号由拟南芥转录因子GIS,ZFP8和GIS2的整合。发展。2007年,134:2073年至2081年。10.1242 / dev.005017。
- 28。
【关键词】拟南芥(Arabidopsis thana);表皮毛状体;植物营养学报。2008,31(4):457 - 461。10.1104 / pp.108.125385。
- 29。
Yoshida Y,Sano R,Wada T,Takabayashi J,Okada K:Glabra3的Jasmonic酸控制在拟南芥中的诱导防御和培训型图案化。发展。2009,136:1039-1048。10.1242 / dev.030585。
- 30.
Maes L, Goossens A:激素介导的植物毛状体启动的促进是保守的,但利用了物种和毛状体特异性的调节机制。植物学报2010,5:205-207。10.4161 / psb.5.2.11214。
- 31。
Morohashi K,Zhao M,Yang M,Read B,Lloyd A,Lamb R,Grotewold E:拟南芥BHLH因子GL3在滴毛组启动监管事件中的参与。植物理性。2007,145:736-746。10.1104 / pp.107.104521。
- 32。
Hajdukiewicz P,什瓦布Z,马利加,P:小型,多功能pPZP家庭植物转化农杆菌二元载体。植物mol biol。1994年,25:989-994。10.1007 / BF00014672。
- 33。
Clough SJ,弯曲AF:花卉浸:农杆菌介导的拟南芥转化的简化方法。植物J. 1998,16:736-743。
- 34。
生长素响应因子结构域在生长素响应转录中的作用。acta botanica sinica, 2017, 36(5): 531 - 534。10.1105 / tpc.008417。
- 35。
王某,张y,guo j,陈jg:拟南芥卵形家族蛋白1是抑制细胞伸长的转录压缩机。工厂J. 2007,50:858-872。10.1111 / J.1365-313x.2007.03096.x。
- 36。
Wang S, Tiwari SB, Hagen G, Guilfoyle TJ:生长素响应因子7在突变拟南芥叶肉原生质体中恢复生长素响应基因的表达。植物学报。2005,17:1979-1993。10.1105 / tpc.105.031096。
致谢
我们感谢王佳伟博士和Detlef Weigel博士分享的种子35 s: MIR156转基因植物,ABRC用于T-DNA插入线,以及肖恩曼斯菲尔德博士提供pHANNIBAL和pART27向量。国家自然科学基金(批准号:)资助。31170262)和东北师范大学对西南地区的启动资金,以及橡树岭国家实验室的实验室指导研发计划。橡树岭国家实验室由UT-Battelle有限责任公司管理,根据合同DE-AC05-00OR22725为美国能源部。
作者信息
从属关系
通讯作者
额外的信息
利益争夺
两位作者宣称他们没有相互竞争的利益。
作者的贡献
LG进行了大部分实验。SW设计了实验,并进行了部分实验。LG和SW起草了手稿。KX和J-GC构思了这项研究,参与了其设计并帮助编辑了手稿。所有作者阅读并批准了最终的手稿。
电子辅料
Adobe Photoshop,表达单重复MYB基因
附加文件1:35秒:TCL2RNAI.转基因植物.RNA从野生类型的10天幼苗和两个独立的幼苗中分离出来35秒:TCL2RNAI.转基因系和RT-PCR用于检查单重复MYB基因的表达。注意转录程序ETC1没有包含在图中,因为我们无法检测?的表达ETC1在幼苗。Actin2的表达(ACT2)作为对照。(TIFF 454 KB)
Adobe Photoshop,控制毛滴体形成的转录因子网络的模型
附加文件2:拟南芥.TTG1,GL3 / EGL3和GL1形成活化剂复合物,以调节的转录GL2,以及一些单重复MYB基因。单个MYB转录因子与GL1竞争GL3/EGL3的结合,从而限制了TTG1-GL3-GL1激活复合物的形成。本研究表明,TCL2可以与GL3完整结合,还可以抑制GL3的表达GL1,从而限制TTG1-GL3-GL1激活复合物的转录活性。像这样的TCL1,转录TCL2是由SPLs调控的,然而,转录激活可能需要未知的共激活因子。问号表示未知的监管机构或不明确的流程。(TIFF 1 MB)
作者的原始提交的图像文件
权利和权限
开放访问本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
Gan,L.,xia,K.,陈,JG。et al。TRICHOMELESS2的功能特性,一个新的单重复R3 MYB转录因子调控毛状体模式拟南芥.BMC植物BIOL.11,176(2011)。https://doi.org/10.1186/1471-2229-11-176
已收到:
接受:
发表:
关键字
- 转基因植物
- 激活复杂
- 毛状体形成
- Squamosa启动子结合蛋白喜欢
- 透明的外种皮GLABRA1