摘要
背景
植物颜色的变化不仅是由于全球颜料浓度也不同类型的颜料的比例。变化的色彩频谱可以从二级修饰,如羟基化和甲基化出现,影响颜料的色特性。在葡萄(葡萄甲基化程度改变了花色苷的稳定性和反应性,直接影响浆果的颜色。花青素甲基化是一种复杂的性状,受多种分子因素的控制,可能涉及多个调控步骤。
结果
在西拉×歌海娜子代中,检测到2个花色苷甲基化水平变异的qtl。第一个解释了高达27%的变异,它与一簇myb型转录因子基因共定位。第二种解释了高达20%的差异,与一群O -甲基转移酶编码基因(AOMT)在32个不相关的品种中,MybA和AOMT表达谱与甲基化花青素水平相关。此外,新特征AOMT2基因呈现出与甲基化水平相关的两个SNP。这些突变可能导致AOMT2蛋白的结构变化显着影响了3'-的酶特异性催化效率O -Delphinidin 3-葡糖苷的甲基化。
结论
我们展示了甲基花青素积累的变异是易患同时涉及转录调控和结构的变化。我们在这里报告小说AOMT的识别变异可能导致甲基花青素变化。QTL定位和分子方法的整合使更好地理解在基因表达,将所得的酶催化效率的变化如何可以影响葡萄花青素轮廓。
背景
花青素是类黄酮家族的主要成员之一,由贮藏在液泡中的水溶性小分子组成。作为广泛分布的植物次生代谢物,它们是许多植物组织的红色和蓝色的来源[1].作为主要颜料的花青素,通过吸引粉化剂和种子分散剂并保护光氧化应激,起到植物繁殖中的重要作用[2].在作物、观赏植物和水果中,它们构成了产品美学质量的关键特征。在葡萄中,由于它们与其他酚类化合物以及蛋白质和多糖的复杂相互作用,它们在葡萄酒颜色和感官特性方面发挥着关键作用[3.].
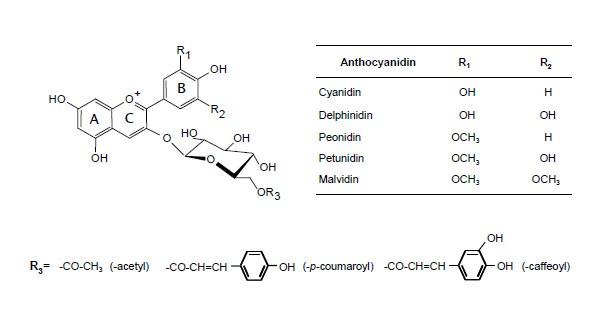
发现的花青素葡萄是3-O -单葡萄糖苷(3-glc)和3-O -从五个主花色素衍生的酰基单葡糖苷 - 花翠素(DP),矢车菊(CY),甲基花青素(PN),矮牵牛(Pt)和二甲花翠素(MV) - ,其中的羟基的数目和位置彼此不同和位于其B环上的甲氧基(图1):飞燕素和花青素未甲基化,芍药素和芍药素单甲基化,malvidin二甲基化。s -腺苷- l-蛋氨酸(SAM)依赖的甲基化O -甲基转移酶在改变植物次级代谢物的结构方面发挥着重要作用。对于花青素,甲基化稳定酚B环,从而降低整体分子的反应性[4],和增加的水溶解度,从而增强它的颜色性质[5,6].花青素的颜色很大程度上取决于羟基的数量:羟基的数量越多,颜色就越蓝。另一方面O -花青素的甲基化有泛红的效果。
花青素生物合成途径已广泛表征众多植物物种[7,8].在葡萄树中,已经克隆了导致DP 3-Glc和Cy 3-Glc合成的花青素途径的核心结构基因并表现为[9,10.].最近,有两个花青素O -甲基转移酶(AOMT和FAOMT)能够甲基化花青素体外和在活的有机体内已被确定[11.,12.].花青素生物合成由MyB-BHLH转录复合物控制,该复合物激活途径后期涉及的结构基因的表达[7,13.- - - - - -16].特别是,vvmyba.基因诱导的转录UFGT和AOMT在彩色组织中[17- - - - - -19]显示在葡萄中控制花青素积累[20.,21].虽然花青素在葡萄中甲基化被环境和文化条件改变了[22,23,它也受到遗传因素的强烈影响。事实上,无论是花色苷的总量,还是单一花色苷的相对丰度,在红皮和蓝皮的品种之间都有很大的差异。尽管存在这种可变性,单甲基和二甲基衍生物仍占主要地位[24,25], malvidin 3-glucoside是大多数品种的主要花青素,而芍药苷3-glucoside通常含量较少[26,27].编码黄酮类化合物3' - 和3'5' - 羟基化酶羟基化的基因[28,29或编码基因O -甲基转移酶参与花青素甲基化[11.,12.,30.]可以潜在地产生花青素组合物的差异。全基因组序列的可用性[31,32]除了广泛的遗传资源,将有助于我们进一步阐明葡萄中涉及花青素生物合成的机制。
本研究的目的是了解葡萄花青素甲基化的遗传控制体系结构,并提高我们对调控花青素甲基化的复杂因素的认识。鉴定了2个花色苷甲基化变异qtl: 1个与aMybA基因簇和第二与三个假定的簇共定位AOMT基因。本研究旨在验证后者在花青素甲基化中的作用,并识别遗传变异背后的分子因素。将正向遗传方法(以系谱和群体为基础)与功能基因组学和酶学相结合,可以描述花青素-的复杂调控O -甲基转移酶基因簇是控制葡萄花青素甲基化的主要基因。
结果
甲基化花青素含量的变异
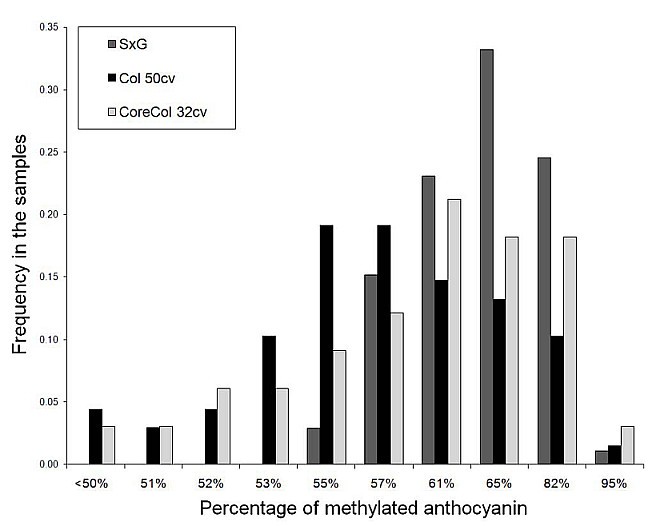
为了研究花青素甲基化的遗传基础,我们对三种植物进行了分析:(2)从Vassal种质(Coll 50 cv, INRA, Domaine de Vassal, France)收集的50个颜色基因型;(3) 32个基因型的子集(Core-Coll 32 cv),最能代表50个个体样本中个体数量较少的花青素甲基化水平的多样性。在SxG的后代中,花青素的组成也有很大的不同1)和自然多样性的收集(数据提交给Core-Coll 32 cv,附加文件2).后日志- 在三个样品中形成甲基化的花青素(MT)的分布(P-Val> 0.05)。SXG后代在MT的水平上显示出广泛的变化,从50%至97%的甲基化花青素的水平,具有MT的差异σ2mt sxg.= 0.42(图2).50种彩色葡萄品种(Coll 50 CV)的集合显示出与甲基化的花青素的31%至97%的变化,具有MT方差σ2MT 50 CV= 0.58。方差增加到σ2太32个简历在Core-Coll 32 cv中= 0.89。
分布的太变量在QTL和关联作图中使用.的太变量表示为甲基化/非甲基化花青素与每g新鲜浆果皮肤的甲基化/非甲基化青花青蛋白比值的对数。SXG:191来自Syrah×Grenache后代用于QTL映射的人。Coll 50 CV:从原始农业核心集合的50个彩色葡萄品种的随机抽样(Barnaud等[33])。Core-Coll 32 cv: core-collection设计自Coll 50 cv,以优化捕获太变异性。
花色苷甲基化水平的QTL定位
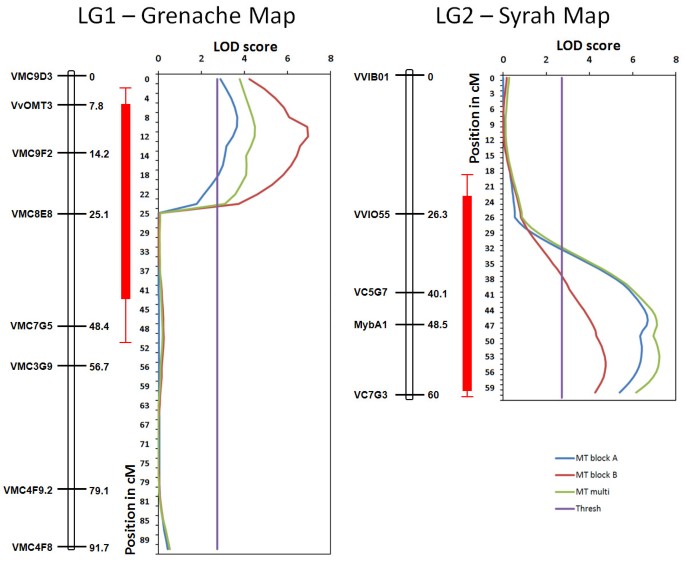
利用多性状分析方法分别对两个区块进行QTL检测。在这两种情况下,对花青素甲基化水平的两个qtl进行了一致的鉴定。第一个QTL位于标记VMC5G7和VMC8C2之间的Linkage Group 2 (LG2)上,可以解释27%的花青素甲基化表型变异(图)3.).在Syrah父母地图上检测到该QTL,并支持最大LOD 7.49,用于多特征检测。在两个块上也检测到它分别检测。这种QTL,其与先前鉴定为控制葡萄浆果中花青素的含量的QTL [20.,对应于vvmyba.基因聚类,共同控制花青素甲基化和总积累。第二个QTL在歌海那亲本遗传图谱LG1标记VMC9E3和VMC8E8之间,解释了高达20%的表型变异,最大LOD为6.96(图)3.).在本研究中,我们重点研究了与花青素甲基化相关的第二个QTL。与LG1 QTL最接近的标记pOMT2显示,高MT等位基因纯合组合与低MT等位基因杂合组合在pOMT2位点上的差异为11.8%3.).
候选基因的QTL选择
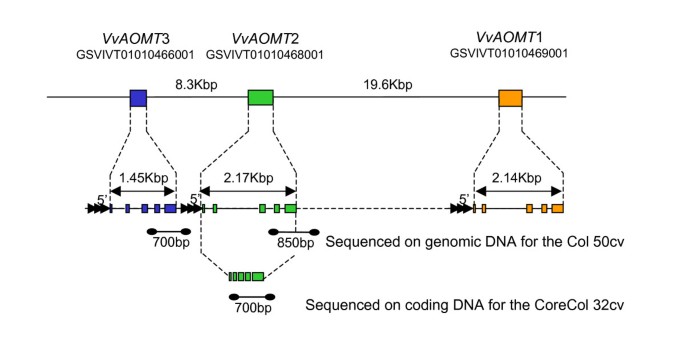
LG1 QTL最大LOD周围1 Mbp的物理区间包含46个鉴定评分高于5的预测unigenes(附加文件)4).在这些单基因中,一组由三个基因组成的推测花青素基因O -一个的1.2Kbp 33区域内的甲基转移酶(AOMT)被确定,此后称作vvaomt1,vvaomt2,vvaomt.3(图4).vvaomt1编码了一种与西拉的AOMT相同的蛋白质,可以甲基化花青素体外和在足底[11.与赤霞珠(Cabernet Sauvignon)的FAOMT类似,显示出花青素的甲基化作用体外[12.];因此,我们将研究范围缩小到这三个候选基因。这三个基因结构相似,有5个小外显子,大小在51 - 294 bp之间,4个内含子(图)4).三个OMTS的推导氨基酸序列显示出高序列相似性(附加文件5)在基因组水平下最小成对相同率为90%,在转录水平下96%。此外,没有其他蛋白质显示出超过20个氨基酸,与葡萄基因组中的Aomt相似,显示出证据vvaomt.作为一个孤独的家族。相应的转录本长708 bp,非常类似于vvaomt1.因此,所有三种基因可能是潜在的。3'非编码结束vvaomt.基因出现更少的保守比编码区域,和三个isogenes之间的唯一区别健壮从而依靠发散的非编码3' 末端。同源基因特异性引物可以被设计为vvaomt.2,vvaomt.3 cDNA,但不为vvaomt.1 cDNA,由于序列同源与另外两个等原性和较短的3'端。使用特定引物vvaomt.3、在Syrah、Joubertin和Petit Bouschet成熟浆果中未检测到表达,说明该同基因在成熟红浆果中未表达6).虽然这并没有说明的非功能性vvaomt.3,它证明了进一步的考虑vvaomt1和vvaomt.2、作为关联遗传分析的候选基因,两者均在成熟浆果中表达。
的开放阅读框的基因组结构vvaomt.染色体上的基因簇1.连续的线条代表按正确比例绘制的截面;虚线表示比例的变化。点之间的线表示序列片段。填满的盒子表示外显子。数据对应的12X基因组注释可从Genoscope葡萄基因组浏览器数据库http://www.genosope.cns.fr/externe/genomebrowser/vitis/.
效果vvaomt.和vvmyba.甲基化花青素的表达
评估…的相对影响vvaomt.和vvmyba.我们在Core-Coll 32 cv中测定了它们各自的转录量,以最大限度地提高甲基化花青素的多样性。我们分析了表达水平vvaomt.(eAOMT),它结合了三个isogenes的表达vvaomt1,vvaomt2,vvaomt.3,vvmyba.(emyba.),其结合了这两种isogenes的表达vvmyba.1vvmyba.2.这两个eAOMT和emyba.似乎遵循32种品种的持续变化,没有通过单一主要多态性进行调节的证据。eAOMT似乎与浆果皮肤的甲基花青素含量(高度相关ρ= 0.58,P-Val <0.001;表格1).emyba.出现与总花青素含量相关,但没有甲基化的花青素含量(表1).最后,对甲基化花青素含量进行了较好的预测eAOMT和emyba.在多元回归模型中被联合考虑(表2),提示这两个基因的表达水平对花青素甲基化有影响,可能直接影响eAOMT和间接影响emyba..
协会映射vvaomt1和vvaomt2.
将两者的特殊效果分离开来vvaomt.我们对50个花色品种(基因组DNA片段对应于3'端700 bp)的候选基因进行了部分测序vvaomt1和3'端的850个碱基vvaomt.2;figure4).这允许检测基因组DNA的两个最后外显子和3'UTR的多态性vvaomt.候选(高序列同源性和较短的3'UTRvvaomt1在完整的编码序列中没有允许特异性扩增)。上vvaomt1,我们鉴定了15个SNPs和2个InDelsvvaomt2.在美国,我们鉴定了19个SNPs和1个InDel,产生9个非同义突变。我们使用EMMA软件测试了这些多态性与甲基化花青素水平的关联[34].六个SNP被确定为与花青素的甲基化变化有关vvaomt.2和none invvaomt1.显著相关的多态性与P-value < 0.05,检验统计量见表3..SNP Y522未改变该基因的氨基酸序列,其他5个相关多态性均位于该基因的3'UTR部分vvaomt.2基因,从而不影响该蛋白质的结构。所有六个相关的SNPs显示显著LD,一个LD块,包括SNP Y522,Y717,Y741和W774(成对[R2= 0.5-1),另一个LD块,包括M843和Indel909(成对r2= 0.6)。然而,鉴于两个基因座的高水平多态性,我们预期如果其他地方有功能变化vvaomt1通过与因果变动量LD序列,我们会进行基因分型的至少一个SNP显著相关。除了报道的LD的两个街区vvaomt2.,识别出两块高LDvvaomt1(附加文件7).但是,没有代际LD在vvaomt1和vvaomt2.,显示包括这些基因的基因组片段中LD的快速衰减。as.vvaomt2.与花青素的甲基化水平的唯一的同源基因多态位点的关联,我们只保留了vvaomt2.作为候选基因。
具体的表达vvaomt2.
特异性特异性引物被设计为测量候选基因的特异性表达vvaomt.2 in.(1) MybA1转化的葡萄毛毛根积累了花青素[18]和在(2)Core-Coll 32 cv(附加文件2).因为我们没有成功地设计特异性引物AOMT1,我们只能比较全球表达式eAOMT(vvaomt1+vvaomt.2)使用具有特定表达的非特异性引物vvaomt.2.在毛状根中过度表达MybA1,表达vvaomt.2与对照相比,增加了5.5倍的增加,而水平eAOMT,增加了75倍的增加(附加文件8).尽管vvmyba.1vvaomt.2 .不可忽视的是,这些结果表明……的影响vvmyba.1vvaomt.2是有限的。在32个品种的亚核收集中,表达量之间没有显著的相关性vvaomt.2和甲基化花青素的比例。此外,无显著影响emyba.观察到表达的表达vvaomt.2(表1).然而,即使具体的表达水平vvaomt.2与global相关eAOMT(ρ= 0.40,P-val = 0.023),具有显著的调节作用eAOMT在甲基化水平上,在没有相关性之间的情况下vvaomt.2表达和MT,我们得出的结论是vvaomt.2的表达对花青素甲基化没有直接的调控作用。
序列分析vvaomt2.基因
我们完全排序了vvaomt.2个Core-Coll 32 cv的cDNA,在ORF中鉴定了30个多态性,包括26个SNPs和4个InDels(附加文件)9).作为基因组和cDNA片段测序vvaomt.2部分重叠,8是共同的,到了50个品种样品中已经鉴定的那些,包括在表4个最相关的SNPs3..再次测试这种新的多态性集合在核心 - Coll 32 CV中再次与甲基化的花青素水平相关联,只发现三个关联意义:Y741再次强烈相关,以及两个新的SNP,Y127和W388。这三个SNP显示完全的联系不平衡(R2= 1),它们的效果就这样被混淆了。此外,VvOMT2SxG群体亲本的序列与pOMT2标记相同,西拉亲本W388和Y741强等位基因为纯合,歌海歌海亲本为杂合。这支持了LG1位点上的歌海娜QTL可能与定位群体中VvOMT2等位基因分离有关。
最后,在最佳模型中,包括仅表达配置文件,eAOMT关联模型中单一SNP Y127或W388对同一样本解释了43%的方差(表1)2和表格3.).这种强烈的效应与在Y127和W388位点携带强或弱等位基因的组之间花青素甲基化的高度显著差异有关(MT平均分别为94.7%和76.5%)。SNPs Y127和W388对应于影响AOMT蛋白一级结构的非同义变化。Y127在氨基酸链第43位由H取代Y, W388在氨基酸链第130位由S取代T。Y127在预测的蛋白二级结构的第2个α-螺旋内出现突变,W388在预测的第6个α-螺旋内出现突变。
的等位变异的特征vvaomt2.
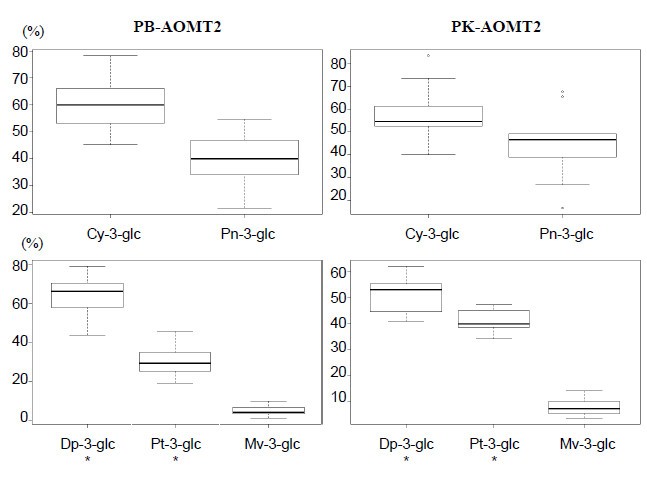
选择两个葡萄品种进行纯合子的单核苷酸多态性对比vvaomt.2个轨迹,代表相应的Aomt2蛋白的两个等位基因变体。'Petit Bouschet×Aramon n°4'(Pb)呈现Y127和AT的弱等位基因T,在W388,'Papadiko'(PK)在W388的Y127和T处呈现强额外的等位基因C.在编码区域中未检测到其他差异。用PB-AOMT2和PK-AOMT2进行的酶检测表明,两种酶催化体外3'O -甲基化花青素与邻苯二酚b环(3',4'二羟基)和3'和5'O -显示邻苯三酚(3',4',5'三- oh) b环的甲基化。然而,对PB-AOMT2和PK-AOMT2活性的详细分析揭示了底物特异性的催化效率差异(表4).事实上,当Cy -glc被用作底物时,PB-AOMT2和PK-AOMT2似乎都能很好地催化Cy -glc的甲基化成为pn3 -glc。相比之下,当Dp 3-glc作为底物时,PB-AOMT2与PK-AOMT2相比,产生Pt 3-glc的效率显著降低(相对最终Pt 3-glc比例的平均差异为9.7%,P-val = 0.02,图5).最后,两种酶都能够以相似的效率在MV 3-GLC中转换DP 3-GLC,但虽然小比例。
讨论
结合分子生理学和遗传学解剖植物复杂性状
通过分子生理学和正向遗传学实验,植物花青素合成研究取得了重大进展[7].然而,QTL和关联定位技术也被证明是分析复杂生理性状的相关工具,特别是花青素代谢[35].因为玉米中的大规模应用,只有少数企图克隆和潜在变化的基因验证多态性已经成功[36].在这项工作中,我们提出了不同的方法来绘制甲基花青素在葡萄调控的一个全球性的图片。作为起点,我们进行了高度多样化的表型的一个合理的采样存在于种质宗藩库(INRA,德了Domaine宗藩,法国),通过使用M-方法[37,38].该方法可确保适合检测对比遗传效应的表型多样性的最佳捕获。使用QTL映射和一个分致级化vvaomt.染色体1的集群,提供了独立证据支持vvaomt.基因可能在决定葡萄花青素甲基化水平中起关键作用。广泛遗传资源的可得性以及葡萄基因组工具的使用[31通过基因表达和关联图谱研究,帮助完善了我们的QTL检测,证明了两者都可能参与CIS.-regulation和新表征等位基因变异在塑造一个复杂的表型。
的多效性影响vvmyba.基因
在LG2上检测到MT级别的QTL(解释了35%的方差)与a共同定位vvmyba.基因群集,支持这一点vvmyba.基因对花青素甲基化有重要影响。在以前的实验设计中发现的结果[20.表明该区域比甲基化花青素水平更好地解释了总花青素含量(64%的方差解释)。这表明该QTL与vvmyba.基因簇,大多是对总花色素苷积累和后果,对花青素的甲基化的间接效果的效果。的vvmyba.基因控制的花青素合成的后期步骤的关键基因的转录:UFGT和AOMT[18].我们的研究表明,vvmyba.1对全球有重大影响vvaomt.表达水平。VvUFGT催化花青素苷元在C3上的糖基转移[19,39].vvaomt.将DP 3-Glc的甲基化催化为Pt 3-Glc和MV 3-glc,以及Cy 3-glc进入pn 3-glc的[11.].这种渗透效果vvmyba.基因座解释了合成花青素的数量和性质之间的关系。这一效应也可以解释为什么黑葡萄浆果总是含有大量的malvidin,这是花青素中甲基化程度最高的一种形式[24- - - - - -26].UFGT和AOMT基因显示出类似的表达曲线[18,40]并且迄今为止,在它们的序列多态性从未与花色素苷含量变化相关联[9,11.,13.].因此,迄今为止,这些基因被认为是纯粹的CIS.- 在花青素途径上进行调节控制。
确定vvaomt.基因独立于vvmyba.基因
我们旨在识别调控因子具体到花青素的甲基化水平和自主总花青素含量。所述MT变量和总花青素含量是统计学独立的,所以QTL的两个性状共分离和之间的相关性vvmyba1.因此,基因的表达和MT完全是由于生物学效应。然而,特定诱导花青素组成差异的基因应该是独立于表达vvmyba.或显示反式-regulation或与花色素苷的甲基化相关联的结构变化。在寻找花青素的甲基化过程中的这种特定的因素,关键是要找到那名显著独立于全球花青素变化的要素VvMybA独联体管理通道。最近,在番薯中发现了一个类似的例子,二羟基黄酮醇还原酶(一种也参与花青素途径的基因),复制的基因逃离了控制网络,以更好地适应[41].我们可能也会怀疑vvaomt.2和花青素甲基化。
的vvaomt.基因簇,复制基因家族的命运
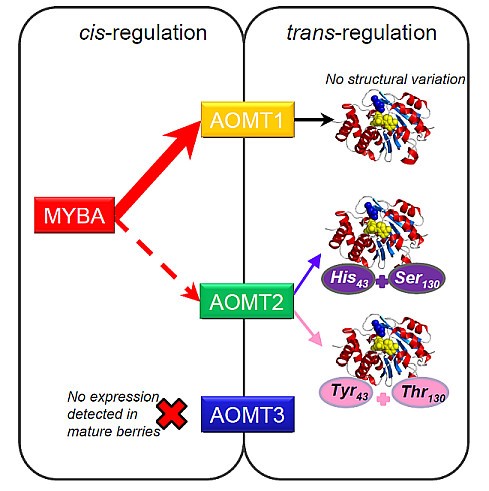
仅覆盖非甲基化的花青素的葡萄品种从未描述过[24- - - - - -26在我们对一个非常多样化的样本进行的研究中也没有发现,这必然涉及到葡萄基因组中功能AOMT的持久性。两种机制可以产生这样的模式:对AOMT活性的强选择性约束和限制有害突变作用的功能冗余vvaomt.轨迹。我们鉴定了编码在QTL的置信区间位于1号染色体OMTS 3个候选基因,可能是所有编码功能性蛋白,其支持初始功能冗余。在三种基因型非常对比MT的表型,只vvaomt1和vvaomt.2在成熟葡萄果实中表达,无表达vvaomt.3被检测到。总表达vvaomt.(vvaomt1和vvaomt.2一起)与甲基化水平高度相关,而特异性表达vvaomt.2没有。我们可以这样假设vvaomt1是CIS.监管的vvmyba.基因,如usorges等。[17和Cutanda-Perez等[18[广泛决定甲基化花青素的水平。相反,vvaomt.2表达仅受轻微影响vvmyba.基因并显示出结构变化,影响花青素的甲基化:作为突变累积功能冗余减少。虽然变化等诸多因素可能花青素的甲基化参与,我们可以按照如下假设一个模型:vvaomt1是严格的功能约束下的花青素甲基化的基本异构,而且vvaomt.在甲基化花青素水平上的细微和特定差异是由较小的功能限制造成的(见拟议的模型图)6).
葡萄花青素甲基化的复合碱
以前对矮牵牛和葡萄的研究表明,不同的omt是造成这种差异的主要原因O -3'或5'位置的花青素的甲基化[42,43].相比之下,Hugueney等人。[11.发现了一种双功能AOMT催化3'和5'O -这表明AOMT单独就足以在葡萄浆果中完成这两个甲基化步骤。在本研究中,我们发现这两种蛋白质是由等位变异编码的vvaomt.2还能够执行体外CY 3-GLC和DP 3-GLC上的3'或3',5'甲基化,但另外,我们确定了两个与甲基化花青素水平的变异相关的SNP。我们表明,这种多态性导致基质特异性催化效率的变化,其仅影响DP 3-Glc甲基化进入Pt 3-Glc。差动3'O -由于蛋白质变异引起的三羟基化的花青素底物上的甲基化可以解释观察到的定量差异在足底,去除后的影响vvaomt1.此外,与前面描述的AOMT1和FAOMT比较[11.,12.表明,在本研究中表征的AOMT2变异体倾向于产生较低比例的Mv 3-glc,优先催化3'O -甲基化。事实上,这两个变体AOMT2合成了Mv 3- GLC(分别为8.1%和5.3%)的相同的低相对比例,而在类似的条件下,AOMT1是能够合成高达了Mv 3- GLC 34%[11.].最后,我们在不同葡萄品种中观察到,催化性质的变化和潜在的表达差异肯定能够创建复杂的甲基化花青素变异模式。
结论
这项工作的目的是通过组合遗传映射和功能研究来识别和量化控制葡萄中的葡萄蛋白甲基化变化的分子因素。关于葡萄中的花青素积累的最先前研究指出了主要的参与vvmyba.轨迹(16,18- - - - - -21,44].我们的发现证实了这个位点的作用,但我们在揭示花青素组成变异中涉及Myb型基因以外的新因素的影响方面迈出了重要的一步。我们定量评估了vvaomt.在花青素甲基化上的基因簇。此外,我们鉴定了从迄今为止所描述的其他Aoms催化性质的催化性质的蛋白质的新基因变体鉴定了蛋白质,显示出等位基因引导的底物特异性。本研究提高了我们关于甲基化的花青素水平的差异如何与总花青素含量无关的知识。由于部分功能冗余,这两个特征的相对独立性是可能的vvaomt.异原,其中vvaomt.2“逃脱”控制vvmyba..最后,在一个轻松的功能约束vvaomt.2,vvaomt1仍然在确保活性的持久性,可能会出现变异,产生新的表现型。
方法
植物材料
植物材料由三个群体组成:用于QTL映射的一个交叉级映射群和协会研究的两个嵌套自然群体。测绘群(SXG)是来自Syrah(S)克隆73之间的互殖交叉的191个个体的F1后代,并且如前所述在两个嵌段(a和b)中复制的grenache(g)的克隆516之间的克隆51620.].由Barnaud等人定义的农业形态学核心收集的50个彩色基因型[33选择以最佳地代表花青素甲基化水平的多样性。在这项研究中展示的所有基因组DNA分析都是在该系列中的50种彩色品种的集合中实现。在这50个基因型中,我们选择了32个个人的子集(在附加文件中列出2)通过m方法设计的[37,38]以优化花青素甲基化水平的可变性。所有转录组分析和基因测序的研究在这32亚核收集分别实现执行。每种基因型的成熟浆果转色期32天后收获。
特征分析
在2006年为SXG后代和2008年为彩色基因型和子芯收集,在2006年以相同的成熟度(20°Brix)收获葡萄浆果。如Founand等人所述分析样品的花青素组成。[45].花翠素的(DP)的浓度,矢车菊(CY),甲基花青素(PN),矮牵牛(Pt)和二甲花翠素(Mv)为衍生物,二甲翠雀素的毫克有人3-O -葡萄糖苷当量每克新鲜的浆果皮肤。计算甲基化水平甲基化(MT)作为甲基化/非甲基化花青素的比例。甲基化/非甲基化的比值是对数转换,以便不适合其分布。在SXG样品中,使用含有花青素(非白种品种)的个体的胞质的Shapiro-Wilks检验检查分布的正常性。将总花青素含量计算为LN(1 + x),其中×是所有花青素化合物的总和。HPLC数据和Subcore集合的MT变量在附加文件中呈现2.
DNA提取、基因分型和测序
为每个基因型收集两平方厘米(80-100毫克)的新鲜幼叶盘。使用Qiagen DNA植物迷你试剂盒(QIAGEN S.A.,COURTABOEUF,法国)提取DNA,具有少量修改,如ADAM-Blondon等人所述。(2004)。191个SXG后代已经进行了97个SSR标记的基因分型,以覆盖最小标记空间(最大10cm)的基因组,具有最佳的多态性(优先考虑为1:1:1:1:1:1分离标记)。对应于200bp插入/删除多态性(Indel)的附加标记vvaomt.2基因座启动子是基因分型。PCR条件为95℃,7分钟,35个循环为95℃(30秒),58℃(30秒),72℃(1分钟)和72℃的最终循环5分钟。将扩增的片段在1%琼脂糖凝胶上进行,用乙藻菊染色并在紫外光下拍摄。使用底漆3软件设计扩增引物,并列在附加文件中10..如Le CUNFF等人所述,扩增,测序和分析PCR片段。[46].
RNA提取,测序,实时荧光定量PCR
在转录组分析中,浆果在100到120 g/L的盐梯度上按密度进行分类,以确保所有样品的成熟阶段都是均匀的,并立即在液氮中冷冻。使用RNeasy Plant Mini Kit (QIAGEN S.A, Courtaboeuf,法国)按照制造商的协议从200 mg浆果粉中提取RNA,然后用Ribogreen(分子探针,Leiden,荷兰)进行定量。按照Fournier-Level等人的描述,从500ng纯化RNA的每个样本中进行3个重复的逆转录[20.].使用底漆3软件设计扩增引物,并列在附加文件中10..PCR片段的扩增、测序和分析如Le Cunff等[46].表达vvaomt.和vvaomt.测定了32个品种的甲基化花青素浆果含量。PCR方法如Fernandez等人所述[47通过将靶基因的循环阈值(CT)与其进行比较VvEF-1α基因用作内标。
框架遗传图谱和QTL检测
根据伪testcross策略构建框架遗传图谱[48使用Carthagene 0.999R软件[]49]如Fournier-Level等人所述。[20.]附加标记,对应于200bp Indelvvaomt.染色体1的2在SxG杂交中分离。对亲本和一致图谱进行QTL检测。使用MapQTL 4.0在共识图的A区和B区分别进行MT上的复合区间作图(CIM) [50]以及两个块用于使用多特征选项QTL Cartographer的父母映射[51].对于亲代图上的CIM,我们使用正向和向后回归方法进行辅助因子选择,0.1作为输入和输出阈值P-VALUE部分F检验的。然后,一个基因组扫描,用10厘米的窗口内的最大五个辅因子进行。对应于5%的试验误差率的阈值LOD然后通过1000个排列确定。对于CIM共识地图上,我们通过1000个置换为5%全基因组错误率确定的简单区间作图LOD阈值。99%和90%置信区间是通过使用R / QTL封装1000引导重采样来确定。
统计测试
使用R软件(R项目,USA)进行统计测试,以便在Shapiro-Wilks用于正常测试和Pearson的相关性测试。根据(1)在QTL间隔的存在下,在葡萄参考基因组序列中选择候选基因,并在QTL间隔和(2)与涉及花青素代谢中的基因的同源性。在高效混合模型关联方法之后使用r进行关联测试[34]使用沿19葡萄连杆组分散的20个SSR标记的亲属矩阵估计[52].对每个基因进行关联检验,以确定基于基因的高度关联多态性P- 值和调整r2利用亲缘关系矩阵作为方差-协方差矩阵来控制遗传背景“结构”效应的混合线性模型。
克隆vvaomt2.重组的表征vvaomt2.
全长cDNA的vvaomt.从两个品种(Petit Bouschet × Aramon n°4 (PB)和Papadiko (PK))成熟果实的cDNA中,用高保真Taq聚合酶(advantagehf - 2 PCR kit;克隆技术),使用上游引物5'-GTGGATCCTCTTCAACCATGTCCAGCTCAAGTCA-3'和下游引物5'- ttgcggccgcatagattaggctaatagaggcgc -3'。相应扩增的cdna命名为PK-AOMT2 (cv。和PB-OMT2 (cv。小Bouschet × Aramon n°4)。两种基因都被扩增vvaomt.将2克隆到PGEM-T易载体(Promega)中,并测序所得质粒以验证未引入突变。然后通过BamH1 / Not1酶消化重组质粒,并将所得限制片段连接到受BamH1 / Not1消化的PGEx-4 T-2重组载体(GE Healthcare)中。AOMT2蛋白质被表示为GST融合蛋白。使用PGEX教学手册后使用谷胱甘肽琼脂糖亲和树脂纯化重组蛋白。使用识别序列在PGEx质粒上的多个克隆位点立即位于突出的位点上游,然后通过SDS-PAGE定量(附加文件)(附加文件11.).然后检测PB-AOMT2和PK-AOMT2酶的活性体外使用花青素作为底物,存在s -腺苷- l-蛋氨酸(SAM),如Hugueney等人所述[11.].酶反应在30°C孵育1 h 30。为了对AOMT2进行表征,我们测试了三种独立的重组蛋白制剂,并对每种制剂进行了四种酶学分析。如前所述,用HPLC-DAD分析反应产物[45].根据其UV可见吸收光谱和保留时间鉴定花青素;使用用麦类3-葡糖苷的外部校准,量化基于520nm的峰面积。
加入数据
从本文的序列数据已经保藏,保藏号#HQ702997的EMBL / GenBank中的数据库(AOMT2从佩蒂特Bouschet×Aramon N°4)。从珀蒂Bouschet×Aramon序列Papadiko不同N°4在两个SNP(T127至C和A388到T)。
参考资料
- 1。
1992年以来类黄酮研究进展。植物化学。2000,55(6):481-504。10.1016 / s0031 - 9422(00) 00235 - 1。
- 2.
Winkel BSJ:植物中的代谢窜。Annu Rev植物Biol。2004,55:85-107。10.1146 / annurev.arplant.55.031903.141714。
- 3.
Vidal S, Francis L, Williams P, Kwiatkowski M, Gawel R, Cheynier W, Waters E:在葡萄酒中多糖和花青素的口感特性。食品化学。2004,85(4):519-525。10.1016 / s0308 - 8146(03) 00084 - 0。
- 4.
陈志强,陈志强,陈志强,等。葡萄花青素降解机理的研究进展。农业科学学报,2011,29(3):457 - 461。10.1002 / jsfa.2740690317。
- 5.
3 .陈志强,陈志强:花青素色素的化学性质。紫外可见分光光度法测定芹菜素及3种相关的3-脱氧黄酮盐的酸度常数。化学学报,2003,23(4):591 - 598。10.1021 / ja00390a033。
- 6.
摇摆o,锡塔岛,芳香r:花青素内的分子内切断效果。植物化学。1993,34(1):119-124。10.1016 / S0031-9422(00)90792-1。
- 7.
陈志强,陈志强。花色苷生物合成的遗传与生物化学。acta botanica sinica(云南植物学报),2012,30(4):457 - 461。
- 8.
摩尔Ĵ,Grotewold E,Koes R:基因如何画花。植物生物技术在体外生物学杂志21世纪。1999年,36:597-600。10.1007 / 978-94-011-4661-6_134。
- 9.
Boss PK, Davies C, Robinson SP:红葡萄和白葡萄花青素生物合成途径基因的表达。acta botanica sinica, 2010, 32(3): 565-569。10.1007 / BF00019111。
- 10。
C:葡萄类黄酮和二苯乙烯生物合成相关结构基因的克隆和分子分析(葡萄,葡萄l)。植物mol biol。1994年,24(5):743-755。10.1007 / bf00029856。
- 11.
Hugueney P,Provenzano S,Verries C,Ferrandino A,Meudec E,Batelli G,Merdinoglu D,Cheynier V,Schubert A,致力于A:一种新的粘合剂依赖于葡萄酰甲基化的甲基甲基转移酶。植物理性。2009,150(4):2057-2070。10.1104 / pp.109.140376。
- 12.
葡萄品种的特性分析。赤霞珠3',5'- o -甲基转移酶对花青素和糖基化黄酮醇表现出强烈的偏好。植物化学学报。2010,71(13):1474-1484。10.1016 / j.phytochem.2010.05.027。
- 13.
C:巨峰葡萄myb相关基因(葡萄属labruscana)调控花青素的生物合成。植物学报。2002,215(6):924-933。10.1007 / s00425 - 002 - 0830 - 5。
- 14.
Koes R,VERWEIJ W,Quattrocchio F:类黄酮:生化途径的监管和发展丰富多彩的模型。趋势植物科学。2005年,10(5):236-242。10.1016 / j.tplants.2005.03.002。
- 15.
MYB-bHLH-WD40蛋白复合物与细胞多样性的进化。植物科学进展,2005,10(2):63-70。10.1016 / j.tplants.2004.12.011。
- 16.
Walker Ar,Lee E,Bogs J,McDavid Daj,Thomas Mr,Robinson SP:白葡萄通过两个类似和相邻的监管基因的突变来源。工厂J. 2007,49(5):772-785。10.1111 / J.1365-313x.2006.02997.x。
- 17.
agorges A, Fernandez L, Vialet S, Merdinoglu D, Terrier N, Romieu C:花青素代谢途径的四个特定同基因系统地与葡萄浆果的红色共同表达。植物学报,2006,170(2):372-383。10.1016 / j.plantsci.2005.09.007。
- 18.
Cutanda-Perez MC, Ageorges A, Gomez C, Vialet S, Terrier N, Romieu C, Torregrosa L:异位表达VlmybA1在葡萄树中,激活涉及花青素合成和运输的狭窄基因。植物mol biol。2009,69(6):633-648。10.1007 / s11103-008-9446-x。
- 19.
小林S,后藤山本N,Hirochika H:协会VvmybA1在葡萄中具有花青素的基因表达(葡萄)肤色突变体。中国科学(d辑:地球科学),2005,74(3):196-203。10.2503 / jjshs.74.196。
- 20.
Fournier-Level A,Le Cunff L,Gomez C,Doligez A,useorges A,Roux C,Bertrand Y,Souquet JM,Cheynier v,这个P:葡萄的花青素变异的定量遗传基因(葡萄L. SSP Sativa)浆果:定量性状核苷酸综合研究的定量性状轨迹。遗传学。2009,183(3):1127-1139。10.1534 / genetics.109.103929。
- 21.
这个P, Lacombe T, Cadle-Davidson M, Owens CL:葡萄酒葡萄(葡萄颜色与驯化基因的等位变异有关VvmybA1.应用电子学报。2007,14(4):723-730。10.1007 / s00122 - 006 - 0472 - 2。
- 22。
Downey MO, Dokoozlian NK, Krstic MP:文化实践和环境对葡萄和葡萄酒类黄酮成分的影响:最近的研究综述。中国生物医学工程学报。2006,27(3):257-268。
- 23。
王志强,王志强,王志强,等:水分亏缺对施拉子果实生长发育过程中原花青素和花青素积累的影响。葡萄酒业,2011,17(1):90-100。10.1111 / j.1755-0238.2010.00121.x。
- 24.
Mazza G:葡萄和葡萄制品中的花青素。中国食品科学,1995,35(4):341-371。10.1080 / 10408399509527704。
- 25.
Pomar F, Novo M, Masa A:用高效液相色谱法研究50个红鲜食葡萄品种花色苷谱的差异。中国有色金属学报,2003,22(1):34-41。10.1016 / j.chroma.2005.07.096。
- 26.
Mattivi F,Guzzon R,Vrhovsek U,Stefanini M,Velasco R:葡萄的代谢物分析:黄酮醇和花青素。JAgric Food Chem。2006,54(20):7692-7702。10.1021 / JF061538C。
- 27.
Roggero JP,Larice JL,Rocheville-Pimorne C,Archier P,Coens S:组成Anthocyanique DesCépages:Essai De Classification Par分析En Composantes Principles Et Par分析因子isciminante。RFOE CAHIERS SCIENCIQUES。1988,112:41-48。
- 28.
Castellarin SD,狄Gaspero G,马可尼R,Nonis酒店的A,Peterlunger E,PAILLARD S,亚当-Blondon AF,Testolin R:红色葡萄藤颜色变化(葡萄L.):浆果皮中以红花青素/蓝飞燕花素为基础的花色苷的基因组组织、类黄酮3'-羟化酶、类黄酮3'、5'-羟化酶基因的表达及相关代谢谱。生物医学工程学报。2006,7:
- 29.
郑正涛,Goto-Yamamoto N, Hashizume K, Esaka M:葡萄中类黄酮3'-羟化酶和类黄酮3',5'-羟化酶基因的表达及类黄酮组成(葡萄).植物SCI。2006,170(1):61-69。10.1016 / J.Plantsci.2005.07.025。
- 30.
Castellarin SD,Pfeiffer A,Sivilotti P,Degan M,Peterlunger E,DI Gaspero G:季节性水缺损下葡萄树葡萄树果实中的花青素生物合成的转录调控。植物细胞环境。2007,30(11):1381-1399。10.1111 / J.1365-3040.2007.01716.x。
- 31.
雅永O,Aury JM,诺尔B,Policriti A,Clepet C,卡萨格兰德A,Choisne N,Aubourg S,Vitulo N,Jubin C,等人:该葡萄基因组序列表明在主要被子植物门类祖hexaploidization。自然。2007年,449(7161):463-U465。10.1038 / nature06148。
- 32.
Velasco R, Zharkikh A, Troggio M, Cartwright DA, Cestaro A, Pruss D, Pindo M, FitzGerald LM, Vezzulli S, Reid J,等:一个杂合子葡萄品种基因组的高质量共识draft sequence。公共科学学报。2007,2 (12):e1326-10.1371/journal. pon.0001326。
- 33.
葡萄栽培中的连锁不平衡,葡萄王志强,王志强。基于遗传算法的计算机辅助设计[j] .计算机工程与应用,2006,32(4):441 - 446。10.1007 / s00122 - 005 - 0174 - 1。
- 34。
康慧敏,蔡立伦,王志强,王志强,王志强:模式生物关联图谱中种群结构的有效控制。中国生物医学工程学报。2008,27(3):427 - 434。10.1534 / genetics.107.080101。
- 35。
McMullen MD,Byrne PF,Snook Me,Wiseman Br,Lee Ea,Widstrom NW,Coe EH:定量特质基因座和代谢途径。美国国家科学院的诉讼程序。1998,95(5):1996-2000。10.1073 / pnas.95.5.1996。
- 36.
普拉S,Cocciolone SM,布什曼S,桑加雷V,McMullen的MD,彼得森T:对于orange1玉米不稳定因素是组织果皮颜色1的特异性沉默等位基因的显性后生改性剂。遗传学。2003年,163(3):1135至1146年。
- 37.
Gouesnard B, Bataillon TM,解不开G, Rozale C, Schoen DJ, David JL: MSTRAT:一种通过最大化等位基因或表型丰富度来构建种质核心收集的算法。王志强,王志强,王志强,等。10.1093 / jhered / 92.1.93。
- 38.
Schoen DJ,Brown Ahd:通过评估遗传标记,辅助野生作物亲属的等位基因丰富的保护。美国国家科学院的诉讼程序。1993,90(22):10623-10627。10.1073 / pnas.90.22.10623。
- 39.
Boss PK, Davies C, Robinson SP:花色苷途径基因在发育中的表达分析葡萄L CV Shiraz葡萄浆果和途径调节的影响。植物理性。1996,111(4):1059-1066。
- 40。
Castellarin SD, Di Gaspero G:花色苷生物合成基因在自然发生的葡萄浆果着色的极端表型的转录控制。生物谷bioon . 2007, 7:
- 41。
Des Marais DL,Rausher MD:在花青素途径基因中复制后从自适应冲突中逃脱。自然。2008,454(7205):762-U785。
- 42。
Bailly C,Cormier F,DO CB:S-腺苷-1-蛋氨酸的表征和活性:Cyanidin 3-葡糖苷3'-O-甲基转移酶与血糖血管细胞悬浮培养的花青素积累有关。植物SCI。1997,122:81-89。10.1016 / s0168-9452(96)04545-1。
- 43.
韦氏培养的P:培养的P:培养皿杂交菌中的糖基化和甲基化模式。II。基因MR1和MF2。pflanzenzucht。1977年,78:113-123。
- 44.
Lijavetzky D,Ruiz-Garcia L,Cabezas Ja,De Andres Mt,Bravo G,Ibanez A,Carreno J,Cabello F,Ibanez J,Martinez-Zapater JM:浆果颜色变化的分子遗传学桌葡萄。Mol Genet基因组学。2006,276(5):427-435。10.1007 / s00438-006-0149-1。
- 45.
Fournand D,Vicens A,SiDhoum L,Souquet JM,Moutounet M,Cheynier V:葡萄皮肤单宁和葡萄粘蛋白在不同先进生理阶段的积累和萃取性。JAgric Food Chem。2006,54(19):7331-7338。10.1021 / JF061467H。
- 46。
Le Cunff L,Fournier-Level A,Laucou V,Vezhulli S,Lacombe T,Adam-Blondon AF,Boursiquot JM,这个P:嵌套遗传核心系列的构建,以优化自然多样性的开发葡萄L.亚种水稻。BMC植物生物学。2008年,8:
- 47。
费尔南德斯L,Torregrosa L,梗N,Sreekantan L,GrimpletĴ,戴维斯C,托马斯MR,Romieu C,Ageorges答:葡萄果实发育过程中与肉形态发生相关的基因的鉴定。植物mol biol。2007年,63(3):307-323。10.1007 / s11103-006-9090-2。
- 48.
Grattapaglia D,Bertolucci Flg,Penchel R,Sederoff Rr:使用母亲半SIB系列和RAPD标记的桉树祖先控制成长和木材品质性状的遗传映射。遗传学。1996,144(3):1205-1214。
- 49.
引用本文:王志强,王志强,王志强,等。CAR(H)(T)基因:多种群综合遗传和辐射杂交定位。生物信息学。2005,21(8):1703-1704。10.1093 /生物信息学/ bti222。
- 50。
自花授粉物种数量性状位点定位的准确性。中国科学(d辑):地球科学(英文版)。
- 51。
Basten CJ, Weir BS, Zeng ZB: QTL制图员。编辑:Statistics Do. 2001,北卡罗来纳州立大学,罗利
- 52。
拉康姆猪T, Boursiquot JM, Laucou V, Dechesne F, var D P:相关关系和遗传多样性在到达瓦举行Domaine de奴隶葡萄种质资源库。中国生物医学工程学报。2007,31(1):124-131。
确认
我们特别感谢Yves Bertrand、Patrick Ortigosa、Marc Farnos和Michel Grolier (INRA蒙彼利埃)的技术人员,以及Vassal葡萄种植庄园的工作人员。我们还要感谢Sandrine Vialet (INRA Montpellier)在定量RT-PCR分析中的出色支持,Cecile Morel和Jean-Marc Souquet进行了HPLC分析。我们感谢Peter Beyer(德国弗莱堡应用生物科学中心)使用了他的实验室设施。最后,我们感谢Véronique Cheynier(蒙彼利埃研究所)和Loic Le Cunff(蒙彼利埃研究所)对手稿的批判性阅读,以及Jonathan Wang对英文的编辑。
这项工作是财务部分由欧洲项目计划FLAVO 2005-51396支持,由法国Genoplante项目,COREGRAPGEN(Trilat 017),由INRA和朗格多克 - 鲁西荣地区。
作者信息
从属关系
相应的作者
附加信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
AFL和AA写了稿件。AFL,AA,PT和PH设计了这项研究。AFL,AA,CV和pH进行实验。PT和pH修订了手稿。所有作者均阅读并批准最终手稿。所有作者宣布没有利益冲突。
电子辅料
12870_2011_962_moesm1_esm.bmp.
附加文件1:描述SxG后代花青素概况的统计摘要。花青素含量以每克新鲜浆果皮中苷元花青素的mg表示。关键:最小,最小;曲,分位数;马克斯,最大值。(BMP 303 KB)
12870 _2011_962_moesm2_esm.pdf
附加文件2:Core-coll 32 cv中VvMybA、VvAOMT和VvAOMT2的花青素含量和表达谱。花青素含量以每克新鲜皮肤的花青素mg表示,VvMybA、VvAOMT和VvAOMT2表达谱为—2ΔCt。(PDF 164 KB)
12870 _2011_962_moesm3_esm.bmp
附加文件3:在嵌段B中测量的SXG后代两种等位基因之间的MT变化的比较。Syrah父母是纯合的VVVOMT2的等位基因,而GRENACHE父母与“弱”和“强烈”是杂合的“等位基因组合。(BMP 801 KB)
12870 _2011_962_moesm4_esm.pdf
附加文件4:来自NCBI Vitis EST数据库的unigene列表,在1.05 Mbp的位置围绕LG1上QTL的最大LOD位置。(PDF 81 KB)
12870_2011_962_MOESM5_ESM.PDF
附加文件5:AOMT1,AOMT2和AOMT3氨基酸序列的比较。使用与VVAOMT1序列相同的离子W对准氨基酸序列。(PDF 15 KB)
12870 _2011_962_moesm6_esm.bmp
附加文件6:在两个(A)基因组DNA和(B)编码DNA AOMT,AOMT2和AOMT3的特异性扩增。(A)扩增基因组DNA上(栽培品种西拉)。(B)对扩增的CV的cDNA。Joubertin(1; 2; 3),CV。Molinara(4; 5; 6)和CV。微型Bouschet(7; 8; 9)的成熟AOMT的浆果(1; 4; 7),AOMT2(2; 5; 8)和AOMT3(3; 6; 9)。(BMP 929 KB)
12870_2011_962_moesm7_esm.bmp.
附加文件7:在VvAOMT1和VvAOMT2基因50 Cv的集合之间的多态性连锁不平衡。R2被报告在从独立卡方检验报告的上对角线的下对角和P-VAL。(BMP 3 MB)
12870 _2011_962_moesm8_esm.pdf
附加文件8:毛状根(对照和VlmybA1-2转化)中AOMT(黑色)和AOMT2(灰色)的实时定量PCR表达谱。所有数据均为两个(对照)和四个(VlmybA1-2转换)独立直线上三个重复的平均值(±SD)。表达值与vvef1进行归一化,并以相对丰度来表达。(PDF 14 KB)
12870_2011_962_moesm9_esm.pdf.
附加文件9:VVAOMT2 cDNA中的多态性。SNP的名称对应于IUB代码中的突变的性质,然后是编码序列上的位置。非同义突变以红色箭头呈现,用红色箭头,3'UTR非编码序列中的突变用虚线箭头呈现,并没有以右尺度报告。(PDF 16 KB)
12870 _2011_962_moesm10_esm.doc
附加文件10:用于实时PCR的PCR引物和扩增片段的预期尺寸。关键:GDNA(基因组DNA);cDNA(编码DNA)。(Doc 24 KB)
12870 _2011_962_moesm11_esm.bmp
附加文件11:重组aomt的SDS-PAGE。Papadiko (PK-AOMT)和简历。小Bouschet × Aramon n°4 (PB-AOMT)。Lanes:(1)蛋白大小标记;(2)经GST裂解纯化的PK-AOMT。(3)经GST裂解纯化的PB-AOMT。标记的分子量用kDa表示。(BMP 352 KB)
作者为图像提交的原始文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
四分之一,A.,Hugueney,P.,Verriès,C.等等。葡萄中花青素甲基化水平的遗传机制(葡萄L.)。BMC植物杂志11,179(2011)。https://doi.org/10.1186/1471-2229-11-179
收到了:
接受:
发表:
关键词
- 毛状根
- 花青素含量
- 花青素生物合成
- 花青素积累
- 葡萄果皮