抽象的
背景
在紫黄质(V)循环中,当强光或光与其他胁迫源结合导致光系统过度兴奋时,V被去环氧化为玉米黄质(Z)。然而,植物在黑暗中也会遭受压力,最近的报道表明,在没有光照的情况下,脱水会触发v -去环氧化反应。在本研究中,我们使用了高耐受性的褐藻Pelvetia canaliculata作为模式生物,由于其缺乏叶黄素,其非光化学猝灭不依赖于转运体-ΔpH,以研究非生物胁迫源诱导的黑暗中触发v循环。
结果
我们已经表明,除了干燥之外,其他因素如浸渍,缺氧和高温也会在黑暗中诱导V-脱氧。一旦治疗停止(除热量外,导致致命损伤除外),该过程是可逆的。不管施加压力源,所得的脱氧叶绿素与FV / FM的降低相关,表明光合作用效率下调的常见功能。还研究了塑料醌池的氧化还原状态和V-循环酶对黑暗中V-脱氧的差异活性的含义。目前的结果表明,即使在黑暗中,紫杉素脱氧酶(VDE)和Zeaxanthin-环氧酶(ZE)也具有基础组成型活性,抑制ZE在应力下抑制。该抑制导致Z累积。
结论
本研究表明,V-cycle活动是由几种非生物胁迫源触发的,即使它们发生在绝对缺乏光的情况下,也会导致Fv/Fm下降。这一发现为深入理解v循环的调控机制及其生理生态作用提供了新的思路。
背景
紫黄质(V)循环,在植物和绿色和棕色藻类中被描述(Müller et al. 2001),由V在光驱动下的脱环氧化形成antheraxanthin (A),然后玉米黄质(Z),然后在黑暗中环氧化回V。第一个反应是由紫黄质深氧化酶(VDE)催化的,这种酶的激活需要由光合作用质子泵产生的酸性pH值[1].V到A + Z的脱环氧化增强和调节了过剩激发能的热耗散率[2].这个过程发生的生物物理机制仍然是一个有争议的问题[3.-7.].可以通过叶绿素的降低来监测该过程一种荧光产率,所谓的非光化学淬火(NPQ)。虽然光已经被认为是在研究的所有生物中激活VDE的必要条件,但是用非天然系统进行的研究表明,可能的是在黑暗中的V去脱氧的人工诱导。在莴苣的分离的类囊体中,已经显示了由外部ATP耗材介导的叶绿素荧光的Z依赖性猝灭的暗诱导[8.].在拟南芥突变体缺乏叶绿体NAD激酶,在黑暗中观察到高水平的Z积累[9.].最近,在自然的、冷适应的橡树叶中观察到Z在黑暗中的积累[10],而已有几篇论文证实,在自然条件下可以通过干燥诱导V的脱环氧化[11那12,而不考虑光合组织的光照。
在绿藻和植物中,除了A + Z的存在外,还需要一个反式囊体质子梯度(ΔpH)来获得最高的NPQ [2].然而,在褐藻中,NPQ的产生完全依赖于v循环的运行,而酸性pH值只需要激活VDE [13].NPQ对Z和缺乏叶黄素的直接依赖性,另一个助成NPQ的类胡萝卜素[14[大大促进了V-循环的功能和操作的研究,成为这种研究中的棕色藻类优秀的模型物种。
在褐色海藻,Pelvetia canaliculata是最耐压的物种之一。它在上面的海岸上形成了最高的带子Fucus spiralis.而且非常耐干燥,能在离开水的情况下存活7天以上[15,水分流失高达96% [16].这种物种的独特干燥耐受能力似乎依赖于内生真菌的共生:球腔菌属acophylli(子囊菌)17].但除了脱水之外,跨思维藻类的偏振与其他压力源有关,例如可能损害其组织的高温[18].强光也是透藻必须处理的压力因素。最近的一篇论文报告说p . canaliculata基于一种有效的类胡萝卜素成分,它们能很快适应高辐射[19].此外,高v循环池的大小p . canaliculata似乎与它对非生物压力的强耐受性有关[20.].
由于越来越多的证据支持V-cycle在某些环境条件下的暗运行,但其生理作用和调节尚不清楚,p . canaliculata作为模式种,为进一步研究该机制提供了依据。具体来说,我们已经确定了除了光之外的环境因素是否会触发V-cycle的激活。三个环境因素这一高度耐压力的物种最终相遇在其寿命研究了在缺乏光线:干燥,当菌体暴露在空气中很长一段时间,和supraoptimal温度和缺氧,发生在低潮时氧气耗尽的潮间带小池。本工作的第二个目的是验证VDE在黑暗中激活后形成的A + Z池是否与高辐照度产生的A + Z池一样参与光化学效率的调节。本文的目的不仅在于了解这一保护机制,还在于更深入地探讨v循环的功能和环境作用。
方法
植物材料
Pelvetia canaliculata(l)Decn。是一种分布在北半球寒冷海岸的褐藻科海藻。成年菌体采自西班牙北部海岸。在进行任何分析之前,将样本用浸过海水的组织覆盖,并在室温和100%相对湿度(RH)的黑暗环境中保存12小时,以使v循环放松。在所有的实验中,都使用了菌体的最后一个顶端分叉,因为这是最活跃的部分,也是最直接暴露于干燥的部分。
实验治疗
将上述收集的菌体暴露于以下不同的试验处理:
•照明
用海水浸湿的组织上的样品直接暴露在阳光下(光子通量密度- pfd -为1500µmol m-2年代-1),浸泡15或60分钟,然后用海水继续浸泡,以免干燥。光照处理后,菌体在黑暗中保持湿润(以便V-cycle再环氧化)60分钟。
•干燥
将样品在黑暗中孵育24小时,含有NaCl饱和溶液(75%相对湿度-RH-)。通过直接溢出沉降的海水开始再水水。然后将样品保持在用海水和100%Rh湿的组织上,以允许恢复。
•预光照的菌体干燥
将分叶菌体置于阳光下15分钟,将其中的一个分枝用铝箔覆盖,然后放入密闭室中进行如上所述的干燥处理。
•高温
在23小时期间,在32℃下在黑暗中在黑暗中孵育Thalli,然后作为恢复将其转移至17℃。为了避免干燥,将Thalli置于用海水的组织和100%RH的受控气氛中。作为对照,将第二组样品保持在17℃和100%RH的黑暗中。
•浸
将菌体放入2ml体积的小瓶中,黑暗中浸泡10和24小时。
•厌氧
菌体在黑暗中培养1、6和17 h,在密闭的真空容器中用N2气体。作为对照,一些样品保存在含有空气的真空容器中。处理后,将样品置于开放真空容器中培养4 h,使组织再充氧。在孵育期间,所有的样本都被海水浸湿的组织覆盖,以避免脱水。
代谢抑制剂
由于V的脱氧化载体所需的ETC载流子的质子泵送产生的腔的酸化是v的,因此v的脱氧所需的是影响V-循环酶的活性,转化术(Transthylaidal pH或氧化还原)的一组抑制剂PQ池的状态,在暗中被干燥的样品中渗透(如上所述)。Thalli用不同浓度的代谢抑制剂渗透溶解在海水中用1%乙醇溶解,以促进稀释。对于渗透,将Thalli置于含有5ml抑制剂溶液的空气温度器中。通过用50mL注射器除去空气5次,研发真空。渗透后,将样品温育在溶液中1小时。在相同的渗透方案之后,用海水和1%乙醇处理对照。在抑制剂处理后,如上所述或维持水合的样品。使用以下抑制剂(来自Sigma-Aldrich,Spain)的抑制剂:
•二硫苏糖醇(DTT)
抑制酶VDE [21].它以5mm的浓度施用。
•Salicyl-adoxime (SA)
抑制ZE活动[22].它以5mm的浓度施用。
•氯化铵(NH4.Cl)
解耦跨囊体-ΔpH [13通过将H +隔离在腔内。其浓度为100 mM。
•2、5-Dibromo-6-isopropyl-3-methyl-1 4-benzoquinone (DBMIB)
通过居住在Q中避免PQ的氧化0.细胞色素B6F复合体的遗址[23].它以25μm的浓度施用。
•二氯苯基二甲基脲(DCMU)
通过阻挡来自PS II的电子流动来避免降低PQ [24].以10 μ M。
•正丙酯(N-PG)
阻断酶质体末端氧化酶(PTOX)介导的PQ氯呼吸氧化[25].其浓度为1 mM。
•远红(FR)
被调制的光λ在FR处理的菌体全部干燥过程中,使用带有FR过滤器的卤素灯提供的>700 nm,以维持PQ由于PS I的诱导而被氧化。
叶绿素一种荧光分析
叶绿素荧光的一种使用成像荧光计(Handy FluorCam, p.s.i.,捷克布尔诺,http://www.psi.cz),详情见[26].每次处理前和处理后立即在菌体中捕捉光化学效率的图像,菌体之前至少适应黑暗5分钟。高灵敏度电荷耦合装置相机检测荧光,产生12位分辨率的图像。该仪器由FluorCam软件包(FluorCam 7)驱动0.,使用超亮发光二极管(led)提供的非光化测量闪光进行测定。接下来,800ms的饱和光辐射脉冲(2000 μ mol光子m-2年代-1由卤素灯产生的)被给予测量最大荧光水平Fm。将光照II(FV / FM)的最大光化学效率计算为(FM-F.0.) / Fm。Fv/Fm的像素值图像显示为假颜色代码,范围从蓝色(0.1)到绿色和黄色到红色(0.9)。计算每个像素的Fv/Fm,然后平均每个样本的总面积。NPQ没有被测量,因为与干燥相关的体积收缩阻碍了可比Fm(参考Fm’)和Fm’(实际Fm’)的获得。因此,与持续热耗散相关的Fv/Fm的下降被用作NPQ的代理。
色谱分析
对于颜料分析,立即在液体中冷冻样品2保存至-80°C。冷冻样品用组织撕裂器或均质器(型号395,Dremel,墨西哥)在纯丙酮溶液中用碳酸钙缓冲3..提取液16100 g离心20 min,上清液用0.2 mm PTFE过滤器(Teknokroma, Spain)过滤。色谱柱为反相C18色谱柱(Waters Spherisorb ODS1, 4.6 × 250 mm,美国马萨诸塞州),色谱方法为[27],[28].在HPLC处理过程中,样品在冷藏室中保持在4ºC。采用光电二极管阵列(PDA)检测器进行识别和定量。颜料的保留时间和转化率与[27那28以(A + Z)/(V + A + Z)的比值估计叶黄素循环色素的相对脱环氧状态,用简写AZ/VAZ表示。
统计数据
单向ANOVA用于测试ChoChran测试后响应光,干燥,浸入和缺氧治疗的AZ / VAZ和FV / FM值的差异,以检查差异的均匀性。进行了邓肯后HOC测试以区分不同的时间和治疗。必要时,数据是对数转换的。曼恩惠特尼你对非正态数据进行检验。采用线性回归分析AZ/VAZ与Fv/Fm的关系。计算p-值、系数和回归线在α = 0.05显著时显示在图上。所有分析均使用SPSS 17.0软件包进行。
结果
在照明时进行v循环操作Pelvetia canaliculata
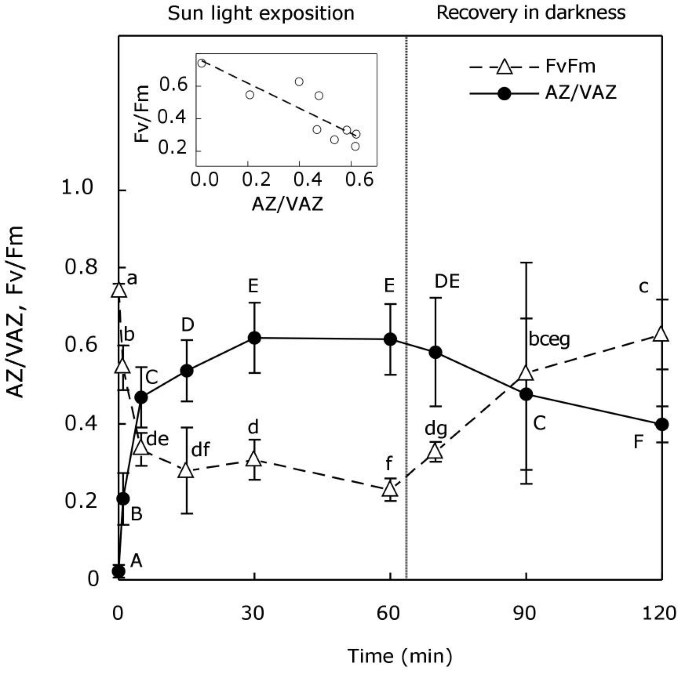
确定了光诱导紫黄质循环(v循环)的一般操作p . canaliculata.当暴露在阳光下时,紫黄质(V)被迅速地去环氧化为蒽黄质(A)和玉米黄质(Z),这是VAZ池在30分钟内转化为A + Z的60%(图)1).在黑暗中,Z和A被缓慢地重新环氧化成V,结束了这个循环。在整个过程中,Fv/Fm与AZ/VAZ呈反比,当AZ/VAZ几乎为零时,Fv/Fm达到最大值。两个参数(Fv/Fm和AZ/VAZ)均呈负相关(见图中插入)1).
V-cycle和脱水
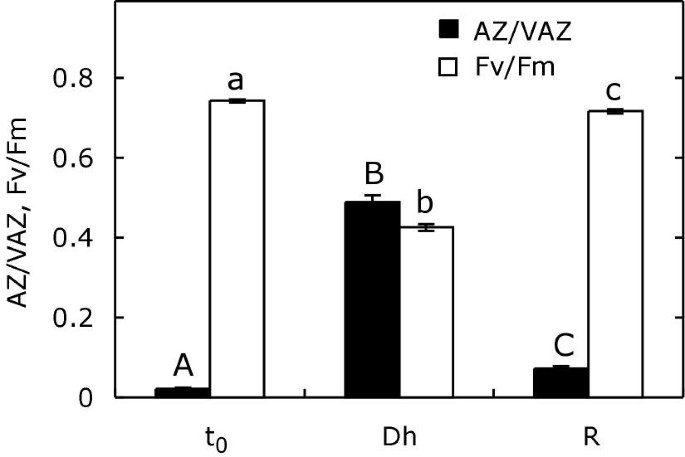
在灯光下验证其常规活动后,V-Cycle操作p . canaliculata在无光条件下进行脱水-再水化处理(图2),如材料和方法部分所述。在脱水过程中,尽管黑暗,v脱氧为+ Z,并且在用海水再水化后发生反应。如在光实验期间观察到的(图1), Fv/Fm值最低时,AZ/VAZ水平最高(图)2).
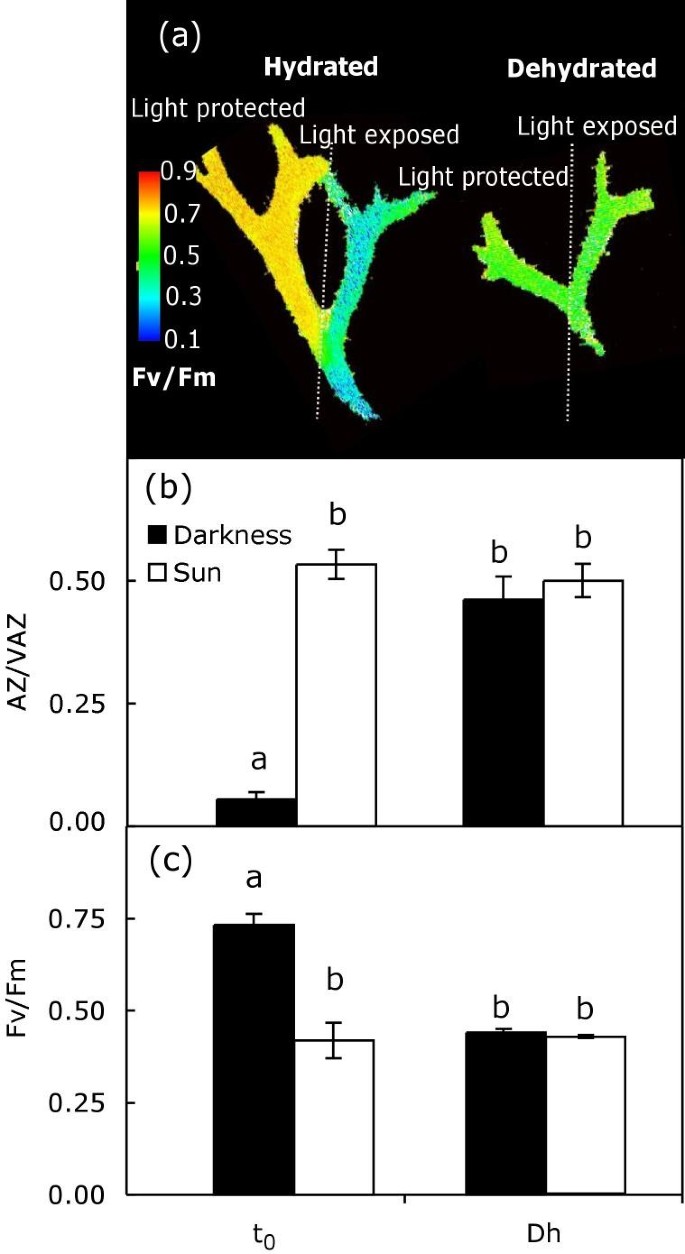
为了验证在脱水过程中生成的A + Z是否与在光照条件下合成的A + Z具有不同的作用,进行了一项新的试验,比较了它们对Fv/Fm的影响。为此目的,样本p . canaliculata在阳光下暴露15分钟,每个菌体的一半被保护起来(用铝箔)。在这种光/暗预处理之后,所有的样品在没有光的情况下脱水,如上所述。菌体光照使AZ/VAZ比值增加到0.53±0.03。脱水后,在预先照明的样品中,该指数保持不变(0.50±0.03)(图3 b而在未预光照的菌体中,同样增加(0.46±0.05)3 b,关闭酒吧)。需要指出的是,前者的A + Z是由光诱导的,而后者是在黑暗脱水过程中产生的。Fv/Fm反映了v循环中去环氧化指数的变化(图)3 c):在实验开始时,适应黑暗的菌体的Fv/Fm显著高于预光照的菌体,但在脱水过程中,Fv/Fm显著降低,达到与预光照菌体相同的值(图)3 a, c).
中冬温度
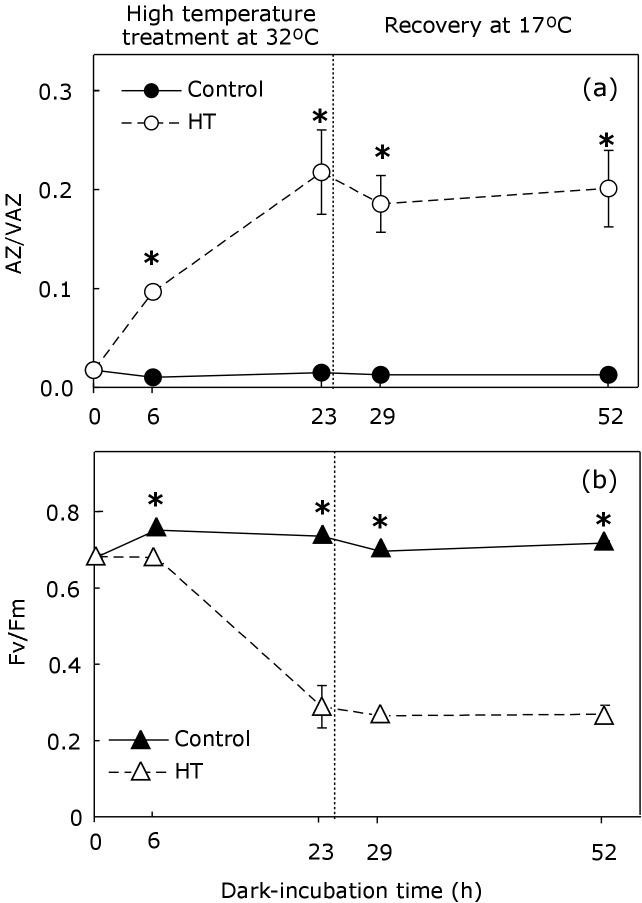
在32°C的黑暗中孵育的含量高温对V-循环的影响(图4.).在孵育6 h后,热处理样品的AZ/VAZ比值显著增加,在23 h时进一步增加(图)4).与此同时,Fv/Fm在整个孵育过程中不断下降,直到达到0.2左右(图1)4 b).与观察到干燥(图2),治疗样品的返回控制条件(17°C)并未反转AZ / VAZ的初始值,也不是FV / FM的初始值。
V-cycle和缺氧
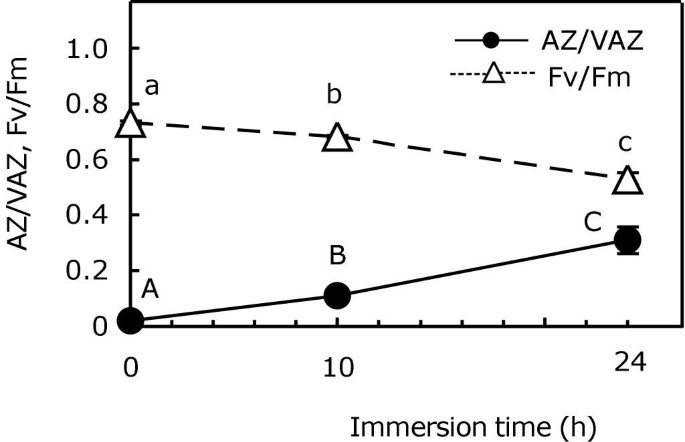
作为一种生长在海岸高处的潮间带、耐干燥的藻类,它已被证明长时间、频繁的浸泡是有害的p . canaliculata.在黑暗中长时间浸入24小时时监测V-循环的活性(图5.).令人惊讶的是,尽管没有光,但在浸渍10小时后,v在10小时后将乙氧化酶脱氧。在忽略由于呼吸导致的水(未显示的数据)的pH值(数据未显示)的可能性之后,作为在浸渍过程中诱导V-循环去环氧化的因素,分别测试缺氧条件的影响。
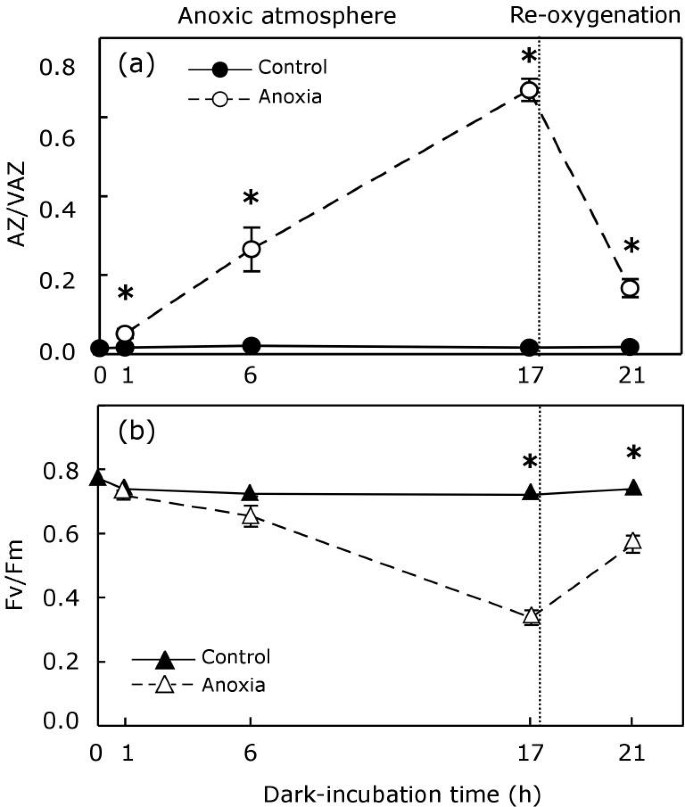
用用海水浸湿的组织覆盖的样品在一个N2- ATM(缺氧气氛),而对照组以同样的方式孵育,但在空气气氛中。缺氧培养诱导v型循环的去环氧化(图6).在这些条件下,1小时就足以引起AZ/VAZ比值轻微但显著的增加。在6 h后,它变成了对照的12倍,在17 h孵育后,AZ/VAZ增加到高辐照下达到的范围(对比图)6和图1).以平行的方式与AZ / VAZ的增加,FV / FM经历逐渐减少,在17小时后2-atm,与在控件中发生的情况有显著不同(图6 b).孵育17小时后,将处理过的样品转移到空气中,使菌体重新充氧。在空气中静置4 h后,v循环的脱环氧还原,AZ/VAZ降至0.2以下(图2)6), Fv/Fm恢复相当,但仍低于控制值。
阵线/ Fm和V-cycle
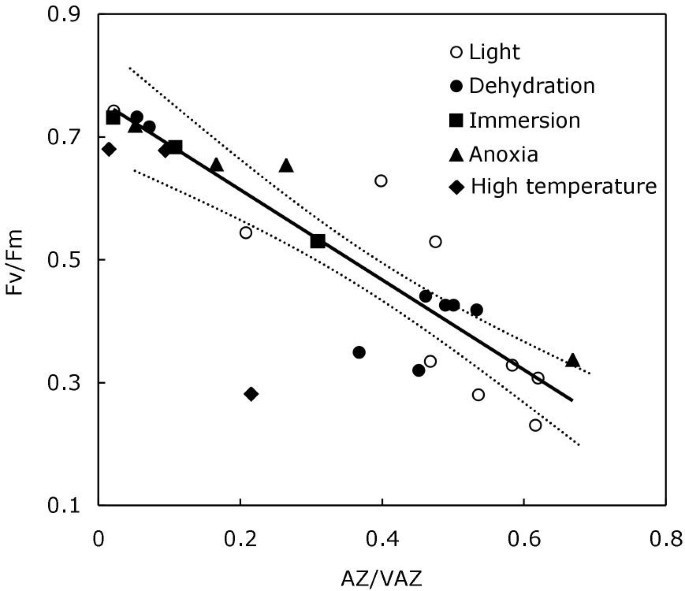
测试AZ / VAZ和FV / FM之间的关系,用于所有治疗(高光,深脱水,深浸,深缺氧和深温孵育)以验证在黑暗中形成的A + Z是否相同作为图中所示的回归1插入或不阐明,如果情况下,该A + Z在光线下形成的+ Z的作用相同。如图所示7.,无论治疗如何,V的去环氧化与Thalli的FV / FM高度相关p . canaliculata(皮尔森相关系数;r= 0.906;和r当包括高温处理数据时= 0.855)。此外,AZ / VAZ和FV / FM之间存在强有力的关系(图7.;线性回归模型,r2= 0.833,P.< 0.001;和r2= 0.731,P.包括来自高温处理的数据时<0.01)。
揭示黑暗中v循环激活的共同机制
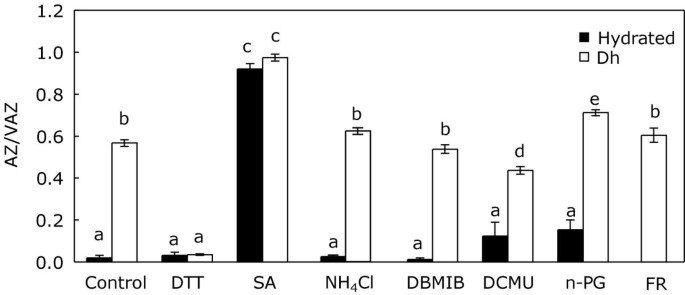
试图更深入地看待生物化学机制,触发在这种不同应力的黑暗中v的偏析的脱氧,采用了三组抑制剂。第一个(DTT和SA)影响V-循环酶,第二个(NH4.Cl)解耦跨囊体-ΔpH和第三(n-PG, DCMU, DBMIB和FR)改变质体醌池(PQ-pool)的氧化还原状态。在菌体中检测了这些抑制剂对AZ/VAZ的影响p . canalicualta在黑暗中干燥。DTT在干燥过程中提出了完全抑制Z形成的z形成(图8.).相比之下,SA导致Z在黑暗中积累的强烈增加。尽管经过干燥处理后,sa处理的样品的AZ/VAZ水平比对照高30%(图)8.), SA的作用尤其明显,水合样品中AZ/VAZ的结果是水合对照的200多倍(0.921±0.026 vs 0.020±0.011)。与此形成对比的是NH解耦的跨囊体-ΔpH4.CL没有诱导AZ / VAZ的任何重大变化(图8.).
作用于PQ池的氧化还原状态的第三组抑制剂对水合样品没有影响,对干燥后达到的AZ / VAZ水平几乎没有或没有影响(图8.).具体而言,与干燥对照远红(FR)和DBMIB无影响时,DCMU引起脱水后达到的AZ/VAZ水平轻微下降,n-PG引起脱水后达到的AZ/VAZ水平轻微上升。
讨论
生活在潮间区的光合生物需要能够承受与交替的出苗和淹没时期相关的环境因素(如温度,盐度,光和干燥)的突然变化。事实上,在岩石海岸上,海藻物种在分化的水平带中成长,其特征在于特定的光和温度胁迫[29].光不仅受太阳辐照度日变化的影响,而且受潮差的影响,是影响潮间带物种的最可变和限制因素之一。因此,海藻已经开发出一系列的光保护机制,允许他们被他们吸收光合作用的光量调整装置,从而优化其使用当光限制光合作用,快速发展下的光保护反应photoinhibitory光强度的影响。藻类具有不同的光保护机制,如叶绿体取向的调节[30.];修复机制(31];紫外线吸收酚类化合物的积累[32];或与叶黄素循环有关的吸收多余光能的耗散。最后一种机制更为灵活和快速,对防止光抑制损伤至关重要。在p . canaliculata,V周期池尺寸远高于其他棕色藻类,与其在最上面的透段中的位置相对应20.].此外,已经证明了当暴露于高辐照度时,该物种在暴露于高辐照度时发育高,非光化学淬火(NPQ)[20.].如图所示1,在黑暗开始后恢复光诱导的去环氧化,确认在该物种中的V-循环的完全操作。
García-Mendoza及Colombo-Pallota [13],最近描述了棕色藻类Macrocystis pyrifera缺乏维管植物所显示的初始荧光猝灭[2],与Transthylakoidal-Δph相关联。结果,该物种显示了V-循环去环氧化比和NPQ之间的直接和线性关系,其在血管植物中不会发生,其中由于Δph而独立于Δph而开发的初始NPQ组分(QE)V-循环去环氧化。类似地,在AZ / VAZ和FV / FM之间发现了线性负相关(图1这意味着光化学效率的降低,主要取决于v循环操作。
正如前面对其他光养生物,如蕨类植物和绿藻类所证明的那样[11那12),在p . canaliculatav型循环操作可以完全由脱水引起,而不依赖于光(图)2).此外,脱水引发了V的脱环氧化和Fv/Fm的下调,其程度与光照相同(图)1和2).为了弄清光和脱水诱导的V-cycle活性之间的相似性,我们进行了一个单独的实验,将同一菌体的每个分支暴露在光下或黑暗中,然后在黑暗中脱水(因此产生一个分支,其中a + Z的形成是由光触发的,另一个分支是由脱水诱导的)。如图所示3., Fv/Fm的下降程度与V脱氧来源无关,说明A + Z在光诱导和脱水诱导下均具有相同的调节作用。
复生往往有利于过热,而过热会损害温带藻类[18].当Pelvetia菌体暴露于32℃时,热处理引起A + Z增加,但达到的AZ/VAZ低于任何其他处理(即脱水)后的水平(图)2),浸(图5.)或缺氧(图6.).Fv/Fm的下降明显大于其他处理相同水平的去环氧化(注意图外点)7.).Fv/Fm的下降和AZ/VAZ的增加在处理结束后均不可逆,说明该胁迫可能已经超过了冷水大型藻的致死阈值。事实上,对于其他物种来说,最近的研究表明,适度的热应激可以极大地影响类囊体反应[33].
除了干燥和高温外,潮间带池的周期性缺氧期可能对这些生境的光合生物有害[34那35尤其是在夜间(这时没有光合作用产生的氧气可以抵消呼吸作用)。令人吃惊的是,浸没式(图5.)或缺氧后在无光条件下再充氧(图6.),诱导对V循环和FV / FM的相同效果,如脱水再水合或光暗循环。通过浸没激活VDE可能是由于呼吸有限公司释放诱导的细胞酸化2,或通过发酵新陈代谢[36,但这种假设似乎不太可能,因为这种酶位于囊体内。
考虑到这一假设的不可能性,由氯呼吸引起的腔内酸化将成为需要考虑的机制。基本上,在氯呼吸过程中,质体末端氧化酶(PTOX)可能氧化质体喹啉(PQH)2)通过将电子转移给氧[37与此同时,质子会被抽吸到腔中[38],提供VDE活化所需的流明酸性pH。若干作者描述了缺氧的激活氯仑血管途径[39那40].虽然在绿藻中从未观察到在含氯呼吸条件下去环氧化的叶黄素的积累[41],氯镁最近被提出为负责在缺氧条件下硅藻中的DiatInOxanthin循环的黑暗激活的机制[40].除了缺氧,Brüggemann和同事最近提出,氯呼吸是一些冬季适应橡树在室温下的黑暗孵育中观察到的AZ/VAZ增加的机制[10].这两个例子表明,氯镁可能代表v脱氧的激活的合理解释p . canaliculata在黑暗中。这可能是干燥或过热组织的情况,但在缺氧条件下,PTOX不太可能氧化PQH2由于缺少电子受体(氧),即使认为在这些条件下PQ池应该被过度还原[42].此外,n-PG对PTOX的抑制并没有阻止V-cycle色素在干燥过程中在黑暗中发生的去环氧化(图)8.).这一结果表明,除了ptox介导的PQ氧化外,另一种机制可能负责生成VDE激活所需的跨囊体-ΔpH。然而,在黑暗中样品干燥过程中Z的积累并没有因为解耦剂NH的应用而改变4.Cl(图8.)使我们考虑了V在黑暗中脱氧环氧化的另一种解释。
有时人们认为,在强光条件下,只有VDE被激活,而只有ZE在夜间或弱光条件下工作。然而,ZE活动似乎是结构性的[43].SA诱导V在黑暗中完全脱环氧化(图8.),以及DTT诱导的V脱氧环氧化抑制,表明VDE活性也是结构性的,即使在黑暗中。在没有光的情况下,由于ZE阻止了Z的积累,在无压力的条件下无法观察到Z的积累。然而,胁迫对ZE的抑制会导致大部分V的去环氧化,从而导致保护z的增加。由于ZE需要分子氧作为第二底物,NADPH作为辅因子,这两种分子都可能限制ZE的活性[43].负责这种抑制的潜在机制是未知的,但它可能与NADPH的可用性相关,如图所示拟南芥缺乏叶绿体NAD激酶的突变体[9.].在这些突变体中,ZE由于其辅助因子NADPH的可用性降低而降低其活性。因此,这些植物即使在弱光下也能积累大量的Z [9.].
结论
在这项研究中,已经表明,不管诱导V去环氧化的因素是什么,生成的A + Z分子总是有助于光化学效率的下调。事实上,当本文报告的所有试验的AZ/VAZ值与Fv/Fm在同一回归图中绘制时,无论应力因素如何,它们之间都可以观察到显著的线性依赖关系(图)7.).这一观察为报道的V-cycle暗激活提供了生理学意义,但也开启了关于这一特性的作用和适应价值的问题。所有的实验证据[4.]支持VDE激活需要一个酸性pH值的理论,这通常是由光诱导的质子泵浦生成的,但Z的暗积累需要一个不同的解释,可能与ZE活性的下调有关。尽管ZE下调的分子基础尚不清楚,但有证据表明磷酸化反应可能参与了这一过程[22那44那45].
考虑到在黑暗中出现的导致Z形成的胁迫源数量,以及该叶黄素在膜稳定中的多重保护作用[46那47],以防止活性氧(ROS)的产生[48那49]并且在罗斯的清除[50,看来,V在黑暗中去环氧化不仅是一种生物化学上的奇特现象,而且一定是一种非常重要和精细调控的保护机制。就系统发育群而言,V-cycle活动在黑暗中广泛出现[51在诱导因素(如本工作中所示)方面可能意味着这是对大多数压力源的常见反应,这些压力源在进化过程中顽固,即使在危险条件下保护紫花板膜和光合作机也是如此黑暗的。
缩写
- A:
-
茶叶
- DBMIB:
-
二溴异丙基甲基苯醌
- DCMU:
-
Dichlorophenyl dimethylurea
- 德勤:
-
dithiothreitol.
- 阵线/ Fm:
-
PS II的最大光化学效率
- HT:
-
高温
- NPQ:
-
non-photochemical淬火
- N-PG:
-
n-propyl-gallate
- PTOX:
-
质体末端氧化酶
- 接待员:
-
补液
- RH:
-
相对湿度
- 山:
-
salicyl-adoxime
- V:
-
violaxanthin.
- V-cycle:
-
黄质循环
- VDE:
-
黄质de-epoxidase
- Z:
-
玉米黄蛋白。
参考文献
- 1.
Saga G, Giorgietti A, Fufezan C, Giacometti GM, Bassi R, Morosinotto T:紫黄质去环氧化酶的突变分析鉴定了催化作用中的底物结合位点和残基。中国生物化学学报,2010,31(6):643 - 648。10.1074 / jbc.M110.115097。
- 2.
Müller P,李雪平,Niyogi KK:非光化学猝灭。对成功的光能的反应。植物营养与肥料学报。2001,22(4):457 - 461。10.1104 / pp.125.4.1558。
- 3.
李雪萍,李国栋,李国栋,李国栋:类胡萝卜素阳离子的形成及其对光合作用的调控。中国科学:地球科学。10.1126 / science.1105833。
- 4.
Ruban AV, Berera R, Ilioaia C, van Stokkum IHM, Kennis JTM, Pascal AA, van Amerongen H, Robert B, Horton P, van Grondelle R:高等植物光保护能量耗散机制的鉴定。自然。2007,450:575-578。10.1038 / nature06262。
- 5.
Ahn TK, Avenson TJ, Ballottari M, Cheng YC, Niyogi KK, Bassi R, Fleming GR:植物天线蛋白中电荷转移状态调控光收获的结构。中国科学:地球科学。10.1126 / science.1154800。
- 6.
利用时间分辨荧光技术研究光合作用的两个猝灭位点。化学学报。2009,483:262-267。10.1016 / j.cplett.2009.10.085。
- 7.
Müller M, Lambrev P, Reus M, Wientjes E, Croce R, Holzwarth AR:光系统II捕光复合物的单线态能量耗散不涉及能量转移到类胡萝卜素。化学物理学报。2010,11:1289-1296。
- 8.
三磷酸腺苷介导玉米黄质依赖性非光化学荧光猝灭的暗诱导。美国国家科学院学报。1992年,89:1899 - 1903。10.1073 / pnas.89.5.1899。
- 9。
Takahasi H,Watanabe A,Tanaka A,Hashida S,Kawai-yamada M,Sonoike K,Uchimiya H:叶绿体NAD激酶对于通过光合作用的棘癣循环能源转导的能量转导。植物细胞生理。2006,47:1678-1682。10.1093 / PCP / PCL029。
- 10.
BrüggemannW,Bergmann M,Nierbauer Ku,Pflug E,Schmidt C,Weber C:在中欧条件下,欧洲常绿和落叶橡木的光合作用研究:II。冬季适应欧洲欧洲驯化的欧洲欧洲驯化欧洲的光素碱和无违反的violaxanthin解除氧化和下降调节Quercus分类单元。树木。2009,23:1091-1100。10.1007 / s00468 - 009 - 0351 - y。
- 11.
Fernández-Marínb,巴拉圭L,Esteban R,Becerril Jm,García-Plazaola Ji:响应脱水的黑暗诱导光保护曲折周期。J植物理性。2009,166:1734-1744。10.1016 / J.Jplph.2009.04.019。
- 12.
Fernández-Marínb,贝雷西尔·彭(García-Plazaola)(García-Plazaola)肺衣属pulmonaria.植物营养学报。2010,31(4):469 - 474。10.1007 / s00425 - 010 - 1129 - 6。
- 13.
MF:巨型海带Macrocystis pyrifera提出了不同于高等植物的非光化学猝灭控制。植物营养学报,2007,33(6):526-536。
- 14.
Pogson BJ,Niyogi KK,Della-Pena D:改变的Xanthophylls组成对叶绿素积聚和非光化学淬火产生不利影响拟南芥突变体。PROC NAT ACAD SCI USA。1998,95:13324-13329。10.1073 / pnas.95.22.13324。
- 15.
温度和长时间重现对褐潮间带藻光合作用、碳水化合物含量和生长的影响Pelvetia canaliculata.博纳里卡码头。2000,43:399-407。10.1515 / BOT.2000.041。
- 16.
Schonbeck MW, Norton TA:海岸上岩藻上限的干旱硬化。中国海洋大学学报(自然科学版)。10.2307 / 2259120。
- 17.
哈德森HJ:真菌生物学。剑桥:剑桥大学出版社1992年出版社。
- 18.
CollénJ,达维森IR:跨境红海藻中的应力耐受性和反应性氧代谢Mastocarpus斯特拉摘要和陨石球粒管.植物细胞环境。1999年,22:1143-1151。10.1046 / J.1365-3040.1999.00477.x。
- 19.
Hupel M,Lecointre C,Meudec A,Poura ar N,Gall EA:对棕色海藻中紫外线辐射的光保护反应比较Pelvetia canaliculata还有海洋被子植物蓬子ramosissima.海洋生物生态学报,2011,40(4):453 - 457。10.1016 / j.jembe.2011.03.004。
- 20.
Harker M, Berkaloff C, Lemoine Y, Britton G, Young AJ, Duval JC, Rmiki NE, Rousseau B:强光和干燥对两种海洋褐藻叶黄素循环运行的影响。acta physica sinica, 1999, 34: 35-42。10.1080 / 09670269910001736062。
- 21.
二硫苏糖醇对紫黄质脱环氧化和500 nm吸光度变化的影响。Acta botanica sinica(云南植物研究),2017,37(5):538-543。10.1016 / 0005 - 2728 (72) 90182 - x。
- 22.
徐春春,全亚,黄洪杰,李春春:叶绿体磷酸酶抑制剂对水稻叶片玉米黄质环氧化的抑制作用。植物科学学报,1999,46(4):427 - 434。10.1016 / s0168 - 9452(99) 00084 - 9。
- 23.
Roberts AG, Kramer DM:抑制剂“双重占用”在Q0.叶绿体细胞色素B6F复合物的口袋。生物学习。2001,40:13407-13412。10.1021 / Bi015774M。
- 24.
光系统ii中除草剂结合d1蛋白的双重功能的证据。中国海洋大学学报(自然科学版)。
- 25.
Josse EM, Alcaraz JP, Labouré AM, Kuntz M:质体末端氧化酶(PTOX)的体内特征。中国生物医学工程学报。2003,27(4):487 - 494。10.1046 / j.1432-1033.2003.03766.x。
- 26.
李志强,李志强,李志强,等:利用调制光对叶绿素荧光进行动力学成像。中国图象处理杂志,2000,22(3):1 - 8。10.1023 /: 1010729821876。
- 27.
García-Plazaola JI, Becerril JM:一种快速高效液相色谱法测定应激植物中亲脂抗氧化剂:同时测定类胡萝卜素和生育酚。植物化学学报,1999,10:307-313。10.1002 / (SICI) 1099 - 1565 (199911/12) 6 < 307:: AID-PCA477 > 3.0.CO; 2 l。
- 28.
García-Plazaola JI, Becerril JM:山毛榉光合色素和抗氧化剂的季节变化(Fagus sylvatica)在地中海气候下:对树木衰退诊断的启示。植物营养与肥料学报。2001,2:225-32。
- 29.
MA, Santos CPD, Yoneshigue-Valentin Y, Strbac D, Hall DO:深水光合光响应曲线与光抑制昆布属植物abyssalis和潮间带昆布属植物digitata(褐藻纲)。植物营养学报,2000,36:97-106。10.1046 / j.1529-8817.2000.98213.x。
- 30。
刘志强,刘志强,刘志强:海藻色素团排列与光合活性之间存在相关性吗?中国海洋大学学报,1998,21(4):457 - 461。10.1007 / BF00388172。
- 31。
Häder DP, Lebert M, Sinha RP, Barbieri ES, Helbling EW:保护修复机制在海洋大型藻类光合作用抑制中的作用。光化学与光化学。2002,19(1):1 -8。10.1039 / b206152j。
- 32。
黄志强,王志强,王志强,等。不同潮汐周期对三种褐藻酚含量及抗氧化能力的影响。海洋生物生态学报,2003,19(4):459 - 469。10.1016 / j.jembe.2007.05.028。
- 33.
Zhang R, Cruz JA, Kramer DM, Magallanes-Lundback ME, DellaPenna D, Sharkey TD:中等热胁迫降低了适应光的完整烟草叶片转运体质子动力的pH分量。植物学报。2009,32:1538-1547。10.1111 / j.1365-3040.2009.02018.x。
- 34.
Peckol P,Rivers JS:机会主义宏观格子的生理反应Cladophora vagabunda范登霍克和Gracilaria tikvahiae(McLachlan)与与富营养化有关的环境干扰。中国海洋生物学报,1999,19(4):427 - 434。10.1016 / 0022 - 0981 (95) 00026 - n。
- 35.
Pulido C,Borum J:Eelgrass(Zostera Marina)对贫血的耐受性。J Exp Marine Biol Ecol。2010,385:8-13。10.1016 / J.Jembe.2010.01.014。
- 36.
Summers JE, Ratcliffe RG, Jackson MB:水生单子叶植物的耐缺氧性Potamogeton pectinatus:没有氧气刺激与异常大的巴斯特效应相关的伸长率。J Exp Bot。2000,51:1413-1422。10.1093 / JEXBOT / 51.349.1413。
- 37.
Peltier G, Cournac L:氯呼吸。植物生态学报,2003,22(4):531 - 534。10.1146 / annurev.arplant.53.100301.135242。
- 38.
Rumeau D,Peltier G,Cournac L:在光合作用和植物应激反应期间PSI周围的氯镁和循环电子流。植物细胞环境。2007,30:1041-1051。10.1111 / J.1365-3040.2007.01675.x。
- 39.
Haldimann P, Strasser RJ:用多相叶绿素a荧光上升动力学研究豌豆厌氧的影响(Pisum一l .)。Photosynth Res. 1999, 62: 67-83。10.1023 /: 1006321126009。
- 40.
Cruz S,Goss R,Wilhelm C,Leegood R,Horton P,Jakob T:氯磺酸对叶绿素荧光的非光化学猝灭的影响以及硅藻中的DIAdinoxanthin循环调节thalassiosira pseudonana.中国生物医学工程学报,2010,31(6):513 - 514。
- 41。
GOSS R,JAKOB T:藻类杂志依赖性光保护的调节和功能。Photosynth Res。2010,106:103-122。10.1007 / s11120-010-9536-x。
- 42。
Wright Ah,Delong Jm,Gunawardena A,Prange RK:植物中较低氧气极限,叶绿素荧光和叶黄素循环之间的相互关系。Photosynth Res。2011,107:223-235。10.1007 / s11120-011-9621-9。
- 43。
杨志强,李志强,李志强:紫黄质循环的机制和调控:触角蛋白和膜脂的作用。Acta botanica sinica, 2009, 37(5): 593 - 598。10.1016 / j.bbabio.2008.09.013。
- 44。
ebert V, Adams WW, Mattoo AK, Sokolenko B, Demmig-Adams B:光系统II核心蛋白磷酸酶抑制剂的上调和D1的持续磷酸化在玉米黄质保留,光抑制道格拉斯冷杉越冬针叶。acta botanica sinica(云南植物学报),2005,28(4):457 - 461。10.1111 / j.1365-3040.2004.01267.x。
- 45.
Rokka A, Aro EM, Herrmann RR, Andersson B, Vener AV:植物光合膜光系统II反应中心蛋白的去磷酸化作为对温度突然升高的即时响应。植物生理学报。2000,23(4):427 - 434。10.1104 / pp.123.4.1525。
- 46.
类胡萝卜素在叶绿体中的膜稳定剂。植物科学进展。1998,3:147-151。10.1016 / s1360 - 1385 (98) 01200 - x。
- 47.
Kostecka-Gugala A, Latowski D, Strzalka K: α -二棕榈酰磷脂酰胆碱多层膜的热致相行为受到含有不同结构特征的类胡萝卜素的不同程度的影响——来自差示扫描量热法的证据。生物化学学报。2003,32(6):643 - 648。10.1016 / s0005 - 2736(02) 00688 - 0。
- 48.
Ruban Av,Johnson MP:Xanthophylls作为膜蛋白功能的调节剂。拱生物学生生物糖。2010年,504:78-85。
- 49.
玉米黄质与光系统II单体天线蛋白Lhcb6 (CP24)结合的动力学及其光保护特性的调节。中国生物医学工程学报,2010,27(4):467 - 477。
- 50.
Havaux M, Dall'Osto L, Bassi R:玉米黄质具有增强抗氧化能力的所有其他叶黄素拟南芥独立于PS II天线的叶片和功能。植物营养与肥料学报。2007,32(4):457 - 461。10.1104 / pp.107.108480。
- 51.
Fernandez-Marín B, Míguez F, Becerril JM, García-Plazaola JI:黑暗条件下脱水介导的叶黄素循环激活:是否与耐脱水有关?植物学报。2011,doi: 10.1007/s00425-011-1420-1
确认
这项工作得到了西班牙教育和科学部[BFU 2010-15021]和巴斯克政府[UPV/EHU-GV IT-299-07]的支持。BFM获得了巴斯克政府的奖学金。我们感谢布莱恩韦伯斯特的英语复习。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
实验由BFM和JIGP设计并完成。FM和BFM进行了HPLC分析。JIGP、BFM和FM分析荧光。JMB、BFM和JIGP对抑制剂进行了实验并进行了统计分析。所有作者阅读并批准了手稿的最终版本。
作者为图像提交的原始文件
以下是与作者的原始提交的图像的链接。
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署名许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Fernández-Marín, B., Míguez, F., Becerril, J.M.et al。黑暗中紫黄质循环的激活是对不同非生物胁迫的共同反应:一个案例研究Pelvetia canaliculata.BMC植物杂志11,181(2011)。https://doi.org/10.1186/1471-2229-11-181
已收到:
公认:
发表:
关键字
- 叶黄素
- 褐藻
- DCMU
- 光化学效率
- violaxanthin.