摘要
背景
随着高通量基因组工具的出现,现在有可能在传统模式生物之外对单个物种进行详细的分子研究。结合对生理过程的良好理解,这些工具使研究人员能够探索自然多样性,从而更好地理解生物机制。本文对猕猴桃这一非模式生物从开花到衰老的果实发育过程进行了详细研究,猕猴桃对(“Hort16A”)。
结果
与以往的研究一致,研究发现,除了果实成熟进程有显著差异外,果实形态、生长发育的许多方面与模型果番茄相似。果实成熟的早期阶段发生在果实仍在生长的过程中,许多成熟事件与自催化乙烯产生无关(历史上与呼吸更年期有关)。自催化乙烯是在果实开始衰老的成熟过程后期产生的。
结论
通过调整答:对果实发育到物候尺度,这项研究为后续的生理和基因组研究提供了参考框架,并将允许跨水果物种的交叉比较,从而更好地了解植物王国中发现的果实的多样性。
背景
花器官发育成肉质果实,为种子提供了有效的保护和传播。肉质果实由肿胀的子房或其他花的部位发育而成[1],其结构是在开花、授粉和施肥之前或之后不久形成的[2].受精后,会有一段快速生长期,最初由细胞分裂促进,细胞分裂决定果实的形状、下沉强度和大小。番茄的细胞分裂可在开花后7-10天完成,柑橘的细胞分裂可在开花后50天完成[1].随后的果实生长是由于种子发育所调节的细胞扩张及其对果实库强度的影响[3.].在果实生长接近尾声时,胚胎成熟,果实成熟,通常在激素浓度、呼吸作用、细胞壁完整性、颜色、香气和风味化合物方面表现出快速变化[4].这些可取的特性导致了对苹果、葡萄、番茄、柑橘和核果等水果作物的选择、商业开发和理解的悠久历史。由于长期的驯化,许多这些作物结出的果实与它们的野生亲戚几乎没有相似之处。相比之下,所有人工栽培的猕猴桃,包括重要的商业品种“海沃德”(猕猴桃deliciosa(答:Chev。)C.F. Liang和A.R. Ferguson),以及“Hort16A”(猕猴桃对木板。var。对'Hort16A')与它们的野生亲戚只相差一两代[5].
猕猴桃种(猕猴桃科)具有许多共同特征;它们都是雌雄异株,雌花的子房由许多心皮融合而成,形成一个自由的、放射的花柱。这种水果是一种浆果,果肉多汁,含有许多种子。6].早期的研究主要集中在六倍体,绿肉,答:deliciosa奇异果(7- - - - - -11].然而,由于其高倍体数量,对这种水果的分子研究具有挑战性,研究人员正在选择二倍体基因型答:对了解这个属的分子过程。现在有一个全面的遗传图谱的29条染色体答:对[12]、相当数量的无害环境技术[13],而且很容易转换[14].最后,答:对目前是一个正在进行的基因组测序计划的焦点(R Hellens, pers。通讯)。植物果实发育研究答:对'Hort16A'专注于果实生长和颜色发育的某些方面[15- - - - - -19],而水果碳水化合物浓度的季节变化已被描述为其他答:对基因型(20.].的不同寻常的特征之一猕猴桃虽然被归类为更年期水果,但该物种正处于成熟阶段[11]大部分成熟发生在产生自催化乙烯之前[21].
许多植物物种的研究人员受益于标准化的发展描述符,因为这使得研究研究可以在不同的环境或管理系统下进行比较,以评估诱变或特定转基因的影响。最常用的方法是德国生物科学、联邦科学和化学工业(BBCH)量表,该量表使用两个十进制数字刻度描述植物生长的物候变化,第一个表示主要生长阶段(从0到9),第二个表示次要生长阶段(从0到9)[22].用于植物生长的BBCH鳞片现在可用于许多植物,包括拟南芥(换算成0-9.9分)[23]、谷类[22]、蔬菜作物[24]、红果及核果[25],葡萄藤[26]和柑橘[27].而BBCH量表已被用来描述的发展答:deliciosa“海沃德”(28],该研究没有关注果实的发育,对每个发育阶段的生理过程的细节也很少。
在这里,我们详细研究了果实从开花到衰老的过程答:对“Hort16A”(29].研究的发育方面包括果实生长和成熟(软化、果肉颜色变化和可溶性固形物积累)、碳水化合物和酸的积累、乙烯代谢和基因表达。在本研究中,我们提出了一个基于BBCH系统的描述猕猴桃生理发育的系统模型,可作为后续猕猴桃发育研究的锚点。
结果
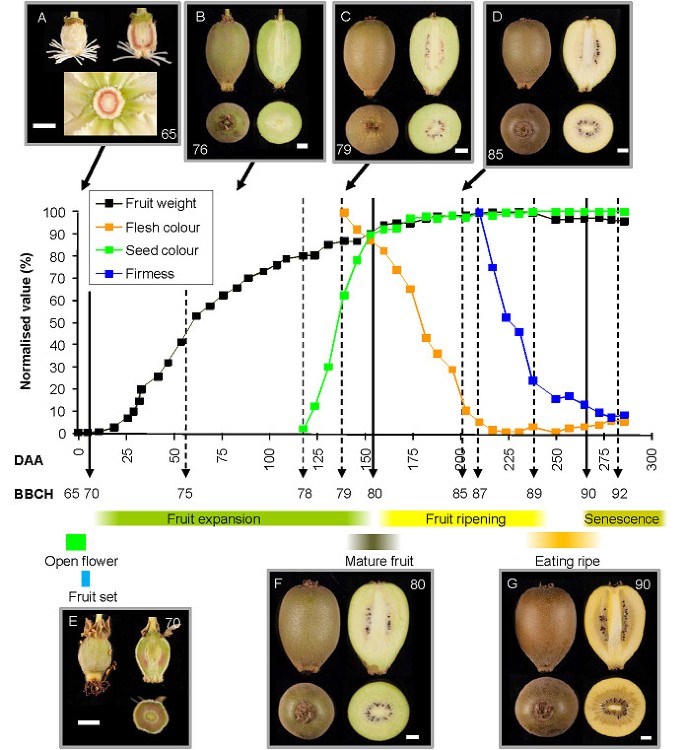
BBCH量表答:对Hort16A果实发育
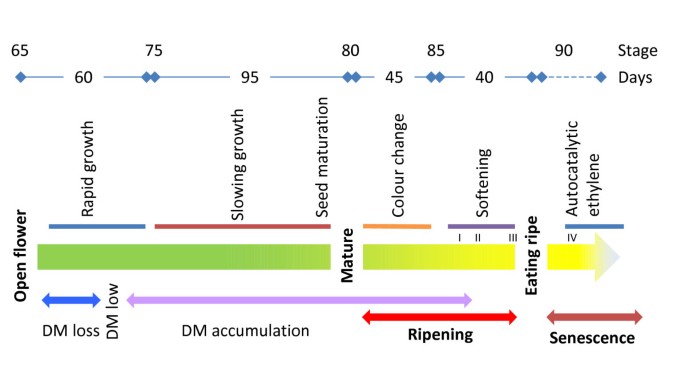
详细研究答:对在三个生长季节(第1-3季)的果实发育过程中,从开花(开花后0天,DAA)到果实衰老(300 DAA)都进行了“Hort16A”,并与BBCH尺度对齐(图1-3)1,附加文件1,2).在完全开放的花朵(65期)之后,水果生长的主要阶段是坐果(70期)和成熟的果实(80期)。虽然许多BBCH鳞片停止在89阶段,即水果“吃熟了”,但由于以下原因,增加了一个额外的主要果实发育阶段-果实衰老(90阶段)。这与整株植物的BBCH等级是一致的,该等级将90级及以上的果实分配给衰老,而92级偶尔用于过熟果实[30.].
在'Hort16A'果实发育中,每个主要生长阶段的明确不变描述如下:
主要阶段70坐果,花瓣脱落,果实开始生长
主阶段80成熟果实,果实内种子95%以上为黑色
主阶段90开始衰老,果实开始产生自催化乙烯。
在第1季,这些主要阶段分别达到10 DAA, 155 DAA和270 DAA(图1e f g).
对于BBCH分级中的二级生长阶段,70至80阶段被描述为果实生长的百分比,71阶段具有最终果实重量的10%,79阶段具有最终果实重量的90%。‘Hort16A’1季果实鲜重增长呈双相增长,呈s型增长曲线(图)1,2).受精后,果实生长呈指数级增长,25 DAA时达到71期(最终鲜重的10%),约60 DAA时达到75期(最终重的50%)。在第75阶段之后,果实进入第二个较慢的生长阶段,第79阶段(最终重量的90%)达到140 DAA。在第85阶段(200 DAA),当种子完全变黑,果肉颜色发生变化时,测量果实重量进一步增加。此后,果实重量保持不变,直到89阶段(237 DAA),随着果实衰老(90阶段),重量略有下降。在第78期(115 DAA),果实生长明显放缓,种子开始变色,从白色变成棕色,最后变成黑色(图1 c).超过95%的种子在80期变黑(155 DAA;数字1 f).
在第二季的水果中观察到类似的s型生长模式(图2).然而,第三季有一个异常炎热干燥的时期,这使得果实生长从76阶段(最终果实生长的60%)急剧下降到78阶段(80至115 DAA)。这种缓慢的生长之后是一段更快的代偿性生长,直到大约83阶段(175 DAA)(图2).这表明,不寻常的环境条件可以改变生长模式,促使种子生长到完全黑色的地步。在这些情况下,应该使用不变的发育描述符,即大于95%黑期80的种子。
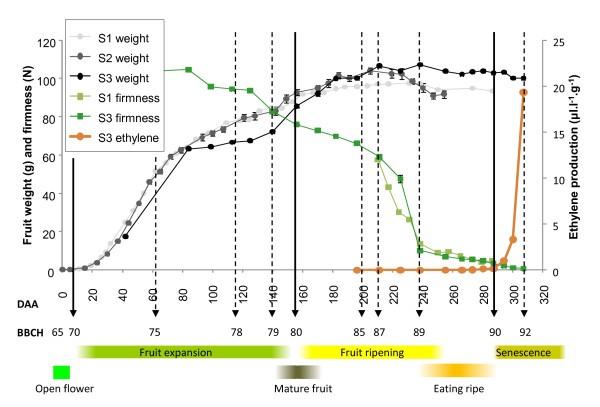
对于80至90阶段之间的次级阶段,BBCH规模从未成熟的果实发展到果实衰老的开始。在许多水果品种中,果肉颜色的变化在第85阶段结束,此时开始软化(第87阶段),在第89阶段水果软化到“成熟”。吃熟了是一种感官描述,完全取决于消费者,因此可以根据个人口味而有很大差异。对于“Hort16A”水果更可靠的阶段描述,发展的关键点是自催化乙烯的生产。这发生在果实成熟的末期和果实衰老的初期2).自催化乙烯生产是一种定义明确且易于测量的生理事件,已被指定为90级。
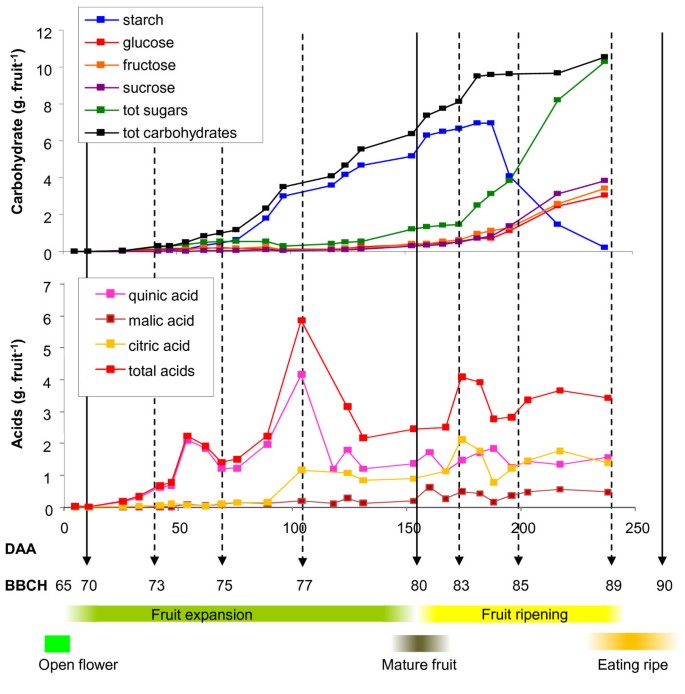
在'Hort16A'中,未成熟果实(< 79期)的外果皮呈绿色,色相角约为115°。颜色在79阶段(140 DAA)开始改变,并在85阶段(200 DAA)发展到黄色(色相角约100°h)(图1).此时,果实仍较硬(> 60 N)。80-85阶段,果实中可溶性糖含量显著增加;糖增加的拐点被指定为83阶段(175 DAA)。糖的快速积累一直持续到果实处于89期(237 DAA)(图3.).
在第三季中,一旦水果大到足以评估75级(60 DAA),就开始测量果肉硬度。在75 ~ 85阶段(200 DAA),果实从100 N到50 N逐渐软化(图2).在这之后,与第一季一致,水果经历了典型的猕猴桃软化模式,就像在“海沃德”水果中发现的那样。这种软化模式被描述为有四个软化阶段[31].阶段I是硬度在87阶段(210 DAA)开始的初始下降,阶段II是硬度的快速下降(阶段88 - 225 DAA),阶段III是硬度缓慢下降到~10 N或更小(结束于阶段89 - 237 DAA)。当果实产生自催化乙烯时,细胞产生芳香挥发物[32],硬度进一步下降(第四阶段软化),果实衰老开始- 90阶段(270-285 DAA)(图1,2).阶段92代表过熟衰老果实,当果实小于4 N (> 300 DAA)。在一些不太有利的生长条件下,在第80和第90阶段之间可能观察不到明显的次级阶段的进展(肉的颜色变化、糖的积累和软化),直到第88阶段才发生肉的颜色变化(J. Burdon,在准备阶段)。在这些情况下,应使用更可靠的83阶段(糖拐点)和87阶段(快速肉软化的开始)标记(表2)1).
在发育过程中果实形态的变化
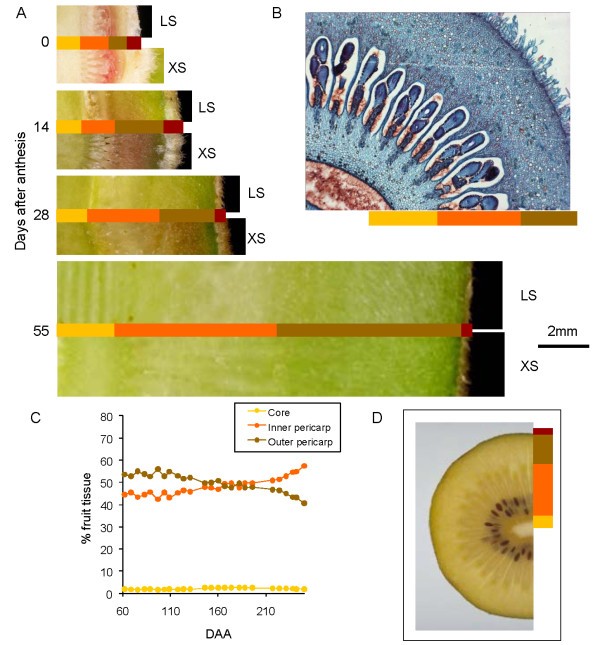
Hort16A果实由多心皮子房发育而来,每个心皮包含若干胚珠。果实有四种不同的组织类型:中央核,内含子房和种子的内皮(IP),密集的外皮(OP)和果皮(图)4模拟).在花期(完全开放的花-第65期),胚珠附着在花核上,花核被果皮组织包围,果皮组织也被几个细胞厚的细丝附着在花核上(图4 b).此时,皮肤上覆盖着一层厚厚的毛发(图1而且4).到了70期,花中的OP组织已经扩张到原来宽度的3倍,而发育成IP的房腔在这一阶段没有扩张(图4).到了第71阶段,发育中的IP在种子周围迅速扩张(图7)4).到第75阶段,IP约占果实横截面积的40%,之后IP在整个果实生长的其余阶段继续以比OP更快的速度扩张。随着果实成熟,果皮内层向OP延伸,一旦果实达到90期,OP就变成了一个只有几毫米深的组织带,毗邻皮肤(图4摄氏度).
生长过程中的碳积累
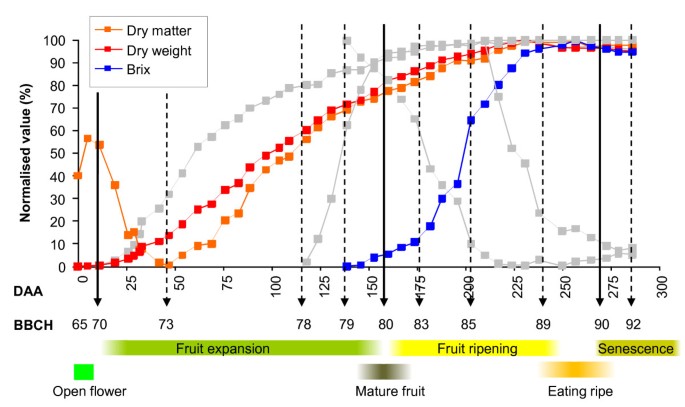
虽然'Hort16A'果实的鲜重积累呈s型增长模式,在75期后增长缓慢,但果实的干重在71期(28 DAA)和79期(140 DAA)之间呈线性增长(图3.).在此之后,果实的干重继续增加,在第89阶段达到最大干重(237 DAA),远远晚于第85阶段观察到的最大鲜重(200 DAA)(图3.).这一差异表明,在发育过程中,碳和水的积累之间存在复杂的关系,这可以通过比较水果的鲜重和干重作为干物质百分比来可视化3.).果实干物质含量在坐果期(70期)较高,在第一个快速生长期迅速下降,在45 DAA时达到最低。这是当水果达到最终新鲜重量的30%时,即73阶段(表2)1).然后,干物质比鲜重增加得更快,直到阶段89,此时没有观察到干物质进一步增加(图3.).
从73阶段开始,淀粉开始在果实中积累,直到190 DAA达到淀粉最大值(84阶段)(图5).此后,淀粉被迅速分解并代谢成类似浓度的蔗糖、葡萄糖和果糖(图5).“Hort16A”水果中可溶性糖的含量持续增加,直到水果达到食用成熟。当评估每个组织中的糖含量时,OP和IP都具有相似的组成,直到果实开始成熟。然而,在成熟过程中,淀粉在OP中比在IP中更快地转化为糖(附加文件)3.).有趣的是,可溶性糖增加的拐点出现在淀粉显著减少之前(在175 DAA - 83阶段)。
在果实快速生长的早期阶段(第71-77期(最终果实重量的70%)),观察到酸的积累,特别是奎宁酸(图2)5 b).这一增长之前在其他国家也有报道猕猴桃物种(33]并被证明是水果渗透潜能的一部分,有助于水果生长。在这一点之后,总酸迅速下降到79阶段,之后在水果中观察到酸的稳定状态。从第76阶段开始,柠檬酸增加,之后在果实生长的其余阶段保持不变。苹果酸是在发育过程中积累的次要果酸(图5 b).
水果对乙烯的反应
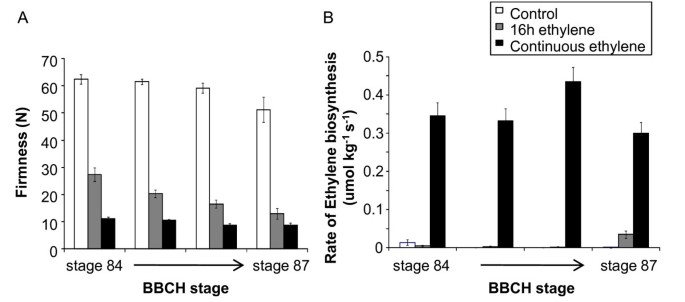
在“Hort16A”果实中,许多与果实成熟相关的生理变化(淀粉转化、颜色变化和果肉软化)发生在乙烯产量没有任何显著增加的情况下(图2).事实上,当果实留在藤蔓上时,只有在果实进入衰老90期时才检测到自催化乙烯。虽然在成熟过程中果实的乙烯产量没有明显增加,但在此之前,果实对外源乙烯的反应能力就已经发展起来了。外源乙烯处理84期离体果实可迅速加速果实软化至食用成熟(89期;数字6).随后每周收获的果实,直到87阶段,藤上留下的果实几乎没有软化,但对乙烯的敏感性在这段时间内增加了(图6).在早期收获的果实中,软化程度取决于乙烯处理的时间。连续乙烯(100 ul.l-1)的供应比单独应用乙烯(16 h, 100 ul.l-1).分别施用乙烯和连续施用乙烯处理的果实在2天后硬度的差异从第84期的约18 N减少到第85期的< 5 N。在乙烯处理的果实中观察到的快速软化并不一定与内源性自催化乙烯产生的增加相一致(图6 b),作为处理16小时的果实(50 ul.l-1)不会产生自催化乙烯,而连续乙烯处理的水果则会产生乙烯。
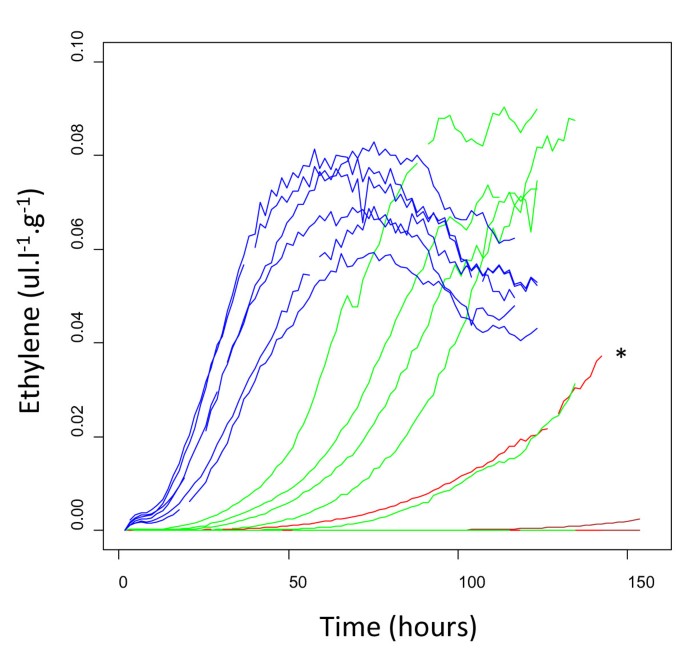
为了建立诱导乙烯自催化生产所需的乙烯阈值,对88期果实进行不同时间的50 ul.l处理-1乙烯(12、24、36小时),并在随后的7天内持续监测乙烯产量。对照组(未经处理)的水果都没有产生自催化乙烯,经过12小时处理的水果中只有1个产生自催化乙烯(后来发现这一罐水果中有一种感染了疾病的水果)(图)7).然而,5/6用乙烯处理24小时的水果在乙烯处理后的24小时至7天内产生了自催化乙烯。所有用乙烯处理36小时的水果在处理24小时内产生乙烯。乙烯的增加与呼吸频率的增加相关(附加文件)4).经过7天的乙烯测量后,评估了肌肉硬度。没有检测到乙烯的罐子里的水果保持在8 N左右,这与89阶段一致,而产生自催化乙烯的罐子里的水果已经发展到92阶段甚至更高,硬度小于4 N。
在果实发育过程中基因表达的变化
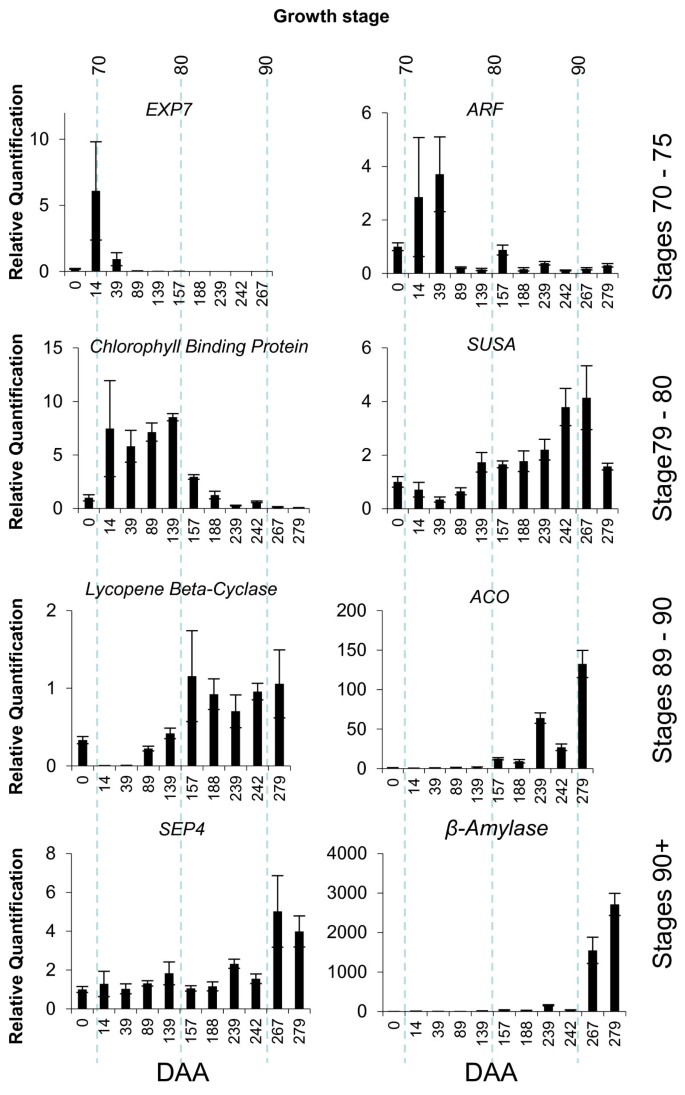
预计未来使用该量表的工作将包括分子研究。为此,我们扩大了果实发育过程中表达差异的基因的生理尺度,以作为果实发育不同阶段的标记基因。基于文献检索和猕猴桃EST库中单个果实组织文库序列的存在,筛选出20个基因进行表达分析。所选择的基因具有可能解释所观察到的某些表型变化的功能[13].其中14个基因表现出单一的扩增产物,并在果实发育过程中表现出表达差异。其中包括聚半乳糖醛酸酶(PG) [34],ACC氧化酶[32),两个棒曲霉素(经验值)基因,生长素反应因子(东盟地区论坛),叶绿素a-b结合蛋白(出租车),一个番茄红素环化酶[17),一个种子成熟蛋白,一个SEPALLATA 4(SEP4)像基因[35]和四个与淀粉代谢相关的基因,包括aβ淀粉酶而且蔗糖合成酶a(苏萨) [36](附加文件5).图中显示了“Hort16A”果实发育不同阶段的8个基因的表达8.其余基因的表达与这些模式重叠(附加文件6).在发育的早期阶段,表达EXP7在71阶段达到顶峰东盟地区论坛在71-75期高表达。a的表达式出租车在71-80阶段增加。表达苏萨在第8期,基因在果实中增加,并在果实衰老前保持高水平(91)。淀粉质体蛋白在果实中从85期到食用成熟(89期)表达量增加SEP4而且β淀粉酶基因在89期后的衰老果实中高度表达(图8).
讨论
在此,我们详细描述了在藤本植物的生长发育过程中发生的生理变化猕猴桃对'Hort16A'果实,从开花到衰老,与BBCH等级的关系(总结在图中9).BBCH量表是一种全植物量表,由作物生理学家设计,用于比较植物物种从种子到衰老的生长和发育,果实只是量表的一个组成部分。这导致一些研究只提供了水果生长阶段的粗略描述,这很难适用于给定的实验。这里给出了果实生长的详细描述(表1),为其他品种的果实发育研究提供了框架猕猴桃物种。这个尺度不同于第二个猕猴桃品种的全植物研究中提出的尺度,答:deliciosa《海沃德》作者:[28].首先,主阶段80被分配给完全黑种子(之前分配给阶段85 [28]),其次,阶段90是指开始产生自催化乙烯的水果,在[28].这里详细描述的不变主阶段很可能是保守的猕猴桃,根据最终的果实大小,可以很容易地翻译70到80之间的次级阶段。80至90年间的次生阶段可能更具有物种和品种特异性,特别是在不同的成熟果实中观察到果肉颜色的范围猕猴桃品种及栽培品种[13,18].90期的描述符似乎是保守的,因为以前的研究在其他猕猴桃物种报告了在没有自催化乙烯的情况下的成熟过程[11,21,37].
像许多多年生水果,如苹果[38],葡萄[26]和柑橘[1’Hort16A’猕猴桃的果实发育期很长。果实的生长横跨全年生长季节的大部分时间,从春季开花开始,接着是夏季果实快速生长,秋季成熟,最后是冬季果实从藤蔓上衰老和脱落[7,39].相比之下,番茄的果实生长发育仅持续1.5至2个月,压缩了果实发育的时间[3.,40,41].尽管番茄和Hort16A水果的发育时间不同,但它们有很多相似之处;它们是真正的水果(浆果),是子房衍生的,它们有相似的组织带(外皮,房内皮和核心组织),在成熟和成熟的过程中,果肉会改变颜色,果肉会软化。在这项研究中,'Hort16A'果实的生长遵循s型模式,与之前的研究一致[15].密切相关的答:deliciosa果实的生长也被描述为具有双重[7]或三重[11s型生长模式。在这些研究中,额外的突变很可能是环境衍生的,而不是基因编程的,正如第三季干旱期间'Hort16A'的较慢增长期所显示的那样。来自不同基因型的番茄果实的双相生长也是典型的[40].在这项研究中,我们还记录了在水果成熟的早期阶段,水果继续生长,一旦达到食用成熟度,水果就会收缩并开始衰老。在番茄和答:deliciosa,生长的第一阶段主要是细胞分裂、种子形成和早期胚胎发育[3.,7],这对于处于初始发展阶段(70-75阶段)的'Hort16A'来说可能是正确的。这一时期的特点是果皮组织的大小和发育迅速变化,首先是外皮组织,然后是内皮组织,种子的发育以及an的表达EXP7和一个东盟地区论坛基因。这段快速生长发育时期的另一个特点是,与碳相比,水更多地流入水果[15]和奎宁酸的累积[42].从最初的快速增长期到较长时期的缓慢增长期的根本变化被定义为第75阶段。在番茄和“海沃德”猕猴桃中,这种生长速度的变化表明了从主要的细胞分裂到细胞扩张时期的变化[3.,7].
与许多其他水果相比,其成熟反应较慢答:对是不寻常的。“Hort16A”水果的乙烯生产模式与“Hayward”水果相似。“海沃德”被归类为更年期水果[43],尽管果实成熟时乙烯的产生没有明显增加[11].在“海沃德”中,水果通常在硬度低于10n时才产生自催化乙烯。21],除非身体、生理或疾病在某种程度上受到损害[44,45].'Hort16A'在没有自催化乙烯生产的情况下也会成熟。这与番茄形成鲜明对比,番茄的乙烯产量在果实成熟初期迅速增加。自催化乙烯仅由'Hort16A'果实在89期后产生,因此将乙烯产生与果实衰老联系起来可能更合适,而不是将其与成熟联系起来。正因为如此,我们将90级衰老纳入了“Hort16A”的建议BBCH量表(图9).然而,值得注意的是,这个衰老阶段似乎与番茄成熟反应有关成熟抑制剂基因(46]与拟南芥相似SEP4基因。与猕猴桃基因最接近的同源基因AcSEP4[35]在乙烯产生的转折点上调。这也与其他与成熟相关的基因表达相对应;例如,a的上调β淀粉酶基因(32]在这一阶段观察到(图8).
虽然猕猴桃的成熟不依赖于自催化乙烯的产生,但内源性乙烯似乎在软化过程中发挥了作用。对乙烯作用抑制剂1-甲基环丙烯(1-MCP)的研究表明,可以通过阻断乙烯作用来减缓快速软化(88阶段)[47,48].此外,猕猴桃对外源施加的乙烯特别敏感,并迅速软化[49].这表明,基础量的乙烯可能有助于成熟过程,而不是实际上诱导自催化反应。这也表明,自催化乙烯生产对乙烯的敏感性低于果实软化,这与作者提出的苹果果实成熟的敏感性/依赖性模型一致。
结论
本研究详细描述了‘Hort16A’果实发育过程中发生的发育变化。通过将其与BBCH量表相匹配,我们为进一步的生理和分子研究提供了一个框架,以进行比较,独立于开花后的天数,或任何给定年份的环境影响。
方法
种植材料和收获日期
实验是用来自猕猴桃对(地板)var。对在2004/2005(第一季),2005/2006(第二季)和2009/2010(第三季)生长季,“Hort16A”葡萄树生长在植物和食品研究,Kerikeri研究中心(35°14’S 173°55’E)。第1季开花时间为50%的花(2004年10月21日)被标记为后续采样,每隔一周从10株葡萄中每株抽取2个果实,评估如下。第二季重复了第一季的设计,从50%开花开始每周测量(2005年10月16日)。从第三季的果实(2009年10月10日)中,每隔2周采样一次,从50%的花期(2009年10月10日)拍摄,并测试硬度和乙烯产量(图)1,2和附加文件1,2).对于采后处理,在第三季,从第84阶段开始,对10棵葡萄树的批量收获的果实进行了乙烯反应评估。
果实评估方法
取样后,对每个水果进行称重。使用Effigi穿透仪(Alphonsine, Italy)或水果质地分析仪(Guss, South Africa)以20mm .s的速度测定水果硬度-1[50然后在果实赤道90°的两个位置取下1毫米厚的果皮和外皮。取2mm赤道切片,用数字卡尺(日本Mitutoyo)测量每个组织的最大和最小直径,确定果皮内外组织的比例,并记录果实中全色黑色种子的百分比。然后称重,在65°C下干燥24小时,以确定水果干重和水果干物质百分比。干物质按干重/鲜重* 100计算。果肉颜色使用CR 300色度仪(美能达,日本),使用C65光源和LCH配色系统,在每个水果的两个位置,在赤道90°,去除皮和果肉,深度约2毫米[16].使用折光计测定从水果两端提取的果汁中的可溶性固形物(爱宕,日本)[51].
乙烯的治疗方法
从第84阶段到第87阶段,每隔一周收集第3季的大量样本。在每个采样时间内,三分之二的样品用100 ul.l处理-1乙烯在340l容器与循环空气。三分之一在16个小时的治疗后被取出,三分之一留在那里2天;剩下的果实被放在无乙烯的环境中。在评估之前,将乙烯释放2小时,并测量水果的硬度和内源性乙烯的产生。通过将单个水果密封在536毫升的容器中,在20°C下测量乙烯产量。用装有火焰电离检测器的气相色谱仪(详见[32],乙烯产量是按每克水果的速率计算的。
用于连续的乙烯监测(图7),将乙烯处理后的果实分为6批,每批3个。水果暴露在50 ul.l-1乙烯按上述方法放置12、24和36小时,并放入单独的(1l)罐中,空气持续流动(28ml .min)-1)。每2小时,使用GC 2014(岛津,日本)对空气样本进行乙烯评估。
非结构性碳水化合物和有机酸组成
第1季水果的样本是从至少四个水果中的每个水果中纵向切片(代表所有组织类型),在液氮中快速冷冻,并在-80°C下储存,以便后续分析非结构性碳水化合物(淀粉和可溶性糖)和有机酸。淀粉的分析如前所述,由[52]、可溶性糖(葡萄糖、果糖、蔗糖、myo-肌醇和半乳糖)的测量方法如下[53],而有机酸(柠檬酸、奎宁酸和苹果酸)则按照[54].
基因表达分析
对1季果实进行基因表达分析。对于早季样品,0 - 60 DAA,至少收获10个独立果实用于RNA提取。在60 DAA后,从10个水果中各取一个赤道切片进行分析。每个样品在液氮中快速冷冻,并在-80°C保存,直到提取。RNA按[55],并使用RNA清除试剂盒(Qiagen)根据制造商的协议进行清洗。单链cDNA使用SuperScript III (Invitrogen)试剂盒按照制造商的协议合成。定量PCR方法如[32],利用PP2a和EF1α基因作为管家基因。在两种情况下,基因的表达模式是相似的。图中所示表达模式与肌动蛋白进行比较。qPCR引物详见附加文件5.
缩写
- BBCH:
-
联邦生物技术,联邦农业和化学工业
- DAA:
-
开花后的日子
- 美国东部时间:
-
表达序列标签
- 知识产权:
-
内果皮
- 人事处:
-
外果皮
- qPCR:
-
定量聚合酶链反应。
参考文献
- 1.
Monselise SP: CRC坐果与发育手册。美国佛罗里达州:CRC出版社1986年出版。
- 2.
Coombe BG:肉质水果的发展。植物学报,1997,27(1):207-228。10.1146 / annurev.pp.27.060176.001231。
- 3.
王志刚,王志刚,王志刚:《水果的发展》。中国生物医学工程学报,2003,26(3):357 - 357。
- 4.
白色PJ:果实发育和成熟的最新进展:综述。应用物理学报,2002,29(3):344 - 344。10.1093 / jxb / erf105。
- 5.
Ferguson AR:对种质资源的特性和评价的需要:以猕猴桃为例。自然科学进展,2007,34(3):366 - 366。10.1007 / s10681 - 006 - 9188 - 2。
- 6.
Ferguson AR:猕猴桃:植物学评论。《圣经》1984,6:1-64。
- 7.
跳跃ME:外源生长素、赤霉素和细胞分裂素对猕猴桃果实发育的影响(猕猴桃对地板)。张志军学报,1976,14:69-75。
- 8.
沃尔顿·EF,德钟TM:估算种植一颗猕猴桃的生物能量成本。第二届果树研究与果园管理计算机建模国际研讨会。编辑:Anderson JL1990,中国园艺学报,27(3):344 - 344。
- 9.
理查德森AC, McAneney KJ,道森TE:猕猴桃碳水化合物动态。中国园艺学报,1997,27(6):357 - 357。
- 10.
Okuse I, Ryugo K:加利福尼亚州正在生长的“海沃德”猕猴桃的成分变化。环境科学学报,2004,26(1):344 - 344。
- 11.
Pratt HK, Reid MS:中国醋栗:果实生长和成熟的季节模式,成熟,呼吸和乙烯的作用。中国粮食科学,2004,25(7):747-757。10.1002 / jsfa.2740250702。
- 12.
Fraser LG, Tsang GK, Datson PM, De Silva HN, Harvey CF, Gill GP, Crowhurst RN, McNeilage MA:雄雄异株猕猴桃(猕猴桃)的基因丰富连锁图揭示了推测的X/Y性别决定染色体。中国生物医学工程学报,2009,10:102-10.1186/1471-2164- 10102。
- 13.
Crowhurst RN, Gleave AP, MacRae EA, Ampomah-Dwamena C, Atkinson RG, Beuning LL, Bulley SM, Chagne D, Marsh KB, Matich AJ,等:表达序列标签分析猕猴桃:跨物种EST数据库在风味、健康、颜色和成熟领域基因发现的应用。中国生物医学工程学报,2008,9:351-10.1186/1471-2164-9-351。
- 14.
王涛,冉YD, Atkinson RG, Gleave AP, Cohen D:猕猴桃的转化:猕猴桃功能基因组学研究的一个潜在种。植物细胞学报,2006,25(5):425-431。10.1007 / s00299 - 005 - 0080 - 7。
- 15.
裴敏钦,陈志强,陈志强,陈志强:猕猴桃Hort16A果实终重预测。聂志军,作物园艺学报,2003,31(2):147-157。10.1080 / 01140671.2003.9514247。
- 16.
裴敏钦,De Silva N, Snelgar WP, Richardson AC, Thorp TG:猕猴桃“Hort16A”果实颜色发育的模拟。聂志军,作物园艺学报,2003,31(1):41-53。10.1080 / 01140671.2003.9514234。
- 17.
Ampomah-Dwamena C, McGhie T, Wibisono R, Montefiori M, Hellens RP, Allan AC:猕猴桃番茄红素β -环化酶在水果类胡萝卜素积累中起着重要作用。实验学报,2009,60(13):3765-3779。10.1093 / jxb / erp218。
- 18.
Montefiori M, McGhie TK, Hallett IC, Costa G:绿肉猕猴桃和黄肉猕猴桃成熟过程中色素和质体超微结构的变化。Sci Hortic-Amsterdam。2009, 40(4): 377-387。10.1016 / j.scienta.2008.08.022。
- 19.
Snelgar WP, Hall AJ, Ferguson AR, Blattmann P:温度对‘Hayward’猕猴桃藤蔓果实生长和成熟的影响。植物学报,2005,32(7):631-642。10.1071 / FP05062。
- 20.
Boldingh, Smith GS, Klages K: 5种猕猴桃果实、叶片和细根组织中非结构性碳水化合物的季节浓度。安Bot-London。2000, 85(4): 469-476。10.1006 / anbo.1999.1094。
- 21.
何金,Hewett EW, Lallu N:乙烯在猕猴桃软化中的作用。植物学报,1999,498:255-262。
- 22.
兰开夏PD, Bleiholder H, Vandenboom T, Langeluddeke P, Stauss R, Weber E, Witzenberger A:作物和杂草生长阶段的统一十进制代码。中国生物医学工程学报,2001,29(3):366 - 366。10.1111 / j.1744-7348.1991.tb04895.x。
- 23.
杨晓东,刘志刚,刘志刚,刘志刚,刘志刚,等,Görlach J:拟南芥生长发育阶段表型分析:植物高通量功能基因组学模型。植物细胞学报,2001,13(7):1499-1510。10.1105 / tpc.13.7.1499。
- 24.
Feller C, HB, Burh L, Hack H, Hess M, Klose R, Meier U, RS, TVdB EW: Phänologische Entwicklungsstadien von Gemüsepflanzen: I. Zwiebel-, Wurzel-, Knollen und Blattgemüse。中国农业大学学报,1998,29(3):344 - 344。
- 25.
Meier U, Graf H, Hess M, Kennel W, Klose R, Mappes D, Seipp D, RS, Streif J, TvdB: Phänologischeund Pyrus communis L.), des Steinobstes (Prunus-Arten), der Johannisbeere (Ribes-Arten) and der Erdbeere (Fragaria × ananassa Duch.)。中华医学杂志,1994,29(4):344 - 344。
- 26.
Lorenz DH, Eichhorn KW, Bleiholder H, Klose R, Meier U, Weber E:葡萄物候生长阶段(Vitis vinifera L. ssp.)-根据扩展的BBCH分级的代码和描述。德国葡萄酒,1995,1(2):100-110。10.1111 / j.1755-0238.1995.tb00085.x。
- 27.
Agusti M, Zaragoza S, HB, Burh L, Hack H, Klose R, RS: Escala BBCH para la descripción de los estadios fenológicos del desarrollo de los agrios (Gén。柑橘类)。王晓明,王晓明,2004,(3):1 - 5。
- 28.
Salinero MC, Vela P, Sainz MJ:猕猴桃物候生长阶段(猕猴桃deliciosa“海沃德”)。Sci Hortic-Amsterdam。2009, 121(1): 27-31。10.1016 / j.scienta.2009.01.013。
- 29.
弗格森AR:猕猴桃品种:育种和选择。植物学报,1999,498:43-51。
- 30.
桑z - cortes F, Martinez-Calvo J, Badenes ML, Bleiholder H, Hack H, lacer G, Meier U:橄榄树物候生长阶段研究。中国生物医学工程学报,2002,40(2):357 - 357。10.1111 / j.1744-7348.2002.tb00167.x。
- 31.
施罗德R,阿特金森RG:猕猴桃细胞壁:对软化的理解。新西兰林业科学,2006,36(1):112-129。
- 32.
Atkinson RG, Gunaseelan K, Wang MY, Luo L, Wang T, Norling C, Johnston SL, Muddumage R, Schroder R, Schaffer RJ:猕猴桃中乙烯的作用剖析(猕猴桃对)使用acc氧化酶敲除线催熟。实验学报,2011,62(11):3821-3835。10.1093 / jxb / err063。
- 33.
Marsh KB, bolding HL, Shilton RS, Laing WA:三种猕猴桃果实发育过程中奎宁酸代谢的变化。植物学报,2009,36(5):463-470。10.1071 / FP08240。
- 34.
Atkinson RG, Gardner RC:猕猴桃的聚半乳糖醛酸酶基因。植物营养学报,2003,23(2):366 - 366。10.1104 / pp.103.2.669。
- 35.
Varkonyi-Gasic E, Moss S, Voogd C, Wu R, Lough R, Wang Y-Y, Hellens R:猕猴桃开花基因的鉴定与鉴定:序列保护及其在猕猴桃花发育中的作用。植物学报,2011,11(1):72-10.1186/1471-2229-11-72。
- 36.
Richardson AC, Marsh KB, Boldingh HL, Pickering AH, Bulley SM, Frearson NJ, Ferguson AR, Thornber SE, Bolitho KM, Macrae EA:高生长温度会降低猕猴桃中的水果碳水化合物和维生素C。植物细胞环境,2004,27(4):423-435。10.1111 / j.1365-3040.2003.01161.x。
- 37.
McRae EA, Redgwell R:猕猴桃软化。采收后新闻信息。1992,3:49-52。
- 38.
Janssen BJ, Thodey K, Schaffer RJ, Alba R, Balakrishnan L, Bishop R, Bowen JH, Crowhurst RN, Gleave AP, Ledger S,等:苹果花蕾到成熟果实发育的全局基因表达分析。中国生物医学工程学报,2008,8:16-10.1186/1471-2229-8-16。
- 39.
李文杰,李志刚,李志刚:果实发育与生理机制的关系,中国科学院学报(自然科学版),第4期。编辑:Warrington IJ, Weston GG. 1990,猕猴桃:科学与管理Ray Richards出版社和新西兰社会为Hort Sei
- 40.
Bertin N, Causse M, Brunel B, Tricon D, Genard M:番茄果实大小和成分qtl的生长过程鉴定。实验学报,2009,60(1):237-248。
- 41.
Giovannoni JJ:果实发育和成熟的基因调控。植物学报,2004,16:S170-S180。10.1105 / tpc.019158。
- 42.
Nardozza S, Boldingh HL, Richardson AC, Costa G, Marsh H, MacRae EA, Clearwater MJ:猕猴猕猴发育果实中碳含量和大小的变异。植物学报,2010,37(6):545-554。10.1071 / FP09301。
- 43.
Pratt H:中国醋栗-水果生长和成熟的季节模式,成熟,呼吸和乙烯的作用。粮食与农业科学学报,1974,25:747-10.1002/jsfa.2740250702。
- 44.
Hyodo H:猕猴桃乙烯生产1。地球物理学报,2004,26(2):379 - 379。
- 45.
冯杰,马圭尔,马凯,马凯BR:海沃德猕猴桃乙烯产量的影响因素。植物学报,2003,10:203-209。
- 46.
Vrebalov J, Ruezinsky D, Padmanabhan V, White R, Medrano D, Drake R, Schuch W, Giovannoni J:番茄成熟抑制因子(Rin)位点上果实成熟所必需的MADS-Box基因科学通报,2002,29(3):344 - 344。10.1126 / science.1068181。
- 47.
Crisosto CH, Garner D: 1-MCP抑制猕猴桃贮藏软化。易腐处理季刊,2001,108:19-20。
- 48.
regroli G,朋友P: SmartFreshSM(1-甲基环丙烯)对猕猴桃有益。植物学报,2007,753:745-754。
- 49.
麦当劳B:猕猴桃的预冷、储存和运输。1990年,奥克兰:雷·理查德出版社
- 50.
Lallu N, Searle AN, Macrae EA:早季猕猴桃成熟和处理策略的研究(猕猴桃deliciosa海沃德的简历)。粮食作物学报,1998,47(4):387-400。10.1002 / jsfa.2740470402。
- 51.
霍普克尔克G, Beever DJ, Triggs CM:猕猴桃收获时可溶性固形物浓度的变化。新热忱农业学报,1986,29(3):475-484。
- 52.
史密斯GS,克拉克CJ,博尔丁HL:猕猴桃葡萄的成分淀粉的季节性积累。植物学报,1997,19(1):19-25。
- 53.
克拉奇斯K,唐尼森H,博尔丁H,麦克雷E:myo-肌醇是主要的糖猕猴桃arguta在果实发育早期。植物学报,1998,25(1):61-67。10.1071 / PP97052。
- 54.
程昌,Seal AG, Boldingh HL, Marsh KB, MacRae EA, Murphy SJ, Ferguson AR:二倍体果实大小和数量的遗传特性猕猴桃对(猕猴桃)人口。中国生物科学,2004,38(2):344 - 344。
- 55.
张春华,张志刚,张志刚,等:一种提取松材中核糖核酸的方法。植物分子生物学学报,1993,11(2):113-116。10.1007 / BF02670468。
确认
我们要感谢Nagin Lallu在乙烯处理方面的帮助和建议,Tim Holmes的猕猴桃摄影,Ian Hallett, Linda Boyd和Anne Le Guevel的显微镜图像答:对花卉,Kerikeri研究中心的技术和果园工作人员协助采样和植物管理,以及Dave Billing帮助监测乙烯。这项工作由新西兰研究科学与技术基金会(合同编号:新西兰科学与技术基金会)资助。C06X0706)。我们要感谢Toshi Foster和Simona Nardozza对这篇论文的批判性阅读。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
ACR构思设计实验,负责果园数据分析并帮助起草稿件,HLB负责碳水化合物和酸的测量和数据分析,PAM负责采后生理和分子样本处理及表达分析,KG负责采后生理和分子样本处理,ZL帮助基因表达分析,RGA负责数据分析并帮助起草论文,KMD参与数据分析并帮助起草论文,JMB参与采后分析和解释并帮助起草论文,RJS构思和设计实验,分析数据,协调论文,帮助起草手稿。所有作者均已阅读并批准稿件
电子辅助材料
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
理查德森,a.c.,博尔丁,h.l.,麦克提,P.A.et al。二倍体猕猴桃的果实发育猕猴桃对“Hort16A”。BMC植物生物学11,182(2011)。https://doi.org/10.1186/1471-2229-11-182
收到了:
接受:
发表:
关键字
- 乙烯生产
- 水果发展
- 水果生长
- 生长素反应因子
- 肉的颜色