摘要
背景
水仙碱(Narciclasine, NCS)是一种Amaryllidaceae生物碱水仙tazetta灯泡。NCS对广泛的生物活动具有抑制作用,因此具有各种潜在的实际应用。在这里,我们研究NCS如何抑制植物根系生长。
结果
结果表明,NCS抑制细胞分裂拟南芥根尖及其对细胞分化的效果是浓度依赖性;在低浓度(0.5和1.0μM)NCS优先靶向的有丝分裂细胞周期特异性/细胞周期蛋白复合物,而在高浓度(5.0μM)KIP-相关蛋白质的NCS-刺激累积(KRP1和RP2)影响CDK复合物与角色在两个G1 / S和G2 / M期。
结论
我们的研究结果表明,NCS调节细胞分裂和分化之间的协调拟南芥根尖,因此影响胚胎后期的发育拟南芥幼苗。
背景
多细胞生物的生长和发展取决于细胞增殖,细胞分化和随后的细胞专业的时空协调[1].在植物后后期发育过程中,共给组织为主体轴两端提供新的细胞。根业中的干细胞生成过渡放大单元,该传输放大电池在近端公司中经历额外的分区,并在分配在不同小区文件中分割和扩展单元之间的边界来区分。细胞增殖,细胞周期滞留和分化之间的平衡依赖于细胞生殖器的协调,细胞周期调节剂的基因表达,后期改性和特异性蛋白水解。视网膜母细胞瘤(RB)-e2F途径是控制和情侣分区和细胞分化的最重要的调节途径之一[2那3.].E2F和DP蛋白相互作用形成活性转录因子,与各种基因启动子结合,调节细胞周期进展所需基因的表达。RB蛋白与E2F蛋白结合,掩盖了反式激活区,阻断了转录活性。这种抑制可以通过RB蛋白磷酸化释放,并由周期蛋白依赖激酶(CDKs)催化,形成功能性E2F-DP异源二聚体[2那4.-8.].
CDK活性可由多种机制调节,包括磷酸化、细胞周期蛋白降解或与CDK抑制蛋白相关[9.-12.].在一些生物体内,CDK抑制蛋白也被证明是内重复制循环的重要调节因子。哺乳动物Kip/Cip CDK抑制剂类相关蛋白已在植物中鉴定,并指定Kip相关蛋白(KRPs) [13.那14.].尽管与哺乳动物对应物序列低序列同源性,但KRPS是善意的在体外和体内均能抑制CDK活性的Kip/Cip蛋白的功能同源物[13.那15.-18].
Amarallidacae生物碱广泛存在于植物王国中,具有重要的生物学性质,如乙酰胆碱酯酶抑制活性,细胞毒性,抗肿瘤活性等[19].水仙碱(Narciclasine, NCS)是一种Amaryllidaceae生物碱水仙tazetta灯泡也存在于属雪花属那哈尼斯图斯那Leucojum那成钙那Sprekelia那斯特恩伯格和vallota.[20.].以前的研究表明,NCS具有抗氨酸[21抗病毒功能[22,抑制兔网织红细胞和酵母无细胞系统中的蛋白质合成[23,诱导某些人类癌细胞凋亡介导的细胞毒性[24],并激活胶质母细胞瘤细胞中的Rho和应激纤维[25].mclachlan等人。表明,化学结构非常接近NC的胰腺炎素诱导在药理剂量的Shsy-5Y神经母细胞瘤细胞中快速凋亡[26].这些研究主要集中在NCS的抗癌作用上,而对其在植物中的作用研究较少。近年来,人们发现NCS在植物中具有广泛的抑制作用,包括抑制水稻和大白菜的种子萌发和幼苗生长[27];以及小麦中叶绿素和叶绿体蛋白的积累[28].然而,关于NCS作用在植物细胞中的机制很少。在本研究中,我们提供证据表明,通过影响细胞分裂与分化之间的平衡,NCs抑制胚胎后发育拟南芥根技巧。
结果
NCS对课后发展的影响拟南芥根
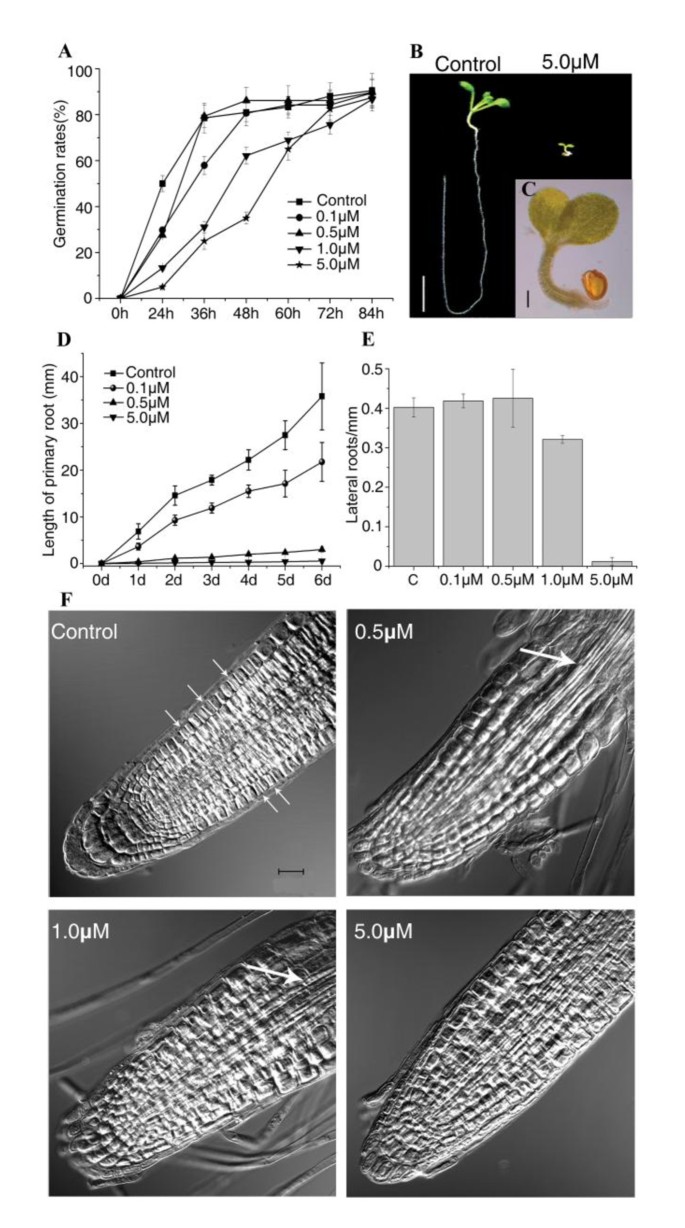
研究NCS对发展的影响拟南芥,我们首先测试了不同浓度的NCS对野生型(WT)发芽率的影响。拟南芥种子。84小时连续监测后,我们发现NCS显着延迟了胚胎出现和种子萌发。在控制介质中,超过80%的拟南芥在36小时内发芽的种子,但在含有1.0或5.0μm的培养基中,只有约20%的种子在36小时发芽(图1).此外,幼苗生长明显抑制了5.0μmncs(图1 b和1 c).在5.0 μM NCS存在时,根在萌发后停止生长,主根只生长到1.0 ~ 2.0 mm左右(图)1 c).这些结果表明,NCS抑制胚根的伸长。
NCS对胚胎后期发育的影响拟南芥根.(A)NCS对种子萌发过程中胚芽突起的抑制作用。(b)野生型拟南芥在含有0或5.0μmncs的培养基上生长的分层后10天幼苗。酒吧= 5毫米。(c)用5.0μmS处理的(b)的整个植物的特写视图。酒吧= 1毫米。(d)NCS抑制原始根伸长率。转移3日龄后测量根生长时间课程拟南芥幼苗到含ncs的培养基中。(E) NCS暴露7天后对侧根密度的影响。(A)、(D)、(E)为三次独立实验的平均值±标准差(n)≧20, p < 0.01)。(F) NCS对分生组织细胞增殖和分裂的影响。控制面板中的箭头显示了正在分裂的单元格。所有面板的bar = 50 μm。利用共聚焦显微镜的透射光探测器捕捉差分干涉对比度(DIC)图像。
为了进一步探讨NCS在胚胎后期发育中的作用,我们研究了NCS对初生根伸长和侧根密度的影响。如图所示1 d当NCS浓度为0.1 μM时,主根生长受到抑制,而5.0 μM NCS几乎完全抑制了主根生长。转入NCS后,主根的相对生长率也受到极大的抑制1:图S1A)。0.1和0.5 μM NCS对侧根密度没有影响,1.0 μM NCS对侧根密度的抑制约为21.2%,5.0 μM NCS对侧根密度的抑制几乎完全(图1)1 e).
植物形态发生依赖于受管制的细胞分裂和定向细胞扩张[29].为了检查NCS是否影响细胞分裂或细胞扩张,我们使用共聚焦显微镜检查初级根中的细胞。如图所示1 f和第二季附加文件1表S1, NCS处理后的根的分生组织细胞比对照根的大,说明NCS刺激分生组织区细胞的扩张。与对照组相比,根尖分裂细胞的数量大大减少(图)1 f)和分生组织区有丝分裂指数拟南芥根也减少了(附加文件1:图S1B)NCS处理后,表明NCS抑制细胞增殖的拟南芥的根源。结果还表明,在0.5和1.0μm的NCS处理后,血管束逐渐从上部区域逐渐延伸到根部的底部部分(图1 f和附加文件1:图S2)。然而,5.0μMNCS治疗未显示出这种表型。这意味着低浓度的NCs可以刺激根尖中的细胞分化。
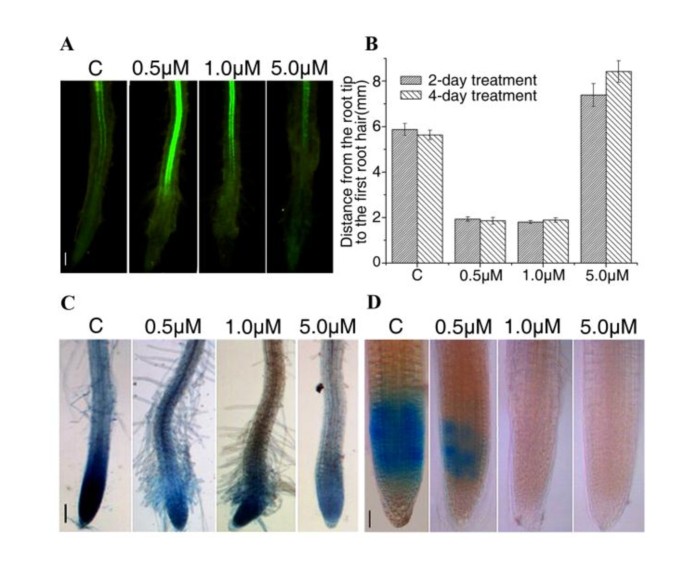
为进一步证实NCS对细胞分化的影响,选择表达拟南芥研究了GAL4增强子诱捕反式激活系J0121在分生组织区的分布。0.5或1.0 μM NCS处理2天后,根尖GFP表达增加,提示中柱鞘细胞分化受到刺激(图)2).在血管细胞的分化期间(图1 f和附加文件1:图S2),根毛从ncs处理的根的顶端区域的表皮细胞中出现,而对照根没有(图S2)2 b和2摄氏度),提示NCS可以刺激根毛的发育拟南芥根技巧。说明0.5 μM或1.0 μM NCS可直接或间接促进增殖组织中的细胞分化。在5.0 μM NCS处理下,与对照相比,GFP在根尖区表达降低(图5)2).此外,5.0 μM NCS处理后根的第一个根毛距离根尖较对照组更远(图4)2 b).这表明NCS对细胞分化的影响拟南芥根是浓度。
当细胞达到预定大小时,细胞命运(分裂、分化或其他过程)由不同的细胞周期控制蛋白和不同的信号共同控制[30.].要检查NCS如何影响细胞分裂过程,两个GUS融合线,CDKA; 1:: uidA和CYCB1:1: uidA使用。这CDKA:1启动子活动反映了细胞分裂的能力状况[31那32]并且在整个细胞周期中组成型表达[11.].相比之下,CYCB1:1启动子活性标志着从G2晚期到M期的进展[33].在转移到含ncs的培养基后的第2天和第4天,从每个品系制备全量GUS检测样品。的表达CDKA; 1在1.0和5.0μm的NCS治疗4天后被抑制(图2摄氏度).这CYCB1:1促进活动也受到抑制(图二维)在NCS治疗2天后。这些发现表明NCs可以影响细胞周期基因的表达拟南芥的根源。
我们进一步研究了静止中心(QC)标记线的表达,QC25.如附加文件所示1:图S3A,表达式QC25不受NCS的影响。当NCS治疗时拟南芥将幼苗转移到无ncs的培养基中,主根生长正常1:图S3B,C和d)。此外,NCS既不诱导的细胞死亡(附加文件1:图S4A),也不氧化应激(附加文件1:图S4B和C)拟南芥根,表明这种物质对此没有发挥有毒影响拟南芥本研究使用的浓度下的根。
荷尔蒙治疗不能救出NC的影响
摘要植物激素对植物的生长发育具有重要的影响。来研究是否被抑制拟南芥根生长是由于含有NCS培养基中的激素引起的,我们补充了具有多种植物激素的培养基:NAA,IAA,2,4-D,6-BA,KIN和GA(各自以10的浓度施用-9, 10-8, 10-7, 10-6和10-5结果表明,在0.5 μM和5.0 μM NCS处理下,上述两种激素均不能恢复根系生长1:表S2)。因此,我们得出结论,NCS对的抑制作用拟南芥根的生长不是由于缺乏这些生长调节剂引起的。
NCS对细胞周期进展的影响
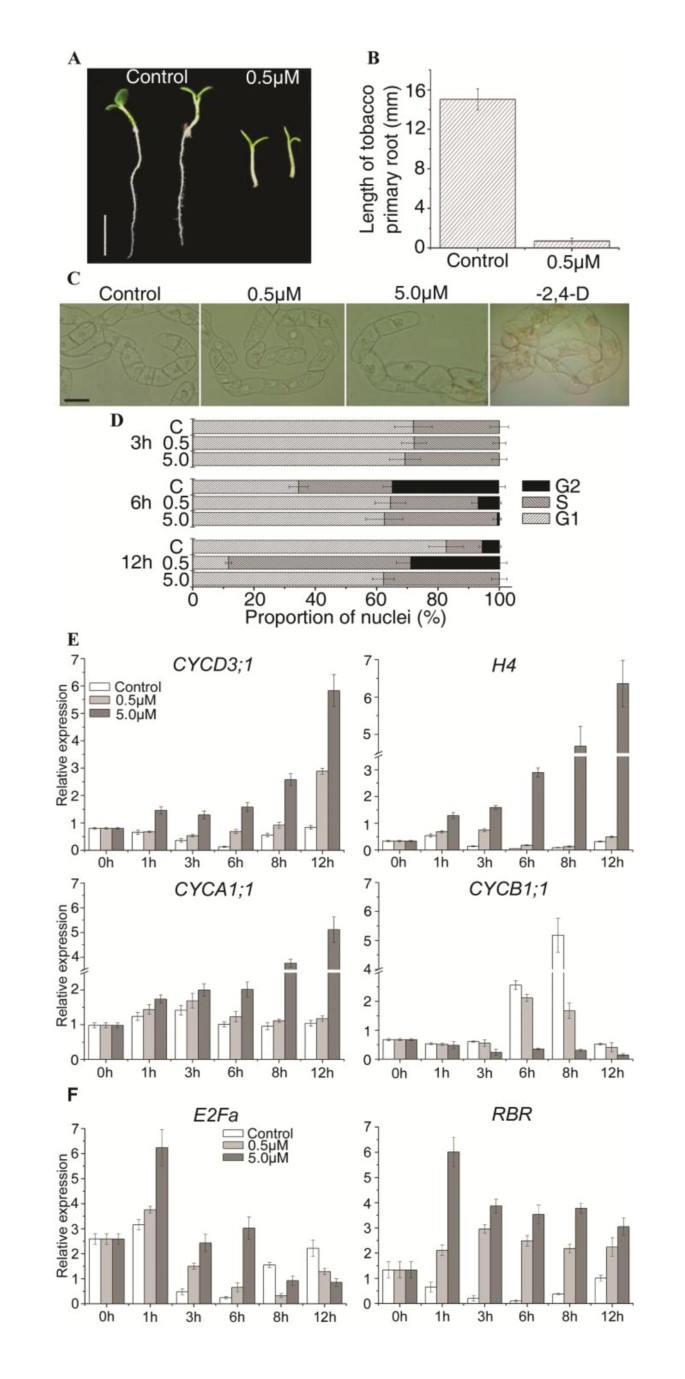
为了专门研究NCS对细胞周期进展的影响,应该使用一种允许细胞与细胞周期进展抑制剂同步的悬浮细胞系统。为此,我们选择了高度专业化的烟草(尼科尼亚塔哈瓦姆)具有广泛用于植物细胞周期研究的细胞系(BY-2)[34].
首先,NCS是否对烟草根系发育类似的抑制效果的观察拟南芥在含有0.5 μM NCS的培养基上发芽测定烟草种子的根。类似于拟南芥结果表明,NCS显著抑制烟草幼苗主根生长(图2)3和3 b).然后,我们检测了NCS处理是否影响BY-2悬浮培养细胞的分裂。以指数增长的BY-2细胞用缺乏2,4- d的培养基洗涤3 ~ 5次,然后用不同的培养基稀释等量的细胞。治疗两天后,对细胞进行拍照。如图所示3 c,在对照培养基中观察到小by-2细胞的链。虽然细胞分裂没有完全抑制,但0.5μM的NCS处理细胞比对照的大小更大(图3 c).当用5.0μm的NC处理时,大多数均达2个细胞与毒素饥饿的细胞相似大扩展(图3 c).流式细胞仪分析进一步验证了NCS处理对高度同步的BY-2细胞周期进程的影响。用不同浓度的NCS处理BY-2细胞一种Phidicolin(参见下面的方法)。有控制和NCS处理的细胞之间没有差异在3小时,这表明NCS不影响细胞进入S期阿非迪霉素的耗尽后(图3 d).处理6 h后,35.6%的对照细胞处于G2期,而0.5 μM ncs处理的细胞只有7.3%处于G2期,5.0 μM ncs处理的细胞只有0.7%处于G2期。0.5 μM NCS处理12 h后,S期核种群明显增加(图)3 d).在5.0 μM NCS处理3 h后,S相核的数量保持在35.2%左右,直到12 h都没有变化(图)3 d).在5.0μmncs治疗后G2种群的几乎完全耗尽表明,在这种情况下,很少的细胞可以将S期通过S期至G2相。为了研究NCS治疗诱导的细胞周期阻断的潜在机制,四种烟草细胞周期基因的表达,CYCD3:1那组蛋白H4那CYCA1:1和CYCB1:1采用定量逆转录PCR (qRT-PCR)检测。结果在图3 e表明在未处理的同步细胞中,CYCD3:1mRNA在0 h G1早期积累,在S期进展中下调;组蛋白H4MRNA在G1-o-S相转变为0至1小时,而CYCA1:1mRNA开始在3至6小时的中间阶段积累。的表达CYCB1:1从6至8小时的G2-至M相增加。这四个细胞周期蛋白基因的表达模式类似于先前观察到的[35],确认每个基因在细胞周期转换中的标记作用。有趣的是,通过NCS治疗改变了上述细胞周期基因的时间表情模式。0.5μmncs增加表达水平CYCD3:1那组蛋白H4, 和CYCA1:1在特定的阶段,但延迟表达的时间(图3 e).为了CYCB1:1在8 h时,0.5 μM NCS对振幅有明显的改变,而5.0 μM NCS对表达有明显的刺激CYCD3:1那组蛋白H4和CYCA1:1,并扰乱了与对照组相比的表达模式。的表达CYCB1:15.0μMNCS大大抑制。这些结果表明,细胞周期基因在BY-2细胞中的表达通过NCS干扰。为了进一步研究NCS对细胞周期的基因表达和DNA复制的影响,我们研究的mRNA水平E2Fa和RBR在同步BY-2细胞中。这E2FaNCS处理1 ~ 6 h转录本上调,8 ~ 12 h转录本下调(图)3 f).NCS处理1-12小时后,RBR转录本受到显著刺激(图)3 f),证实E2Fa/DPa对基因转录和进入S期的转录活性可能被NCS通过上调RBR表达。
NCS影响核心细胞周期基因的表达拟南芥根技巧
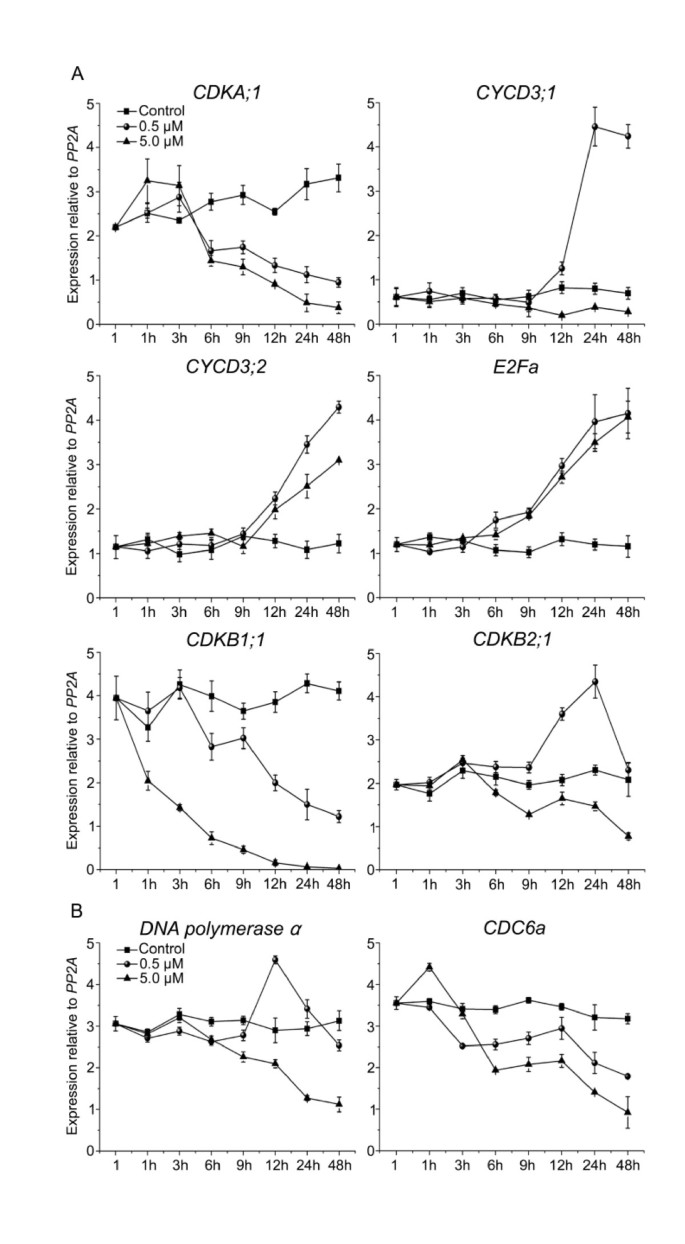
为了进一步验证我们对BY-2细胞周期基因表达的研究,我们分析了NCS对百合根尖关键细胞周期基因mRNA水平的影响拟南芥QRT-PCR幼苗。在治疗期间在八个时间点进行对植物进行取样以检查表达CDKA; 1那CYCD3:1那CYCD3:2那E2Fa那CDKB1:1和CDKB2:1(数字4).CDKA; 1转染6 h后,NCS抑制转录。的表达CYCD3:1在0.5 μM NCS处理9 h后显著增加。CYCD3:2显示了非常相似的表达式模式CYCD3:1在0.5μMNSC治疗。但是,不像CYCD3:1增加CYCD3:2在5.0 μM NCS处理下也观察到表达。如图所示4,0.5和5.0μMNCS增强E2Fa信使rna的积累。的表达CDKB2:1在0.5 μM NCS处理12和24 h时,表达量增加约2倍,在48 h时下降至对照水平,而在5.0 μM NCS处理6 h后,表达量受到抑制。CDKB1:1用NCS处理的植物中的转录水平稳定下降(图4).这些结果表明,G1/S期和G2/M期基因在拟南芥根尖受到NCS的干扰。这种扰动可能会影响细胞分化拟南芥根技巧。
以往的研究表明,细胞分裂和分化伴随着全基因组复制[36].在这项研究中,我们表明0.5和1.0μMNCS治疗刺激细胞分化拟南芥根(图1 f那2 b和2摄氏度).虽然表达了5.0μm,但抑制了5.0μm的血管细胞和根毛的分化。CYCD3:2增加了。为了测试5.0μmncs对细胞分化的影响是否是由DNA复制的抑制引起的,我们进一步分析了两个推定的E2F靶标,CDC6a和DNA聚合酶α,其启动子中含有E2F位点,参与DNA复制的起始[37].结果表明DNA聚合酶α表现出类似的变化模式CDKB2:1,即DNA聚合酶α转录在12小时的12小时下刺激0.5μm,但在48小时下抑制,并且通过5.0μMS处理显着降低(图4 b).CDC6a5.0 μM NCS处理显著降低了mRNA的表达,但在12 h前,0.5 μM NCS处理对mRNA的抑制较弱(图)4 b).这说明0.5 μM NCS在12 h前对E2Fa/DPa活性没有影响。5.0 μM NCS下调E2Fa/DPa活性影响了ORC的形成,进而干扰了DNA复制源的激活。这表明NCS可能以浓度依赖的方式影响E2Fa/DPa的转录活性。
ncs处理后CDK活性降低拟南芥根
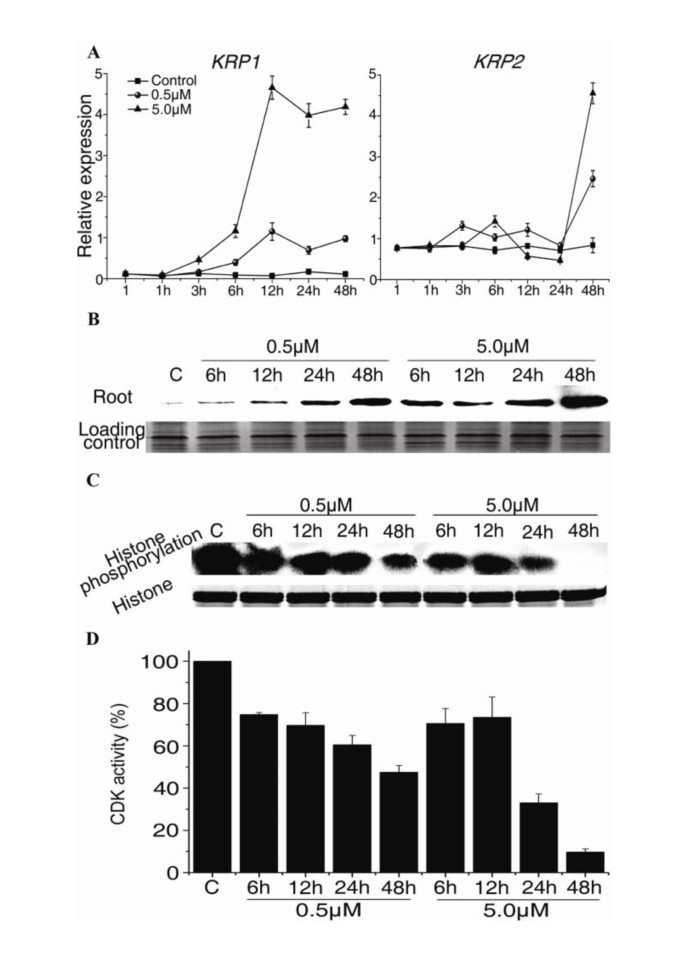
如前所述,CDKA活动决定了细胞是否经历分裂或分化[13.那38].为了分析NCS对CDKs的影响,我们检测了两种CDK抑制剂的表达,KRP1和KRP2.,qrt-pcr。KRP10.5 μM NCS轻度上调mRNA表达。相反,在5.0 μM ncs处理的根中进行强刺激(图)5).这KRP2.在NCS处理的根表达模式从不同KRP1.的表达KRP2.在24小时之前没有受到NC的影响,但在NCS治疗的48小时受到刺激(图5).
KRP1和KRP2蛋白丰度通过CDK磷酸化和蛋白酶体降解的转录后调控[39].因此,我们采用免疫印迹法检测KRP2蛋白的丰度。在0.5 μM和5.0 μM NCS处理下,观察到KRP2蛋白丰度的差异(图)5 b).在0.5 μM ncs处理的根中,KRP2水平在48 h时升高。在5.0 μM ncs处理的根中,KRP2在6 h后积累,且在6、12、24和48 h时均高于0.5 μM ncs处理的根(图2)5 b).
为了进一步确定这两种抑制剂的上调是否影响CDK活性,我们测量了P10CKS1AT结合的CDK活动拟南芥的根源。在12 h前,NCS对CDK活性有轻微抑制作用,但在0.5 μM NCS处理48 h后,CDK活性分别降至对照的45.5%和33.2%,在5.0 μM NCS处理24和48 h后,CDK活性分别降至对照的10.1%和33.2%(图2)5度和5 d).5.0 μM NCS处理根的CDK活性在24和48 h受到的抑制比0.5 μM NCS处理根的抑制更严重(图)5度和5 d).据推测,CDKB1;1通过控制KRP2蛋白丰度调控细胞分裂过程中CDKA;1的活性[39].如果是这样,KRP2蛋白的积累和在NCS治疗后观察到的CDK活性的抑制可能是由抑制引起的CDKB1; 1表达。以及细胞分化和表达的数据E2Fa下游基因拟南芥根尖,这些结果表明,与在这两个细胞分裂和分化的作用CDK /细胞周期蛋白复合物通过5.0μMNCS治疗受损,而有丝分裂CDK复合物通过在NCS 0.5μM主要针对。
讨论
NCS抑制根顶部公司中的细胞增殖
发芽需要复杂的一系列过程恢复增长和发展,当胚胎穿透种子外,通常被认为是完整的[40].在萌发过程中,由G1期退出,进入S期,根分生组织中有一部分细胞分裂先于胚根突出拟南芥[41].在本研究中,我们发现NCS显着延迟胚胎出现(图1).在先前的研究中观察到类似蚜虫苷和罗昔伐的效果。作为DNA聚合酶和CDK抑制剂,分别,蚜虫蛋白和Roscovitine显着延迟胚芽突起,表明DNA合成和CDK活性均导致胚根的伸长率在其出现期间[41].这些发现表明细胞分裂对于激进出现很重要。我们的数据也表明细胞分裂(图1 f),有丝分歧指数(附加文件1:图S1B)和G2 / M期细胞周期基因的表达拟南芥根被NCS抑制(图二维和4).P10CKS1At- 用于CDK活动拟南芥ncs减少了根源(图5度和5 d).所有这些结果都强烈表明NCS对胚胎后发育的影响拟南芥根与胚根分生组织区分裂细胞的数量减少有关。
NCS调节细胞周期基因的表达
细胞周期调节对于植物生长和发育至关重要。研究表明,植物中细胞周期进展控制的关键要素是细胞周期基因的调节[5.-7.那42].例如,Dewitte等发现的结构性过表达CYCD3:1增加了cycd3:1相关激酶的活性,减少了细胞周期G1期细胞的比例,并引起显著的发育变化[7.].此外,异位表达E2Fa诱导正常分化的子叶和下胚轴细胞持续增殖[43].Boudolf等。发现表达了占主导地位等位基因的表达拟南芥CDKB1:1基因抑制细胞分裂和增强内重复制[44].在本研究中,一些细胞周期基因在BY-2细胞中的表达(图3 e和3 f) 和拟南芥根提示(图4)受到NCS的影响。通常,刺激G1 / S期基因的表达,但NCS处理降低了G2 / M相基因的表达。对于一些细胞周期基因,例如CYCD3; 1,NCS对其表达的影响是浓度依赖的拟南芥根提示(图4).NCS对Cell循环基因在同步的-2细胞中的细胞周期基因的影响方面也存在一些差异拟南芥根技巧。例如,mRNA水平CYCD3; 15 μM NCS的影响不同(图3 e和图4A)。这可以通过两种植物细胞系统之间的差异而引起的。先前结果还表明,d型细胞周期蛋白的在BY-2细胞培养物中的表达是与在不同拟南芥细胞培养物(6)。
我们进一步发现NCS刺激了成绩单的积累KRP1和KRP2蛋白质丰富拟南芥根(图5和5 b).在这两种抑制剂的作用下,不同浓度的NCS对CDK活性的影响不同。CDK活性降低影响E2Fa/DPa的转录活性(图)4 b).这也解释了为什么0.5 μM NCS在12 h时上调了DNA聚合酶α的表达。由于CDK活性不够低,0.5 μM NCS在12 h时可能不会抑制E2Fa/DPa的转录活性(图)5度和5 d).NCS干扰G1/S和G2/M期细胞周期基因的表达显著影响胚胎后期发育拟南芥的根源。
NCS示出了通过以依赖于浓度的方式KRPS在细胞分化的不同角色
在其他真核生物中,细胞周期蛋白依赖激酶(CDKs)控制着植物的细胞周期。不同的CDK-cyclin复合物在G1-to-S和G2-to-M的关键过渡点磷酸化大量底物,分别触发DNA复制和有丝分裂的开始。在植物中,一个真正的PSTAIRE CDK,被称为CDKA,在G1-to-S和G2-to-M过渡点起着关键作用。生产过剩是消极的主导因素CDKA的拟南芥蒂利亚纳在烟草植物产生较小的工厂。然而,G1 / G2比保持不变,与观察该CDKA活性可以在两个检查点被检测到相应的[45-47].因此,CDKA在细胞周期的G1-TO-S和G2-TO-M转变中是必不可少的。植物还拥有独特的CDK,所谓的B型CDK尚未在任何其他生物中描述[48-50].在B型CDK中,CDKA中呈现的PStaire标志被PPTRRRE或PPTTLRE取代,反映了两个子组的存在,CDKB1和CDKB2 [14.].CDKB1活性对有丝分裂进程的需求已被一种主要的负性方法证明,说明CDKB1活性的降低导致4C/2C比率的增加,因为g2 - m转变受阻[47那51].我们的研究结果表明,CDK活动受到NCS的不同影响拟南芥根(图5度和5 d).虽然P10CKS1At结合的CDK的大概同时含有A型和B型CDK,所述6和12小时抑制了细胞分裂(图降低CDK活性1 f和附加文件1:图S1)。说明G2/M转变比G1/S转变需要更高的CDK活性。之前的研究表明果蝇特殊的CDK抑制剂,罗布斯(Rux),与灭活有丝分裂CDK复合物结合,有助于利用低CDK活性建立G1相[52那53].此外,发病S期的需要比有丝分裂的开始的蛋白激酶活性的一个较低的阈值,以确保一个G1细胞将自动地有丝分裂之前发起S期[54].从这种观点来看,对细胞分化的0.5或1.0μmncs的作用可能是间接效应,从而低浓度NCS对微观分割细胞中细胞周期的抑制作用可能会引发细胞分化的启动Arabidopsi根的技巧。
在一些错误表达的研究中,KRPs阻断内复制并减少细胞数量,在极端情况下导致植物矮小[13.那17那18那39那55那56].我们在…中观察到类似的现象拟南芥根,因为表达KRP1NCS提高了KRP2蛋白的丰度(图)5和5 b).然而,KRP2.在24小时之前没有通过NC刺激转录物。这意味着KRP1表达对NCS更敏感KRP2.,以及NCS的在最初的几个小时的抑制效果可通过的上调而引起KRP1.从这个角度来看,刺激KRP1可能是NCS在前几个小时内抑制细胞分裂的原因。为了验证这一点,我们在NCS治疗后检查了KRP2蛋白质丰度(图5 b).结果表明KRP1在24 h前,KRP2蛋白通过对CDK活性的作用而引起KRP2蛋白的积累KRP1Weinl等人的观察结果表明KRP1在高浓度下阻断G1/S转变,在低浓度下阻断G2/M转变[56].此外,Verkest等人报道KRP2的功能增益对植物的DNA倍性水平有正或负的影响,这取决于的水平KRP2.过度表达[39].我们的结果表明0.5 μM NCS轻度上调KRP1(数字5)和krp2(图5 b),从而引起了共和区的最早(图1 f,附加文件1:图S2和图2).相比之下,5.0μMNCS显著刺激KRP1表达(图5)和KRP2蛋白丰度(图5 b),严重抑制在24和48小时的G1 / S期进展所需的CDK活性(图5度和5 d),然后抑制细胞分化拟南芥根技巧。
在高等植物中,器官发生不断发生,大多数细胞在响应分子信号(如生长素)的作用下,保持重新进入和调节细胞周期的能力。之前的报道显示KRP1和KRP2.在NPA处理的根部的无活性自行细胞细胞中很高[32].我们最近的结果表明,极地养羊贷运输拟南芥根被NCS抑制[57].说明NCS对细胞周期进程的影响可能是由于其对生长素运输的作用。我们还发现,外源植物激素不能恢复NCS对根系发育的抑制作用(附加文件1:表S2),与一般生长素极性运输阻断剂NPA不同[58].外源激素处理可能无法挽救NCS处理的根中激素的分布和/或信号转导状态。NCS对根毛发育的影响也可能是由于其对生长素信号转导的作用,因为已有研究证实生长素参与根毛的分化[59].然而,NCS如何影响生长素信号拟南芥其根源尚待阐明。
结论
我们的结果表明,在低浓度NCS的情况下,优先抑制有丝分裂细胞周期特异性/细胞周期复合物,而在高浓度下,KRP1和KRP2蛋白的强烈积累会影响CDK / Cyclin络合物,并在G1 / S两者的影响和g2 / m阶段。因此,低浓度NCS对微观分割细胞中细胞周期的抑制作用可能引发细胞分化的启动拟南芥根技巧。NCS对G1/S和G2/M期细胞周期基因平衡的干扰显著影响了胚胎后期的发育拟南芥的根源。鉴定该天然化合物在植物细胞中的分子靶点,可能为研究根分生组织中细胞周期调控和细胞分化的调控途径提供新的思路。
方法
nc的净化
从植物中分离纯化了NCSn tazetta根据Bi等人[27].
植物材料和培养条件
这拟南芥哥伦比亚生态型(Col-0)和转基因素线CYCB1:1: uidA那CDKA; 1:: uidA(C24),QC25 :: UIDA在本研究中使用了J0121。最初,NCS对WT发芽率的影响拟南芥将种子表面消毒后,置于1/2 × MS (pH 5.7)培养基(含1.0%蔗糖、1.0%琼脂和0.1、0.5、1.0或5.0 μM NCS)培养皿中,观察种子和根的生长情况。培养皿在4°C条件下保存4天,然后转移到生长室,在生长室中,培养皿以相对于水平方向约85°的角度放置在架子上。将培养皿置于21 ~ 23℃、16/8 h光周期下保存84 h,在此期间连续观察并记录其萌发率和萌发时间。将3日龄幼苗移栽NCS 7 d后,用Image J软件(NIH, version 1.62)从平板数字图像上拍摄幼苗,测量其主根长度,并在解剖显微镜下计数侧根和侧根原基。
烟草BY-2细胞悬浮与同步性
如所述维持烟草亮黄色2(BY-2)细胞培养物[34].对于呈指数增长的-2细胞的实验,使用了3天的悬浮液。对于具有同步电池的实验,如Reichheld所描述的那样进行同步。简要地,用3μgml连续处理-1用aphidicolin (Sigma, USA)孵育24 h专门研究G1-to-S相转变[35].为了在G1-〜S相转变下用NCS处理,在去除蚜虫蛋白后,在表明浓度下加入NC。添加NCS的时间点被指定了实验的时间0。
流式细胞术
对于流式细胞术分析,通过将细胞培养1小时,用1.5%纤维素酶R-10(Yakult Company,Japan)和0.1%Morzyme R-10(Yakult Company,Japan)来制备烟草BY-2细胞的原生质体。将细胞在27℃下孵育,洗涤,并在Galbraith的缓冲液中裂解[60],通过10微米的尼龙网,用RNA酶A处理,并用碘化丙啶(50微克毫升染色过滤在1%甲醛-1).细胞分析至少使用104.EPICS流式细胞仪检测细胞核(Beckman Coulter,美国)。对于文本中给出的所有结果,如果两个群体的偏差超过5%,就被认为是显著不同的。
共聚焦显微镜
使用LSM510激光共聚焦扫描显微镜(Zeiss, Jena, Germany)捕捉共聚焦图像,使用488 nm氩气激光激发,并设置505-550 nm发射滤光片用于GFP荧光观察。
组织化学分析
如Jefferson等人所述进行GUS活性的组织化学分析。微小修改[61].撕开CYCB1:1: uidA那CDKA; 1:: uidA或QC25幼苗用NCS处理(浓度和时间如文字和图形所示),然后浸泡在GUS染色缓冲液中,其中包含1 mM X-Gluc、100 mM磷酸钠(pH7.5)、0.5 mM铁氰化钾、0.5 mM铁氰化钾、10 mM EDTA和0.1% Triton X-100。37℃孵育12 h后用70% (v/v)乙醇固定。按Willemsen等人的描述对淀粉颗粒进行染色[62].标本置于30%甘油中,在解剖显微镜下拍照。
定量逆转录PCR分析
用烟草线的100mg样品萃取总RNA,从烟草线的100mg样品,或来自CA.5毫米样本的切除根段和6天老的根尖尖端拟南芥幼苗。在PCR分析之前,用无RNase的DNase(Promega,USA)预处理总RNA以消除任何污染的基因组DNA。使用上标II逆转录酶(Invitrogen,USA)从1至2μg的总RNA合成第一链cDNA。使用Takara Sybr Premix EXTAQ制备20μl的PCR反应,其中2μL模板DNA。使用Rotor-Gene 3000仪器(Corbett,澳大利亚)进行实时热循环,下列标准循环条件:95℃,10 s,其次为40个95°C循环,5 s和60°Cs。通过转子-Cee实时分析软件6.1分析结果(构建81)。每个基因的特定引物显示在附加文件中1S1:表。
蛋白质提取和免疫印迹
长6天的根源拟南芥收获植物并立即使用,或在液氮中冷冻并储存在-70℃。通过用石英砂在均匀化缓冲液中研磨组织(50mM Tris,pH 7.2,60mMβ-甘油磷酸,15mM硝基苯基,15mM EGTA,15mM MgCl,通过将组织进行萃取蛋白质2、2 mM二硫苏糖醇、0.1 mM钒酸盐、50 mM NaF、20 μg ml-1白细胞介素,20 μg ml-1蛋白,100 μM苄脒,1 mM苯甲基磺酰氟,0.1% Triton X-100)。10000 g离心30分钟后,上清液中的蛋白用11.5%的SDS-PAGE分离,并在Immobilon-P膜(Millipore, USA)上印迹。在室温下将滤膜浸入50 mM Tris、pH 7.4、150 mM NaCl和含5% (w/v)奶粉的0.05% Tween 20(阻断缓冲液)中阻断3 h,然后在含1% (w/v)奶粉的阻断缓冲液中与KRP2(1/1000)抗体在4℃下孵育过夜。用ECL化学发光系统用1/5000稀释的辣根过氧化物酶标记的IgG检测抗原-抗体复合物。
体外激酶测定
P10CKS1At- 按照De Veylder等人所述测量CDK活性。[63]有修改。从过量的菌株纯化CKS1AT大肠杆菌根据供应商的说明,以每1g珠子的11mg蛋白浓度与CNBR-Sepharose 4B连接。P10的所得悬浮液的部分(50μL)CKS1At-琼脂糖珠用珠缓冲液(50 mM Tris, pH 7.4, 5 mM NaF, 250 mM NaCl, 5 mM EDTA, 5 mM EGTA, 0.1% Nonidet P40, 20 μg ml)洗涤-1白细胞介素,20 μg ml-1aprotein 100μM phenylmethylsulfonyl氟苯甲脒和1毫米)和提取的混合部分,如上所述,包含150μg蛋白在管,然后旋转不断在4°C 3 h。在5000 rpm和删除短暂离心后的上清液,用珠缓冲液仔细清洗三次,用激酶缓冲液(50 mM HEPES, pH 7.5, 10 mM MgCl)清洗一次2, 1 mM二硫苏糖醇),然后用于激酶测定。45],具有组蛋白作为CDK衬底。
加入号码
尼科尼亚塔哈瓦姆:[Actin2:U60495,CYCD3; 1:AB015222,E2Fa: AB025347,H4.:AB280787,Cyca1; 1: D50735,CYCB1; 1: Z37978,RBR:AB015221]
拟南芥蒂利亚纳:[pp2a.:AY099760,CDKA; 1: AB009399,CYCD3; 1: NM_119579,CYCD3; 2: NM_126126,CDKB1; 1:D10851,CDKB2; 1:nm_106304,E2Fa:AJ294534,DNA聚合酶: NM_126110,CDC6a: NM_128522,KRP1: NM_127907,KRP2.NM_114923):
缩写
- CDK:
-
细胞周期蛋白依赖性激酶
- KRP1:
-
Kip-related protein1
- KRP2:
-
Kip-related实验研究
- 多发性硬化症:
-
Murashige-skoog.
- nc:
-
水仙环素
- 兽人:
-
起源识别复杂
- RBR:
-
视网膜母细胞瘤相关
- RB:
-
视网膜母细胞瘤
- QRT-PCR:
-
定量逆转录PCR
- QC:
-
相当中心
- WT:
-
野生型。
参考
- 1。
Coffman J:细胞周期发育。通讯作者:张志强。10.1016 / s1534 - 5807 (04) 00067 - x。
- 2.
Gutierrez C,Ramirez-Parra E,Castellano MM,Del Pozo JC:G1到S转换:超过一个细胞周期发动机开关。CurrOp植物BIOL。2002,5:480-486。10.1016 / s1369-5266(02)00301-1。
- 3.
Stevaux o,Dyson NJ:E2F转录网络和RB功能的修订版图片。CurrOp植物BIOL。2002,14:684-691。
- 4.
Cooper S,Shayman Ja:在哺乳动物细胞周期中重新发现视网膜母细胞瘤蛋白磷酸化。细胞mol寿命。2001,58:580-595。10.1007 / PL00000883。
- 5.
D:植物细胞周期转变。植物生态学报。2003,6:536-543。10.1016 / j.pbi.2003.09.001。
- 6.
Dewitte W, Murray JAH:植物细胞周期。植物学报。2003,54:235-264。10.1146 / annurev.arplant.54.031902.134836。
- 7.
DEWITTE W,RIOU-KHAMLICHI C,SCOFIELD S,HEALY JMS,Jacqmard A,Kilby NJ,Murray Jah:改变细胞周期分布,增生和抑制分化拟南芥由d型细胞周期蛋白CYCD3引起acta botanica sinica(云南植物学报),2003,15:79-92。10.1105 / tpc.004838。
- 8.
Murray AW:循环利用细胞周期蛋白。细胞。2004,116:221-234。10.1016 / s0092 - 8674(03) 01080 - 8。
- 9.
Elledge SJ:细胞周期检查点:防止身份危机。科学通报。1996,32(4):457 - 461。10.1126 / science.274.5293.1664。
- 10。
内史密斯K:观点:将细胞周期按顺序排列。科学通报。1996,27(4):457 - 461。10.1126 / science.274.5293.1643。
- 11.
Mironov V,De Veylder L,Van Montagu M,inzéd:植物周期依赖性激酶和细胞分裂 - Nexus。植物细胞。1999年,11:509-522。
- 12.
Sherr CJ,Roberts JM:CDK抑制剂:G1相进展的正面和负调节剂。基因开发。1999,13:1501-1512。10.1101 / gad.13.12.1501。
- 13.
De Veylder L,Beeckman T,Beemster GTS,Krols L,Terras F,Landrieu I,Van der Schueren E,Maes S,Naudts M,Inzéd:Cyclin依赖激酶抑制剂的功能分析拟南芥.acta botanica sinica(云南植物学报). 2001,13(4):593 - 598。
- 14.
Vandepoele K,Raes J,De Veylder L,RouzéP,rombauts S,inzéd:基因组 - 核心细胞周期基因分析拟南芥.acta botanica sinica(云南植物学报),2002,14(4):593 - 598。10.1105 / tpc.010445。
- 15.
植物周期蛋白依赖性激酶抑制基因。自然。1997,386:451-452。10.1038 / 386451 a0。
- 16.
王H,QI Q,Schorr P,Cutler AJ,Crosby WL,Fowke LC:ICK1,基蛋白依赖性蛋白激酶抑制剂拟南芥蒂利亚纳与Cdc2a和CycD3相互作用,其表达由脱落酸诱导。植物学报1998,15:501-510。10.1046 / j.1365 - 313 x.1998.00231.x。
- 17.
Wang H, Zhou Y, Zhou Y, Gilmer S, Whitwill S, Fowke LC:植物周期蛋白依赖性激酶抑制剂ICK1的表达影响细胞分裂,植物生长和形态。植物学报,2000,24:613-623。10.1046 / j.1365 - 313 x.2000.00899.x。
- 18.
Zhou Y Y, Fowke LC, Wang H:植物CDK抑制剂与酵母双杂交系统中细胞周期调节因子的相互作用研究及转基因植物功能比较拟南芥植物。植物细胞代表2002,20:967-975。10.1007 / s00299-001-0434-8。
- 19.
巴斯蒂达Ĵ,LaVilla酒店R,维拉多马特F:化学和水仙生物碱的生物方面。生物碱。科德尔GA:主编。2006年,3:87-179。
- 20.
PIOZZI F,MARINO ML,FUGANTI C,MARTINO AD:Amaryllidaceae中非基本代谢物的发生。植物化学。1969,8:1745-1748。10.1016 / s0031-9422(00)85963-4。
- 21.
水仙素:水仙鳞茎中的一种抗有丝分裂物质。自然。1967,213:595-596。10.1038 / 213595 a0。
- 22.
Gabrielsen B, Monath TP, Huggins JW, Kefauver DF, Pettit GR, Groszek G, Hollingshead M, Kirsi JJ, Shannon WM, Schubert EM: Amaryllidaceae异喹啉类化合物的抗病毒(RNA)活性及相关物质的合成。王志强,王志强。10.1021 / np50089a003。
- 23.
Carrasco L,Fresno M,Vazquez D:Narciclasine:一种抗肿瘤生物碱,其通过真核核糖体阻断肽键形成。费用。1975年,52:236-239。10.1016 / 0014-5793(75)80813-1。
- 24.
Dumont P,Ingrassia L,Rouzeau S,Ribaucour F,Thomas S,Roland I,Darro F,Lefranc F,Kiss R:Amaryllidaceae Isocarbostyril Narciclasine通过激活癌细胞中的死亡受体和/或线粒体途径来诱导细胞凋亡正常成纤维细胞。瘤形成。2007,9:766-776。10.1593 / neo.07535。
- 25.
Lefranc F,Sauvage S,Goietsenoven GV,Mégalizzi,Lamoral-ins D,Debeir O,Spiegl-Kreinecker S,Berger W,Mathieu V,Decaestecker C,Kiss R:Narciclasine,植物生长调制器,激活RHO和应力纤维胶质母细胞瘤细胞。莫癌。2009,8(7):1739-1750。10.1158 / 1535-7163.mct-08-0932。
- 26.
McLachlan A,Kekre N,McNulty J,Pancratistatin Pandey:一种天然抗癌化合物,其特异性地在癌细胞中诱导细胞凋亡。细胞凋亡。2005,10:619-630。10.1007 / s10495-005-1896-x。
- 27.
毕玉玲,容克华,黄玉华:水仙碱对植物黏液的生理作用水仙tazettaL.灯泡。植物SCI。1998,135:103-108。10.1016 / s0168-9452(98)00069-7。
- 28.
Bi Yr,张LX,郭继杰,yung kh,黄yh:水痘改变叶绿体膜结构,抑制5-氨基纤维酸和叶绿素结合蛋白质积累的小麦(Triticum Aestivum.树叶)。作物学报,2003,31:335-344。10.1080 / 01140671.2003.9514269。
- 29.
张志强,王志强,王志强,等:叶原基的诱导与细胞壁蛋白膨胀蛋白的表达。中国科学:地球科学。10.1126 / science.276.5317.1415。
- 30.
泰勒CB:植物营养发育:从种子和胚到茎和根。植物学报。1997,9:981-988。10.1105 / tpc.9.7.981。
- 31。
Martinez MC,JørgensenJE,Lawton Ma,Lamb CJ,Doerner PW:空间模式CDC2.植物发育过程中分生组织活性与细胞增殖的关系。美国国家科学院学报。1992年,89:7360 - 7364。10.1073 / pnas.89.16.7360。
- 32。
Himanen K,Boucheron E,Vanneste S,De A Engler J,Inzéd,北克斯曼T:早期侧根引发期间的植物蛋白介导的细胞周期激活。植物细胞。2002,14:2339-2351。10.1105 / TPC.004960。
- 33。
费雷拉PCG,贺梅利,孟tagu MV, Inzé D:植物发育过程中细胞增殖的控制。植物营养与肥料学报。1994,26:1289-1303。10.1007 / BF00016475。
- 34。
Nagata T,Nemoto Y,Hasezawa S:烟草BY-2细胞系作为高等植物细胞生物学中的HELA细胞。INT转速cytol。1992,132:1-30。
- 35。
Reichheld JP, Chaubet N, Shen WH, Renaudin JP, Gigot C:多个a型细胞周期蛋白在细胞周期中顺序表达尼科尼亚塔哈瓦姆BY2细胞。美国国家科学院学报。1996,93:13819-13824。10.1073 / pnas.93.24.13819。
- 36.
Dewitte W,Scofield S,Alcasabas AA,Maughan SC,Menges M,Braun N,Collins C,Nieuwland J,Prinsen E,Sundaresan V,Murray Jah:拟南芥CYCD.3.D型细胞周期环节细胞增殖和终依克,是细胞蛋白反应的速率限制。美国国家科学院学报。2007,104:14537-14542。10.1073 / pnas.0704166104。
- 37.
Vandepoele K, Vlieghe K, Florquin K, Hennig L, Beemster GTS, Gruissem W, Vande Peer Y, Inzé D, de Veylder L:潜在植物E2F靶基因的全基因组鉴定。植物营养与肥料学报。2005,29(4):429 - 434。10.1104 / pp.105.066290。
- 38.
Verkest A, Weinl C, Inzé D, De Veylder L, Schnittger A:切换细胞周期。植物细胞周期调控中的kip相关蛋白。植物营养与肥料学报,2005,29(4):513 - 514。10.1104 / pp.105.069906。
- 39.
Verkest A, Manes CLO, Vercruysse S, Maes S, Van Der Schueren E, Beeckman T, Genschik P, Kuiper M, Inzé D, De Veylder L:周期蛋白依赖的激酶抑制剂KRP2控制核内重复周期的开始拟南芥通过抑制筛选CDKA叶的发展;1个激酶复合物。植物细胞。2005,17:1723-1736。10.1105 / TPC.105.032383。
- 40。
Toorop PE, Barroco RM, Engler G, Groot SPC, Hilhorst HWM:与种子休眠或萌发相关的差异表达基因拟南芥蒂利亚纳种子。Planta。2005年,221:637-647。10.1007 / s00425-004-1477-1。
- 41。
Masubelele NH,Dewitte W,Menges M,Maughan S,Collins C,Huntley R,Nieuwland J,Scofield S,Murray Jah:D型Cyclins在根顶部激活划分,以促进种子萌发拟南芥.美国国家科学院学报。2005年,102:15694-15699。10.1073 / pnas.0507581102。
- 42。
尼斯D:用于细胞周期的绿灯。Embo J. 2005,24:657-662。10.1038 / sj.emboj.7600561。
- 43。
De Veylder L, Beeckman T, Beemster GTS, De Almeida Engle J, Ormenese S, Maes S, Naudts M, Van Der Schueren E, Jacqmard A, Engler G, Inzé拟南芥E2Fa-DPa转录因子。中国海洋大学学报(自然科学版),2002,21(4):461 - 468。10.1093 / emboj / 21.6.1360。
- 44.
Boudolf V,Barrôcor,de Almeida Engler J,Verkest A,Beeckman T,Naudts M,Inzéd,de Veylder L:B1型环素依赖性激酶对于形成气孔复合物的形成至关重要拟南芥蒂利亚纳.植物细胞。2004,16:945-955。10.1105 / TPC.021774。
- 45.
Hemerly A,De Engler J,Bergousoux C,Van Montagu M,Engler G,inzéd,Ferreira P:CDC2激酶的显性负突变体免受迭代植物开发的脱离细胞划分。Embo J. 1995,14:3925-3936。
- 46.
JoubèsJ,de Schutter K,Verkest A,Inzéd,de Veylder L:有条件的,重组酶介导的,植物细胞培养物中基因的表达。工厂J. 2004,37:889-896。10.1111 / J.1365-313x.2004.02004.x。
- 47.
Porceddu A,斯托尔斯H,赖克尔德JP,塞赫尔斯G,德Veylder L,德皮尼奥BARROCO R,Casteels P,凡蒙塔古男,Inzéd,米罗诺夫五:植物特异性周期蛋白依赖性激酶参与G2的控制/中号进展植物。J Biol Chem。2001年,276:36354-36360。10.1074 / jbc.M011060200。
- 48.
Hirayama T,Imajuku Y,Anai T,Matsui M,Oka A:鉴定两种细胞周期控制CDC2基因同源物拟南芥蒂利亚纳.基因。1991,105:159-165。10.1016 / 0378 - 1119(91) 90146 - 3。
- 49.
JoubèsJ,Chevalier C,Dudits D,Heberle-Bors E,inzéd,umeda m,瑞杜jp:植物中的CDK相关蛋白激酶。植物mol biol。2000,43:607-620。10.1023 /答:1006470301554。
- 50。
Boudolf V,Rombauts S,Naudts M,Inzéd,de Veylder L:鉴定与CKS1蛋白相互作用的新型细胞周期蛋白依赖性激酶拟南芥.中国生物医学工程学报,2001,21(4):457 - 461。10.1093 / jexbot / 52.359.1381。
- 51.
Boudolf V,Vlieghe K,GTS的Beemster,匈牙利Z,阿科斯塔JAT,梅斯S,范德Schueren E,Inzéd,德Veylder L:特定植物细胞周期蛋白依赖性激酶CDKB1;1和转录因子E2Fa-DPA控制在有丝分裂和分裂细胞endoreduplicating平衡拟南芥.acta botanica sinica(云南植物学报). 2004,16(6):693 - 698。10.1105 / tpc.104.024398。
- 52.
Foley E,O'Farrell pH,Sprenger F:Rux是针对有丝分裂细胞周期蛋白CDK复合物的细胞周期依赖性激酶抑制剂(CKI)。Curr Biol。1999,9:1392-1402。10.1016 / s0960-9822(00)80084-6。
- 53.
Foley E,Sprenger F:细胞周期蛋白依赖性激酶抑制剂罗布斯参与有丝分裂出口果蝇.Curr Biol。2001,11:151-160。10.1016 / s0960-9822(01)00050-1。
- 54.
cdc2控制分裂酵母S期和有丝分裂的定量模型。流行趋势,1996,12:345-350。
- 55。
Schnitter A,Weinl C,Bouyer D,SchöbingerU,HülskampM:细胞周期蛋白依赖激酶抑制剂的misexpressionICK1 / KRP1.在单细胞拟南芥毛状体减少核内复制和细胞大小,并诱导细胞死亡。acta botanica sinica(云南植物学报). 2003,27(5):457 - 461。10.1105 / tpc.008342。
- 56。
Weinl C,Marquardt S,Kuijt SJH,俄克斯克姆,Jakoby MJ,HülskampM,Schnitter - 答:植物细胞周期依赖性激酶抑制剂的新功能ICK1 / KRP1,可作出非细胞自主和抑制分配的进入。植物细胞。2005,17:1704-1722。10.1105 / TPC.104.030486。
- 57。
na xf,hu yf,yue k,lu hx,jia pf,王hh,王xm,bi yr:narciclasine调节极性养蛋白运输拟南芥的根源。acta botanica sinica, 2017, 36(5): 769 - 774。10.1016 / j.jplph.2011.01.025。
- 58。
Casimiro I, Marchant A, Bhalerao R, Beeckman T, Dhooge S, Swarup R, Grahamb N, Inzé D, Sandbergc G, Caseroa PJ, Bennett M:生长素运输促进拟南芥侧根起始。植物学报。2001,13:843-852。
- 59。
Masucci J,Schiefelbein J:RHD6突变拟南芥蒂利亚纳通过制冷和乙烯相关方法改变根毛发生。植物生理学。1994年,106:1335-1346。
- 60。
Galbraith DW, Harkins KR, Maddox JM, Ayres NM, Sharma DP, Firoozabady E:完整植物组织细胞周期的快速流式细胞分析。中国科学:地球科学。10.1126 / science.220.4601.1049。
- 61。
杰弗森·雷,卡瓦坦塔,Bevan MW:GUS Fusions:β-葡萄糖醛酸酶作为高等植物中的敏感和多功能基因融合标记物。Embo J. 1987,6:3901-3907。
- 62。
霍比特基因是根分生组织形成的必需基因拟南芥胚胎。发展。1998,125:521-531。
- 63。
De Veylder L,Segers G,Glab N,Casteels P,Van Montagu M,inzéd:拟南芥CKS1AT蛋白质结合细胞周期蛋白依赖性激酶CDC2AAT和CDC2BAT。费用。1997年,412:446-452。10.1016 / S0014-5793(97)00822-3。
确认
作者感谢DRS。小雅陈为善意提供CYCB1:1: uidA和CDKA; 1:: uidA种子,Ben Scheres forQC25 :: UIDALaurent Laplaze为J0121种子,Lieven De Veylder为大肠杆菌用于KRP2抗体的细胞和Pascal Genschik。我们感谢Jiangqi Wen博士对稿件进行评论。该工作受到中国国家自然科学基金的财务支持(No.30670191)。
作者信息
从属关系
通讯作者
附加信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
XN设计了研究,参与了实验并起草了手稿。YH进行了免疫分析和组织化学分析。KY参与了q-RT-PCR。HL参与流式细胞术分析。PJ帮助使用共聚焦显微镜。HW和XW对实验和手稿提出了很好的建议。YB构思了这项研究,并参与了研究的设计和协调,并帮助起草了文稿。所有作者阅读并批准了最终的手稿。
小凡娜,胡雁峰贡献同样对这项工作。
电子辅料
表S1
附加文件1:。NCS对表皮细胞大小的影响拟南芥根。表S2.植物激素和NCS对大白菜主根生长的影响拟南芥.表S3.本研究使用的PCR引物列表。图S1.NCS对黄芪相对生长速率和有丝分裂指数的影响拟南芥根。图S2.NCS对血管细胞分化的影响。图S3.恢复NCS对根系发展的抑制作用。图S4.NCS的生理效应拟南芥根。(DOC 8 MB)
作者为图像提交的原始文件
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署名许可协议(http://creativeCommons.org/licenses/by/2.0.)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
呐,X.,胡,Y.,岳,K.等等。水仙碱对细胞周期进展的浓度依赖性作用拟南芥根技巧。BMC植物杂志11,184(2011)。https://doi.org/10.1186/1471-2229-11-184
已收到:
公认:
发表:
关键词
- 根发
- 拟南芥根
- 细胞周期基因
- Roscovitine
- 蚜虫蛋白