抽象的
背景
Haspin激酶是从酵母到人类的丝分裂激酶。人HASPIN是一种组蛋白H3三激酶,其在有丝分裂期间具有重要作用。此外,通过裂解酵母溶血素Thr3的组蛋白H3的磷酸化,非洲爪蟾蜍并且人类是在Centromere上积累极光B的累积,以及随后激活极光B激酶活性,用于精确染色体对准和偏析。虽然在酵母和动物中进行了广泛的霍普林分析,但有机组织中HASPIN的功能仍不清楚。
结果
在这里,我们鉴定了一个hasaspin激酶,命名为AtHaspin拟南芥.纯化的Athaspin磷酸化组蛋白H3在Thr3和Thr11中在体外.通过对BY-2细胞中AtHaspin-tdTomato和GFP-α-tubulin的活体成像显示,在细胞分裂前期和中期,AtHaspin-tdTomato定位在染色体上,在细胞分裂期间定位在细胞板周围。在BY-2细胞中,AtHaspin的定位与组蛋白H3磷酸化的Thr3和Thr11的定位重叠。在根分生组织、茎分生组织、花分生组织以及整个胚的细胞高度分裂阶段,AtHaspin-GFP在天然启动子驱动下均有表达。AtHaspin激酶结构域突变体的过表达降低了根分生组织的大小,延缓了根的生长。
结论
我们的结果表明,Haspin激酶是一个组蛋白H3苏氨酸激酶A. Thaliana..Athaspin磷酸化的组蛋白H3在THR3和THR11中在体外.表达和显性阴性分析表明,Athaspin在植物生长过程中可能在有丝分裂细胞分裂中作用。进一步分析涉及HASPIN和极光激酶的协调机制将在植物生长发育过程中对细胞分裂中染色体隔离调节的新光。
背景
有丝分裂阶段包括有丝分裂和细胞分裂,是遗传信息从一个细胞传递到另一个细胞的基本过程。有丝分裂的主要目的是将姐妹染色单体分离成两个子细胞。有丝分裂进程的调控主要依赖于两种翻译后机制;蛋白质磷酸化和蛋白质水解。细胞分裂由有丝分裂激酶调控,如周期蛋白依赖性激酶1 (CDK1), Polo家族,NIMA(从不在有丝分裂A中)和Aurora家族,以及涉及有丝分裂检查点,有丝分裂出口和细胞分裂的激酶[1].
核心组蛋白翻译后修饰在染色质结构和基因表达中起着至关重要的作用[2].尽管组蛋白H3的N-末端序列和磷酸化在真核生物中高度保守,但是染色体上的磷酸化组蛋白H3的分布模式在动物和植物之间不同。在哺乳动物细胞中,H3S10ph开始从G2相开始出现在脑大分子区域中,沿染色体周边展开至中期,然后在晚期后消失[3.].H3S28的磷酸化图案与丝分裂期间H3S10ph的磷酸化模式相似[4.那5.].因为H3S10ph和H3S28ph的空间和时间模式与染色体缩合和裂缝一致,所以认为H3S10ph和H3S28ph在动物中染色体凝结中具有至关重要的作用。相反,H3S10ph和H3S28ph在脑大学区域中发生 - 不是沿整个染色体 - 从植物中的预磷酸到后期[6.-8.].这些分布模式表明H3S10ph和H3S28ph在姐妹染色单体的凝聚和分离中起着至关重要的作用[9.].在植物中,AtAUR3 (拟南芥Aurora Kinase3)Ser10和Ser28的组磷酸酯H3在体外[8.那10.那11.].Husperadin处理对极光激酶的抑制可防止H3S10PH和H3S28ph在烟草含量和H3S10ph中拟南芥悬浮细胞[8.那12.].因此,Aurora激酶在Ser10和Ser28中磷酸化组蛋白H3在植物中。
H3T3和H3T11也磷酸化,但它们的分布模式在有丝分裂期间与H3S10ph和H3S28ph的分布模式不同。在哺乳动物细胞中,H3T3PH和H3T11ph优先在从预丙酶到后羟基丙酶中发生[13.那14.].相反,H3T3PH和H3T11ph沿植物中染色体的整个长度分布[15.那16.].Aurora激酶在Ser10和Ser28位点磷酸化组蛋白H3,但在植物中负责H3T3ph和H3T11ph的激酶尚未被识别。
首先将Haspin(单倍体胚芽细胞特异性核蛋白激酶)鉴定为小鼠的睾丸特异性基因[17.那18.].虽然睾丸中HASPIN mRNA水平最高,但在其他器官中检测到较低水平的HASPIN mRNA,表明HASPIN的表达不是真正特异的单倍体胚芽细胞[19.].人Haspin可使Thr3处的组蛋白H3磷酸化,并参与有丝分裂期间的染色体会聚[13.].人类细胞中H3T3ph的着丝粒定位和Haspin敲低表型表明,在有丝分裂过程中,Haspin是维持着丝粒内聚力所必需的[20.那21.].最近,三项研究酿酒酵母酿酒酵母那非洲爪蟾蜍,和人类揭示了导致有丝分裂激酶募集到着丝粒的新级联[22.-24.].在酿酒酵母, Haspin与内聚蛋白相互作用,内聚蛋白相关的Haspin使内着丝粒Thr3处的组蛋白H3磷酸化[22.].然后磷酸化的H3T3结合含有Aurora B的染色体乘客络合物(CPC),从而将CPC招募到内CENTROMERE [22.-24.].因此,CPC在确定用于精确染色体取向和偏析的正确的动脉卷微管附件时,并且该功能通过内厘米上的H3磷酸化调节。
Haspin的分析首先在酵母和动物中进行,虽然该蛋白在有丝分裂和细胞分裂中有作用,但Haspin在器官发生中的功能仍不清楚。在这项研究中,我们确定A. Thaliana.Haspin,表征其激酶活性,并确定其在有丝分裂中的定位。AtHaspin激酶结构域突变体的表达抑制了根的生长,提示Haspin参与了有丝分裂过程中的细胞分裂。
结果
Haspin候选基因拟南芥
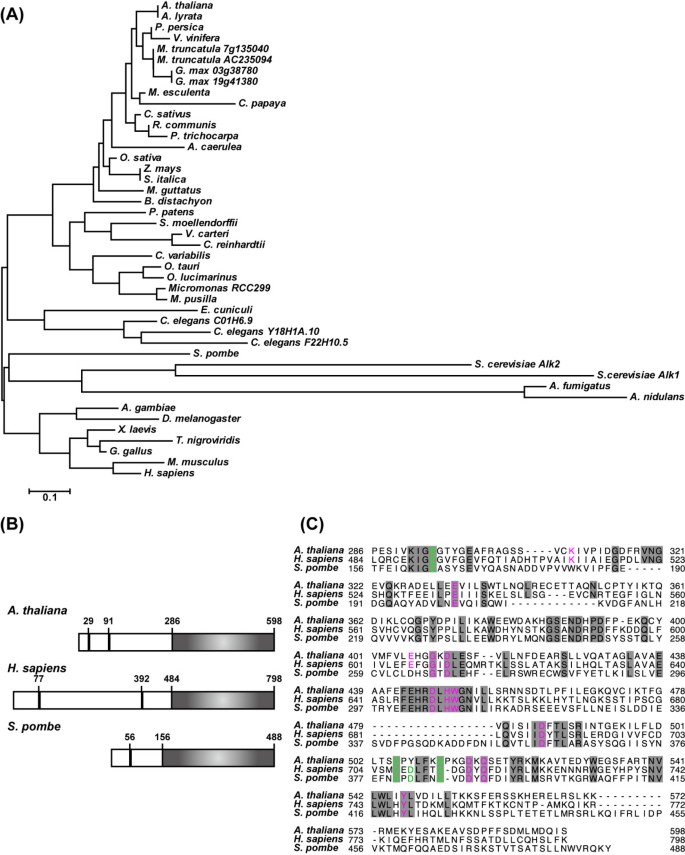
编码Haspin同源物的基因已经在包括脊椎动物、无脊椎动物、植物和真菌在内的多种真核生物中被确认,但在原核生物和古细菌中未发现[25.] (数字1A).除了秀丽隐杆线虫和酿酒酵母在美国,大多数生物只有一个哈斯普林激酶基因。在BLAST搜索A. Thaliana.(BLAST评分= 196,E-value = 3E)-50年)到人类的Haspin激酶结构域。第二基因相似性较低(BLAST评分= 46.6,E-value = 4E)-5).在一些植物物种中鉴定了一种Haspin候选基因,包括蕨类植物,苔藓和藻类(图1A).尽管发现了两种可能的基因大豆和Medicago Truncatula.,来自植物血红素的同时性分析[26.表明这些基因被复制了。在A. Thaliana.在基因组中,推测的Haspin基因(At1g09450)被指定为AtHaspin (A. Thaliana.Haspin-related基因)。Haspin蛋白的c端有一个保守的激酶结构域[27.] (数字1B.).AtHaspin cDNA的激酶结构域与人Haspin的氨基酸序列相似度为38%。最近,人类Haspin激酶结构域的晶体结构被解决[28.那29.].虽然AtHaspin在整个激酶结构域与人类的hasaspin相似度较低,但作为ATP和Mg的残基2+人和离子结合位点A. Thaliana.(数字1C.).这些数据表明,Haspin的有丝分裂激酶功能可能在植物中是保守的。
激酶结构域中HASPIN激酶的多次对准.(A)来自的激酶结构域anopheles gambiae.(EAA05110),Aquilegia caerulea(AcoGoldSmith_v1.025146m),rapidopsis rylata.(XP_002889750),拟南芥(NP_172416),来自烟曲霉属真菌(XP_751829),曲霉属真菌nidulans(XP_659658),Brachypodium distachyon(Bradi1g20070.1),秀丽隐杆线虫F22H10.5(NP_510696),C. Elegans.C01H8.9 (NP_492043),C. Elegans.Y18H1A.10(NP_490768),卡里卡番木瓜(evm.model.supercontig_48.218),衣藻reinhardtii(XP_001699957),小球藻摘要(EFN57276),Cucumis sativus(Cucsa.050880.1),黑腹果蝇(P83103),脑耳廓丘西锡(NP_597598),Gallus Gallus.(XP_425408),大豆03 g38780 (Glyma03g38780.1),g·马克斯19G41380(Glyma19G41380.1),智人(AAH47457),Manihot Esculenta.(cassava4.1_028012m),Medicago Truncatula.(AC235094_20.1),m . truncatula(Medtr7g135040.1),Mimulus guttatus(mgv1a027116m),micromonas pusilla.(XP_003057374),Micromonas RCC299(XP_002502153),亩骶(NP_034483),Physcomitrella patens.(XP_001777245),Populus Trichocarpa.(XP_002329997),碧桃(PPA015455M),栽培稻(BAC16406),Ostreococcus lucimarinus.(XP_001417826),Ostreococcus金牛座的(XP_003079484),里纳斯市政府(XP_002512572),酿酒酵母酿酒酵母YBL009WP(NP_009544),酿酒酵母ALK-1 (CAA61012),Schizosaccharomyces Pombe(CAB16874),Selaginella Moellendorffii.(XP_002986955),Setaria italica(SIPROV006697M),Tetraodon nigroviridis.(CAF92724),葡萄属vinfera(XP_002276683),Volvox carteri(XP_002952488),Xenopus laevis.(TC388096),Zea Mays.(NP_001149827)。从日本DNA数据库(DDBJ)或来自基因组数据库(植物七血管v6.0)的转录名称的登录号码在括号中给出。(b)HASPIN蛋白的氨基酸结构来自A. Thaliana.那智人,S. Pombe..黑匣子显示的是PSORT算法预测的核定位信号(http://psort.nibb.ac.jp/form.html.).灰框表示激酶结构域。(C) AtHaspin、human Haspin和裂变酵母Haspin的激酶结构域的多重比对。缺失的残基用破折号表示,相同的氨基酸用灰色表示,ATP/Mg的残基2+离子结合位点在洋红色中示出。催化裂缝中组蛋白H3磷酸化的重要残基以绿色显示。
AtHaspin在Thr3和Thr11位点磷酸化组蛋白H3在体外
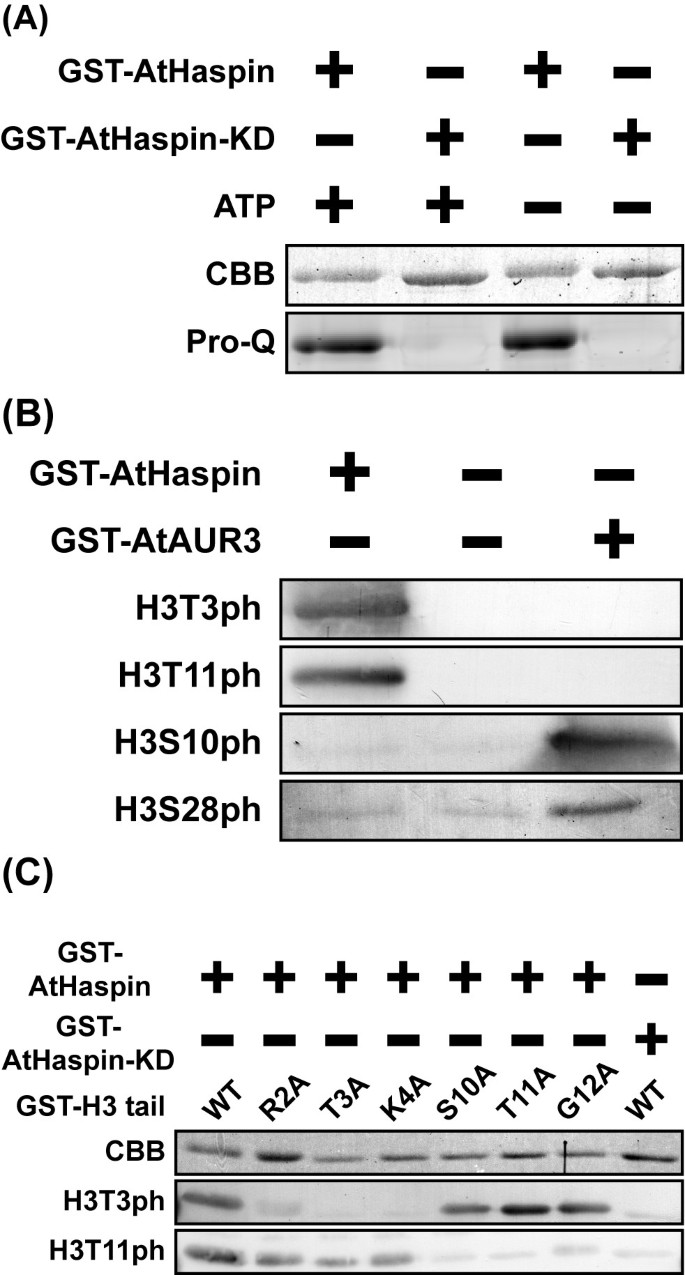
人类哈斯普林蛋白K511A,含有一个对ATP结合很重要的单一保守赖氨酸残基的突变,没有激酶活性[13.].检查纯化的GST-Athaspin是否具有激酶活动,在体外用含或不含ATP的纯化GST-AtHaspin和GST-AtHaspin KD(激酶死亡)(K309A)进行激酶检测。用ProQ金刚石磷酸蛋白染色检测磷酸化蛋白。正如预期的那样,即使在ATP存在的情况下,GST-AtHaspin-KD也没有发生自磷酸化(图)2A,第二车道)。然而,GST-AtHaspin在ATP存在或不存在时均发生自磷酸化(图)2A,第一和第三车道)。该结果表明,Athaspin的自磷酸化不依赖于添加ATP,并且该赖氨酸残留也是Athaspin自磷酸化所需的。该结果也表明GST-Athaspin在生产过程中是自磷酸化的大肠杆菌.
GST-Athaspin磷酸化组蛋白H3在Thr3和Thr11在体外.(A) GST-AtHaspin和GST-AtHaspin- kd分别加入或不加入ATP孵育,磷酸化蛋白用ProQ Diamond phospprotein染色。(B) GST-AtHaspin和GST-AtAUR3与GST-H3尾部(左右车道)孵育。阴性控制:仅GST-H3尾端(中间车道)。使用抗h3t3ph、H3T11ph、H3S10ph和H3S28ph抗体对磷酸化的GST-H3尾进行免疫染色。(C) GST-AtHaspin和GST-AtHaspin- kd以GST-H3尾部或突变体为底物孵育。用抗h3t3ph和抗h3t11ph抗体对磷酸化的GST-H3尾部进行免疫染色。
Haspin唯一已知的底物是组蛋白H3的Thr3 [13.].为了确定AtHaspin是否是组蛋白H3 Thr3激酶,我们进行了在体外使用纯化的GST-Athaspin,阳性对照(GST-Ataur3)和植物组蛋白H3作为基材的激酶测定。阳性对照,GST-Ataur3是组蛋白H3 Ser10和Ser28激酶[8.].GST-AtAUR3在Ser10和Ser28位点磷酸化组蛋白H3,而GST-AtHaspin在Thr3位点磷酸化组蛋白H3在体外.令人惊讶的是,GST-AtHaspin也使Thr11处的组蛋白H3磷酸化在体外(数字2B.).
确认针对H3T3PH和H3T11ph的抗体的特异性,在体外通过纯化的GST-组蛋白H3尾蛋白在THR3,THR11,邻近它们(ARG2,LYS4,SER10和GLY12)的几个残基中进行激酶测定。使用抗H3T3PH抗体,在正常组蛋白H3和S10A,T11A和G11A突变体的情况下检测带的条带,但在R2A,T3A或K4A突变体的情况下(图2C).使用抗h3t11ph抗体,在R2A、T3A和K4A突变体中检测到条带,但在S10A、T11A和G12A突变体中检测不到条带(图)2C).GST-AtHaspin-KD(激酶结构域突变;K309A)在Thr3和Thr11处对H3没有激酶活性在体外.这些结果表明,Athaspin激酶在Thr3和Thr11处磷酸化组蛋白H3在体外.
Athaspin在-2细胞中的亚细胞定位
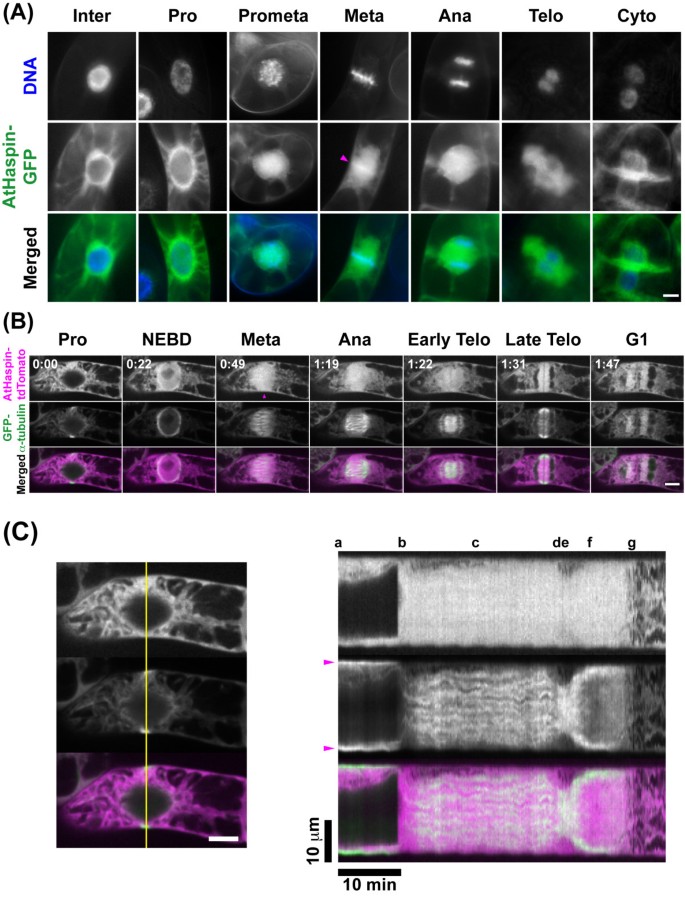
为了分析AtHaspin在细胞分裂过程中的亚细胞定位,我们进行了转化烟草简历。亮黄-2 (tobacco by -2)培养细胞与gfp融合的AtHaspin, Hoechst 33342染色,观察到烟草by -2细胞稳定表达AtHaspin- gfp(图)3A).在差间期间,Athaspin主要是在细胞质和核周边的局部化。在核包塔故障(NEBD)之后,Athaspin侵入了核区域。在中期期间,在染色体上也观察到Athaspin-GFP的荧光信号(图3A箭头)。中期后,AtHaspin-GFP随着细胞周期的进展,从最初在赤道面中心形成到向细胞外周扩展,与phragmoplastin一起定位。
活性烟草中Athaspin的亚细胞定位.(A) Hoechst 33342 DNA染色(上一行),GFP荧光(中一行),合并图像(下一行)显示DNA(蓝色)和GFP(绿色)。品红箭头表示染色体上的荧光信号。(B) 10 μM 17-β-雌二醇诱导AtHaspin-tdTomato表达GFP-α-微管蛋白48 h后,对表达GFP-α-微管蛋白的BY-2细胞进行活细胞成像。合并后的图像显示AtHaspin-tdTomato(洋红色)和GFP-α-微管蛋白(绿色)。品红箭头表示染色体上的荧光信号。附加文件中的数字表示观察时间(h: min)1.(C)左栏黄线荧光曲线。箭头表示PPB。如图(B)所示,字母表示有丝分裂阶段。比例尺:左10 μm,下10分钟。
为了分析Athaspin和Microtubules之间的关系,观察到表达GFP-α-小蛋白的转基因-2细胞,诱导诱导Athaspin-Tdtomato。在NEBD之后,Athaspin-TDTOMATO立即侵入核,而α-小管蛋白保持在核周边。在PROMetaphase和中期期间,微管组织有丝分裂主轴,而Athaspin-Tdtomato广泛分布在主轴上。在赤道板上对准的染色体上观察到Athaspin-TDTomato信号(图3B.箭头)。在后期,AtHaspin-tdTomato定位于姐妹染色单体,在末期,它定位于phragmo质体。随着细胞膜向细胞外周扩张,AtHaspin向细胞外周移动。然而,AtHaspin-tdTomato的运动与phragmoplast的运动不同3C,附加文件1).高等植物细胞分裂开始时,在细胞分裂的未来平面开始形成密集的皮层微管的前期带(pre-prophase band, PPB)。在NEBD之前,AtHaspin-tdTomato定位在细胞质上,而不在PPB上(图)3C;a,箭头),然后Athaspin-tdtomato在痣之后分散(图3C;b和c).当细胞板在末期扩张时,隔膜体在赤道板中心解聚,沿生长的细胞板边缘再聚合。尽管phragmo质体向细胞外周扩展,AtHaspin-tdTomato仍停留在细胞板周围,直到末期结束(图)3C;F)。考虑到Athaspin-Tdtomato的动态,Athaspin无法直接参与有丝分裂过程中微管的动态。
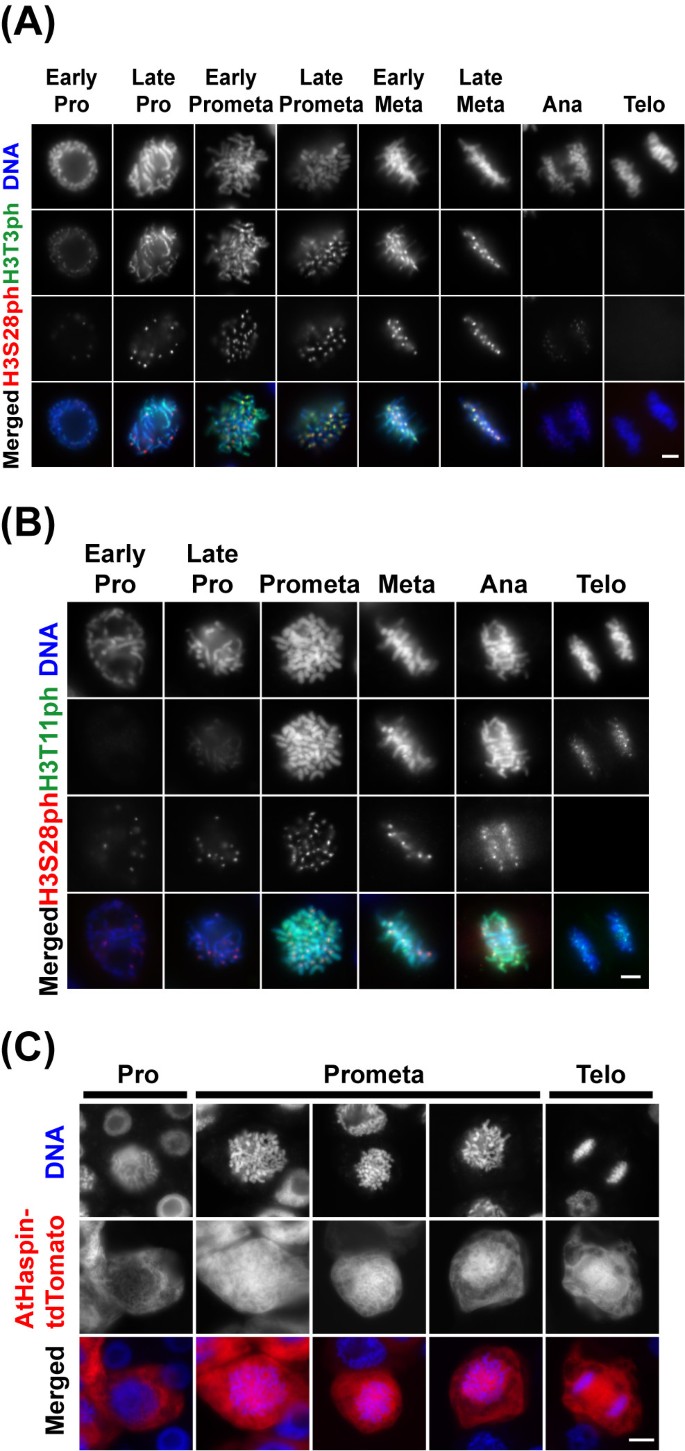
研究AtHaspin是否能使组蛋白H3在Thr3和Thr11位点磷酸化在活的有机体内,我们在BY-2细胞中使用抗h3t3ph、H3T11ph和H3S28ph抗体进行间接免疫荧光(图)4A和4B.).间期未观察到H3T3ph、H3T11ph、H3S28ph信号。在NEBD之前的早期染色体上首次检测到H3T3ph信号,而在NEBD之后的晚期染色体上首次检测到H3T11ph信号。在前期晚期,沿着染色体观察到H3T3ph信号,而H3S28ph信号则出现在着丝点周围区域。在分裂前期,H3T3ph信号在染色体中端区比在染色体臂区更强。直到中期后期,H3T3ph的信号在中心点区域增加。相比之下,磷酸化的H3T11从前期到后期完全定位于染色体上。后期染色体分离后,H3T3ph信号消失,而H3T11ph信号仍定位于染色体上。在染色体的前期和中期观察到一个中等强度的AtHaspin-tdTomato信号(图)3A和3B.箭头)。Athaspin-Tdtomato的本地化与磷酸化的H3T3和H3T11重叠,从NEBD之后直至2个细胞中的除去(图4A和4B.).
组蛋白H3在Thr3和Thr11处的磷酸化在活的有机体内.(a,b)在细胞周期期间THR3和THR11的组蛋白H3的磷酸化。使用抗H3T3PH(A),抗H3T11ph(B)或抗H3S28PH抗体免疫染色的含量-2细胞。DNA用DAPI染色。DNA(蓝色),H3S10ph(红色)和H3S28ph(绿色)的合并图像以颜色显示。秤条:10μm。(c)用10μm17-β-雌二醇诱导48小时后,用4%(w / v)多聚甲醛固定诱导Athaspin-Tdtomato的BY-2细胞20分钟。DNA用DAPI染色。合并的DNA(蓝色)和Athaspin-Tdtomato(红色)的图像以颜色显示。秤条:10μm。
然后,我们观察到Athaspin-TDTOMATO在固定的AthaSpin-TDTOMATO与多变甲醛(图)定位4C).在NEBD之前的早期,AtHaspin-tdTomato定位于细胞核周围的细胞质中(图)4C;箴)。在NEBD后的前期,AtHaspin-tdTomato包裹了整个染色体(图4C;Prometa)。这种本地化还表明Athaspin在有丝分裂期间THR3和THR11磷酸化组蛋白H3。
AtHaspin在发育器官中的表达
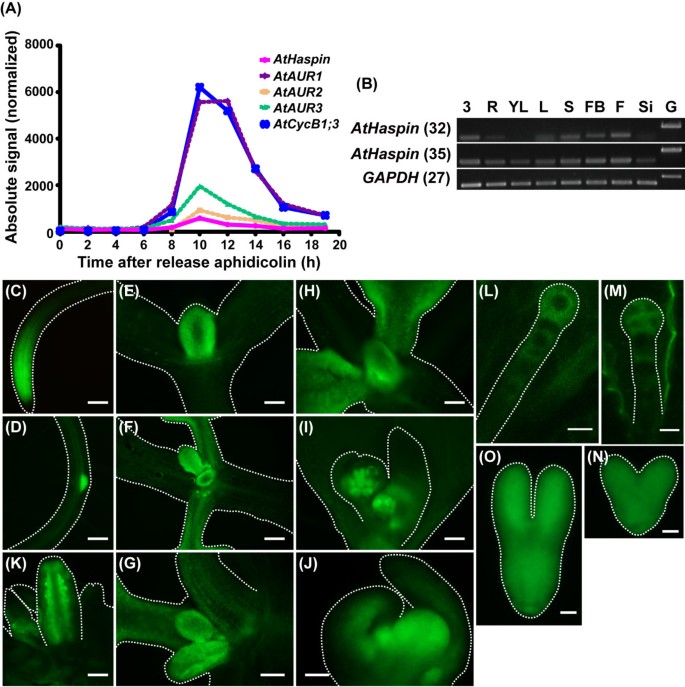
根据Genevestigator公开可用的微阵列数据[30.],阿斯帕辛在根尖和茎尖有较高水平的表达。我们使用已发表的微阵列数据集绘制了RNA谱图[31.].表达式阿斯帕辛在去除DNA合成抑制剂蚜蝶素(aphidicolin)后8 ~ 16小时被激活(图5).这个档案阿斯帕辛表达与那些非常相似哈特和有丝分裂AtCycB1; 3,表明AtHaspin是一种有丝分裂特异性激酶。RT-PCR分析显示,AtHaspin在多个组织中表达(图5 b).虽然Haspin最初被确定为小鼠睾丸特异性基因[17.那18.[该表达谱表明Athaspin不是特定于生殖的基因A. Thaliana..Athaspin在花蕾和具有高细胞分裂活动的花朵中表现出相对高的表达。
Athaspin-GFP中的表达模式拟南芥.(一)的表达阿斯帕辛那哈特年代,AtCycB1; 3在同步的有丝分裂细胞周期拟南芥培养细胞。从公开的微阵列数据获得表达数据[30.].图中显示了去除DNA合成抑制剂蚜蝶素后基因的表达。(B)从3日龄幼苗(3)、根(R)、幼叶(YL)、叶(L)、茎(S)、花蕾(FB)、花(F)、七叶(Si)和基因组DNA (G)中提取总RNA,并采用RT-PCR检测其表达情况。PCR循环数在基因名称后的括号中。GAPDH用作内部控制。(C-N) Expression of AtHaspin-GFP in root tip (C), lateral root (D), shoot meristem and leaf primordia (E-H), leaf primordia and first true leaves (F, G), leaf primordia and second true leaves (H), inflorescence meristem and floral meristem in cauline leaves (I), floral meristem (J), ovules in closed flowers (K), one-cell stage embryo (L), four-cell stage embryo (M), heart stage embryo (N), and torpedo stage embryo (O). Scale bars: 100 μm (C, D, F, H, I, J), 50 μm (E), 30 μm (G, K), 10 μm (L, M), and 20 μm (N, O).
调查Athaspin的表达模式拟南芥植物,我们在天然启动子区的控制下产生了表达Athaspin-GFP的转基因植物(Athaspin的翻译引发密码子的上游区域1672-BP)。Athaspin-GFP在单尖的分娩和原始侧,侧根(图5度和5 d),拍摄顶点,叶(图5 e-5h)和花(图5i-5k.).在胚珠中观察到Athaspin-GFP的荧光信号(图5 j).在胚胎发生期间,Athaspin-GFP在胚胎和悬浮体中从单细胞阶段表达到四个细胞阶段(图5 l和5米).AtHaspin-GFP在鱼雷阶段胚胎中持续表达(图5 n和5啊).因此,AtHaspin-GFP的表达模式与器官发育过程中的细胞分裂密切相关。
为了更详细地研究AtHaspin的亚细胞定位,我们对根尖和胚胎中的AtHaspin- gfp进行了延迟分析。间期细胞质中可见AtHaspin-GFP的荧光信号。在有丝分裂期间,AtHaspin-GFP在分裂前期侵入细胞核,并在胞质分裂时向细胞外周扩张(附文件)2那3.和4.).这些定位模式与在BY-2细胞中观察到的定位模式一致。
诱导AtHaspin-KD降低根的分生组织大小
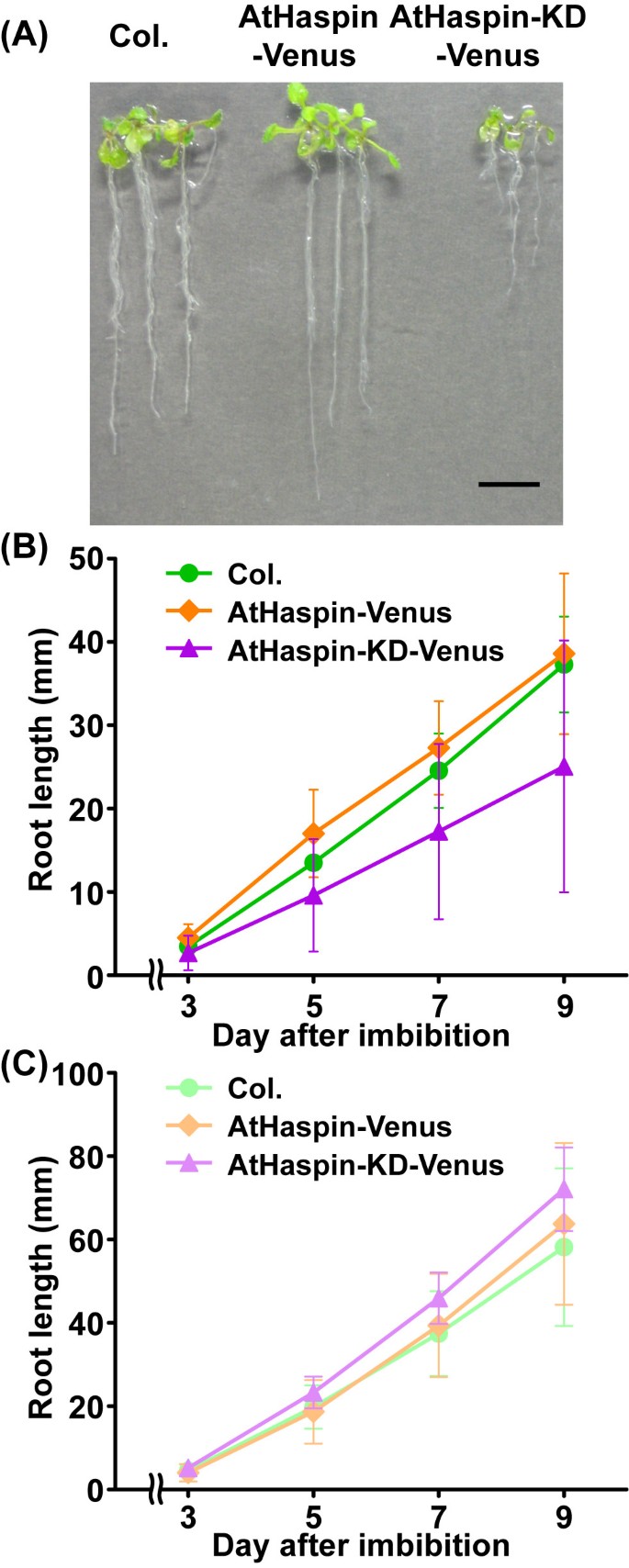
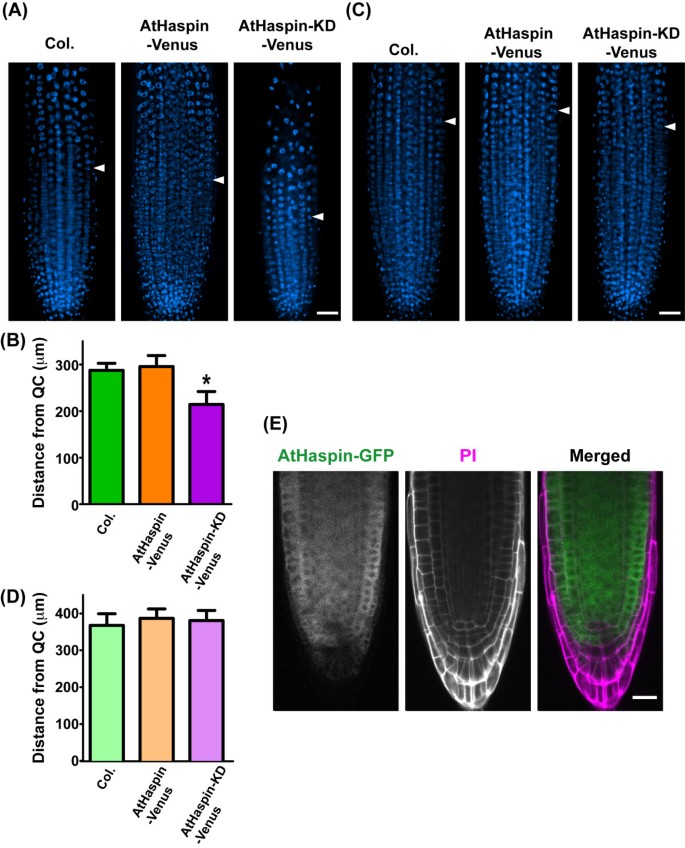
我们寻找T-DNA标记线来阐明AtHaspin的功能;但未发现AtHaspin敲除突变体。考虑到AtHaspin功能缺失突变体可能是胚胎致死的,我们利用雌二醇诱导的XVE系统构建了一个化学诱导过表达AtHaspin激酶域突变体(AtHaspin- kd)的细胞系[32.].在含10 μM 17-β-雌二醇的垂直平板上生长时,AtHaspin-KD-Venus植株的主根生长从吸吸后11 d开始下降上校.和紫菀属植物(图6和6 b).为研究AtHaspin-KD-Venus过表达对根尖细胞的影响,采用4′,6-二氨基-2-苯基吲哚(DAPI)染色,通过检测细胞的DNA倍性来观察根尖细胞的分生组织。植物的根分生组织比植物小上校.而在AtHaspin-Venus植株中,分生组织不受影响(图7一个和7 b).此外,大多数AtHaspin-KD-Venus植物的细胞板显示出异常的定向(4/5株,附加文件5.).这些结果表明,有吸白的细胞分裂对根尖中的异常细胞模式负责。在转基因植物中未观察到这些表型在不诱导Athaspin-venus和Athaspin-Kd-venus(图6摄氏度那7 c,7 d).Athaspin-GFP在商品中表达,但不在静态中心(QC)或根提示的菌内(图7 e).这些结果表明Athaspin可能在有丝分裂细胞分裂中作用。
Athaspin-KD-Venus的过度表达减少了根系的大小.(a,c)在吸收后6天,DNA用DAPI染色与诱导型Athaspin-venus和Athaspin-Kd-venus的转化体,具有(a)或不诱导(c)。箭头表示表皮中首先尾依克的位置。如材料和方法中所述估计第一内渗卵的位置。比例尺:50 μm。(b,d)从qc中的qc在表皮和细胞皮质中的第一内卵细胞与诱导型Athaspin-venus和Athaspin-kd-venus的细胞皮质(b)或没有诱导(d)的细胞皮质。显示平均值±标准错误(N= 5植物)。经Bonferroni后测的单因素方差分析表明,AtHaspin-KD-Venus过表达植物与植株之间存在显著差异上校.(P.< 0.001)。(E)除QC和根柱外,AtHaspin-GFP在根尖均有表达。细胞壁用PI染色。合并后的图像显示AtHaspin-GFP(绿色)和PI(洋红色)。比例尺:20 μm。
讨论
Athaspin在Thr3和Thr11中磷酸化组蛋白H3在体外
在本研究中,我们鉴定了一种植物Haspin激酶A. Thaliana..Haspin激酶从酵母中保存给人类。大多数生物都有一个haspin激酶基因,除了C. Elegans.和酿酒酵母.一些植物物种,包括A. Thaliana.有一个Haspin候选基因(图1A).即使在激酶结构域,AtHaspin与人类Haspin的同源性也很低(37%)。然而,激酶活性的重要残基,如与ATP/Mg相关的残基2+离子结合,是很保守的A. Thaliana.(数字1C.).
正如预期的那样,GST-Athaspin磷酸化组蛋白H3在thr3在体外.令人惊讶的是,GST-Athaspin也能够在Thr11磷酸化组蛋白H3在体外.尚不确定是裂变酵母的Haspin还是非洲爪蟾蜍Haspin可使组蛋白H3在Thr11位点磷酸化,而人Haspin可使组蛋白H3在Thr3位点磷酸化,但不能使Thr11在体外[13.那22.那24.].在Aurora激酶的情况下,由于其一致序列是(RXS/T), AtAUR3可以使组蛋白H3在Ser10位点磷酸化(A7.R.8.K.9.S.10.)和Ser28 (A25.R.26.K.27.S.28.)[33.].然而,Thr3 (A1R.2T.3.K.4.)与thr11周围不同(k9.S.10.T.11.G12.).对人HASPIN的点突变分析显示催化裂缝中组蛋白H3磷酸化的重要残留[29.].这些残留物几乎都保存在A. Thaliana.(数字1C.,绿色),人类(ASP709)之间只有一个残留物拟南芥(Tyr507)。人类Haspin突变体D709N对组蛋白H3尾部亲和力降低,H3磷酸化能力受损[29.].虽然Athaspin可以磷酸化组蛋白H3,但是其基质特异性可能比人HASPIN的底物特异性宽。在哺乳动物细胞中,DLK / ZIP激酶在TH11中磷酸化组蛋白H3在体外[14.,但没有直接证据表明它能使组蛋白H3在Thr11位点磷酸化在活的有机体内.然而,在有丝分裂过程中,Dlk/ZIP的着丝粒定位表明该激酶与H3T11ph有关。这A. Thaliana.基因组含有没有DLK / ZIP激酶脱节论,因此,Athaspin在H3 Thr11激酶中具有额外的作用A. Thaliana..
组蛋白H3在Thr3和Thr11处的磷酸化
组织H3在Ser10,Ser28,Thr3和Thr11中的丝分裂磷酸化在真核生物中高度保守。虽然在30多年前首次观察组蛋白H3的磷酸化,但这种修改的功能仍然尚不清楚[34.].在有丝分裂期间H3S10ph和染色体凝结之间存在明显的相关性,表明H3S10ph对染色体结构很重要。然而,一些物种中的染色体凝结不需要H3S10ph [35.].在动物中,H3S10ph和H3S28ph沿整个染色体发生,而H3T3PH和H3T11ph仅在脑大学区域发生。尚未表征H3T3PH和H3T11PH的功能。与动物中的情况相比,H3T3PH和H3T11ph优先沿着植物中的整个染色体分布(图4A和4B.).因此,在植物和动物的有丝分裂过程中,组蛋白H3 Ser和Thr磷酸化的定位和时间是不同的。然而,Haspin和Aurora激酶负责植物和动物中组蛋白H3磷酸化的事实表明,组蛋白H3磷酸化的功能在真核生物中是保守的。
在间期至NEBD前,与AtHaspin融合的荧光蛋白(AtHaspin- fp)定位于细胞质。AtHaspin的间期定位不同于人类的Haspin,人类的Haspin在间期定位于细胞核[36.].在NEBD之后,ATHASPIN-FP侵入核并沿染色体蔓延,整个细胞质蔓延至中期。在Prometaphase和Metaphase期间在染色体上观察到强大的Athaspin-FP信号。Athaspin-FP的本地化模式与原生启动子驱动的Athaspin-GFP的定位模式一致A. Thaliana.(附加文件2那3.和4.).虽然在BY-2 EST数据库中没有发现含有Haspin同源物的contigs [37.[Athaspin在激酶结构域中股份61%氨基酸序列同一性,来自Kazusa番茄SBM数据库的番茄散列蛋白正轨[38.],暗示Athaspin-FP的定位和动态反映了2个细胞内源性Haspin蛋白的定位和动态。
AtHaspin-FP的定位与BY-2细胞中H3T3和H3T11磷酸化的定位一致(图)3.和4.).在有丝分裂过程中,H3T3和H3T11磷酸化和去磷酸化的时间是不同的。H3T3ph在NEBD之前的早期开始,而H3T11ph在NEBD之后的早期开始。H3T3的去磷酸化发生在后期,而H3T11的去磷酸化发生在末期。这些结果表明,植物中H3T3和H3T11的去磷酸化有不同的磷酸酶。我们不能排除除AtHaspin之外还有另一个组蛋白H3 Thr3和Thr11激酶的可能性,因为AtHaspin存在于细胞质中,但在NEBD之前就检测到了H3T3ph信号。另一种可能是针对H3T3ph和H3T11ph的抗体的特异性。这在体外激酶检测显示,抗H3T3ph和H3T11ph的抗体与其他组蛋白H3磷酸化没有交叉反应(图)2B.和2C).但是,我们不知道这些抗体是否与其他组蛋白修饰反应在活的有机体内.Aurora激酶抑制剂可防止H3S10ph和H3S28ph,即使这两个磷酸化事件在烟草含量的含量在不同时间发生在烟草含量的不同时间中[8.].同样,Athaspin可以在Thr3和Thr11处磷酸化组蛋白H3在Planta..
Athaspin参与了细胞分裂
由于植物细胞壁的存在,细胞分裂,包括细胞质分裂,在植物中比在动物中更为复杂。一种植物特有的细胞骨架结构,即phragmoplast,是植物细胞质分裂完成所必需的[39.].染色体分离后,AtHaspin-tdTomato定位在phragmo质体上。尽管phragmoplasms扩展到细胞壁,AtHaspin-tdTomato仍然停留在细胞板周围(图3C;f). AtHaspin- td番茄定位和运动的动态表明,AtHaspin与细胞分裂有关。
分析拟南芥由自己的启动子驱动的Athaspin-GFP的植物表明Athaspin以根本分发,射击分类,花卉分生,以及具有高细胞分裂活动的胚胎表达。此外,Athaspin-Kd-invus的过度表达导致根生长缺陷。植物生长受细胞分裂和细胞膨胀调节,这些过程中的缺陷导致根生长延迟。细胞膨胀由微管相关蛋白(MAPS)调节[40].MAPs在微管聚合、解聚、成束和成核中发挥作用。然而,在间期和有丝分裂期间未观察到荧光蛋白融合AtHaspin的丝状结构拟南芥和BY-2细胞(图3.额外的文件1那2那3.和4.).除QC和柱状细胞外,AtHaspin- gfp在根分生组织中表达,提示AtHaspin可能在有丝分裂过程中参与细胞分裂(图)7 e).此外,在过表达Athaspin-KD-Venus的植物的根裂中观察到一些异常定向的细胞(附加文件5.).尽管需要进一步分析Athaspin的下调,但这些结果表明Athaspin-KD-Venus可能以显性负面方式抑制细胞分裂。
结论
在这项研究中,Haspin激酶A. Thaliana.鉴定为有丝分裂组蛋白H3苏氨酸激酶。AtHaspin的表达和显性阴性分析表明,AtHaspin可能在有丝分裂过程中参与细胞分裂。H3苏氨酸磷酸化的功能在动物和植物中仍然不清楚。最近的研究表明,H3T3ph酿酒酵母那非洲爪蟾蜍人HASPIN是在CENTROMERE上积累极光,并随后激活极光B激酶活性[22.-24.].因此,Athaspin和AtuT3通过H3磷酸化在有丝分裂期间调节细胞分裂。如前所述[11.那41.],通过序列相似性未在植物中发现CPC组分(incp、Survivin和Borealin/DasraB)的同源物。然而,CPC在动物和酵母中通过调控Haspin和Aurora B的染色体分离中具有重要作用[22.-24.].Haspin和Aurora激酶的功能和定位部分被保守A. Thaliana.[8.那10.-12.那42.],提示植物中存在CPC组分的功能类似物。进一步分析AtHaspin的底物及其下调机制,将为植物生长发育过程中细胞分裂的调控提供理论依据。
方法
植物材料
A. Thaliana.(生态型哥伦比亚)种子在含有半强度Murashige和Skoog Salts,Gamborg B5维生素,0.05%MES-KOH(pH 5.8)的平板上生长,在连续光下在22℃下在生长室中的1%琼脂。如先前由Kurihara等人所述维持烟草的“亮黄-2”(BY-2)细胞。[42.].
克隆
候选Haspin激酶(RAFL15-11-J01)的全长cDNA是从Riken Bioresource中心获得的[43.].通过基于PCR的诱变产生P454L的Athaspin的突变突变。用于构建GST融合蛋白,cDNA阿斯帕辛通过Gateway技术(Invitrogen公司)克隆到pDEST15表达载体中。K309A的GST-AtHaspin和GST-H3尾部表达载体的GST-H3尾部和R2A、T3A、K4A、S10A、T11A和G12A的GST-H3尾部位点突变是通过基于pcr的诱变产生的,如其他地方所述[44.].
阿斯帕辛cDNA被克隆到含有CAMV 35s启动子的SPUC-GFP载体中。用Pebis-KH2消化并连接Spuc-Athaspin-GFP,如Fujimoto等人所述。[45.].
对于诱导型表达结构,阿斯帕辛cDNA克隆到spUC-tdTomato载体[42.].对于Venus表达结构,将tdTomato替换为来自mVenus/pRSETB的Venus [46.].AtHaspin-tdTomato(或Venus)的PCR片段克隆到pX7-GFP [32.].
用于构建绿色荧光蛋白表达载体阿斯帕辛原生启动子,启动子和基因组区域被扩增A. Thaliana.基因组DNA。采用pENTR/D-TOPO克隆试剂盒(Invitrogen公司)将PCR产物克隆到pENTR中,然后通过Gateway克隆系统(Invitrogen公司)的LR反应将PCR产物克隆到pGWB4表达载体中。
在体外激酶测定
这在体外用纯化的GST-AtHaspin或GST-AtHaspin- kd、GST-histone H3尾和突变体作为底物进行激酶检测,如Kurihara等人先前所描述的[8.].
成像
用-2细胞和By-GT16细胞的转化[47.]进行了使用农杆菌-中介方法如前所述[42.].使用荧光显微镜观察稳定表达AtHaspin-GFP的转基因BY-2细胞(IX-81;奥林匹斯山)。将10 μM 17-β-雌二醇(Sigma)或0.1%乙醇(对照)添加到2日龄的细胞中诱导AtHaspin-tdTomato,然后再培养48 h。使用荧光显微镜(x -81;奥林巴斯)配备nipko盘共焦单元(CSU-X1;横河电机)。如前所述进行间接免疫荧光[42.].
花卉DIP方法用于农杆菌- 相关的拟南芥转型 [48.].转基因拟南芥使用直立荧光显微镜(BX-51; Olympus)或FluoView FV1000(Olympus)观察由本地启动子驱动的Athaspin-GFP的植物。用10μg/ ml碘化丙啶(PI)染色细胞壁。
根表型分析
对于诱导Athaspin-venus和Athaspin-Kd-venus,将10μm17-β-雌二醇(Sigma)加入到MS培养基(pH 5.8,1.5%琼脂)中,以在无菌条件下种子萌发期间诱导表达。用MBF Imagej软件测量垂直生长幼苗的根长。
根分生组织的大小由第一个内复制细胞的位置决定,这是根据其DNA含量确定的。用4%多聚甲醛和0.1% Triton X-100固定根40分钟,用含有DAPI (Partec)的CyStain染色液染色5分钟。用IX-81荧光显微镜在Z轴处取0.5 μm切片。这些2D图像使用AutoQuant X(媒体控制论)构建3D反褶积图像。利用Metamorph (Molecular Devices)计算细胞倍性。当3个DNA含量超过4C的细胞连续排列时,顶端的细胞被定义为第一个内复制细胞。采用mPS-PI法分析细胞壁模式[49.].在配备有共焦扫描单元(CSU-X1,Yokogawa Electric)的荧光显微镜(IX-81,Olympus)下获得PI-染色图像。使用GraphPad Prism 5.04 for Windows(GraphPad软件)进行统计分析(单向ANOVA,后跟Bonferroni后Hoc测试)。
缩写
- 方差分析:
-
方差分析
- 爆炸:
-
基本的局部对齐搜索工具
- BY-2:
-
明亮Yellow-2
- 中国共产党:
-
染色体乘客综合体
- DAPI:
-
4, 6-diamidino-2-phenylindole
- 美国东部时间:
-
表达序列标签
- 绿色荧光蛋白:
-
绿色荧光蛋白
- GST:
-
谷胱甘肽S-转移酶
- H3S10PH:
-
SER10中组蛋白H3的磷酸化
- H3S28PH:
-
SER28中组蛋白H3的磷酸化
- H3T3ph:
-
组蛋白H3在Thr3的磷酸化
- H3T11PH:
-
组蛋白H3在Thr11处的磷酸化
- KD:
-
激酶死
- 地图:
-
微管相关蛋白质
- 痣:
-
核膜破裂
- PFA:
-
多甲甲醛
- PPB:
-
预先出版带
- QC:
-
静止中心。
参考文献
- 1。
Nigg EA:丝分裂激酶作为细胞分裂调节剂及其检查站。NAT Rev Mol Cell Biol。2001,2(1):21-32。
- 2。
核染色质修饰及其功能。acta photonica sinica, 2012, 37(4): 593 - 598。10.1016 / j.cell.2007.02.005。
- 3.
Hendzel MJ, Wei Y, Mancini MA, Van Hooser A, Ranalli T, Brinkley BR, Bazett-Jones DP, Allis CD:有丝分裂特异的组蛋白H3磷酸化主要在G2期间的中丝粒异染色质内启动,并以与有丝分裂染色体凝聚一致的有序方式扩散。中国生物医学工程学报。1997,10(6):348-360。10.1007 / s004120050256。
- 4.
Goto H, Tomono Y, Ajiro K, Kosako H, Fujita M, Sakurai M, Okawa K, Iwamatsu A, Okigaki T, Takahashi T, et al .:组蛋白H3上一个新的磷酸化位点的鉴定与有丝分裂染色体凝聚。中国生物医学工程学报,2003,23(4):427 - 434。10.1074 / jbc.274.36.25543。
- 5。
Aurora-B磷酸化组蛋白H3在丝氨酸28与有丝分裂染色体冷凝。中国生物医学工程学报。2002,7(1):11-17。10.1046 / j.1356-9597.2001.00498.x。
- 6.
Houben A, Wako T, furusima - shimogawara R, Presting G, Kunzel G, Schubert II, Fukui K:短通讯:细胞周期依赖的组蛋白H3磷酸化与植物有丝分裂染色体的凝聚相关。植物学报,1999,18(6):675-679。10.1046 / j.1365 - 313 x.1999.00496.x。
- 7.
Gernand D, Demidov D, Houben A:组蛋白H3在28号丝氨酸和10号丝氨酸磷酸化的时间和空间模式在植物中是相似的,但在单中心和多中心染色体中是不同的。中国生物医学工程学报,2012,31(2):457 - 461。10.1159 / 000074175。
- 8.
Kurihara D,Matsunaga S,Kawabe A,Fujimoto S,Noda M,Uchiyama S,Fukui K:Aurora激酶是烟草中染色体偏析所必需的。工厂J. 2006,48(4):572-580。10.1111 / J.1365-313x.2006.02893.x。
- 9.
张X,Li X,Marshall JB,Zhong CX,Dawe RK:玉米浓缩型组蛋白H3和组蛋白H3在染色体隔离期间划分Centromere和Pericentromere。植物细胞。2005,17(2):572-583。10.1105 / TPC.104.028522。
- 10.
Demidov D,Van Damme D,GEELEN D,BLATTNER FR,Houben A:拟南芥和其他植物中两类Aurora样激酶的识别和动态。植物细胞。2005,17(3):836-848。10.1105 / TPC.104.029710。
- 11.
Kawabe A,Matsunaga S,Nakagawa K,Kurihara D,Yoneda A,Hasezawa S,Uchiyama S,Fukui K:在有丝分裂过程中植物极光激酶的表征。植物mol biol。2005,58(1):1-13。10.1007 / s11103-005-3454-x。
- 12.
deidov D, Hesse S, Tewes A, Rutten T, Fuchs J, Ashtiyani RK, Lein S, Fischer A, Reuter G, Houben A:拟南芥组蛋白H3的Aurora1磷酸化活性及其与其他翻译后组蛋白修饰的交叉对话。植物学报,2009,59(2):221-230。10.1111 / j.1365 - 313 x.2009.03861.x。
- 13。
Dai J, Sultan S, Taylor SS, Higgins JM: haspin激酶是有丝分裂组蛋白H3 Thr 3磷酸化和正常中期染色体排列所必需的。基因工程学报,2005,19(4):472-488。10.1101 / gad.1267105。
- 14。
Preuss U,Landsberg G,Scheidtmann KH:DLK / ZIP激酶介导的THR11的组蛋白H3的新型细节磷酸化。核酸RES。2003,31(3):878-885。10.1093 / nar / gkg176。
- 15.
Houben A, Demidov D, Rutten T, Scheidtmann KH:植物细胞中组蛋白H3在苏氨酸11上的新磷酸化,与有丝分裂和减数分裂染色体的缩合暂时相关。中国生物医学工程学报,2003,23(3):427 - 434。10.1159 / 000082394。
- 16.
研究了组蛋白H3中磷酸化的Thr 3和Thr 32在植物有丝分裂和减数分裂中的分布规律。中国生物医学工程学报,2008,31(1):1 -7。10.1159 / 000151319。
- 17.
田中,吉村,西西那,野崎,野岛,西敏:睾丸生殖细胞特异表达cDNA克隆的分离与鉴定。王志强,王志强,王志强,等。10.1016 / 0014 - 5793(94) 01155 - 9。
- 18.
Tanaka H,Yoshimura Y,Nozaki M,Yomogida k,Tsuchida J,Tosaka Y,Habu T,Nakanishi T,冈田M,Nojima H,等:鉴别和表征单倍体胚芽细胞特异性核蛋白激酶(Haspin)精菌细胞核及其对体细胞的影响。J Biol Chem。1999,274(24):17049-17057。10.1074 / JBC.274.24.17049。
- 19.
Haspin基因:位于整合素α e基因内含子内,整合素α来源RNA的相关转录,并在二倍体和单倍体细胞中表达。基因工程学报。2001,27(1):55-69。10.1016 / s0378 - 1119(01) 00387 - 0。
- 20.
戴J,Sullivan BA,HIGGINS JM:HASPIN和Aurora B. dev细胞的纺织物质染色体凝聚力调节。2006,11(5):741-750。10.1016 / j.devcel.2006.09.018。
- 21.
戴J,Kateneva AV,HIGGINS JM:HASPIN耗尽细胞的研究表明,有丝分裂中的纺锤体完整性需要染色体凝聚力。J Cell SCI。2009,122(PT 22):4168-4176。
- 22.
Yamagishi Y,本田T,Tanno Y,Watanabe Y:两个组蛋白标记建立内焦点和染色体双向。科学。2010,330(6001):239-243。10.1126 / Science1194498。
- 23。
Wang F, Dai J, Daum JR, Niedzialkowska E, Banerjee B, Stukenberg PT, Gorbsky GJ, Higgins JM: Haspin介导的组蛋白H3 thr3磷酸化在有丝分裂中定位Aurora B。中国科学:地球科学,2010,33(6):641 - 646。10.1126 / science.1189435。
- 24。
Kelly AE,Ghenoiu C,Xue Jz,Zierhut C,Kimura H,Funabiki H:Survivin读取磷酸化的组蛋白H3苏氨酸3,激活丝分裂激酶Aurora B.科学。2010,330(6001):235-239。10.1126 / Science.1189505。
- 25。
HIGGINS JM:HASPIN和HASPIN相关蛋白的结构,功能和演化,一种独特的真核蛋白激酶组。细胞mol寿命。2003,60(3):446-462。10.1007 / S000180300038。
- 26。
Phytozome v 6.0。[http://www.phytozome.net/]
- 27。
haspin样蛋白:一个进化上保守的假定真核蛋白激酶的新家族。中国生物医学工程学报。2001,10(8):1677-1684。10.1110 / ps.49901。
- 28.
Eswaran J,Patnaik D,Filippakopoulos P,Wang F,Stein RL,Murray JW,Higgins JM,Knapp S:结构和功能性表征非典型人类激酶Haspin。Proc Natl Acad Sci USA。2009,106(48):20198-20203。10.1073 / pnas.0901989106。
- 29.
Villa F,Capasso P,Tortorici M,Forneris F,De Marco A,Mattevi A,Musacchio A:Haspin催化结构域的晶体结构,一种非典型激酶,其族在染色质组织中。Proc Natl Acad Sci USA。2009,106(48):20204-20209。10.1073 / pnas.0908485106。
- 30.
Zimmermann P,Hennig L,Gruissem W:Genevestigator。拟南芥微阵列数据库和分析工具箱。植物理性。2004,136(1):2621-2632。10.1104 / pp.104.046367。
- 31.
Menges M,Hennig L,Gruissem W,Murray Ja:拟南芥细胞周期调节基因表达。J Biol Chem。2002,277(44):41987-42002。10.1074 / JBC.M207570200。
- 32.
郭海生,费建峰,谢强,蔡宁华:植物中一个化学调控的诱导RNAi系统。植物学报,2003,34(3):383-392。10.1046 / j.1365 - 313 x.2003.01723.x。
- 33.
Ohashi S, Sakashita G, Ban R, Nagasawa M, Matsuzaki H, Murata Y, Taniguchi H, Shima H, Furukawa K, Urano T: Phospho-regulation of human protein kinase Aurora-A: anti-phospho-Thr288单克隆抗体分析。中国肿瘤杂志。2006,25(59):7691-7702。10.1038 / sj.onc.1209754。
- 34.
Gurley LR,Walters Ra,Tobey Ra:汉闲细胞周期中组蛋白底板的顺序phsophoration。J Biol Chem。1975,250(10):3936-3944。
- 35。
组蛋白H3S10磷酸化对染色质结构的调控。中国生物医学工程学报,2006,14(4):393-404。10.1007 / s10577 - 006 - 1063 - 4。
- 36。
Haspin:中期染色体排列所需的有丝分裂组蛋白激酶。中国生物医学工程学报,2017,30(5):457 - 461。10.4161 / cc.4.5.1683。
- 37。
Matsuoka K, Demura T, Galis I, Horiguchi T, Sasaki M, Tashiro G, Fukuda H:对烟草BY-2细胞生长和分化的全面基因表达分析。植物生理学报。2004,45(9):1280-1289。10.1093 /卡式肺囊虫肺炎/ pch155。
- 38。
Kazusa Tomato SBM数据库。[http://www.kazusa.or.jp/tomato/]
- 39。
Verma DP:植物中细胞板的细胞因子和建筑物。Annu Rev植物植物植物Mol Biol。2001,52:751-784。10.1146 / annurev.arplant.52.1.751。
- 40.
Sedbrook JC,Kaloriti D:微管,地图和植物定向电池扩张。趋势植物SCI。2008,13(6):303-310。10.1016 / J.Plants.2008.04.002。
- 41.
组蛋白H3在植物中的磷酸化——一个动态的事件。生物化学学报。2007,1769(5-6):308-315。
- 42.
Kurihara D, Matsunaga S, Uchiyama S, Fukui K:活细胞成像显示植物极光激酶在有丝分裂中具有双重作用。植物生理学报。2008,49(8):1256-1261。10.1093 /卡式肺囊虫肺炎/ pcn098。
- 43.
Seki M, Narusaka M, Kamiya A, Ishida J, Satou M, Sakurai T, Nakajima M, Enju A, Akiyama K, Oono Y,等:拟南芥cDNA文库的功能注释。中国科学(d辑):地球科学(英文版)。10.1126 / science.1071006。
- 44.
Kurihara D, Kawabe A, Matsunaga S, Nakagawa K, Fujimoto S, Uchiyama S, Fukui K:植物极光激酶剪接变异的特性。植物生理学报。2007
- 45.
Fujimoto S, Matsunaga S, Yonemura M, Uchiyama S, Azuma T, Fukui K:一种定位于染色体表面的植物MAR DNA结合蛋白的鉴定。acta botanica sinica(云南植物学报),2004,56(2):225-239。10.1007 / s11103 - 004 - 3249 - 5。
- 46.
Nagai T, Ibata K, Park ES, Kubota M, Mikoshiba K, miyaaki A:一种快速和高效成熟的黄色荧光蛋白,用于细胞生物学应用。生物技术学报,2002,20(1):87-90。10.1038 / nbt0102 - 87。
- 47。
Kumagai F,Yoneda A,Tomida T,Sano T,Nagata T,Hasezawa S:由M / G1接口组织的新生微管的命运,如同步的烟草BY-2细胞所可见的,稳定表达GFP-管蛋白:时间序列观察生物植物细胞中皮质微管的重组。植物细胞生理。2001,42(7):723-732。10.1093 / PCP / PCE091。
- 48。
Clough SJ,弯曲AF:花卉浸:农杆菌介导的拟南芥转化的简化方法。工厂J.998,16(6):735-743。10.1046 / J.1365-313x.1998.00343.x。
- 49。
Truernit E, Bauby H, Dubreucq B, Grandjean O, runion J, Barthelemy J, Palauqui JC:高分辨率的三维组织组织和基因表达的全座成像使研究拟南芥韧皮部发育和结构成为可能。植物学报。2008,20(6):1494-1503。10.1105 / tpc.107.056069。
致谢
我们感谢日本BRC RAFL15-11-J01 cDNA克隆,美国博士Hasezawa提供转基因2细胞株GT-16,金星表达载体a . Miyawaki博士,博士r . y .钱的tdTomato表达载体,为pX7-GFP向量n h·蔡博士,玲子Isobe技术援助。这项工作得到了日本文部科学省(the Ministry of Education, Culture, Sports, Science and Technology of Japan)给S.M.的科学研究资助(grants in- aid for Scientific Research)和日本科学技术振兴机构(the Japan Science and Technology Agency, BIRD and Program-T to S.M.)的资助。D.K.得到了日本科学促进协会青年科学家研究奖学金的支持。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
DK构思和设计了研究,进行了实验,进行了统计分析,撰写了手稿。SM参与了本研究的设计,对根尖AtHaspin-KD过表达进行了倍性分析和观察,并对手稿草稿进行了修改。对过表达AtHaspin-KD的植物进行表型分析。TH和KF参与了这项研究的协调工作。所有作者阅读并批准了最终的手稿。
电子辅料
12870 _2011_866_moesm1_esm.mov
附加文件1:AtHaspin-tdTomato和GFP-α-tubulin在烟草BY-2细胞中的动态。10 μM 17-β-雌二醇诱导BY-2细胞48h后,AtHaspin-tdTomato(洋红色)和GFP-α-微管蛋白(绿色)在G2晚期至G1早期的动态变化。在40 ×物镜下以30秒的间隔获取图像,电影以每秒15帧(fps)的速度显示。数字表示时间(h: min)。(MOV 2 MB)
12870 _2011_866_moesm2_esm.mov
附加文件2:Athaspin-GFP的动态拟南芥根技巧。在40 ×物镜下每隔1分钟获取图像,电影以15 fps的速度显示。数字表示时间(h: min)。箭头表示有丝分裂细胞。(MOV 5 MB)
12870 _2011_866_moesm3_esm.mov
附加文件3:动态的AtHaspin-GFP拟南芥鱼雷胚。在40 ×物镜下每隔1分钟获取图像,电影以10 fps显示。数字表示时间(h: min)。箭头表示有丝分裂细胞。(MOV 3 MB)
12870_2011_866_moesm4_esm.mov.
附加文件4:动态的AtHaspin-GFP拟南芥根技巧。在100×物镜下以90-S间隔获取图像,电影显示为5 FPS。数字表示时间(h: min)。箭头表示有丝分裂细胞。(MOV 1 MB)
Athaspin-KD植物中细胞取向异常
附加文件5:。在吸吮后6天,上校.利用mPS-PI方法分析了有或没有诱导的AtHaspin-KD-Venus载体的植株和转化体。在AtHaspin-KD植物中,箭头表示横向相邻细胞间细胞壁方向的异常。比例尺:50 μm。(TIFF 3 MB)
作者为图像提交的原始文件
权利和权限
开放访问本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
Kurihara,D.,Matsunaga,S.,Omura,T.等等。植物HAPIN激酶作为组蛋白H3苏氨酸激酶的鉴定与表征。BMC植物BIOL.11,73(2011)。https://doi.org/10.1186/1471-2229-11-73
收到了:
公认:
发表:
关键词
- 根分生组织
- 激酶测定
- Aurora激酶
- Pericentromeric地区
- 原生启动人员