抽象的
背景
质体基因组(或cpDNA)多态性特征是植物系统地理学、种群遗传学和法医学分析的常用方法,但检测cpDNA变异有时具有挑战性,限制了这一方法的应用。在本研究中,我们筛选了橄榄树(齐墩果欧洲公司通过对具有不同cpDNA谱系的树的完整质体基因组进行测序。我们的目标是开发新的标记物,用于快速分析地中海橄榄树cpDNA单倍型(通过多重pcr)。
结果
八个完整的cpdna基因组olea.是测序德诺维.橄榄CPDNA谱系之间的核苷酸差异低,不超过0.07%。基于这些序列,开发标记物用于研究两个单一核苷酸取代和62个区域的长度多态性(具有可变微卫星基序或其他诱导)。然后,它们用于基因型cpdna变异在栽培和野生地中海橄榄树(315个体)中。在该样品上检测到四十个多晶型基因座,允许22个单倍型属于称为E1,E2和E3的三种地中海CPDNA谱系。对于培养的单倍型,培养的橄榄树,CpDNA变异的区分力特别低,但在野生种群中检测到更多的多样性。
结论
提出了一种快速鉴定地中海橄榄种质的方法。栽培橄榄树的低变异表明cpDNA变异用于法医分析仅限于罕见的单倍型。与此相反,野生群体cpDNA的高变异表明我们的标记可能有助于系统地理学和群体遗传学研究O. Europaea.
背景
在过去的几十年里,重大的技术革新使得基因组分析的各种方法得到了快速发展。这导致了从系统地理重建到法医分析和物种鉴定的各种应用[1那2].在植物中,许多研究专注于细胞器基因组(即,Plastid DNA - CpDNA - 和线粒体DNA - MTDNA),六个主要原因:(我)这些基因组通常是单亲本遗传的(从母亲或父亲),因此可以在没有重组效应的情况下研究种子或花粉的基因传播[3.];(2)它们的单倍体性质有助于它们的测序,通常不需要克隆;(III)这样的基因组更容易受到随机事件的影响,因为它们的有效种群规模是二倍体基因组的一半,这使它们能够更准确地检测进化事件,例如在最后一次冰期期间,在保护区残余种群长期存在[4.].此外,母体遗传基因组的分散(仅由种子传播)发生在比核基因组短的较短地理距离。细胞石基因组中的降低的基因分散和高遗传漂移的结果是一般明显明显的地理结构,促进了植物地理分析以及追踪栽培物种或侵入性群体的起源[3.];(IV.)它们每种细胞显示大量相同的副本[5.],这可能代表法医分析的显着优势;(v),它们是圆形的,由双层膜包膜保护,这使得它们能抵抗外切酶,不易被内切酶降解(法医的另一个优势;[6.]);和 (6)它们的突变率比核基因组低[7.那8.[通常需要这种稳定性来进行可追溯性分析(虽然见下文)。
橄榄树(齐墩果欧洲公司(木犀科)是最古老的木本作物之一,如今是地中海地区主要的栽培物种之一[9.].最近,人们利用不同的分子技术研究了这个物种的起源,包括观察细胞器变异[10.-15.].这些以前的研究允许检测7个主要的cpDNA谱系O. Europaea复杂(对于橄榄树分类,请参阅[16.]):在地中海地区和撒哈拉山脉中检测到谱系E2,谱系E2和E3特异于西部地中海地区,谱系M仅在Macaronesia中检测到,从亚洲南部到东非和血统观察到亚洲人C1和C2。A是热带非洲橄榄的特征[15.].在这些研究中遇到的一个局限性是地中海橄榄树中cpDNA和mtDNA多态性水平特别低。到目前为止,只有7个单倍型被检测到不同的基因座组合[17.那18.].这些单倍型属于谱系E1、E2和E3(即每个谱系有两个或三个单倍型[15.])。最近,第一橄榄塑体基因组(CPDNA)被释放[18.].为了检测栽培橄榄树的多态性,Mariotti和同事分析了21个cpDNA片段的序列变异[18.].可变微卫星(也称为简单序列重复; SSR),重复或非重复区域中的插入/缺失(吲哚)和单核苷酸多态性(SNP),并允许鉴定六个CPDNA单倍型(或氯型)一套30种栽培的橄榄树,但与之前的研究相比,他们没有发现新的变体[17.].在地中海谱系中检测到的低CPDNA变异阻碍了这些标记的任何应用,特别是对于橄榄油的可追溯性或真实性进行可追溯性[17.].这种低水平的cpDNA多态性已经在其他栽培木本物种中观察到,如李属鸟结核[19.],葡萄[20.),Pinus Pinea.[21].这可能是由于人类分散了源自减少基因库的栽培基因型。此外,在森林树木中也有低cpDNA多态性的报道,这也可能是由于长寿生物体的低突变率[22-24].然而,在野生橄榄中检测到的cpDNA变异高于栽培橄榄,这使得一些群体遗传分析得以进行,例如在野生橄榄中Laperrinei.和瓜察分别来自撒哈拉山脉和加那利群岛的亚种[25-27].
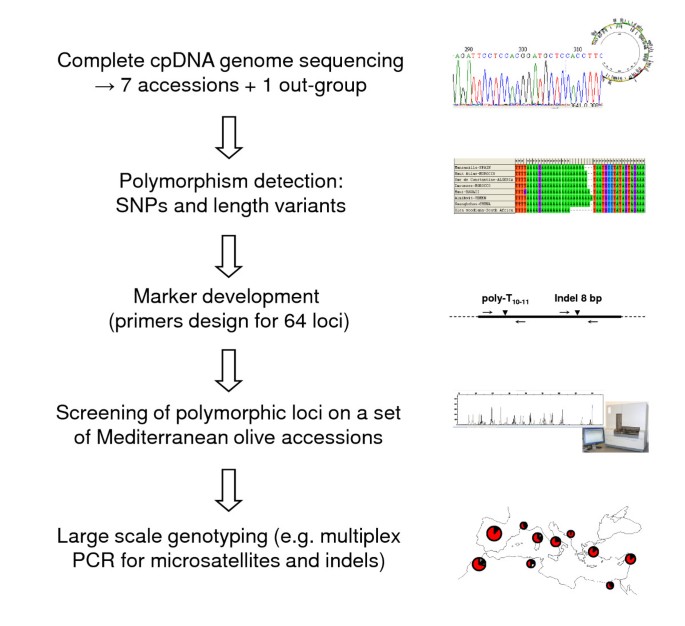
需要额外的调查来通过测试新标记来最大化橄榄树中的CPDNA单倍型鉴定(特别是多铝基微卫星[28)。在这里,我们应对这一挑战。首先,我们对7个叶绿体基因组进行了测序O. Europaea加入,包括一个西班牙品种('manzanilla de sevilla')和六棵野生橄榄树。选择这些分类群代表以前在橄榄树综合体中报告的七个谱系[15.].我们也报道了完整的质体基因组o . woodiana,属于组的一个分类单元。Ligustrodes.,这是姐姐的思考O. Europaea[29].其次,基于这些基因组序列,我们开发了一种快速和常规表征的方法,其长度变化在62个区域加上两种切割的扩增多态性序列基因座(盖子)。使用这种方法表征了一套186种品种(包括主要品种和局部类型)以及五个遥远的野生橄榄树种群(129个个体)。基于观察到的多态性,我们提出了一种优化的底漆,以检测地中海单倍型。我们还讨论了这种方法对法医分析以及橄榄树复合物的讲解分析的效用。
结果与讨论
在该研究中,在登录号FN650747,FN996943,FN99644,FN996972,FN997650,FN997651,FN998900和FN998901中测序八个完全橄榄树体积基因组并沉积在Genbank / Embl中。多态性用于开发新标记以扫描CPDNA变异。这些基因座用于表征栽培和野生橄榄树,以评估其效用以获得法医和神话研究。我们的一般方法总结在图中1.
橄榄树叶绿体基因组的变异
cpDNA基因组大小在155,531个碱基对(bp;血统C2;Almhiwit 5.1)和155,896 bp(谱系M;Imouzzer S1)。正如Besnard & Bervillé所怀疑的那样[30.]基于RFLPS,在七个橄榄树CPDNA基因组中观察到两个长的诱导:342bp删除(在ycf在谱系E3(GUÉDENCLANTANE20)中观察到1个基因,而225bp删除(在TRN.问:石头剪刀在南亚的两个人(谱系C1和C2)中检测到16个代际间隔物。另外,还发现了15个较小的吲哚(即,不包括微卫星基序,不包括微卫星基质)。Five of these indels correspond to the presence/absence of a repeated motif of seven to 12 bp (i.e., composed of one or two motifs; located at nucleotide 7,328, 9,526, 14,693, 83,196 and 85,059 in the 'Manzanilla de Sevilla' sequence; see GenBank/EMBL accession no FN996972).
序列变异较小,7个橄榄质体基因组共218个替换。Gué de Constantine 20(阿尔及利亚)和Almhiwit 5.1(也门)的cpDNA基因组最多检测到106个(0.07%),而广州1号(中国)和Almhiwit 5.1(也门)的cpDNA基因组仅检测到34个(补充文件)1).的质体基因组o . woodiana与七个相比,在417和432次替换(<0.28%)之间显示O. Europaea基因组。再一次,如果我们考虑到部分之间的差异,这种变化水平是非常低的olea.(O. Europaea) 和Ligustrodes.(o . woodiana)估计介于14至2200万年(我的; [29])。根据这些结果,cpDNA取代率估计在1.2 × 10之间-102 × 10-10在olea.子根属,大约比对于塑性基因组报告的典型突变率大约十倍[7.].这种缓慢的分子进化可能与橄榄树的长世代有关[23那24].
结果表明,“Frantoio”(GenBank/EMBL accession GU931818, GenBank/EMBL accession GU931818, GenBank/EMBL accession GU931818, GenBank/EMBL accession GU931818;意大利;[18.])和'Manzanilla de Sevilla'(西班牙;这项研究)。根据我们的方法,我们在西班牙Córdoba的橄榄世界种质银行(Owgb)中重新排序了“Frantoio”(Genbank / Embl登录No.Fr754486至FR754495),但这些多态性未确认。这12个差异不位于筛选的CPDNA区域中,用于Mariotti等人的序列变化。[18.]并且可以被视为加入GU931818中的推定排序错误。考虑到这一事实,我们的分析表明,“Frantoio”和'Manzanilla de Sevilla'显示相同的体积基因组,支持这两个品种的常见母体起源。
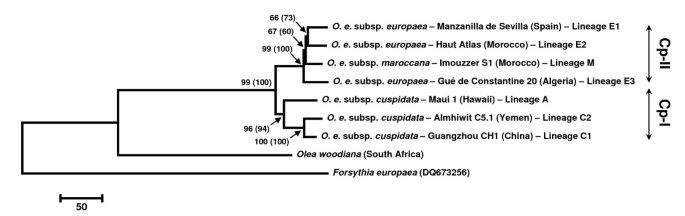
仅基于核苷酸取代(即,在218个取代中只有65个替代物在橄榄树复合物中逐渐提供),使用最大判定值(MP)和最大似然(ML)技术从完整的CPDNA基因组中描绘了系统发育关系(图2).由此产生的拓扑确认BESNARD等人的结果。[15.那29]通过恢复两个主要的林业:地中海/北非思工(CLADE CP-II),包括谱系E1,E2,E3和M,以及一个cuspidata包括谱系C1,C2和A.在CLADE CP-II中的思工(思工CP-I),对谱系E3(GUÉDENCLANTANE20)的早期发散位置的中等引导支持与基于几个CPDNA微卫星的结果同意,indels和帽子[15.].谱系E1和E2的聚类也恢复了中等水平的支持。在进化支Cp-II中仅检测到9个信息性替换,其中3个为非同义替换1).这些网站带来的信息并不强烈支持任何关系,说明有些网站可能是同源的。事实上,三个非同义替换中的两个(52,165和83,304)在两个进化支Cp-I和Cp-II中都具有多态性,这表明这些位点可能处于选择压力下,要么保持多态性,要么促成相同替换的反复出现(参见[18.])。了解这些非同义位点的分子变异值得设计实验以测试其来源及其自适应意义。
基于完全塑性基因组的核苷酸取代的七橄榄树谱系的体积DNA系统发育树.获得相同的拓扑,具有最大规定和最大可能性(GTR + I + G)分析。在每个分支上给出引导值(当优于50%),第一对应于MP分析和第二(在括号)上的ML分析。这连翘欧洲公司和Olea Woodiana.使用序列作为除群。树根扎根了连翘顺序。根据BESNARD等人指示两个片状CP-I和CP-II。[15.].
cpDNA标记的发展
低CPDNA替代率与可能的选择性效果相结合(可能对系统发育重建可能有问题[31])导致我们专注于“长度多态性”。这种多态性是微卫星基序中的可变数量的重复的结果(称为“微卫星”),或另一种类型的插入/缺失(称为“Indel”)。调查了六十二区,其中51个显示变量微卫星图案(附加文件2).这些位点位于非编码区(除了位点61ycf1),因此可以认为是中立的。用于扩增62个区域的聚合酶链反应(PCR)引物列表见附加文件2.两个帽子基因座(位于rpl.14和呢petA-psbJ同性恋间隔件还表征允许在谱系E1中的新单倍型分化(参见方法)。315种培养和野生树木的表征后,为每个个人定义多点谱(或CPDNA单倍型)(附加文件3).此外,一个88年的植物标本室叶子样本被成功地鉴定,表明我们的方法适用于调查cpDNA变异,即使在保存较差的DNA。共有40个位点在地中海/北非橄榄树中具有多态性(附加文件3 b).我们希望不同实验室使用这种方法生成的数据可以进行比较,以生成地中海橄榄树的参考数据集。这样,就有可能根据大量的种群重建物种详细的系统地理,就像已经做的那样,例如,欧洲白栎树[32].
地中海橄榄的多态性评估
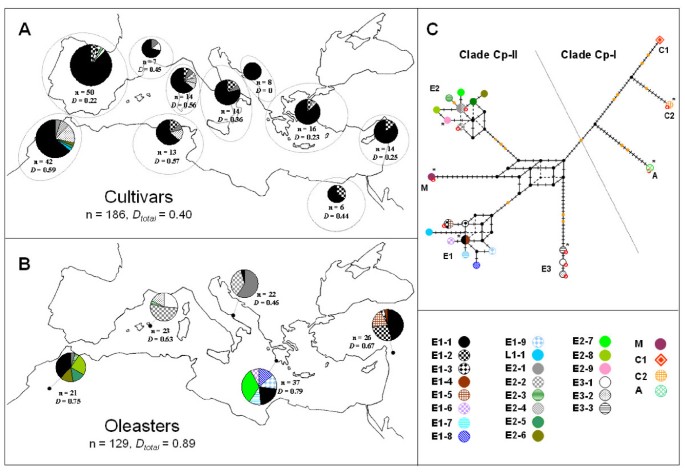
一些橄榄树品种用于生产高质量(和因此更昂贵的)特级初榨橄榄油。因此,它们可以被授予受保护的起源指定的标签(PDO;欧洲联盟标签指的是特定区域或城镇特有的食品,传达特定区域的特定质量或特征)。我们的标记可以在这种高质量橄榄油的可追溯性中找到一些应用,但需要确定它们的辨别力来评估其推定的效用。使用我们的CPDNA LOCI,在品种中检测到12个单倍型(表2, 数字3和附加文件3.):因此,与以前的研究相比,我们的方法允许检测到的变异数量增加两倍[17.那18.].在77%的品种中检测到最常见的单倍型(E1.1),包括'Frantoio'和'Manzanilla de Sevilla'。Two other haplotypes (E1.2 and E3.2) displayed a frequency superior to 5%, but the remaining haplotypes were rare, and sometimes detected only once (i.e., L1.1, E2.3, E2.5 and E2.6) or twice (i.e., E1.3, E2.2 and E3.1). Several of these rare haplotypes were detected in local cultivars with a limited economic importance (e.g., E2.5, E2.6 and L1.1). The probability that two samples chosen at random display a different haplotype was low (D.= 0.40)与核标记,特别是每位点识别力一般超过0.70的核微卫星相比[33-35].这表明法医分析的CPDNA变异的效用仅限于罕见的单倍型,例如检测到“Picholine”(E2.1)和“奥利尼埃”(E3.1)在法国,'Villalonga' - 'Blanqueta'(E1.3),“Farga”(E3.1)和“Lechíndeviilla”(E2.3)在西班牙,或希腊的“梅加蒂基”(E2.2)。这些品种用于生产高质量的特级初榨橄榄油(例如,用于西班牙品种[36])。cpdna变异,即先验与核单拷贝基因相比,容易分析,因此应该有助于根据核多态性补充橄榄可追溯性的其他程序[例如,[37]]。
地中海橄榄树的塑性DNA变异.一种.在栽培橄榄树中分布CPDNA单倍型(另见附加文件5.用于品种列表和相应的CPDNA单倍型)。B..五个研究的奥塞尔人群中单倍型分布。对于栽培和野生基因池,附加次数(n)和辨别力量(D.那D.全部的),给出了每个区域或群体和全球样本的cpDNA变异。C.Reduced-median网络(54] cpdna haplotypes。分支机构的特质代表每个人的变化。吉尔斯由较大的橙色特征特别区分。每个单倍型由具有明确颜色的符号表示。根据BESNARD等人给出每个CPDNA思路或血统的名称。[15.](另见图2)。缺失的中间节点用小黑点表示。帽,Xap我和帽子 -生态在该分析中未考虑RI。因此,在网络中没有区分三对单倍型(即,E1-1 / E1-4,E1-2 / E1-5和E2-1 / E2-4)。此外,九个单倍型不受限制Xap我用一个红色的圆圈表示。*单倍型,在本研究中释放了完整的基因组。
在葡萄酒的五个群体中,检测到18个CPDNA单倍型,其中十分之一与品种共用(表2, 数字3 b和附加文件3.).CPDNA的鉴别力量在这些人群中很高(D.与栽培的橄榄树相比,= 0.89)。14个单倍型是独特的一种人群,而剩余的四个单倍型在至少两种群体之间共用:E1.1(Rajo,Gialova,Pugnochiuso和Bin El ouidane),E2.1和E2.2(甲基Euidane和Pugnochiuso)和E2.3(米拉和宾埃尔ouidane)。在培养的橄榄树中检测到这四种单倍型,可以反映由人类介导的长距离基因流动[15.那38].以这种方式,品种中最常见的单倍型(E1.1)也是奥德德斯中最常见和广泛的单倍型(22%;图3 b).
影响phylogeography
由于检测到的单倍型数量较少,以往对地中海橄榄树cpDNA系统地理学的研究受到了限制[17.那18.].在这里,我们证明了塑性DNA的基因组分析方法主要基于微卫星和诱导可以解决这个问题。在五个遥远的野生种群中检测到的高变异表明我们解决地中海橄榄树历史的方法的高潜力。一个推定的限制是不同作者报告的微卫星基质上的同性化的均质水平[39-42],并且在准确地识别单倍型之间的进化关系时,这可能证明是有问题的。我们基于分子标记重建了一个减少的中值网络(图3 c).地中海单倍型聚集成三个谱系(E1,E2和E3),同时患者的单倍型。maroccana在北非形成了第四个世系(M)。该拓扑完全与Besnard等人一致[15.那29]使用不同的CPDNA数据(即微卫星,吲哚和帽或核苷酸)。每个谱系都显示至少一个特定的indel,除谱系m外(图3 c).Phylogenetic relationships remain unresolved at the base of lineages E1 and E2, as well as in the centre of the network, as a consequence of homoplasy between haplotypes belonging to different lineages (e.g., shared length polymorphisms between clades Cp-I and Cp-II at loci 1, 2, 9, 17, 25, 38, 47, 48, 49, 50 and 58; Additional file3.).这种确定祖先状态的困难阻碍了正确识别不同血统之间的历史联系。相比之下,我们认为同源性不会成为解决谱系间系统发育关系的严重限制,因为它们的单倍型最近发生了分化[42].无论如何,为了在群体水平上对cpDNA变异进行最优分析,需要考虑可能的长度同源性,并且需要使用适当的模型[41那43].
新人的部分或完全CPDNA测序可能会揭示将是兴趣的核苷酸取代[18.]为了开发像SNPS(或帽)这样的新分子标记。这种SNP可用于改善我们的方法。然而,同性膜不限于重复序列,如选择的基因中的非同义位点所示,例如在帽子上检测到的多态性 -Xap我基因座(在rpl.14;桌子1).在本研究中,我们发现该位点在E1和E2(支系Cp-II)以及支系Cp-I中存在限制性多态性。数字3 c)表明该位点具有高度同质性(另见Mariotti等人[18.])。因此,出于系统地理的目的,应该谨慎使用该站点。然而,我们认为它可能在谱系水平上带来潜在的重要信息,特别是解决单倍型E1.2在栽培基因库(7%的品种)的起源。
结论
发布了一组40个多态性位点(包括35个微卫星基序),用于地中海橄榄树种质资源的cpDNA快速表征(见方法和表)3.).我们预计,除了他们的潜在取证应用外,它们的使用对于Phylogeography分析也很重要。特别是,这些研究应该允许在地中海盆地中的依赖群体的持久性进行测试[44],以及测试其后冰川后扩张和随后的驯化的假设[15.那45].此外,真正野生种群的鉴定可能代表了养护地中海橄榄树多样性的重要进化遗产。最后,核和cpdna资源的结合使用应该有助于解除种子和花粉对遗传多样性结构的基因分散的影响。例如,我们的CPDNA标记将具有对不同环境中野生橄榄树种群的动态的比较研究的应用,例如群岛和撒哈拉山脉[25那26].这些信息可能与定义适当的户钉策略和原位保护野生橄榄树。
方法
一般方法总结在图中1.
叶绿体基因组测序
为了最大化多态性检测,分析集中在七个人上O. Europaeal .(亚属olea.教派。olea.,或橄榄树复合体),它们被选择来代表前面描述的每个谱系的一个单倍型[15.].因此调查了以下基因型:'Manzanilla de Sevilla'(西班牙品种;血统E1),Oleaster“Haut Atlas 1”(摩洛哥;血统E2),Oleaster“Guédenclancyand20”(阿尔及利亚;血统E3),subsp。maroccana“Imouzzer S1”(摩洛哥;血统,无性系种群。cuspidata“毛伊1”(夏威夷;血统a),subsp。cuspidata“广州CH1”(中国;赛德C1)和亚木。cuspidata“Almhiwit C5.1”(也门;血统C2)。此外,我们还鉴定了一种外群物种[o . woodianaKnobl。无性系种群。woodiana(南非);教派。Ligustrodes.遗数。和钩子。],属于姐妹群O. Europaea[16.那29].设计合适的PCR引物扩增105个重叠的cpDNA片段(附加文件)4.).每个PCR反应(25μL)含有10ng DNA模板,1×反应缓冲液,2mM MgCl2,0.2mm dntps,每个引物的0.2μmol,和0.75 uTaq.DNA聚合酶(Promega, Madison, WI, USA)。反应混合物在热循环器(T1;Biometra, Göttingen,德国)在95°C下持续2分钟,然后在95°C(变性)下持续30秒,36个循环,在退火温度下持续30秒(附加文件4.), 72°C 2分钟(延伸)。最后一个循环在72°C下延长10分钟。PCR扩增产物用ABI Prism 3100进行直接测序xl遗传分析仪,根据制造商的说明(应用生物系统,福斯特城,USA)的说明,使用Big Dye V3.1终结器循环测序套件。此外,嵌套(内部)引物也被设计为完成每个片段的排序(附加文件4.).八olea.因此,使用类似的方法来重建基因组,以使Mariotti等人使用的类似方法。[18.].
地中海橄榄树CPDNA多态性的特征
基于七个O. Europaea62个区域检测到序列、长度多态性。这些多态性要么是由于微卫星motif中重复数量的变化,要么是其他类型的indel(附加文件2).PCR引物在侧翼区域设计,以具体放大短段(通常较差240bp)。对于基因座复用,所有这些引物的退火温度需要相似,而每个基因座的PCR产物的大小应尽可能不同。最后,这些引物还被设计用于允许扩增短DNA段,以表征较差的保存材料和来自Herbarium样品的高度降解的DNA。另外,轨迹19的反向引物的5'末端用序列GTGTCTT标记以最小化带状痉挛。在附加文件中给出所有引物对和生成片段的特定特征2.为了降低PCR鉴定的成本(即时间和成本),我们使用了Schuelke所描述的方法[46].每个位点(除8、10、61位点外)均在正向引物上添加一个18 bp的M13尾部(附加文件)2).每个位点单独扩增时,每个PCR反应(25 μl)包含10 ng DNA模板、1×反应缓冲液、2.5 mM MgCl2, 0.2 mM dNTPs, 0.2 μmol通用荧光标记M13(-21)引物(5'-TGTAAAACGACGGCCAGT-3');标记以下三种荧光色素之一:HEX, 6-FAM或NED), 0.2 μmol反向引物,0.05 μmol正向引物,0.5 UTaq.DNA聚合酶(Promega)。反应混合物在T1 thermocycler孵化2分钟在95°C,紧随其后的是28周期30年代在95°C, 30年代在57°C,在72°C和1分钟,然后由8周期30年代在95°C, 30年代在51.5°C, 1分钟在72°C。最后一个循环在72°C下延长20分钟。通常,我们会在同一反应中扩增5到6个基因座,但在这种情况下,是MgCl2浓度升高至5mm,引物浓度(标记的M13引物除外)减少5或6。在以下条件下单独扩增LOCI 8,10和61(没有M13尾部):每个PCR反应(25μL)含有10ng DNA模板,1×反应缓冲液,2mM MgCl2,0.2mm dntps,每个引物的0.2μmol,和0.75 uTaq.DNA聚合酶。反应混合物在T1热循环器中95°C孵育2 min,随后在95°C孵育36个循环,30 s, 53°C孵育30 s, 72°C孵育2 min。最后一个循环在72°C下延长10分钟。
用荧光染料标记的PCR产物与Genescan-500 ROX一起混合为内标,同时运行LOCI的最大值(考虑颜色和预期的等位基因尺寸范围)。他们在Abi Prism 3100上分开了xl基因分析仪和片段大小用GeneMapper 4.0版本进行测定。对于两个非标记位点8和61,迁移后在2.5%琼脂糖凝胶电泳(GelRed, Biotium, Hayward, CA, USA)上显示了342和225 bp的indelet。
我们还关注了Mariotti等人检测到的两种替换的特征[18.系E1(在栽培橄榄树中最常见的系;参见[13.那17.),可能对法医分析和橄榄树驯化的研究有潜在的帮助。我们选择开发两个Cleaved amplification Polymorphism Site (CAPS)位点,如Besnard等人[47],为了迅速表征大量的人。PCR引物在附加文件中给出2.采用与微卫星相同的PCR条件扩增两个位点。PCR产物经限制性内切酶(埃森我或XapI)根据制造商的建议。然后将两个位点的限制性片段混合(与内部标准ROX 500),并在ABI Prism 3100上分离xl基因分析仪。对每个基因型是否存在限制性内切位点的多态性进行评分。可复用三种不同颜色(例如NED, FAM和HEX),每次运行可表征288 (96 × 3)样品。
随后,我们对来自不同地区的186份橄榄树种质进行了鉴定,其中64个位点(见表)2, 数字3和附加文件5.).分析的种质包括来自OWGB Córdoba的106个品种[48].这些品种代表了来自所有地中海国家的主要品种。为了提高栽培基因库的代表性,本研究还纳入了一些来自不同地方的本地品种。首先,我们鉴定了55种来自摩洛哥(41种)和科西嘉-撒丁岛(14种)的本地栽培品种,这些品种之前已经用核标记进行了基因分型[49那50].此外,本研究还添加了阿尔及利亚-突尼斯(6)、意大利(6)、法国(2)、希腊-土耳其(3)、黎凡特地区(5)、利比亚-埃及-苏丹(2)和南非(1)已知教派的栽培树木。在此之前,我们用核微卫星测试了这些新物种的基因差异(G. Besnard,未公开)。数据),但利比亚库夫拉植物标本室(Newberry, sn;1933年-英国皇家植物园)。此外,为了评估野生地中海橄榄树的cpDNA变异,来自5个遥远种群的129个个体(图)3 b)还被特征:Rajo(叙利亚; 36°43'50''n,36°40'00'''e),Gialova(希腊; 36°55'12''n,21°42'42''e),Pugnochiuso(意大利; 41°47'46''n,16°10'05''e),minorca(西班牙; 39°56'52''n,04°14'42'''''e和bin El ouidane(摩洛哥; 32°03'00''n,06°35'00'w)。To test the reproducibility of the method, the characterisation of ten accessions (i.e., 'Picholine Marocaine', 'Manzanilla de Sevilla', 'Frantoio', 'Moraiolo', 'Ciarasina', 'Confetto', 'Itrana', 'Giaraffa', 'Kalamon' and 'Souri') were repeated three times at random.
基于这种对野生和栽培的栽培的分析,在地中海橄榄树中检测到40个多晶型基因座(附加文件3.).我们首先提出将这些基因座中的36个结合在一起,以快速表征地中海橄榄树种质。在表中提出了五个或六个基因座的多路复用PCR3.,但这很容易修改。PCR条件与之前报道的相同(使用M13引物)。在PCR之后,这些产物被混合在一起(在给定颜色的位点之间没有等位基因大小的重叠)。需要单独扩增的位点10与这些多重pcr结合。其次,在多重PCR扩增时,我们在位点19上遇到了一些困难(表中未报道)3.),因此我们建议单独使用它,并将其与两个CAPS (CAPS-Xap我和帽子 -生态RI)为三个基因座的第二组合。最后,基因座61独立地表征在2.5%琼脂糖凝胶电泳上。
数据分析
建立了完整质体基因组的系统发育树。部分cpDNA序列连翘(DQ673256;[51])用作树木的小组。序列与应用程序对齐EGAv4.1 [52].对齐是手动精制的。首先,进行最大分析分析。所有角色都同样加权。差距被视为缺失数据。启发式搜索被用来找到最具宽松的树木。近距离交换算法与搜索级别为3,如软件中的建议和在[52].这些搜索包括随机添加序列的100次重复。所有最好的树都保留了下来。严格共识树是由同样最吝啬的树生成的。引导值是使用10,000次重复计算的。其次,在最大似然准则下,利用应用程序PHYMLv3.0 [53].通过分层似然比测试确定的最佳替代模型是GTR模型,具有不变的站点和从数据估计的伽马形状参数。通过1,000 Bootstrap复制获得支持值。基于片段基因分型(即,微卫星和吲哚),通过构建应用程序n中实现的减少的中值网络来观察CPDNA单倍型之间的关系ETWORKv4.112 [54].用有序等位基因处理多状态微卫星,并由每个等位基因的重复基序的数量进行编码(例如,T或A的数量;另见[15.]),而其他索引的存在或不存在分别被编码为1和0。基本上,这种编码策略假设cpDNA微卫星的变异主要是由于单步突变(例如,[15.那18.]),同时允许考虑具有相似重量的长度多态性(微卫星或吲哚)。但是,我们是否使用不同的权重与indels与微卫星没有影响拓扑。另外,对于基因座组合indel和微卫星图案(Loci 10,11,54和57),我们根据这些基因座的可用序列分开编码两种类型的字符。用于分析的矩阵在附加文件中给出6..
随机选取的两个个体显示不同单体型的概率计算为D.= 1 - Σp我2, 在哪里p我是单倍型的频率我.该参数分别在栽培和野生橄榄树上计算,也在子样本或种群上计算。栽培的橄榄树的种类是根据它们的地理来源来定义的。
参考文献
- 1。
Weir BS,安德森广告,Hepler AB:遗传相关性分析:现代数据和新挑战。NAT Rev Genet。2006年,7:771-780。10.1038 / NRG1960。
- 2.
Lahaye R, Van der Bank M, Bogarin D, Warner J, Pupulin F, Gigot G, Maurin O, Duthoit S, Barraclough TG, Savolainen V:生物多样性热点区植物区系的DNA条形码。美国国家科学院学报。2008年,105:2923 - 2928。10.1073 / pnas.0709936105。
- 3.
Schaal Ba,Olsen km:基因遗传学和植物种群变异。美国国家科学院学报。2000,97:7024-7029。10.1073 / pnas.97.13.7024。
- 4.
植物细胞器和核基因的有限岛模型。遗传。1993,71:630-641。10.1038 / hdy.1993.188。
- 5.
Bendich AJ:为什么叶绿体和线粒体含有如此多的基因组副本?生物。1987年,6:279-282。10.1002 / bies.950060608。
- 6.
退化DNA基因分析的法医学意义:综述。中国科学:地球科学,2010,34(4):497 - 503。10.1016 / j.fsigen.2009.09.007。
- 7.
Wolfe Kh,李夫,夏普PM:核苷酸速率置换率在植物线粒体,叶绿体和核DNA中变化很大。美国国家科学院学报。1987,84:9054-9058。10.1073 / pnas.84.24.9054。
- 8.
夏建军:种子植物线粒体、叶绿体和核基因组中同义替换的相对比率。中国生物医学工程学报。2008,29(4):427 - 431。10.1016 / j.ympev.2008.09.009。
- 9。
旧世界水果生长的开端。科学进展。10.1126 / science.187.4174.319。
- 10。
Angiolillo A,Mencuccini M,Baldoni L:使用扩增的片段长度多态性评估橄榄遗传多样性。Al Appl Genet。1999,98:411-421。10.1007 / S001220051087。
- 11.
Amane M,Lumaret R,Hany V,Ouazzani N,替代C,Vivier G,Deguilloux MF:栽培和野生橄榄叶绿体-DNA变异(齐墩果欧洲公司l .)。Al Appl Genet。1999,99:133-139。10.1007 / S001220051217。
- 12.
Besnard G,Khadari B,Villemur P,BervilléA:橄榄中的细胞质雄性不育(齐墩果欧洲公司l .)。应用计算机网络。2000,100:1018-1024。10.1007 / s001220051383。
- 13.
利用叶绿体和线粒体DNA多态性研究橄榄复合体细胞质遗传分化(齐墩果欧洲公司l .)。Al Appl Genet。2002,105:139-144。10.1007 / S00122-002-0868-6。
- 14.
Lumaret R, Ouazzani R, Michaud H, Vivier G, Deguilloux MF, Di Giusto F:橄榄树种群(野生橄榄树)等位酶变异(齐墩果欧洲公司产于地中海盆地。遗传。2004,92:334-352。
- 15.
Besnard G,Rubio de Casas R,Vargas P:塑性和核DNA多态性揭示了橄榄树复合物中的隔离和网状物的历史过程(齐墩果欧洲公司).j生物纪元。2007,34:736-752。10.1111 / J.1365-2699.2006.01653.x。
- 16.
绿色PS:修改olea.邱志明,2002,(4):1-14。10.2307 / 4110824。
- 17.
BESNARD G:地中海橄榄的叶绿体DNA变异。J Hort Sci Biotechnol。2008,83:51-54。
- 18.
Mariotti R,CultraLa Ngm,Muñozdíezc,Baldoni L,Rubini A:鉴定新的多晶型区域和栽培橄榄的分化(齐墩果欧洲公司L.)通过塑料序列比较。BMC植物BIOL。2010,10:211-10.1186 / 1471-2229-10-211。
- 19。
(1)野生种群叶绿体DNA的遗传分析李属鸟结核l在欧洲。遗传。2001,87:421-427。10.1046 / j.1365-2540.2001.00922.x。
- 20。
Arroyo-Garcia R, Ruiz-Garcia L, L博林,Ocete R,洛佩兹,阿诺德C, Ergul, Soylemezoglu G, Uzun嗨,卡贝略港F, Ibanez说J, Aradhya可,Atanassov, Atanassov我Balint年代,Cenis杰,Constantini L, Goris-Lavets年代,Grando女士,克莱恩,麦戈文PE、Merdinoglu D, Pejic我Pelsy F, Primkirios N, Risovannaya V, Snoussi, Sotiri P, Tamhankar年代,这个P, Troshin L, Malpica JM, Lefort F, Martinez-Zapater JM:栽培葡萄的多种来源(葡萄l . ssp。漂白亚麻纤维卷)基于叶绿体DNA多态性。Mol Ecol。2006,15:3707-3714。10.1111 / J.1365-294x.2006.03049.x。
- 21。
Vendramin GG,Fady B,González-MartínezSC,盛胡诗,斯科蒂I,Sebastiani F,Soto A,Petit RJ:遗传疏贫但普遍存在:象征地中海松片的案例。进化。2008,62:680-688。10.1111 / J.1558-5646.2007.00294.x。
- 22。
Heuertz M,Carnevale S,Fineschi S,Sebastiani F,Hausman JF,Paule L,Vendramin GG:欧洲灰烬的叶绿体DNA Phylogeography,fraxinus.sp (Oleaceae):杂交和生活史性状的作用。环境科学学报。2006,15(4):591 - 598。10.1111 / j.1365 - 294 x.2006.02897.x。
- 23。
Magri D,Fineschi S,Bellarosa R,Buonamici A,Sebastiani F,Schirone B,Simeone MC,Vendramin GG:分布Quercus木栓叶绿体单倍型与西部地中海的古地理历史相匹配。Mol Ecol。2007,16:5259-5266。10.1111 / J.1365-294X.2007.03587.x。
- 24。
史密斯SA,Donoghue MJ:分子演变的速度与开花植物中的生命历史相关联。科学。2008,322:86-89。10.1126 / Science.1163197。
- 25.
Besnard G,Christin Pa,Baali-Cherif D,Bouguedoura N,Anthelme F:营商橄榄的空间遗传结构(齐墩果欧洲公司无性系种群。Laperrinei.),一种来自撒哈拉中部山区的长寿树。遗传。2007,99:649-657。10.1038 / sj.hdy.6801051。
- 26.
García-Verdugo C, Forrest AD, Ballaguer L, Fay MF, Vargas P: insular的平行进化齐墩果欧洲公司基于质体DNA变异的地理结构和叶片性状的表型相似性的亚种。引用本文10.1111 / j.1095-8339.2009.01013.x。
- 27.
García-Verdugo C,Forrest AD,Fay MF,Vargas P:基因流动在海洋岛流动的Metapulation动态中的相关性,齐墩果欧洲公司无性系种群。瓜察.进化。2010,64:3525-3536。10.1111 / j.1558-5646.2010.01091.x。
- 28.
陈志强,陈志强,陈志强:叶绿体简单序列重复序列(cpSSRs)的发现和应用。环境科学学报,2009,29(4):591 - 598。10.1111 / j.1755-0998.2008.02319.x。
- 29.
Besnard G,Rubio de Casas R,Christin Pa,Vargas P:Phylogenseticsolea.(木犀科)基于质体和核糖体DNA序列:第三纪气候变迁和谱系分化时期。王志强。2009:1 - 4。10.1093 / aob / mcp105。
- 30。
贝纳德G, Bervillé A:橄榄叶绿体DNA变异研究(齐墩果欧洲公司L.)复合物:RFLP和PCR多态性的比较。Al Appl Genet。2002,104:1157-1163。10.1007 / s00122-001-0834-8。
- 31。
遗传趋同的原因及其进化意义。趋势通讯,2010,26:400-405。10.1016 / j.tig.2010.06.005。
- 32。
Petit RJ,Brewer S,Bordacs S,Burg K,Cheddadi R,Coart E,Cottrell J,Csaikl UM,Van Dam B,Deans JD,Espinel S,Fineschi S,Finkeldey R,Glaz I,Goicoechea PG,Jensen JS,Konig敖,Lowe AJ,Madsen SF,Matyas G,Munro Rc,Popescu F,Slade D,Tabbener H,De Vries SGM,Ziegenhagen B,De Beaulieu JL,Kremer A:识别避难所和冰川后冰川殖民航线的欧洲白橡木基于叶绿体DNA和化石花粉证据。森林ECOL管理。2002,156:49-74。10.1016 / s0378-1127(01)00634-x。
- 33。
BESNARD G,BRETON C,BARADAT P,Khadari B,BervilléA:基于RAPD标记的橄榄品种鉴定。J Amer SoC Hort SCI。2001,126:668-675。
- 34。
Belaj A, Satovic Z, Cipriani G, Baldoni L, Testolin R, Rallo L, Trujillo I: RAPD、AFLP和SSR标记的鉴别能力及其在建立橄榄亲缘关系中的有效性的比较研究。中国科学:地球科学。2003,27(6):736-744。10.1007 / s00122 - 003 - 1301 - 5。
- 35。
Khadari B,Breton C,Moutier N,Roger JP,Besnard G,BervilléA,Dosba F:在法国橄榄系列中使用分子标记进行种质管理。Al Appl Genet。2003,106:521-529。
- 36。
来自西班牙的橄榄油。(浏览日期01/12/2010),[http://www.oliveoilfromspain.com/OOFS/everything/denominations_of_origins.asp]
- 37.
Consolandi C,Palmieri L,Severgnini M,Maestri E,Marmiroli N,Agrimonti C,Baldoni L,Donini P,De Bellis G,Castiglioni B:橄榄油可追溯性和真实性的过程:DNA提取,多重PCR和LDR-通用阵列分析。EUR FOITE RECONGOL。2008,227:1429-1438。10.1007 / s00217-008-0863-5。
- 38.
Besnard G, Khadari B, Baradat P, Bervillé A:齐墩果欧洲公司基于叶绿体DNA多态性的木犀科系统地理研究。中国科学(d辑),2002,19(4):353- 361。10.1007 / s00122 - 001 - 0832 - x。
- 39.
黄豆野生多年生近缘植物叶绿体微卫星的大小同源性甘氨酸亚属甘氨酸).生物科学进展。1998,15(4):489 - 494。
- 40。
黄志强,王志强,王志强,等。植物叶绿体微卫星研究进展[J]。生态学报。2001,16:142-147。10.1016 / s0169 - 5347(00) 02097 - 8。
- 41。
植物叶绿体微卫星:遗传多样性和同塑效应的度量。生态学报。2005,14:1333-1341。10.1111 / j.1365 - 294 x.2005.02504.x。
- 42。
基于叶绿体DNA的系统地理推断:定量分析重复和非重复序列突变的影响。环境科学学报,2011,29(6):759 - 762。10.1111 / j.1755-0998.2010.02921.x。
- 43。
Estoup A,Jarne P,Cornuet JM:微卫星基因座的同性化和突变模型及其对群体遗传分析的影响。Mol Ecol。2002,11:1591-1604。10.1046 / J.1365-294x.2002.01576.x。
- 44。
腐肉Y,Ntinou M,Badal E:齐墩果欧洲公司L.在北地中海盆地,在受限层和早期的全新世。QUAT SCI Rev.2010,29:952-968。10.1016 / J.Quascirev.2009.12.015。
- 45。
Breton C,Terral JF,Pinatel C,MédailF,Bonhomme F,BervilléA:橄榄树驯化的起源。C r Biol。2009,332:1059-1064。10.1016 / J.CRVI.2009.08.001。
- 46。
Schuelke M:PCR片段的荧光标记的经济方法。NAT BIOTECHNOL。2000,18:233-234。10.1038 / 72708。
- 47。
Besnard g,Rubio de Casas r,Vargas P:一组用于长度和核苷酸替代多态性在叶片塑料DNA中的引物齐墩果欧洲公司l .(木犀科)。中国生态学报。2003,3:651-653。10.1046 / j.1471-8286.2003.00547.x。
- 48。
卡巴列罗JM,德尔Río C,巴兰科D,特鲁希略I:西班牙Córdoba橄榄世界种质库。中国海洋大学学报(自然科学版),2006,25:14-19。
- 49.
De Caraffa VB,Maury J,Gambotti C,Breton C,BervilléA,Giannettini J:Mitochondrial DNA变异和RAPD Mark Oleasters,来自西部和东部地中海的橄榄橄榄。Al Appl Genet。2002,104:1209-1216。10.1007 / S00122-002-0883-7。
- 50.
Khadari B,Charafi S,Moukhli A,Ater M:尽管单一主要品种的培养摩洛哥橄榄植物遗传多样性:使用SSR基因座的矛盾局面证明了矛盾的局面。树遗传学基因组织。2008,4:213-221。10.1007 / s11295-007-0102-4。
- 51.
李洪志,李志强,李志强,等:植物叶绿体基因组的基因重组茉莉花和menodora(木犀科)是由于多重,重叠倒置。中国生物科学(英文版),2007,24(4):491 - 497。10.1093 / molbev / msm036。
- 52。
Tamura K,Dudley J,Nei M,Kumar S:Mega4:分子进化遗传学分析(Mega)软件版本4.0。mol Biol Evol。2007,24:1596-1599。10.1093 / molbev / msm092。
- 53。
一种简单、快速、准确的算法,通过最大似然估计较大的系统发育。中国科学:地球科学。10.1080 / 10635150390235520。
- 54。
基于中位连接网络的种内系统发育研究。生物科学进展,1999,16:37-48。
确认
感谢Virginie Brunini,Christos Mammides,Andriana Minou,Giorgos MinoS,Alex Papadopoulos和Carmen delRío(奥格威,Ifapa,Centro Alameda del Obispo,Córdoba,西班牙; Feder-Inia RFP2009-00008-C2-01)提供橄榄树样品或DNA提取物。一叶样品也由Kew Herbarium提供。这项工作由欧洲内部奖学金Pief-Ga-2008-220813资助GB资助。来自西班牙科学和创新部的Micinn Grant Agl2010-17316支持pH值。GD由项目041 / C / 2007,75 / C / 2009和56 / C / 2010的“Consejeríadayryingrura,Junta deAndalucía”;“Grupo Pai”Agr-248的“Junta deAndalucía”;和“Ayuda a grupos”的“大学德科尔多瓦”(西班牙)。来自ERC,Leverhulme Trust,NERC和皇家社会的补助金支持。我们还感谢Silvana del Vecchio for Lab Adveart,Martyn Powell和两个匿名评论员,有关此手稿的有用评论。
作者信息
隶属关系
通讯作者
额外的信息
作者的贡献
GB & VS设计了最初的项目,其他作者随后做出了贡献。GB进行了实验,并撰写了手稿的最初版本。GD和PH有助于橄榄cpDNA测序和培养橄榄基因分型数据的获取。BK有助于采集栽培和野生橄榄树的数据。GB、PH、BK、GD、VS对手稿进行了严格的修改。所有作者都最终同意了这个版本的出版。
电子补充材料
12870 _2011_869_moesm2_esm.xls
附加文件2:Loci特性。给出了引物、等位基因大小范围、多态性类型、基因组位置及相关研究名称(XLS 58kb)
基于64个基因的塑性DNA变异
附加文件3:。一)在本研究中表征的321棵树的概况(包括完整的CPDNA基因组织的树木);和b)不同的cpdna haplotypes。(XLS 190 KB)
12870_2011_869_moesm4_esm.doc.
附加文件4:用于扩增和序列完全橄榄血浆基因组的PCR扩增和测序引物(5' - > 3')。(Doc 202 KB)
作者为图像提交的原始文件
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署名许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
BENNARD,G.,Hernández,P.,Khadari,B。et al。地中海橄榄树塑性DNA变异的基因组分析。BMC植物杂志11,80(2011)。https://doi.org/10.1186/1471-2229-11-80
已收到:
公认:
发表:
关键字
- 橄榄树
- plastid基因组
- 微卫星图案
- cpDNA单体型
- cpdna变异