摘要
背景
丛枝菌根(AM)共生由土壤真菌与大多数植物物种的根系相互关系。该协会提供糖髓菌根用糖,而真菌可提高宿主植物中的水和矿物质营养素的吸收。然后,建立丛枝菌根(AM)共生需要微调宿主基因表达的识别和鉴别真菌Symbiont。在植物中,钙在发育过程中作为第二信使在环境刺激的反应期间发挥关键作用。即使已知在AM共生期间在宿主细胞中发生钙瞬变,钙信号的解码也是下游的解码才能理解得不景气。
结果
在AM共生的前共生阶段,检测了代表水稻四个不同系统发育类群的17个钙依赖蛋白激酶(CPK)基因的表达。其中,OsCPK18和OsCPK4,被发现在接种AM真菌时被转录激活Glomus MorrarAce。OsCPK18和OsCPK4基因表达也由真菌制备的扩散分子上调。激光微碎裂揭示了表达OsCPK18在皮质细胞中,而不是表皮细胞G. MINTRAADICE.- 植物稻根,表明该基因在根皮层中的优先作用。此外,通过在洋葱表皮细胞中的绿色荧光蛋白标记的OSCPK18的瞬时表达测定观察OSCPK18的质膜定位。我们还表明,血浆膜靶向需要OSCPK18 N-末端的MyRistoylation遗址。
结论
快速激活OsCPK18它的表达也被真菌分泌的信号所诱导,加上观察到的OsCPK18的质膜定位,表明OsCPK18在AM真菌感知中的作用。这OsCPK18基因可能被认为是共生过程的出生阶段的标志物。这些发现提供了更好地理解在AM共生期间运行的信号传导机制,并将极大地促进其分子解剖。
背景
大多数血管开花植物有能力与丛枝菌根(AM)真菌建立共生关联[1].该植物的主要益处是改善了来自土壤,特别是磷酸盐的水和矿物质的摄取,以换取光合固定碳[2].菌根共生在几种植物物种中对病原体感染和对非生物胁迫的耐受性增加有关[3.].因此,AM共生在农业生态系统中具有巨大意义。
的豆类Medicago Truncatula.和莲花japonicus.已被广泛采用作为研究AM共生的参考种。相反,拟南芥蒂利亚纳,植物中功能基因组学的模型系统,没有发现能力。米饭,一种具有完全测序的基因组的单圈植物,与菌根真菌建立了共生关联[4.那5.].与模型豆类物种相比,对水稻中AM共生相互作用的基因较小。
am Fungi的成功共生依赖于微调和适当控制宿主基因表达和生理反应。在宿主植物和AM真菌之间提前建立了分子对话,并为随后的根殖民化准备两个合作伙伴。信号交换和通信在Symbionts之间的初始小区到小区接触之前开始。因此,植物根部散发出对AM生长的刺激作用的血液滴答物[6.].官方菌丝官方产生扩散分子,“MYC因素”(类似于根瘤菌点点因子)。最近,据报道,AM真菌分泌脂肪OONIGOS糖,其在不同植物物种中刺激AM共生的形成[7.].宿主细胞对Myc因子的感知引发了细胞内钙的快速和短暂的升高,细胞结构的改变和根的转录重编程[8.-12.].尽管细胞质[10.]和核[9.] pre-infection Ca2+尖峰反应被引发m . truncatula根系对AM真菌的响应,Ca2+感测改变并转换为早期的AM诱导的信号传导仍然未知。
一旦建立了共生之间的接触,真菌通过表皮细胞进入根部,并渗透到皮质中,在根的皮质细胞中形成高度分支的结构,称为仲裁。仲裁是两个共生之间的主要营养交换的部位[2那13.那14.].
我们也知道,植物对Myc因子的反应是由一个部分特征的信号通路介导的,这是建立根瘤菌和AM共生所必需的,即所谓的共同共生(SYM)通路[2那13.-15.].模型豆科植物的正向遗传分析Medicago Truncatula.和莲花japonicus.已经识别了SYM信号通路的组成部分。它们是:富亮氨酸重复序列受体样激酶SYMRK蛋白质L. japonicus.(被称为DMI2对于“没有发染2”m . truncatula),两个核锁素(NUP85和NUP133),两个阳离子通道蛋白L. japonicus.CASTOR和北河三蛋白质;DMI1a和DMI1b在m . truncatula),是一种钙和钙调素依赖的蛋白激酶(CCaMK在L. japonicus.;DMI3在m . truncatula)和cyclops(LjCYCLOPS;DIM3-interacting蛋白质m . truncatula)[16.-21.].CCaMK与细胞核内的CYCLOPS相互作用并磷酸化[21.那22.].在水稻中,几个SYM基因的功能似乎是保守的,包括CASTOR和北河三(起到钙尖峰信号的上游)和CCaMK和CYCLOPS(作用于钙峰信号的下游)[23.-25.].证据还支持替代,互相独立的信号传导途径,控制两种米和米真菌的早期反应m . truncatula[25.那26.].
通过菌根根的转录本分析,可以识别包括水稻在内的几种植物中am调控的基因[3.那27.-30.].然而,大多数这些研究的重点是共生过程的成熟阶段,其中宿主源性已经殖民的时间和枝枝在根皮质细胞中开发。除此之外,与营养采集过程的基因表达的改变,如磷酸盐转运基因,在不同的AM关联中有很好地记载[31.那32.].参与细胞修饰,转录控制和防御相关反应的基因也被称为在AM共生期间调节[4.那31.].
即使Ca2+已知在宿主细胞中发生水平,在出生期期间,钙信号的解码仅被理解得很差。另一方面,很好地确定了钙依赖性蛋白激酶(CPK或CDPK)是重要的2+植物生长、发育和胁迫反应中信号传导过程中的传感器[33.那34.].CPKs属于CDPK/SnRK蛋白激酶超家族,是在植物、藻类和原生生物中发现的一组分化的蛋白激酶[34.-36.].它们具有由四个结构域组成的特征结构域:氨基末端可变结构域、丝氨酸/苏氨酸激酶结构域、连接自抑制结构域和c端钙调蛋白结构域。这些特征使CPKs的结构非常理想,能够迅速感知细胞内钙浓度的变化,并将其转化为蛋白磷酸化级联反应。然而,CPK的功能与CCaMK的功能不同,因为CPKs的激活不需要钙调素。Ca2+直接结合CPK的钙调蛋白结构域,并诱导导致激酶激活的构象变化[34.].来自各种植物物种的植物CPK的可用信息表明它们由多烯家族编码,而其中一些基因普遍表达,其他基因表达了组织特异性的表达模式或受胁迫(伤口,盐度,冷,冷,干旱,病原体感染)[33.那37.那38.].
知道加利福尼亚州2+在am诱导的信号通路中起核心作用,研究CPKs在多大程度上参与am诱导的信号通路是很有意义的。朝着这个目标,十七种表达模式CPK.在被AM真菌接种的水稻植物中监测基因Glomus mortraradice.。我们提供了证据表明两个不同的表达CPK.基因,这OsCPK18和OsCPK4基因,在水稻共生前阶段迅速被诱导G. MINTRAADICE.相互作用。OsCPK18和OsCPK4基因表达也被真菌产生的扩散真菌信号(s)激活。利用激光显微解剖(LMD)技术,OsCPK18在皮质细胞中检测到表达,但不是表皮细胞G. MINTRAADICE.接种水稻根系。此外,本文报道了OsCPK18的质膜定位,它的质膜定位需要OsCPK18的豆蔻酰化位点。总之,这些发现支持OsCPK18可能在宿主细胞识别AM真菌过程中发挥作用。
结果
表达式CPK.am接种水稻根的基因
水稻全基因组分析CPK.基因鉴定出31个基因,分布于4个系统发育组(I-IV) [39.那40].而且,米饭的比较CPK.基因区分了11对密切相关的基因,它们最有可能是通过连续复制事件而产生的OsCPK1/15那OsCPK2/14, OsCPK3/16, OsCPK4/18, OsCPK5/13, OsCPK7/23, OsCPK8/20, OsCPK11/17, OsCPK21/22, OsCPK24/28和OsCPK25/26对[40].基于大米的同源性和系统发育相关性CPK.基因,我们选择了17个子集CPK.代表四种不同的水稻CPKs的三种不同系统发育基团的基因,其中至少一个代表性成员每对密切相关CPK.基因是存在的。在这项工作中检测的基因子集包括OsCPK7、OsCPK10 OsCPK13那OsCPK17和OsCPK24来自群体;OsCPK2那OsCPK15那OsCPK19和OsCPK25从第二组;OsCPK8, OsCPK9那OsCPK16和OsCPK22来自第三组;和OsCPK4那OsCPK18那震票30岁,OsCPK31来自第四组。
选定米的表达模式CPK.基因及其对接种AM真菌的转录反应G. MINTRAADICE.,在共生过程的前共生阶段进行检测。通过半定量RT-PCR实验,对真菌孢子接种水稻全根的RNA样本进行初步筛选。在水稻根接种后24、48、72和96 h分离总RNAG. MINTRAADICE.,以及模拟接种的水稻根。许多CPK.发现基因在水稻根和不同的水平中表达(附加文件1:图S1)。其中,OsCPK4和OsCPK18基因在最高水平表达。观察到中度至低水平的表达OsCPK10那OsCPK13那OsCPK17那OsCPK24那OsCPK15那OsCPK19那OsCPK8和OsCPK9, 然而OsCPK30转录本几乎没有被检测到(附加文件1:图S1)。这OsCPK7和OsCPK16基因的表达谱与图中所示的相似OsCPK8和OsCPK30(结果未显示)。从整体上看,表达水平各不相同CPK.这里研究的基因似乎在接种后没有显著的影响G. MINTRAADICE.,除了OsCPK4和OsCPK18表达式(附加文件1:图S1)
为了进行比较,所知的表达信谊基因来自水稻,即水稻OsSYMRK那ospolux那OsCASTOR和OsCCaMK基因,也进行了检查。这一分析揭示了OsSYMRK那ospolux和OsCCaMK为了应对G. MINTRAADICE.接种后72和96小时(附加文件)1:图S1)。观察到的这些基因的诱导表明宿主植物细胞通过激活AM特定的符号信号通路来感知和响应AM真菌。
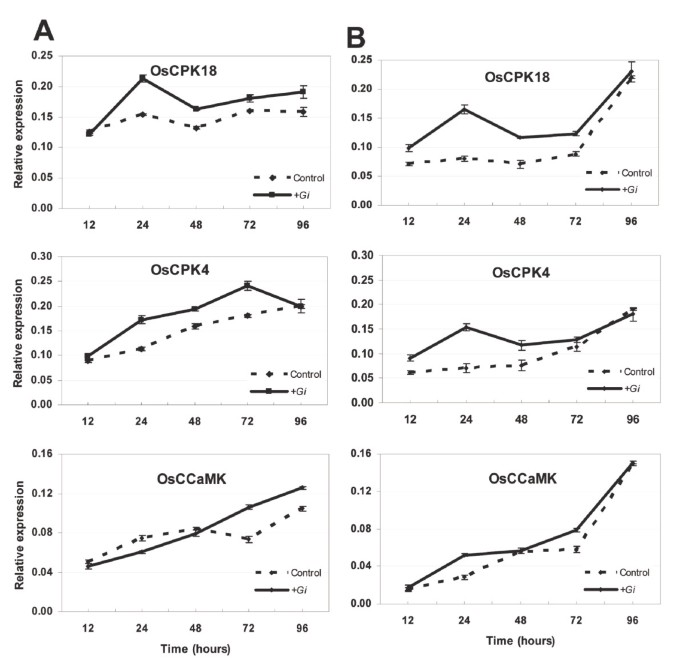
由于RT-PCR分析不提供基因表达的可靠定量数据,因此使用定量逆转录PCR(RT-QPCR)来进一步表征效果G. MINTRAADICE.接种上OsCPK4和OsCPK18基因表达。通过使用单三明治系统进行真菌接种,上调OsCPK18基因表达早在接种后24 h就出现G. MINTRAADICE.(数字1A,上半部分)。的水平OsCPK18在随后的时间点,转录本仍然较高G. MINTRAADICE.- 与嘲弄接种的根的根源的根。有关OsCPK4,它的表达也被发现在响应G. MINTRAADICE.接种时间为24-72小时。OsCPK4表达返回到接种后96小时的与非接种根部相似的水平(图1A中间面板)。最后,OsCCaMK表达增加了G. MINTRAADICE.接种后72-96小时,感染根相对于模拟接种根的数量(图1A,下面的面板)。
总体而言,基因表达研究揭示了米饭的上调OsCPK4和OsCPK18AM共生前共生阶段的基因。这些结果在所有三个独立的实验中都得到了一致的观察。虽然表达OSCPK18,OSCPK4和OsCCaMK与未接种am的根相比,am接种的根中基因的表达上调,这也是事实,在这里分析的时间段内,这些基因的差异表达幅度不是很高。有关OsCCaMK在水稻中证明了在共生期间的作用[23.[响应于AM接种的表达水平的变化也很低,与观察到的OS的检测到的激活相比,在稍后的时间点发生CPK18和OsCPK4基因表达。
释放的扩散因子G. MINTRAADICE.诱导OsCPK18和OsCPK4在稻根中的表达
通常假设植物甚至在两个共生之间的物理接触之前感知AM真菌,并且该识别Myc因子触发了CA中的改变2+宿主根的水平和转录反应[7.那9.那11.那41.].在这项工作中,使用双三明治方法来研究是否观察到的诱导OsCPK18和OsCPK4表达可归因于真菌释放的扩散因子。该系统防止两个共生体之间的接触,同时允许信号分子交换[42.].OsCPK18和OsCPK4RT-qPCR分析表达(图1B.).使用双三明治系统进行接种稻谷时,OsCPK18和OsCPK4表达被发现在反应中被迅速激活G. MINTRAADICE.接种(图1B.,上、中面板)。然而,诱导OsCPK4和OsCPK18表达不随时间而保持(两个基因的最大诱导发生在接种后24小时)。在中也观察到类似水平的转录本积累G. MINTRAADICE.-和模拟接种根在这里分析的最新时间点(接种后96小时)。从这些结果可以得出结论,一个扩散真菌因子引发水稻的表达OsCPK18和OsCPK4基因,这种激活是短暂的。最重要的是,需要在感染过程的后续阶段以活化的方式保持两种伴侣之间的接触以保持这些基因的表达。在相同的实验条件下,激活OsCCaMK基因表达在接种后24 h也发生了OsCCaMKAM接种和嘲弄接种根部之间的基因表达低于观察到的CPK.基因(图1B.,下面的面板)。
OsCPK18在微解剖的根细胞中的表达
激光显微解剖(LMD)技术已成功应用于不同植物中含丛枝植物细胞的基因表达分析Medicago.那L.O.TUS.或番茄27.-29.那43.那44.].为了确定最合适的固定和包埋条件,以保留细胞形态,同时仍能提取高质量的RNA用于PCR扩增,已经开发了各种各样的根组织LMD协议。这样,激光微解剖细胞就可以用于RNA的提取和表达研究,从而避免了全根提取RNA样本的稀释作用。在这项工作中,先前开发的协议[43.],用于番茄根系细胞的分离,获得水稻根系细胞。石蜡组织制剂结合Methacarn固定提供了水稻根组织,令人满意地保留了细胞形态。然后,从激光显微解剖的根细胞中获得高质量的RNA样本。
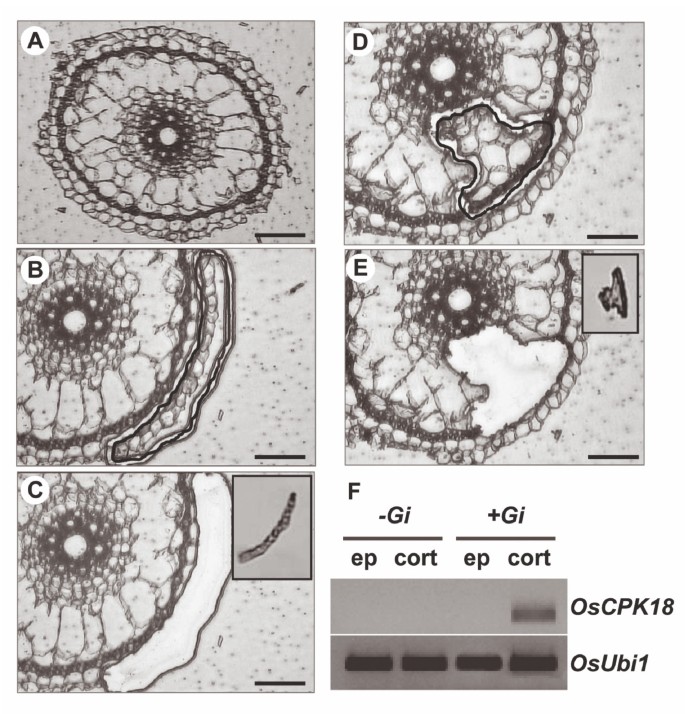
表皮和皮质的部分是由G. MINTRAADICE.-和模拟接种水稻根接种后4天(图)2).细胞,无论是表皮细胞或皮层细胞,收集并用于RNA提取。细胞类型特异性的表达模式OsCPK18基因在激光微散射细胞中检查。因为它如图所示2f.那OsCPK18在皮质细胞中专门检测到转录物G. MINTRAADICE.接种水稻根系。OsCPK18在真菌接种根部的表皮细胞中不可检测到转录物。通过嵌套的PCR确认了真菌接种根的表皮细胞中的PCR扩增产物(结果未显示)。对成绩单的成绩单ubiquitin1基因(图2f.) 或者还有在从激光微散射细胞获得的所有RNA样品中也检测到基因(未显示结果)。使用跨越内含子的基因特异性引物排除了用于RT-PCR分析的总RNA样品中基因组DNA的可能性。在RT阴性反应中没有扩增产物,也排除了从激光微散射细胞获得的RNA样品中的任何DNA污染(结果未显示)。最后,OsCPK4在从真菌接种和对照根部捕获的两种细胞类型获得的RNA样品中检测到转录物,该观察进一步支持本研究中使用的RNA样品的完整性(附加文件2:图S2)。
水稻根表皮和皮层细胞的激光显微解剖。(A)典型的水稻根横截面。(B和C)激光显微解剖前(B)和后(C)具有代表性的靶向表皮细胞横切面。(D和E)激光显微解剖器切割前(D)和(E)后靶向皮质细胞的代表性横切面。C和E的插图显示显微解剖的细胞。采用LMD分离水稻根表皮细胞和根皮层细胞进行了两个独立的实验。(F) RT-PCR分析检测OsCPK18激光微放射细胞中的转录物来自稻谷。收获细胞G. MINTRAADICE.接种(+GI.)和模拟接种( -GI.)的根源。总RNA样本从汇集的微解剖细胞中获得。采用RT - PCR一步法进行表达分析。OsCPK18转录本仅在皮质细胞中检测到。柱,100 μm (A), 50 μm (B到E)。
比较获得的结果时OsCPK18在激光显微解剖细胞中的表达(图2f.)和整根(图1),一个明显的矛盾被观察到。因此,OsCPK18从嘲弄接种根部的分离细胞中未检测到转录物(图2f.),而RT-qPCR分析显示OsCPK18在整根表达(图1A,上半部分)。考虑到这些研究中使用的植物材料和实验方法,可以解释这一发现。在这项工作中,仅收获两种细胞类型的根目录,用于LMD相关的分析(表皮和皮质细胞)。因此,检测OsCPK18整个模拟接种根部的表达可能是由于细胞类型的存在组成型表达OsCPK18没有用LMD(即来自中央圆筒的细胞)的分析。另外,横向部分在Aprox常规地进行。距离根尖2厘米。因此观察到的表达OsCPK18除了用于激光微粉(即,MERISTEMS)的稻根区域中的基因可能很好地占所观察到的OsCPK18在模拟接种的全根中表达。这一观察结果也说明,使用全根获得的基因表达结果往往会被误解,使用全根可能无法感知基因表达的空间差异。显然,更详细的分析OsCPK18在水稻根系生长发育过程中需要表达。
OSCPK18的亚细胞定位
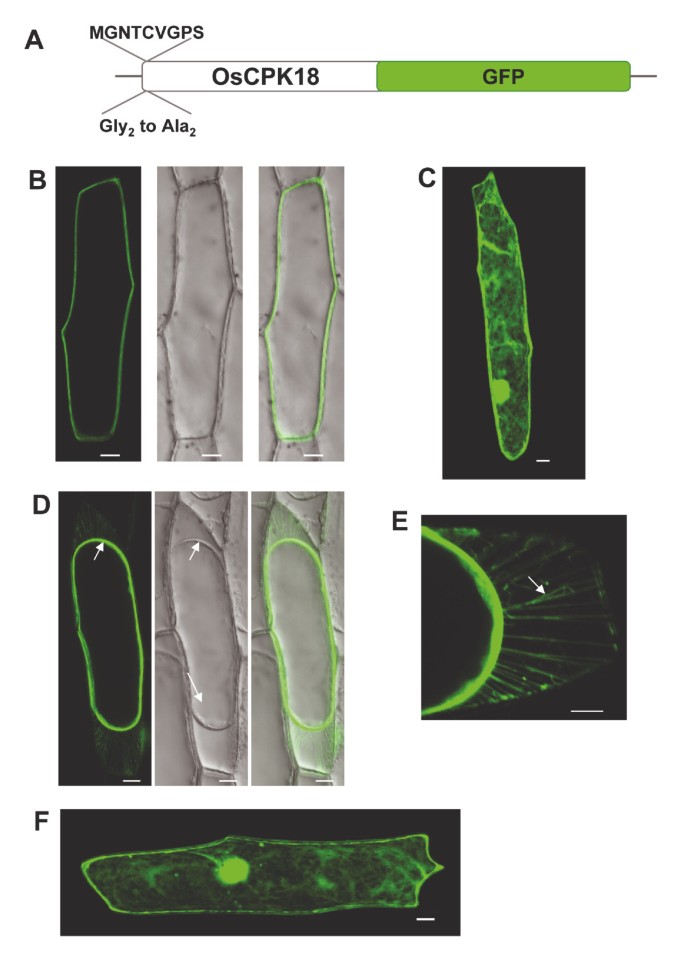
洋葱表皮细胞被广泛应用于评价gfp标记蛋白的亚细胞位置。因此,我们研究了OsCPK18在洋葱表皮细胞中瞬时表达绿色荧光蛋白(GFP)基因融合的亚细胞定位(图)3A).转化的洋葱细胞的共聚焦显微镜显示,OSCPK18-GFP定位于细胞周边,可能是质膜(图3B.).如预期的那样,表达GFP基因的洋葱细胞显示在整个细胞中分布的荧光(图3C).
异位膜定位OSCPK18。野生型OSCPK18和N-末端MyRistoylation突变体瞬时表示为洋葱表皮细胞中的GFP融合蛋白。轰击后24小时拍摄共聚焦图像。(a)用于粒子表皮细胞,野生OSCPK18-GFP和突变体OSCPK18-GFP融合蛋白的粒子轰击的构建体的图。2突变为Ala (OsCPK18G2A.).(b)野生OSCPK18-GFP融合蛋白的定位。与相应的光显微照片的绿色荧光通道的合并图片显示在右侧。(c)GFP的定位。(d)用甘露醇(15分钟15分钟)等离子体溶液后的洋葱细胞。光显微照片显示原生质体(白色箭头)的收缩。(e)用甘露醇处理使Hechtian股线(箭头)将质膜附着到细胞壁上。(f)洋葱表皮细胞,用改变的MyRistoylation位点表达突变形式的OSCPK18(OSCPK18G2A.-GFP)。虽然野生型蛋白质局部局限于血浆膜,但G2一个突变蛋白失去了它特有的质膜定位。投影(B, C, D, F)和个别(E)切片显示。比例尺= 20 μm (B, C, D, F), 10 μm (E)。
洋葱表皮细胞对于质膜蛋白的分析也特别有用,因为环境条件可以被操纵,从而导致质膜分离和部分质膜从细胞壁分离。洋葱表皮细胞在转化后发生质裂解OSCPK18-GFP.。在等离子体聚糖细胞中,OSCPK18-GFP呈现出与其在缩小原生质的质膜中的位置一致的图案(图3d).在这些条件下,原生质体从细胞壁拉出,留下大量薄的等离子体膜桥,称为Hechtian股线,牢固地固定在细胞壁上(图3E).
OSCPK18的氨基酸序列的分析表明,OSCPK18多肽在第2位(GLY)的含量残留物中具有N-末端肌细胞酵母位点(Gly2)提示n -豆蔻酰化。这种脂质修饰以促进和稳定某些CPKs的膜结合的必要性已经被实验证明[37.].为了解决异质膜结合中OSCPK18的MyRistoylation位点的作用,制备了OSCPK18多肽的N-末端肌中织物位点(MGNTCVGPS)的突变。将GLY2转化为ALA(G2A,称为OSCPK18G2A.)并融合给GFP(图3A).表皮洋葱细胞中的瞬时表达显示了含量2突变消除了OsCPK18的质膜定位(图3F.).相反,对于单独的GFP类似的OSCPK18的突变版本观察到整个小区的分布。这些发现表明,N-末端MyRistoylation位点是在质膜处OSCPK18的亚细胞定位所必需的。
系统发育分析CPK.基因
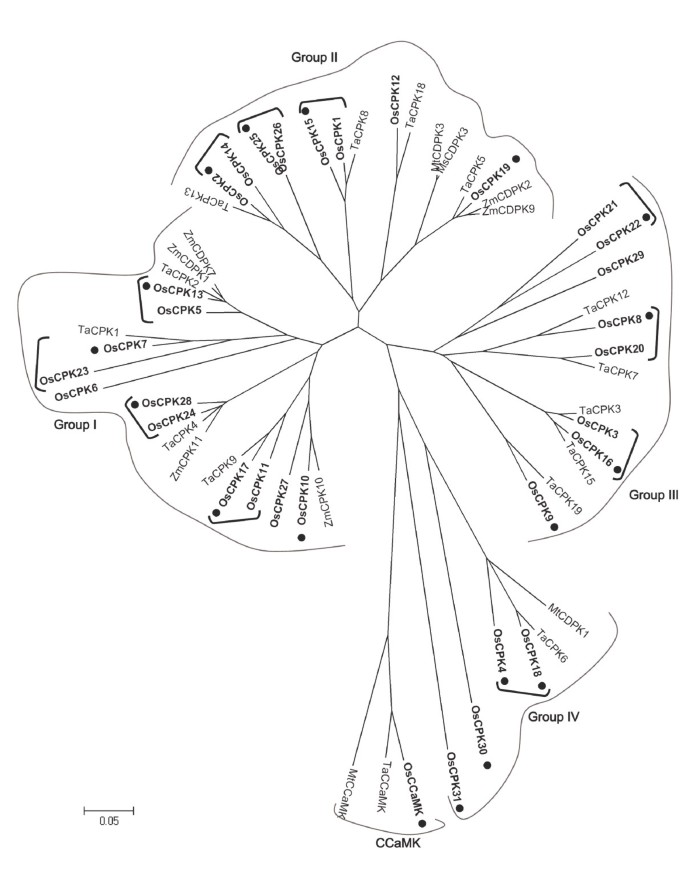
在这项工作中,确定了来自水稻的CPKs与已知的其他植物CPKs之间的进化关系,这些CPKs与AM真菌建立了关联。对于本分析,来自谷类物种,即小麦和玉米的全长CPK蛋白序列,以及迄今为止在模式共生物种中表征的CPKsMedicago.被使用了。如前所述,水稻基因组含有31CPK.分为四个主要系统发育组(I-IV)的基因[39.那40].已知的CCaMK蛋白序列来自水稻、小麦和Medicago.也被考虑。在这方面,水稻基因组包含一个单一的CCaMK基因(39.].由于拟南芥不是AM真菌的寄主,因此拟南芥未被纳入系统发育分析。
基于邻近的方法构建CPK和CCAMK蛋白的系统发育树(图4.)或最大分析方法(附加文件3.:图S3)。用于构建系统发育树的各种蛋白质的抗性在附加文件中呈现4.).类似于先前报道的内容[40], CPKs聚为四个不同的系统发育组(图4.).四个不同的CPK,OSCPK18,OSCPK4,OSCPK30和OSCPK31,集群到CPKs独立的CPK,IV族,似乎与其他水稻CPK序列显着发散。明显,这里的结果显示了这一点OsCPK18和OsCPK4都被AM真菌上调了G. MINTRAADICE.,这些特定的CPK属于米CPKs的第IV族。至于水稻CPKs组IV组的其他成员,不能在稻谷中检测到表达Oscpk31, 然而Oscpk30表现出低表达,但对AM接种无应答。
通过对CPK和CCaMK蛋白的系统发育分析,我们发现了一些有趣的现象。首先,OsCPK18和OsCPK4似乎与am相关的MtCDPK1密切相关(图)4.).第二,第四类水稻CPKs与CCaMKs具有密切的联系。的确,与其他CPKs相比,第四组CPKs似乎与CCaMKs更相关。在这里,值得一提的是,它的基本功能MTCCAMK.和OsCCaMK在菌根共生的过程中[18.那23.].最后,OsCPK18明显与TaCPK6相关,TaCPK6是小麦中描述的20个CPKs之一[45.].
序列分析OsCPK18和OsCPK4启动子
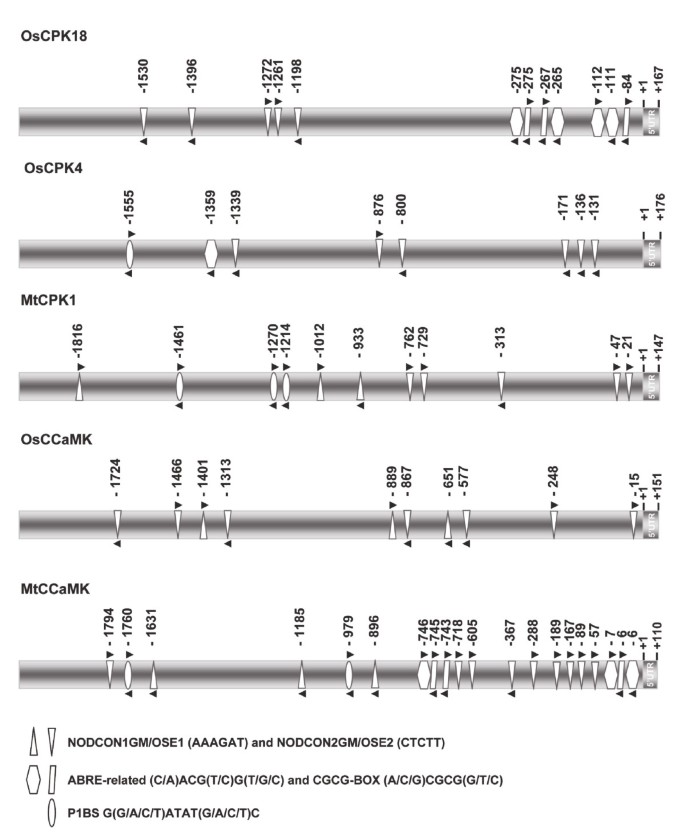
知道这一点OsCPK18和OsCPK4响应于与AM真菌接种而转录激活基因G. MINTRAADICE.,调查与共生有关的情况有兴趣CIS.- 这些基因的启动子区域中存在。这OsCPK18和OsCPK4使用该算法进行启动子分析[46.]并扩展到AM和根瘤根结节Symbiases的众所周知的基因,例如MtCPK1和MTCCAMK.基因m . truncatula和OsCCaMK来自米饭。
分析了2 kB启动子区的分析OsCPK18和OsCPK4基因揭示了CTCTT元素(Nodcon2GM)的存在,该CTCTT元素(NODCON2GM)在其中最多可发现五倍和六次OsCPK18和OsCPK4分别推动者(图5.和额外的文件5.:表S1和S2)。NODCON2GM以及NODCON1GM元素(AAAGAT)是来自根结节和AM共生期间受到调节的基因的启动子的特征基序。这些图案也是“器官特异性元素”(OSE)序列的一部分[47.].这MTCPK1,OSCCAMK和MTCCAMK启动子含有NodCon1GM和Nodcon2GM共识序列的几拷贝。
有趣的是,与之相关的共识术术[(c / a)acg(t / c)g(t / g / c),大明矾的多份副本存在于近端区域OsCPK18推动者(图5.和额外的文件5.:表S1和S2)。abre相关的母题是CIS.-Element在162 CA的上游区域中识别2+-反应性上调基因[48.].此外,CGCG-BOX元素(GCCGCGGC)在Oscpk18推动者,这个元素参与了CA++/钙调素调节的基因表达[49.] (数字5.和额外的文件5.:表S1和S2)。这OsCPK4启动子区域包含abre相关基序元件的一个拷贝。发现G(G/A/C/T)ATAT(G/A/C/T)C (P1BS元素)OsCPK4, MtCPK1和MTCCAMK.启动子(图5.和额外的文件5.:表S1和S2)。该元件在几种植物的磷酸盐饥饿反应基因的上游区域被发现[50.].
最后,OsCPK18和OsCPK4启动子与多种压力相关CIS.- 包括所知的元素,包括赋予病原体调节基因的反应的元素。其中一些在这些启动子中代表多次,例如含有TGAC的W盒式转录因子(附加文件5.:表S1和S2)。与此一致,我们最近报道了水稻根定殖过程中防御和胁迫相关基因的激活G. MINTRAADICE.[4.].的表达式是否OsCPK18和OsCPK4病原菌侵染根系过程中调控的基因尚不清楚。
总体而言,本研究揭示了与共生相关的主题的存在,以及与CA相关的推定元素2+对基因表达的调节,在启动子区OsCPK18和OsCPK4基因。这种观察结果与两者的观察到的诱导一致CPK.am接种水稻根的基因。
讨论
在这项工作中,表达了CPK.在水稻中AM共生的早期阶段监测基因。这OsCPK18和OsCPK4始终显示出响应于接种的上调。还介绍了转录激活的证据OsCPK18和OsCPK4通过由此产生的扩散分子的表达G. MINTRAADICE.。比较米的表达轮廓CPK.和C.CaMK基因,似乎两者的激活CPK.基因(OsCPK18和OsCPK4)比那更早地发生OsCCaMK指向这些特定米的作用CPK.在共生过程的早期阶段的基因。观察OsCPK18, OsCPK4, OsCCaMK, MtCPK1和MTCCAMK.基因股份与共生相关CIS.-元素也表明这些基因的转录调控是参与水稻AM共生的信号机制的一部分。展开的观点OsCPK18基因表达来源于激光显微解剖水稻根细胞的表达研究。接种后4天G. MINTRAADICE.那OsCPK18在皮层细胞中可见,而在表皮细胞中不可见。
显然,在给定的信令路径中的CPK功能的特异性可以不仅可以通过表达的差异模式而且通过靶向CPK蛋白到特定的亚细胞室来实现。除此之外,CPK蛋白质似乎广泛分布在亚细胞室中,包括细胞溶胶,过氧化物组,质膜,油体和细胞核,以及与肌动蛋白长丝,线粒体和内质网相关联的关系[33.].我们在转化的洋葱细胞中的结果清楚地证明了OSCPK18定位于质膜。此外,OSCPK18至血浆膜的关联可能与该蛋白质的N-末端肌苷膜相连。
知道CPKs充当Ca2+在植物信号的传感器,和Ca2+在AM共生中发挥着重要作用,作为CA的OSCPK18的功能2+可以设想在AM诱导的主体反应期间传感器可以设想对AM真菌的反应。因此,对真菌产生的共生信号的感知将激活建立共生关联所需的下游信号事件,包括细胞质和核CA2+尖峰反应[9.-11.].加利福尼亚州的改变2+水平本身就是调节上调的一个主要因素OsCPK18通过CA存在判断,核中的基因表达2+响应CIS.-Elements在OsCPK18启动子区域[48.].符合此,拟南芥的先前研究揭示了CA中与毛杆菌相关序列的存在2+- 响应基因,独家在上调的CA中2+- 响应基因[48.].ABRE-CIS元素的四聚体足以赋予该转录激活响应CA2+瞬变。存在多个Ca2+响应CIS.-调控元件的启动子区域OsCPK18基因(如abre相关和CGCG-box元件)有利于Ca2+- 相关的上调OsCPK18基因表达。回应快速瞬态CA的转录因子的身份2+信号,随后通过abre相关激活基因表达顺式元素仍有待确定。
除了转录激活,CA直接调节OSCPK18酶活性2+可以预期。因此,众所周知,CPKs的活性是由钙结合到其固有的钙调素样结构域来调节的。在基底Ca2+浓度,功能性自身调节结构域用作抑制CPK(自动抑制结构)的激酶活性的假效。响应瞬态增加的蜂窝CA水平2+, CPKs经历构象变化,激活其激酶活性(钙结合结构)[51.].因此,可以合理地假设,定位于质膜的OsCPK18蛋白能够感知am诱导的细胞质Ca的增加2+水平并将该信号转移到磷酸化过程中。这OsCPK18介导的信号传导过程可能对根皮层中真菌Symbiont的根部定植和容纳来说是至关重要的。然而,鉴定OSCPK18激酶活性的下游靶案需要进一步调查。
另一方面,我们能够建立菌根协会的CPK和CCAMK的系统发育分析表明,CPK和CCAMK的第四族彼此密切相关,指向两种蛋白激酶的两个家庭之间的进化关系。在绿色藻类中进行的其他研究中,提出了CCAMK起源于绿藻进化期间CPK的基因复制[52.]完全,这些发现明确支持CPKS第IV组成员的功能专业化及其与CCAMK功能的相关性。适应步骤可能发生在不同植物物种中,确定其功能专业化和共生特异性调节。
目前的工作还为进一步的麦片化能力与麦芽等菌根相关的复杂CPK家族的进一步努力调查提供了基础。因此,CPK的系统发育分析显示,OSCPK18和OSCPK4与小麦TACPK6蛋白质密切相关,以及Medicago.MtCDPK1蛋白质。MtCDPK1在AM共生建立过程中的作用已被充分证明[53.].因此,人们很容易推测TaCPK6基因在小麦植株中可能表现出am调控的表达模式。
一个有趣的方面是在CPKs的第IV组中存在三个拟南芥蛋白[39.,尽管拟南芥不是AM真菌的宿主。到目前为止,已经有人提出,植物发育的其他方面所需的基因可能已经被招募到共生途径中发挥作用。与此相一致,失活MTCDPK1基因与根瘤菌和菌根共生的显著减少有关,也导致矮小的根和短的根毛m . truncatula[53.].在其他研究中,根发发育的损害导致共生的相互作用有缺陷L. japonicus.[54.].然后,CPKS第IV族内的拟南芥CPK可能在根生长和发展期间在正常过程中发挥作用。在不与AM真菌联系的物种中发现Sym基因(例如Arabidopsis和Physcomatrella.),还支持在根系中正常发育过程中发挥的特定基因也可能调节菌根感染。如果是这样,这一事实将解释通过RT-QPCR在整根对整根进行的实验中观察到的OSCPK18的表达。
结论
本研究为水稻AM共生的分子机制研究提供了新的思路OsCPK18- 在此过程中呈现的信号通路功能。快速激活OsCPK18结果表明,OsCPK18可能在水稻AM真菌的感知和/或识别过程中发挥了重要作用。与豆科植物相比,对这一重要作物的AM共生互作特性的研究投入较少。OsCPK18可能被认为是共生过程的前共生阶段的标记,可能在根皮层中发挥优先作用。现在我们可以对OsCPK18参与的am诱导信号过程的其他成分进行鉴定。未来研究的一个主要挑战是确定CPKs和SYM组分之间是否存在相互连接和协同功能,这种相互作用决定了两个共生伙伴之间的识别和兼容性。
方法
植物材料及生长条件
米 (栽培稻CV Nipponbare)用作实验材料。将种子用70%乙醇的表面灭菌1分钟,次氯酸钠(30%v / v)持续30分钟,并用无菌水广泛洗涤(四次,10分钟)。用最小培养基制备的琼脂(0.4%)发芽种子。幼苗在垂直板上的18h / 6小时光/黑暗中在27℃下生长。
G. MINTRAADICE.(DAOM197198)孢子由红萝卜根的红萝卜培养物制备,如前面描述的[4.].根和G. MINTRAADICE.将培养物在5体积的5体积的无菌10mM柠檬酸钠中溶解,在37℃下,在37℃下溶液6.0,并通过250μm筛过滤四次。用稻根接种G. MINTRAADICE.孢子悬浮液,使用单一三明治[29.或双层三明治[42.)系统。
单夹芯法是将水稻幼苗直接接种丛枝菌根孢子悬浮液或模拟接种(无菌水),置于两片无菌硝化纤维素膜(Millipore,孔径0.45 μm)之间。对于双层夹层法,首先将水稻幼苗置于两个微孔膜之间。然后用真菌孢子悬浮液接种被膜覆盖的幼苗,并覆盖第二层膜。这样,真菌和根之间的物理接触就避免了。将含有接种苗的组装三明治放置在含有0.4%琼脂的培养皿中。由于微孔膜对扩散分子是可渗透的,即使在两个共生体之间没有物理接触的情况下,根细胞也可以在双层夹层法中感知真菌信号。对照苗用无菌水接种。
组织制备和激光显微解剖
上述方法[43.的细胞分离方法G. MINTRAADICE.- 植物和嘲弄接种的稻食。将4-8mm的根部长度与剃刀刀片分解并立即转移到新鲜制备的甲基氨基甲溶液中(绝对甲醇/氯仿/冰醋酸6:3:1)。将根部保持在固定溶液中过夜,然后在4℃下在4℃:50,70和90%的乙醇中脱水,在无菌水中和100%乙醇,然后用异丙醇(两次),每次踩到冰上1小时。用石蜡逐渐替换异丙醇(副桩加上; Sigma Aldrich,St.LOUIS)。使用Reichert Jung 2050 Supercut电动切片机(Leica,Arnsberg,Germany)制造10-15μm的横向根部。丝带布置在无RNase,UV处理的笔膜2.0μm载玻片上。将载玻片在40℃下保持在滑块升温,直至干燥并在4℃下储存并在两天内使用。
Leica LDM6000激光微探测系统(Leica,Bannockburn,IL,USA)用于激光微生物(LMD)。就在使用前,石蜡切片在Neoclear(Merck,Darmstadt,Germany)处理中脱糖膜10分钟,然后加入100%乙醇2分钟,然后空气干燥。将脱碱的载玻片放在显微镜上。通过摄像机在计算机监视器上可视化组织。标记表皮和皮质细胞,然后使用UV激光(337-nm波长)切割。收集靶细胞,没有任何额外的力进入微量加压(无RNase的PCR管帽)。对于每种细胞类型,我们每种生物复制分离至少1500个细胞部分,并进行了两个独立的生物重复。在收集后,添加了来自Picopure试剂盒(Arcturus,Sunnyvale,Ca,U.S.)的50μl的RNA提取缓冲液。将样品在42℃下孵育30分钟,以800g离心2分钟,并在-80℃下储存直至RNA分离。
RNA孤立
接种后,在不同时间从整根中提取总RNAG. MINTRAADICE.孢子,以及模拟接种的根,使用TRIZOL®试剂(Invitrogen,Carlsbad,Ca,USA)。对于每个时间点,收集了至少12种单个植物的根。进行了三个独立的实验。第一个cDNA由具有M-MLV(Moloney-鼠白血病病毒)逆转录酶(Invitrogen,Carlsbad,Ca,USA)的DNase处理的总RNA(1μg)合成。将得到的RT反应产物的等分试样用作PCR分析的模板。
使用改进的Picopure套件协议(Arcturus,Sunnyvale,CA,USA)进行激光微小细胞的RNA分离。基本上,在试剂柱上未进行DNase治疗,但在25μl的DEPC处理H中洗脱RNA2o然后用无RNase的DNase(Roche,Mannhein,德国)治疗。沉淀后0.1 Vol。3M Na-醋酸盐和2.5 Vol。冷乙醇(100%),将RNA重悬于20μL无菌水中并使用纳米二玻璃1000分光光度计量化。
基因表达分析
实时定量PCR (RT-qPCR)分析在光学96孔板LightCycler中进行®480根据以下程序的实时PCR系统(Roche):10分钟在95°C下,其次为45个循环为95°C,10 s,60°C,30 s,以及额外的解离曲线循环以确保独特的放大。将反应混合物含有10μl2×SYBR绿母混合物试剂(罗氏,Mannhein,德国),2μLcDNA样品和300μm的每个基因特异性引物,最终体积为20μl。用于RT-QPCR的引物在附加文件中表示6.:表S3。关于MIQE指南后RT-QPCR分析的详细信息[55.]包含在附加文件中7.。通常,每个样品使用三个重复反应。数据归一化osact1.内部控制。三次重复pcr的平均CT值归一化为平均CT值osact1.基因从相同的RNA制备。分析了三个独立的生物学重复。每个生物材料做3个技术重复进行RT-qPCR分析。
本研究采用半定量逆转录聚合酶链反应(RT-PCR)研究水稻的表达模式CPK.基因以及米饭信谊基因,即OsSYMRK、OsCCaMK OsPOLLUX和OsCASTOR基因。(附加文件8.:表S4和附加文件9.:补充方法)。
对于从激光显微解剖细胞中获得的RNA样本进行RT-PCR分析,根据制造商的说明书(Qiagen GmbH, Hilden, Germany)一步RT-PCR。20μl反应制备,为每个反应包含以下试剂:4μl (5 x)试剂盒一步法rt - pcr缓冲,0 5μl试剂盒一步法rt - pcr酶混合,0,每个核苷酸的5毫米,0,每个引物的25μM, 21 ng总RNA和核糖核酸酶的自由水20μl。
系统发育分析
从NCBI数据库获得全长蛋白质序列并使用CLUSTALW对齐[56.].使用GeneDoc 2.7.0软件建立了不同植物CPKs的比对[57.],并显示在附加文件中4.。
除了来自水稻的31个CPK外,已知的CPK全长序列来自m . truncatula那m .漂白亚麻纤维卷和Zea Mays.也使用了。它们(登记号码来自国家生物技术信息中心的基因库(NCBI)数据库http://www.ncbi.nlm.nih.gov/:MTCDPK1 [AAX15706],MTCDPK3 [ABE72958]和MSCDPK3,X96723];ZMCDPK1 [BAA12338],ZMCDPK2 [AAA69507],ZMCDPK7 [BAA13232],ZMCDPK9 [BAA12715],ZMCDPK10 [CAA07481]和ZMCDPK11 [AAP57564]。至于小麦,已经描述了最多20个CPK,从该研究中包含14种可用序列[45.].它们分别是:TaCPK1 [ABY59004], TaCPK2 [ABY59005], TaCPK3 [ABY59006], TaCPK4 [ABY59007], TaCPK5 [ABY59008], TaCPK6 [ABY59009], TaCPK7 [ABY59017], TaCPK8 [ABY59010], TaCPK9 [ABY59011], TaCPK12 [ABY59012], TaCPK13 [ABY59018], TaCPK15 [ABY59013], TaCPK18 [ABY59014], TaCPK19 [ABY59015]。此外,还对水稻、小麦和小麦的CCaMK序列进行了分析Medicago.水稻OsCCaMK [Q6AVM3]、小麦TaCCaMK [ADK22086]和m . truncatulaMTCCAMK [Q6RET7]序列。根据邻近的方法创建系统发育树(图4.)或最大判例算法(附加文件3.:图S3)使用MEGA4程序[58.那59.].
启动子分析
序列2000 BP所选上游CPK从NCBI数据库中检索基因。已知的植物图案是从地点数据库获得的http://www.dna.affrc.go.jp/place/。
共聚焦显微镜下的生物细胞转化和成像
为了探讨OSCPK18的亚细胞定位,绿色荧光蛋白(GFP)基因是平移地融合到C末端的末端OsCPK18序列。为此,一个GFP.缺失n端信号肽和c端HDEL序列的基因通过PCR初步获得m-GFP5-ER顺序 [60.].使用的引物为5'-cggGGATCCatgagtaaaggagaagaacttttcc -3'(向前)和5'-CCGAGCTCTTATTATTTGTATAGTTCATCCATGC-3”(反向)。在PCR反应中,BamHI和SACI.将位点引入PCR扩增的DNA片段(PCR引物序列中下划线的核苷酸)。接下来,这是GFP.变体克隆在BamHI和SACI.PUC19衍生质粒的遗址覆盆子35 scamv启动子和Nopaline合成酶终止子(TNO.)创造PP35S:MGFP:NOS构造。
这OsCPK18DNA片段是翻译成融合的GFP.通过PCR扩增产生基因。一种BglII位点被引入到pcr扩增的3'端Oscpk18DNA片段。同样,一个SPE.I位点是在5′端引入的Oscpk18序列。全长OsCPK18对从KOME (Knowledge-based Oryza Molecular biology Encyclopedia)数据库中获得的克隆株J023148F12进行cDNA序列pcr扩增,引物为5'-ATactagt.ATGGGACTCTGCTCCTCCTCC-3' (forward)和5'- ATAGATCTACCTGGTGGTGGCGATCTGTGAACACTCCT-3'(反向)(带下划线的序列表示SpeI和BglII限制性位点;加粗字体表示尾部残留的一个甘氨酸和三个脯氨酸,以确保融合)。获得嵌合体OSCPK18-GFP.基因,PCR-amplifiedOsCPK18DNA片段被消化SpeI和BglII并克隆到消化的XbaI/ bamhi中PP35S:GFP:NOS质粒产生质粒pP35S: OsCPK18-GFP: nos。
一种嵌合基因,其中突变版本OsCPK18基因融合到了GFP.基因也被制备。准备突变版本的OsCPK18将含量2的甘氨酸残基转化为ALA(G2A),其中pP35S: OsCPK18-GFP: nos以质粒为模板进行PCR。为此,一个向前引物与一个单一的变化(粗体)5'-ATactagt.atgg.CActCTGCTCCTCCTCC-3',和OsCPK18使用上述反向底漆。这OsCPK18G2A.然后将DNA克隆到XbaI / BamHI消化PP35S:MGFP:NOS质粒。通过核苷酸测序验证所有构建体。
通过粒子轰击转化洋葱表皮细胞。通过从新鲜洋葱灯泡剥离内表皮来制备洋葱灯泡鳞片的表皮。对于每个DNA构建体,将4μg的DNA与20μl0.1M颗粒物混合,50μl2.5mcac2和15μl的金微载体(60μgml-1在50%甘油中),剧烈旋转30秒,800 g在微离心机中离心10秒。用乙醇洗涤颗粒。使用生物PSD-1000/He粒子输送系统(Bio-Rad),在1100 psi的压力下,靶距为6cm的条件下将dna -金粒子轰击细胞。转染后的细胞在MS培养基上黑暗保存16-24小时。在Olympus Fluoview FV1000共聚焦激光扫描显微镜(东京,日本)上,用共聚焦激光扫描显微镜(CLSM)测定融合蛋白的亚细胞定位。激发波长为488 nm。GFP的发射窗口设置在500-600 nm。为确认质膜定位,用0.75 M甘露醇对细胞进行质膜分离。
参考文献
- 1。
史密斯S,读D:菌根共生。伦敦:学术出版社;2008年。
- 2。
Parniske M:丛枝mycorrhiza:植物根尾剂的母亲。NAT Rev Micro。2008,6:763-775。10.1038 / nrmicro1987。
- 3.
Liu J, Maldonado-Mendoza I, Lopez-Meyer M,张F, Town CD, Harrison MJ:丛枝菌根共生伴随着局部和系统的基因表达改变和抗病性的提高。植物学报,2007,50:529-544。10.1111 / j.1365 - 313 x.2007.03069.x。
- 4。
水稻基础防御机制的激活Glomus mortraradice.不影响丛枝菌根共生。新植物学报,2010,33(6):593 - 598。10.1111 / j.1469-8137.2010.03386.x。
- 5。
谷菌根:现代农业中的一种古老的共生关系。植物科学进展,2008,13:93-97。10.1016 / j.tplants.2007.11.006。
- 6。
Akiyama k,Matsuzaki Ki,Hayashi H:植物Sesquiterpenes在丛枝菌根真菌中诱导亚酚枝。自然。2005,435:824-827。10.1038 / Nature03608。
- 7。
Maillet F,Poinsot V,Andre O,Puech-Pages V,Haouy A,Gueunier M,Cromer L,Giraudet D,Formey D,Niebel A,Martinez EA,Driguez H,Becard G,Denarie J:真菌脂肪寡聚糖在丛林中的真菌信号mycorrhiza。自然。2011,469:58-63。10.1038 / Nature09622。
- 8。
丛枝菌根真菌诱导细胞内结构的研究Medicago Truncatula.感染前根表皮细胞。acta botanica sinica, 2017, 36(5): 489- 494。10.1105 / tpc.105.035410。
- 9。
Chabaud M, Genre A, Sieberer BJ, Faccio A, Fournier J, Novero M, Barker DG, Bonfante P:丛枝菌根菌丝和萌发孢子分泌引发豆科和非豆科根表皮Ca2+峰值。新植绿,2010,347-355。
- 10。
孙杰:豆科植物共生信号通路中钙信号的差异和混乱。美国国家科学院学报。2008年,105:9823 - 9828。10.1073 / pnas.0803499105。
- 11.
丛枝菌根真菌的扩散信号诱导寄主植物细胞内钙离子的瞬时升高。植物营养与肥料学报。2007,33(4):457 - 461。10.1104 / pp.106.086959。
- 12.
共生信号核心的核钙变化。植物生态学报。2006,9:351-357。10.1016 / j.pbi.2006.05.003。
- 13。
菌根共生植物与真菌相互作用的机制。国家自然科学基金,2010,1:48-
- 14。
paszkowski u:通过丛枝菌根ysbioss的信号传达的旅程。新植物。2006,172:35-46。10.1111 / J.1469-8137.2006.01840.x。
- 15。
哈里森MJ:在丛枝菌根共生中的信号传导。Annu Rev Microbiol。2005,59:19-42。10.1146 / annurev.micro.58.030603.123749
- 16。
Charpentier M,Bredemeier R,Wanner G,Takeda N,Schleiff E,Parniske M:Lotus Japonicus Castor和Pollux是离子通道,对豆科根胚胎纤维素症的Perinucleclecalcalcalciping尖锐必不可少的离子通道。植物细胞。2008,20:3467-3479。10.1105 / TPC.108.063255。
- 17。
Kanamori N,Madsen LH,Radutoiu S,Frantescu M,Quistgaard Emh,Miwa H,Downie Ja,James Ek,Felle Hh,Hhaing Ll,Jensen Th,佐藤S,Nakamura Y,Tabata S,Sandal n,Stougaard J:核偶诱导Ca2 +在豆类结节发育中诱导Ca2 +尖峰,对Rhizobial和真菌共生至关重要。美国国家科学院学报。2006,103:359-364。10.1073 / pnas.0508883103
- 18。
在细菌和真菌共生过程中,Ca2+和钙调素依赖的蛋白激酶是必需的。中国科学:地球科学。10.1126 / science.1093038。
- 19。
Saito K,Yoshikawa M,Yano K,Miwa H,Uchida H,Asamizu E,Sato S,Tabata S,Imaizumi-Anraku H,Umehara Y,Kouchi H,Murooka Y,Szczyglowski K,Downie Ja,Parniske M,Hayashi M,kawaguchi m:钙尖峰,真菌和细菌共生,种子生产需要核偶胆管85莲花japonicus.。植物细胞。2007,19:610-624。10.1105 / TPC.106.046938。
- 20。
Stracke S, Kistner C, Yoshida S, Mulder L, Sato S, Kaneko T, Tabata S, Sandal N, Stougaard J, Szczyglowski K, Parniske M:细菌和真菌共生所需的植物受体样激酶。自然科学。2002,417:959-962。10.1038 / nature00841。
- 21。
Yano K, Yoshida S, Müller J, Singh S, Banba M, Vickers K, Markmann K, White C, Schuller B, Sato S, Asamizu E, Tabata S, Murooka Y, Perry J, Wang TL, Kawaguchi M, Imaizumi-Anraku H, Hayashi M, Parniske M: CYCLOPS,共生胞内调节的中介。美国国家科学院学报。2008年,105:20540 - 20545。10.1073 / pnas.0806858105。
- 22。
Messinese E,Mun JH,Yeun LH,Jayaraman D,RougéP,Barre A,Lougnon G,Schornack S,Bono JJ,Cook Dr,Anéjm:一种新的核蛋白与共生DMI3钙和钙调蛋白依赖性蛋白激酶相互作用的Medicago Truncatula.。植物营养与肥料学报。2007,20(4):429 - 434。10.1094 / mpmi - 20 - 8 - 0912。
- 23。
Chen C,Gao M,Liu J,朱H:水稻的真菌共生,需要豆类常见共生基因的正交编码Ca2 + /钙调蛋白依赖性蛋白激酶。植物理性。2007,145:1619-1628。10.1104 / pp.107.109876。
- 24。
GoDFroy O,Debelle F,Timmers T,Rosenberg C:水稻钙和钙调蛋白依赖性蛋白激酶恢复豆类突变体的染色。Mol植物微生物相互作用。2006,19:495-501。10.1094 / mpmi-19-0495。
- 25.
Gutjahr C,Banba M,Croset V,AN K,Miyao A,G,Hirochika H,Imaizumi-Anrakuh H,Paszkowski U:丛生菌疹的特异性信号在水稻中超越共同的共生信号传导路径。植物细胞。2008,20:2989-3005。10.1105 / TPC.108.062414。
- 26.
Kuhn H, Küster H, Requena N:由扩散真菌信号诱导的膜甾体结合蛋白1在短梗苜蓿菌根化中起关键作用。新植物学报,2010,33(6):716-733。10.1111 / j.1469-8137.2009.03116.x。
- 27.
Fiorilli V, Catoni M, Miozzi L, Novero M, Accotto GP, Lanfranco L:一种丛枝菌根真菌定植的番茄植株的全球和细胞型基因表达谱。植物营养学报,2009,29(4):457 - 461。10.1111 / j.1469-8137.2009.03031.x。
- 28.
Gomez SK,Javot H,Deewatthanawong P,Torres-Jerez I,Tang Y,Blancaflor E,Udvardi M,Harrison M:Medicago Truncatula和Glomus Intraradics在皮质细胞中携带仲裁细胞中的枝条菌染色体共生中的枝条。BMC植物BIOL。2009,9:10-10.1186 / 1471-2229-9-10。
- 29。
Guether M,Balestini R,Hannah M,He J,Udvardi Mk,Bonfante P:在莲花粳稻丛林菌根共生期间的监管网络,运输,细胞壁和膜生物发生的基因组重新编程。新植物。2009,182:200-212。10.1111 / J.1469-8137.2008.02725.x。
- 30。
Güimil S, Chang HS, Zhu T, Sesma A, Osbourn A, Roux C, Ioannidis V, Oakeley EJ, Docquier M, Descombes P, Briggs SP, Paszkowski U:水稻转录组学揭示了一种古老的微生物定植反应模式。美国国家科学院学报。2005年,102:8066 - 8070。10.1073 / pnas.0502999102。
- 31。
丛枝菌根共生植物与真菌的基因表达。微生物学通报。2006,16:509-524。10.1007 / s00572 - 006 - 0069 - 2。
- 32。
Harrison MJ,Buuren ML:来自菌根真菌的磷酸盐转运蛋白glomus versiforme。自然科学。1995,378:626-629。10.1038 / 378626 a0。
- 33。
植物钙依赖蛋白激酶的结构和功能。生物化学学报。2007,54:219-233。
- 34。
Harper JF,Breton G,Harmo A:通过植物蛋白激酶解码CA2 +信号。Annu Rev植物Biol。2004,55:263-288。10.1146 / annurev.arplant.55.031903.141627。
- 35。
Cheng Sh,Willmann Mr,Chen HC,Sheen J:通过蛋白激酶的钙信号传导。拟南芥钙依赖性蛋白激酶基因家族。植物理性。2002,129:469-485。10.1104 / pp.005645。
- 36。
Harmon Ac,Gribskov M,Gubrium E,Harper JF:CDPK Superfamily蛋白激酶。新植物。2001,151:175-183。10.1046 / J.1469-8137.2001.00171.x。
- 37。
可口可乐,San Segundo B:ATCPK1依赖性蛋白激酶在拟南芥中介导病原体抗性。工厂J.2010,63:526-540。
- 38。
罗密斯T,Piedras P,Jones JDG:抗性基因依赖性植物防御反应中钙依赖性蛋白激酶的活化。植物细胞。2000,12:803-816。
- 39。
田中平,杨国平,林林,小松:水稻钙依赖蛋白激酶基因家族的全基因组鉴定:水稻CDPKs基因家族的综合分析。植物营养与肥料学报。2005,32(4):457 - 461。10.1093 /卡式肺囊虫肺炎/ pci035。
- 40.
Ray S,Agarwal P,Arora R,Kapoor S,Tyagi A:钙依赖性蛋白激酶基因家族在水稻中生殖发育和非生物胁迫条件的表达分析oryza sativa;L. SSP。indic。中国生物医学工程学报。2007,27(4):497 - 503。10.1007 / s00438 - 007 - 0267 - 4。
- 41.
魏德曼,桑切斯,戴思博,李志刚,李志刚,李志刚:紫花苜蓿(Medicago truncatula)中信号转导相关植物基因的诱导与菌根的建立相关。植物营养与肥料学报,2004,17(4):489 - 494。10.1094 / MPMI.2004.17.12.1385。
- 42.
Gutjahr C,Novero M,Guether M,Montanari O,Udvardi M,Bonfante P:丛枝菌根真菌吉拉斯玛格丽塔菌诱导淀粉积累释放的推迟因子。新植物。2009,183:53-61。10.1111 / J.1469-8137.2009.02871.x。
- 43。
Balestrini R, Gómez-Ariza J, Lanfranco L, Bonfante P:激光显微解剖揭示了五种植物和一种真菌磷酸盐转运蛋白基因的转录本同时存在于丛枝细胞中。植物营养与肥料学报,2007,20(4):489 - 494。10.1094 / mpmi - 20 - 9 - 1055。
- 44。
Gómez-ariza j,Balestrini r,Novero M,Bonfante P:菌根番茄根磷酸盐转运蛋白的细胞特异性基因表达。BIOL海洋土壤。2009,45:845-853。10.1007 / S00374-009-0399-2。
- 45。
李艾尔,朱毅,谭思,王X,魏B,郭鹤,张泽,陈XB,赵格,孔XY,毛泽东,毛泽东地区小麦小麦小康基因家族的进化和功能研究。植物mol biol。2008,66:429-443。10.1007 / s11103-007-9281-5。
- 46。
HIGO K,UGAWA Y,Iwamoto M,Korenaga T:植物顺式作用调控DNA元素(Place)数据库:1999。核酸RES。1999年,27:297-300。10.1093 / nar / 27.1.297。
- 47。
Stougaard J,Sandal Nn,GrønA,KühleA,Marcker Ja:5'Soybean Leghaemoglobin分析LBC.3.基因:启动子活性和器官特异性所需的调节元件。Embo J. 1987,6:3565-3569。
- 48。
Kaplan B,Davydov O,Knight H,Galon Y,Knight Mr,Fluhr R,FROMM H:Cytosolic CA2 +瞬态诱导的快速转录组变化显示雅典相关序列作为拟南芥中的CA2 + -Responsive CIS元素。植物细胞。2006,18:2733-2748。10.1105 / TPC.106.042713。
- 49.
Yang T, Poovaiah BW: A calmodulin binding/CGCG Box dna binding Protein Family Involved in Multiple Signaling Pathways in Plants。中国生物化学杂志。2002,27(4):449 - 458。10.1074 / jbc.M207941200。
- 50.
Rubio V,Linhares F,Solano R,MartínAc,iglesias j,leyva a,Paz-Ares J:血管植物和单细胞藻类中磷酸盐饥饿信号传导的保守MyB转录因子。基因开发。2001,15:2122-2133。10.1101 / gad.204401。
- 51.
Wernimont AK, Artz JD, Finerty P, Lin YH, Amani M, lali-Hassani A, Senisterra G, Vedadi M, Tempel W, Mackenzie F, Chau I, Lourido S, Sibley LD, Hui R: apicomplexan钙依赖蛋白激酶的结构揭示钙激活机制。中国生物医学工程学报。2010,17:596-601。10.1038 / nsmb.1795。
- 52。
王斌,尹丽华,薛建勇,刘艳,Ané JM,邱玉玲:菌根基因在陆地植物共同祖先中的存在表明菌根在植物定殖中起关键作用。植物生态学报,2010,32(6):514-525。10.1111 / j.1469-8137.2009.03137.x。
- 53。
Ivashuta S, Liu J, Liu J, Lohar DP, Haridas S, Bucciarelli B, VandenBosch KA, Vance CP, Harrison MJ, Gantt JS: RNA干扰鉴定参与紫花苜蓿截根发育的钙依赖蛋白激酶。植物营养与肥料学报。
- 54。
Karas B,Amyot L,Johansen C,Sato S,Tabata S,Kawaguchi M,Szczyglowski K:莲花和拟南芥的保护基本螺旋环 - 螺旋蛋白揭示了根发发育中的新球员。植物理性。2009,151:1175-1185。10.1104 / pp.109.143867。
- 55。
Bustin Sa,Benes V,Garson Ja,Hellemans J,Huggett J,Kubista M,Mueller R,Nolan T,Pfaffl MW,Shipley GL,Vandesompele J,Wittwer CT:MIQE指南:公布定量实时PCR的最低信息实验。Clin Chem。2009年,55:611-622。10.1373 / Clinchem.2008.112797。
- 56。
Thompson JD,HIGGINS DG,Gibson TJ:Clustal W:通过序列加权,位置特定的间隙惩罚和重量矩阵选择提高逐行多序列对准的灵敏度。核酸RES。1994年,22:4673-4680。10.1093 / NAR / 22.222.4673。
- 57。
Nicholas K,Nicholas H,Deerfield D:Genedoc:遗传变异的分析和可视化。embnew新闻。1997年,4:14-
- 58。
Saitou N,Nei M:邻居加入方法:重建系统发育树的新方法。mol Biol Evol。1987年,4:406-425。
- 59。
Tamura K, Dudley J, Nei M, Kumar S: MEGA4:分子进化遗传学分析(MEGA)软件版本4.0。生物科学进展。2007,24:1596-1599。10.1093 / molbev / msm092。
- 60。
Siemering Kr,Golbik R,Sever R,Haseloff J:抑制绿色荧光蛋白热敏感性的突变。Curr Biol。1996,6:1653-1663。10.1016 / s0960-9822(02)70789-6。
确认
LCS获得了加泰罗尼亚大学的博士预科奖学金。本研究得到了“Acción Integrada”HI2007-0258和西班牙科学与创新部BIO2009-08719的资助,以及Consolider-Ingenio 2010项目CSD2007-00036“农业基因组学研究中心”的支持。我们也感谢加泰罗尼亚大学(Xarxa de Referencia en Biotecnología和SGR 09626)的“'Innovació, Universitats i Empresa”部门的大力支持。
作者信息
隶属关系
通讯作者
额外的信息
作者的贡献
LCS进行了大部分的实验工作和数据分析。JGA参与激光显微解剖和基因表达研究。BSS协调了本次研究的设计和执行,并撰写了论文。PB也参与了本次研究的设计,并对重要知识内容的手稿进行了批判性的修改。所有作者阅读并批准了最终的手稿。
电子补充材料
图S1:水稻的RT-PCR分析
附加文件1:CPK.基因模拟接种(-)和G. MINTRAADICE.- 吞噬(+)米根。接种与G. MINTRAADICE.使用单三明治系统进行孢子。在接种后,在接种后在不同时间收获根,并从12株植物的根部制备每个RNA样品。使用特异性引物进行RT-PCR,用于指示CPK.基因。选择用于表达分析的基因子集包括四个系统发育群的成员CPK.基因(I-IV)(详见图4)。水稻符号标记基因的表达,Osccamk,oScastor.那ospolux和OsSYMRK在与用于分析的相同RNA样品中分析基因CPK.基因表达。对成绩单的成绩单OsCPK2那OsCPK22那OsCPK25和OsCPK31无法检测到(结果未显示,先前报告了类似的结果[40通过微阵列分析)。组成思考的表达方式actin1.(osact1.)基因被用作这些实验中的内部控制。用类似的结果进行三个独立实验。(PDF 175 KB)
图S2:表达式
附加文件2:OsCPK4来自稻谷激光微放射细胞的基因。收获细胞G. MINTRAADICE.接种(+GI.)和模拟接种( -GI.)的根源。总RNA样本从汇集的微解剖细胞中获得。采用RT - PCR一步法进行表达分析。虽然在表皮和皮层细胞中观察到不同的表达水平,但从激光显微解剖细胞中获得的RNA样本的RT-PCR分析不能提供基因表达的定量信息。(PDF 14 KB)
图S3:植物CPK的关系
附加文件3:。使用来自水稻(OS),小麦(TA),玉米(ZM)和Medicago(ZM)和Memicago的CPK的全长氨基酸序列构建系统发育树。m . truncatula,MT;m .漂白亚麻纤维卷,ms)和ccamks。四组是指(I-IV)。(PDF 122 KB)
植物CPKs和CCaMKs的氨基酸序列比对
附加文件4:。水稻(Os)、小麦(Ta)、玉米(Zm)和紫花苜蓿(m . truncatula,MT;m .漂白亚麻纤维卷,ms)对齐。黑色和灰色背景分别表示相同或相似的氨基酸。破折号表示该位置没有存在残留物。示出了激酶(OSCPK18中的氨基酸51-317)和嗜钙素样(在OSCPK18中的氨基酸347-493)的边界(分别为黑色和灰色箭头)。(PDF 199 KB)
表S1和表S2
附加文件5:。表S1。Symbiosis-relatedCIS.中标识的元素OsCPK18那OsCPK4那MtCPK1那OsCCAMK和MTCCAMK.启动子。每个启动子上游2 kb区域使用PLACE基序数据库进行分析。表S2。symbiosis-related数量CIS.的-元素OSCPK18,OSCPK4那MtCPK1那OsCCaMK和MTCCAMK.启动子。显示了每个启动子的2kB上游区域内所指示的基序的存在(x)或缺失( - )。给定的多个副本CIS.-元素存在于特定的启动子中(2x, 3x, 4x等)。使用PLACE motif数据库进行分析。主题按字母顺序排列。(PDF 15 KB)
作者的原始提交的图像文件
权利和权限
开放访问本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Campos-Soriano,L.,Gómez-Ariza,J.,Bonfante,P。等等。在丛枝菌根共生的前共生阶段,水稻钙依赖蛋白激酶在皮层根细胞中表达。BMC植物BIOL.11,90(2011)。https://doi.org/10.1186/1471-2229-11-90
已收到:
公认:
发表:
关键词
- 丛枝菌根
- 水稻根
- 绿色荧光蛋白基因
- 洋葱表皮细胞
- 激光显微解剖