抽象的
背景
体塑性编码基因的转录需要两种不同的DNA依赖性RNA聚合酶,核编码的聚合酶(NEP)和塑性编码的聚合酶(PEP)。最近的研究确定了两种相关的PFKB型碳水化合物激酶,命名为Fruckinase样蛋白(FLN1和FLN2),因为两者中紫胶骨结合的PEP复合物的组分拟南芥蒂利亚纳和Sinapis Alba.(芥末)。其他工作表明RNAi介导的减少FLN表达特异性地减少了PEP依赖性基因的转录。
结果
在这里,我们报告的特征拟南芥FLN淘汰等位基因来检查每个基因在植物生长,叶绿体开发中的贡献,以及介导PEP依赖性转录。我们展示了这一点弗恩植物有严重的表型fln1导致白化表型,在没有外源碳源的情况下幼苗是致命的。相比之下,fln2植物在叶片膨大前出现褪绿,但变绿缓慢,保持自养状态,可以生长到成熟,并结出可存活的种子。FLN1 FLN2.双突变分析揭示了HAPLO不足,并且FLN1 FLN2.植物有类似的,但更严重的表型比任何一个单一的突变。正常的质体发育在光明和黑暗中都需要FLNs,但令人惊讶的是,skoformphogenesis不受影响弗恩幼苗。幼苗在遗传上FLN1-1.与dexamethasone-inducibleFLN1-HA萌发时的表达在表型上与野生型没有区别。FLN- ha在萌发24小时后的诱导不能挽救突变体的表型,这表明FLN的损失的影响并不总是可逆的。叶绿体基因表达的检测FLN1-1.和fln2-1qRT-PCR结果显示,与nep依赖基因相比,两种突变体中pep依赖基因的转录本均明显减少。
结论
我们的结果表明,每个FLN蛋白有助于野生型生长,并且对植物生长和发育至关重要。
背景
塑体是一种必需植物细胞器,是多种生物合成途径的唯一部位,例如德诺维脂肪酸和氨基酸合成。在分化到光合作用的叶绿体中,膜局部光学络合物将光能转化为化学能量和可溶性酶减少CO2成各种碳水化合物。质体基因组并不编码这些反应所需的全部蛋白质;因此,核编码蛋白几乎存在于所有质体定位的多蛋白复合物中。这需要将许多蛋白质导入质体,将它们定位到正确的亚细胞器位置,并且在大多数情况下,与质体编码的亚单位组装。核编码基因和叶绿体编码基因的表达必须相互协调,以产生适当的亚基化学计量和足够的蛋白质复合物,以满足植物的代谢需要[1].
通过陆地植物中的两种不同类型的DNA依赖性RNA聚合酶实现塑体编码基因的转录[2].的plastid -encoded RNA.p甲羟酶(PEP)类似于序列同一性的细菌RNA聚合酶,要求多个亚基的要求,以及赋予启动子特异性的Σ因素。塑体含有第二个无关型,单亚基nyclear-encoded RNA.p烯键酶(NEP)[3.].单个PEP亚单位编码基因的缺失会影响质体编码基因的一个特定子集的转录,这表明这两种聚合酶转录独特的质体基因集,尽管有些基因同时被PEP和NEP转录[4- - - - - -6].PEP可以在两种不同的复合物中找到,一种基质定位可溶性复合物和一种膜附着复合物[2]后者称为TACtranscriptionally一个CTIVE.chromosome [7].有趣的是,NEP转录质体编码的PEP核心聚合酶亚基,表明转录的层次结构。
生物化学分离结合质谱分析多物种的TAC复合体[8- - - - - -12]发现了一些额外的成分,除了核心PEP聚合酶亚基外,还鉴定出了多达50个蛋白质(pTACs) [13].值得注意的是,在pkfb型碳水化合物激酶家族中存在两种相关蛋白,最初由Suzuki等人报道[12,并由他人确认[9,14].这些蛋白质后来被命名FRUCTOKINASE -l艾克蛋白质N1 (FLN1, At3g54090)和FLN2 (At1g69200) [15].FLN1与硫氧还蛋白z相互作用,并包含相互作用所需的2个邻近半胱氨酸[15].FLN蛋白在PEP复合物中的作用是未知的,并为塑性基因转录调节增加另一种尺寸。
据报道,其他生物中的碳水化合物激酶样蛋白具有调节作用,而不是直接催化功能,而其他生物似乎具有两种功能。出芽酵母半乳糖激酶样蛋白Gal3p缺乏催化活性,但结合ATP和半乳糖。gal3p -半乳糖- atp复合物与转录抑制剂Gal80p结合,降低Gal80p的抑制作用加推动者[16].类似地,酵母六酮酶2同工酶,HXK2P,活性激酶,具有不需要催化活性的核信号传导功能[17,18].在拟南芥HEXOKinase1(HXK1)是活性激酶,但是,即使通过突变消除其催化活性,也与信号蛋白相似是活性激活蛋白[19].
将糖激酶分成三个在氨基酸序列和结构中不相关的三个进化不同的家族 - 六酮酶,罗酮酶和吡酰基酶的家族[20.].FLN蛋白属于罗布纳酶系列内的大群碳水化合物激酶,包括各种已知和预测的碳水化合物,磷酸碳水化合物和嘧啶激酶,但仍然是一个较差的群体。成员包括两人拟南芥腺苷激酶(ADK)显示在腺苷酸和甲基循环中起重要作用[21].ADK表达减少的植物具有生长缺陷[22]和退化根向地性[23],与改变的细胞蛋白水平相关的缺陷[24].除了FLNS之外,还表征了另一种叶绿体局部的PFKB型激酶,NARA5对叶绿体发育和塑性基因表达是重要的[25].
对于两个密切相关的pfkb型蛋白,FLN1和FLN2,之前在拟南芥中使用可诱导RNAi的研究表明,这两个蛋白在引起新生叶片褪绿的作用相同[15].奇怪的是,利用vgs介导的RNAi在N. Benthamiana,同样的研究表明,降低FLN1诱导烟草褪绿,而降低FLN2的影响很小。RNAi的作用可能是可变的,通常是不完整的。此外,FLN在这些实验中,mRNA瞬间下调。因此,我们试图分析植物中FLN损失的效果遗传缺乏每个个人FLN.我们分析了个体的表型fln1和fln2空植物,以及FLN1 FLN2.双突变幼苗。我们的结果为FLN功能提供了新的证据拟南芥.与以前的结果相比,在哪里拟南芥每种蛋白质同样贡献,零等位基因的分析显示了FLN1的更大作用。此外,我们首次展示,在一起,FLN1和FLN2对于增长和发展至关重要。我们还表明,黑暗中的初始增长不受影响弗恩,支持FLNs在光合能力发展中的作用。与之前的研究相似,依赖于pep的叶绿体基因的转录在每个稳定体中都受到强烈且特定的影响弗恩突变体。最后,通过诱导表达,我们证明了FLN1在光照下萌发早期就需要,而在子叶出苗后表达并不能挽救突变体的表型,这表明FLNs在发育中起调控作用。
结果
FLN1和FLN2功能损失突变体具有严重的褪色表型
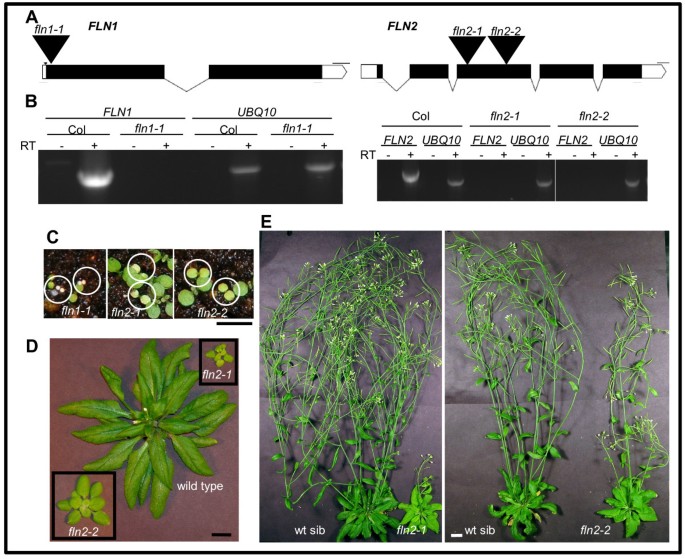
我们采取了逆向遗传方法,分析了可用的T-DNA插入等位基因以确定每个的作用FLN在植物生长和发展中。我们分析了一FLN1和两个FLN2插入等位基因(图1一种)。从种子萌发后,评估来自植物的杂合子对每个T-DNA等位基因的杂合,用于种子萌发后的任何可观察表型以及随后的转基因组。观察到两种表型;每条线隔离3:1为绿色:苍白/褪色的表型(χ23:1分离适格性试验:FLN1-1.,χ2 = 3.5, p-value = 0.060;fln2-1χ2 = 0.086, p-value = 0.76;fln2-2,χ2 = 0.030, p-value = 0.86. PCR-based genotyping revealed that the pale/chlorotic seedlings are homozygous for their respective T-DNA insertion.
描述的弗恩插入行。(一)的代表FLN1(AT3G54090)和FLN2(AT1G69200)基因。T-DNA插入用大的黑色三角形(不缩放)表示,在它们上方具有等位基因标记。外显子,UTR,内含子和删除分别由黑匣子,白色盒子,线和小三角形表示。秤条代表100 bp。红色箭头表示用于RT-PCR的引物的位置。使用外显子图形制造商产生图形(http://wormweb.org/exonintron.).(B)RT-PCR分析fln1和fln2等位基因。7天的旧光生长幼苗用于RNA提取。的UBQ10反应表示COL-0和突变线的等效RNA输入,并且除逆转录酶未包含在RT反应中,除了等效地处理的样品。实验是3个生物学重复的代表性。(C)7天龄表型弗恩突变体。种子的隔离弗恩等位基因在18oC.纯合个体被圈出。比例尺代表0.5厘米。(D)40天老fln2植物。从(c)的幼苗转移到单个盆中以继续生长。(E)70天老fln2植物。(D)生长30天后的植株。(D)和(E)条代表1厘米。
我们通过PCR和跨T-DNA-基因连接的DNA测序确定了每个等位基因的T-DNA插入位置(附加文件)1:图S1)。为了FLN1-1.和fln2-2只检测到一个插入。pcr与fln2-1 T-DNA primers generated a product with either gene-specific primer, suggesting that this allele has two inverted T-DNA insertions (Additional file1:图S1)。
来确定fln1和fln2T-DNA插入线合成真实的mRNA,从合并的浅/氯化幼苗中提取RNA,并用于随后的RT-PCR实验(图1b)。使用特异性的引物FLN1,没有可检测到的产品FLN1-1.cDNA,而从Col-0 cDNA可见产物(图1B,左侧面板)。同样,用产品产生了一种产品FLN2仅来自COL-0的特异性引物,而不是从合成的cDNAfln2-1要么fln2-2RNA(图1B,右面板)。在所有使用的样品中可见PCR产物UBQ10引物表明输入的cDNA模板大致相同。在cDNA合成反应(−RT lanes)中省略逆转录酶(RT)则没有产物,说明+ RT反应的模板来源是cDNA,而不是基因组DNA。这些结果表明FLN1和两者FLN2插入线都可能是空等位基因。
由于最初观察到的表型是在添加了b维生素和1%蔗糖的培养基上生长的,我们试图测试同样的苍白/褪绿表型是否在土壤上生长的幼苗中重现,并检查突变体是否能够自养生长和发育。的种子FLN / FLN.亲本直接在土壤上播种,在116 μmol/s的连续光照下生长-1米-2).在土壤种植的幼苗中观察到GM培养基上观察到的类似表型(图1C)。FLN1-1.幼苗有小黄色子叶,从未绿色,它们不会在发芽后两周内产生真实的叶子并死亡。fln2突变体在土壤和转基因培养皿上的生长方式相似。它们有淡绿色的子叶和fln2-2略大于那些fln2-1(图1C)fln2等位基因比野生型小,而真实的叶子慢慢绿色(图1d)。fln2-2植物有稍大的莲座和绿色比fln2-1,可能是由于混合生态型背景fln2-2.最终,所有人fln2突变体会抽薹并结出种子。成人fln2-1植物的花序比野生型的同胞少,有褪绿的茎,茎状叶和萼片(图1E)。fln2-2另一方面,植物与...相比产生较高的花序fln2-1.
FLN1-HA补充的诱导表达FLN1-1.
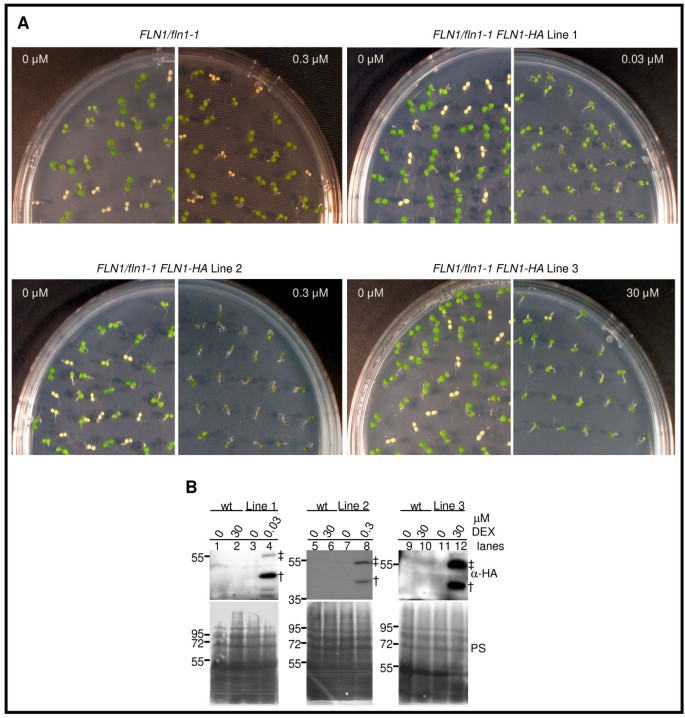
两个独立的插入等位基因的表型相似FLN2强烈提示该突变体表型由缺失FLN2表达式。然而,只有一个插入等位基因FLN1是可用的。为了证明FLN1的缺失是观察到的表型的原因,FLN1 / FLN1-1用表达构建体转化植物,用于对FLN1的HA标记形式的组成型表达。所有这些转化体都表现出与转基因沉默(未示出的数据)一致的表型,防止分析互补。克服这个问题,FLN1 / FLN1-1用地塞米松诱导剂转化植物[26,27相同的版本FLN1-HA开放阅读框架。从三个独立的后代FLN1 / FLN1-1 FLN1-HA对品系在含dex培养基上生长后的表型变化和FLN1-HA诱导进行评估(图)2和表1).对于所有三种品系,在含dex培养基上生长的幼苗提取物中都能检测到两种抗ha免疫反应物种(图)2B,车道4,8,12),但在溶剂对照中的同一系列中没有幼苗(图2B,车道3,7,11)尽管加载了类似的总蛋白质(图2B,下面板)。这表明FLN1-HA表达是依赖的。可以在野生型,非转化的对照幼苗(绿色后代)中检测抗HA免疫反应性。(绿色后代)FLN1 / FLN1-1仅)在溶剂控制下生长(图2B,车道1,5,9)或30μm德克斯(图2B,车道2,6,10)证明DEX诱导的蛋白质FLN1 / FLN1-1 FLN1-HA行要求FLN1-HA而不是单纯的DEX治疗。我们假设55kda物种(双杂交,图2b)在进口到叶绿体之前的全长FLN1-HA,以及更快的迁移物种(单十字,数字2b)进口和过境肽裂解后的FLN1-HA。
互补FLN1-1.与dexamethasone-inducibleFLN1-HA.(一)互补FLN1-1.表型。公元前1F2种子来自FLN1 / FLN1-1或T3.FLN1 / FLN1-1 FLN1-HA种子在指定浓度的地塞米松上生长7 d, 20o答案:C0 μM为DMSO溶剂控制。图示是至少三个独立实验中的一个代表性实验。(B)用地塞米松诱导FLN1-HA诱导FLN1 / FLN1-1 FLN1-HA线条。在7天生长后从幼苗中提取蛋白质,在20时在恒定的光下oC,在添加指示浓度地塞米松(DEX)的转基因平板上,用抗ha抗体免疫印迹。Ponceau S染色(PS)膜显示为加载控制。野生型(wt)植物是一种绿色幼苗FLN1 / FLN1-1父母没有FLN1-HA转基因。用于这些互补线的“0”处理处理的幼苗是与之隔离的绿色兄弟姐妹(混合基因型)FLN1-1.没有德克斯的表现。其他治疗的幼苗包括板上所有幼苗(所有可能基因型)的池(如FLN1-1.表型由DEX补充)。推测的FLN1-HA前体带用双杂交表示,成熟的FLN-HA用单杂交表示。大小标记,用kDa表示,在印迹的左边。第1、2、3行指的是三个独立的FLN / fln1-1 FLN1-HA线条。幼苗是F.3.来自A的幼苗FLN / fln1-1 FLN1-HA父母基因型。
互补的FLN1-1.FLN1-HA的表型通过观察绿苗与白苗的分离率来评估FLN1 / FLN1-1 FLN1-HADEX培养基上萌发后的亲本。在FLN1 / FLN1-1后代缺乏FLN1-HA转基因,DEX治疗没有改变绿色到白色幼苗的3:1分离比率,也不会影响表型(图2一、表1).然而,DEX媒体上的增长消除了任何可观察到的隔离FLN1-1.来自三个独立的自私后代的幼苗FLN1 / FLN1-1 FLN1-HA的父母。这一结果,再加上DEX对FLN1-HA的紧密诱导(图)2B),证明了这一点FLN1-1.可以通过Dex诱导的FLN1-HA表达来拯救。这些系列显示出不同浓度的DEX互补,范围为0.03至30μm。第1行和2完全补充FLN1-1.在0.03和0.3μmdex时生长的表型,尽管第2条幼苗较小(图2一、表1).线3在3.0和30μmDEX上生长时部分地补充了这种表型。没有白色FLN1-1.观察到浓度幼苗,但在最高的DEX剂量下观察到表现出白绿色杂色子叶的几种幼苗(图2一、表1).
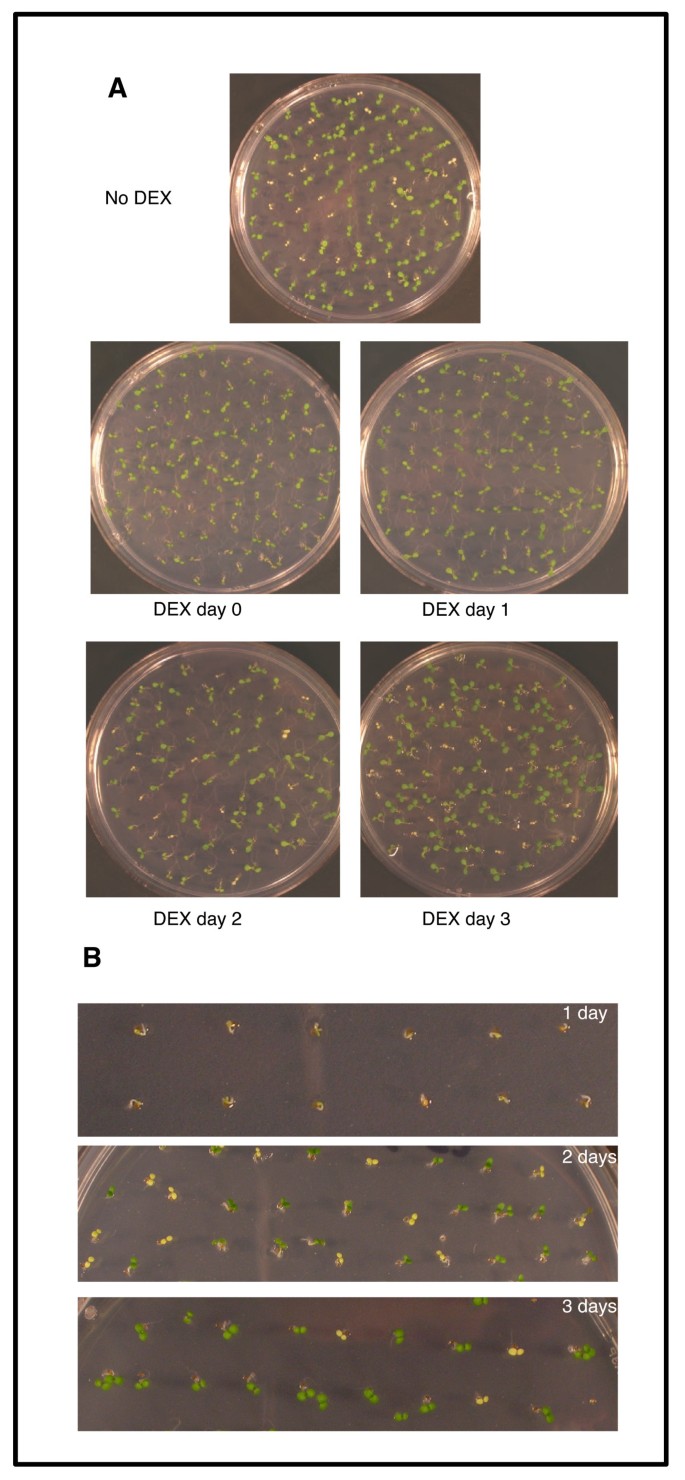
研究了FLN1-HA在萌发后在不同时间拯救突变表型的能力,以评估野生型生长需要早期的FLN1表达。的种子FLN1 / FLN1-1将FLN1-HA线镀上,4℃分层2天,室温(RT)培养。第一次转移至RT (0 d)或1、2、3 d时加入DEX。7天后,苍白苗木的数量被记录下来(图)3.).在分层(0天)后立即添加DEX加入,1天后救出突变表型,因为没有观察到少数苍白的幼苗(图3.一、表2).然而,在生长2或3天后添加地塞米松并不能挽救所有3个株系,因为在预期比例下观察到苍白的幼苗(图)3.一、表2).
确定FLN1-HA表达能够恢复的发育阶段fln1从幼苗到野生型,幼苗的发育是在添加地塞米松之前立即记录的(图)3.b)。1天后,观察到胚胎出现,但尚未发生胞嘧啶扩张和鉴定弗恩幼苗是不可能的(图3.B,顶部)。2天后,野生型子叶反折,全绿色,几乎完全膨大,叶色苍白弗恩子叶很明显(图3.B,中间)。这些结果表明,FLN1-HA表达必须在幼苗开发中非常早发,以拯救突变表型。
lossfln1要么fln2特别破坏PEP依赖性转录
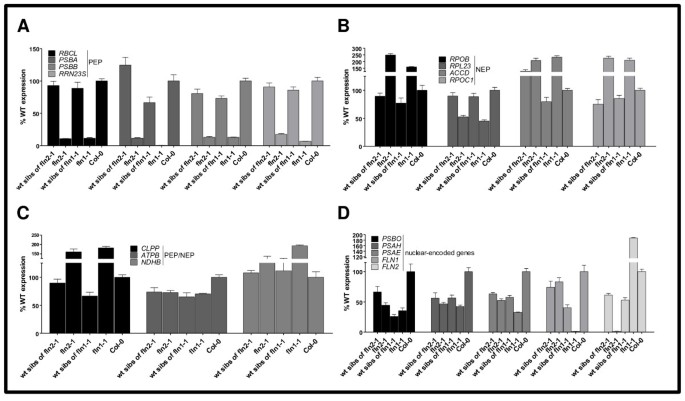
为了探讨每个FLN在叶绿体转录中的作用,确定叶绿体编码的mRNA水平FLN1-1.和fln2-1.以前,效果降低了FLN研究了诱导型RNA干扰的表达拟南芥和烟草叶子[15]但尚未确定稳定弗恩零植物。在这里,我们检查了我们的mRNA水平弗恩三类叶绿体编码基因的空等位基因:pep依赖(第一类,图4a),依赖nep(III类,图4B), PEP-和NEP-转录C(II类,图4)和编码质体定位蛋白的核基因(图4D). 7天大的RNA弗恩幼苗及其表型野生型同胞(组合FLN和FLN / FLN.实时定量RT-PCR (qRT-PCR)分析(图)4).
叶绿体编码基因的表达弗恩幼苗。表明基因转录物水平的QRT-PCR分析在如图中生长的7日龄幼苗中进行1B.检查四类基因,PEP依赖(一),nep依赖(B)PEP-和NEP转录(C)和核编码(D).所示数据为代表性实验平均值(SE)的平均值±标准误差(n = 3)。表达水平以相对于野生型的百分比表示。
pep依赖基因的表达:,psbA,psbB, 和rrn23S两者都大幅减少了吗FLN1-1.和fln2-1幼苗与Col-0和它们各自的表型野生型兄弟姐妹相比(图4一种)。Nep依赖性基因的转录物RPOB.,accD, 和rpoc1.而另一方面,它的高度却略有上升弗恩幼苗,除了rpl23.突变体中只有50%的野生型表达的转录本。CLPP.,atpB, 和NDHB.由PEP和NEP共同转录。这两个CLPP.和NDHB.突变体的mrna水平略有上调atpB两者的mRNA相似弗恩突变到他们各自的野生型兄弟姐妹(图4C)。
最少、mrna为FLN1和FLN2在各自突变体的cDNA中缺失。有趣的是,FLN2信使rna的含量要高出两倍FLN1-1.但反过来就不成立了FLN1mRNA没有提升fln2-1(图4D).对于其他核编码的叶绿体定位蛋白,弗恩和野生型兄弟姐妹有相似的转录水平,与Col-0相比大约减少50%(图4d)。这种减少可能由由此组成的表型野生型兄弟苗的混合基因型产生FLN / FLN和FLN / fln1-1基因型。总之,只有PEP依赖的成绩单始终如一地持续下调弗恩说明FLNs是TAC复合体功能的正调控因子。
在黑暗中植物细胞伸长率不需要FLN蛋白
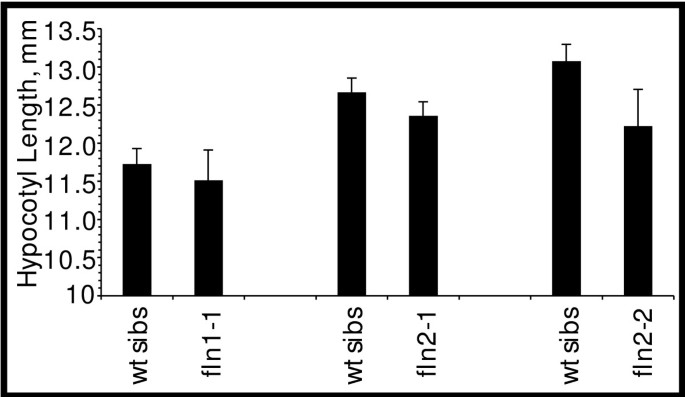
鉴于强烈的依赖性FLN用于野生型生长幼苗的野生型生长的表达,我们试图确定肌肉膀胱是否需要FLN蛋白。我们在深种7天幼苗中检查了休底伸长率FLN / FLN.的父母。所有幼苗都有伸长的下胚轴,顶端的钩和未扩展的子叶(数据未显示)。我们测量了黄化幼苗的下胚轴长度,以评估细胞在黑暗中扩张是否受到影响(图)5).弗恩由于学生评估的,下胚轴长度比其相应的野生型兄弟姐妹的长度明显短 t-test(与野生型同胞比较的p值:FLN1-1.0.607;fln2-10.202;和fln2-20.0821;α= 0.05)。
然后将暗生长的幼苗暴露在光照下。子叶的FLN1-1.变种人从来不会变绿,但在阳光下会脱钩。fln2幼苗未垂直,转动浅绿色,最终类似于子叶fln2在连续光下生长的突变体。因此,黑暗中的膨胀未改变表型弗恩在光线下的子叶。因此,我们得出结论,FLN1和FLN2在skoformphogenesis中都不是必需的。
正常塑性发育需要FLN蛋白质
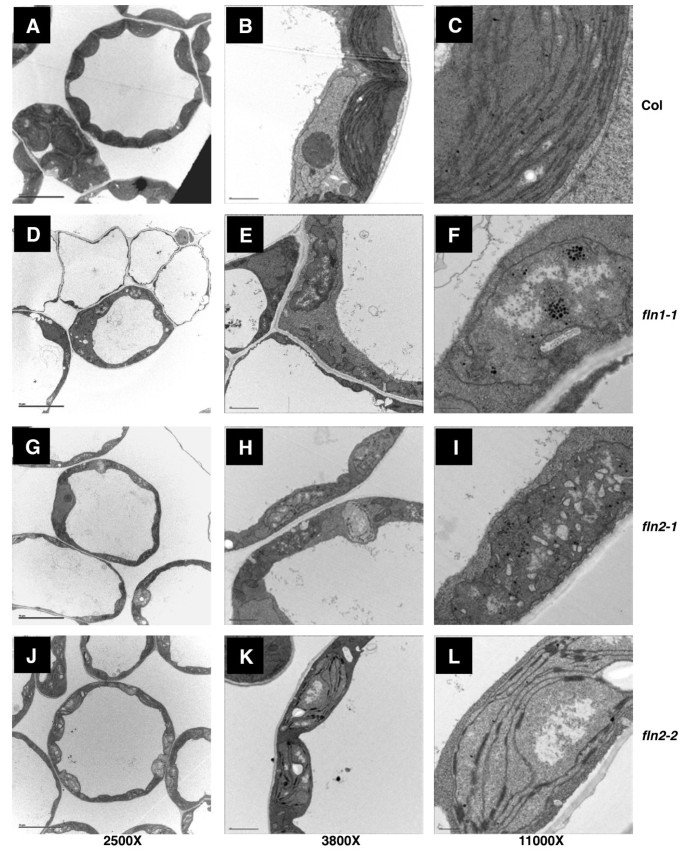
调查塑性发展fln1和fln2幼苗,通过透射电子显微镜(TEM)在GM上生长的7天龄浅种幼苗的子叶中的叶绿体超微结构检查叶绿体超微结构(图6).哥伦比亚(Col-0)细胞含有形态均匀叶绿体的群体(图6一种)。野生型叶绿体是通过通过基质囊体膜连接的堆叠囊膜,其中少量淀粉颗粒和血浆整个基质(图)6C)。是一致的fln1具有更严重形态表型的突变体(图1),细胞FLN1-1.非常真空,含有更极端的缺陷含叶绿体(图6d,E.)而不是那些fln2细胞(图6克,J).几乎全部fln1叶绿体缺乏具有大量密集染色塑料囊泡的内膜结构。(图6F)。
相比之下,fln2细胞中含有一系列缺陷的叶绿体(图)6克j)。同时fln2等位基因,与野生型COL-0相比,叶绿体具有高度破坏的内膜结构(图6H, K)fln2-1和fln2-2叶绿体缺少囊体膜,高度真空,含有更多的塑料囊泡而不是野生型,并充满了未识别的子内潜力结构(图6一世)。其他叶绿体含有一些基质囊体膜和几颗堆叠堆(图6L)。总之,fln2-1叶绿体缺乏典型的膜结构或仅有少量类囊体膜和基粒堆积。fln2-2另一方面,叶绿体有一些相邻的基质类囊体膜,形成网状结构,颗粒堆积减少(图)6L)。
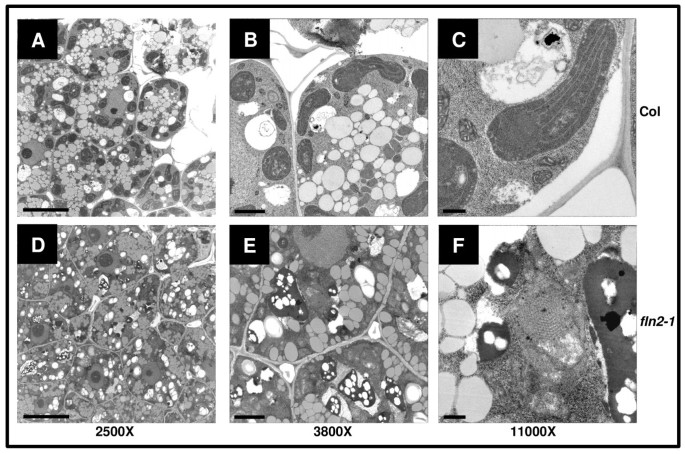
虽然成熟的叶绿体弗恩突变体不能正常发育,在光照下突变体有严重的生长缺陷,细胞伸长在黑暗中基本不受影响(图)5).这些观察结果导致我们调查牙塑料的发展是否受到影响弗恩突变体。只有fln2可以分析因为fln1纯合子种子无法获得[FLN1-1.幼苗是致命的(图1)], 和FLN1-1.分离不能表现出来FLN1和FLN1 / FLN1-1黑暗中的兄弟姐妹(图5).fln 2 - 1用透射电镜观察了3天龄暗生幼苗子叶的黄化体(图)7).对于col0和fln2-1细胞呈暗色生长,细胞质致密,有多个小液泡和油体(图)7广告)。fln2-1细胞中还含有亚细胞成分,这些成分在制备样品时没有固定,在切片上留下孔(图)7E)。Col-0中的牙骨塑料可以很容易地识别和染色(图7B),但fln2-1黄化质体染色密度较低,难以与其他细胞内容物区分(图7E)。COL-0牙骨塑料含有明显的基质胶质体,具有从它们延伸的基质链的基质链(图)(图7C)。fln2-1霉素确实含有高蛋白体,但是非典型的并且缺乏任何明显的相关基质囊体(图7F)。总的来说,这些数据表明了FLN2不仅需要叶绿体开发的光,而且还用于在黑暗中发育牙骨果筋。
FLNs在植物生长发育过程中起附加作用
为了确定当两个FLN蛋白都缺失时对幼苗生长的影响,我们进行了杂交fln2-1比如,FLN1 / FLN1-1杂合的获得FLN1 FLN2.纯合突变体的两倍。的种子FLN1 / fln1-1 FLN2 / fln2-1植物被镀锌,在三周内监测生长。一个星期大的苍白/褪蓝的幼苗被标记和拍摄(图8A, B).同样的培养皿又培养了两周,之后这些植物被宰杀FLN1-1.和fln2 -1基因分型。双倍的FLN1 FLN2.鉴定突变体(盘旋,图8a,b),并以大f的预期1/16频率恢复2人口(χ.2= 1.142, p-value = 0.2853, α = 0.05)
此外,在一周大的苍白幼苗中也是单个突变兄弟姐妹和兄弟姐妹在一个基因座和纯合酶上,另一个(图8C).每个基因型的3个不同幼苗,代表观察到的表型,在不同年龄显示。单fln2-1幼苗有淡色的子叶,还有几片绿色的真叶经过三周的生长;不像在土壤上,其他叶子保持苍白(图8 c, 第一排)。如在土壤上观察到(图1),单突变FLN1-1.子叶为白色,完全没有可见的叶绿素。对土壤不同,FLN1-1.在添加1%蔗糖的培养基上生长的幼苗能长出真正的叶子。这些叶子是白色的,从不绿色(图8 c第二行)。
分析FLN1 / fln1-1 fln2-1和fln1-1 FLN2 / fln2-2植物揭示了这些基因型中FLN功能的HAPLO功能不足。FLN1 / fln1-1 fln2-1幼苗在外观上更类似于更严重的单曲FLN1-1.而不是单身fln2-1经过一周的成长,宫内节黄从来没有绿色。这种基因型类的真实叶片出现淡绿色,但比那些较少扩展fln2-1.大概三周吧FLN1 / fln1-1 fln2-1植物类似于fln2-1,而大多数有更严重的表型(图8C,第三行)。fln1-1 FLN2 / fln2-1幼苗看起来像FLN1-1.在生长7天后,但在14天后,这一基因型类的一部分开始出现萎缩的子叶,而其他的则继续看起来像FLN1-1.(图8C,第四行)。即使在三周后,更严厉的个体也不会张开它们的真叶,而像FLN1-1 FLN2-1双突变体(图8C,底下一行)。
双突变体FLN1-1 FLN2-1植物和他们的FLN1-1.兄弟姐妹经过7天的增长,但三周后明显不同(图8C,第五行)。所有双突变体都会产生一组非常小,白色的真实叶,两个星期可见,但这些永远不会展开。双突变体和一个子集fln1-1 FLN2 / fln2-1幼苗之间无法从表型上区分开来,这共同证明了缺乏全部FLN活性或FLN活性不足的幼苗即使在添加蔗糖时也是致命的。这一结果表明,即使在蔗糖存在的情况下,FLN在一定程度上也是发育所必需的。该基因分析还表明,FLN1和FLN2可能不具有功能特异性,而是附加作用于基因表达。
讨论
来自来自多种植物物种的Puksid TAC络合物中的PFKB系列中的具有预测结构域的两种蛋白质,但它们的角色仍然是神秘的。大肠杆菌具有两种磷酸果糖激酶PFKB / PFK-2最初被发现为一个抑制器pfka / pfk-1突变[28,29].虽然pfka和pfkb都是催化活性的,但它们依次不相似并且具有不同的变构调节[30.- - - - - -32].因此,具有与PFKB序列相似性的激酶被称为PFKB型激酶。其他PFKB型激酶磷酸化各种基材,包括果糖,果糖-6-磷酸,核糖,腺苷,磷甲基吡啶,和塔白糖-6-磷酸盐[33,但许多人的特征仍然很差。为了揭开pfkB-type激酶在植物生长和发育的作用我们反向遗传学的方法来评估pfkB-type激酶功能丧失突变体的表型,从基因编码两个紧密FRUCTOKINASE-LIKE蛋白质,FLN1 FLN2,确认为PEP TAC复杂的组件9,12,14].通过半定量和qRT-PCR,我们证明了这些弗恩插入等位基因不会产生可检测的mRNA,并且是零等位基因,通过多个等位基因的互补和表征,表明观察到的表型因丧失而导致弗恩表达式。这些空等位基因分别用于评估FLN对植物生长发育的个体和集体贡献。
这项工作最初描述了FLNs,利用RNAi在成体植物中的作用[14,15].沉默的沉默FLN1要么FLN2在幼体和发育中引起类似的褪绿拟南芥玫瑰花叶[15].相比之下,我们的FLN函数丧失分析显示FLN1和FLN2的不等角色。因此,我们观察到叶绿体fln1植物受到的影响比植物更严重fln2.两种实验之间的差异可能是因为在早期幼苗生长期间FLN1和FLN2的差异贡献比在玫瑰花叶中更大。减少的效果FLN在烟草中也评估表达。唯一的rnaiFLN1导致褪绿,这与我们提出的FLN1发挥更大作用的观点一致。未观察叶绿体超微结构拟南芥RNAi线;然而,作者确实检查了叶片FLN1烟草细胞中的RNAi [15].叶绿体in.FLN1RNAi烟草与那些人非常相似拟南芥fln1这里报道的植物,表明烟草和烟草中这种蛋白质的损失拟南芥导致相似的质体缺陷。
FLN对TAC复合物的定位表明,功能突变体的丧失应具有相似的表型。PEP全酶在组合物中与大鼠RNA聚合酶相似,并由四个不同的亚基α组成2由塑性基因编码的ββ'β'RPOA.RPOB.rpoc1., 和rpoc2.,分别。依赖于pep的转录还需要核编码西格玛因子来确保正确的转录起始位点[34]]。突变RPO.烟草中的基因导致血浆发育中的复合症和严重缺陷[6,35].RPO.-植物只能在补充蔗糖时生长;然而,除色素沉着损失外,这些植物在形态上类似于野生型植物,并且可以正常地发展,花和设置种子[35].在这里,我们展示了这一点fln1植物还需要蔗糖来生长,但与之不相同RPO.-植物。fln1在蔗糖上生长和花,但植物是非常小的,不孕的(数据未显示)。fln2另一方面,植物保持自养状态,其正常的叶绿体比任何一种植物都多fln1要么RPO.-两者都缺乏类囊体膜,且高度液泡化[6,35].的FLN1-1 FLN2-1双突变体是幼苗致命,即使在蔗糖上生长,也只有一组两个真实叶片在死亡前没有随后的膨胀。这结果,鉴于可行性RPO.-在蔗糖上生长的植物表明,除了它们在PEP复合物中的作用外,氟氯虫还可以为另一个功能提供服务,或者弗斯的损失比核心百分子亚基的损失更具毒性。对这种解释的挑战是没有RPO.-拟南芥已描述。那些植物可能比烟草突变体更严重,更紧密地相似弗恩双突变体。FLN底物仍然难以捉摸[15因此,完全了解其内部和外部TAC复合物中的角色的作用等待衬底的识别。对TAC复合物独立于闭塞功能的一种方法是评估表型和叶绿体编码的转录水平弗恩表达不定位到TAC复合物的FLNS的空白。然而,尚未确定这种突变迄今为止。
在这项工作中,我们还试图评估FLN蛋白在skoformphogenesis中的作用。我们评估了黄体结构fln2dark-grown幼苗。不幸的是,我们无法在fln1由于幼苗的致病性,阻止了收集纯合子和种子的群体FLN1-1.在黑暗中生长时,幼苗与野生型兄弟姐妹难以区分。但是,基于温和的缺陷fln2黄化体和正常的sko形态发生fln1和fln2植物,我们得出结论,FLNS在光线塑性发育中具有比介于黑暗中的生长在光线上具有更大的作用。
FLNs似乎受到硫氧还蛋白系统的调控,该系统在光照下调节酶的活性,对FLNs来说,这需要一种特定的硫氧还蛋白TRX-z [15].trx-zNULL植物是可行的,在供应蔗糖时没有叶绿素的情况下发育形态正常的叶子[15].相反,FLN表达完全缺失FLN1 FLN2.背景导致幼苗致死表型,即使在提供外源蔗糖。生长能力的差异trx-z和FLN1 FLN2.蔗糖合成培养基的突变体表明存在一些FLN活动trx-z植物,因此,FLN活性不严格要求TRX-Z的氧化还原调节。
与交谘会综合大楼的位置相符[15和以前用RNAi植物进行的RNA分析[15),单弗恩突变体显着影响PEP依赖性叶绿体RNA积累,而大多数NEP和NEP / PEP依赖MRNA略微积聚或不受影响。这些发现符合先前的观察结果,即PEP依赖性转录的破坏导致III类和一些类叶绿体基因(在[36])。我们的实验中的一个例外是rpl23.,依赖于依赖的基因,其mRNA降低弗恩幼苗。最近的一项研究表明rpl23.当PEP在萌发过程中被抑制时,转录水平降低[37提示该基因在建苗阶段可同时被NEP和PEP转录。Arsova等人2010年只检测了成熟莲座叶中nep依赖的转录本,不包括rpl23..本研究在早期幼苗生长期间增加了对PEP活动的要求的新洞察力。
PEP依赖性转录在绿化过程中最大,尽管提出了发芽早期的作用[37,38].最近的报告表明,在吸收期间,PEP存在和活跃;然而,PEP仅在这种显影阶段进行编码核糖体蛋白的基因,通过使用Tagetin,PEP特异性抑制剂揭示。PEP开始在完成发芽之前24小时内在吸收的24小时内转录光合作用相关基因[37].FLN1-HA补充的能力fln1在种子分层后表达时表达的表型,并且在萌发一天后表明不需要早期不需要FLN活性,而是随着幼苗正在发展光合能力。然而,这些植物表达了FLN2,因此FLN2可能早期提供足够的活性,但在快速叶绿体成熟期间不足。塑料中的塑料fln1子叶不像叶绿体(图6),并且大部分的内膜缺失。通过dex诱导将FLN1-HA添加到这些质体中并不能挽救苍白的表型,这意味着FLN减少的影响是不可逆的。换句话说,一旦光形态发生超过某一特定点,添加FLN1就不能恢复正常的绿化。这些观察结果与严重发育错误/受损的叶绿体在从黄体或原质体发育后无法自我重组和修复相一致。
PEP核心亚基可在可溶性PEP复合物和与质体DNA相关的不溶TAC复合物中找到[9].据估计,TACs除了PEP亚基外,还含有40-60种不同的蛋白质[9].尽管尚未向TAC的所有组分报告突变分析,但PEP和PTAC编码基因突变的植物具有不同的抗性表型,但所有股份,在某种程度上丧失色素沉着和异常塑性发育。据我们所知,通过函数分析丧失评估以下TAC组件:PTAC1 / WHIRLY1 [39],ptac2 [9ptac4 /囊泡诱导蛋白在塑性中[40], pTAC6 [9],ptac11 / whrly3 [39],ptac12 / hemera [9,41],铁超氧歧化酶1和3 [42],DNA丙糖酶[43,44,硫氧还蛋白z [14,15],尿苷二磷酸 -N- 乙酰琥珀酸连接酶E [45],ptac14 [46],基因组未替换1 [47,48],塑性氧化还原不敏感2 [49]和果糖激酶样蛋白1和2 [[11,15[这项工作]。除了Whirly,DNA戊曲酶,基因组脱位1和Plastid氧化还原不敏感2,上面列出的所有突变体需要外源碳源进行活力。Whirly突变体具有低褪色的氯化杂色,并且这些突变体是完全自养的。DNA旋转酶突变体,类似于弗恩双突变体,只产生两颗真正的叶子,即使在补充蔗糖时也没有进一步的增长。
虽然FLN的确切作用机制尚不清楚,但我们的遗传分析指出,FLN1和FLN2在质体发育和质体特异性基因表达方面的作用是重叠的。植物pfkb型激酶的系统发育分析显示,FLNs分支的酶显示有果糖激酶活性,并且与已知的腺苷激酶关系较远[15].使用重组FLN和多种糖来鉴定FLN底物的尝试均不成功[15].FLN可以用于尚未鉴定的酶功能和/或另外作为PEP复合物中的代谢传感器,以协调基因表达,以塑体的代谢状态。具有双重功能的蛋白质在代谢和信令中的特征在于所有王国界面[审核[50]],拟南芥六酮酶1已被显示为染色质免疫沉淀,用核DNA和葡萄糖信号所需的其他蛋白质[51].
结论
我们的分析弗恩功能损失突变体进一步证实了以前报告的RNAi表型拟南芥并揭示了这些蛋白质在植物生长和发育中的重要作用。依赖于pep的叶绿体基因的转录本严重减少弗恩结果表明,FLN蛋白是TAC复合物不可缺少的组成部分。基因分析表明FLN1比…起更主要的作用FLN2;单一突变分析显示FLN1以进行自养生长;双突变分析表明,即使在外源碳源也会导致幼苗功能的完全丧失。该分析表明幼苗对FLN水平非常敏感。
方法
植物材料和生长条件
所有的植物都是拟南芥蒂利亚纳,生态型Columbia-0 (Col-0),除非另有说明。At3g54090 T-DNA插入线GK-443A08 (FLN1-1.),摘自《欧洲人报》拟南芥股票中心(http://Arabidopsis.info/)[52].用于AT1G69200的T-DNA插入线是Salk_008812(fln2-1)从中获得拟南芥生物资源中心(ABRC)(http://abrc.osu.edu/)[53]和flag_110f06(fln2-2Wassilevskija (WS-4)生态型)拟南芥蒂利亚纳基因组学资源中心(http://www-ijpb.versailles.inra.fr/en/sgap/equipes/variabilite / crg / index.htm)[54].来自ABRC的推定的第三等位基因[Salk_005734(fln2-3)]的插入位置与SALK_008812相同(附加文件1:图S1),并且很可能是同一插入事件的无意重复。它表现出与fln2-2.PCR基因分型引物列于附加文件2S1:表。所有株系均为F2来自回复的后代(BC1)到Col-0。如前所述制备在板中生长的植物的生长培养基(GM)制备[55].种子表面消毒30%漂白剂,0.1% triton - x100在电镀前。所有平板种植的幼苗都在20岁时生长o在40-50 μmol/s白光下-1米-2.
对于下胚轴测量,子代来自FLN / FLN.在黑暗中在阳光下生长7天。然后将幼苗转移到新的板上,成像,注意到它们的位置,并且从该图像中确定的下胚轴长度。鉴定哪些次乳杆菌是弗恩在美国,幼苗被放置在光照下,并允许额外生长7天。纯合子的弗恩根据子叶和真叶的白色/苍白表型鉴定下胚轴。测量由Image J 1.36 (http://rsb.info.nih.gov/ij/).
RT-PCR分析FLN插入线中的转录物
公元前1F2种子分离每个弗恩等位基因在转基因植株上培养7 d。纯合子突变体经表型鉴定,收获后贮存于液体N2用于RNA提取。使用RNEasy植物迷你试剂盒(QIAGEN)进行RNA提取。在RNA洗脱之前在柱上进行DNase消化以消除污染基因组DNA。为了fln1和fln2实验,2.5和2.8μg总RNA分别用于使用上标III RT(Invitrogen,Carlsbad,Ca)和寡核苷酸(DT)底漆来合成cDNA的反向转录酶(RT)反应。然后将cDNA用作扩增的模板FLN全长编码序列(CD)。PCR产物为1437,1851和1446 bpFLN1,FLN2, 和UBIQUITIN10(UBQ10分别)。UBQ10对照,以确保所有cDNA合成反应使用相同的RNA。的FLN1产品包括整个5'UTR作为注释并以终止密码子序列结束,而FLN2为起始密码子序列到终止密码子序列。用于RT-PCR实验的引物列在附加文件中2S1:表。
叶绿体基因表达的qRT-PCR分析
按照上述方法培养植物并提取RNA进行RT-PCR。用Maxima第一链cDNA合成试剂盒(Fermentas)从2 μg总RNA中制备cDNA。以稀释倍数为1:400的cDNA 5 μL为模板进行qRT-PCR。使用CFX384进行实时PCRTM使用Sybr Green(Invitrogen)的实时系统(BIO-RAD)。所有PCR反应用于所有PCR反应的标准热曲线:95℃,95℃的40℃,10s和60℃持续1分钟。底漆psbOpsaHpsaE, 和NDHB.如先前所发表[15].附加引物列于附加文件中2S1:表。将表达水平标准化为18s rRNA含量。
透射电子显微镜法
如上所述,幼苗在转基因培养皿上生长。光生长的幼苗为7日龄,暗生长的幼苗为3日龄。子叶被固定在卡洛夫斯基的固定物中[56]使用微波炉[57],在0.1M PBS中漂洗,并在硬脂葡萄状后的1%锇后固定2小时。然后将样品在0.1%鞣酸(水溶液)中孵育30分钟,然后脱水[58- - - - - -60),每步增加20分钟的乙醇浓度(30%-50%)。然后用2%乙酸铀酰和50%乙醇对其进行染色[61].脱水以70%完成,95% 3次,100%乙醇2次,每次20分钟[57].纯环氧树脂(Epon/Araldite)取代最后一步乙醇,并渗透过夜[62].然后小心地将样品慎重放置在平面嵌入模具(电子显微镜科学,PA,USA)的底部,并且胶囊填充有新鲜树脂并在70中聚合过夜oC烤箱。使用金刚石刀(Diatom ame,瑞士,EMS U.S.A.分销商)在Leica Ultracut Uct Ultramicrootome上切断了部分。观看样本,使用Philips CM120 Biotwin Tem,(Fei Company,Hillsboro或者美国)采用图像,使用Gatan Megascan 794/20数码相机(2 K X 2 K)(Uppleanton,Ca,USA)。所有工作都在戴维斯大学加利福尼亚大学医学院医学和实验室医学系中完成了所有工作。
遗传互补FLN1-1.突变体和FLN1的诱导表达
我们得到了一个完整的克隆FLN1(AT3G54090.1)来自ABRC的编码序列(克隆U17866)[63在pENTR/SD/中D-topo骨干。为了克隆这种ORF而没有停止密码子,用于制作C末端标记的转化融合,我们使用U17866作为使用Phusion高保真DNA聚合酶(NEB)的模板。使用的引物在附加文件中列出2S1:表。PCR产物经凝胶纯化,用GATEWAY Technology bp -克隆酶反应(Invitrogen公司)重组成pDonr201。ORF测序验证后重组到pBAV154植物转化载体[27]根据制造商的指示。重组后的最终植物表达盒允许地塞米松(DEX)诱导的FLN1-HA表达。将植物转化向量引入根癌土壤杆菌,菌株AGL1,然后用来改变FLN1-1.花浸法杂合子[64].通过喷洒0.578%的压叶菊(1%谷膦酸铵,拜耳作物科学公司)溶液来筛选转化子株http://www.bayercropscience.com/);抗性T.1植物的基因型FLN1-1.插入和14个杂合子(独立变换事件)向前推进2一代。因为只有FLN1-1.杂合子在添加磺胺嘧啶、T2从这些14个线的种子镀在5.25μg/ ml磺胺嗪钠(Sigma-Aldrich,S6387)上涂覆以选择FLN1-1.杂合子。将耐药物转移到土壤中并用决赛喷洒以确定FLN1-HA每条线存在的转基因。仅脱脂3:1对甘草皂酸盐耐药的线进行分离。T3.这些T的种子2家庭在土壤上播种,再次选择血糖皂膦抗性以确定哪个2家庭个体被固定为FLN1-HA转基因。T3.种子纯合FLN1-HA转基因和分离FLN1-1.采用地塞米松依赖互补试验。种子在不同浓度的地塞米松上培养皿,7天后记录子叶为绿色或淡色的幼苗数量。在生长发育过程中,将种子在4°C下铺层2 d,然后置于室温(RT)。RT当天或1、2天后将地塞米松添加到培养皿中,7天后将子叶标记为绿色。
免疫印迹分析
总蛋白提取液是从为上述补充试验而生长的幼苗中制备的。采用5x Laemmli样品缓冲液(125 mM Tris pH 6.8, 20% SDS, 10% β-硫醇,20%甘油,0.2 mg/mL溴苯基蓝),以幼苗质量(mg)与缓冲液(μl)的1:1比例均匀化组织。均质后,裂解物煮沸5分钟,16000xg离心20分钟清除。蛋白在8%凝胶上通过SDS-PAGE分离,转移到PDVF Immobilon-P膜(Millipore, Billerica, MA, USA)进行免疫印迹。用BLOTTO[5%脱脂奶粉,TBS-T (50 mM Tris, 200 mM NaCl, 0.1% Tween-20), 0.165%消泡Y乳剂(Sigma)]封膜15分钟,然后用1:1000抗ha过氧化物酶(3只F10大鼠单克隆抗体,Mannheim, Roche Diagnostics, Germany)在BLOTTO中免疫印迹2小时。膜在TBS-T中清洗,然后使用Amersham ECL Plus西部检测系统(GE Healthcare, Buckinghamshire, United Kingdom)和x射线胶片按照制造商的说明进行开发。
缩写
- NEP:
-
Nuclear-encoded聚合酶
- 动员:
-
Plastid-encoded聚合酶
- FLN1 FLN2:
-
Fructokinase样蛋白质
- TAC:
-
转录活跃的染色体
- QRT-PCR:
-
定量实时RT-PCR
- TEM:
-
透射电子显微镜法
- ADK:
-
腺苷激酶。
参考文献
- 1.
关键词:核基因组,基因表达,基因表达王志强。2008,9:383-395。10.1038 / nrg2348。
- 2.
Hess WR, Börner T:高等植物细胞器RNA聚合酶。国家自然科学基金项目:国家自然科学基金项目。
- 3.
丰田Y,Onda Y,Shiina T,Nakahira Y:高等植物中的塑性转录。CRIT Rev Plant Sci。2005,24:59-81。10.1080 / 07352680590910438
- 4.
Serino G, Maliga P:质体rpo基因编码的RNA聚合酶亚基与核编码的质体酶不共享。植物营养与肥料学报。1998,19(4):457 - 461。10.1104 / pp.117.4.1165。
- 5.
Hajdukiewicz Pt,Allison La,Maliga P:由核和塑性隔室编码的两个RNA聚合酶在烟草塑料中透过不同的基因组。Embo J. 1997,16:4041-4048。10.1093 / EMBOJ / 16.13.4041。
- 6.
Allison LA, Simon LD, Maliga P: rpoB的缺失揭示了高等植物质体中第二个不同的转录系统。中国海洋大学学报(自然科学版),1996,15:2802-2809。
- 7.
Hallick RB,Lipper C,Richards OC,Rutter WJ:从Euglena Gracilis的叶绿体中分离转录活性染色体。生物化学。1976,15:3039-3045。10.1021 / BI00659A016。
- 8.
黄敏:玉米叶片中叶绿体和质体发育的核丰富蛋白质组:核功能的新概念框架。植物营养与肥料学报。2012,32(4):457 - 461。10.1104 / pp.111.188474。
- 9。
Pfalz J, Liere K, Kandlbinder A, Dietz KJ, Oelmüller R: pTAC2, -6,和−12是质体基因表达所需的转录活性质体染色体的组成部分。acta botanica sinica, 2017, 36(6): 772 - 772。10.1105 / tpc.105.036392。
- 10。
在芥菜(Sinapis alba L.)幼苗中差异表达的两类质体dna依赖RNA聚合酶的分离。植物生态学报,1998,25(4):489 - 494。10.1007 / BF00024199。
- 11.
Steiner S, Schröter Y, Pfalz J, Pfannschmidt T:质体编码RNA聚合酶复合物的基本亚基的鉴定揭示了适当的质体发育的构建模块。植物营养与肥料学报。2011,31(4):453 - 457。10.1104 / pp.111.184515。
- 12.
Suzuki Jy,Ytterberg Aj,Beardslee Ta,Allison La,Wijk Kj,Maliga P:亲和纯化烟草塑性RNA聚合酶和体外重建的全酶。工厂J. 2004,40:164-172。10.1111 / J.1365-313x.2004.02195.x。
- 13.
李志强,王伟和,李志强,等:植物线粒体和叶绿体的转录机制:组成、功能和调控。植物营养与肥料学报,2011,29(4):441 - 446。10.1016 / j.jplph.2011.01.005。
- 14.
Schröter Y, Steiner S, Matthäi K, Pfannschmidt T:分析芥菜中核酸结合蛋白的叶绿体亚蛋白质组中的寡聚蛋白复合物,揭示了质体基因表达的潜在氧化还原调控因子。蛋白质组学。2010,10:2191-2204。10.1002 / pmic.200900678。
- 15.
Arsova B, Hoja U, Wimmelbacher M, Greiner E, Ustün S, Melzer M, Petersen K, Lein W, Börnkeacta botanica sinica(云南植物研究),2010,22(4):498- 498。10.1105 / tpc.109.071001。
- 16.
Sellick Ca,Campbell Rn,Reece RJ:酵母结构中的半乳糖新陈代谢和Leloir途径酶的调节和编码它们的基因。INT Rev Cell Mol Biol。2008,269:111-150。
- 17.
通过hxk2依赖的信号通路感知葡萄糖。生物化学学报,2005,33:265-268。10.1042 / BST0330265。
- 18.
PELÁEZr,伊莱德·普,莫雷诺F:酵母六酮酶的功能域2. Biochem J.2010,432:181-190。10.1042 / BJ20100663。
- 19.
刘义祥,周玲,刘义祥。拟南芥葡萄糖传感器HXK1在营养、光和激素信号转导中的作用。科学通报。2003,33(4):434 - 434。10.1126 / science.1080585。
- 20。
在糖激酶的己糖激酶、核激酶和半乳糖激酶家族的不同蛋白质折叠上相似的酶功能的收敛进化。中国生物医学工程学报,1993,2:31-40。
- 21。
王磊,王丽萍,王丽萍,王丽萍,王丽萍。拟南芥腺苷激酶的研究进展。动力学特性和基因表达。植物生理学报。2000,34(4):591 - 598。10.1104 / pp.124.4.1775。
- 22。
Moffatt BA, Stevens YY, Allen MS, Snider JD, Pereira LA, Todorova MI, Summers PS, Weretilnyk EA, Martin-McCaffrey L, Wagner C:腺苷激酶缺乏与发育异常和转甲基化减少相关。植物营养与肥料学报。2002,22(2):429 - 434。10.1104 / pp.010880。
- 23。
Young LS, Harrison BR, Narayana Murthy UM, Moffatt BA, Gilroy S, Masson PH:腺苷激酶调节拟南芥根向地性和帽状形态发生。植物营养与肥料学报,2006,32(4):569 -573。10.1104 / pp.106.084798。
- 24.
Schoor S,Farrow S,Blaschke H,Lee S,Perry G,Von Schwartzenberg K,Emery N,Moffatt B:腺苷激酶有助于拟南芥中的细胞蛋白互联。植物理性。2011,157:659-672。10.1104 / pp.111.181560。
- 25.
Ogawa T, Nishimura K, Aoki T, Takase H, Tomizawa K, Ashida H, Yokota A:一种磷酸果糖激酶b型碳水化合物激酶家族蛋白,NARA5,在拟南芥中大量表达质体编码的光合基因。植物营养与肥料学报。2009,31(4):591 - 598。10.1104 / pp.109.139683。
- 26.
陈志强,陈志强,陈志强:转基因植物中糖皮质激素介导的转录诱导系统。植物学报1997,11:605-612。10.1046 / j.1365 - 313 x.1997.11030605.x。
- 27.
VINATZEL BA,TEITZEL GM,LEE MW,Jelenska J,Hotton S,Fairfax K,Jenrette J,Greenberg JT:III型效应曲目掺杂射精PV。Syringae B728a及其在宿主和非宿主植物上的存活和疾病中的作用。mol microbiol。2006,62:26-44。10.1111 / J.1365-2958.2006.05350.x。
- 28.
Morrissey at,Fraenkel dg:大肠杆菌的磷蛋白酶突变抑制剂。J细菌。1972,112:183-187。
- 29。
Fraenkel DG,Kotlarz D,Buc H:两种果糖6-磷酸激酶激酶活动在大肠杆菌中。J Biol Chem。1973,248:4865-4866。
- 30.
Daldal F:基因PFKB的核苷酸序列编码大肠杆菌K-12的次磷酸氨基酶。基因。1984年,28:337-342。10.1016 / 0378-1119(84)90151-3。
- 31。
Babul J:FromeScherichia Coli的磷蛋白酶酶。缺乏同工酶的纯化和表征。J Biol Chem。1978年,253:4350-4355。
- 32。
大肠埃希氏菌磷酸果糖激酶的核苷酸序列和高水平表达。王志强,王志强。10.1111 / j.1432-1033.1985.tb08934.x。
- 33。
腺苷激酶和核糖激酶- RK家族蛋白。中国生物医学工程学报。2008,32(6):691 - 697。10.1007 / s00018 - 008 - 8123 - 1。
- 34。
HESS WR,送达T:高等植物的细胞内RNA聚合酶。国家自然科学基金项目:国家自然科学基金项目。
- 35。
DE Santis-Maciossek G,Kofer W,Bock A,Schoch S,Maier RM,Wanner G,RüdigerW,Koop Hu,Herrmann RG:塑体RNA聚合酶基因RPOA,B和C1的靶向破坏:分子生物学,生物化学和超微结构.植物J. 1999,18:477-489。10.1046 / J.1365-313x.1999.00473.x。
- 36.
王建辉,王建辉,王建辉,王建辉,王建辉。王志强,王志强。2003。10.1098 / rstb.2002.1180。
- 37.
DEMARSY E,BUHR F,Lambert E,LERBS-MACHE S:塑体特异性萌发和幼苗建立转录程序的表征。J Exp Bot。2012,63:925-939。10.1093 / JXB / ERR322。
- 38.
王志强,王志强,王志强:植物萌发和早期发育过程中质体转录机制的构建。植物营养与肥料学报,2006,32(4):457 - 461。10.1104 / pp.106.085043。
- 39.
Maréchal A, Parent JS, Véronneau-Lafortune F, Joyeux A, Lang BF, Brisson N:在拟南芥中,旋转蛋白维持质体基因组的稳定性。美国国家科学院学报。2009年,106:14693 - 14698。10.1073 / pnas.0901710106。
- 40.
关键词:拟南芥,拟南芥,类囊体膜,核基因,VIPP1美国国家科学院学报。2001年,98:4238 - 4242。10.1073 / pnas.061500998。
- 41.
Chen M,GalvãoRM,Li M,Burger B,Budea J,Bolado J,Chory J:Arabidopsis Hemera / PTAC12通过Phytochromes引发光致血栓发生。细胞。2010,141:1230-1240。10.1016 / J.Cell.2010.05.007。
- 42.
Myouga F, Hosoda C, Umezawa T, Iizumi H, Kuromori T, Motohashi R, Shono Y, Nagata N, Ikeuchi M, Shinozaki K:铁超氧化物歧化酶杂合物在拟南芥叶绿体核防御氧化应激和叶绿体发育中必不可少。acta botanica sinica, 2017, 36(4): 497 - 503。10.1105 / tpc.108.061341。
- 43.
拟南芥DNA旋回酶是针对叶绿体和线粒体的。美国国家科学院学报。2004年,101:7821 - 7826。10.1073 / pnas.0400836101。
- 44。
Cho HS,Lee Ss,Kim KD,Hwang I,Lim Js,Park Yi,Pai Hs:DNA丙糖酶参与叶绿体核分配。植物细胞。2004,16:2665-2682。10.1105 / TPC.104.024281。
- 45。
Garcia M,Myouga F,Takechi K,Sato H,Nabeshima K,Nagata N,Takio S,Shinozaki K,Takano H:细菌肽蛋白合成酶Mure的拟南芥同源物在叶绿体发育中具有重要作用。工厂J. 2008,53:924-934。
- 46。
Gao ZP, Yu QB, Zhao TT, Ma Q, Chen GX, Yang ZN:拟南芥染色体复合物pTAC14与pTAC12/HEMERA相互作用并调控质体基因表达。植物营养与肥料学报。2011,33(4):453 - 457。10.1104 / pp.111.184762。
- 47。
Koussevitzky S,Nott A,Mockler TC,Hong F,Sachetto-Martins G,Surpin M,Lim IJ,Mittler R,Chory J:来自Chloroplasts的信号融合以调节核基因表达。科学。2007,316:715-719。10.1126 /科学。1140516。
- 48.
SUSEK R,AUSUBEL F,CHORY J:拟南芥信号转导突变体uncuply核驾驶室和RBCS基因表达来自叶绿体发育。细胞。1993,74:787-799。10.1016 / 0092-8674(93)90459-4。
- 49.
晶文p,kremnev d,blanco n,de dios barajaslópezj,piñasfernándeza,tellgren-roth c,小我,strand a:Pep活动和高光依赖性塑料氧化还原的拟氧化物的塑料氧化还原2突变体受损向核发出信号。工厂J. 2012,70:279-291。10.1111 / J.1365-313x.2011.04865.x。
- 50。
Huberts DH,Van der Klei IJ:Moonlighting Proteins:多任务处理的有趣模式。Biochim Biophys Acta。2010,1803:520-525。10.1016 / J.BBAMCR.2010.01.022。
- 51。
核己糖激酶1复合物在葡萄糖信号转导中的调控作用。细胞。2006,127:579-589。10.1016 / j.cell.2006.09.028。
- 52.
王志强,王志强:拟南芥种子资源的研究进展。植物营养与肥料学报。2000,19(4):457 - 461。10.1104 / pp.124.4.1477。
- 53.
Alonso JM, Stepanova AN, Leisse TJ, Kim CJ, Chen H, Shinn P, Stevenson DK, Zimmerman J, Barajas P, Cheuk R,等:拟南芥全基因组插入突变。中国科学(d辑):地球科学(英文版)。10.1126 / science.1086391。
- 54.
Samson F, Brunaud V, Balzergue S, Dubreucq B, Lepiniec L, Pelletier G, Caboche M, Lecharny A:拟南芥T-DNA转化体侧边插入位点(FSTs)定位数据库。核酸学报2002,30:94-97。10.1093 / nar / 30.1.94。
- 55。
Gilkerson J,Hu J,Brown J,Jones A,Sun TP,Callis J:Cul1-7的隔离和表征,Cullin1的隐性等位基因,破坏了Cul1拟南芥C末端的SCF功能。遗传学。2009,181:945-963。10.1534 / genetics.108.097675。
- 56。
Karnovsky MJ:一种甲醛-戊二醛固定剂,用于电子显微镜的高渗透性。中国生物医学工程杂志。
- 57。
真空-微波组合处理植物组织的电子显微镜。微波技术与协议。编辑:Giberson RT Jr, Demaree RS. 2001, Human Press, Totowa, NJ
- 58。
张志强,张志强:《透射电子显微镜的原理与技术》,1992,Jones and Bartlett Publishers, Boston, MA, 16-47。
- 59。
Kalina M,Pease DC:在模型系统中通过单宁酸在饱和磷脂酰胆碱中的超微结构保存,II型肺炎。J细胞BIOL。1977年,74:726-741。10.1083 / JCB.74.3.726。
- 60.
电子显微镜下低分子量的没食子葡萄糖作为媒质。I.媒染效果的程序和证据。中国生物医学工程杂志。10.1083 / jcb.70.3.608。
- 61.
Bozzola JJ, Russell LD:透射电镜标本染色和对比方法。《生物学家的电子显微镜原理和技术》,1992,Jones and Bartlett Publishers, Boston, MA, 48-71。
- 62.
微波刺激戊二醛和锇四氧化物固定植物组织:超微结构保存秒。生物化学学报。1998,7:341-347。10.1007 / BF00270036。
- 63.
Yamada K, Lim J, Dale JM, Chen H, Shinn P, Palm CJ, Southwick AM, Wu HC, Kim C, Nguyen M,等:拟南芥基因组转录活性的实证分析。中国科学:地球科学。10.1126 / science.1088305。
- 64.
Clough SJ,弯曲AF:花卉浸:农杆菌介导的拟南芥转化的简化方法。工厂J.998,16:735-743。10.1046 / J.1365-313x.1998.00343.x。
确认
作者感谢美国能源部基础能源科学办公室化学科学、地球科学和生物科学部门对JCallis (DE-FG02-09ER16077)和JChory (FG02-11ER15540)的评价。此外,qPCR实验得到了霍华德休斯医学研究所(JChory)的部分支持。我们感谢加州大学戴维斯控制环境基金(CEF)在转基因植物繁殖方面的帮助。我们感谢Meliza Castro和Gurjeet Bath的出色协助,以及UCD电子显微镜实验室Patricia Kysar对TEM实验的帮助。我们特别感谢井上Kentaro对这里没有展示的实验进行了有益的讨论和帮助,还有Jesse Woodson进行了有益的讨论。
作者信息
隶属关系
通讯作者
额外的信息
利益争夺
两位作者宣称他们没有相互竞争的利益。
作者的贡献
JG和JCALLIS构思了实验,JG,JMPR和JCALLIS进行了实验。JCHORY参与了QRTPCR研究的设计。JG写了第一个草案,由Jcallis和JChory编辑。所有作者阅读并认可的终稿。
电子补充材料
12870_2012_1030_moesm1_esm.pdf.
附加文件1:图S1:T-DNA边界的序列弗恩等位基因。来自PCRS的T-DNA特异性条带从T-DNA的左边缘测序三种不同的线。T-DNA的取向由左边的“L”表示,对于右边边界。盒装序列是在插入之前的T-DNA或在轨迹处的额外DNA。插入位点的右边界序列未确定。因为fln2-1和fln2-3有两个倒置的T-DNA串联插入,可以确定插入的每一侧的序列。未装箱序列存在于内源性位点。(PDF 33 KB)
12870_2012_1030_moesm2_esm.doc.
附加文件2:表S1:用于PCR的DNA引物序列。包含本研究中使用的引物序列列表。(DOC 58 KB)
作者为图像提交的原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0.)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
吉尔克森,佩雷斯-鲁伊斯,乔里,J。et al。pfkb型碳水化合物激酶果糖激酶- 1和果糖激酶- 2是植物生长发育所必需的拟南芥蒂利亚纳.BMC植物杂志12,102(2012)。https://doi.org/10.1186/1471-2229-12-102
已收到:
接受:
发表:
关键字
- PFKB型碳水化合物激酶
- FLN
- 叶绿体转录
- PTAC复合体
- 拟南芥蒂利亚纳