摘要
背景
MYB超家族是植物中描述的最丰富的转录因子群之一。然而,它们的职能似乎非常多样化,仍然相当不明确。到目前为止,还没有在豆科植物中进行过该基因家族的全基因组特性研究。在这里,我们报道了第一个对豆科植物大豆MYB超家族的全基因组分析。大豆),包括基因结构、系统发育、染色体位置、保守基序和表达模式,以及与拟南芥.
结果
共鉴定出244个R2R3-MYB基因,并将其与已知的同源基因进行系统发育比较分析,分为48个亚家族,显示出基因丢失和复制事件。系统发育分析表明,功能相似的MYB基因大多聚在同一个亚家族中,并通过同源性分析确定了同源基因,表明MYB基因亚群之间具有很强的功能保守性。MYB基因各亚群的系统发育关系均由MYB结构域外高度保守的内含子/外显子结构和基序所支持。同义核苷酸取代(dN/d年代)分析表明,大豆MYB dna结合域处于强负选择状态。染色体分布模式表明,大豆MYB基因在全基因组范围内的片段复制和串联复制促进了基因的扩增。此外,我们发现约4%的大豆R2R3-MYB基因发生了选择性剪接事件,从一个基因产生了多种转录本,说明转录组调控的复杂性极高。R2R3-MYB基因在大豆和大豆中的比较表达谱分析拟南芥揭示了MYB基因在植物中的作用是保守的和多样化的,这表明了功能上的分化。
结论
在这项研究中,我们确定了迄今为止已知的植物中最大的MYB基因家族。我们的研究结果表明,这个大基因家族的成员可能参与不同的植物生物学过程,其中一些可能与豆科植物特异性结瘤有关。我们的比较基因组学分析为未来该家族基因的功能解剖提供了坚实的基础。
背景
转录因子通常至少由四个离散的结构域组成:dna结合结构域、核定位信号、转录激活结构域和寡聚结构域。这些结构域共同作用,调节许多生理和生化过程,激活和/或抑制转录,以应对内源性和外源性刺激[1,2].此外,转录因子通常由多基因家族编码,因此增加了可能的转录调控作用的数量和复杂性[1].
MYB转录因子广泛分布于所有真核生物中,是植物界中最大的转录因子家族之一。MYB蛋白由位于n端高度保守的MYB dna结合结构域定义[3.].MYB结构域在动物、酵母和植物中高度保守,通常由1-4个不完全重复序列(R0、R1、R2和R3)组成。每个重复包含大约50-53个氨基酸,编码3个α-螺旋,其中第二个和第三个螺旋形成螺旋-转螺旋(HTH)结构。当与DNA结合时,HTH结构插入主槽[3.,4].此外,它还包含三个有规律间隔的色氨酸残基,这些残基在每个重复的疏水核心中形成簇,并稳定dna结合域的结构[5].相比之下,c端是激活结构域,MYB蛋白之间差异很大,这导致了MYB基因家族的调控作用广泛[4,6,7].
第一个被发现的MYB基因是v-myb禽成髓细胞病病毒基因[8].随后,3 v -myb有关的基因(c -myb, - - - - - -myb和B -myb)在各种脊椎动物、昆虫、真菌和黏菌中被发现[3.,9- - - - - -11].一般来说,动物MYB dna结合结构域由三个串联的MYB基序重复序列(指定为R1、R2和R3)组成,称为3R-MYB蛋白。第一个鉴定到的植物MYB基因为C1,从该植物中分离得到玉米编码一个c-myb参与花青素生物合成的类转录因子[12].越来越多的植物R2R3-MYB超家族成员随后被鉴定出来,并在许多植物中进行了鉴定。这些基因在植物特异性过程中具有多种功能,包括次生代谢[13- - - - - -16],激素信号转导[17,18]、环境压力[19- - - - - -21]、细胞形状和器官发育[22- - - - - -25].此外,尽管植物也可能含有3R-MYB基因,但主要的MYB转录因子是R2R3-MYB和/或R1-MYB类型[26,27].例如,拟南芥基因组只包含5个3R-MYB基因,而R2R3-MYB和myb相关基因多达190个[4,27,28].与此同时,杨树基因组包含5个3R-MYB基因和192个R2R3-MYB基因[29].
目前,我们对植物MYB基因的大部分知识都来自于对主要遗传模式植物的研究,拟南芥该研究基于其注释完善的基因组序列。然而,该属缺乏某些农业性状,如与根瘤菌形成固氮共生关系的能力,与菌根真菌形成土壤养分清除共生关系的能力。因此,虽然它构成了基因功能研究的一个有用的模式生物,但它的潜在农业应用有限。相比之下,豆科植物能够建立有益的固氮和菌根共生关系,因此,数千年来一直是可持续农业的中流砥柱。然而,到目前为止,还没有在豆科植物中进行MYB家族的全基因组特性研究。因此,正如下文所讨论的,只有少数豆科植物MYB基因(MYB)的功能是已知的,主要是与非生物胁迫、类黄酮代谢和结瘤有关的基因。此外,大豆MYB基因(gmmyb)与其他植物MYB基因的全基因组分布和系统发育关系尚不清楚。幸运的是,完整的大豆基因组序列为该基因家族的基因组分析提供了宝贵的资源。因此,迫切需要对大豆myb基因的作用进行表征,并对这些基因进行完整的鉴定和分类。
鉴于MYB蛋白在调控基因表达、次生代谢和对环境胁迫的反应方面的潜在作用,以及大豆是第一种完整基因组测序的豆科植物,确定该物种中存在多少MYB基因,以及基因结构特征、系统发育关系、染色体位置、保守基序和表达模式是很有意义的。此外,揭示新的和尚未鉴定的大豆myb的功能也很重要,特别是那些可能涉及种子发育和豆类特异性结瘤的myb。在此框架下,本研究确定了大豆myb的全部补体,并对大豆和大豆之间的myb进行了全基因组比较分析拟南芥.我们提出了大豆MYB基因家族的全面分类,以及结构、表达和功能分析。我们共鉴定了252个myb基因,其中包括244个R2R3-MYB (2R-MYB)基因,6个R1R2R3-MYB (3R-MYB)基因和2个R0R1R2R3-MYB (4R-MYB)基因,其中大部分基因的功能特征未被证实。在系统发育分析的基础上,我们将myb分为拟南芥将大豆和大豆分成48个亚科,从而可以识别共享和唯一的亚科,并检查myb亚群之间的功能关系。我们还估计了大豆和大豆最近共同祖先中myb的数量拟南芥.值得注意的是,在系统发育分析的基础上定义的亚家族的可靠性是由附加的标准支持的,如内含子的存在和位置、基因结构和MYB结构域外常见蛋白基序的存在。染色体分布分析表明,部分复制事件可能促成了该基因家族的扩大。在每个亚科中发现的同源和同源基因的特定簇显示了祖先复制和/或基因丢失事件。此外,大豆全基因组RNA-seq分析也揭示了不同器官、组织和/或发育阶段的表达谱[30.].大豆和大豆中myb基因表达谱的比较分析拟南芥表明atmyb和gmmyb具有不同的表达模式,并且在同一系统发育演化支和子演化支中的myb具有保守的表达模式。这一发现表明,gmmyb及其同源物之间存在着功能多样性和守恒性。此外,还有种特异性亚科,其中一些在结瘤过程中特异表达。我们的发现为进一步研究大豆MYB转录因子的生物学和分子功能迈出了第一步。
结果与讨论
大豆MYB基因家族的鉴定与分类
为了确定大豆MYB基因家族,我们搜索了整个大豆基因组序列,寻找编码含有MYB dna结合域的蛋白质的基因。BLASTP搜索使用一致典型的R2R3-MYB dna结合域序列作为查询。我们确定了大约700个包含MYB或类似MYB重复的序列;这些基因约占46,430个大豆蛋白编码位点的1.7%,以及5671个大豆转录因子基因的14% [31].首先,我们根据其识别号和染色体位置从数据集中删除冗余序列。
为了验证我们研究结果的可靠性,我们进行了PROSITE profile (PS50090)和简单的模块化架构研究工具(SMART)分析,以确定大豆基因组中所有假定的MYB蛋白序列。我们从进一步的分析中排除了26个假定的MYB蛋白序列,它们包含典型的R2R3-MYB结构域,但在n端区域缺少部分序列(额外的文件1).我们还排除了Glyma09g37340,它包含一个预测的MYB基序和完整的开放阅读框(OFR),且置信度低。假设的新MYB序列,结合之前对MYB家族的估计,最终从大豆基因组中获得了244个典型的R2R3-MYB蛋白(2R-MYB), 6个R1R2R3-MYB蛋白(3R-MYB)和2个类似4r的MYB蛋白(4R-MYB)的原始数据集(额外的文件1).MYB超家族是植物中最丰富的转录因子家族,共有126个2R-MYB基因拟南芥[4, 109在水稻[27,32,葡萄118毫升[29,33,以及Populus中的192个[29].在本研究中,剩余的252个序列(超过5671个预测大豆转录因子基因的4%)代表了大豆MYB家族的最新分类,构成了已知的最大的植物MYB转录因子基因家族之一。根据通用系统命名所得到的序列,以及序列名称与来自相应基因组浏览器的基因和蛋白质标识符的对应关系(额外的文件1).本研究中使用的gmmyb命名系统暂时用于区分每个MYB基因。
MYB结构域的多序列比对和序列特征
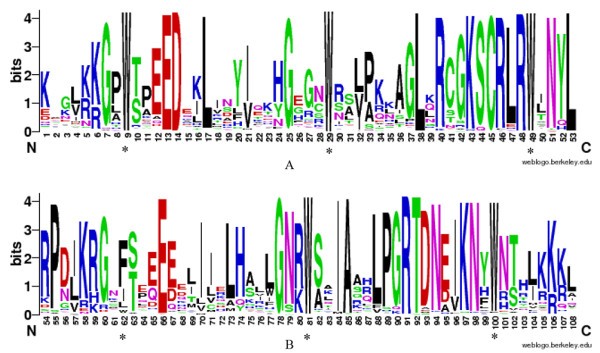
为了研究大豆R2R3-MYB结构域的同源结构域序列特征,以及大豆R2R3-MYB结构域每个重复中每个位置最常见氨基酸的频率,我们使用R2和R3重复的244个同源结构域氨基酸序列进行了多次对齐分析(图1).
在大豆基因组的所有R2R3-MYB蛋白中,R2和R3 MYB重复序列高度保守。R2 (一个)和R3 (b) MYB重复序列是基于所有大豆R2R3-MYB结构域的全长比对。用ClustalW对244个大豆典型的R2R3-MYB结构域进行多重比对分析(比对的完整表示见额外的文件2).位分数表示序列中每个位置的信息内容。星号表示MYB结构域的保守色氨酸残基(Trp)。
总的来说,MYB结构域的基本区域有108个基本残基(包括连接子区域),很少有缺失或插入(约6%;额外的文件2).相比之下,dna结合区域外的区域在长度和氨基酸组成方面是不同的。数字1为R2和R3 MYB重复序列对应位置的氨基酸残基分布。总的来说,大豆的MYB结构域中保守氨基酸的分布与大豆非常相似拟南芥,与植物间myb的进化距离相符。与之前的报道一致,大豆R2R3-MYB家族的R2和R3 MYB重复序列包含特征氨基酸,包括一系列分布均匀且高度保守的色氨酸(Trp)残基,已知其在序列特异性DNA结合中发挥关键作用[4,29,32].除了高度保守的色氨酸残基,我们还观察到超过90%的大豆R2R3-MYB结构域存在高度保守的替代残基。其中包括R2重复序列中的Gly-7、gly -13、Asp-14、Leu-17、Gly-25、Leu-38、Arg-40、Lys-43、Cys-45、Arg-46、Arg-48、Asn-51和Leu-531a)和Pro-55, Glu-66, Gly-78, Ile-84, Ala-85, Leu-88, Pro-89, Gly-90, Arg-91, thri -92, Asp-93, Asn-94, Lys-97和Asn-98在R3重复(图1b).与其他植物物种中的Trp相同,R3重复中第一个保守的Trp残基通常被F所取代(图1b).如图所示1, MYB结构域的主要保守残基主要分布在每个重复的第二和第三个保守色氨酸残基之间。因此,每个重复MYB结构域第一部分的保守性明显较低,这主要是因为每个重复中HTH结构域的第三螺旋是244个gmmyb中最保守的区域。
244个gmmyb在cDNA水平上的序列相似性在开放阅读框(ORF)上表现出高度的序列差异,在5.50% ~ 99%之间。ORF相似性最高的是GmMYB100、GmMYB243和GmMYB244,而相似性最低的是GmMYB029和GmMYB156。大多数基因具有非常短的5 ' -非翻译区(UTR)(图2b和额外的文件3),该编码区相似性最低,表明该编码区比5 ' -UTR序列更为保守。3 ' -UTR序列在gmmyb中同样保守性较差。此外,我们观察到gmmyb的一些5 ' -和3 ' - utr序列有内含子。有趣的是,这些基因主要聚集在同一个亚家族(C40;额外的文件3).244个r2r3 - myb编码的预测蛋白具有大约25-100%的一致性。与其他植物的MYB蛋白一样,大豆的MYB蛋白在dna结合区域高度保守。244个GmMYB蛋白在MYB结构域的整体相似性似乎较高。大约11对gmmyb蛋白在MYB结构域几乎相同,而超过72对gmmyb蛋白的相似性超过97%(在R2R3区域的108个残基中,观察到的差异不到3个)。相比之下,在MYB结构域下游几乎没有序列相似性。
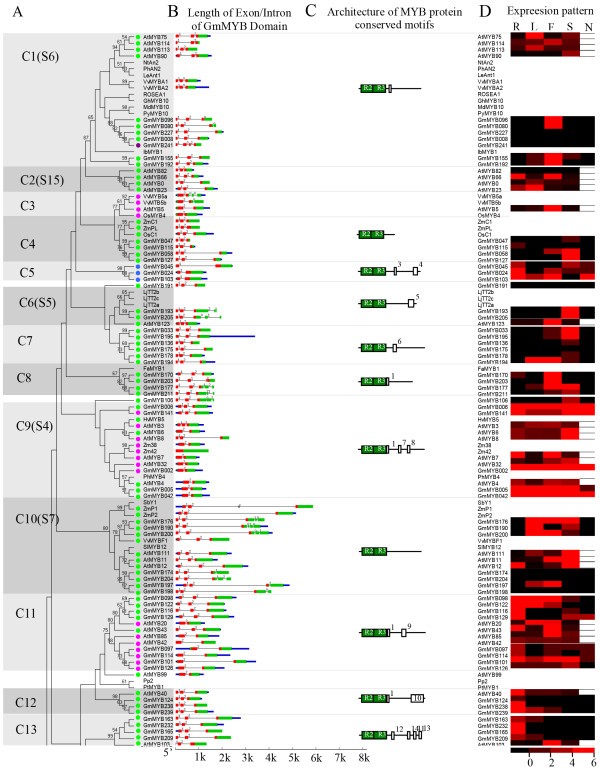
大豆MYB蛋白的系统发育关系和亚群命名,拟南芥和其他植物。(一个)邻接树表示来自大豆的252个MYB蛋白和来自大豆的132个MYB蛋白的关系拟南芥,包括5个3R-MYB蛋白拟南芥和6种大豆3R-MYB蛋白。将蛋白聚类为47个亚组,用亚组号(如C1)进行编号,并用不同交替色调的灰色背景进行标记,以方便亚族识别,具有较高的预测价值。分支旁边的数字表示来自1000个复制的引导支持值(>50%)。16个蛋白质不能很好地组合成簇。彩色的圆圈表示对应的内含子分布模式,如图所示3..(b)大豆和大豆MYB基因的结构拟南芥.外显子用绿色的方框表示,MYB结构域用红色的方框表示,未翻译区域用蓝色的方框表示,而彩色方框之间的空格对应着内含子。外显子和内含子的大小可以用水平比例尺来估计。(c47个亚科保守蛋白基序的结构。右边的基序是用模因(MEME)检测出来的,用图示的方式表示为每个亚科的代表性植物MYB蛋白按比例绘制的白色方框。(dMYB基因在大豆和大豆中的表达谱拟南芥在不同的器官。R,根;L,叶;F,花;年代,种子;N, legume-specific有节。在这个表达模式分析中,从AtGenExpress和SoySeq数据库中发表的四个器官的表达值中选择最高值。
作为作用于这些基因的选择压力的一个指标,我们计算了非同义核苷酸取代与同义核苷酸取代的比率(dN/d年代)在大豆MYB结构域。通过全局拟合进化模型,adN/d年代估计为0.1567,表明大豆MYB结构域处于强负选择状态(中性选择对应的比值为1)。在单个密码子水平上,我们发现99个MYB基因残基处于负选择状态,没有一个正选择残基。
MYB基因的选择性剪接
选择性剪接(Alternative splicing, AS)是一种通过扩展、缩短、跳过或包含外显子序列或保留内含子序列,使一个共同前体mRNA产生不同mRNA变体的机制。这使得从一个单一的编码序列中产生许多功能丰富的基因产物成为可能。最近,有人提出它是一种产生高阶多样性的机制,从而导致rna的多样化种群[34,35].由AS产生的各种基因异构体可能在特定的细胞隔室、组织和发育阶段具有特定的作用。
在水稻基因组18,933个转录单元中,约有27%因AS而包含两个或两个以上的转录本[36].本研究检测了MYB基因的AS。我们发现,大豆中244个R2R3-MYB基因中有10个包含2到5个替代结构,表明它们经历了AS,因此从单个基因(额外的文件1).在这些基因中,5个经历了多个启动子事件,4个竞争3 '剪接位点事件,一个多聚(a)位点事件。类似的,多达18个R2R3-MYB基因拟南芥经历类似的AS事件,包括5个多重启动子事件,5个竞争5 '剪接位点事件,4个竞争3 '剪接位点事件,一个多聚(A)位点事件和一个保留内含子事件。其余两个AS事件发生在5 ' -UTR区域而不影响编码帧,这表明它们产生了多种utr,这些utr可能在基因调控中发挥关键作用。我们的研究结果表明,多个启动子事件和竞争性3 '和/或5 '剪接位点事件可能是R2R3-MYB基因中AS事件的主要类型,这与人类和酵母AS事件形成了对比[37,38].我们的分析还表明,竞争的5 '和3 '剪接位点的外显子修饰的平均大小显著较短(约31 bp)。更有趣的是,在大豆中,4个相互竞争的3’剪接位点事件都位于R3重复的第二螺旋的同一位置,这表明可能存在一种保守机制。
通常,这些AS事件会导致相应orf中的各种序列插入和/或删除。例如,GmMYB028中一个33 bp的替代3 '剪接位点允许R3重复序列中11个氨基酸的延长或缩短。类似地,GmMYB140中21 bp的备选3 '剪接位点导致R3重复序列中7个氨基酸的缺失。有趣的是,我们观察到一些AS事件改变了MYB蛋白的类型。例如,GmMYB082的一个189 bp的替代启动子位点导致了一个帧移位,使R2R3-MYB转变为信号重复MYB类型。同样,在GmMYB152中一个237 bp的可选启动子位点将5 '外显子转位,使典型的R2R3-MYB基因转变为信号重复MYB基因。相比之下,GmMYB237通过不同的启动子和不同的聚(A)位点表现出三种不同类型的剪接。第一个转录本在5 '端删除了超过2000 bp,在3 '端插入了一个长片段;第二种结果是在3 '末端出现了长时间的删除;第三种(3R-MYB蛋白)导致3R-MYB蛋白中R1和R3重复的缺失。 In拟南芥, 18个AS事件中的16个发生了类似的AS事件(数据未显示),这进一步强调了AS与MYB基因家族的相关性。
目前MYB dna结合域的进化有两种模型:“获得”和“失去”模型。“增益”模型提出r1r2r3 - myb是由原始真核生物中连续的基因内复制或三重复制产生的[3.,39].MYB结构域的复制产生多重复MYB蛋白,然后通过整个基因的复制使MYB蛋白扩增,分别导致高等植物和动物中R2R3-MYB和R1R2R3-MYB的丰度[40].“丢失”模型表明植物MYB祖先可能有三个MYB重复序列,r2r3 -MYB相关蛋白在祖先三重复MYB基因中编码R1的序列丢失后出现[26,41].这两种模型在解释MYB转录因子家族起源方面各有优缺点。因此,该基因家族的进化有待进一步研究。我们目前的研究结果表明,一些MYB基因可以通过AS产生不同的变异,其中一些变异涉及从2R-MYB到1R-MYB,或从3R-MYB到2R-MYB的变化。因此,AS事件似乎为MYB蛋白的进化提供了新的见解。
MYB家族基因的系统发育分析
为了评估MYB基因家族内部的进化关系,我们对MYB基因家族进行了组合系统发育分析拟南芥和大豆R2R3-MYB蛋白,得到邻居连接(NJ)树(图2一个和额外的文件3).由于类群数量多,信息特征相对较少,导致内部节点的bootstrap支持值较低;相比之下,外部节点获得了更高的引导支持(数据未显示)。因此,我们通过使用最大简约性(MP)分析生成MP树,寻找更多的证据来支持我们的亚族命名的可靠性(额外的文件4).NJ和MP分析得到的树拓扑结构基本一致,表明两种方法具有很强的一致性。我们只发现三个序列(GmMYB078、GmMYB108和GmMYB143)不属于任何已识别的亚科,或者在不同的系统发育树之间显示了不明确的位置(图2一个和额外的文件3).
观察到的序列相似性和系统发生树拓扑结构使我们能够对大豆的MYB基因进行分类,拟南芥和其他植物分成47个亚科,大小从2到28个MYB基因不等(图2一个和额外的文件3).在我们对MYB基因的亚家族分类中,我们还考虑了strack等人(2001)和Dubos等人(2010)对atmyb基因的结果(图1)2一个和额外的文件3).我们的系统发育重建的有效性被以下事实所证实:它显示了与之前构建的系统发育树中观察到的相同的亚群[4,33,42].在之前的研究中,126个atmyb中的90个被分为25个亚科。然而,由于统计支持度低,其余36个基因未纳入系统发育分析。为了将我们的结果与之前的研究进行比较,我们在图中所示的树中标记了之前定义的演化支2而且额外的文件3.大部分大亚家族(即C1、C9和C38)得到了之前研究的支持,并得到了很强的bootstrap支持。然而,一些小的亚科(如C11, C15和C35;数字2一个和额外的文件3)没有在strack等人(2001)和Dubos等人(2010)报道的新泽西树中检索到。
在多基因家族的比较中,来自同一谱系的myb在系统发育树中倾向于聚集在一起,这表明它们是在谱系分化后复制的。此外,大豆和拟南芥R2R3-MYB蛋白在特定的支系中并不相同(图2一个和额外的文件3).通常发现两个或两个以上的gmmyb被假定为一个基因的同源物拟南芥,这说明大豆的myb在大豆和的分化后经历了复制拟南芥.例如,C22亚家族的系统发育只包括1个AtMYB和6个gmmyb。相比之下,4个atmyb和2个gmmyb包含在C19亚家族中。值得注意的是,一些同源物是在一个分支中的物种聚集在一起的(图2一个和额外的文件3),显示了祖先复制和基因丢失事件。例如,在C24亚族中,没有gmmyb被分组在拟南芥芥子油苷的进化枝(43- - - - - -45],其成员主要存在于十字花科物种中。这表明物种特异性myb的存在,它们要么丢失在拟南芥或从最近的共同祖先分化后在大豆谱系中获得。大豆和大豆在解剖和生理上的差异拟南芥表明在比较这两个R2R3-MYB亚家族时,某些分支可能发生了差异扩展。在这些功能支的内部和外部,大豆基因扩展被观察到作为基因对或集群。这可能反映了一个分支成员的缺失或大豆基因组的错误注释。在这种情况下,对某些成员的基因功能的了解将有助于确认近亲关系和同源关系。由于大多数gmmyb的功能尚未被表征,因此揭示每个分支中的正交关系将是有用的。
然而,仅从树的拓扑结构中很难推断出正交向量。一般来说,一个分支的基因功能在植物物种中表现出高度的,但不是绝对保守的。因此,利用共时关系来准确识别植物物种间的真同源关系是很有用的。为了支持假定的gmmyb和atmyb的正交关系,我们检查了大豆和atmyb基因组之间基于基因含量、顺序和方向的共效关系拟南芥.尽管染色体重排(例如,基因定位反转),但分析的不同染色体区域之间的基因含量是相似的,这支持了这些基因更可能是同源的推论。结果表明,广泛的大豆区域表现出同向性拟南芥基因组和多达1610个共链块之间的大豆和拟南芥本研究对基因组进行了鉴定。此外,在这两个物种中,多达100个高信度共链块包含至少一对MYB同源基因,约占gmmyb的36%,如GmMYB232/AtMYB103、GmMYB138/AtMYB124和GmMYB214/AtMYB61(表2)1,额外的文件5).我们经常发现,位于不同染色体上的多个gmmyb是同一个AtMYB基因的同源物,这强烈支持了大豆基因组的基因组复制事件。相比之下,观察到复制的atmyb是单个GmMYB基因的同源基因,这表明atmyb在从共同祖先分化后也经历了复制。
MYB结构域内内含子/外显子结构的定义
观察到的内含子在每个亚族中的分布、位置和相如图所示3.而且额外的文件3.为了确定每个大豆MYB基因内外显子和内含子的数量和位置,我们将全长cDNA序列与相应的基因组DNA序列进行了比较。我们观察到大多数myb的编码序列被内含子破坏。相比之下,只有5%的MYB在MYB编码区没有内含子(图3.模式n);其余的基因根据它们的相对位置和相位有多达14个内含子。
此前有报道称,大多数拟南芥MYB家族基因拥有两个内含子,dna结合域内含子的数量从0到3个不等[32,33].在本研究中,我们在gmmyb中发现了更多的内含子类型(dna结合域的内含子类型从1到5种不等),可以根据内含子的存在和位置分为14种模式(图)3.约74%的大豆基因表现为模式h,该模式在R2R3-MYB结构域具有高度保守的3个外显子和2个内含子的拼接排列(图1)3.).除了典型的h模式外,其余myb也改变了剪接位点,显示出其余13种模式(图3.).17%的gmmyb(如C5、C16、C29和C30亚家族)中不存在这两个内含子中的任何一个,而只有4%的gmmyb在MYB结构域中包含两个以上的内含子。
值得注意的是,同一亚科的基因通常表现出相同的内含子模式,在大多数亚科中内含子的位置几乎完全保守。这一发现为测试我们的系统发育分析的可靠性提供了一个独立的标准。例如,亚族C42缺少内含子1和2;亚族C5缺少内含子2;亚族C30缺少内含子1;C4亚族保留了典型的剪接位点(图2b和额外的文件3).有趣的是,在拟南芥大多数MYB在MYB结构域中包含不超过2个内含子,除了'保护细胞分裂限制'分支中的AtMYB88和AtMYB124,它们具有复杂的外显子/内含子组织(分别为10和11个内含子)[33].而在大豆中,检测到AtMYB88和AtMYB124的4个同源基因(GmMYB051、GmMYB067、GmMYB091和GmMYB138),并将其归为C46亚家族。与AtMYB88和AtMYB124一样,该亚家族中的gmmyb在整个ORF中也包含一个复杂的外显子/内含子组织(10-12个内含子)。这一组的成员在MYB结构域中包含了多达5个内含子,这不仅支持了它们之间密切的进化关系,也表明了该内含子模式(模式m)在进化中的保守性。值得注意的是,尽管MYB结构域中有大量的内含子,但内含子的相位几乎是保守的(图3.而且额外的文件3).这说明它不是一个偶然的突变事件,而是植物MYB转录因子进化的一个保守模式。
我们进一步观察到内含子的剪接位点一般位于R2和R3重复序列中,并且靠近剪接位点的氨基酸高度保守(图3.而且额外的文件2).内含子1的剪接位点最常见的氨基酸是R2重复序列中的AG-L,而R3重复序列中内含子2的插入位点为LGN-WS,典型的模式为h(占大豆基因的74%)。除模式n(无内含子)外,244个r2r3 - myb中只有13%的内含子位置不同(额外的文件3,亚科C39 ~ C47)。多序列比对分析表明,MYB蛋白插入位点附近的一个或多个保守氨基酸残基在相应位点发生了突变或缺失(例如,C39、C40和C43亚家族;附加文件2而且3.).这一结果表明,这些位点在内含子的拼接中起着重要作用。有趣的是,内含子的主要剪接位点位于非常接近每个重复的保守位置(额外的文件2).此外,虽然整个ORF区域内含子的数量从1到14个不等,长度也有变化,但所有的内含子都是典型的I型(gt - ag -内含子)。这可能说明大豆MYB家族基因的内含子类型高度保守。
除了剪接位点外,我们还研究了MYB结构域中与密码子相关的内含子阶段。每个内含子的拼接被认为发生在三个阶段之一:阶段0、阶段1或阶段2,这取决于剪接是否发生在密码子之间。在第0阶段,剪接发生在第一个密码子的第三个核苷酸之后;在第一阶段,剪接发生在单个密码子的第一个核苷酸之后;在第二阶段,剪接发生在第二个核苷酸之后[46].有趣的是,同一亚家族的内含子在MYB结构域中的相位几乎是保守的(图2而且3.).同一亚群内的所有基因不仅外显子模式相似,而且外显子内含子相位保守;此外,大豆和大豆的基因结构是保守的拟南芥.例如,C4、C7和C10亚族(模式h)分别包含3个外显子,在R2重复和R3重复中分别包含1期和2期内含子。同样,C29、C30和C42亚家族中的内含子分别处于1期、2期和0期。我们的研究进一步揭示了MYB结构域中1期和2期内含子的显著过量,以及非对称外显子的过量。在分析的252个大豆MYB结构域中,79%有1期内含子,93%有2期内含子,只有10%有0期内含子。此外,在同一地点的阶段几乎是保守的(图2而且3.).总之,这些发现表明,在MYB基因的进化过程中,剪接阶段是高度保守的,因此进一步支持我们的亚家族命名(图2b和额外的文件3).
myb的外显子长度在每个亚科内高度保守。外显子1和2在长度上更受限制,而外显子3在大小上最多样化。总的来说,外显子1和2的长度非常相似(外显子1,133 bp;外显子2,130 bp)和高度保守(外显子1,27%的发生率;外显子2,68%发生)。外显子3编码MYB蛋白R3重复序列的最后一个区域和c端区域。该外显子的不同长度有助于获得新的或合作的功能基序和结构域,这可能是植物MYB同源体之间功能差异的原因。有趣的是,在大豆中观察到的R2R3-MYB超家族的外显子长度与记录的一致拟南芥和葡萄33].MYB结构域有限的外显子长度解释了植物界MYB结构域在物种进化过程中的高度保守性。我们的研究结果表明,MYB结构域的内含子可能通过未知的机制在MYB基因家族的进化中发挥重要作用。
值得注意的是,在内含子位置、长度和相位方面,本研究揭示的大豆基因结构与大豆的系统发育亚家族一致拟南芥蒋等人定义的大米[32].这一发现为植物MYB基因之间的进化关系提供了进一步的线索。
大豆R2R3-MYB基因的染色体分布和复制事件
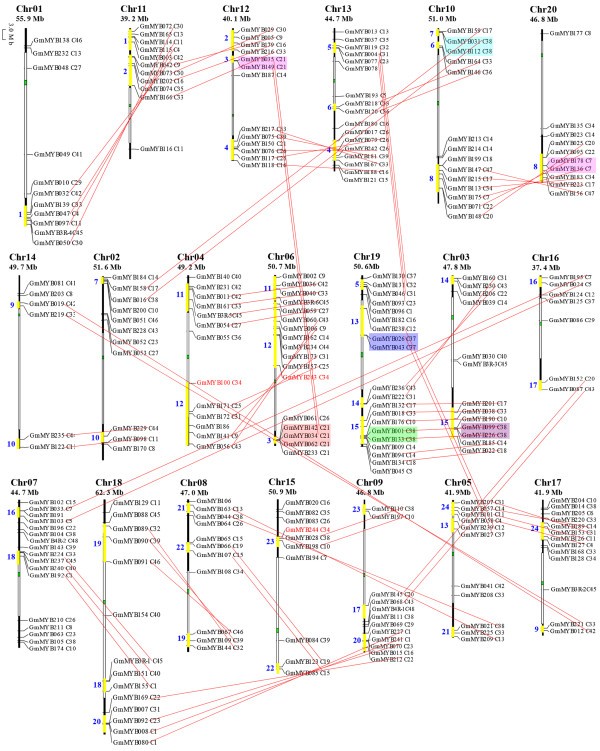
为了确定MYB的基因组分布,我们使用每个大豆MYB基因和BLASTN的DNA序列搜索大豆基因组数据库。基因组染色体定位分析表明,大豆myb几乎分布在所有染色体上。虽然20个大豆染色体中每一个都含有myb,但其分布似乎是不均匀的4).14号染色体上共有6个gmmyb;16号染色体上有7个;染色体1、5、9、15和20上各有10个;染色体2、3、8、11和17上各有11个;4号染色体和18号染色体各有12个;12号染色体上有13个;染色体10上有14个;6号染色体和7号染色体各有15个;染色体13上有16个; and 19 on chromosome 19. The gene density per chromosome was uneven, ranging from 0.3% to 0.7%, with the highest density observed on chromosome 19 and lowest density on chromosome 14 (Figure4).平均每2.5 Mb出现一个R2R3-MYB基因。在一些染色体区域,包括染色体3、4、5、6、7、8、10、12、13、18和19的顶部和底部,myb的密度较高;染色体1、9和20的顶端;2号,11号,14号,15号,16号,17号染色体的底部。相比之下,几乎所有的中心染色体区域都缺乏myb,包括着丝粒和周围染色体区域(图4).
大豆MYB基因的染色体定位、区域复制和预测聚类。在JGI大豆基因组7.0版本的基础上,对大豆MYB基因的染色体位置进行了定位。染色体的编号在每条染色体的上方标明。其规模以兆(Mb)为单位。染色体名称下面的数字表示长度。每个基因的系统发育分类(图2)由子组号表示。每一对复制的MYB基因都用一条红线连接。连接线标记的具体情况下,复制的基因组区域和存在的MYB基因与密切相关的预测氨基酸序列有很强的相关性。彩色框表示染色体上的同基因和同基因的基因簇组。染色体上的黄色条和条旁的蓝色数字表示24个预测复制区域。染色体上的绿色条和白色条分别表示着丝粒和周围粒。
基因复制在植物进化过程中一直被认为是存在的,因此有助于建立新的基因功能,并奠定了进化新颖性的基础[47,48].多基因家族的起源被认为是由区域特异性复制或全基因组多倍化引起的基因复制。这一机制已被证实是植物基因组进化的一个显著特征。为了检测gmmyb和基因组复制之间的潜在关系,我们鉴定了大约92对gmmyb,它们在相同的子分支中高度相似,通过它们的蛋白质序列具有高度的一致性。例如,GmMYB005和GmMYB042的整个蛋白质序列相似性为92%,而GmMYB058和GmMYB127的蛋白质序列相似性为94%4,以红线连结)。这些基因约占大豆myb的75%(244个中的184个),这支持了它们由假定的大豆基因组复制事件进化而来的假设。此外,多对染色体连接了至少24个潜在的染色体/片段重复(图4例如1号染色体和11号染色体的大片段。大约1300万年前,大豆发生了一次基因组复制事件,导致了高度复制的基因组[31].与此相一致的是,我们的研究结果显示,许多预测的gmmyb在相关染色体的共纤区有平行的对应物(图4这表明片段复制是大豆基因扩增的主要驱动因素。
在本研究中,在大豆基因组中也观察到染色体内复制。一系列的串联基因复制也有助于增加R2R3-MYB家族基因的数量,这可以从单个集群中一些密切相关的gmmyb在一个特定染色体上的物理位置上彼此靠近而没有插入注释基因的事实得到证明:例如,位于染色体3底部的GmMYB099/GmMYB226,位于染色体10顶部的GmMYB031/GmMYB112,以及位于染色体19顶部的GmMYB026/GmMYB0434,用彩色方框标出)。总共约5%(244个gmmyb中的13个)涉及串联复制。一般来说,大豆的串联重复涉及到重复的myb编码基因,除了一个三重重复(图46号染色体;GmMYB034 / GmMYB062 GmMYB142)。此外,GmMYB100、GmMYB243和GmMYB244三个特定基因只包含dna结合域(没有c端区域),提示这些基因可能丧失功能。GmMYB100和GmMYB243的氨基酸序列完全相同;它们对应的cDNA和DNA序列也非常相似(分别为99.7%和99.5%),除了在c端区域有一些不连续的突变。GmMYB244的氨基酸序列与GmMYB100和GmMYB243高度相似,只是在c端区域出现了单位点突变。它们的高度相似性表明这三个基因产生于最近的一个复制事件,从而为基因复制对大豆MYB基因扩增做出了重要贡献提供了强有力的证据。
不同的myb很可能是在复制其dna结合域后进化而来,随后在ORF(特别是在c端区域)中发生一系列同义和/或非同义突变,从而在进化过程中产生新的功能。我们的研究结果表明,全基因组复制、片段复制和串联基因复制都促进了大豆R2R3-MYB基因的扩增。串联复制的数量远远少于基因组和/或片段复制的数量,因此后者可能是大豆MYB基因扩增的主要原因。
MYB域外的保守主题
有趣的是,植物MYB结构域的相对空间位置是可变的,可能在蛋白质的n端、中间或c端区域。在典型的R2R3-MYB蛋白中,MYB结构域通常位于靠近n端区域,而MYB结构域之前的极短区域在不同亚族之间的保守性似乎较差。因此,在整个植物MYB基因家族的这些区域没有检测到基序。相比之下,MYB结构域外的c端区域通常包含许多特定的、功能重要的结构域或基序,涉及转录活性和蛋白质-蛋白质相互作用。具有相同基序的亚家族中的蛋白质很可能具有相似的功能。
利用模因(MEME),我们在每组大豆MYB蛋白中寻找保守的基序。一个子族的大多数成员在MYB域之外共享一个或多个基序,这为子族的定义提供了进一步的支持。我们在c端区域共鉴定出50个保守基序(表2),大小由18至250个氨基酸不等;其中一些子家族特异性基序以前被定性为定义额外的功能属性[4].有趣的是,除了基序1,它直接跟随R3重复序列,并且在一些亚家族(C8, C9和C11;数字2c和额外的文件3),大多数基序选择性地分布在系统发育树中的特定分支中。我们的研究结果表明,蛋白质结构在一个特定的亚家族中是非常保守的。
MYB家族个体成员的蛋白基序方案揭示了亚家族内蛋白质的结构相似性(图2一个和额外的文件3).虽然这些保守基序中的大部分功能尚未被鉴定,但其中一些很可能在靶基因的转录调控中发挥重要作用。例如基序7和基序8,它们在亚科C9的成员中是保守的2c),在atmyb中被表征为C2阻遏子基序和锌指。这组成员拥有C1和C2基序,已知分别参与bHLH相互作用和启动子抑制。在本研究中,我们鉴定了三种同源gmmyb,它们在c端区域包含相同的保守基序,这些基序已被证明具有抑制域的功能。这些同源myb很可能在大豆中也起抑制因子的作用。
在拟南芥,三个非典型MYB基因(AtMYBCDC5, AtMYB3R-like和AtMYB4R1)编码有两个或两个以上重复序列的MYB蛋白,与典型的R2R3-MYB蛋白有较远的亲缘关系[4,27,42].AtMYBCDC5包含一个MYB结构域,由两个重复序列组成,与典型的r2r3型MYB结构域同源性非常低(约31%的同源性),以及一个非常长的c端区域(比典型的r2r3型MYB基因长3倍多)。在大豆中,我们观察到两个基因(GmMYB147和GmMYB156)与AtMYBCDC5 (额外的文件3;亚科C47)。值得注意的是,尽管编码区长度和MYB结构域外的内含子模式不同,但MYB结构域内的内含子相位和剪接位点几乎相同(图2b).使用这三种非典型MYB蛋白的氨基酸序列进行模因搜索,发现了三个意外的大型保守基序(额外的文件3;基序48,49和50)在该亚科的c端区。这一发现可能有助于识别这些类型的myb的功能特征。然而,它们的生物学功能仍有待阐明。我们还观察到AtMYB4R1的两个同源基因,AtMYB4R1被认为是含有4个r1r2样重复序列的MYB蛋白(额外的文件3;亚科C48)。虽然MYB结构域之前的区域可能比典型的MYB基因的区域长,但在这个亚家族中它似乎并不保守。在N端和c端未检测到子家族特异性的保守基序。在大豆基因组中未发现同源atmyb3r样基因;这可能反映了大豆基因组进化过程中的基因丢失。
R2R3-MYB基因在大豆和大豆中的表达谱拟南芥
转录因子基因在所有真核生物基因组中占有相当大的比例。根据转录因子基因编码的dna结合域的类型,大多数转录因子基因可以被分为几个不同的,通常是大的家族。功能冗余在这些家庭中并不罕见;因此,一个特定转录因子基因的正确表征通常需要在整个家族的背景下进行研究。通过蛋白质-蛋白质相互作用形成复杂的网络,同时在转录水平上,转录因子控制着基因组的表达。因此,如果不考虑它们在全基因组范围内的活动,最终就无法理解它们的功能。以前已经注意到,许多转录因子基因家族在不同的真核生物中表现出巨大的丰度差异,有些家族是谱系特异性的。
最近开发的基于RNA-Seq的工具,包括跨多个组织和器官的基因表达数据,允许对大豆的基因转录组进行表征和比较。30.].因此,在所有244个gmmyb的RNA-Seq Atlas数据集中,可以很容易地识别出不同的转录本丰度模式。基因表达谱可以为基因功能的研究提供重要线索。因此,我们获得了每个分支的表达信息,并将大豆MYB转录因子亚家族的表达谱与其进行了比较拟南芥利用SoySeq和AtGenExpress数据对根、叶、花和种子组织进行分析。我们随后根据系统发育树总结了这些表达谱(图2d和额外的文件3).为了评估myb在豆科植物特异性过程中的潜在作用,我们还研究了大豆R2R3-MYB基因家族在结瘤过程中的表达。
根据RNA-Seq图谱分析,与编码转录因子的基因一样,许多gmmyb表现出较低的转录丰度水平。整合两个数据集后,我们观察到大多数基因的表达谱非常宽。然而,5个atmyb和32个gmmyb(13%)缺乏表达信息,这可能表明这些是假基因或仅在特定发育阶段或特殊条件下表达。接下来,我们检查了来自第二个大豆转录组图谱的数据[49],是大豆多种组织的完整转录组图谱。结果表明,所有32个gmmyb在大豆组织中都有高置信度的预测(数据未显示),这表明这些基因在高度限制性条件下表达。
我们观察到R2R3-MYB基因转录本的积累与不同的组织相关,每个R2R3-MYB基因成员的表达模式不同(图2d和额外的文件3).在大豆中,只有少数(244个中的23个;9%)所分析的myb在所有四种测试组织中都有组成性表达,这表明gmmyb在多个发育阶段发挥调节作用。相比之下,大多数gmmyb表现出优先表达。RNA-Seq Atlas数据显示,大多数(244例中的157例;64%)的gmmyb的转录物丰度谱仅在单个组织中有显著的峰值。这一结果表明,这些R2R3-MYB蛋白作为植物特异性的调节因子,并仅限于离散的细胞、器官或条件。这244个gmmyb中约有99个(41%)在花组织中表现出最高的转录本积累水平,82个(34%)在根组织中表现出最高的转录本积累水平,41个(17%)在叶组织中表现出最高的转录本积累水平,60个(25%)在种子组织中表现出最高的转录本积累水平(一些基因在两个以上的组织中表现出相同的转录本积累水平)。这些基因的广泛表达表明大豆和大豆中的myb拟南芥在特定条件下参与所有器官或组织的发育。
虽然myb的表达模式在大豆和大豆之间有所不同拟南芥,我们还观察到保守表达谱。除了表现出相似的转录物丰度谱但在系统发育上相对不同的基因组外,几个系统发育分支在很大程度上共享相同的转录物丰度谱。例如,在C1亚家族中,大部分atmyb和gmmyb在花组织中表达,这表明它们在花发育中具有保守的功能。C20亚家族成员在大豆和大豆中的表达拟南芥在根组织中可以检测到,这表明它们在根形成中起着保守的作用。C23亚家族成员在花和种子发育过程中表现出相似的表达模式,这支持了这些基因在大豆和种子发育过程中发挥作用的假说拟南芥分化(图2d和额外的文件3).相比之下,具有高度序列相似性和共享表达谱的gmmyb是评价大豆基因功能的良好候选基因。在这些分支中,突出的是那些包括与苯丙类代谢调节相关的myb(亚家族C20)。
转录因子不仅参与植物防御系统的激活,而且在控制植物根系与土壤微生物之间的相互作用中起着关键作用。例如,结瘤涉及根与土壤细菌的相互作用,导致共生固氮,这主要局限于豆科植物。第一个被证明与结瘤有关的转录因子是Lotus对虾NIN基因(50,51].随后,Medicago truncatula通过筛选快中子和Tnt1转座子标记的诱变群体来表征linjnin的同源物[52,53].其他对结瘤过程至关重要的转录因子已经被发现,包括肝内的GRAS家族蛋白M.truncatula而且l .对虾[54,55, bZIP转录因子在L.japonicus[56, AP2-EREBP转录因子MtERN在M.truncatula[57- - - - - -59),L.japonicus[60的干旱转录因子LjSIP1l .对虾[61,62].在本研究中,我们观察到244种gmmyb中的64种在豆科植物特异性结瘤过程中表现出转录本积累,其中39种(16%)在该组织中表现出最高表达水平(图)2d和额外的文件1).然而,只有三个表达结节的基因(GmMYB201GmMYB034而且GmMYB035)可能是结节特异性的,因为在其他组织中没有检测到转录本积累。此外,GmMYB201已被证明是结节特异性的,最近[63].这些结果表明,MYB转录因子可能在豆科植物特异性结瘤的调控中起着重要作用。有趣的是,豆科植物的特殊之处是什么,比如共生固氮的特性,以及这些特性在豆科植物中是如何进化的。然而,植物中转录因子基因在不同转录因子家族中的分布没有显著差异,这表明植物的种特异性性状可能依赖于转录因子基因的表达模式及其功能。有趣的是,在我们对拟南芥在大豆基因组中,这三种结瘤特异性表达的gmmyb均不存在同源性拟南芥这表明它们可能是大豆和大豆分化后的新功能化拟南芥。这些结果表明,MYB基因可能在豆科植物结节的进化发展中起重要作用。尽管许多gmmyb在结瘤过程中表现出较高的转录本积累,但由于该过程中缺乏相应的同源物,这意味着gmmyb在豆科植物特异性结瘤过程中的功能特征仍有待阐明。
鉴于大豆MYB基因家族如此之大,一个关键问题是,不同的谬误是否显示出类似的表达模式,提示功能冗余。如图所示2而且额外的文件3研究发现,大豆中绝大多数对副基因具有相似的表达模式和表达水平,因而表现出功能冗余。与此相反,其余的对表现出显著的表达差异,这支持了复序句在重复后表达差异显著的观点。然而,正交镜通常表现出相似的表达模式。总的来说,这些基因在广泛组织中的表达表明大豆和大豆中的myb拟南芥在特定条件下参与所有器官或组织的发育,如豆科植物特异性结瘤。此外,myb的表达拟南芥或者大豆支持跨植物物种的基因同源功能的守恒。同源基因表达模式的差异可能表明功能上的差异。然而,myb的功能似乎在植物物种中高度保守,但不是绝对的。虽然大多数gmmyb的功能尚不清楚,但我们的系统发育和表达分析为未来大豆和大豆的功能研究提供了坚实的基础拟南芥.
大豆R2R3-MYB转录因子的推测功能
系统发育分析允许确认假定的同源和副同源myb。前人认为,同源基因通常具有相似的功能,并且聚集在同一个演化支和子演化支中,而同源基因通常表现出不同的功能,这表明密切相关的myb可以识别相似的靶基因,可能具有功能冗余。因此,同源和同源基因的分析是比较基因组学的必要条件。
目前,对植物myb最广泛的注释评价来自于拟南芥.为了更新也可能存在于大豆亚科的功能分支,我们构建了一个系统发育树,以确定来自不同物种的同源MYB家族,基于R2R3-MYB基因的良好特征拟南芥和其他一些植物(图2一个和额外的文件3).在每个亚家族中,我们识别了特定的同源和同源基因簇,这有助于每个亚家族的特征描述。例如,C1亚家族包括4个atmyb (AtMYB75, AtMYB90, AtMYB113和AtMYB114), 10个来自其他植物物种的myb (PhAn2;NtAn2;LeAn1;MdMYB10;VvMYBA1 VvMYBA2;PyMYB10;ROSEA1;GhMYB10; and IbMYB1), and seven GmMYBs (Figure2a).这些包括在c端区域包含基序2的基因成员,可能具有一致的内含子模式。尽管该亚家族中gmmyb的功能尚不清楚,但已知其余基因参与花青素的生物合成。因此,我们有理由假设gmmyb也可能在花青素生物合成途径中发挥作用。亚科C10包含7个gmmyb, 3个atmyb (AtMYB11, AtMYB12和At MYB111)和5个来自其他植物物种的myb (y1;P1;P2;VvMYBF1;和SlMYB12。除了gmmyb基因外,其他基因众所周知在黄酮醇生物合成的调控中发挥着至关重要的作用2) (16].因此,该亚群中的gmmyb可能在黄酮醇生物合成途径中发挥重要作用。其他植物的myb (atmybb2、AtMYB62、AtMYB78、AtMYB108、AtMYB112和AtMYB116;已知TaPIMP1)参与与防御相关的通路,如干旱、盐和病原体反应[44].亚家族C39基因参与ga诱导的反应(AtMYB33, AtMYB65, AtMYB81和AtMYB101;LtGAMYB;HvGAMYB;和OsGAMYB),而亚家族C40基因(AtMYB91;AmPHAN;LePHAN;ZmPHAN;和WRS2),包括4个大豆同源基因,被认为参与粗鞘发育(图2一个和额外的文件3).同样,亚家族C42中的8个与4个atmyb同源的gmmyb (AtMYB44, AtMYB70, AtMYB73和AtMYB77)表明对非生物胁迫有响应[42].
一般来说,大多数植物myb是转录的正调控因子。例如,AtMYB12通过上调查尔酮合成酶(CHS)、黄酮3-羟化酶(F3H)、黄酮醇合酶(FLS的)和查尔酮黄酮异构酶(气[15])。玉米中的C1 [12],其正交物PcMYB1在Petroselinum crispum[64和AtMYB111拟南芥[16],通过控制黄酮的表达,正向调节黄酮的生物合成CHS.基因表达的转录调控不仅受激活因子的调控,也受抑制因子的调控。既往研究表明,一些MYB基因具有转录抑制因子或弱激活因子的作用。例如,在拟南芥, AtMYB4通过抑制关键酶肉桂酸-4-羟化酶(C4H[19])。同样,AtMYB32抑制COMT的基因拟南芥[65],而草莓FaMYB1转录因子抑制烟草中花青素和黄酮醇的积累[66].进一步的研究表明,这些myb的c端区域往往具有抑制基序。例如,C2基序阻遏子分支在c端具有保守的C2基序(pdLNLD/ELxiG/S),已知与转录抑制有关。本研究发现三个gmmyb (GmMYB002、GmMYB005和GmMYB042)在其c端区域具有相同的抑制基序。这些基因被归为C9亚家族,这表明它们可能起抑制因子的作用。
转录因子之间的组合相互作用是调控真核基因表达的关键。bHLH-MYB-WD40配合物对类黄酮生物合成途径的组合调控是很明显的。这些相互作用既可以调节转录因子活性,也可以促进具有非常相似dna相互作用基序的因子的生物学特异性。据报道,在玉米中,MYB蛋白C1/Pl依赖于与R/B (bHLH蛋白)的相互作用,以实现其在花青素生物合成中的调节功能[12].在拟南芥TT2、TT8和TTG1(分别编码MYB、bHLH和WDR蛋白)调控几个类黄酮结构基因的表达[67,68].控制苯丙烷生物合成的类似调控因子已从其他物种中分离出来[69,70].进一步的研究发现,在植物细胞中与R相互作用时,C1 R3重复序列的第1螺旋上的4个残基(所有4个残基必须都存在)和第2螺旋上的2个残基是必需的[71].有趣的是,在目前的研究中,我们观察到多达10种gmmyb在同一位置有所有6种残基。虽然这些基因聚集在MYB亚家族(C4和C6)的不同分支中,并且似乎具有不同的靶基因,但我们认为这些基因具有组合调控机制来调控大豆靶基因的表达。
3R-MYB基因主要存在于脊椎动物中;然而,这个三重复MYB基因家族的成员也在一些植物系系中被检测到,包括拟南芥葡萄,杨树trichocarpa[26,72,73].事实上,这些物种中只有5个同源基因存在,这表明植物3R-MYB基因的数量是严格限制的。有趣的是,我们检测到6个3R-MYB拟南芥这表明大豆的3r - myb基因可能正在扩增(额外的文件3,亚C45)。我们的研究结果表明,3R-MYB基因代表了一个古老的进化保守的植物基因家族。此外,与R2R3-MYB蛋白的功能多样性相比,3r - myb蛋白似乎履行了许多进化上保守的核心细胞功能[72- - - - - -74].因此,假设大豆3r - myb可能具有相同的功能是可信的。
结论
MYB基因广泛分布于高等植物中,是植物界最大的转录因子群之一。然而,大多数植物MYB基因的具体作用尚不清楚。在本研究中,我们试图通过鉴定大豆GmMYB基因可能的完整补体,阐明大豆MYB基因的结构特征、系统发育关系、染色体位置、保守基序和表达模式及其功能多样性。我们对候选大豆MYB基因进行了广泛的分析,并将其与其他品种进行了比较拟南芥.
我们把大豆和拟南芥根据它们的系统发育关系,myb被分为48个亚科,这些亚科由额外的保守蛋白基序和内含子/外显子结构支持。我们的系统发育分析结果与前人的研究结果一致[29,32,33].大部分亚科成员来自大豆和拟南芥,这表明在一个特定亚科的成员具有共同的进化起源,大多数MYB基因的功能在被子植物进化过程中是保守的。缺乏拟南芥或者,某些分支中的大豆家族成员表明,两个物种之间的多样化可能促进了谱系特异性表型的创新。对内含子/外显子结构的分析表明,大多数内含子的剪接位点、长度和相位在MYB结构域中高度保守,尤其是在同一亚家族中的内含子。因此,在进化过程中,MYB结构域最初可能是紧凑和保守的。染色体分布、系统发育分析和同源性分析表明,在整个大豆基因组中存在基因组复制事件。基因扩增以基因对或基因簇的形式进行观察。因此,基因组复制事件可能导致了MYB基因家族扩张过程中的基因多样化和冗余。计算搜索用于识别存在于不同亚族中的保守c端基序。我们观察到,大多数主题似乎是不同亚科的特定特征。
此外,还对大豆和大豆中myb的表达谱进行了比较分析拟南芥揭示了myb可能在不同的植物生物学过程中发挥保守而多样的作用,显示出功能上的差异,部分myb可能参与了大豆种子发育和豆科特异性结瘤。综合来看,大量的表达数据,以及可用的atmyb功能数据,支持了gmmyb在不同发育阶段的不同组织中执行各种功能的假设。尽管大多数植物MYB的功能仍然未知,需要许多实验来确定它们的精确功能,我们对大豆和大豆MYB基因家族的系统发育和表达分析拟南芥为未来gmmyb的综合功能分析奠定了坚实的基础。
方法
大豆和大豆MYB蛋白的数据库检索拟南芥
126人的基因识别码拟南芥R2R3-和R1R2R3-MYB基因从strack等人(2001)获得。从拟南芥信息资源(The Arabidopsis Information Resource, TAIR;http://www.Arabidopsis.org/).利用联合基因组研究所(JGI)提供的BLASTN和BLASTP对大豆MYB蛋白进行了初步的搜索。大豆版本7.0网站(http://www.phytozome.net/cgi-bin/gbrowse/soybean/).为了确认获得的氨基酸序列,使用SMART工具的隐马尔可夫模型(http://smart.embl-heidelberg.de/[75])和ExPASy蛋白质组学服务器(http://expasy.org/prosite/[76])。所有的大豆MYB蛋白都被人工检测,以确保假定的基因模型包含2到3个MYB dna结合域,并且基因模型在各自基因组中定位到独特的位点。我们从数据集中丢弃了具有不同识别码和相同染色体位点的冗余序列。
在JGI大豆基因组数据库(使用大豆MYB基因的预测蛋白)中BLASTP搜索结果的基础上,我们获得了cDNA序列、基因组序列、内含子分布模式、相以及内含子/外显子边界等信息。用JGI大豆浏览器(http://www.phytozome.net/cgi-bin/gbrowse/soybean/).从JGI中的BLASTP搜索结果大豆基因组浏览器2.16版本,我们获得了染色体位置的信息。
多序列比对
使用Multalin工具(http://prodestoulouse.inra.fr/multalin/[77])使用默认参数,我们对获得的MYB结构域序列进行多次序列比对。我们手动调整了MYB motif中相应氨基酸的位置,并使用BioEdit版本7.0.0软件(匹兹堡超级计算中心;http://www.psc.edu/biomed/genedoc/[78])。我们使用ClustalX (http://www-igbmc.u-strasbg.fr/BioInfo/[79)作为校准序列和重新检查结果的辅助方法。为了对齐与MYB成员相同的基序,我们使用BioEdit手动调整对齐。
使用Hyphy 2.0版本对GmMYB蛋白的MYB结构域进行对齐计算核苷酸取代水平[80]以及相应的新泽西系统发育树(额外的文件6).HyPhy批处理文件NucModelCompare。bf with a model rejection level of 0.0002 was used to establish the best-fitting of 203 general time reversible models of nucleotide substitution [80].HyPhy批量快速选择的版本。bf was used to estimate site-by-site variation in rates.
比较大豆和大豆的进化关系拟南芥myb, gmmyb和atmyb的域与ClustalX一致。
蛋白质主题识别
为了更详细地研究蛋白质基序,我们使用MEME 3.5.7版本的工具来识别MYB蛋白之间共享的保守基序[81].使用了以下参数设置:motif的分布,每个序列为0或1;最多可找到50个图案;基序最小宽度,六;基序的最大宽度250(用于识别长R2R3结构域);母题必须存在于同一亚科的所有成员中。其他选项使用默认值。只保留e值<1e-20的基元作进一步分析。随后,使用MAST程序在蛋白质数据库中搜索检测到的基序[82].
系统发育分析
探讨大豆与植物的进化关系拟南芥myb,我们从对齐的大豆和构建了NJ树拟南芥MYB域使用MEGA 4.0 (http://www.megasoftware.net/index.html;[83]),使用以下参数:泊松校正、成对删除和1000次重复的自举分析。根据以往的研究结果[1,32,我们认为AtCDC5基因(包含一个非典型R2R3结构域)是R2R3- myb蛋白,并将其纳入我们的系统发育分析中,以确定其同源物是否存在于大豆基因组中。我们还包括4R-MYB蛋白(它包含两个相邻的重复R1R2结构域)和3R-MYB蛋白(它包含一个典型的大豆和R1R2R3结构域)拟南芥).为了验证用NJ方法得到的结果,我们使用MEGA 4.0对1000个重复进行MP分析和自举分析。
在本研究中,为了识别同源基因,我们定义了同向块,包括不同染色体和/或基因组之间的基因含量、顺序和方向的守恒。之间的跨基因组同步关系拟南芥用植物基因组复制(PGDD,http://chibba.agtec.uga.edu/duplication/[84]),加上这两个物种的现有全基因组序列。
atmyb和gmmyb的表达分析
我们使用了Soyseq (http://soybase.org/soyseq/[30.])及AtGenExpress (http://www.weigelworld.org/resources/microarray/AtGenExpress[85)数据库检测gmmyb和atmyb的表达模式。从四个器官已发表的表达值中选取最高值。
参考文献
Riechmann JL, Heard J, Martin G, Reuber L, Jiang C, Keddie J, Adam L, Pineda O, Ratcliffe OJ, Samaha RR, Creelman R, Pilgrim M, Broun P, Zhang JZ, Ghandehari D, Sherman BK, Yu G:拟南芥转录因子:真核生物全基因组比较分析。科学学报,2000,29(3):359 - 359。10.1126 / science.290.5499.2105。
Amoutzias GD, Veron AS, Weiner J, Robinson-Rechavi M, Bornberg-Bauer E, Oliver SG, Robertson DL: 10亿年的bZIP转录因子进化:二聚化和dna结合位点特异性的保守和变化。中华分子生物学及免疫学杂志,2007,24:827-835。
嘴唇病JS: 10亿年的Myb。癌基因研究。1996,13:223-235。
Stracke R, Werber M, Weisshaar B:拟南芥R2R3-MYB基因家族。植物生态学报,2001,14(4):447-456。
Ogata K, Morikawa S, Nakamura H, Hojo H, Yoshimura S, Zhang R, Aimoto S, Ametani Y, Hirata Z, Sarai A, Ishii S, Nishimura Y: c-Myb dna结合域的游离和dna复合形式的比较。中国生物医学工程学报,2003,21(2):369 - 371。10.1038 / nsb0495 - 309。
Kranz HD, Denekamp M, Greco R, Jin H, Leyva A, Meissner RC, Petroni K, Urzainqui A, Bevan M, Martin C, Smeekens S, Tonelli C, Paz-Ares J, Weisshaar B:拟南芥R2R3-MYB基因家族成员的功能特性研究植物学报,1998,16(3):366 - 366。10.1046 / j.1365 - 313 x.1998.00278.x。
Jin H, Martin C:植物myb基因家族的多功能性和多样性。植物生物学杂志,1999,41:577-585。10.1023 /: 1006319732410。
Klempnauer KH, Gonda TJ, Bishop JM:逆转录病毒白血病基因v-myb及其细胞前体c-myb的核苷酸序列:转导癌基因的结构。细胞学报,1982,31:453-463。10.1016 / 0092 - 8674(82) 90138 - 6。
杨建军,张建军,张建军,等。植物MYB转录因子的研究进展。科学通报,1997,13:67-73。10.1016 / s0168 - 9525(96) 10049 - 4。
Rosinski JA, Atchley WR:转录因子Myb家族的分子进化:多系起源的证据。中华分子生物学杂志,1998,46:74-83。10.1007 / PL00006285。
Weston K: Myb蛋白在生命、死亡和分化中的作用。中华检验医学杂志,1998,8:76-81。10.1016 / s0959 - 437 x(98) 80065 - 8。
Paz-Ares J, Ghosal D, Wienand U, Peterson PA, Saedler H:玉米的调控c1位点编码一种蛋白质,与myb原癌基因产物同源,与转录激活子结构相似。中国科学(d辑:自然科学版)。
Goicoechea M、Lacombe E、Legay S、Mihaljevic S、Rech P、Jauneau A、Lapierre C、Pollet B、Verhaegen D、Chaubet-Gigot N、Grima-Pettenati J: EgMYB2是桉树木质部一种新的转录激活因子,可调节次生细胞壁形成和木质素生物合成。植物学报,2005,43:553-567。10.1111 / j.1365 - 313 x.2005.02480.x。
Mehrtens F, Kranz H, Bednarek P, Weisshaar B:拟南芥转录因子MYB12是一种黄酮醇特异性苯丙类生物合成调控因子。植物生理学报,2005,38(4):394 - 394。10.1104 / pp.104.058032。
杨丽娟,王晓燕,王晓燕,等。白云杉R2R3-MYB转录因子在木成组织中的表达及序列分析。植物生物学杂志,2007,7:17-10.1186/1471-2229-7-17。
strke R、Ishihara H、Huep G、Barsch A、Mehrtens F、Niehaus K、Weisshaar B:密切相关的r2p3 - myb转录因子差异调控拟南芥幼苗不同部位黄酮醇积累植物学报,2007,30(5):366 - 366。10.1111 / j.1365 - 313 x.2007.03078.x。
Gocal GF、Poole AT、Gubler F、Watts RJ、Blundell C、King RW:长日GAMYB基因在Lolium temulentum花序形成过程中的上调植物生理学报,2004,24(3):379 - 379。10.1104 / pp.119.4.1271。
Abe H, Urao T, Ito T, Seki M, Shinozaki K, Yamaguchi-Shinozaki K:拟南芥AtMYC2 (bHLH)和AtMYB2 (MYB)在aba信号通路中起转录激活作用。植物学报,2003,15:63-78。10.1105 / tpc.006130。
Jin H, Cominelli E, Bailey P, Parr A, Mehrtens F, Jones J, Tonelli C, Weisshaar B, Martin C: AtMYB4转录抑制控制拟南芥抗紫外线防晒霜的产生。中华医学杂志,2000,19:6150-6161。10.1093 / emboj / 19.22.6150。
Hartmann U, Sagasser M, Mehrtens F, strackr, Weisshaar B:由R2R3-MYB, BZIP和BHLH因子识别的顺式作用元件的微分组合相互作用控制了苯丙类生物合成基因的光响应和组织特异性激活。植物生物学杂志,2004,25(3):356 - 356。10.1007 / s11103 - 004 - 6910 - 0。
Jung C, Seo JS, Han SW, Koo YJ, Kim CH, Song SI, Nahm BH, Choi YD, Cheong JJ:在转基因拟南芥中,过表达AtMYB44增强气孔关闭能力,获得非生物胁迫的耐受力。植物生理学报,2008,26(4):369 - 369。
李顺生,李文华,刘文华,等。拟南芥AtMYB103基因在绒毡层和毛状体发育中的调控作用。植物学报,2003,34(4):379 - 379。10.1046 / j.1365 - 313 x.2003.01791.x。
Perez-Rodriguez M, Jaffe FW, Butelli E, Glover BJ, Martin C:三种不同细胞类型的发育与反rrhinum majus花腹花瓣中一个特定的MYB转录因子的活性有关。科学进展,2005,32:359-370。10.1242 / dev.01584。
鲍曼K, Perez-Rodriguez M, Bradley D, Venail J, Bailey P, Jin H, Koes R, Roberts K, Martin C: R2R3 MYB转录因子对细胞和花瓣形态发生的控制。发展,2007,134:1691-1701。10.1242 / dev.02836。
Tominaga R, Iwata M, Okada K, Wada T:拟南芥表皮特异性MYB基因CAPRICE和wolf的功能分析。植物学报,2007,29(4):366 - 366。10.1105 / tpc.106.045732。
Kranz H, Scholz K, Weisshaar B:编码三种MYB重复序列的c-MYB癌基因样基因在所有主要植物谱系中都存在。植物学报,2000,29(4):371 - 371。10.1046 / j.1365 - 313 x.2000.00666.x。
闫辉C,肖远Y, H坤,美华L,吉刚L,赵峰G,志强L,云飞Z,肖晓W,晓明Q,云平S,李Z,晓晖D,京初L,邢旺D,张亮C,洪亚G,李佳Q:拟南芥MYB转录因子超家族:与水稻MYB家族的表达分析及系统发育比较。植物生物学杂志,2006,30(4):447 - 447。10.1007 / s11103 - 005 - 2910 - y。
Durbarry A, Vizir I, Twell D:拟南芥雄性生殖系发育:双花粉突变体揭示生殖细胞周期进程的配子体调节因子。植物生理学报,2005,37(4):378 - 378。10.1104 / pp.104.053165。
Wilkins O, Nahal H, Foong J, Provart NJ, Campbell MM:杨树R2R3-MYB转录因子家族的扩展和多样化。植物生理学报,2009,29(4):369 - 369。
Severin AJ, Woody JL, Bolon YT, Joseph B, Diers BW, Farmer AD, Muehlbauer GJ, Nelson RT, Grant D, Specht JE, Graham MA, Cannon SB, May GD, Vance CP, Shoemaker RC: Glycine max的RNA-Seq图谱:大豆转录组指南。植物生物学杂志,2010,10:160-10.1186/1471-2229-10-160。
污物J,大炮某人,马Schlueter J, J, Mitros T,纳尔逊W,海顿耐DL,歌Q, JJ,泰伦程J,徐D, Hellsten U, GD,于Y,樱井T, Umezawa T, Bhattacharyya可,Sandhu D, Valliyodan B,林奎斯特E,皮托,格兰特D,蜀年代,古德斯坦D,巴里·K Futrell-Griggs M B,阿伯纳西Du J,田Z,朱L,吉尔N, Joshi T, Libault M, Sethuraman,张XC, Shinozaki K,阮HT,翅膀RA, Cregan P, Specht J, Grimwood J, Rokhsar D,斯泰西G,鞋匠RC,杰克逊山:古多倍体大豆基因组序列。自然学报,2010,463:178-183。10.1038 / nature08670。
蒋晨,顾旭,Peterson T:拟南芥和水稻Myb基因家族保守基因结构和羧基末端基序的鉴定。籼稻。中国生物学报,2004,5:R46-10.1186/gb-2004-5-7-r46。
Matus JT, aqua F, Arce-Johnson P:对葡萄MYB R2R3亚家族的分析揭示了葡萄和拟南芥基因组中与葡萄酒品质相关的扩展分支和保守的基因结构组织。植物生物学杂志,2008,8:83-98。10.1186 / 1471-2229-8-83。
Brett D, Pospisil H, Valcarcel J, Reich J, Bork P:选择性剪接和基因组复杂性。中国科学院学报,2002,30:29-30。10.1038 / ng803。
Richard H, Schulz M, Sultan M, Nurnberger A, Schrinner S, Balzereit D, Dagand E, Rasche A, Lehrach H, Vingron M, Haas SA, Yaspo ML: RNA-Seq实验中从外显子表达水平预测备选异构体。核酸学报,2010,38 (No): 10 e112-
菊池,Satoh K,经营T, Kawagashira N, Doi K,岸本N, Yazaki J,石川M,山田H, Ooka H, Hotta我,小岛K,只T, Ohneda E, Yahagi W,铃木K,李CJ, Ohtsuki K, Shishiki T, Otomo Y,村上K, Iida Y, Sugano年代》T,铃木Y, Y Tsunoda Kurosaki T, T Kodama Masuda H,小林M,谢问,陆M, Narikawa R, Sugiyama,美津浓K, Yokomizo年代,Niikura J, Ikeda R, Ishibiki J,川俣町M, Yoshimura,三浦J, Kusumegi T,奥卡河,Ryu R,建筑师,松原K, Otomo Y,村上K, Iida Y, Sugano年代》T,铃木Y, Y Tsunoda Kurosaki T, T Kodama Masuda H,小林M,谢问,陆M, Narikawa R, Sugiyama,美津浓K, Yokomizo年代,Niikura J, Ikeda R, Ishibiki J,川俣町M, Yoshimura,三浦J, Kusumegi T,奥卡河,Ryu R,建筑师,松原K,卡瓦依J, Carninci P,足立J, K Aizawa,荒川T,福田,Hara, Hashizume W, Hayatsu N, Imotani K, Ishii Y,伊藤M, Kagawa我,近藤年代,Konno H,宫崎骏,大里N, Ota Y,齐藤R,佐佐木D,佐藤K,柴田K,Shinagawa A, Shiraki T, Yoshino M, Hayashizaki Y, Yasunishi A,国际科学进步基金会基因组测序与分析小组RIKEN,国际科学进步基金会基因组测序与分析小组:收集、定位和注释28000多个粳稻cDNA克隆。科学通报,2003,32(3):376-379。10.1126 / science.1081288。
Sultan M, Schulz MH, Richard H, Magen A, Klingenhoff A, Scherf M, Seifert M, Borodina T, Soldatov A, Parkhomchuk D, Schmidt D, O'Keeffe S, Haas S, Vingron M, Lehrach H, Yaspo ML:通过人类转录组深度测序研究基因活性和选择性剪接的全球观点。科学通报,2008,32(4):359 - 361。10.1126 / science.1160342。
Wang ET, Sandberg R, Luo S, Khrebtukova I, Zhang L, Mayr C, Kingsmore SF, Schroth GP, Burge CB:人类组织转录组中的替代亚型调控。自然学报,2008,456:470-476。10.1038 / nature07509。
蒋晨,顾娟,Chopra S,顾曦,Peterson T:典型的二重复和三重复Myb基因的有序起源。中国生物技术学报,2004,29(4):326 - 326。
Rabinowicz PD, Braun EL, Wolfe AD, Bowen B, Grotewold E:玉米R2R3 Myb基因序列分析显示在高等植物中扩增。遗传学杂志,1999,53:427-444。
Braun EL, Grotewold E:新发现的植物c-myb类基因改写了植物myb基因家族的进化。植物工程学报,1998,21(4):447 - 447。10.1104 / pp.121.1.21。
Dubos C, Stracke R, Grotewold E, Weisshaar B, Martin C, Lepiniec L:拟南芥MYB转录因子。植物科学进展,2010,15:573-581。10.1016 / j.tplants.2010.06.005。
Sønderby IE, Hansen BG, Bjarnholt N, Ticconi C, Halkier BA, Kliebenstein DJ:系统生物学方法鉴定了一个在脂肪族硫代葡萄糖苷调控中具有独特和重叠功能的R2R3 MYB基因亚家族。科学通报,2007,2:e1322-10.1371/journal.pone.0001322。
UI:转录因子HIG1/MYB51调控拟南芥吲哚酸硫代葡萄糖苷生物合成。植物学报,2007,30(4):366 - 366。10.1111 / j.1365 - 313 x.2007.03099.x。
Gigolashvili T, Engqvist M, Yatusevich R, Müller C, Flügge UI: HAG2/MYB76和HAG3/MYB29对拟南芥脂肪族硫代葡萄糖苷生物合成的调控具有特异性和协同性。植物学报,2008,37(4):369 - 369。10.1111 / j.1469-8137.2007.02295.x。
夏普PA:对RNA剪接的猜测。Cell, 1981,23: 643-646。10.1016 / 0092 - 8674(81) 90425 - 6。
Kent WJ, Baertsch R, Hinrichs A, Miller W, Haussler D:进化的大锅:老鼠和人类基因组的复制、删除和重排。美国国家科学研究院。2003年,100:11484 - 11489。10.1073 / pnas.1932072100。
Cannon SB, Mitra A, Baumgarten A, Young ND, May G:片段和串联基因复制在拟南芥大基因家族进化中的作用。植物生物学杂志,2004,4:10-10.1186/1471-2229-4-10。
Libault M, Farmer A, Joshi T, Takahashi K, Langley RJ, Franklin LD, He J, Xu D, May G, Stacey G:作物模型Glycine max的转录组整合图谱及其在植物比较分析中的应用。植物学报,2010,29(3):366 - 366。
Schauser L, Roussis A, Stiller J, Stougaard J:一种控制共生根瘤发育的植物调控因子。自然,1999,402:191-195。10.1038/46058。
奥尔droyd GE, Downie JA:豆科植物根瘤菌侵染与结节形态发生的协调。植物学报,2008,29(5):519-546。10.1146 / annurev.arplant.59.032607.092839。
Catoira R、Timmers AC、Maillet F、Galera C、Penmetsa RV、Cook D、Denarie J、Gough C:截断苜蓿HCL基因控制根瘤菌诱导的根毛卷曲。发展,2001,128:1507-1518。
Marsh JF, Rakocevic A, Mitra RM, Brocard L, Sun J, Eschstruth A, Long SR, Schultze M, Ratet P, Oldroyd GE:紫花苜蓿NIN在自活性钙/钙调蛋白依赖性蛋白激酶诱导的根瘤菌非依赖性结节器官发生中至关重要。植物生理学报,2004,24(3):354 - 354。10.1104 / pp.106.093021。
Kaló P, Gleason C, Edwards A, Marsh J, Mitra RM, Hirsch S, Jakab J, Sims S, Long SR, Rogers J, Kiss GB, Downie JA, Oldroyd GE:豆科植物的结瘤信号需要NSP2,它是GRAS转录调控家族的成员。科学通报,2005,38(4):369 - 369。10.1126 / science.1110951。
Murakami Y, Miwa H, Imaizumi-Anraku H, Kouchi H, Downie JA, Kawaguchi M, Kawasaki S:定位克隆鉴定了荷花(Lotus japonicus) NSP2,一种假设的GRAS家族转录因子,在结节启动过程中NIN和ENOD40基因表达所需。DNA学报,2006,13:255-265。10.1093 / dnares / dsl017。
Nishimura R, Ohmori M, Kawaguchi M:日本莲强化结瘤突变体的新共生表型:诱变突变体是一种早期结瘤突变体,结瘤带较宽。植物生理学报,2002,38(4):359 - 359。10.1093 /卡式肺囊虫肺炎/ pcf098。
El Yahyaoui F, Küster H, Ben Amor B, Hohnjec N, Pühler A, Becker A, Gouzy J, Vernié T, Gough C, Niebel A, Godiard L, Gamas P:在Medicago truncatula中,表达谱鉴定了超过750个在结瘤过程中差异表达的基因,包括许多潜在的共生程序的调控因子。植物生理学报,2004,24(3):369 - 369。10.1104 / pp.104.043612。
Middleton PH、Jakab J、Penmetsa RV、Starker CG、Doll J、Kaló P、Prabhu R、Marsh JF、Mitra RM、Kereszt A、Dudas B、VandenBosch K、Long SR、Cook DR、Kiss GB、Oldroyd GE:截断Medicago truncatula中Nod因子信号转导必不可少的ERF转录因子。植物学报,2007,19:1221-1234。10.1105 / tpc.106.048264。
Vernie T, Moreau S, de Billy F, Plet J, Combier JP, Rogers C, Oldroyd G, Frugier F, Niebel A, Gamas P: EFD是一种ERF转录因子,参与控制截断苜蓿(Medicago truncatula)结节数量和分化。植物科学学报,2008,29(4):366 - 366。10.1105 / tpc.108.059857。
Asamizu E, Shimoda Y, Kouchi H, Tabata S, Sato S:通过对日本莲结瘤相关转录因子的系统分析,揭示了LjERF1在结瘤过程中的正向调控作用。植物生理学报,2008,37(4):369 - 369。10.1104 / pp.108.118141。
Stracke S, Kistner C, Yoshida S, Mulder L, Sato S, Kaneko T, Tabata S, Sandal N, Stougaard J, Szczyglowski K, Parniske M:细菌和真菌共生所需的植物受体激酶。自然学报,2002,417:959-962。10.1038 / nature00841。
朱辉,陈涛,朱明,方强,康辉,洪铮,张铮:一种新的干旱dna结合蛋白与SymRK互作,并在日本莲早期结节发育过程中表达。植物生理学报,2008,29(4):347 -347。10.1104 / pp.108.119164。
Libault M, Joshi T, Takahashi K, Hurley-Sommer A, Puricelli K, Blake S, Finger RE, Taylor CG, Xu D, Nguyen HT, Stacey G:对大豆调控基因表达的大规模分析发现了一个参与大豆结节发育的Myb基因。植物生理学报,2009,29(4):371 - 371。10.1104 / pp.109.144030。
Feldbrügge M, Sprenger M, Hahlbrock K, Weisshaar B: PcMYB1是一种新的植物蛋白,含有一个dna结合域和一个MYB重复,在体内与光调节启动子单元相互作用。植物学报,1997,15(4):369 - 371。10.1046 / j.1365 - 313 x.1997.11051079.x。
Preston J, Wheeler J, Heazlewood J, Li SF, Parish RW:拟南芥花粉正常发育需要AtMYB32。植物学报,2004,29(4):369 - 371。10.1111 / j.1365 - 313 x.2004.02280.x。
爱,Vos CHRD,葡萄酒M,太阳Z,希腊R,克朗,摩尔JNM,奥康奈尔美联社:草莓FaMYB1转录因子抑制花青素和黄酮醇积累在转基因烟草。植物学报,2001,28:319-332。10.1046 / j.1365 - 313 x.2001.01154.x。
Baudry A, Caboche M, Lepiniec L: TT8在一个涉及TTG1和同源MYB和bHLH因子的反馈调控中控制自身的表达,允许拟南芥中类黄酮的强细胞特异性积累。植物学报,2006,29(4):366 - 366。10.1111 / j.1365 - 313 x.2006.02733.x。
Baudry A、Heim MA、Dubreucq B、Caboche M、Weisshaar B、Lepiniec L: TT2、TT8和TTG1协同调控拟南芥中BANYULS和原花青素生物合成的表达。植物学报,2004,29(4):366- 366。10.1111 / j.1365 - 313 x.2004.02138.x。
柑桔R2R3-MYB和bHLH-MYC转录因子的克隆及分子特性研究。中国植物学报,2009,26(6):381 - 381。
牛珊珊,徐春杰,张文伟,张斌,李旭,林旺K, Ferguson IB, Allan AC,陈克勤:R2R3 MYB转录因子对杨梅果实花青素生物合成的协调调控。植物学报,2009,6:101-112。
Grotewold E, Sainz MB, Tagliani L, Hernandez JM, Bowen B, Chandler VL:玉米C1中与bHLH辅助因子相互作用的Myb结构域残基的鉴定。2000年,97:13579 - 13584。10.1073 / pnas.250379897。
植物三重复Myb转录因子的保存与多样性。植物保护学报,2005,29(6):689 - 689。10.1007 / s10265 - 005 - 0192 - 8。
Haga N, Kato K, Murase M, Araki S, Kubo M, Demura T, Suzuki K, Müller I, Voss U, Jürgens G, Ito M: R1R2R3-Myb蛋白通过激活拟南芥KNOLLE转录正向调控胞质分裂。科学进展,2007,34(4):381 - 381。10.1242 / dev.02801。
Okada M, Akimaru H, Hou DX, Takahashi T, Ishii S: Myb通过诱导果蝇视盘细胞周期蛋白B的表达控制G(2)/M的进展。中华医学杂志,2002,21:675-684。10.1093 / emboj / 21.4.675。
Letunic I、Copley RR、Schmidt S、Ciccarelli FD、Doerks T、Schultz J、Ponting CP、Bork P:面向基因组数据集成的SMART 4.0。核酸学报,2004,32:D142-D144。10.1093 / nar / gkh088。
穆德NJ,阿韦勒R,阿特伍德TK,拜罗奇A,贝特曼A,宾斯D,布莱德利P,博克P,布赫P,塞鲁蒂L,科普利R,库尔切勒E,库尔切勒E,哈夫特D,哈特N,胡洛N,卡恩D,卡纳平A,克雷斯蒂亚尼诺娃M,朗斯代尔D,洛佩斯R,莱图尼奇I,马德拉M,马斯伦J,麦克道尔J,米切尔A,尼古斯卡娅AN,奥查德S,帕格尼M,庞廷CP,克维隆E,赛勒古特J,西格里斯特CJ,西尔文托伊宁V, Studholme DJ,沃恩R,吴CH:InterPro数据库是蛋白质族、结构域和功能位点的综合文档资源。核酸学报,2001,29:37-40。10.1093 / nar / 29.1.37。
Corpet F:多级聚类的多重序列对齐。核酸学报,1988,16:10881-10890。10.1093 / nar / 16.22.10881。
Nicholas KB, Nicholas HBJ, Deerfield DWI: Genedoc:遗传变异的分析和可视化。中华科学杂志,1997,4:14-
Thompson JD, Gibson TJ, Plewniak F, Jeanmougin F, Higgins DG: CLUSTAL_X窗口界面:由质量分析工具辅助的多序列对齐的灵活策略。核酸学报,1997,25:4876-4882。10.1093 / nar / 25.24.4876。
Kosakovsky Pond SL, Frost SDW, Muse SV: HyPhy:使用系统发育的假设检验。生物信息学,2005,21:676-679。10.1093 /生物信息学/ bti079。
Bailey TL, Williams N, Misleh C, Li WW:模因:发现和分析DNA和蛋白质序列基序。核酸学报,2006,34:W369-W373。10.1093 / nar / gkl198。
贝利TL, Gribskov M:结合证据使用p值:应用于序列同源搜索。生物信息学,1998,14:48-54。10.1093 /生物信息学/ 14.1.48。
Tamura K, Dudley J, Nei M, Kumar S: MEGA4:分子进化遗传学分析(MEGA)软件4.0版本。分子生物学与分子生物学杂志,2007,24:1596-1599。10.1093 / molbev / msm092。
唐辉,王晓丽,王晓丽,王晓丽,王晓丽:植物基因组共线与共线。科学通报,2008,32(4):489 -488。10.1126 / science.1153917。
Kilian J, Whitehead D, Horak J, Wanke D, Weinl S, Batistic O, D'Angelo C, Bornberg-Bauer E, Kudla J, Harter K: AtGenExpress全球应力表达数据集:UV-B光、干旱和寒冷胁迫响应的协议、评估和模型数据分析。植物学报,2007,30(4):369 - 371。10.1111 / j.1365 - 313 x.2007.03052.x。
确认
国家重点基础研究与发展计划项目(2011Cb100100、2011Cb100106)、国家自然科学基金项目(31071354)、国家转基因计划项目(2009ZX08009055B)资助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
HD进行了基因组搜索、序列分析、系统发育分析,对结果进行了解释并起草了手稿。BF和HD一起为基因组搜索做出了贡献,并编译了序列比对。SY和LL有助于系统发育、表达和结构分析。ZL进行了同位性和核苷酸取代分析。YH和YT共同参与了研究的构思和协调,参与了手稿的修改,并最终批准了即将出版的版本。所有作者阅读并批准了最终稿件。
权利和权限
开放获取本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于这篇文章
引用这篇文章
杜、华、杨、SS、梁、Z。et al。大豆MYB转录因子超家族的全基因组分析。BMC植物杂志12日,106(2012)。https://doi.org/10.1186/1471-2229-12-106
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-12-106
关键字
- 大豆基因组
- 高记录积累
- 记录丰富的配置文件
- 拼接网站事件


评论
查看存档意见(1)