摘要
背景
机械感测及其下游反应可能与含钙的感觉复合体有关2 +-渗透性机械敏感通道。在识别渗透信号时,植物细胞启动广泛的信号转导网络,诱导第二信使和触发诱导防御反应。典型的早期信号事件包括Ca2 +内流,蛋白质磷酸化和活性氧(ROS)的产生。药理分析显示钙2 +机械敏钙介导的内流2 +通路来影响渗透信号的诱导,包括ROS的产生。然而,早期渗透信号事件的分子基础和调节机制仍然很不清楚。
结果
我们在此鉴定并研究了已知Ca的唯一水稻同源物OsMCA12 +拟南芥(MCAs)的-渗透力敏通道。OsMCA1特异性定位于质膜。启动子-报告子实验表明OsMCA1在水稻中,mRNA广泛表达于种胚、芽的近端和根尖、叶和根的叶肉细胞中。Ca2 +摄取增强OsMCA1表明OsMCA1参与了Ca2 +通过质膜流入。NADPH氧化酶介导的低渗透冲击诱导ROS生成也增强OsMCA1 -overexpressing细胞。我们也生成和描述OsMCA1-RNAi转基因植物及培养细胞;OsMCA1 -受抑制的植株生长迟缓,株系缩短OsMCA1-抑制细胞携带Ca2 +-敏感的光蛋白aequorin在胞质游离钙中表现出部分受损的变化2 +浓度([Ca2 +]cyt)由低渗透休克和三硝基酚(一种机械敏感通道的激活剂)诱导。
结论
我们在水稻基因组中鉴定了唯一的MCA同源基因,并开发了过表达和抑制系。这种假定钙水平改变培养细胞的分析2 +-渗透性力敏通道表明OsMCA1参与了质膜钙的调控2 +低渗透胁迫诱导水稻细胞内流和ROS生成。这些发现揭示了我们对机械传感途径的理解。
背景
植物需要感知和响应机械压力,如风、触摸和渗透压的变化[1- - - - - -3.].胞质游离钙升高2 +浓度([Ca2 +]cyt)是对各种刺激的反应,如化学、物理和机械刺激[2,4- - - - - -7].在这个过程中,[Ca2 +]cyt关卡通过Ca的开放而上升2 +位于质膜和内膜上的通道。电生理和生物信息学研究揭示了质膜钙的存在2 +-机械刺激激活的渗透通道,尽管所涉及的结构实体及其生理功能在很大程度上尚不清楚[8- - - - - -12].
分子和电生理研究表明拟南芥MSL9和MSL10是细菌力敏通道MscS的同源物,是根细胞质膜中力敏通道活性所必需的,并且对Cl的渗透性更强-比Ca2 +[13,14].我们最近鉴定了两种质膜蛋白为推定的Ca2 +拟南芥中-渗透力敏通道MCA1 (At4g35920)和MCA2 (At2g17780) [15,16的异位过表达MCA1增加钙2 +对[Ca .]的吸收2 +]cyt低渗透性休克后升高。然而,MCA蛋白直接影响渗透诱导的Ca2 +通过质膜的内流和渗透信号通路尚不清楚。
在识别渗透信号后,植物细胞启动广泛的信号转导网络,诱导第二信使和触发诱导防御反应。典型的早期信号事件包括Ca2 +内流、蛋白质磷酸化及活性氧的产生[17- - - - - -20.].当Ca2 +流入受到Ca2 +螯合剂,如乙二醇-双(2-氨基乙醚)-N N N’N’-四乙酸(EGTA),或Ca2 +-通道阻滞剂,如La3 +[21].据报道,在烟草细胞中,低渗透冲击诱导的ROS生成需要激活机械敏感钙2 +渠道(22].这些结果表明Ca2 +机械敏钙介导的内流2 +通道参与渗透信号的诱导,包括ROS的产生。然而,在渗透反应中,分子基础和调控机制仍然很不清楚。
在目前的研究中,我们已经在水稻基因组中发现了唯一的MCA同源基因,并开发了过表达和抑制系。这些系的研究改变了这种假定的力敏钙的水平2 +OsMCA1参与了质膜钙的调控2 +低渗透胁迫诱导水稻细胞内流和ROS生成。
结果
OsMCA1的鉴定及其表达模式
全长cDNAOsMCA1通过快速扩增cDNA末端(RACE -PCR)方法获得。它编码了一个含有418个氨基酸残基的多肽,计算分子质量为47,417 (GenBank Accession No. 417)。AB601973)。预测蛋白与拟南芥MCA1和MCA2的氨基酸序列一致性分别为66.7%和57.6%;TopPred项目http://www.sbc.su.se/~erikw/toppred2/表明OsMCA1有两个潜在的跨膜段(S1和S2)(附加文件)1),而其他跨膜段预测程序给出了不同数量的假定跨膜段(数据未显示)。通过TMpred预测发现了PLAC8基序http://www.ch.embnet.org/software/TMPRED_form.html在c端区域(附加文件1).全基因组数据库搜索(Rice BLAST;http://riceblast.dna.affrc.go.jp/)表明大米没有其他的同源物OsMCA1.
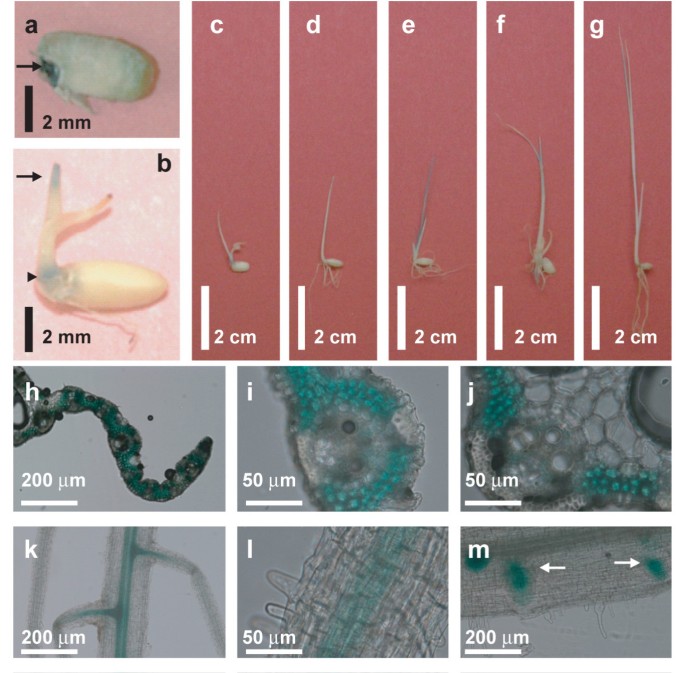
定量逆转录酶(RT -PCR)分析结果显示OsMCA1mRNA在成熟叶、嫩枝、根和悬浮液培养细胞中均有表达OsMCA1mRNA在整个植物的幼苗和培养细胞中表达(附加文件2).我们还查阅了微阵列表达数据库(Rice XPro;http://ricexpro.dna.affrc.go.jp/GGEP/index.html,OsMCA1轨迹ID;Os03g0157300),表达OsMCA1整个发育阶段的mRNA,包括根、叶片、圆锥花序、花药、雌蕊和子房以及胚胎(数据未显示)。的空间格局OsMCA1表达被检查使用OsMCA1启动子:β葡萄糖醛酸酶(格斯)融合报告基因构建(OsMCA1p::格斯).数字1显示OsMCA1p::格斯在种子中表达,在胚中表达量较高。在苗期,OsMCA1p::格斯在茎部近端和顶端高度表达(图1 b-g).叶子的横截面说明了这一点OsMCA1p::格斯在叶肉细胞中高度表达,但在维管组织中表达水平相对非常低(图1 h-j).OsMCA1p::格斯在根中也有表达,在主根中心和侧根原基中表达量较高(图1 km).这些结果表明OsMCA1转录在整个发育阶段都可能受到调控。的表达模式OsMCA1和拟南芥相似吗MCA2.
OsMCA1蛋白的细胞内定位
为了研究OsMCA1蛋白的胞内定位,我们将融合于OsMCA1 n端编码序列的绿色荧光蛋白(GFP)构建物引入烟草BY-2细胞,并使用共聚焦激光扫描显微镜检测其胞内定位。当GFP单独表达时,它定位于细胞核和细胞质(图2 i, j).相比之下,GFP-OsMCA1融合蛋白特异性定位于质膜(图2 a, b).用高渗透溶液(1 M甘露醇)处理后,这种模式得到加强,其诱导了质水解(图2 e, f).此外,GFP-OsMCA1在质解前后的荧光图像和行为与细胞内染色标记物FM4-64不同(图4-64)2c g k而且2d h l),说明OsMCA1定位于质膜。
OsMCA1过表达对Ca2 +在培养水稻细胞中的吸收
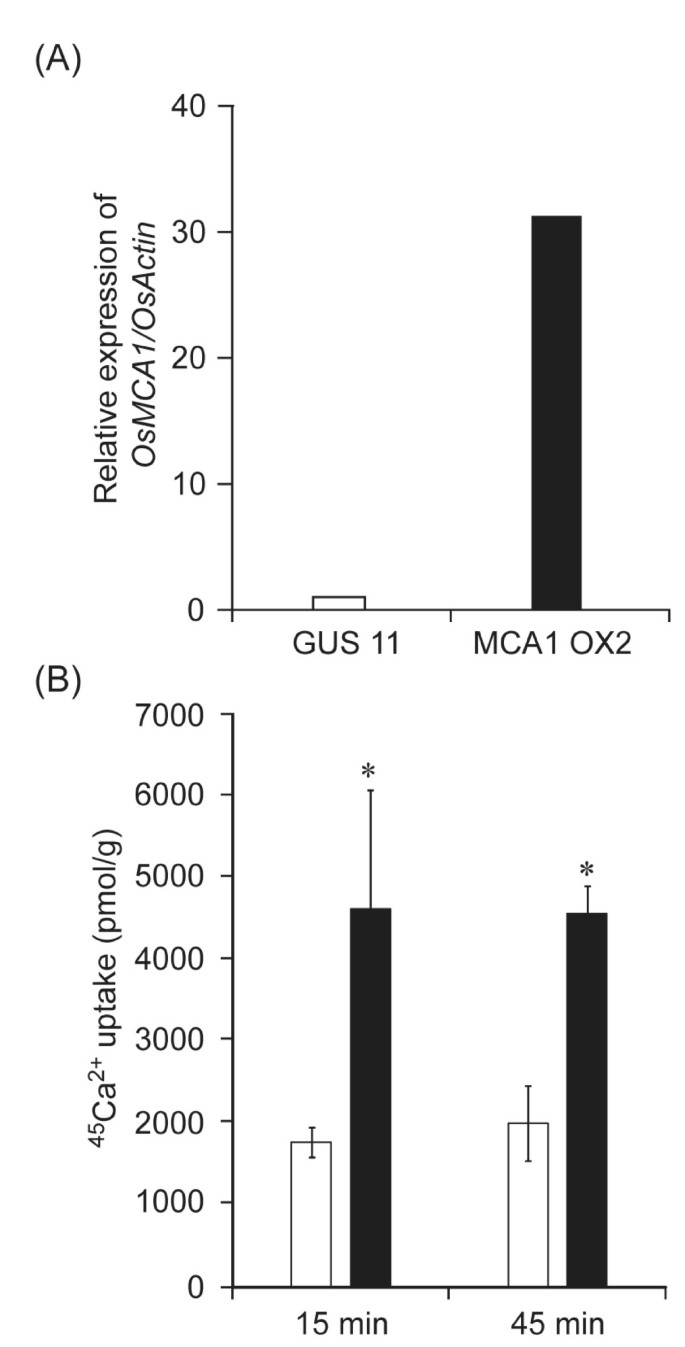
测试OsMCA1是否在Ca中起作用2 +在转运过程中,我们产生了过度表达的培养细胞OsMCA1并分析了是否表达水平OsMCA1影响钙2 +吸收的活动。如图所示3 a, B、钙2 +的吸收活性较高OsMCA1-过度表达的细胞格斯表明OsMCA1参与了Ca2 +水稻在质膜上的吸收。我们还生成了OsMCA1-过表达的植物,没有显着的可见表型(数据未显示)。
OsMCA1抑制对植物生长发育的影响
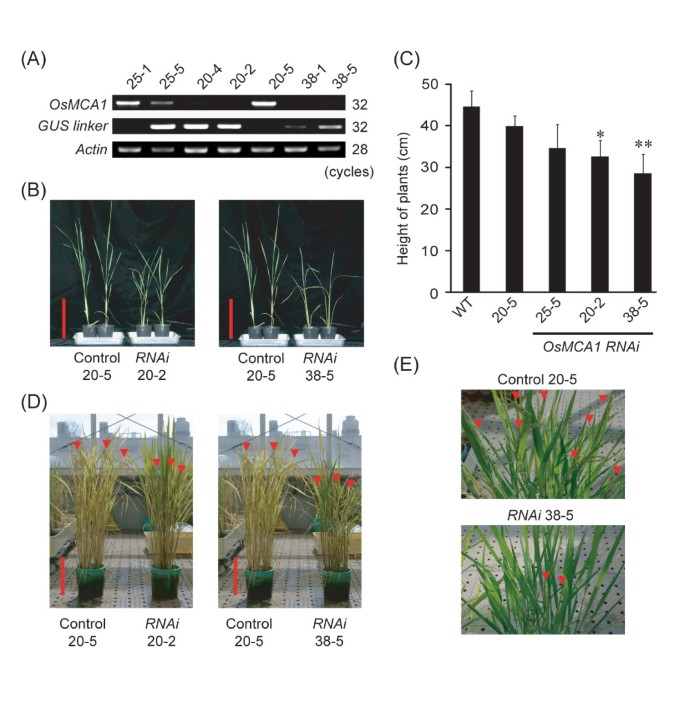
为了阐明OsMCA1的生理作用,我们在OsMCA1中培养了转基因植物OsMCA1RNA干扰抑制表达(RNAi)使用基因特异性序列(400 bp的区域OsMCA1).5个独立的转基因植株农杆菌属介导的转换。同时研究了非转基因植物作为对照,通过杂合分离去除转导基因。RT-PCR分析显示OsMCA1mRNA水平与对照组比较(图4).
的OsMCA1-抑制系在成体植株中生长较慢(图4 b, C).虽然在Murashige和Skoog培养基(MS培养基)中,抑制系的发芽率(数据未显示)和幼苗生长与对照相当(附加文件)3.),移栽到温室土壤后,抑制系生长明显受阻OsMCA1压抑会导致对环境压力的极度敏感。该表型在5个独立T中均有表现2转基因RNAi行;表型的严重程度与基因的表达水平密切相关OsMCA1成绩单(图4 a, C).此外,与拟南芥不同mca变种人,种族OsMCA1 -抑制线明显短于对照组(图4 d, E),表明OsMCA1在某些发育阶段与拟南芥MCAs发挥不同的作用。
osmca1抑制对细胞生长和Ca2 +培养水稻细胞的敏感性
我们测试了OsMCA1抑制Ca2 +对水稻细胞生长的敏感性。在含有3mm钙的常规介质中2 +的增长率OsMCA1-抑制线与对照组相当(图5).相反,当Ca2 +培养基浓度降低至0.1 mM(图5)、增长OsMCA1与对照组相比,OsMCA1基因的表达明显受限,提示OsMCA1基因可能参与了Ca的获取2 +钙对细胞生长的影响2 +限制。
OsMCA1参与机械应力诱导[Ca2 +]cyt变化
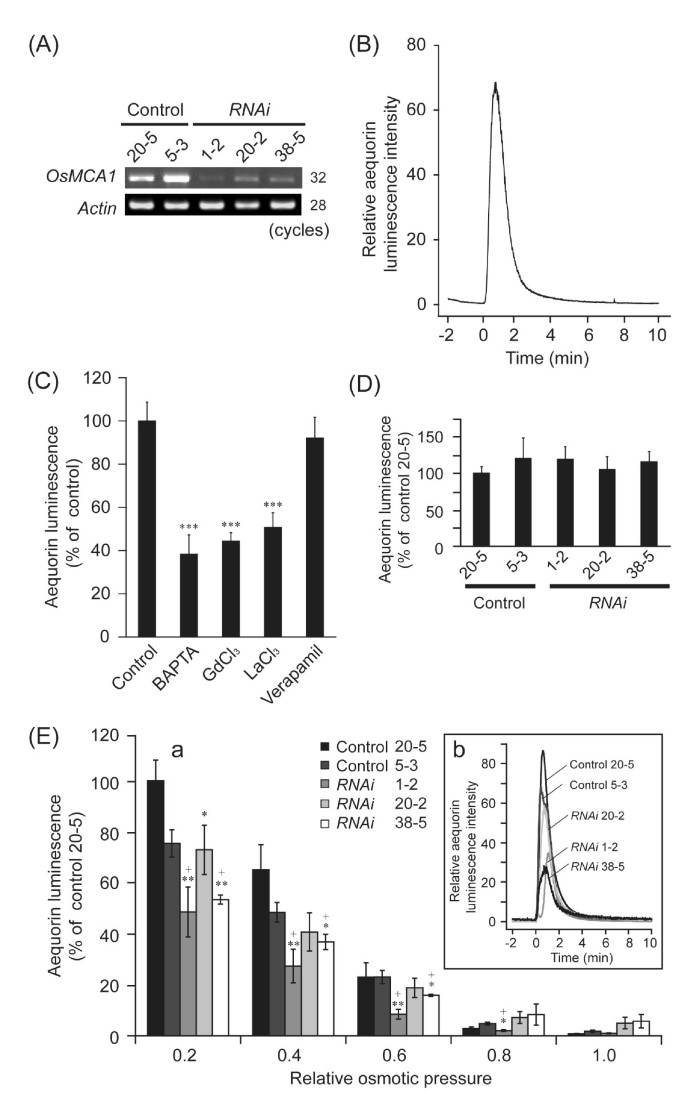
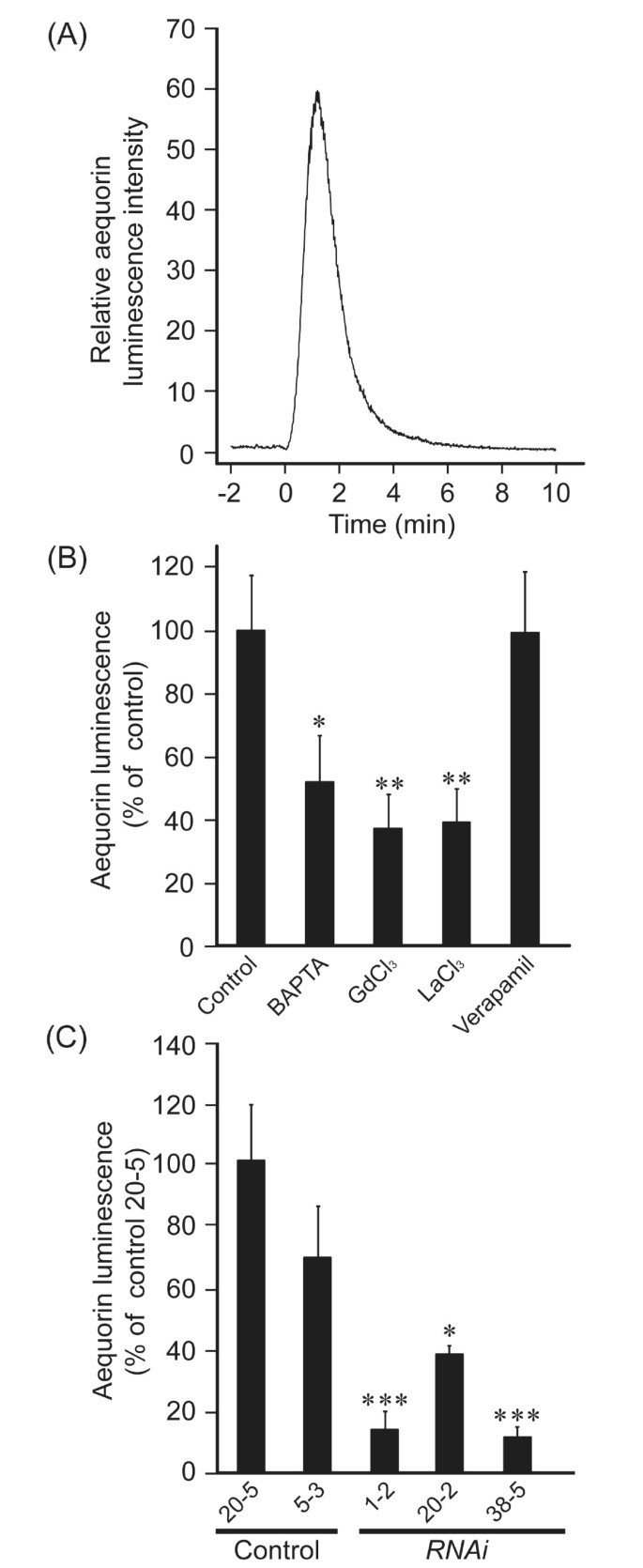
检测OsMCA1是否参与钙的调控2 +各种刺激诱发的涌入,我们产生了OsMCA1-抑制线港Ca2 +-敏感的生物发光蛋白aequorin(图6).低渗透冲击诱导的瞬态[Ca2 +]cyt在培养水稻细胞中的变化(图6 b)被Ca2 +螯合剂,以叔——(2-aminophenoxy)乙烷-N N N’N’-四乙酸(BAPTA)和Ca2 +通道阻滞剂(GdCl3.和LaCl3.)而不是通过维拉帕米,一种电压依赖性钙抑制剂2 +通道(图6摄氏度),表明质膜Ca2 +Gd介导的内流3 +Ca2 +-渗透通道是由低渗透冲击引起的。低渗透冲击诱导[Ca2 +]cyt变化在OsMCA1-抑制细胞(图6 e),与的水平成正比OsMCA1表达方式OsMCA1抑制细胞。另一方面,增加[Ca2 +]cyt引发的N乙酰壳寡糖,一种水稻质膜受体识别的主要微生物相关分子模式[23,24],不受影响OsMCA1表达水平(图6 d).这些结果表明OsMCA1参与了质膜Ca2 +低渗透休克而非mamp引起的内流。
OsMCA1参与低渗透休克诱导的[Ca2 +]cyt变化.(一个) RT-PCR分析OsMCA1在三个独立的RNAi行表达apoaequorin信使rna。(B)低渗透冲击诱导[Ca2 +]cyt培养水稻细胞的变化。细胞在0分钟用水稀释四倍。五个实验的代表性结果显示。(C)低渗透休克诱导[Ca2 +]cyt的变化。细胞在0分钟用水稀释四倍。BAPTA (5 mM), GdCl3.(5 mM), LaCl3.在低渗透休克治疗前15 min,细胞悬液中加入(5 mM)和维拉帕米(1 mM)。对照组在低渗透性休克前未接受任何治疗。比较了马蹄苷化学发光峰强度;对照的相对发光水平标准化为100% (C而且D).5个独立实验数据均为均数±标准差。***P< 0.005;与对照组相比有显著差异。(D)的影响OsMCA1抑制对N-acetylchito-oligosaccharides-induced (Ca2 +]cyt的变化。细胞用N-乙酰壳庚糖(1 μM)。误差条表示5次实验平均值的SE。(E-a)加入1毫升水、培养基或稀释的培养基OsMCA1在0分钟时,apoaequorin在细胞外渗透压产生广泛的变化。在低渗透休克后10分钟内累积的相对发光量与相对细胞外渗透压绘制。数据为均值±标准差,n = 3-7。+*P< 0.05;+**P< 0.01;与2条控制线(20-5号和5-3号)相比有显著差异。*P< 0.05;与控制线(20-5号)有显著差异。(E-b)低渗透冲击诱导Ca2 +签名在OsMCA1抑制线。细胞在0分钟用水稀释四倍。几个实验的代表性结果显示。
三硝基酚(TNP)是一种有效的化合物,可产生膜扭曲,激活机械敏感通道,模拟植物的机械刺激[15]和动物细胞。我们研究了TNP对[Ca2 +]cyt以及OsMCA1可能参与了其在培养水稻细胞中的调控。TNP诱导的瞬态[Ca2 +]cyt变化,BAPTA、GdCl抑制3.,和LaCl3.而不是维拉帕米(图7 a、B).[Ca2 +]cyt低渗透休克和TNP触发的瞬态基本相似(图6摄氏度,7 b).TNP-induced (Ca2 +]cyt变化也被削弱OsMCA1-抑制线(图7 c),提示OsMCA1可能参与了一个假定的机械敏感Ca2 +-渗透通道在机械应力触发的质膜Ca2 +涌入。
OsMCA1参与三硝基酚(TNP)诱导的[Ca2 +]cyt变化.(一个) tnp诱导的[Ca2 +]cyt培养水稻细胞的变化。细胞用TNP (1 mM)处理0分钟。5个实验的代表性结果显示。(B) tnp诱导的[Ca2 +]cyt的变化。BAPTA (5 mM), GdCl3.(5 mM), LaCl3.TNP处理前15分钟,在细胞悬液中加入(5 mM)和维拉帕米(1 mM);DMSO作为对照。比较了水马苷的化学发光峰强度;对照的相对发光水平标准化为100%。数据为三个独立实验的平均值±标准差。*P< 0.05;**P< 0.01;与对照组相比有显著差异。(C)的影响OsMCA1-抑制tnp诱导的[Ca2 +]cyt的变化。TNP (1 μM)处理细胞。比较了水马苷的化学发光峰强度;对照线(20-5)的相对发光水平标准化为100%。数据为三个独立实验的平均值±标准差。*P< 0.05;***P< 0.005;与两条控制线(20-5和5-3)相比有显著差异。
我们也试图检查过表达的影响OsMCA1机械应力触发Ca2 +涌入。然而,我们观察到,在所有过表达的转基因细胞系中,aequorin的总发光强度都有很强的降低OsMCA1(数据未显示)。因此不可能测量[Ca2 +]cyt使用OsMCA1-overexpressing线。Real-time RT-PCR分析结果显示aequorin基因的表达水平OsMCA1-过表达线与对照组相当(数据未显示)。的本构过表达OsMCA1不影响马蹄素蛋白的表达,但可能影响马蹄素蛋白的稳定性或抑制马蹄素化学发光。
osmca1过表达对低渗透休克敏感性和活性氧产生的影响
低渗透性休克已被证明可在[Ca2 +]cyt培养烟草细胞增加[18,22].由于OsMCA1被认为影响低渗透休克诱导的Ca的调节2 +涌入(图6 e),我们利用两种对超氧阴离子自由基敏感的方法(•O2-)和过氧化氢(H2O2).
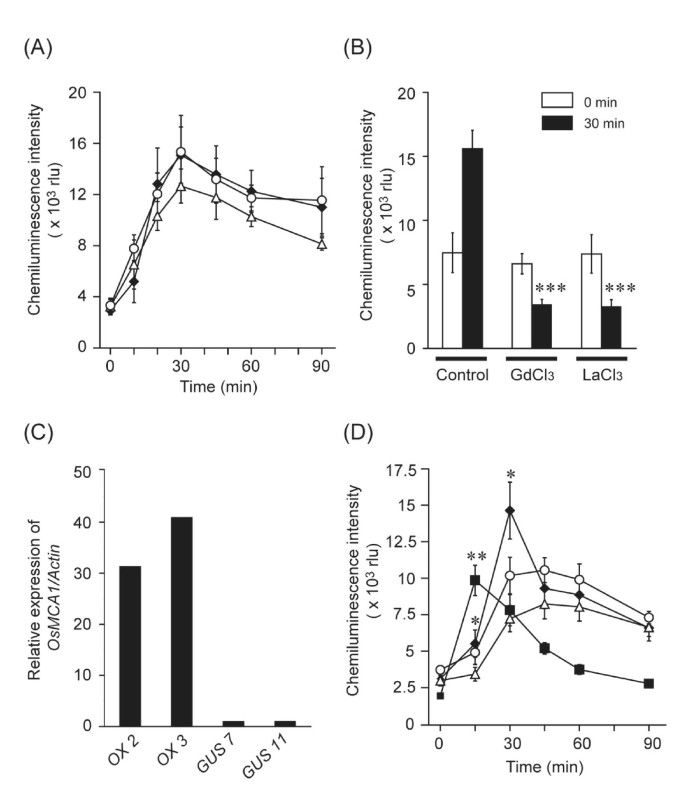
低渗透休克在5分钟内触发ROS生成(图8), Ca2 +通道阻滞剂(GdCl3.和LaCl3.),表明Ca在其中发挥了重要作用2 +低渗透休克诱导的ROS生成(图8 b).二苯碘(DPI;10 μM),一种NADPH氧化酶抑制剂,显著抑制ROS的生成(附加文件4).过氧化物酶催化的反应也被提出用于渗透冲击诱导的ROS生成的培养烟草和拟南芥细胞(19].然而,过氧化物酶抑制剂水杨酸羟肟酸(SHAM, 3 mM)几乎不影响低渗透休克诱导的ROS生成(附加文件)5),表明低渗透冲击诱导ROS生成的主要原因是培养水稻细胞中产生ROS的NADPH氧化酶。低渗透休克诱发的世代•O2-(图8 c, D)和H2O2(附加文件6),要么显著增强,要么更快OsMCA1-比对照组多表达了几行。体内ROS的生成OsMCA1-抑制线与对照组相当(图8).
表达水平的影响OsMCA1对低渗透冲击诱导ROS生成的影响.(一个)的影响OsMCA1-通过MCLA化学发光测定低渗透冲击诱导ROS生成的抑制作用。数据为控制线(封闭菱形控制20-5)5个独立实验的平均值±SE和2个独立实验RNAi线(开圈为RNAi20-2;开放三角形RNAi38-5)。作为低渗透冲击,生长培养基在0分钟用稀释4倍的培养基代替(一个而且B).(B)几种Ca2 +通道阻滞剂对野生型低渗透冲击诱导ROS生成的影响。GdCl3.(1mm)和LaCl3.(1 mM)在低渗透休克治疗前60分钟加入细胞。数据为三次或四次独立实验的平均值±标准差。***P< 0.005;与对照组相比有显著差异。(C的定量表达水平OsMCA1mrna在OsMCA1实时定量PCR表达过表达系。的相对水平OsMCA1对照细胞(GUS No. 7)的mrna标准化为1。(D)的影响OsMCA1低渗透休克诱导ROS生成的过表达。作为低渗透冲击,生长培养基在0分钟被稀释三倍的培养基所取代。数据为两个对照线5次独立实验的平均值±SE(开圈为GUS No. 11;GUS 7号为开放三角形)和两条过表达线(OX 2号为封闭菱形;为3号牛的封闭方)。*P< 0.05;**P< 0.01;与对照组(GUS No. 7)有显著差异。
讨论
有人认为Ca2 +在机械传感中起着至关重要的作用[7,25].然而,钙的分子机制却知之甚少2 +动员。的功能特征OsMCA1-RNAiOsMCA1参与了低渗透休克诱导的Ca2 +内流和ROS生成。
OsMCA1在水稻生长发育调控中的可能功能
OsMCA1-抑制的植物表现出生长迟缓和缩短的racu(图4 d, E).这些表型经常在干旱胁迫条件下观察到[26].压制OsMCA1可能影响了对干旱的适应。众所周知,干旱胁迫会导致细胞水平的渗透胁迫。由于低渗透冲击诱导[Ca2 +]cyt的变化受到损害OsMCA1-抑制系,这些系可能在渗透感应/反应和适应干旱胁迫能力方面存在缺陷。未来的研究将描述干旱的生理反应和机械信号OsMCA1 -抑制植物将进一步阐明OsMCA1在完整植物体内的作用。
在拟南芥中mca1 mca2双突变体在土壤中生长缺陷,钙的积累减少2 +以及增强对Mg的敏感性2 +[16].Ca的余额2 +和毫克2 +是植物正常生长的重要因素[27].自成长起OsMCA1与对照相比,Ca处理显著限制-抑制系2 +限制(图5),生长迟缓OsMCA1钙含量降低可能是导致植物钙含量降低的原因2 +摄取,导致低钙2 +毫克2 +比率。
OsMCA1可能参与水稻细胞的渗透信号传导
GFP-OsMCA1融合蛋白特异性定位于质膜(图2),表明OsMCA1是一种质膜蛋白。在培养的水稻细胞中,低渗透休克和tnp诱导的[Ca2 +]cyt瞬态,这是由La抑制3 +和Gd3 +,在OsMCA1-抑制线(图6而且7).mamp诱导的[Ca2 +]cyt瞬态是类似的(数据未显示),但不受影响OsMCA1抑制(图6 d).这些结果表明OsMCA1影响Ca的调控2 +在人工培养的水稻细胞中,机械刺激对质膜的反应。
低渗透性休克触发ROS生成[Ca2 +]cyt增加(18,20.,22].细胞外钙2 +Ca2 +低渗透休克引起的内流和NADPH氧化酶介导的ROS生成(图6摄氏度而且8 b,附加文件4),表明ROS的产生需要Ca2 +通过质膜流入。过度的OsMCA1增强ROS的生成(图8 d,附加文件6).绑定Ca2 +到植物NADPH氧化酶细胞质调节结构域的ef手区直接激活它们[28- - - - - -30.].据报道,一种功能性NADPH氧化酶AtrbohC/RHD2影响机械应激诱导的活性氧生成2 +-依赖方式[31].质膜钙过量2 +-渗透性通道可诱导过量钙的动员2 +对机械刺激的反应,这可能会导致NADPH氧化酶的增强激活。
在OsMCA1低渗透休克挑战的-抑制系,Ca2 +内流部分受损(图6 e),但在我们的实验条件下,没有检测到损伤对后续ROS生成的显著影响(图8).类似的过表达和功能缺失突变也观察到另一种推定的钙2 +-渗透通道,OsTPC1 [32].一定量的钙2 +对NADPH氧化酶介导的ROS生成可能足够。或者,其他Ca2 +低渗透休克激活的-渗透性通道可能在绕过OsMCA1中起冗余作用。研究表明,拟南芥MSL9和MSL10是细菌力学敏感通道MscS的同源物,是根细胞膜力学敏感通道活性所必需的,能够转运包括Ca在内的阳离子2 +[13,14].因此,水稻MSL同源物可能是这种Ca的候选者2 +透水通道。
结论
本研究表明OsMCA1参与了质膜钙的调控2 +低渗透胁迫诱导水稻细胞内流和NADPH氧化酶介导的ROS生成。这些发现揭示了我们对机械传感途径的理解。
方法
植物材料及细胞培养
表面杀菌的水稻种子,水稻.简历。日本枯草,在MS培养基上萌发[33]含0.8%琼脂,在长昼条件下(光照16小时/黑暗8小时,28°C)生长室中生长10天。幼苗移栽到土壤中,在温室(光照16小时/黑暗8小时,28°C,湿度60%)中生长。愈伤组织在25℃液体L培养基中悬浮培养[34]含有2,4- d (0.5 mg L .-1),并在新鲜培养基中传代培养。每2周用20目筛网对细胞进行过滤,形成细团聚物。传代后5 d的细胞进行渗透胁迫和防御反应实验。N-乙酰壳寡糖由Naoto Shibuya教授(明治大学)提供。
OsMCA1 cDNA的分离
的估计编码区域OsMCA1采用两种引物进行PCR扩增:OsMCA1向前,5“-GAAGAAGAAGAAGAAGAAGAAGCCGAGTAG-3”;OsMCA1相反,5‘-TATTTATGCTTACCCTGCATTGTTTGTGTT-3’。使用Trizol (Invitrogen, Carlsbad, CA, USA)从水稻叶片中分离总RNA,并按照制造商的方案进行分光光度法定量。用oligo-dT引物和逆转录酶(Invitrogen)从3 μg总RNA合成第一链cDNA。获取全长cdnaOsMCA1为了确定开放阅读框,按照制造商的协议,使用3'-full RACE核心试剂盒(Takara, Ohtsu, Japan)和5'-RACE系统(Invitrogen)进行3'-RACE PCR和5'-RACE PCR。
RNA分离和RT-PCR分析
使用Trizol试剂按照制造商的方案分离总RNA,并使用分光光度计定量。用寡核苷酸dt引物和逆转录酶从3 μg总RNA合成第一链cDNA。PCR扩增在95°C初始变性3 min,然后在94°C孵育30 s, 55°C孵育90 s, 72°C孵育1 min,使用特定引物进行OsMCA1。肌动蛋白用作定量对照[35].用琼脂糖凝胶电泳分析各PCR产物的等分,并用溴化乙锭染色和紫外线照射进行观察。
实时RT-PCR定量
实时RT-PCR检测如Kurusu等人(2010)所述[36].用寡聚- dt引物和逆转录酶从3 μg总RNA合成第一链cDNA。实时PCR使用ABI PRISM 7300序列检测系统(Applied Biosystems, Foster City, CA, USA)和SYBR Green实时PCR Master Mix (Toyobo, Osaka, Japan)进行OsMCA1特异性引物OsMCA1-RealF, 5'-TGGTCTCAAGCAGAGGATCATACA-3';OsMCA1-RealR 5“-CTCTGAACAGCAACCAAGCAAA-3”。使用标准曲线法计算相对mRNA水平,并归一化到相应的水平OsActin1基因水平。已知模板量的标准样品用于定量PCR产物。
OsMCA1p:: gus表达植物OsMCA1表达的空间格局
一个DNA片段OsMCA1通过聚合酶链反应合成5'-非编码区,制备启动子区-从1.5到0 KBOsMCA1起始密码子,以水稻(Nipponbare)基因组DNA为模板,引物:OsMCA1pF, 5'-中国商用飞机有限责任公司AACAACCCCTAACATGCCTAA-3 ';OsMCA1pR, 5'-TGCCGTCGTCTACTCGGCTTCTTCT-3' (Gateway系统使用的CACC序列),亚克隆到pENTR/D-TOPO克隆载体上,然后克隆到ti基无启动子上格斯表达载体,pHGWFS7 [37]使用LR克隆酶反应;农杆菌属对水稻愈伤组织进行了细胞介导转化。用湿霉素(50 μg mL)筛选转化愈伤组织-1);然后再生转基因植物。
T2转基因植株在28℃光照16 h /暗8 h的循环条件下生长进行实验。GUS活性原位组织化学定位如下。样品在Eppendorf管中用90%的丙酮固定1小时,放置在冰上,并用100 mM磷酸钠缓冲液(pH 7.0)洗涤4次。样品在X-Gluc缓冲液(0.5 mg/mL 5-溴-4-氯-3-吲哚基葡醛酸酶(Nacalai Tesque, Osaka, Japan), 50 mM磷酸钠缓冲液,pH 7.0, 5%甲醇)中37℃孵育24 h,然后依次用50%、70%、90%、100% (v/v)乙醇清洗固定1 h。固定样品在100%乙醇中保存后拍照。
osmca1过表达和抑制系的产生
为了生成rna沉默触发的反向重复结构,的3'-UTR的400 bp对应区域OsMCA1用RNAiFW扩增,5'-中国商用飞机有限责任公司CTCTTATCCAAACTTGCCAT-3'和RNAiRV, 5'- AATGTTCCACAGGGGAAAAAGAATGTTCTC-3'作为特异性引物,亚克隆到pENTR/D-TOPO克隆载体中,克隆到ti基RNAi载体pANDA [38]使用LR克隆酶反应。将该结构引入水稻愈伤组织中农杆菌属-介导的转化,根据Tanaka et al. 2001的方法[39].用湿霉素(50 μg mL)筛选转化愈伤组织-1);然后再生转基因植物。从T2植物被用于各种分析。
过度表现OsMCA1而且格斯将cdna、序列克隆到ti基载体pPZP2H-lac [40玉米的下游泛素启动子,农杆菌属对水稻愈伤组织进行了细胞介导转化。用湿霉素(50 μg mL)筛选转化愈伤组织-1),然后再生转基因植物。
表达细胞质靶向apoaequorin互补脱氧核糖核酸(41在OsMCA1克隆到ti载体pSMAB704 [42的下游CaMV 35 s启动子,农杆菌属对水稻愈伤组织进行了细胞介导转化。转化愈伤组织采用bialaphos (Meiji Seika, Tokyo, Japan)筛选(5 μg mL-1),然后再生转基因植物。
OsMCA1在烟草BY-2细胞中的亚细胞定位
为了产生表达GFP-OsMCA1的转基因BY-2细胞,使用OsMCA1(GFP)F, 5'-扩增编码区中国商用飞机有限责任公司ATGGCGTCGTGGGAGAACCT-3'和OsMCA1(GFP)R, 5'-TTAGTGTTCCATGTACTGAA-3'作为特异性引物,亚克隆到pENTR/D-TOPO克隆载体上,然后克隆到n端EGFP融合的pH7WGF2载体上[37]使用LR克隆酶反应。
BY-2细胞转化按照An(1985)进行[43将4 mL 3天的指数生长培养物转移到90毫米的培养皿中,在28℃下与100 μL新鲜的隔夜培养物一起孵育根癌土壤杆菌pGV2260包含二进制矢量pH7WGF2。共培养48h后,将烟草细胞清洗后镀于含湿霉素(50 μg mL)的LS琼脂培养基上-1)和卡本西林(250 μg mL-1).每隔3-4周,选择转化体并转移到新鲜培养基上继续选择。
荧光苯乙烯膜探针FM4-64 (Molecular Probes, Carlsbad, CA, USA)作为17 mM的原始溶液保存在无菌水中,并在最终浓度为4.25 μM时用于标记液泡膜(液泡体)。5日龄BY-2细胞用FM4-64处理3 h,用培养基洗涤2次。
胞质钙的测定2 +浓度
钙的测量2 +根据Kurusu等人(2011)描述的方法进行动员[44].简单地说,传代后5天表达apoaequorin的水稻细胞用1 μM腔肠嗪在25℃下孵育至少12 h。细胞悬液(250 μL)转移到直径1.1 cm的培养管中,置于光度计(Lumicounter 2500, Microtech Nition,千叶,日本)中。在光度计中,培养管顺时针和逆时针每3s旋转17转,搅拌细胞。经过15分钟的孵育使细胞稳定,Ca2 +测定依赖于水马苷的发光,并表示为相对发光单位(rlu)。
Ca2 +培养细胞摄取
传代后5 d的水稻细胞用于测定钙含量2 +吸收。水稻细胞在Ca中培养2 +在25°C条件下,游离介质至少3小时。细胞悬液(80 mg mL-1)转移到含有0.1 mM氯化钙的培养基中2孵育1小时左右2 +吸收是通过添加开始的45CaCl2最终浓度为33 kBq/g。然后在25°C下搅拌细胞;分别于0、15、45分钟后取细胞1 mL45CaCl2.用5 mM氯化钙预浸泡的Whatman过滤器(GF/C)过滤细胞2用5毫米氯化钙的冰冷溶液清洗5次2,和2毫米LaCl3.删除45Ca2 +从细胞壁。每个过滤器上保留的放射性按前面所述进行计数[45].
ROS的测量
水稻细胞(cv。继代培养后5 d进行测定•O2-和H2O2在细胞外培养基中。•O2-在添加20 μM甲氧基化塞地纳荧光素类似物(MCLA(2-甲基-6-[p-methoxyphenyl) 3, 7-dihydroimidazo[1, 2 -α]pyrazin-3-one);Invitrogen)在相同的条件下使用发光计(Lumicounter 2500)测量[Ca2 +]cyt[46].
监测H2O2产生于细胞外培养基,细胞(80 mg mL-1)在含有0.5 mM氯化钙的5 mM MES缓冲液(pH 7.0)中洗涤和重悬2, 0.5 mM K2所以4添加或不添加175 mM甘露醇(Kurusu et al. 2005)。将25 μl培养基与150 μl 50 mM Tris-HCl (pH 8.0)和25 μl 0.462 mM鲁米诺(50 mM Tris-HCl, pH 8.0)混合在96孔滴定板中。加入铁氰化钾(25 μL, 11.76 mM)2O2使用光度计(MicroLumat Plus LB96V, Berthold Technologies, Bad Wildbad, Germany)记录依赖于荧光的化学发光15 s。
统计分析
使用未配对的学生数据来确定统计学意义t测试;P< 0.05为显著性。
作者的信息
现地址:日本前桥市群马大学分子与细胞调控研究所细胞生物学实验室,群马371-8510。
缩写
- BAPTA:
-
1,以- (2-aminophenoxy)乙烷N N N’N’-四乙酸
- (Ca2 +]cyt:
-
胞质游离钙2 +浓度
- 迪拜国际资本:
-
差分干涉对比
- DPI:
-
二苯基碘鎓
- EGTA:
-
乙烯glycol-bis - (2-aminoethylether)N N N’N’-四乙酸
- 绿色荧光蛋白:
-
绿色荧光蛋白
- 格斯:
-
β葡萄糖醛酸酶
- H2O2:
-
过氧化氢
- MAMP:
-
微生物相关分子模式
- MCLA:
-
2-methyl-6 - [p-methoxyphenyl) 3, 7-dihydroimidazo[1, 2 -α]pyrazin-3-one
- •O2-:
-
超氧阴离子自由基
- 媒介女士:
-
Murashige和Skoog medium
- 种族:
-
cDNA末端的快速扩增
- rlu:
-
相对发光单位
- RNAi:
-
RNA干扰
- RT:
-
逆转录酶
- ROS:
-
活性氧
- 假:
-
salicylhydroxamic酸
- 对照组:
-
苦味酸。
参考文献
- 1.
Reddy ASN:钙:信号中的银弹。植物科学学报,2001,26(3):366 - 366。10.1016 / s0168 - 9452(00) 00386 - 1。
- 2.
桑德斯D,佩洛克斯J,布朗利C,哈珀JF:钙在信号的十字路口。中国生物医学工程学报,2002,14:S401-S417。
- 3.
杨涛,杨文华,王晓明,等。钙调素介导的植物信号网络研究。植物科学进展,2003,8:505- 506。10.1016 / j.tplants.2003.09.004。
- 4.
王志刚,王志刚,王志刚:植物对重力和触觉的离子信号通路研究。植物生长学报,2002,21:71-88。10.1007 / s003440010049。
- 5.
拟南芥触觉和黑暗调控基因的全基因组鉴定:钙调素样和XTH基因。中国生物工程学报,2005,29(3):344 - 344。
- 6.
Toyoda M, Furuichi T, Tatsumi H, Sokabe M:拟南芥幼苗下胚轴和叶柄重力载体变化对细胞质钙的影响。植物科学学报,2008,29(3):357 - 357。
- 7.
多德·安,库德拉·J,桑德斯·D:钙信号的语言。植物学报,2010,2:593-620。
- 8.
Véry AA, senenac H:拟南芥质膜中的阳离子通道。植物科学进展,2002,7:168-175。10.1016 / s1360 - 1385(02) 02262 - 8。
- 9.
白丽娟,李志强,李志强,李志强,等。植物根细胞质膜钙离子通道基因的研究进展。生物化学学报,2002,29(3):349 - 349。10.1016 / s0005 - 2736(02) 00509 - 6。
- 10.
Dutta R, Robinson KR:花粉原生质体中拉伸激活离子通道的鉴定和表征。植物科学学报,2004,26(3):344 - 344。10.1104 / pp.104.041483。
- 11.
祁喆,中川Y,井田H, Sokabe M:一种机械敏感阴离子通道拟南芥叶肉细胞。中国生物医学工程学报,2004,34(4):344 - 344。10.1093 /卡式肺囊虫肺炎/ pch194。
- 12.
Telewski FW:植物机械知觉的统一假设。机械工程学报,2006,29(3):344 - 344。10.3732 / ajb.93.10.1466。
- 13.
Haswell ES, Peyronnet R, Barbier-Brygoo H, Meyerowitz EM, Frachisse JM:两种MscS同源物在MscS中提供机械敏感通道活性拟南芥根。动物学报,2008,18:730-734。10.1016 / j.cub.2008.04.039。
- 14.
裴龙平,王晓明,王晓明,等。拟南芥根质膜张力传感器的研究进展。植物信号与行为学报,2008,3:726-729。10.4161 / psb.3.9.6487。
- 15.
中川Y、片尻T、筱崎K、齐Z、达美H、古路一T、岸神A、粟部M、小岛I、佐藤S、加藤T、塔田S、饭田K、寺岛A、中野M、池田M、山中T、饭田H:拟南芥质膜蛋白对钙含量至关重要2 +根的内流和触摸感应。美国国家科学研究院。2007, 30(4): 339 - 344。10.1073 / pnas.0607703104。
- 16.
山中T,中川Y,森K,中野M, Imamura T,片冈H,寺岛A,饭田K,小岛I, Katagiri T,筱崎K,饭田H:介导Ca的MCA1和MCA22 +摄取在拟南芥中具有不同且重叠的作用。中国生物医学工程学报,2010,29(4):344 - 344。10.1104 / pp.109.147371。
- 17.
Zingarelli L, Marré MT, masardi F, Lado P:高渗胁迫对K的影响+通量,H+挤压、跨膜电位差及与杂霉素作用的比较。中国生物医学工程学报,1999,26(3):349 - 349。10.1034 / j.1399-3054.1999.106305.x。
- 18.
渗透胁迫过程中活性氧产生的调控拟南芥培养细胞:涉及质膜钙2 +- atp酶和H+腺苷三磷酸酶。中国生物医学工程学报,2005,29(4):349 - 349。10.1093 /卡式肺囊虫肺炎/ pci142。
- 19.
Rouet MA, Mathieu Y, Barbier-Brygoo H, Laurière C:烟草和拟南芥细胞悬液中活性氧产生蛋白对低渗反应的特性:细胞壁过氧化物酶的鉴定。应用物理学报,2006,29(3):344 - 344。10.1093 / jxb / erj107。
- 20.
林T,原田A,酒井T,高木S: Ca2 +拟南芥叶片胞外渗透压变化诱导的瞬态:细胞壁-质膜粘附的差异参与。植物细胞环境学报,2006,29:661-672。10.1111 / j.1365-3040.2005.01447.x。
- 21.
叶片运动细胞的渗透调节。中国农业科学,2007,27(4):457 - 457。10.1016 / j.febslet.2007.04.002。
- 22.
Cazalé AC, Rouet-Mayer MA, Barbier-Brygoo H, Mathieu Y, Laurière C:烟草细胞悬浮液的氧化爆发和低渗透压胁迫。植物科学学报,1998,16(3):359 - 369。10.1104 / pp.116.2.659。
- 23.
Kaku H, Nishizawa Y, Ishii-Minami N, Akimoto-Tomiyama C, Dohmae N, Takio K, Minami E, Shibuya N:植物细胞通过质膜受体识别甲壳素片段作为防御信号。美国国家科学研究院。2006, 30(4): 344 - 344。10.1073 / pnas.0508882103。
- 24.
Miya A, Albert P, Shinya T, Desaki Y, Ichimura K, Shirasu K, Narusaka Y, Kawakami N, Kaku H, Shibuya N: CERK1,一种LysM受体激酶,在几丁质激发子信号传导中至关重要拟南芥.美国国家科学研究院。2007, 44(1): 1 - 4。10.1073 / pnas.0705147104。
- 25.
Trewavas A, Knight M:机械信号,钙和植物形态。植物化学学报,1994,26:1329-1341。10.1007 / BF00016478。
- 26.
季晓敏,Raveendran M, Oane R, Ismail A, Lafitte R, Bruskiewich R,程晨,Bennett J:水稻细胞壁转化酶基因在开花时的组织特异性表达及干旱响应性。中国生物医学工程学报,2005,29(4):344 - 344。10.1007 / s11103 - 005 - 2415 - 8。
- 27.
王志刚,王志刚,王志刚:植物适应蛇形土壤的进化生态学研究。环境科学学报,2005,36(3):344 - 344。10.1146 / annurev.ecolsys.35.021103.105730。
- 28.
Ogasawara Y, Kaya H, Hiraoka G, Yumoto F, Kimura S, Kadota Y, Hishinuma H, Senzaki E, Yamagoe S, Nagata K, Nara M, Suzuki K, Tanokura M, Kuchitsu K: Ca对拟南芥NADPH氧化酶AtrbohD的协同激活2 +和磷酸化。中国生物医学工程学报,2008,29(3):344 - 344。10.1074 / jbc.M708106200。
- 29.
Takeda S, Gapper C, Kaya H, Bell E, Kuchitsu K, Dolan L:根毛细胞的局部正反馈调控决定细胞形状。科学通报,2008,39(4):344 - 344。10.1126 / science.1152505。
- 30.
Kimura S, Kaya H, Kawarazaki T, Hiraoka G, Senzaki E, Michikawa M, Kuchitsu K:蛋白质磷酸化是Ca的先决条件2 +依赖激活拟南芥NADPH氧化酶可能是Ca正反馈调控的触发因子2 +还有活性氧。生物化学学报,2011,27(3):388 - 388。
- 31.
Monshausen GB, Bibikova TN, Weisenseel MH, Gilroy S: Ca2 +调节拟南芥根系机械感应过程中活性氧的产生和pH值。植物学报,2009,21:2341-2356。10.1105 / tpc.109.068395。
- 32.
Kurusu T, Yagala T, Miyao A, Hirochika H, Kuchitsu K:一种推定电压门控Ca的鉴定2 +通道作为水稻中诱导超敏细胞死亡和丝裂原活化蛋白激酶活化的关键调节因子。植物学报,2005,29(4):344 - 344。10.1111 / j.1365 - 313 x.2005.02415.x。
- 33.
Murashige T, Skoog F:烟草组织培养快速生长和生物测定的修订培养基。中国生物医学工程学报,2004,27(3):344 - 344。10.1111 / j.1399-3054.1962.tb08052.x。
- 34.
久chitsu K菊山M涩谷N:N-乙酰壳寡糖,植物抗毒素生产的生物激发子,诱导悬浮培养水稻细胞的瞬时膜去极化。中国生物工程学报,1994,27(4):489 - 497。10.1007 / BF01404046。
- 35.
小岛S,高桥Y,小林Y,蒙娜L,佐佐木T,荒木T,矢野M:Hd3a拟南芥的一种水稻同源植物英国《金融时报》基因,促进开花下游的转录即在短日照条件下。植物生理学报,2002,29(4):344 - 344。10.1093 /卡式肺囊虫肺炎/ pcf156。
- 36.
Kurusu T, Hamada J, Nokajima H, Kitagawa Y, Kiyoduka M, Takahashi A, Hanamata S, Ohno R, Hayashi T, Okada K, Koga J, Hirochika H, Yamane H, Kuchitsu K:钙调磷酸酶b样蛋白相互作用蛋白激酶,OsCIPK14/15调控水稻培养细胞中微生物相关分子模式诱导的超敏细胞死亡、植物抗毒素产生和防御基因表达。中国生物医学工程学报,2010,29(3):344 - 344。10.1104 / pp.109.151852。
- 37.
杨晓明,杨晓明,Inzé D,杨晓明。农杆菌介导植物转化的研究进展。植物科学进展,2002,7:193-195。10.1016 / s1360 - 1385(02) 02251 - 3。
- 38.
杨晓明,王晓明,王晓明:水稻基因功能稳定和短暂抑制的简单RNAi载体。植物生理学报,2004,45:489 -495。10.1093 /卡式肺囊虫肺炎/ pch048。
- 39.
田中H, Kayano T, Ugaki M, Shiobara F, Onodera H, Ono K, Tagiri A, Nishizawa Y, Shibuya N:单子叶植物的超快速转化技术。国际专利申请,2001,No。Wo 01/06844 a1
- 40.
Fuse T, Sasaki T, Yano M:用于水稻基因功能分析的ti质粒载体。植物学报,2001,18:219-222。10.5511 / plantbiotechnology.18.219。
- 41.
Knight MR, Campbell AK, Smith SM, Trewavas AJ:转基因植物aequorin报告了触摸和冷休克及其激发子对细胞质钙的影响。自然科学学报,1997,26(4):524-526。10.1038 / 352524 a0。
- 42.
Igasaki T,石田Y, Mohri T,市川H,筱原K:转化杨树阿尔巴并直接选择除草剂双阿拉福的转化子。FFPRI公报。2002, 1: 235-240。
- 43.
An G:烟草细胞的高效转化。中国农业科学,2004,27(4):457 - 457。10.1104 / pp.79.2.568。
- 44.
Kurusu T, Hamada H, Sugiyama Y, Yagala T, Kadota Y, Furuichi T, Hayashi T, Umemura K, Komatsu S, MIyao A, Hirochika H, Kuchitsu K:微生物相关分子模式诱导胞质Ca的负反馈调控2 +瞬时蛋白质磷酸化。植物科学学报,2011,29(4):344 - 344。10.1007 / s10265 - 010 - 0388 - 4。
- 45.
饭田,Yagawa Y, Anraku Y: Ca诱导的重要作用2 +[Ca .2 +]我在交配信息素反应通路后期维持酵母细胞活力的上升。对[Ca2 +]我在单酿酒酵母fura-2成像细胞。中国生物医学工程学报,2000,26(4):457 - 457。
- 46.
张晓东,李志强,李志强,李志强,等。水稻钙调神经磷酸酶b样蛋白互作蛋白激酶在植物先天免疫中的作用。植物生态学报,2010,30(4):344 - 344。10.4161 / psb.5.8.12407。
确认
我们要感谢樱井康弘先生提供的技术援助。Hiroaki Shimada和Tadamasa Sasaki提供了有用的技术建议。三木大辅和岛本子RNAi质粒(pANDA载体),和涩谷直人博士为礼物N-acethylchitoheptaose。
本工作部分由教育、文化、体育、科学技术省创新领域科学研究(21200067)资助TK,探索研究(21658118)资助KK,青年科学家(B)(21780041)资助TK,优先领域科学研究(21026009)资助HI,科学研究B(19370023)资助KK和(21370017)资助HI,以及日本科学技术厅的资助。通过目标驱动研发(AS221Z03504E)向TK提供适应性和无缝技术转移计划,并为CREST向HI和KK提供技术转移计划。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
TK, DN和YY进行了大部分的实验和数据分析。TK和KK设计了研究并撰写了手稿。DN、YY、MG参与共焦成像分析。MN、TY、KI对Ca2 +酵母吸收实验。HH和HS参与了转基因系的构建和PCR分析。YN, KS, HI参与了研究的设计,并对手稿进行了批判性的修改。所有作者都阅读并批准了最终的手稿。
Takamitsu Kurusu, Daisuke Nishikawa, Yukari Yamazaki对这项工作做出了同样的贡献。
电子辅助材料
12870 _2011_994_moesm1_esm.pdf
附加文件1:利用Clustal w对水稻OsMCA1和拟南芥MCA1和MCA2的多氨基酸序列进行比对。星号表示在比对中整个序列中有相同或保守的残基。冒号表示保守替换。圆点表示半守恒替换。浅灰色方框和深灰色方框分别表示PLAC8主题和卷曲线圈主题。两个假定的跨膜段(S1和S2)被划线。(pdf 511kb)
表达
附加文件2:OsMCA1水稻组织中的基因.的表达式OsMCA1采用定量RT-PCR法测定。从水稻植株各组织及培养细胞中提取总RNA。数量OsMCA1从RT-PCR对数线性范围内的阈值点计算mRNA。相对OsMCA1培养细胞mRNA水平标准化为1。数据为均值±标准差;N = 2-3个独立样本。(pdf 52 kb)
生长表型
附加文件3:OsMCA1-抑制的幼苗在MS培养基中.根茎长度的控制线(20-5)和OsMCA1在长日条件(光照16小时/黑暗8小时,28℃)下,在生长室中MS培养基上生长10日龄幼苗的-抑制系(20-2和38-5)。数据为均值±标准差;N = 7-10株独立苗。(pdf 40kb)
NADPH氧化酶抑制剂对低渗透休克诱导ROS生成的影响
附加文件4:。H2O2用铁氰化物催化发光氨氧化法测定细胞外培养基中的浓度。二苯碘(DPI;10 μM)在低渗透休克处理前30 min加入水稻细胞。数据为野生型5个独立实验的平均值±标准差。***P< 0.005;与对照组相比有显著差异。(pdf 38kb)
水杨酸羟肟酸,一种过氧化物酶抑制剂,对低渗透休克诱导的ROS生成的影响
附加文件5:。浓度•O2-用MCLA化学发光法测定细胞外培养基中的含量。水杨酸羟肟酸;在低渗透休克处理前30 min,在水稻细胞中加入3 mM)。野生型三个独立实验的平均值和SE。(pdf 30kb)
的影响
附加文件6:OsMCA1-在低渗透休克诱导的ROS生成中的过表达.H2O2用铁氰化物催化发光氨氧化法测定细胞外介质中的浓度。作为低渗透冲击,生长培养基在0分钟被稀释三倍的培养基所取代。数据为两个对照线四次独立实验的平均值±SE(开圈为GUS No. 11;GUS 7号为开放三角形)和两条过表达线(OX 2号为封闭菱形;为3号牛的封闭方)。*P< 0.05,与GUS 7号和11号对照有显著性差异。(pdf 77 kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
Kurusu, T,西川,D,山崎,Y。et al。质膜蛋白OsMCA1参与低渗透休克诱导钙的调控2 +水稻培养细胞中活性氧的流入和调节。BMC植物生物学12,11(2012)。https://doi.org/10.1186/1471-2229-12-11
收到了:
接受:
发表:
关键字
- 活性氧生成
- LaCl3
- GdCl3
- 透水通道
- Mechanosensitive通道