- 研究文章G.ydF4y2Ba
- 开放访问G.ydF4y2Ba
- 发布:G.ydF4y2Ba
苹果果实多酚成分的QTL定位及候选基因定位G.ydF4y2Ba
BMC植物生物学G.ydF4y2Ba体积G.ydF4y2Ba12G.ydF4y2Ba文章编号:G.ydF4y2Ba12G.ydF4y2Ba(G.ydF4y2Ba2012G.ydF4y2Ba)G.ydF4y2Ba
摘要G.ydF4y2Ba
背景G.ydF4y2Ba
苯丙醇丙烷途径的多酚产物,包括花青素,花青素和黄酮醇,具有可提供健康益处的抗氧化性能。为了研究苹果果实中生物合成的遗传结构,各种多酚化合物在后代从“皇家佳拉”×'Braeburn'苹果群体分离用于抗氧化含量,采用果皮提取物的超高效液相色谱法和皮肤。G.ydF4y2Ba
结果G.ydF4y2Ba
“皇家嘎拉”和“Braeburn”的遗传地图构建,使能检测79个定量性状基因座(QTL)的17种果实多酚化合物的含量。七个QTL集群在两年的收获中稳定,包括黄黄酮,黄酮醇,花青素和羟基氨基酸含量的QTL。父母遗传图与苹果全基因组序列的对齐G.ydF4y2Ba在Silico.G.ydF4y2Ba使能筛选与多酚类生物合成途径中酶编码的一系列候选基因的QTL进行共析。通过衍生自基因序列的标记的遗传映射来确认该共同位置。G.ydF4y2Baleucoanthocyanidin还原酶G.ydF4y2Ba(G.ydF4y2BaLAR1G.ydF4y2Ba)与水果黄酮的QTL簇共同定位,用于果皮,ProCyanidin二聚体和五个未知的Procyanidin寡聚蛋白,靠近连杆组(LG)16的顶部,同时G.ydF4y2Ba羟基肉桂/ Quinate转移酶G.ydF4y2Ba(G.ydF4y2BaHCTG.ydF4y2Ba/G.ydF4y2BaHQT.G.ydF4y2Ba)与lg17底部附近绿原酸浓度定位的QTL共定位。G.ydF4y2Ba
结论G.ydF4y2Ba
我们得出这样的结论:G.ydF4y2BaLAR1G.ydF4y2Ba和G.ydF4y2BaHCTG.ydF4y2Ba/G.ydF4y2BaHQT.G.ydF4y2Ba可能会影响苹果果实中这些化合物的浓度,并提供有用的等位基因特异性标记,用于标记有含有健康属性的树木的标记辅助选择。G.ydF4y2Ba
背景G.ydF4y2Ba
营养学家建议多吃水果和蔬菜,因为水果和蔬菜是纤维、微量营养素和抗氧化化合物等对人体健康有益的膳食化合物的来源。G.ydF4y2Ba1G.ydF4y2Ba].苹果(G.ydF4y2Ba马鲁斯G.ydF4y2BaX.G.ydF4y2Ba家庭G.ydF4y2Ba)被认为是健康饮食的一部分,总热量非常低,膳食纤维的良好来源(2克新鲜水果/100克)[G.ydF4y2Ba2G.ydF4y2Ba那G.ydF4y2Ba3.G.ydF4y2Ba].虽然苹果在维生素C中比其他水果低(5-25mg / 100g,取决于品种[G.ydF4y2Ba4.G.ydF4y2Ba),它们有非常高浓度的其他抗氧化植物化学物质,特别是多酚化合物,如槲皮素、表儿茶素和原花青素聚合物[G.ydF4y2Ba2G.ydF4y2Ba那G.ydF4y2Ba5.G.ydF4y2Ba那G.ydF4y2Ba6.G.ydF4y2Ba].G.ydF4y2Ba
大量流行病学研究表明,多酚化合物可预防退行性疾病,如上皮性(但与激素无关)癌症、心血管疾病、2型糖尿病、血栓性中风、肥胖、与衰老和感染相关的神经退行性疾病[G.ydF4y2Ba7.G.ydF4y2Ba].虽然已经研究了多酚化合物的抗氧化性能,但现在的特征很好G.ydF4y2Ba在体外G.ydF4y2Ba,最近的研究强调,多酚的生物作用机制已超出其抗氧化特性[G.ydF4y2Ba8.G.ydF4y2Ba].现在据信,多酚可以通过调节基因表达和各种酶和细胞受体的活性来发挥其有益作用[G.ydF4y2Ba9.G.ydF4y2Ba那G.ydF4y2Ba10G.ydF4y2Ba].然而,膳食多酚的健康效果取决于所消耗的量和生物利用度。以前的研究表明,多酚的生物利用度与其化学结构有关[G.ydF4y2Ba11G.ydF4y2Ba].例如,糖缀合物和酚醛糖苷酮的性质对于花青素吸收和排泄都很重要。G.ydF4y2Ba
已经在高等植物中鉴定了具有多酚结构的几千种化合物[G.ydF4y2Ba12G.ydF4y2Ba那G.ydF4y2Ba13G.ydF4y2Ba].这些化合物是通过病原体或紫外线辐射来防御侵略的次生代谢物。植物中最重要的多酚是黄酮类化合物,酚醛酸,木质素和斯蒂芬。类黄酮基团可以细分为七个亚组:黄酮醇,黄酮,异黄酮,黄烷醇,黄酮酮,花青素和二羟基葡萄酒,其中黄酮醇,黄烷醇,花青素和二羟基葡萄酒在苹果中发现[G.ydF4y2Ba14G.ydF4y2Ba].黄酮醇的主要代表,槲皮素和山酚,以糖基化形式存在,相关的糖部分通常是葡萄糖或鼠李糖。黄烷醇没有糖基化,以单体形式(儿茶素)和聚合物形式(原花青素或缩合单宁)存在。儿茶素和表儿茶素是水果中主要的黄烷醇,也是二聚体、低聚体和聚合物原花青素的组成部分。花青素色素溶解在通常的空泡的sap水果的表皮组织中存在一系列的化学形式,是蓝色的,红色的,紫色的,粉红色或无色根据博士他们是高度不稳定的苷配基,在植物中发现糖基化的形式是稳定的光下,pH值和氧化条件。花青素和天竺葵苷是食品中最常见的花青素。最后,二氢查尔酮是双环类黄酮的一个家族,由两个由三碳桥连接的苯环定义。苹果的果实中含有一种二氢查尔酮类的花叶苷[G.ydF4y2Ba14G.ydF4y2Ba].G.ydF4y2Ba
可以区分两类酚酸:苯甲酸的衍生物,以及肉桂酸的衍生物。这些酸在植物中发现自由和酯化的糖或其他有机酸[G.ydF4y2Ba15G.ydF4y2Ba].羟基肉桂酸比羟基苯甲酸多见,与羟基肉桂酸类的存在的主要化合物G.ydF4y2BaP.G.ydF4y2Ba香豆酸,咖啡酸和绿原酸。羟基苯甲酸和羟基肉桂酸也是复杂结构的组成成分,如水解单宁(没食子酸和鞣花单宁)和木质素。G.ydF4y2Ba
多酚含量和身份可以根据水果中的位置(例如皮质v.皮质),果实成熟阶段,植物结构中水果的位置和收获的时间内的位置变化。果实多酚浓度在苹果品种中变化[G.ydF4y2Ba2G.ydF4y2Ba],使这个角色成为潜在的育种目标。然而,目前的苹果育种计划强调外观(肤色,果实的果实,含有颜色,尺寸和形状的水果),吃质量(味道和质地)和储存能力。害虫和疾病抗性的育种是第二个主要目标[G.ydF4y2Ba16G.ydF4y2Ba].尽管健康的营养素化合物来自苹果和其他水果,但我们并不知道苹果的繁殖计划包括植物化学性质和抗氧化含量。因此,遗传映射研究侧重于果实质量和抗病性,只有少数人涉及苹果植物化学含量。对维生素C的定量性状基因座(QTL)已被确定在分析“Telamon”×'Braeburn'隔离人群[G.ydF4y2Ba4.G.ydF4y2Ba],苹果果肉花青素含量的一个主要位点已被定位到连锁群(LG) 9 [G.ydF4y2Ba17G.ydF4y2Ba].该基因座的表达已经表征为受到控制的特征G.ydF4y2BaMYB10G.ydF4y2Ba[G.ydF4y2Ba18G.ydF4y2Ba那G.ydF4y2Ba19G.ydF4y2Ba].G.ydF4y2Ba
本研究分析了使用隔离F的果实多酚浓度的遗传控制G.ydF4y2Ba1G.ydF4y2Ba从苹果品种“Royal Gala”和“Braeburn”的杂交中获得的群体,以及来自苹果全基因组序列的信息(Velasco et al. 2010)。定量性状位点(quantitative trait loci, QTL)确定后,通过基因组测序和遗传作图确定了参与多酚化合物合成的酶的候选基因。根据我们的研究结果,我们认为G.ydF4y2BaLAR1G.ydF4y2Ba是水果皮层和皮肤中黄黄醇浓度变异的可能原因,以及类似的变化G.ydF4y2BaHQT / HCTG.ydF4y2Ba可能导致绿原酸的变化。G.ydF4y2Ba
结果G.ydF4y2Ba
uhplc在“皇家嘎拉”×'braeburn'隔离人群中的苹果多酚分析G.ydF4y2Ba
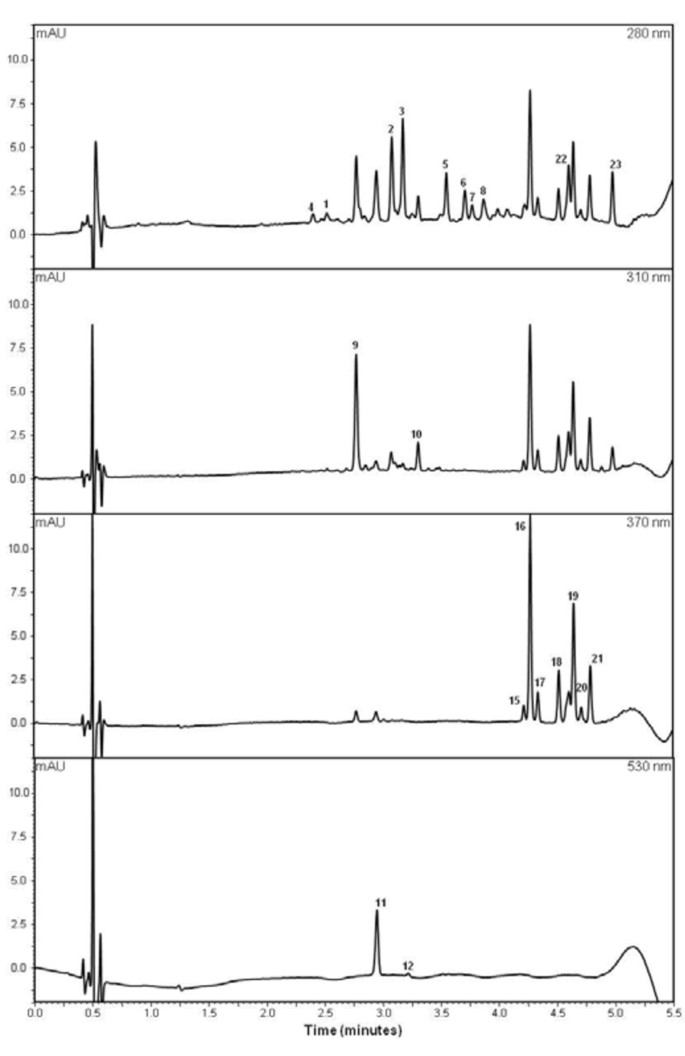
在2008年和2010年使用超高效液相色谱(UHPLC)分析了“皇家Gala'×Braeburn”分离群体的果实(图G.ydF4y2Ba1G.ydF4y2Ba).二十三个化合物与可变浓度在2010年苹果果实皮质和皮肤样本和16种化合物在2008年进行定量(表G.ydF4y2Ba1G.ydF4y2Ba).根据化合物和组织的各种化合物的浓度变化。对所有23种化合物观察到的最小浓度低于仪器的检测限。G.ydF4y2Ba
黄酮酚G.ydF4y2Ba
槲皮苷是苹果中唯一检测到的黄酮醇。槲皮素苷主要有七种:槲皮素3-G.ydF4y2BaO.G.ydF4y2Ba-rutinoside,槲皮素3-G.ydF4y2BaO.G.ydF4y2Ba半乳糖苷,槲皮素3 -G.ydF4y2BaO.G.ydF4y2Ba- 葡萄糖苷,槲皮素3-G.ydF4y2BaO.G.ydF4y2Ba-xyloside,槲皮素-3-G.ydF4y2BaO.G.ydF4y2Ba-Arabinopyranoside,槲皮素3-G.ydF4y2BaO.G.ydF4y2Ba-阿拉伯呋喃糖苷和槲皮素3-G.ydF4y2BaO.G.ydF4y2Ba-rhamnoside。最浓缩的黄酮是槲皮素3-G.ydF4y2BaO.G.ydF4y2Ba-Galactoside。仅为两颗体检测到槲皮素糖苷酮,其中一个在果皮中,另一种在皮质中。黄酮醇占果皮;然而,在皮质中几乎没有或未检测到这些内容(表G.ydF4y2Ba1G.ydF4y2Ba).2008年和2010年的水果之间的相关性来自G.ydF4y2BaR.G.ydF4y2Ba2G.ydF4y2Ba= 0.14至G.ydF4y2BaR.G.ydF4y2Ba2G.ydF4y2Ba= 0.38,槲皮素3-没有相关性G.ydF4y2BaO.G.ydF4y2Ba年之间的木糖苷。皮肤黄酮醇之间高度相关,并与皮肤中存在的其他多酚化合物(如花青素、黄烷醇和二氢查尔酮)呈中到高相关性G.ydF4y2Ba1G.ydF4y2Ba;表S1)。在2008年和2010年,所有黄酮醇化合物在“Royal Gala”דBraeburn”分离种群中均表现出倾斜表型分布G.ydF4y2Ba2G.ydF4y2Ba;图S1)。G.ydF4y2Ba
黄黄烷醇G.ydF4y2Ba
八种黄烷醇化合物代表了皮肤和皮质中的第二类化合物。三种被鉴定为儿茶素,原霉素B2和EpicateChin。五种化合物匹配的原霉素光谱,被认为是未知的原霉素寡聚体。EPICATECHIN是皮肤和皮质中具有最高浓度的化合物,其次是Procyanidin B2。岁月间的黄烷醇浓度的相关性是中等(G.ydF4y2BaR.G.ydF4y2Ba2G.ydF4y2Ba= 0.32的皮肤儿茶素)至高(G.ydF4y2BaR.G.ydF4y2Ba2G.ydF4y2Ba皮质儿茶素= 0.69)。黄黄烷醇在皮质和皮肤内部和皮质和皮肤之间的皮质和皮肤之间的高度相关,皮肤肌肤。除了皮质Procyanidin B2和未知的草原蛋白2和3,均在“皇家佳拉”×'Braeburn's Scregating群体中展示了偏斜分布。G.ydF4y2Ba
花青素G.ydF4y2Ba
鉴定出四种花青素苷:花青素3-G.ydF4y2BaO.G.ydF4y2Ba-Galactoside,Cyanidin 3-G.ydF4y2BaO.G.ydF4y2Ba-阿拉伯糖苷和两种未知的花青素。花青素在果皮中占主导地位,而在‘Royal Gala’בBraeburn’种群的果实皮层中几乎不存在。花青素3-的年相关性G.ydF4y2BaO.G.ydF4y2Ba-Arabinoside和Cyanidin 3-G.ydF4y2BaO.G.ydF4y2Ba-半乳糖苷含量中高(G.ydF4y2BaR.G.ydF4y2Ba2G.ydF4y2Ba= 0.27且G.ydF4y2BaR.G.ydF4y2Ba2G.ydF4y2Ba= 0.54分别)。Cyanidin 3-G.ydF4y2BaO.G.ydF4y2Ba-半乳糖与黄烷醇呈中间相关(G.ydF4y2BaR.G.ydF4y2Ba2G.ydF4y2Ba= 0.45与槲皮素3-G.ydF4y2BaO.G.ydF4y2Ba- 皮肤中的 - 高烷烃和黄酮化合物(G.ydF4y2BaR.G.ydF4y2Ba2G.ydF4y2Ba= 0.26与表儿茶素)。所有花青素化合物在分离群体中均呈偏态分布。G.ydF4y2Ba
羟基氨基酸G.ydF4y2Ba
绿原酸(3-G.ydF4y2BaO.G.ydF4y2Ba-Caffeyl氨基酸)和G.ydF4y2BaP.G.ydF4y2Ba-香豆素奎宁酸在苹果皮和皮层中均有发现。虽然总羟基肉桂酸只占皮肤总多酚谱的一小部分,但它们在果实皮层中占主要组,其中绿原酸占皮层中检测到的所有多酚的近40%。除了皮肤以外,这两种化合物的年龄相关性都很高G.ydF4y2BaP.G.ydF4y2Ba-coumaroyl氨基酸(G.ydF4y2BaR.G.ydF4y2Ba2G.ydF4y2Ba= 0.32)。绿原酸和G.ydF4y2BaP.G.ydF4y2Ba-香豆素奎尼酸在“Royal Gala”דBraeburn”分离种群的皮肤和皮层中均呈偏斜分布。G.ydF4y2Ba
DihydrochalconesG.ydF4y2Ba
Phloridzin和Phloridzin-Xyloside是苹果皮肤和皮质中唯一发现的二羟基酮。两年为两种化合物的相关性低至中等(G.ydF4y2BaR.G.ydF4y2Ba2G.ydF4y2Ba= 0.08G.ydF4y2BaR.G.ydF4y2Ba2G.ydF4y2Ba= 0.41)。皮肤根皮苷和根皮素木糖甙与两个皮肤黄烷醇和黄酮类化合物有关。所有的皮肤和皮质二氢查耳酮展出的分离群体偏态分布。G.ydF4y2Ba
遗传地图结构和QTL分析G.ydF4y2Ba
共有951个单核苷酸多态性(SNP)标记,最初从“金美味”发展到基因锚定“金美味”苹果基因组序列[G.ydF4y2Ba20.G.ydF4y2Ba采用20个SNPlex™检测方法,对“Royal Gala”דBraeburn”分离群体的590个个体进行基因分型。在这些SNP标记中,511个(53.7%)是多态性的,158个(16.6%)是失败的,282个(29.6%)是单形的。利用苹果多酚类化合物表型的170个个体,构建了两亲本的遗传图谱。118个SNP标记的子集构建了一个“Braeburn”遗传图谱,标记分布尽可能均匀,且倾向回交型标记(G.ydF4y2Baab×aa.G.ydF4y2Ba)以上更少的信息性交互标记(G.ydF4y2Baab×ab.G.ydF4y2Ba).该地图的累计距离为1004.8 cM,覆盖了所有17个LGs,平均每8.5 cM有一个标记,最大间距为32.5 cMG.ydF4y2Ba3.G.ydF4y2Ba;图S2)。一个连杆组(LG 7)仅跨越4.1厘米,只有三个标记。九十六个标记是回复类型(G.ydF4y2Baab×aa.G.ydF4y2Ba), 22例为交叉型(G.ydF4y2Baab×ab.G.ydF4y2Ba).使用与“Braeburn”地图的类似分布和分离类型标准,使用了132个SNP标记的子集来构建“Royal Gala”遗传地图;这些中的129个是回复型,3个是较少的信息交互类型。“皇家加拉”遗传地图的累积遗传尺寸为863.9厘米,覆盖所有17升,平均每67厘米和最大间隙为31.3厘米。G.ydF4y2Ba
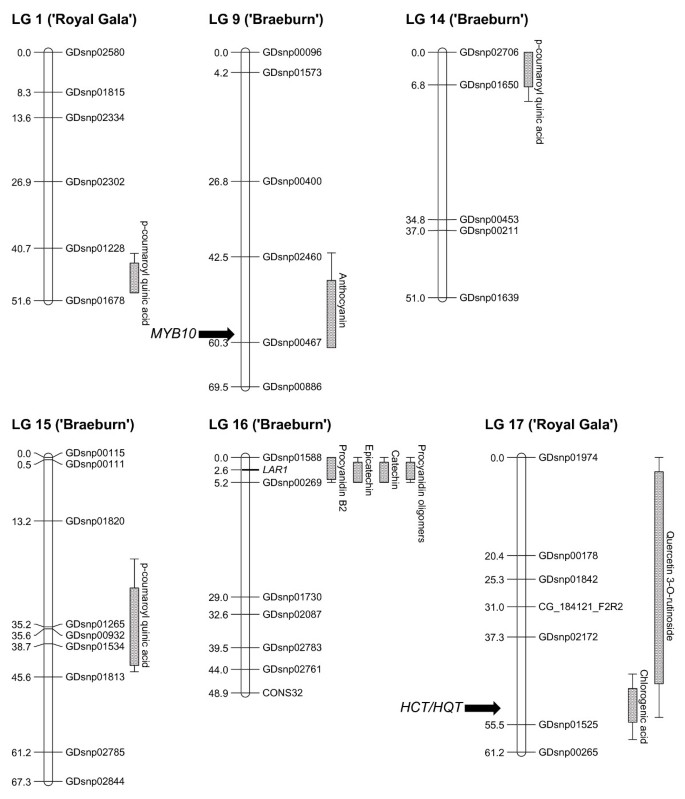
通过多重QTL (multiple QTL, MQM)分析,共检测到17个化合物的79个QTLG.ydF4y2Ba2G.ydF4y2BaA),可解释的基因型变异范围从5%到71.8%。采用Kruskal-Wallis检验法检测了4个原花青素B2和2个未知原花青素低聚物的qtlG.ydF4y2Ba2G.ydF4y2Bab)。在“Royal Gala”和“Braeburn”地图上检测到四十一和38个QTL。最大的QTL集群位于LG 16的顶部,其中在两个父母映射上对同一区域内的黄烷醇化合物检测到42个QTL。发现七集群,QTL之间稳定年份和课程(图)G.ydF4y2Ba2G.ydF4y2Ba),包括:槲皮素3-G.ydF4y2BaO.G.ydF4y2Ba- 在LG 17上的“皇家佳拉”的果皮中的蛋黄酱;Cyanidin 3-G.ydF4y2BaO.G.ydF4y2Ba半乳糖苷和矢车菊3-G.ydF4y2BaO.G.ydF4y2Ba-arabinoside在水果表皮父母双方对LG 9;所有八个测量黄烷醇的水果皮和皮层父母双方对LG 16;绿原酸在水果表皮和皮层对LG 17“皇家嘎拉”;G.ydF4y2BaP.G.ydF4y2Ba-Coumaroyl氨基酸在水果皮层中为“Braeburn”的LG 15;G.ydF4y2BaP.G.ydF4y2Ba-香豆素奎尼酸在水果皮和皮质“皇家盛会”LG 1;G.ydF4y2BaP.G.ydF4y2Ba-coumaroyl醋酸在LG 14上父母的果皮和皮质。在单个年份的一系列化合物上检测到其他QTL,但在一系列的化合物上检测到一系列化合物。G.ydF4y2Ba
候选基因与qtl共定位G.ydF4y2Ba
基于参与多酚生物合成途径的候选基因预测(附加文件)G.ydF4y2Ba4.G.ydF4y2Ba;图S3)通过BLASTN分析,对“Golden Delicious”全基因组序列进行生物信息学定位(表3)G.ydF4y2Ba3.G.ydF4y2Ba).G.ydF4y2Ba
3个候选基因与相应化合物浓度相关的QTL簇共定位。一个假定的G.ydF4y2Ba羟基肉桂酸酯转移酶/羟基Quinate转移酶G.ydF4y2Ba(G.ydF4y2BaHCT / HQT.G.ydF4y2Ba)位于lg17的底部附近,有一个稳定的绿原酸QTL。LG 17上预测的苹果HCT和HQT蛋白(MDP0000307780)与朝鲜蓟HCT(86%)和HQT1(97%)高度相似[G.ydF4y2Ba21.G.ydF4y2Ba]分别。G.ydF4y2Ba白藻胺蛋白还原酶1G.ydF4y2Ba(G.ydF4y2BaLAR1G.ydF4y2Ba) [G.ydF4y2Ba22.G.ydF4y2Ba]位于lg16的顶端,与黄烷醇的qtl群共位。5个位置相同的预测基因模型的序列相似性显著G.ydF4y2BaLAR1G.ydF4y2Ba在这个基因组区域。从这两种基因序列中开发了PCR引物G.ydF4y2BaLAR1G.ydF4y2Ba和G.ydF4y2BaHCTG.ydF4y2Ba/G.ydF4y2BaHQT.G.ydF4y2Ba,使候选者能够相对于相应的QTL遗传地映射。G.ydF4y2Ba花青素合成酶G.ydF4y2Ba(G.ydF4y2BaANS.G.ydF4y2Ba),位于“Braeburn”的QTL中的LG 6上G.ydF4y2BaP.G.ydF4y2Ba-coumaroyl醋酸在果皮中,仅在2008年发现。G.ydF4y2Ba
七个候选基因定位在没有相关QTL的联系基团上:G.ydF4y2BaPAL,F3H,ANR,FLS,C4H,4CLG.ydF4y2Ba和G.ydF4y2BaDFR.G.ydF4y2Ba.候选基因中的八个定位在检测到一些QTL的联动组上;然而,这些候选基因中的大多数未定位在QTL间隔内,或者如果它们共同定位在候选基因之间没有明显的功能性生物合成途径相关性,并且鉴定了QTL的化合物。G.ydF4y2Ba
高分辨率熔融(HRM)基于遗传标记G.ydF4y2BaHCT / HQT.G.ydF4y2Ba映射在“Braeburn”父母地图的LG 17底部。因此,QTL间隔内的候选基因的位置基于“Braeburn”地图与“皇家佳拉”地图的对齐(附加文件G.ydF4y2Ba3.G.ydF4y2Ba;图S2)。G.ydF4y2Ba
基于HRM的遗传标记G.ydF4y2BaLAR1G.ydF4y2Ba映射在LG 16的顶部是完全信息性的,隔离G.ydF4y2Ba英孚G.ydF4y2BaX.G.ydF4y2Ba如G.ydF4y2Ba,并且可以在父母地图中使用它用于QTL检测。该多晶型标记物的PCR引物位于第四个内含子G.ydF4y2BaLAR1G.ydF4y2Ba.该标记对于父母地图中的所有八种黄烷醇化合物具有最高的LOD分数(表G.ydF4y2Ba2G.ydF4y2Baa)。MQM分析G.ydF4y2BaLAR1G.ydF4y2Ba作为辅助因子揭示了LG 16区域内或其他地方在基因组中没有其他的QTL。当G.ydF4y2BaF.G.ydF4y2Ba和G.ydF4y2BaG.G.ydF4y2Ba“皇家Gala”和“Braeburn”的等位基因分别与浓度的黄黄醇浓度相关。携带纯合的个体G.ydF4y2BaeeG.ydF4y2Ba基因型在果皮中显着较低浓度的黄烷醇化合物,在水果皮层中没有检测到黄黄烷醇(图G.ydF4y2Ba3.G.ydF4y2Ba).G.ydF4y2Ba
进行全面搜索LG 16上的Flavanol QTL簇的1.2 MB基因组区域,以确定除了以外的候选基因G.ydF4y2BaLAR1G.ydF4y2Ba也位于QTL间隔内。总共有93个具有支持cDNA序列的苹果预测基因在LG 16上鉴定在0.8mb至2.0mb之间的0.8mb(附加文件)G.ydF4y2Ba5.G.ydF4y2Ba;图S4)。其中12种可能对多酚生物合成有调节或直接影响(见表)G.ydF4y2Ba4.G.ydF4y2Ba)包括锌手指C2H2,硫代,AP2 Bzip,BHLH,MYBS和MYB相关的转录因子。G.ydF4y2Ba
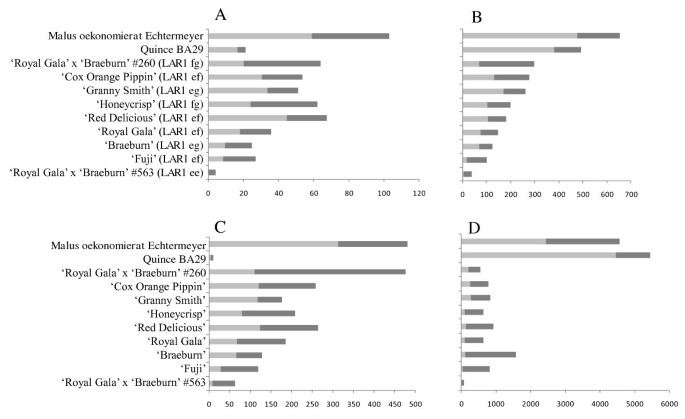
我们比较了‘Royal Gala’בBraeburn’分离群体中个体的黄烷醇含量,以及两个多酚含量极高的近缘物种:温柏和海棠花(图)G.ydF4y2Ba4.G.ydF4y2Ba).Quince(G.ydF4y2Ba榅G.ydF4y2Ba)的表儿茶素含量极低,远低于“Royal Gala”דBraeburn”分离种群中最低成员的表儿茶素含量,而“Royal Gala”דBraeburn”分离种群中最高成员的表儿茶素含量与海棠(G.ydF4y2Ba马吕斯矮牵牛的G.ydF4y2BaOekonomierat echtermeyer.G.ydF4y2Ba'G.ydF4y2Ba).尽管如此,苹果'皇家佳拉'×'braeburn'后代具有不太有利的等位基因G.ydF4y2BaLAR1G.ydF4y2Ba(G.ydF4y2BaeeG.ydF4y2Ba)总是很低。G.ydF4y2Ba
讨论G.ydF4y2Ba
多酚化合物浓度的变异在隔离苹果群中的浓度G.ydF4y2Ba
通过UHPLC分析的二十五次果多酚化合物在“皇家加仑·××'Braeburn”的分离群体中的浓度大大变化,表明育种过程可能会迅速降低营养素化合物的浓度正相关通过选择与人体健康联系带来负相关性状。虽然我们的绘图人口(目前的商业品种)的父母在它们的多酚浓度中适度,但苹果种质存在于远远较高的浓度(图G.ydF4y2Ba4.G.ydF4y2Ba,[G.ydF4y2Ba2G.ydF4y2Ba]),表明通过育种者提高或降低多酚浓度的机会。在2008年至2010年间“皇家晚会”×'Braeburn的群体中的多酚浓度中观察到差异。这些差异可能是由于两年之间的气候条件的变化。G.ydF4y2Ba
用于多酚化合物的QTLG.ydF4y2Ba
我们对“皇家佳拉”×Braeburn'隔离人群的水果中的多酚化合物的QTL的测绘已经很大增加了关于苹果中抗氧化剂含量的遗传建筑的知识体系,以前限于抗坏血酸QTL的映射[G.ydF4y2Ba4.G.ydF4y2Ba],果皮花细胞氰基团[G.ydF4y2Ba23.G.ydF4y2Ba]水果皮质花青素含量的主要基因座[G.ydF4y2Ba17G.ydF4y2Ba].7个QTL在2年收获过程中均保持稳定,共65个QTL均达到极显著水平,其中包括黄烷醇、黄酮醇、花青素和羟基肉桂酸。尽管在2008年或2010年的水果收成中检测到的另外14个推测为控制8种多酚化合物浓度的qtl仍需要验证,它们的数量表明控制苹果果实中有助于人类健康的化合物生物合成的复杂性,并指出了环境和遗传因素的影响。G.ydF4y2Ba
在LG 9的底部被检测为皮肤花青素甲QTL簇,在用于皮肤着色的主要基因座较早映射使用序列特征性扩增区域的区域(SCAR)标记物[G.ydF4y2Ba24.G.ydF4y2Ba那G.ydF4y2Ba25.G.ydF4y2Ba].也有证据表明G.ydF4y2Bamyb1.G.ydF4y2Ba涉及皮肤聚焦[G.ydF4y2Ba23.G.ydF4y2Ba].我们的发现证实了这些观察。G.ydF4y2Ba
用于共同定位的绿原酸的QTL簇G.ydF4y2BaHCT / HQT.G.ydF4y2Ba基因。绿原酸是苹果果皮中最浓缩的多酚化合物,来自“皇家嘎拉”×'Braeburn'分离群体。此外,绿原酸具有强烈的抗氧化活性,这使得苹果的健康益处主要重要。G.ydF4y2BaHCTG.ydF4y2Ba和G.ydF4y2BaHQT.G.ydF4y2Ba已被证明有助于咖啡中绿原酸的合成[G.ydF4y2Ba26.G.ydF4y2Ba]和朝鲜蓟[G.ydF4y2Ba21.G.ydF4y2Ba那G.ydF4y2Ba27.G.ydF4y2Ba].然而,G.ydF4y2BaHCTG.ydF4y2Ba和G.ydF4y2BaHQT.G.ydF4y2Ba苹果中的基因仍有待研究,需要进一步的工作来确认这些基因及其变异的参与,以确定果实中绿原酸的浓度。这包括开发一个G.ydF4y2BaHCTG.ydF4y2Ba/G.ydF4y2BaHQT.G.ydF4y2Ba“皇家佳拉”的标记证实QTL与这种特性有着强烈的联系,并在具有不同浓度的羟基氨基酸的品种果实开发过程中研究这些基因的表达。G.ydF4y2Ba
控制果中儿茶素、表儿茶素、原花青素低聚物和原花青素B2浓度的大效应QTL群与G.ydF4y2BaLAR1G.ydF4y2Ba,编码催化酶的候选基因,该基因催化催化白蒽酸盐转化为CATECHIN,在聚合的原霉素的生物合成途径上游(附加档案G.ydF4y2Ba3.G.ydF4y2Ba;图S2)。编码的十二个基因,用于几个课程的转录因子,可能会调节G.ydF4y2BaLAR1G.ydF4y2Ba也位于该基因组区域内。需要进一步的工作来确定效果是否是基因调节的变化或通过编码的酶的生化功能的变化G.ydF4y2BaLAR1G.ydF4y2Ba.为此,我们已经开始研究模式G.ydF4y2BaLAR1G.ydF4y2Ba极端表型在定位群体和一系列苹果种质资源中的表达。G.ydF4y2BaLAR1G.ydF4y2Ba被证明在水果开发期间以“Crep的红色”的绿色和红色皮肤表达[G.ydF4y2Ba22.G.ydF4y2Ba],具有更高的表达在果实发育的早期阶段。然而,这项研究仅在一种品种中进行。除了G.ydF4y2BaLAR1G.ydF4y2Ba,位于QTL间隔中的转录因子的mRNA表达将在我们的研究中进行。通过碱化的黄烷醇化合物浓度的控制与花青素含量的情况形成鲜明对比,在那里已经证明对照施加在转录水平[G.ydF4y2Ba19G.ydF4y2Ba,通过激活花青素生物合成途径的酶G.ydF4y2BaMYB10G.ydF4y2Ba通过WD40-bHLH-MYB蛋白复合物。我们倾向于假设突变是在启动子区域G.ydF4y2BaLAR1G.ydF4y2Ba在通过调节它的转录因子识别的位点。我们认为,这是可能的变化是没有的功能完全丧失G.ydF4y2BaLAR1G.ydF4y2Ba作为单宁的,因为在植物对生物和非生物压力的反应中具有公认的作用,虽然还有另一种副本G.ydF4y2Ba拉G.ydF4y2Ba基因(G.ydF4y2BaLAR2G.ydF4y2Ba)位于LG13上,它不会与任何Flavanol QTL一起定位。G.ydF4y2Ba
虽然我们的QTL映射研究没有提供明确证明G.ydF4y2BaLAR1G.ydF4y2Ba控制使用基因沉默的果皮皮层和皮肤中黄烷醇浓度的变异,最近的功能证据G.ydF4y2BaMdANSG.ydF4y2Ba加强了这一假设。ANS使用白色花青素与LAR竞争,并合成花青素,这些花青素被转化为两种花青素G.ydF4y2BaviaG.ydF4y2BaUFGT或EpicaTechin.G.ydF4y2Ba通过ANR.G.ydF4y2Ba.的沉默G.ydF4y2BaMdANSG.ydF4y2Ba抑制红叶苹果品种的红色着色,并显着增加了转基因植物中其他多酚化合物,儿茶素和表情蛋白酶的浓度[G.ydF4y2Ba28.G.ydF4y2Ba].而G.ydF4y2BaANS.G.ydF4y2Ba不参与羟基氨基酸的合成,我们发现它与Q-Coumaroyl氨基酸的QTL共同定位。虽然这款QTL仅在2008年发现,但我们的结果表明G.ydF4y2BaANS.G.ydF4y2Ba控制这种特性变异。Szankowski及其同事的结果表明,通过截止骨膜或通过基础糖苷寡聚体的非立体特异性解聚的epicaTechin来合成替代途径[G.ydF4y2Ba28.G.ydF4y2Ba].我们的研究结果表明,EPICATECHIN和儿茶素分别呈正相关(皮肤和皮层0.65,分别为0.77和0.65),其两种化合物的QTL都与之共同定位G.ydF4y2BaLAR1G.ydF4y2Ba等位基因G.ydF4y2BaLAR1G.ydF4y2Ba对两种化合物的浓度具有相同的效果,其增强了Szankowski的假设及其替代途径的替代途径的同事。G.ydF4y2Ba
来自的等位基因特异性遗传标记G.ydF4y2BaLAR1G.ydF4y2Ba是用于标记辅助选择的优异候选者,用于增加黄黄烷醇含量,因为LG 16 QTL在岁月中稳定,并存在于“Braeburn”和“皇家佳拉”,品种在新西兰发挥重要作用的父母地图中的父母地图其他苹果育种计划在国际上。此外,类似定位的QTL在“Prima”×'Fiesta's Cross(S.Khan和H. Schouten,个人通信)中识别出偏见的人口中,表明LG 16 QTL由一系列其他商业苹果品种携带用作育种父母。使用这种基于基于基于水果黄烷醇含量的基因标记尤为重要,因为当在涉及更多世代的初始选择的初始选择过程中进行幼苗表型评估时,植物化学化合物通常不会通过育种者测量。仅在释放的商业品种中评估,以至于影响最终育种结果为时已晚。我们建议G.ydF4y2BaLAR1G.ydF4y2Ba标记应筛选在父母身上的原始交叉,以及所有代文的后代,以确保所有阶段的育种父母都携带或两位有利的等位基因G.ydF4y2BaLAR1G.ydF4y2Ba.G.ydF4y2Ba
此外,它是有用的研究黄烷醇含量和发展当前育种性状之间的联系。虽然黄烷醇已被认为是抗氧化剂的来源对人体健康有益,他们也有涩味,这是不被消费者首选关联。我们因此打算水果从“皇家嘎拉”דBraeburn”人口的感官分析,以确定是否涩味与黄烷醇含量相关。已知的是,从“普瑞玛”ד嘉年华”人口识别的LG 16 QTL簇共定位与水果酸度(苹果酸)的主要基因座G.ydF4y2Ba25.G.ydF4y2Ba那G.ydF4y2Ba29.G.ydF4y2Ba]并且酸度在确定消费者偏好方面是重要的[G.ydF4y2Ba30.G.ydF4y2Ba].此外,在‘Royal Gala’בBraeburn’群体中,对贮藏期果实硬度损失和芽期果实硬度损失的qtl定位在lg16的同一区域(D. Chagné,未发表)。因此,选择积极和消极特质的混合存在真正的风险,如果G.ydF4y2BaLAR1G.ydF4y2Ba基因标记物用于分离使用。对该地区的每个特征映射的基因标记功能等位基因的鉴定(如我们为黄黄烷醇所做的那样G.ydF4y2BaLAR1G.ydF4y2Ba)将能够选择少数基因精英后代,从大型育种群体中携带最理想的性状组合。G.ydF4y2Ba
结论G.ydF4y2Ba
我们检测到苹果中的多酚抗氧化含量稳定的QTL,并提供了与黄黄烷醇的生物合成酶相关的多态性的强烈证据(G.ydF4y2BaLAR1G.ydF4y2Ba)控制水果皮肤和皮质中黄烷醇的浓度,以及有关的多态性的证据G.ydF4y2BaHQT / HCTG.ydF4y2Ba可以控制绿原酸的浓度。这些候选基因来源的标记具有潜力,以促进新苹果品种开花结果的发展与一系列与人类健康益处多酚类化合物的浓度增加。G.ydF4y2Ba
方法G.ydF4y2Ba
植物材料,水果采样和多酚提取G.ydF4y2Ba
2005年,从“皇家庆典”和“Braeburn”中分离出的590棵幼苗G.ydF4y2Ba1G.ydF4y2Ba在植物和食品研究Clyde研究果园(新西兰中央奥塔哥市)的植物和食品研究人口嫁接了人口。每棵树的两棵树随机种植两棵树,在东西方取向分开5×1.5米。父母的皇室庆典和“Braeburn”也在同一块中随机种植。树木经常灌溉,以避免水赤字,害虫和疾病通过常规技术控制,符合专业实践。G.ydF4y2Ba
基于背景颜色和腮红发育,随后是2月中旬至2010年4月底的确认淀粉碘试验,分别在2008年和2010年分别在2008年和2010年之间进行了确认的淀粉碘测试。从每棵树随机收获六个苹果。水果在两到三天的拣选中加工。每个苹果被纵向通过芯的轴切割成四个季度,通过六个苹果的四个季度的四个季度从每棵树的四个季度取出四个薄段(在皮肤侧宽,逐渐变细).从每个段中除去皮肤以从皮质中形成单独的样品。来自六个苹果的24个皮肤片和24个皮质片分别膨胀,立即在液氮中冷冻,然后在液氮中研磨至细粉末。G.ydF4y2Ba
将约100mg这种粉末悬浮在1ml萃取溶剂(乙醇/水/甲酸,80:20:1,v / v / v)中。使用Heidolph均化每个样品均化1分钟G.ydF4y2Ba®G.ydF4y2BaReax-Shaker,Reax 2000(Heidolph Instruments GmbH,Schwabach,德国),然后在4°C下储存24小时,然后使用Jouan将10分钟以1000g离心10分钟G.ydF4y2Ba®G.ydF4y2BaHema-C离心机(Jouan, Saint Herblain,法国)。将180 μl的清上清转移到96孔板上进行反相UHPLC分析。每10个样品加入一个重复,以评价重现性。G.ydF4y2Ba
水果多酚的UHPLC分析G.ydF4y2Ba
用于分析多酚类物质的UHPLC系统为Dionex UltimateG.ydF4y2Ba®G.ydF4y2Ba3000快速分离LC系统配有四个脱气通道的SRD-3400溶剂架,HPR-3400RS双泵,WPS-3000RS恒温自动进样器,TCC-3000RS恒温柱室,DAD-3000RS二极管阵列检测器,用于监测从190到800 nm的所有波长。分析柱为Kinetex™C18 1.7 μm, 100 × 2.1 mm (PhenomenexG.ydF4y2Ba®G.ydF4y2BaNZ有限公司,米尔福德,奥克兰市,新西兰)保持在45℃。注射体积为提取物为0.5微升。线性梯度洗脱,用溶液A(0.5%磷酸水溶液)和溶液B(乙腈)以0.75毫升/分钟的流速如下递送进行:等度洗脱5%B,0-0.5分钟;从5%B至25%B,0.5-4分钟线性梯度;至95%B,4-4.8分钟;至100%B,480-600分钟;等度洗脱100%B,6-6.5分钟;线性梯度至5%B,6.5-7分钟,在初始条件之前另一个样品注入在9分钟返回。光谱数据收集,在整个运转,和多酚成分通过提取色谱在210,280,310,370和530nm处定量。儿茶素,表儿茶素和使用在210nm处提取的色谱图矢车菊苷配质进行定量; quercetin, phloridzin and phloridzin-xyloside at 280 nm;P.G.ydF4y2Ba-coumaroyl氨基酸,310nm;槲皮素糖苷和绿原酸在370nm处;和530nm的Cyanidin糖苷。使用Chromeleon收集和操纵色谱数据G.ydF4y2Ba®G.ydF4y2Ba色谱管理系统版本6.8。外部校准曲线是针对EPICATECHIN,儿茶素,Phloridzin,槲皮素,槲皮素3-的构建G.ydF4y2BaO.G.ydF4y2Ba-rutinoside,Cyanidin 3-G.ydF4y2BaO.G.ydF4y2Ba- 葡萄原体,绿原酸,原酸甲酰胺B2,和G.ydF4y2BaP.G.ydF4y2Ba-香豆素奎尼酸使用Extrasynthese标准,Genay,法国。没有标准品的成分用相关化合物的标准曲线定量。采用花青素3-定标曲线对所有花青素苷进行定量G.ydF4y2BaO.G.ydF4y2Ba葡萄糖苷。采用槲皮素3-的标定曲线对槲皮素苷进行定量G.ydF4y2BaO.G.ydF4y2Ba-芦丁苷、毛蕊花苷-木糖苷采用毛蕊花苷的标定曲线定量,表儿茶素采用原花青素的标定曲线定量。G.ydF4y2Ba
初始多酚浓度以μg/ ml(C计算G.ydF4y2BaV.G.ydF4y2Ba).浓度(CG.ydF4y2BaW.G.ydF4y2Ba),以μg/g鲜重计算,公式如下:G.ydF4y2Ba
由于苹果含有平均85%的水,所以计算为:G.ydF4y2Ba
中多酚类化合物的鉴定G.ydF4y2Ba马鲁斯G.ydF4y2Ba使用配备二极管阵列检测器(DAD)的Dionex Ultimate 3000系统(Sunnyvale,CA)进行种质集。将5μL等分试样注入Dionex C18 AcclaialAdgantage II柱(150×2.1mm I.D。;3μm粒径)(Sunnyvale,CA)。流动相是(a)水,其水与0.1%甲酸和(b)乙腈,0.1%甲酸。流速为0.35毫升分钟G.ydF4y2Ba-1G.ydF4y2Ba,柱温为35℃。42 min梯度为0 ~ 5 min, B值为0 ~ 8%;5-10分钟,8-15% B;10-20分钟,15-20% B;20-27分钟,20% B线性;27-34分钟,27-100% B;34-36分钟,100% B线性;36-42分钟,0% B,再平衡时间。在254 nm、280 nm、320 nm、520 nm处同时监测定量。多酚化合物通过保留时间和光谱数据与标准品进行鉴别,并采用5点校准曲线进行定量。G.ydF4y2Ba
DNA提取和SNP标记开发G.ydF4y2Ba
根据制造商的协议,使用Qiagen Plant DNeasy Plant Mini试剂盒(Qiagen, Hilden, Germany)从“Royal Gala”דBraeburn”分离群体的亲本和590株幼苗的幼叶中提取基因组DNA。从每个样本中提取10毫微克基因组DNA,然后通过全基因组扩增(WGA;[G.ydF4y2Ba31.G.ydF4y2Ba使用GenomiPhi V2 DNA扩增试剂盒(GE Healthcare, Little Chalfont, Buckinghamshire, United Kingdom)。951个单核苷酸多态性(SNP)标记的一个子集,用于将“金美味”基因组序列固定到遗传图谱上[G.ydF4y2Ba20.G.ydF4y2Ba选择基于沿着“金色美味”伪染色体的均匀分布来绘制。SnPlex™(应用Biosystems Inc.,Foster City,CA)基因分型测定[G.ydF4y2Ba32.G.ydF4y2Ba根据制造商的方案使用1μL(来自45至225ng)的WGA-DNA进行。样品在3730xL DNA分析仪(Applied Biosystems Inc.)上运行,使用Gene Mapper V.4.0软件(Applied Biosystems Inc.)进行分析数据。根据SnPlex_Rules_3730方法进行基因型分析,按照制造商的默认设置。G.ydF4y2Ba
遗传图谱构建及QTL分析G.ydF4y2Ba
使用双伪测试译策略构建父母遗传图[G.ydF4y2Ba33.G.ydF4y2Ba].使用JoinMap进行连锁分析和地图结构G.ydF4y2Ba®G.ydF4y2Bav3.0 [G.ydF4y2Ba34.G.ydF4y2Ba], LOD评分为5分进行分组,Kosambi功能进行遗传距离计算。利用MapQTL进行QTL分析G.ydF4y2Ba®G.ydF4y2Ba5.0版[G.ydF4y2Ba35.G.ydF4y2Ba].在QTL分析之前,为每个化合物验证数据分布:使用非参数(Kruskal-Wallis测试)和间隔映射(IM)分析分析非正常和正常分布。对于IM分析,使用1,000个序列在基因组水平下计算QTL意义的LOD阈值。保留了具有LOD评分的QTL,其在大于90%的基因组范围内被保留。然后,每个QTL的最重要的标记用作多QTL分析(MQM)的辅助因子,用于检测由前一个IM分析中的主要QTL隐藏的次要QTL。G.ydF4y2Ba
候选基因检测G.ydF4y2Ba
基于参与多酚生物合成途径的17个候选基因被选中(附加文件)G.ydF4y2Ba3.G.ydF4y2Ba;图S2)。从Genbank检索候选基因的序列,并针对从“金色美味”的全部基因组序列预测的苹果基因集进行的爆炸搜索[G.ydF4y2Ba20.G.ydF4y2Ba].每个候选基因的位置是基于对苹果的基因组伪染色体的物理位置记录,然后进行比较G.ydF4y2Ba在Silico.G.ydF4y2Ba到QTL位置。这些位置是用苹果基因组序列的组装元序列计算出来的[G.ydF4y2Ba20.G.ydF4y2Ba]以200 kB的任意间隙分开。用QTL共同定位的候选基因G.ydF4y2Ba在Silico.G.ydF4y2Ba用于开发用于遗传映射的多态标记,以用QTL确认它们的共同位置。G.ydF4y2Ba
基于候选基因的标记开发和测绘G.ydF4y2Ba
基于基因组组件CONTIG序列设计PCR引物[G.ydF4y2Ba20.G.ydF4y2Ba利用Primer3 v0.4.0筛选候选基因G.ydF4y2Bahttp://frodo.wi.mit.edu/primer3/G.ydF4y2Ba.设计标准为:最终产品尺寸在100 ~ 150 bp之间;引物大小18 ~ 27 bp(最适20 bp);底漆熔化温度范围为57°C至63°C(最优:60°C);G和C碱基的比例从40%到55%不等。为了防止引物二聚体在PCR过程中形成,将自互补和3’自互补分别设置为最大4和1。将获得的引物(lar1_mdc000496.351 1_f2: TGGTTCCCTGTATCCAAGTTTT, lar1_mdc000496.351 1_r2: acctgagcggtgtccttc, HCT_F2: tggatgtataggttagaatgtgg和HCT_R2: gccattgctagattgacttc)提交到苹果基因组组装的BLASTN分析,以防止多位点退火。G.ydF4y2Ba
在灯笼夹上进行的高分辨率熔化(HRM)技术G.ydF4y2Ba®G.ydF4y2Ba480(Roche)的用于检测序列多态性[G.ydF4y2Ba36.G.ydF4y2Ba].多态标记在“皇家庆典××'Braeburn的分离群体上筛选,并用来使用前面描述的相同参数来构建新的遗传图谱。G.ydF4y2Ba
参考资料G.ydF4y2Ba
- 1.G.ydF4y2Ba
威利特WC:平衡生活方式和基因组学研究以预防疾病。中国科学(d辑):地球科学(英文版)。10.1126 / science.1071055。G.ydF4y2Ba
- 2。G.ydF4y2Ba
McGhie TK, Hunt M, Barnett LE:在新西兰种植的苹果中,抗氧化剂多酚的浓度和组成取决于品种和种植区域。农业工程学报,2005,53(8):3065-3070。10.1021 / jf047832r。G.ydF4y2Ba
- 3.G.ydF4y2Ba
刘红红:苹果植物化学成分及其对人体健康的影响。中国科学(d辑):地球科学(d辑)G.ydF4y2Ba
- 4.G.ydF4y2Ba
Davey MW,Kenis K,Keulemans J:水果维生素C含量的遗传控制。植物物理。2006,142(1):343-351。10.1104 / pp.106.083279。G.ydF4y2Ba
- 5.G.ydF4y2Ba
Hertog MGL,Hollman Pch,Katan MB,Kromhout D:摄入荷兰成人的潜在抗癌性黄酮及其决定因素。Nutr癌症。1993,20(1):21-29。10.1080 / 01635589309514267G.ydF4y2Ba
- 6.G.ydF4y2Ba
Vinson Ja,Su Xh,Zubik L,Bose P:食品中酚抗氧化量和品质:水果。JAgric Food Chem。2001,49(11):5315-5321。10.1021 / JF0009293。G.ydF4y2Ba
- 7。G.ydF4y2Ba
艺术ICW,Hollman PCH:流行病学研究中的多酚和疾病风险。AM J Clin Nutr。2005,81(1):317s-325s。G.ydF4y2Ba
- 8。G.ydF4y2Ba
Halliwell B,Rafter J,Jenner A:黄酮类,生育酚,Tocotrienols和其他酚类的健康促进:直接或间接影响?抗氧化剂与否?AM J Clin Nutr。2005,81(1):268S-276s。G.ydF4y2Ba
- 9。G.ydF4y2Ba
冯瑞涛,卢玉娟,鲍曼,钱勇,陈玉华,丁敏:绿原酸对激活蛋白-1、NF-kappa B和MAPKs的抑制作用及诱导2期解毒酶活性的研究。生物化学学报。2005,28(3):489 - 498。10.1074 / jbc.M503347200。G.ydF4y2Ba
- 10.G.ydF4y2Ba
Stevenson DE, Hurst RD:多酚类植物化学物质——只是抗氧化剂还是更多?中国生物医学工程学报。2007,29(2):241 - 241。10.1007 / s00018 - 007 - 7237 - 1。G.ydF4y2Ba
- 11.G.ydF4y2Ba
Manach C,Williamson G,Morand C,Scalbert A,Remesy C:人类中多酚的生物利用度和生物效率。I.审查97种生物利用度研究。AM J Clin Nutr。2005,81(1):230s-242s。G.ydF4y2Ba
- 12.G.ydF4y2Ba
多酚的研究进展。编辑:Daayf F,Lattanzio V. 2008,1:G.ydF4y2Ba
- 13。G.ydF4y2Ba
多酚的研究进展。桑托斯Buelga C,埃斯克里瓦诺-Bailon MT,拉坦佐五,2010年,2:编辑:G.ydF4y2Ba
- 14。G.ydF4y2Ba
Volz RK,Mcghie TK:苹果果实多酚组成的遗传变异G.ydF4y2Ba马鲁斯G.ydF4y2Ba×G.ydF4y2Ba家庭G.ydF4y2Ba和G.ydF4y2BaMalus Sieversii.G.ydF4y2Ba种质资源生长在新西兰。JAgric Food Chem。2011年,59(21):11509-11521。10.1021 / jf202680h。G.ydF4y2Ba
- 15.G.ydF4y2Ba
Mattila P,HellströmJ,TörrönenR:浆果,水果和饮料中的酚醛酸。JAgric Food Chem。2006,54(19):7193-7199。10.1021 / JF0615247。G.ydF4y2Ba
- 16.G.ydF4y2Ba
Laurens F:回顾世界目前的苹果育种计划:采取枝条品种改善的目标。Acta Hort。1999年,484:163-170。G.ydF4y2Ba
- 17。G.ydF4y2Ba
Chagnéd,卡莱尔cm,金发c,沃尔兹rk,whitworth cj,oraguzie nc,oragurstrn,allan ac,espley rv,hellens rp等:绘制候选基因(G.ydF4y2Bamdmyb10G.ydF4y2Ba)对于苹果中的红色肉体和叶子颜色。BMC基因组学。2007,8:212-10.1186 / 1471-2164-8-212。G.ydF4y2Ba
- 18。G.ydF4y2Ba
Espley RV,Brendolise C,Chagne D,Kutty-Amma S,Green S,Volz R,Putteriliill J,Schouten HJ,Gardiner Se,Hellens RP等:启动子段的多重重复导致红色苹果中的转录因子自动调节。植物细胞。2009,21(1):168-183。10.1105 / TPC.108.059329。G.ydF4y2Ba
- 19。G.ydF4y2Ba
埃斯普利RV,Hellens RP,Putterill J,Stevenson de,Kutty-Amma S,Allan AC:苹果果实的红色着色是由于MYB转录因子,MDMYB10的活动是由于MYB转录因子的活动。工厂J.2007,49(3):414-427。10.1111 / J.1365-313x.2006.02964.x。G.ydF4y2Ba
- 20。G.ydF4y2Ba
贝拉斯科R,Zharkikh A,AffourtitĴ,Dhingra A,Cestaro A,Kalyanaraman A,丰P,纳加尔SK,Troggio男,PRUSS d,等人:家养苹果的基因组(G.ydF4y2Ba马鲁斯G.ydF4y2BaX.G.ydF4y2Ba家庭G.ydF4y2Baborkh。)。NAT Genet。2010年,42(10):833-839。10.1038 / ng.654。G.ydF4y2Ba
- 21。G.ydF4y2Ba
Sonnante G,D'Amore R,Blanco E,Pierri Cl,De Palma M,Luo J,Tucci M,Martin C:新的羟基氨基酰基 - 辅酶,来自朝鲜蓟的Quinate转移酶基因涉及绿原酸的合成。植物物理。2010,153(3):1224-1238。10.1104 / pp.109.150144。G.ydF4y2Ba
- 22.G.ydF4y2Ba
塔克am,ubi是,罗宾逊sp,walker ar:浓缩的单宁生物合成基因与苹果果皮中的其他黄酮生物合成基因分开调节。植物SCI。2006,170(3):487-499。10.1016 / J.Plantsci.2005.10.001。G.ydF4y2Ba
- 23.G.ydF4y2Ba
Takos AM, Jaffe FW, Jacob SR, Bogs J, Robinson SP, Walker AR:光诱导MYB基因表达调控红苹果花青素合成。植物物理学报。2006,142(3):1216-1232。10.1104 / pp.106.088104。G.ydF4y2Ba
- 24.G.ydF4y2Ba
程FS,Weeden NF,Brown SK:鉴定CO主导RAPD标记与苹果中的果皮颜色紧密相关。Al Appl Genet。1996,93(1-2):222-227。10.1007 / BF00225749。G.ydF4y2Ba
- 25。G.ydF4y2Ba
Maliepaard C, Alston FH, van Arkel G, Brown LM, Chevreau E, Dunemann F, Evans KM, Gardiner S, Guilford P, van Heusden AW, et al:苹果(G.ydF4y2BaMalus pumila.G.ydF4y2Ba磨机。)使用多等位基因标记。Al Appl Genet。1998,97(1-2):60-73。10.1007 / S001220050867。G.ydF4y2Ba
- 26。G.ydF4y2Ba
关键词:咖啡,绿原酸,合成,CGA,实时荧光定量pcrG.ydF4y2BaHCTG.ydF4y2Ba那G.ydF4y2BaHQT.G.ydF4y2Ba那G.ydF4y2BaC3H1G.ydF4y2Ba,和G.ydF4y2BaCCOAOMT1G.ydF4y2Ba基因在粮食开发期间G.ydF4y2Bac . canephoraG.ydF4y2Ba.植物SCI。2007,172(5):978-996。10.1016 / J.Plantsci.2007.02.004。G.ydF4y2Ba
- 27.G.ydF4y2Ba
Menin B,Comino C,Moglia A,Dolzhenko Y,Portis E,Lanteri S:与咖啡酰基酸合成有关的基因的鉴定和映射G.ydF4y2BaCynara cardunculusG.ydF4y2BaL.植物SCI。2010,179(4):338-347。10.1016 / J.Plantsci.2010.06.010。G.ydF4y2Ba
- 28.G.ydF4y2Ba
ssankowski I, Flachowsky H, Li H, Halbwirth H, Treutter D, Regos I, Hanke M-V, Stich K, Fischer T:沉默花青素合成酶对苹果多酚谱和亚致死表型的影响(G.ydF4y2Ba马鲁斯G.ydF4y2Basp)。植物学报。2009,229(3):681-692。10.1007 / s00425 - 008 - 0864 - 4。G.ydF4y2Ba
- 29。G.ydF4y2Ba
Conner PJ,Brown Sk,Weeden NF:三种苹果品种的随机扩增的多晶型DNA遗传联系地图。J AM SoC Hort SCI。1997,122(3):350-359。G.ydF4y2Ba
- 30.G.ydF4y2Ba
Harker FR,Kupferman Em,Marin Ab,Gunson Fa,Triggs CM:基于消费者偏好的苹果吃质量标准。Postharv生物技术。2008,50(1):70-78。10.1016 / J.Postharvbio.2008.03.020。G.ydF4y2Ba
- 31。G.ydF4y2Ba
Hosono S,Faruqi AF,Dean FB,Du YF,Sun Zy,Wu Xh,Du J,Kingsmore SF,egholm M,Lasken Rs:直接来自临床样品的全基因组扩增。Genome Res。2003,13(5):954-964。10.1101 / GR.816903。G.ydF4y2Ba
- 32。G.ydF4y2Ba
Tobler AR,Short S,Andersen Mr,Paner TM,Briggs JC,Lambert SM,Wu PP,Wang Y,Spoonde Ay,Koehler Rt等:SnPlex基因分型系统:SNP基因分型的灵活和可扩展平台。J Biomol Tech。2005,16(4):398-406。G.ydF4y2Ba
- 33。G.ydF4y2Ba
张志强,张志强,张志强,等G.ydF4y2Ba桉树祖母G.ydF4y2Ba和G.ydF4y2Ba桉树urophyllaG.ydF4y2Ba使用伪testcross:映射策略和RAPD标记。遗传学。1994,137(4):1121-1137。G.ydF4y2Ba
- 34.G.ydF4y2Ba
Van Ooijen JW, Voorrips RE: JoinMapG.ydF4y2Ba®G.ydF4y2Ba3.0,计算遗传连锁图的软件。荷兰瓦赫宁根:国际植物研究组织;2001。G.ydF4y2Ba
- 35.G.ydF4y2Ba
Ooijen V: MapQTL5,用于绘制实验群体数量性状位点的软件。荷兰瓦赫宁根;2004年。G.ydF4y2Ba
- 36.G.ydF4y2Ba
Chagnéd,Gasic K,Crowurst RN,Han Y,Bassett HC,Bowate Dr,Lawrence TJ,Rikkerink Eha,Gardiner SE,Korban SS:开发苹果表达基因中存在的SNP标记。基因组学。2008,92(5):353-358。10.1016 / J.YGENO.2008.07.008。G.ydF4y2Ba
- 37。G.ydF4y2Ba
Crowhurst RN, Davy M, Deng C: BioView -一个用于非基因组DNA序列自动分析和注释的企业生物信息学系统。第三届国际蔷薇科基因组学会议。编辑:Gardiner SE。2006年,新西兰纳皮尔G.ydF4y2Ba
确认G.ydF4y2Ba
这项工作得到了新西兰植物和食品研究所有限公司Pipfruit内部投资计划(PIIP)的资助。作者感谢约翰·麦卡勒姆博士对手稿的评论。这件作品是为了纪念珍妮·弗雷泽。G.ydF4y2Ba
作者信息G.ydF4y2Ba
隶属关系G.ydF4y2Ba
通讯作者G.ydF4y2Ba
附加信息G.ydF4y2Ba
作者的贡献G.ydF4y2Ba
DC和CK对化学数据集进行分析,构建遗传图谱,进行统计和QTL分析,开发候选基因标记并撰写手稿。JF在地里采集水果样本。MR、WAL、CA、MS对果实进行处理。MP和MT在分离群体中开发和筛选SNP标记。CA、RAH和ACA在苹果基因组序列中鉴定了候选基因。TKM和SEG分别提供化学分析和遗传作图方面的专业知识。ACA, DC和WAL设计了实验,编辑了手稿,是项目的共同负责人。所有作者阅读并批准了最终的手稿。G.ydF4y2Ba
大卫Chagné, Célia克里格对这项工作也做出了同样的贡献。G.ydF4y2Ba
电子补充材料G.ydF4y2Ba
12870 _2011_970_moesm1_esm.xlsxG.ydF4y2Ba
附加文件1:表S1:相关矩阵(G.ydF4y2BaR.G.ydF4y2Ba2G.ydF4y2Ba),用于在水果皮质和皮肤“皇家嘎拉”דBraeburn”的测量23种多酚化合物在2010年分离群体的浓度(XLSX 21 KB)G.ydF4y2Ba
12870 _2011_970_moesm2_esm.pdfG.ydF4y2Ba
附加文件2:图S1:多酚化合物的表型districtubtion在果皮和“皇家嘎拉”דBraeburn”的在2008年和2010年分离群体皮质检测(PDF 723 KB)G.ydF4y2Ba
12870_2011_970_moesm3_esm.pdf.G.ydF4y2Ba
附加文件3:图S2:“皇家佳拉”和“Braeburn”的框架遗传地图用于苹果果皮和皮质中的多酚化合物的QTL分析。(PDF 25 KB)G.ydF4y2Ba
图S3:多酚合成途径的简化示意图。基因符号在表中识别G.ydF4y2Ba
附加文件4:G.ydF4y2Ba3.G.ydF4y2Ba.(PDF 30 KB)G.ydF4y2Ba
图S4:在黄烷醇浓度的QTL间隔中发现的Apple基因预测G.ydF4y2Ba
附加文件5:。图中显示了一组GBrowser轨迹,显示了LG 16上的位置(上轨),关闭位置(第二和第三轨),苹果基因组组装contigs(第四轨),IASMA预测的苹果基因集和苹果cDNA序列(第五轨;G.ydF4y2Ba马鲁斯G.ydF4y2BaBioview™)G.ydF4y2Ba37.G.ydF4y2Ba映射到该区域(定位使用G.ydF4y2BaGMAPG.ydF4y2Ba).在已知的地方标明基因名。(PDF 1 MB)G.ydF4y2Ba
作者为图像提交的原始文件G.ydF4y2Ba
以下是与作者的原始提交的图像的链接。G.ydF4y2Ba
权利和权限G.ydF4y2Ba
这篇文章被许可发布到生物医学中心有限公司这是一个开放存取文章在Creative Commons署名许可的条款分发(G.ydF4y2Bahttp://creativecommons.org/licenses/by/2.0G.ydF4y2Ba),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。G.ydF4y2Ba
关于这篇文章G.ydF4y2Ba
引用这篇文章G.ydF4y2Ba
Chagné,D.,Krieger,C.,Rassam,M。G.ydF4y2Baet al。G.ydF4y2Ba苹果果实多酚成分的QTL定位及候选基因定位G.ydF4y2BaBMC植物杂志G.ydF4y2Ba12日,G.ydF4y2Ba12(2012)。https://doi.org/10.1186/1471-2229-12-12G.ydF4y2Ba
收到G.ydF4y2Ba:G.ydF4y2Ba
接受G.ydF4y2Ba:G.ydF4y2Ba
发表G.ydF4y2Ba:G.ydF4y2Ba
迪伊G.ydF4y2Ba:G.ydF4y2Bahttps://doi.org/10.1186/1471-2229-12-12G.ydF4y2Ba
关键字G.ydF4y2Ba
- 马鲁斯G.ydF4y2BaX.G.ydF4y2Ba家庭G.ydF4y2Ba
- 多酚G.ydF4y2Ba
- QTL定位G.ydF4y2Ba
- 候选基因G.ydF4y2Ba
- 类黄酮G.ydF4y2Ba
- 黄烷醇G.ydF4y2Ba
- 花青素G.ydF4y2Ba
- 单宁G.ydF4y2Ba
- 代谢组学G.ydF4y2Ba