- 研究文章
- 开放获取
- 发布:
全球转录组分析显示,在高粱生长过程中,重复的基因之间有不同的表达Bipolaris sorghicola相互作用
BMC植物生物学体积12, 文章编号:121(2012年)
摘要
背景
高粱(高粱双色L. Moench)是一种丰富的天然植物来源。我们对MRNA进行了大规模的平行测序,以鉴定高粱BTX623感染后鉴别差异表达基因Bipolaris sorghicola这是一种坏死营养真菌,会导致高粱疾病,称为靶叶斑病。
结果
测序从模拟或病原体感染叶的MRNA的七十六碱基读数。基于映射短读数的血压预测未经发布的转录物。统计学上鉴定差异表达的基因;串联重复推定鉴定寄生虫的特定基因高度上调。病原体感染在TCA循环中激活乙氧基化物分流;这改变了TCA周期从能量产生到细胞组分的合成的作用。通过对位于初级和次生代谢之间的分支点的氨基酸代谢酶的上调来激活植物碱合成和硫依赖性排毒的二次代谢途径。协调基因表达可以指导代谢途径以积聚高粱特异性植物化学素3-脱氧藻霉素和Dhurrin。在水稻基因组的相应区域中没有发现合成这些高粱特异性植物化学物质的关键酶。
结论
病原体感染显着改变了特定旁系蛋白酶的表达,即借助于高粱特异性代谢网络的诱导编码酶。
背景
植物通过次级代谢途径合成低分子量植物抗毒素以保护自己免受真菌等病原体的侵害[1].高粱的植物抗毒素如3-脱氧花青素首先出现在真菌侵袭的细胞中,在细胞质包络体中积累。内含物迁移到试图渗透的部位,形成色素,并最终释放植物抗毒素杀死真菌[2].植物抗毒素主要由芳香族氨基酸(苯丙氨酸(Phe)、酪氨酸(Tyr))在多种酶的作用下依次催化生物化学反应而产生。苯丙氨酸解氨酶(PAL)催化苯丙氨酸脱氨trans- 基因酸;这是各种苯丙醇,香豆素,黄酮类化合物和木质素生物合成的第一步[3.-5.].芳香- l -氨基酸脱羧酶催化酪氨酸脱羧成酪胺;这是生产异喹啉生物碱的第一步。细胞色素p450是多种多样的,以产生各种植物抗毒素和参与代谢网络,如花青素、单宁、黄酮和异黄酮[6.那7.].对于植物植物素合成,需要适当的酶活性,不仅需要合成所需的产品,还需要避免毒性代谢物的积累。
高粱(高粱双色莫恩(L. Moench)是世界上第五大最常见的谷类作物,也是特定于高粱的天然产品的丰富来源。为了应对病原体感染,高粱合成了一类独特的类黄酮植物抗毒素,即3-脱氧花青素[2那8.].这些在结构上与花青素相似,不同之处在于它们缺乏C-3羟基化。作为另一个例子,高粱幼苗积累了高水平的Dhurrin,衍生自酪氨酸的氰基糖苷[9.].dhurrin的降解释放出氰化氢(HCN),它对动物、植物、昆虫和微生物都有极高的毒性[10那11].Dhurrin在生物学上也是一种重要的氮储存化合物。[12那13].高粱根散发出疏戈松,疏水p-苯醌化合物,抑制光系统II中的电子转移以排除与邻近植物争夺资源的竞争[14].然而,植物素合成所需的酶尚未得到完全鉴定,并且对生产这些酶的协调基因表达的性质仍有待阐明。
目标叶点是高湿度条件下高粱的主要叶面疾病之一。这种疾病是由病毛刺真菌引起的,Bipolaris sorghicola[15那16].受感染的BTX623的叶子通常橙色到红色斑点,带有秸秆色的中心。目标叶斑显着减少了植物生物质的生产。
高粱功能基因组学的研究是在2009年完成高粱BTx623基因组序列后才开始的[17].高粱有许多近旁重复的基因。例如,编码细胞色素P450酶的基因在高粱中丰富,有15个基因中的326个拷贝,包括最长的串联基因阵列[17].每个基因可以在适于催化特定生物化学反应的条件下表达。然而,这些基因组序列的相似性使得难以区分该家庭的基因成员的表达,即使已经开发了通过使用实时定量逆转录 - 聚合酶链反应(QRT-PCR)来检测SNP或微阵列技术。此外,计算注释尚未完全涵盖整个基因。因此,重要的是鉴定完全基因表达分析的整个转录物(包括未经发挥的转录物),并且需要开发超越阵列的技术。鉴于大规模平行测序技术的快速进展,整个mRNA测序(mRNA-SEQ)已被用于基因表达分析[18-22].已经开发了一系列的程序来直接建立基于短reads堆积的基因模型:Bowtie程序有效地绘制基因组序列上的短reads [23] Tophat连接相邻的外显子,并识别桥梁交叉点的读取[24和袖扣[25[基于由Bowtie和Tophat预测的外显子和桥接序列来构建基因模型。因此,使用测序的表达分析具有克服基于PCR或阵列的分析的限制,并且可用于鉴定家庭成员中表达的关键基因。
从这里,我们旨在鉴定植物熟素合成所需的关键基因,并在感染后阐明其在高粱中的协调表达Bipolaris sorghicola.为此目的,我们通过使用大规模的平行测序技术进行全mRNA测序;基于映射读数的血压鉴定差异表达的基因,包括未经发布的基因。将差异表达的基因映射在代谢途径上;该分析揭示了他们在初级代谢网络中的协调表达,以改变TCA周期和氨基酸的作用。将这些基因的表达与高粱基因组中的串联重复的家族基因的表达进行了比较,并确定了高粱特异性植物素合成中的关键酶。我们还将基因与位于大米相应的基因组区域中的基因进行了比较,我们讨论了高粱特异性植物素合成的进化史。这项工作将有助于阐明响应高粱病原体感染的原发性和次生代谢途径的转录调节。
结果
用mRNA-seq鉴定差异表达基因
我们使用mRNA-seq对高粱进行转录组分析。被孢子感染后Bipolaris sorghicola,高粱BTX623展示典型的叶片病变,是红橙色。收集病原体处理或对照(模拟感染的)高粱叶,并通过使用Illumina mRNA-SEQ技术对来自MRNA的76-碱基对(BP)读数进行测序。在28至3400万质量评价的读数中,共映射了81.7%(感染)或81.8%(模拟)分别映射了68.0%和67.8%,对高粱基因组绘制;桥接8.5%和8.7%独特的外显子;其他人被映射到多个基因座(表1)。这留下了18.3%(感染)和18.2%(模拟感染)未取出高粱基因组。随着对照和受感染样品的未映射读数的比例几乎相同,我们认为少数读取甚至来自真菌转录物。
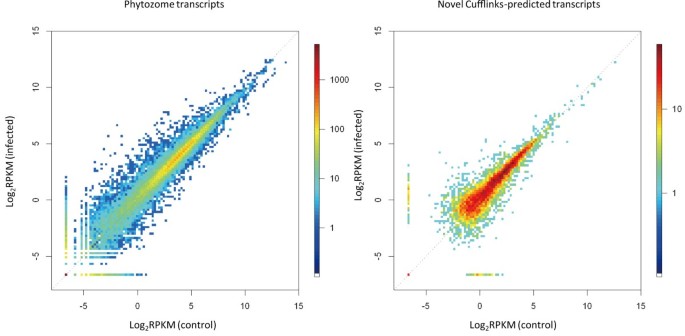
mRNA-SEQ根据每个基因映射的序列数量来定量转录物。我们采用rpkm(每百万百万映射读数的外显子模型每公斤读数)[26]对于转录物定量,并且在对照和感染的叶子中,我们将每种基因的RPKM与植物血红素(http://www.phytozome.net/;数字1);我们引用了植物血统中的注释,并搜索了最好的Blastx拟南芥蒂利亚纳(附加文件1:表S1)。通过使用具有1%的假发现率(FDR)的G检验统计鉴定差异表达基因;5617在5095个锁上的转录物上调,而2688个基因座的3052转录物下调(表2)。
构建基因模型并搜索编码已知蛋白质的基因的同源性
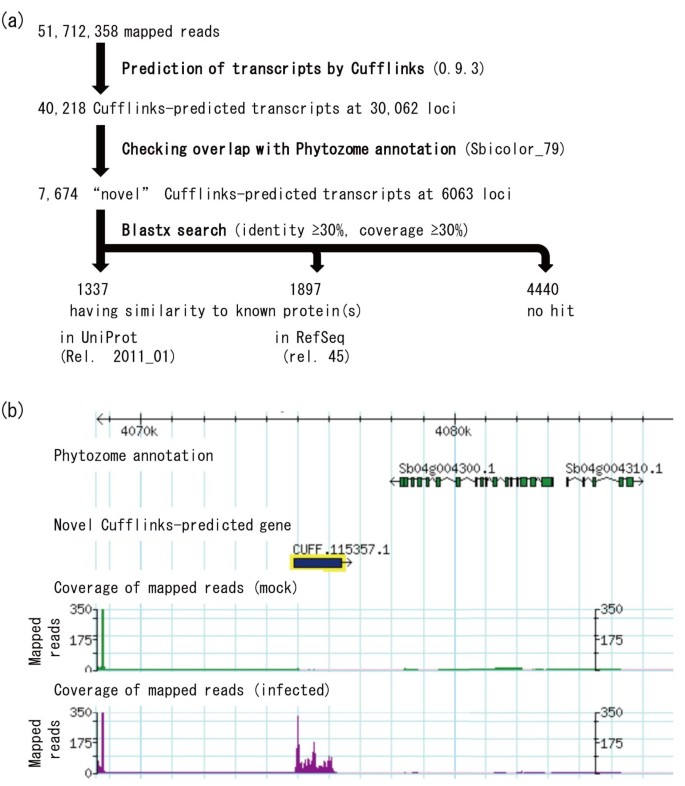
通过Bowtie [23),大礼帽24和袖扣[25].通过使用51,712,358个映射读数(合计来自对照的28,260,814和来自受感染组织的23,451,544;表格1;预先预测总映射),40,218名锁上的转录物(图)2A).检查Phytozome注释的重叠部分,发现6063个位点有7674个转录本未注释(图2一种)。为了预测未经发布的转录物的功能,我们对两种已知的蛋白质数据集进行了Blastx搜索:1337转录物对编码UniProt中已知蛋白质(rel.201)和1897年编码已知蛋白质的基因具有相似性(同一性≥30%和覆盖率≥30%)。转录物与Refseq的转录物相似(第45份);因此42.1%(3234/7674)新的转录物与已知蛋白质有相似之处(图2A).在对病原体感染的反应中,594个位点上有816个未注释的转录本上调,196个位点上有239个转录本下调(表)2)。比较侧链预测基因的RPKMS(图1)和差异表达基因2:表S2)。一些差异表达的未经发布的转录物与植物素合成的二次代谢途径有关:袖口与玉米相似ZRP4 o- 甲基转移酶[27]和袖口115357.1与二氢烷醇4-还原酶(DFR)具有相似性,其催化了高粱中Naringenin的C-4羰基的减少[28)(图2B;额外的文件3.:表S3)。
用于特征未经发布的成绩单的策略。(一个)通过使用袖扣程序,基于映射短读取的PInGing的新的转录物。通过用植物血红素注释(SBICOLOR_79)重叠来选择未经发布的转录物。为了预测未知的转录物的功能,针对已知的蛋白质数据集进行BLASTX搜索,即Uniprot(Rel.2011)和Refseq(版本45)。(b)沟槽预测的转录物的差异表达。该图表指示映射读取的映射 - (模拟;绿色)或病原体感染(感染的;紫色)叶子,在Gbrowse中。通过袖扣计划的血液刺激预测出外显子模型(新型套套接 - 预测基因;蓝盒)。还显示了在植物血红素中注释的基因模型(植物血红素注释;绿色盒子)。袖带115357.1未经发布,表达差异。
差异表达基因的表征
我们在这里重点研究了由高度差异表达基因编码的蛋白质的初级或次级代谢途径;我们还将这些基因的表达与它们家族基因的表达进行了比较。列出了50个极端差异表达的基因4.:表S4)。
主要代谢
在TCA循环中的乙醛分流:异柠檬酸裂解酶和雄性合成酶
编码异柠檬酸裂解酶(Sb02g035150.1)和苹果酸合酶(Sb06g020720)的基因差异显著(分别为86.5倍和131.5倍);数字3.a和附加文件4.:表S4)。这些酶参与TCA循环的分流途径,即乙氧化氧化酯循环。异柠檬酸裂解酶切割脱柠檬酸酯,形成乙醛酸和琥珀酸盐,苹果酸盐合酶转化乙酰甲磺酸盐和乙酰基-COA至苹果醛。琥珀酸盐直接在TCA循环中使用,乙醛酸甲酸盐可在转化为苹果酸盐合酶后的TCA循环中使用。由于与TCA循环相关的其他基因没有差异表达,因此似乎仅增强了循环的乙醛分流部分(图3.A和3.C)。
改变TCA周期和氨基酸代谢的作用。(一个)基因在TCA循环中的表达,包括乙氧基化物分流。将每种基因的RPKM进行比较嘲笑(灰色棒)和病原体感染(黑条)叶子。(b)基因表达氨基酸代谢。将每个基因的RPKMS与(一个)。(c“甘油酯分流和氨基酸代谢在防御反应中的作用。在代谢图上显示了基因的上调或下调。TCA循环的乙醛分流路径跳过了CO2模型的步骤。随后,苯丙氨酸[Phe]和酪氨酸[Tyr]通过莽草酸途径合成。Phe和Tyr分别是各种类黄酮和异醌类生物碱的前体。Tyr也是高粱特有的氰苷dhurrin的前体。琥珀酸由谷氨酸(Glu)提供。半胱氨酸(Cys)由丝氨酸(Ser)提供;Cys是各种硫依赖解毒的前体。
氨基酸新陈代谢
在高粱基因组(Sb07g003010、Sb07g003020、Sb07g003040)中,编码芳香性l -氨基酸脱羧酶(Sb07g003010)的基因被串联复制,但在侵染叶片中只有Sb07g003010基因被高度上调(图)3.b)。芳族L-氨基酸脱羧酶催化L-酪氨酸和/或L-色氨酸脱羧,不可逆地,并负责芳族L-氨基酸对次级代谢途径的承诺,例如异喹啉生物碱生物合成途径(图3.C)。
在染病叶片中诱导得到编码丝氨酸o-乙酰转移酶(01 g044050)的基因(图1)3.B);这种酶催化……的形成O- 来自Ser和乙酰基-CoA的乙酰-Ser。随后,通过硫化物的冷凝形成CysO-acetyl-Ser;这是由O-乙酰丝氨酸(硫醇)裂解酶29].这两个步骤链接SER不可逆转到Cys Biosynthesis(图3.C)。
谷氨酸脱羧酶(glutamate decarboxylase, Sb01g041700)编码基因也在染病叶片中被诱导(图1)3.B);这种酶催化谷氨酸不可逆脱羧最终生成琥珀酸,琥珀酸供给三羧酸循环(图)3.C)。
次生新陈代谢
高粱富含高粱特有的植物化学物质,包括某些3-脱氧花青素[2],Dhurrin [13和sorgoleone [30.].我们重点研究了与这些特定的高粱植物化学物质合成相关的差异表达基因。
3-脱氧菁霉素
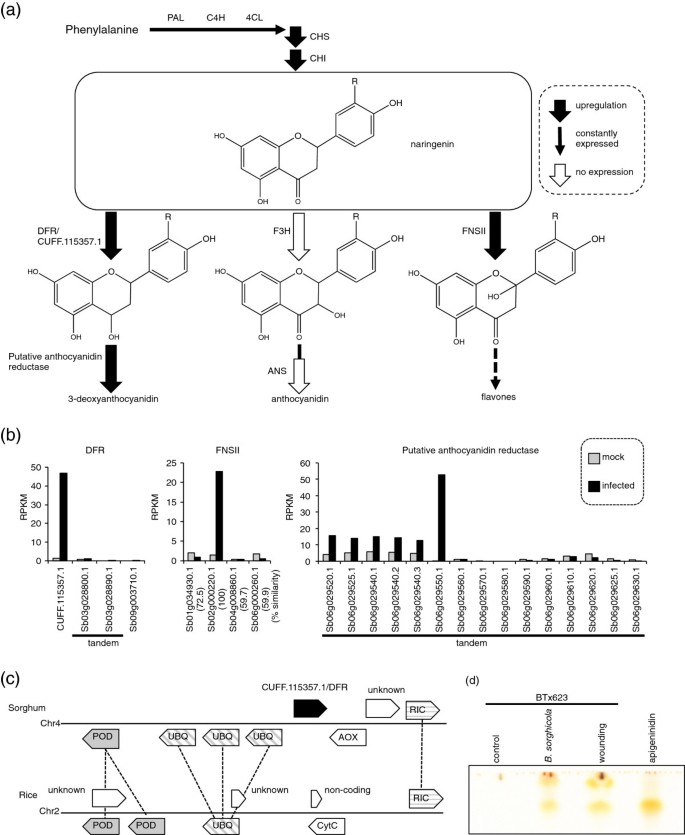
高粱BTx623通过柚皮素从苯丙氨酸中积累3-脱氧花青素,柚皮素是花青素的常见中间体(图)4.苯丙氨酸解氨酶(PAL)、反式肉桂酸4-单加氧酶(C4H)、4-香豆酸酯:辅酶A连接酶(4CL)、查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、二氢黄酮醇4-还原酶(DFR)和一种未知的花青素还原酶催化苯丙氨酸生物合成3-脱氧花青素。
苯丙氨酸二次代谢物的生物合成。(一个) 3-脱氧花青素代谢途径示意图。苯丙氨酸解氨酶(PAL)、反式肉桂酸4-单加氧酶(C4H)、4-香豆酸:辅酶a连接酶(4CL)、查尔酮合酶(CHS)和查尔酮异构酶(CHI)催化苯丙氨酸合成柚皮素(中间)。3-脱氧花青素是由二氢黄酮醇4-还原酶(DFR)和假定的花青素还原酶作用合成的。花青素是由黄酮3-羟化酶(F3H)和柚皮苷合酶(ANS)作用合成的。Upregulation的DFR.和花青素还原酶基因,以及F3H和ANS基因的抑制表明3-脱氧花青素有积累,而花青素没有积累。FNSII通过生成2-羟基黄酮将柚皮素转化为黄酮。(b)柚皮素次生代谢相关基因的表达。比较了模拟感染(灰色条)和病原感染(黑色条)叶片中每个基因的RPKMs。一个未注释的基因CUFF115357.1在4个DFR基因中表达上调。一个推测的花青素还原酶基因(Sb06g029550)在串联重复的推测的同源基因中被高度上调。在4个家族成员中诱导FNSII基因(Sb02g000220.1)表达。(c) CUFF115357.1基因在高粱和水稻中的对应区域。高粱(黑色)中的CUFF115357.1在水稻中没有相应的基因。推测编码多聚泛素(UBQ)、过氧化物酶(POD)、ROP相互作用CRIB基序蛋白(RIC)、胺氧化酶(AOX)、细胞色素C (CytC)或未知蛋白,或非编码转录本。相应的基因由线连接起来。(d)感染后积累的芹菜素。从高粱BTx623叶片中提取色素(对照,感染后Bipolaris sorghicola,或伤口)进行薄层色谱。化学合成的嗜合素蛋白用作标准。
PAL是致力于第一次代谢途径的第一种酶,将PHE转化为4-香豆素 - COA,各种植物化学物质的前体。染色体4(SB04G026510至SB04G026560)上有六个串联重复的高粱基因;由这些基因编码的氨基酸共有81.8%或更多的身份(SB04G026520 = 100%)(附加文件5.:图S1)。部分编码PAL、C4H、4CL的基因高表达,但在病原菌感染后无差异表达(Additional File 5: Figure S1)。
的CHS基因是串联复制的(9个基因;Sb05g020150 Sb05g020230);6个在染病叶片中表达上调,4个几乎不表达5.:图S1)。气有三个分散在不同染色体中的副本,其中两个是上调的(附加文件5.:图S1)。编码CHS和Chi的基因的上调表明,柚皮蛋白的合成,各种植物化学的前体(图4.一种)。
DFR基因由四个推定的伞菌组成;三个目前被注释,并且通过使用袖扣程序(附加文件)基于映射读取的血流读取的血压预测3.:表S3)。未经毁灭的一个,袖口115357.1.,是唯一上调的(图表2B和4.b),暗示袖带115357.1负责减少柚皮素的C-4羰基。的一部分袖口115357.1.与先前命名的序列相同DFR3[28],但在最新的sorghum注释(Sbi_79)中没有注释(图2b)。CUFF115357.1位于多泛素基因(UBQ)和ROP在染色体4上相互作用的婴儿床(CDC42 / RAC-交互结合)基序蛋白(RIC),并通过将基因组序列与水稻基因组对准(国际水稻基因组测序项目构建5.0伪分子)。然而,米饭没有DFR.染色体2上相应区域的基因(图4.C)。
尚未表征了尚未表征用于随后转化为3-脱氧菁钴素的黄烷-4-醇转化的花青素还原酶。我们发现类似于花青素还原酶的SB06G029550在感染的叶子中非常差异(330.4折;附加文件4.:表S4)。在BTx623的58个同源基因中,Sb06g029550是差异最大的基因,其中包括15个串联复制的基因(Sb06g029510到Sb06g029630)(图)4.b)。SB06G029550对此具有相似性A. Thaliana Banyuls.(禁止)基因编码花青素还原酶(附加文件4.:表S4) [31].我们认为SB06G029550是负责合成3-脱氧细胞苷素的最终步骤的候选者。感染后检测到3-脱氧藻胺之一的Apigeninidin的积累Bipolaris sorghicola通过使用薄层色谱(TLC)(图4.d)。因此,上调CHS气袖口115357.1 / DFR.并且推定的花青素还原酶基因SB06G029550表明,合成衍生自苯丙氨酸的3-脱氧细胞苷蛋白。
相比之下,花青素合成基因在BTx623中几乎没有表达。高粱黄酮3-羟化酶F3H1.(Sb06g031790.1)和F3H2.(Phytozome中未作注释)[28]没有表达(附加文件1:表S1),表明Naringenin的C-3羟基化的阻断;因此,这种阻断是临界决定簇的3-脱氧菁蛋白代替花青素(图4.A).编码花青素合成酶(ANS)的基因;Sb04g000260.1),催化花青素形成的下游反应[28那32在研究的任何一种条件下都没有表达(附加文件)1:表S1)。因此,在BTX623中,缺乏F3h和ANS基因的表达支持3-脱氧藻霉素,而不是花青素的积累(图4.一种)。
FNSII基因SB02G000220.1在四个推定的伞菌毒素中上调(图4.b)。FNSII是一种细胞色素P450蛋白(CYP93G3),其通过形成2-羟基酚酮来转化黄烷酮(Naringenin)以黄酮(图4.) (33].
在串联重复的家族成员中,F3'H和多酚氧化酶家族的特定基因有差异表达(附加文件5.:图S2)。差异表达的F3'H基因(SB04G024710.1)先前被命名为SBF3'H2,其参与了特异性特异性的3-脱氧聚体粘蛋白合成(Shih等,2006)。用于高粱F3'H蛋白的推定底物是Naringenin(Shih等人2006)或黄酮类生物合成的前体,如Kaempferol(Boddu等人2004)。由多酚氧化酶基因编码的酶可能与植物脂蛋素合成有关,即使它们的靶标未知。
Dhurrin
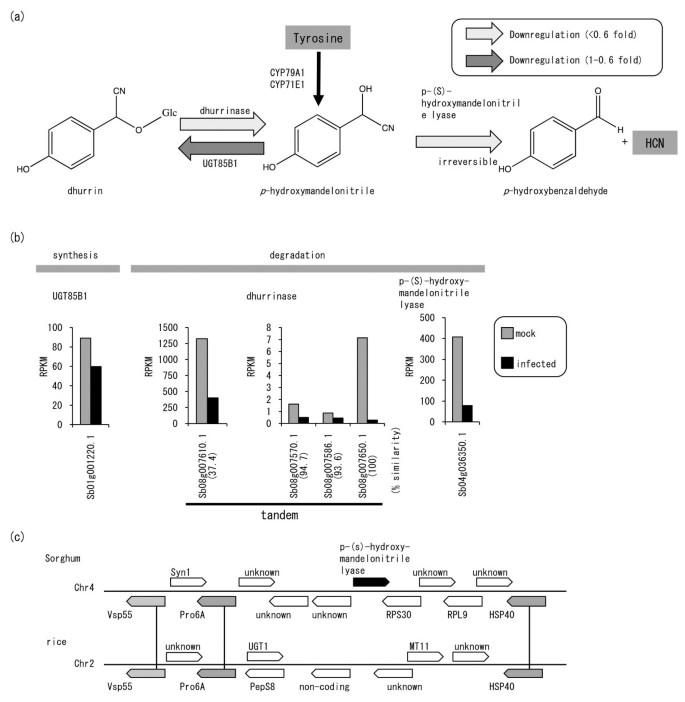
dhurrin的降解和合成是由不同的酶催化的。dhurrinase和P-(S)-羟苯乙腈裂解酶催化降解(图)5.A).在高粱中,有四个串联排列的dhhurrinase基因。其中3个dhurrinase基因(Sb08g007570、Sb08g007586和Sb08g007650)是高度保守的、同时复制的;它们编码的蛋白质至少有93.6%的氨基酸序列相同(图5.B).另一个基因Sb08g007610编码的蛋白与Sb08g007650的同源性较低(37.4%),虽然Sb08g007610接近三个推测的同源性,但其基础表达量高于其他三个。4个dhurrinase基因表达均下调(0.04 ~ 0.53倍;数字5.B;额外的文件1:表S1)。用于降解Dhurrin的另一个基因,P-(S) - 羟基腈裂解酶基因(SB04G036350)极其下调(0.20倍;图5.B;额外的文件1:表S1)。相反,由UGT85B1(SB01G001220)催化的Dhurrin生物合成的基因[13)(图5.A),轻度下调(0.67倍;数字5.B;额外的文件1:表S1)。因此,与合成相比,降解明显受到抑制,这表明病原菌感染可能促进dhurrin的积累。
Dhurrin的合成与降解。(一个) dhurrin的合成和降解途径。酪氨酸经对羟基苯乙腈中间体合成Dhurrin;由CYP79A1和CYP71E1催化。因此,在合成和降解过程中,dhurrin的含量受到调节。在合成途径中,UDP-Glc对羟基苯乙腈糖基转移酶UGT85B1将对羟基苯乙腈转化为dhurrin。在降解途径中,dhurrinase和p-(S)-羟苯乙腈裂解酶依次降解dhurrin,不可逆地释放氰化氢(HCN)。(b) dhurrin降解基因下调。比较了模拟感染(灰色条)和病原感染(黑色条)叶片中每个基因的RPKMs。(c)对羟基苯乙腈基因的区域及相应的水稻区域。高粱中编码液泡蛋白分类55蛋白样蛋白(Vps55)、26s蛋白酶调节亚基6A (Pro6A)和热休克蛋白40 (HSP40)的基因在水稻2号染色体上有相应的基因。水稻相应区域的基因编码udp -糖基转移酶91D1 (UGT;Os02t08039000),肽酶S8 (PepS8;Os02t0803900), 11型甲基转移酶(MT11;Os02t0804300)、未知蛋白(Os02t0804100、Os02t0804400)或非编码蛋白(Os02t0804000)。高粱中p-(S)-羟基mandelonitrile lyase邻近的基因,编码synaptobrevin 1(Syn1)、40s核糖体蛋白S30 (RPS30)和50s核糖体蛋白L9 (RPL9),在水稻中没有相应的基因。
我们将高粱中负责dhurrin合成的基因组区域与水稻中相应的区域进行了比较。p-(S)-羟苯乙腈裂解酶催化释放强效毒素HCN的关键步骤(图)5.A).高粱中p-(S)-羟苯乙腈裂解酶基因位于蛋白酶6A (Pro6A)基因和热休克蛋白40 (HSP40)基因之间(图)5.C).相应水稻区域的基因编码udp -糖基转移酶91D1 (Os02t08039000)、肽酶S8 (Os02t0803900)、甲基转移酶11型(Os02t0804300)或未知蛋白(Os02t0804100、Os02t0804400),或非编码(Os02t0804000)。因此,在水稻基因组中没有发现p-(S)-羟苯乙腈裂解酶基因,该基因负责dhurrin降解和HCN释放的最后一步5.C),支持dhurrin是高粱特有的有毒化学物质的假设。
Sorgoleone.
高粱酮是一种脂质苯醌,仅由该属的成员产生高粱[34-36[烷基间苯二酚合成酶(ARSs)在生物合成高粱酮中起重要作用,高粱酮通过使用中链到长链脂肪酰基辅酶a起始单元生成5-烷基间苯二酚[37.].ARS基因(SB08G003170,SB02G034030,SB05G022500,SB05G022510)[38.]在本研究中未在叶片中表达(附加文件)1:表S1)。随着Sorgoleone参与化感,该基因可能仅在根毛中表达。
讨论
TCA周期的转录调节,氨基酸代谢和光合作用
高粱功能基因组分析是在2009年完成高粱BTx623基因组测序后才开始的[17].为了鉴定高梁植物抗毒素合成的关键表达基因并阐明它们的协同表达,我们使用大规模平行测序技术对mRNA进行了全序列分析1);基于映射读数的血压鉴定差异表达基因,包括未经发布的基因(表格 2;图12;附加文件123.4.:表S1-S4)。我们通过使用生物学重复的QRT-PCR实验验证了这些注释或携带沟槽预测的未解式基因的差异表达(附加文件6.:图S3)。
激活TCA循环中的乙醛分流,涉及异柠檬酸裂解酶和雄性合成酶的作用(图3.A). TCA循环的分流途径允许通过绕过CO增加碳化合物的生产2-生成步骤的三羧酸循环,并有助于合成细胞成分,如细胞壁多糖,核苷酸,氨基酸。shikimate通路中的基因普遍表达(附加文件1:表S1);这加强了Phe和Tyr的供应,这是植物脂蛋素的前体(图3.C)乙醛酸分流广泛存在于植物、细菌和真菌中[39.].在植物中,乙醛分流器对植物幼苗的生长具有主要重要性;它涉及将储存的脂质转化为碳水化合物,其在光合作用前用作原发性营养源[40].然而,酒窖组分的合成导致了TCA循环中组分的消耗。为了弥补这一损失,可以由谷氨酸提供三羧酸循环的底物琥珀酸,因为谷氨酸脱羧酶(Sb01g041700)的产生是高度诱导的,它催化从谷氨酸到琥珀酸的第一步(图)3.B).因此,乙醛酸转导的增加表明TCA循环从能量生产到酒窖组分合成的作用发生了变化。
氨基酸不仅是蛋白质的组成部分;它们也作为抗病原体代谢产物的生物合成前体。Tyr脱羧反应(图3.c)是制备复合异喹啉生物碱的第一步,其包含在各种植物中发现的超过2500种已知化合物[41.].多酚氧化酶基因的上调(附加文件5.:图S2)还支持异喹啉生物碱的合成(附加文件5.:图S2)。PALS,这是强度表达的(附加文件5.图S1),通过催化苯丙氨酸脱氨基反应,参与黄酮类化合物生物合成的第一步(图S1)3.C)。SER乙酰转移酶将SER代谢与CYS生物合成链接(图3.C)。Cys用作各种含硫代谢物的前体,包括谷胱甘肽(GSH),辅因子,必需维生素和硫磺酸酯[42.-44.].谷胱甘肽s -转移酶基因(Sb02g003090.1, Sb01g030880.1;额外的文件1:表S1)还支持激活GSH依赖性排毒。这些氨基酸代谢酶位于初级和次生代谢的分支点处,表明它们的上调能够对途径不可逆转承诺(图3.C)。
在C3植物烟草中观察到光合作用和防御相关基因表达之间的负相关[45.土豆[46.].相比之下,高粱具有C4光合作用的基因[17];之前鉴定的7个C4光合作用基因(2个碳酸酐酶,1个苹果酸脱氢酶,苹果酸酶,磷酸烯醇丙酮酸羧化酶,丙酮酸正磷酸二激酶)中有6个下调2:表S2)。即使变化很小(0.35到0.71折;附加文件2:表S2),光合作用基因的基础表达水平高(例如,丙酮酸正磷酸二磷酸氨基磷酸的RPKM [模拟感染]为3915.65;附加档案5.:图S2和附加文件1:表S1),因此转录本的绝对数量将发生重大变化。这一反应支持了高粱C4光合作用与防御相关基因表达之间的负相关关系。
高粱特异反应的协调基因表达
我们的mRNA-seq分析揭示了合成高粱特定植物化学物质的关键酶步骤的转录调控。通过全基因组分析,我们还确定了导致植物抗毒素积累的序列反应缺失步骤的候选基因。高粱BTx623的孢子侵染后,叶片呈典型的红橙色病变b . sorghicola.Apigeninidin,3-脱氧菁蛋白之一,在感染后积累b . sorghicola(图4.d)。感染后也积累了3-脱氧菁蛋白Colletotrichumsublineolum[2] 要么Cochliobolus heterostrophus[47.].在BTX623中,我们发现协调基因表达和基因的抑制;这包括CHS,CHI,未爆发的DFR基因(CUFF.115357.1)和推定的花青素烷基酶候选(SB06G029550)的上调,以及抑制F3H和ANS基因(图4.一种)。这些研究结果表明,在感染后,3-脱氧菁霉素,但不是花青素的积累发生b . sorghicola.在另一种高粱添加物DK46中,花青素色素通过F3H、DFR和ANS催化的连续反应积累[28,这表明编码这些蛋白质的基因表达在高粱育种过程中发生了变化。
控制这些基因的协调表达是什么?作为候选人,黄色种子1(日元),编码myb型调控蛋白,在3-脱氧花青素介导的高粱种子果皮色素沉着中起关键作用;删除的日元BTX623的等位基因在没有这些3-脱氧水黄酮颜料的情况下产生种子[48.].推定的类黄酮3'羟基杂化酶(F3'H)基因的表达在高粱的控制下日元合成3-脱氧花青素植物抗毒素的基因[49.].P1, 一种y1.玉米中的同源物,激活CHS和CHI编码基因的表达[50.].在这项研究中,叶形表达y1.完全抑制或没有感染b . sorghicola(附加文件1:表S1),但编码CHS,CHI和F3'H的基因差异化表达(附加文件5.:图S1和S2)。因此,我们认为种子和叶片之间的植物素合成的调节可能不同。其他转录因子可能是在BTX623的叶片中表达3-脱氧菁蛋白产生的基因。诱导转录因子家族的基因,如ERF,WRKY,DREB和锌指家族(附加文件)4.:表S4)。在高粱基因组中也复制了转录因子。例如,在植物进化过程中,许多wrky已经被注释,并有一个谱系特异性的基因扩展:一个在衣藻reinhardtii,37岁的苔藓Physcomitrella金属盘其中,拟南芥中有74个,大豆中近200个,高粱中有93个[51.那52.].扩大该家庭的基因数量(即Wrky)可能与持续发展的高度复杂的防御机制与病原体共同发展的持续发展有关。
Dhurrin含量可以通过合成和降解的变化来调节(图5.一个);dhurrin的降解导致HCN的释放,HCN可对动物、昆虫、真菌和植物致命[13那53.那54.].在高粱基因组中,我们鉴定了负责dhurrin代谢的基因,我们发现病原菌感染有利于dhurrin的积累,而不是降解(图)5.b)。由于HCN的释放抑制了植物植物素生产[55.],HCN对植物可能比侵略者更损害。因此,在真菌感染的情况下,可能严格抑制负责Dhurrin降解的基因。而且,表达了CYP79A1,这是对合成p-羟基腈的合成(Dhurrin的中间体;图5.A),也被感染轻微抑制(附加文件1:表S1),而且CYP79A1通过喂食绿虫来诱导表达[56.].因此,与昆虫喂养中的真菌感染中的Dhurrin有关的防御机制可能不同。
高粱和水稻分裂后植物植物素合成的进化史
高粱基因组的大小约为730 MB [17,是水稻基因组389 Mb的两倍[57.].这种大小上的差异主要是由于重复序列的含量不同:高粱基因组中55%由逆转录转座子序列组成,而水稻基因组较小(26%)[17].遗传对准[58.]及细胞学图[59.]表明高粱和水稻具有相似数量的欧海棠(分别为252和309 MB),主要是相连的基因令[60.].然而,高粱基因组中的一些基因在高粱-水稻分裂后被复制。我们证明了编码芳香- l -氨基酸脱羧酶的基因的串联复制和病原菌诱导表达的多样性(图)3.b),DFR,推定的花青素还原酶(图4.dhurrinase(图B)5.B), PAL, CHS(附加文件5.:图S1),F3'H和多酚氧化酶(附加文件5.:图S2)。通过在高粱 - 米分裂后获得的高粱特异性基因进行高粱特异性基因来解释高粱特异性植物学的合成,其在高粱分裂后获得的(图4.D5.C)高粱基因组有三个连续重复的芳香- l -氨基酸脱羧酶基因(图3.B)和6个PAL基因(附加文件5.:图S1),但水稻基因组有两种串联重复的芳族L-氨基酸脱羧酶基因和四个PAL基因[61.],建议在高粱分裂后获得额外的副本,从而加强了途径。含有细胞色素P450含有植物植物素合成和毒素的清除的含域的基因,在高粱中具有丰富的高粱,其具有326个这样的基因,而在水稻中为228个[17],即使目标产品没有完全识别体内.高粱中的这些重复很可能导致了它们基因组序列和表达的多样性;这些基因因此在进化的时间尺度上发展了不同的功能。
mRNA-seq在病原诱导基因鉴定中的优势
MRNA-SEQ提供有关所有转录基因的信息,而无需依赖注释。整个基因组百瓦阵列也可用于识别未经发布的转录物,但不是用于替代剪接变体;这是MRNA-SEQ在微阵列技术的优势。我们在映射读数的血压基础上预测了成绩单;7674型转录物在植物血红素中未被宣传(图2一种)。差异表达的未经发布的转录物编码,例如,与DFR相似的蛋白质,负责3-脱氧藻霉素生物合成,或玉米ZRP4[27],编码o- 参与Suberin Biosynthesis的甲基转移酶(图2B;额外的文件3.:表S3)。Suberin是亲脂性细胞壁屏障中聚合物基质的组分。这些障碍控制气体,水和溶质的势次,它们也有助于保护植物免受生物和非生物胁迫和控制植物形态[62.].未注释的差异表达基因只能通过mRNA-seq进行鉴定。mRNA-seq能够识别和区分每个重复基因的表达;因此,它是分析具有大量这种重复的基因组的强大工具。这种mRNA-seq的应用在代谢途径方面产生了许多新的线索和假设。转录组和代谢组之间的功能连接非常重要,今后应进行系统研究。
最小化技术错误很重要。我们以前经过验证了我们基于序列的基于阵列技术的基于序列的基础表达分析。对于来自芽的每个基因(N = 14,575) and roots (N = 14,861), the ratio obtained from the array and the corresponding ratio obtained from RPKM were highly correlated over a broad range (r = 0.72 in shoot and 0.80 in root) [22].此外,我们通过使用QRT-PCR为感兴趣的基因进行QRT-PCR来证实差异表达(附加文件6.:图S3)。因此,我们认为我们的序列方法通常作为基因表达分析技术有效。
在大规模平行测序技术的快速进展之后,全mRNA测序已用于高粱中的基因表达谱。在本文正在审查的时间内,转录组分析高粱双色响应于渗透胁迫和脱落酸报道[63.].
结识
病原体感染在TCA循环中激活乙氧基化物分流;这改变了TCA周期从能量产生到细胞组分的合成的作用。编码位于植物熟素合成或硫依赖性排出的初级和次生代谢之间的分支点位于分支点处的氨基酸代购酶的基因进行了上调。对病原体感染的协调基因表达表明高粱特异性植物化学素3-脱氧藻霉素的积累。串联重复推定鉴定寄生虫的特定基因高度上调。在水稻基因组的相应区域中没有发现合成这些高粱特异性植物化学物质的关键酶。因此,病原体感染显着改变了特定常规蛋白酶的表达,其借助于高粱特异性代谢网络涉及参与的酶。
方法
植物材料和目标叶斑病感染
BTX623,高粱(美国二色的(L.)Mohench)易受靶叶斑的栽培品种感染b . sorghicola孤立BC-24(农业部,林业和渔业部(MAFF)第511379号)。在蔬菜汁(Campbell V8)琼脂上生长BC-24菌株在25℃下在黑暗中生长10天,然后在UV光下置于UV光下10天以诱导分枝发育。在0.01%Tween-20中收获了分类,将悬浮液的浓度调节至4×105.Conidia / ml。在7-或8叶阶段,用每罐5ml悬浮液喷洒高粱植物,然后置于1/10000-A瓦格纳盆中。将接种的植物在25℃下在黑暗中保持在湿室中16小时,然后在28.5至30℃下转移到温室。接种后七天,植物在液氮中冷冻以进行RNA提取。
mRNA测序
从每个植物组织中提取RNA时,采集至少5个生物复制,立即冷冻在液氮中,并混合,以尽量减少植物之间转录组不均匀的影响。使用RNeasy Plant试剂盒(Qiagen, Hilden, Germany)提取总RNA。使用Bioanalyzer 2100算法计算RNA质量(Agilent Technologies, Palo Alto, CA, USA);使用高质量(RNA完整性号>8)RNA。按照mRNA-Seq样本制备试剂盒(Illumina, San Diego, CA, USA)的协议,对总RNA样本(10 μg)进行cDNA构建,进行Illumina测序。用Oligo(dT)磁珠从总RNA样品中分离poly(A) RNA。将mRNA在94°C加热5分钟后片段化。采用随机六聚体引物分别在25℃/10 min、42℃/50 min、70℃/15 min条件下合成第一链cDNA。第一链合成后,加入dNTPs、RNaseH、DNA聚合酶I,在16℃下合成第二链DNA 2.5 h。用T4 DNA聚合酶和Klenow DNA聚合酶修复双链cDNA末端,用T4多核苷酸激酶磷酸化。 A single “A” base was added to the cDNA molecules by using Klenow exonuclease, and the fragments were ligated to the Paired End (PE) adapters from the Illumina mRNA-Seq kit. cDNA having 200- ± 25-bp fragments were collected. The purified cDNA was amplified by 15 cycles of PCR for 98°C/10 s, 65°C/30 s, and 72°C/30 s using PE1.0 and PE2.0 primers.
构建基因模型并搜索编码已知蛋白质的基因的同源性
使用Illumina基因组分析仪IIX进行测序(单读)cDNA。累积了两种技术复制的数据(来自模拟或病原体感染的叶片的CDNA样品的两个测序纱线,对应于约28.7至34.6百万76磅的读数)。使用少录0.6的阈值阈值的默认illumina管线质量滤波器来识别具有低信噪比的簇。贞节被定义为“四个(基本类型)强度的最高比率与最高的两个的比率”。通过使用Bowtie(0.12.7)将通过过滤器读数映射到高粱参考基因组上[23]和TopHat (1.1.4) [24],有以下选项:段长度,25;最小内含子长度为30;最大内含子长度6000;最大的支安打,40;线程数:2。袖扣(0.9.3)[25用映射读数的刺激被用来预测基因。通过与植物血红素注释(SBIColor_79)进行筛选未筛选未经发布的转录物。为了预测未经发票的转录物的功能,针对Uniprot(rel.2001_01)和Refseq(版本45)(Ident≥30%并覆盖≥30%)进行Blastx搜索。基因组在氨基酸序列相似性的基础上分组了基因组织中基因系列的成员。通过使用Rap-dB(Gbrowse_syn)在高粱和水稻之间的同时性鉴定水稻基因组中的同源基因[61.].通过G-Test(FDR <0.01)鉴定对照和感染组织中差异表达(上或下或下降)的基因。通过使用Kegg(基因和基因组)数据库进行高度上调基因在代谢地图上映射到代谢图上[64.].
定量RT-PCR(QRT-PCR)
为了从每个植物组织中提取RNA,分别采集三个生物重复,并立即冷冻在液氮中。从转录子第一链cDNA合成试剂盒(Roche, Basel, Switzerland)中,在20 μ l反应混合物中逆转录1微克总RNA。qRT-PCR在20 μL反应混合物中进行,混合物中包含2 × SYBR Master Mix (Kapa), 1 μL cDNA模板(稀释倍数为1:10),以及新设计的引物(附加文件)7.:表S5)。使用具有其相对定量的软件(Ver.1.2)的浅线480系统进行每个样品的三种生物重复的QRT-PCR,基于Delta-Delta-CT方法(Roche)。在55℃,55℃下在55℃下进行QRT-PCR,在72℃下进行10 s。每种反应的表达水平均衡抗肌动蛋白基因的表达水平[65.].
薄层色谱法
被感染的叶片样本Bipolaris sorghicola收获,用含有0.1%HCl的甲醇在4℃下孵育过夜萃取颜料。将萃取的3-脱氧菁素在100℃下用1N HCl水解1小时[66.].用异戊醇提取苷元,干燥后溶于含0.1%盐酸的甲醇中。花青素苷元在TLC Cellulose F plates (Merck, Darmstadt, Germany)上开发,使用HCl:AcOH:water (3:30:60 v/v/v)作为溶剂。以化学合成的芹菜素(Fluka Sigma-Aldrich, St. Louis, MO, USA)为标准品。
加入数量
所有主要序列读取数据已被提交给DDBJ(日本DNA数据库)序列读取存档[DRA000387]。
参考
- 1.
kucj:植物中植物植物素,胁迫代谢和抗病性。植物病理学的年度审查。1995年,33:275-297。10.1146 / annurev.py.33.090195.001423。
- 2.
高梁植物抗毒素的合成及其对真菌入侵的位点特异性反应。中国科学(d辑):地球科学(英文版)。10.1126 / science.248.4963.1637。
- 3.
拟南芥类黄酮和黄酮醇苷的代谢。植物PhysiolBioch。中国科学(d辑),1998,36(1-2):135-144。
- 4.
Boudet AM:Lignins和Lignification:选定的问题。植物理性生物生物。2000,38(1-2):81-96。
- 5。
Vogt T:苯丙醇化生物合成。分子植物。2010,3(1):2-20。10.1093 / MP / SSP106。
- 6。
Mizutani M,OHTA D:土地植物进化期间P450基因的多样化。Annu Rev植物Biol。2010,61:291-315。10.1146 / Annurev-Arplant-042809-112305。
- 7。
余强:植物抗除草剂的进化过程。植物生态学报,2010,31(4):497 - 497。10.1146 / annurev - arplant - 042809 - 112119。
- 8。
LO SCC,De Verdier K,Nicholson RL:3-脱氧素蛋白植物脂素植物肝素和高粱Colletotrichum Sublineolum的累积。Physiol Mol Plant P. 1999,55(5):263-273。10.1006 / pmpp.1999.0231。
- 9.
Nielsen Ka,Tattersall DB,Jones Pr,Moller BL:Dhurrin生物合成中的代谢组形成。植物化学。2008,69(1):88-98。10.1016 / J.Phytochem.2007.06.033。
- 10.
植物毒素及其在植物防御中的作用[J]。植物生态学报,2002,5(4):300-307。10.1016 / s1369 - 5266(02) 00264 - 9。
- 11.
TATTERSALL DB,BAK S,JONES PR,OLSEN CE,NIELSEN JK,HANSEN ML,HOJ PB,Moller BL:通过工程染色藻糖苷的合成抵抗食草动物。科学。2001,293(5536):1826-1828。10.1126 / Science1062249。
- 12.
Selmar d,Irandoost Z,Wray V:Dhurrin-6'-葡萄糖苷,来自高粱双子的氰基染色剂。植物化学。1996,43(3):569-572。10.1016 / 0031-9422(96)00297-x。
- 13.
BUSK PK,Moller BL:高粱中的Dhurrin合成在转录水平上调,并通过较老植物中的氮肥诱导。植物理性。2002,129(3):1222-1231。10.1104 / pp.000687。
- 14。
zarnota MA, Paul RN, Dayan FE, Nimbal CI, Weston LA: sorgoleone的作用方式,生产定位,化学性质和活性:一种有效的高粱根系分泌物PSII抑制剂。草业科学。2001,15(4):813-825。10.1614 / 0890 - 037 x (2001) 015 (0813: MOALOP) 2.0.CO; 2。
- 15.
Zummo N,Gourley LM:Mississippi高粱的目标叶斑病(Bipolaris-sorghicola)的发生。植物DIS。1987,71(11):1045-1045。
- 16。
Kawahigashi H,Kasuga S,Ando T,Kanamori H,Wu J,Yonemaru J,Sazuka T,Matsumoto T:DS1的位置克隆,靶叶斑抗性基因对高粱Bipolaris Sorghicola的靶叶斑抗性基因。Al Appl Genet。2011,123(1):131-142。10.1007 / s00122-011-1572-1。
- 17。
帕特森啊,鲍德尔·杰,布鲁格曼·罗,杜宾克,格里姆伍德J,Gundlach H,Hellsten U,Mitros T,Poliakov A等:高粱双色基因组和草的多样化。自然。2009,457(7229):551-556。10.1038 / Nature07723。
- 18。
Sugarbaker DJ,Richards Wg,Gordon GJ,Dong L,De Rienzo A,Maulik G,Glickman JN,Chirieac LR,Hartman Ml,Taillon,等,恶性胸腔间皮瘤瘤的转录组测序。Proc Natl Acad Sci U S A. 2008,105(9):3521-3526。10.1073 / pnas.0712399105。
- 19.
Torres TT,MetTA M,Ottenwalder B,Schotterer C:通过大规模平行测序的基因表达分析。Genome Res。2008,18(1):172-177。
- 20。
ChIP-seq和RNA-seq研究的计算。Nat Methods. 2009, 6 (11 Suppl): S22-32。
- 21。
Wang Z,Gerstein M,Snyder M:RNA-SEQ:用于转录组织的革命性工具。NAT Rev Genet。2009,10(1):57-63。10.1038 / NRG2484。
- 22.
Mizuno H,Kawahara Y,Sakai H,Kanamori H,Wakimoto H,Yamagata H,Oono Y,Wu J,Ikawa H,Itoh T等,MRNA在鉴定中MRNA的巨大平行测序(oryza sativa l.)。BMC基因组学。2010,11:683-10.1186 / 1471-2164-11-683。
- 23.
Langmead B,Trapnell C,Pop M,Salzberg SL:超快速和记忆高DNA序列对人类基因组的对准。基因组Biol。2009,10(3):R25-10.1186 / GB-2009-10-3-R25。
- 24.
Trapnell C,Pachter L,Salzberg SL:Tophat:发现带RNA-SEQ的接头连接点。生物信息学。2009,25(9):1105-1111。10.1093 / Bioinformatics / BTP120。
- 25.
Trapnell C, Williams BA, Pertea G, Mortazavi A, Kwan G, van Baren MJ, Salzberg SL, Wold BJ, Pachter L:通过RNA-Seq转录本组装和定量揭示了细胞分化过程中未注释的转录本和亚型转换。生物技术学报,2010,28(5):511-515。10.1038 / nbt.1621。
- 26。
Mortazavi A,Williams Ba,MCCue K,Schaeffer L,Wold B:通过RNA-SEQ进行映射和定量哺乳动物转录om。NAT方法。2008,5(7):621-628。10.1038 / nmeth.1226。
- 27。
举行BM,Wang H,John I,Wurtele Es,COLBert JT:迫使O-甲基转移酶的MRNA优先在玉米根中积累,主要位于内胚层的区域中。植物理性。1993,102(3):1001-1008。10.1104 / pp.102.3.1001。
- 28。
刘虎,杜,楚,sh琴,黄yw,王米,楚图库,陶佑,罗c:高粱病原菌诱导3-脱氧霉苷素生物合成途径的分子解剖。植物细胞生理。2010,51(7):1173-1185。10.1093 / PCP / PCQ080。
- 29。
植物苯丙氨酸解氨酶及其在防御机制激活中的作用。化学通报。2006,100(7):486-494。
- 30.
Dayan Fe,Howell J,Weidenhamer JD:Sorgoleone的动态根渗出及其在Planta行动机制中。J Exp Bot。2009,60(7):2107-2117。10.1093 / JXB / ERP082。
- 31。
谢大勇,谢大勇,谢大勇,谢大勇:BANYULS编码的花青素还原酶在植物类黄酮生物合成中的作用。中国科学:地球科学。2003,29(6):591 - 598。10.1126 / science.1078540。
- 32。
Winkel BS:植物中的代谢窜。Annu Rev植物Biol。2004,55:85-107。10.1146 / annurev.arplant.55.031903.141714。
- 33。
杜Y,楚H,王M,Chu Ik,LO C:高粱鉴定黄酮植物植物素和病原体诱导黄酮合成酶II基因(SBFNSII)。J Exp Bot。2010,61(4):983-994。10.1093 / JXB / ERP364。
- 34.
zarnota MA, Paul RN, Weston LA, Duke SO:高粱种分泌高粱根毛的解剖。acta botanica sinica(云南植物科学学报),2014,34(6):643 - 648。10.1086/378661。
- 35.
Baerson SR,Dayan Fe,Rimando Am,Nanayakkara NPD,Liu CJ,Schroerder J,Fishbein M,Pan Z,Kagan Ia,Pratt LH,等:高粱双色毛发中的等等化学生物合成的功能基因组学研究。中国生物化学杂志。2008,283(6):3231-3247。
- 36.
Dayan FE, Rimando AM, Pan ZQ, Baerson SR, Gimsing AL, Duke SO:高粱。植物化学学报。2010,71(10):1032-1039。10.1016 / j.phytochem.2010.03.011。
- 37.
厨师D,Rimando Am,Clemente Te,Schroder J,Dayan Fe,Nanayakkara NP,Pan Z,Noonan BP,Fishbein M,Abe I等:在高粱双色毛发中表达的烷基鲁西酚合成酶在生物合成中起重要作用异络苯醌索耳酮。植物细胞。2010年,22(3):867-887。10.1105 / TPC.109.072397。
- 38。
Cook D,Rimando Am,Clemente Te,Schroder J,Dayan Fe,Nanayakkara NPD,Pan ZQ,Noonan BP,Fishbein M,Abe I等:在高粱双色毛发中表达的烷基鲁西酚合成酶在生物合成中起重要作用异络苯醌索耳酮。植物细胞。2010年,22(3):867-887。10.1105 / TPC.109.072397。
- 39。
异柠檬酸裂解酶和苹果酸合酶在细菌和真菌发病机制中的作用。微生物学进展。2009,32(4):591 - 598。
- 40。
Eastmond PJ, Graham IA:重新研究乙醛酸循环在油籽中的作用。植物科学进展,2001,6(2):72-78。10.1016 / s1360 - 1385(00) 01835 - 5。
- 41。
Facchini PJ,Huber-Allanach KL,Tari LW:植物芳香L-氨基酸脱羧酶:进化,生物化学,调节和代谢工程应用。植物化学。2000,54(2):121-138。10.1016 / s0031-9422(00)00050-9。
- 42。
beinert h:对硫磺的致敬。欧洲生物化学杂志。2000,267(18):5657-5664。10.1046 / J.1432-1327.2000.01637.x。
- 43。
Noctor G,Gomez L,Vanacker H,Voyer Ch:生物合成,隔室和传输之间的相互作用在控制谷胱甘肽稳态和信号传导中。实验植物学杂志。2002,53(372):1283-1304。10.1093 / jexbot / 53.372.1283。
- 44。
Watanabe M, Mochida K, Kato T, Tabata S, Yoshimoto N, Noji M, Saito K:比较基因组学和反向遗传分析揭示拟南芥丝氨酸乙酰转移酶基因家族不可缺少的功能。植物学报。2008,20(9):2484-2496。10.1105 / tpc.108.060335。
- 45。
acta botanica yunnanica(云南植物研究中心);acta botanica yunnanica(云南植物研究中心)植物营养与肥料学报。2001,25(2):453 - 457。10.1104 / pp.125.2.683。
- 46.
Kombrink E,Hahlbrock K:核心感染或Elicitor治疗的马铃薯叶中的核苷酸1,5-二磷酸羧化酶小亚基羧化酶的合成的快速,全身抑制。Planta。1990,181(2):216-219。10.1007 / BF02411541。
- 47.
高梁植物抗毒素包涵体与异养Cochliobolus的相互作用acta botanica sinica(云南植物研究),2002,61(5):267-271。10.1006 / pmpp.2003.0440。
- 48.
Boddu J,Svabek C,Ibroaheem F,Jones Ad,Chopra S:高粱MyB基因的缺失等位基因的表征,黄色种子1显示3-脱氧氟烷类硬样蛋白的损失。植物科学。2005,169(3):542-552。10.1016 / J.Plantsci.2005.05.007。
- 49.
ibraheem f,gaffoori,chopra s:黄酮类化合物依赖于炭疽糖叶的抗性,需要在高粱双色肌肉中有一个功能性的黄色种子。遗传学。2010,184(4):915-926。10.1534 / genetics.109.111831。
- 50.
Grotewold E, Chamberlin M, Snook M, Siame B, Butler L, Swenson J, Maddock S, Clair GS, Bowen B:通过转录因子的异位表达工程玉米细胞的次级代谢。植物学报。1998,10(5):721-740。
- 51.
Rushton PJ,Somssich IE,Ringler P,Shen QJ:Wrky转录因子。趋势植物SCI。2010,15(5):247-258。10.1016 / J.Plants.2010.02.006。
- 52。
张Y,王L:Wrky转录因子超家族:其在真核生物中的起源和植物中的扩张。BMC EVOL BIOL。2005,5(1):1-10.1186 / 1471-2148-5-1。
- 53。
Bough Wa,Gander Je:高粱幼苗的外源性L-酪氨酸新陈代谢和Dhurrin周转。植物化学。1971,10(1):67-77。10.1016 / s0031-9422(00)90252-8。
- 54。
阿德乌斯SRA: Dhurrin在青高粱幼苗中的周转。植物生理学。1999,94(3):1219-1224。10.1104 / pp.94.3.1219。
- 55。
李振华,李振华,李振华:氰生成抑制植物的主动防御反应。植物生理学。1989,90(1):33-36。10.1104 / pp.90.1.33。
- 56。
高粱对韧皮部取食蚜虫的防御决定因子的转录调控。植物营养与肥料学报。2004,29(1):1 - 8。10.1104 / pp.103.028324。
- 57。
IRGSP:基于图谱的水稻基因组序列。自然科学学报。2005,436(7):793-800。10.1038 / nature03895。
- 58.
Bowers JE, Abbey C, Anderson S, Chang C, Draye X, Hoppe AH, Jessup R, Lemke C, Lennington J, Li Z, et al:高粱高密度基因重组图谱,作为热带谷物和牧草结构和进化基因组学的框架。遗传学报。2003,16(1):362 - 368。
- 59.
Kim JS,Klein Pe,Klein RR,价格HJ,Mullet Je,Betelly DM:染色体识别和高粱双色的命名法。遗传学。2005,169(2):1169-1173。10.1534 / genetics.104.035980。
- 60。
Bowers JE, Arias MA, Asher R, Avise JA, Ball RT, Brewer GA, Buss RW, Chen AH, Edwards TM, Estill JC,等:比较物理定位将微同染色体的保存与染色体结构的重组联系起来。中国科学(d辑:地球科学),2005,32(6):591 - 598。10.1073 / pnas.0502365102。
- 61。
RINE_ANNOTATION_PROJECT:ORYZA Sativa SSP的策划基因组注释。raponica与拟南芥的比较基因组分析。Genome Res。2007,17(2):175-183。10.1101 / GR.5509507。
- 62.
李玉华,李玉华,李玉华,等:构建脂质屏障:角质和木质素的生物合成。植物科学进展,2008,13(5):236-246。10.1016 / j.tplants.2008.03.003。
- 63.
Dugas DV, Monaco MK, Olsen A, Klein RR, Kumari S, Ware D, Klein PE:高粱二色转录组对渗透胁迫和脱落酸响应的功能注释。基因组学杂志。2011,12:514-10.1186/1471-2164-12-514。
- 64。
Kanehisa M,Goto S:Kegg:Kyoto基因和基因组的百科全书。核酸研究。2000,28(1):27-30。10.1093 / nar / 28.1.27。
- 65。
施春华,朱立科,叶伟康,罗志强:高粱花青素和3-脱氧花青素生物合成中2种黄酮3'-羟化酶cdna的差异表达。植物生理学报。2006,47(10):1412-1419。10.1093 /卡式肺囊虫肺炎/ pcl003。
- 66。
shiizu T, Nakamura M, Kato Y, Yoshihara K, Sawai J, Terahara N:高粱种皮色素(高梁色)的结构、稳定性和抑菌活性。食品化学。1996,3:21-26。
致谢
作者感谢Takao Tsukiboshi博士为他处理真菌的宝贵实验建议。作者还感谢F. AOTA,K. Ohtsu和K. Yamada在样品准备方面的技术援助。本工作得到了日本农业,林业和渔业部的批准(农业创新的基因组学,SOR-0002和SOR-0006)。
作者信息
隶属关系
通讯作者
附加信息
作者的贡献
H. Kaw。,乔和H. Miz。制备的植物材料并进行了cDNA合成和QRT-PCR;H. Kan。和H. min。进行测序实验和主要数据分析;YK和TI进行了数据分析;H. Miz。,Y. Kaw。和TM设计了这项研究;H. Miz。写了手稿。所有作者阅读并认可的终稿。
Hiroshi Mizuno, Hiroyuki Kawahigashi, Yoshihiro Kawahara对这项工作做出了同样的贡献。
电子辅料
12870_2011_1091_moesm4_esm.xls.
附加文件4:表S4。表达比例和差异表达转录物的表达比率和ORF预测。(XLS 45 KB)
12870_2011_1091_moesm5_esm.pdf.
附加文件5:图S1。苯丙氨酸二次代谢与柚皮素相关的基因的表达。示出了苯丙氨酸氨酶(PAL),反式肉桂酸酯4-单氧基酶(C4H),4-作用:COA连接酶(4CL),Chalcone合酶(CHS)和Chalcone异构酶(Chi)的rpkms。PAL和CHS有Tandemly重复推定的伞菌。图S2。与靶叶点感染相关的基因的表达。显示F3'HS,DS1 LRR-RK,多酚氧化酶和C4光合作用基因的RPKM。F3'H和多酚氧化酶具有差异表达的串联重复的推定寄生虫。(PDF 62 KB)
12870_2011_1091_moesm6_esm.pdf.
附加文件6:图S3。实时荧光定量PCR (qRT-PCR)验证表达水平。对每个样品进行3个生物重复的qRT-PCR,并给出平均值和标准偏差。根据肌动蛋白基因的表达水平将每个反应的表达水平归一化。(PDF 191 KB)
作者的原始提交的图像文件
权利和权限
开放获取本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
Mizuno,H.,Kawahigashi,H.,Kawahara,Y。等等。全球转录组分析显示,在高粱生长过程中,重复的基因之间有不同的表达Bipolaris sorghicola交互。BMC植物BIOL.12,121(2012)。https://doi.org/10.1186/1471-2229-12-121
已收到:
公认:
发表:
关键词
- 柚苷配基
- 异柠檬酸裂解酶
- 乙醛分流器
- 异喹啉生物碱
- 次生代谢途径