- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
拟南芥apy酶AtAPY1定位于高尔基体而不是细胞外空间gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba12gydF4y2Ba、物品编号:gydF4y2Ba123gydF4y2Ba(gydF4y2Ba2012gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
两种高度相似的拟南芥apy酶AtAPY1和AtAPY2先前被证明参与植物的生长和发育,显然是通过调节细胞外ATP信号。研究了AtAPY1的亚细胞定位以证实其细胞外功能。gydF4y2Ba
结果gydF4y2Ba
转基因拟南芥系表达gydF4y2BaAtAPY1gydF4y2Ba融合到SNAP-(O)gydF4y2Ba6gydF4y2Ba采用-烷基鸟嘌呤- dna烷基转移酶(dna alkyltransferase)标记进行间接免疫荧光检测,在细胞点状结构中检测到AtAPY1。在稳定过表达的幼苗中发现了相同的信号模式gydF4y2BaAtAPY1-GFPgydF4y2Ba通过间接免疫荧光和实时成像。为了确定atapy1阳性结构的性质,gydF4y2BaAtAPY1-GFPgydF4y2Ba用FM4-64 (N-(3-三乙基氨基丙基)-4-(对二乙基氨基苯基-六三烯基)-二溴吡啶)标记染色处理表达苗,并与表达该基因的转基因株系杂交gydF4y2Ba反式gydF4y2Ba高尔基体标记gydF4y2BaRab E1dgydF4y2Ba.FM4-64和Rab E1d均未与AtAPY1共定位。然而,转基因拟南芥系表达gydF4y2BaAtAPY1-GFPgydF4y2Ba或者是荧光蛋白标记的高尔基标记gydF4y2BaMembrin 12gydF4y2Ba,gydF4y2Ba植物合成素gydF4y2Ba或gydF4y2Ba高尔基转运1蛋白同源物gydF4y2Ba显示co-localization。通过免疫金标记AtAPY1-GFP确认高尔基体定位。使用抗SNAP和GFP抗体、AtAPY1-GFP的实时成像和AtAPY1-GFP的免疫金标进行间接免疫荧光检测,未发现细胞外AtAPY1的存在。AtAPY1-GFP活性测定显示GDP、UDP和IDP是底物,但ATP和ADP都不是底物。为了确定AtAPY1是可溶性蛋白还是膜蛋白,分离微粒体膜并用各种增溶剂处理。只有SDS和尿素(非碱性或高盐条件)能够从微粒体膜释放AtAPY1蛋白。gydF4y2Ba
结论gydF4y2Ba
AtAPY1是一种完整的高尔基蛋白,具有高尔基酶特有的底物特异性。因此,它不可能像以前认为的那样调节细胞外核苷酸信号。我们认为AtAPY1可能通过调节高尔基体中的糖基化反应来发挥其生长和发育作用。gydF4y2Ba
背景gydF4y2Ba
术语“apyrase”(gydF4y2Ba一个gydF4y2BadenosinegydF4y2BapyrgydF4y2BaophosphatgydF4y2Ba日月光半导体gydF4y2Ba)是由Otto Meyerhof于1945年创造的,它是一种酶,可以切割ATP和ADP的磷酸酐键[gydF4y2Ba1gydF4y2Ba]。几十年后,另一个名称“ntpase”(gydF4y2BangydF4y2BaucleosidegydF4y2BatgydF4y2Ba国际扶轮gydF4y2BapgydF4y2BahosphategydF4y2BadgydF4y2BaiphosphohydrolgydF4y2Ba日月光半导体gydF4y2Ba)被正式提出[gydF4y2Ba2gydF4y2Ba]因为apyrase可以水解大量的核苷三磷酸和二磷酸(参见[gydF4y2Ba3.gydF4y2Ba])。许多原核和真核生物中都发现了酶(参见[gydF4y2Ba3.gydF4y2Ba]),它们都共享高度保守的区域[gydF4y2Ba4gydF4y2Ba]。在植物中,假设的功能多种多样,包括结瘤[gydF4y2Ba5gydF4y2Ba- - - - - -gydF4y2Ba9gydF4y2Ba],对外源性药物的抗性[gydF4y2Ba10gydF4y2Ba],磷酸盐清除[gydF4y2Ba11gydF4y2Ba]和增长[gydF4y2Ba12gydF4y2Ba- - - - - -gydF4y2Ba16gydF4y2Ba]。每个真核生物基因组筛选的存在的乙酰酶基因持有至少两个候选。在gydF4y2Ba拟南芥gydF4y2Ba,共有7个apyrase候选基因存在。我们的研究重点是两个拟南芥apyrase基因的功能gydF4y2BaAtAPY1gydF4y2Ba和gydF4y2BaAtAPY2gydF4y2Ba,其对应的蛋白质有87%的氨基酸相同。通过T-DNA(转移DNA)插入敲除两个apyrase基因中的一个,从而产生一个gydF4y2Baapy1gydF4y2Ba或gydF4y2Baapy2gydF4y2Ba单基因敲除(SKO)与野生型(WT)相比,表型无明显差异[gydF4y2Ba17gydF4y2Ba],但同时击倒两者gydF4y2BaAtAPY1gydF4y2Ba和gydF4y2BaAtAPY2gydF4y2Ba抑制花粉萌发[gydF4y2Ba17gydF4y2Ba对幼苗是致命的[gydF4y2Ba18gydF4y2Ba]。过度表达gydF4y2BaAtAPY1gydF4y2Ba或gydF4y2BaAtAPY2gydF4y2Ba导致下胚轴和花粉管更旺盛的生长[gydF4y2Ba12gydF4y2Ba]。然而,通过RNA干扰靶向抑制表达gydF4y2BaAtAPY1gydF4y2Ba在gydF4y2Baapy2gydF4y2BaSKO背景,抑制整个植物的生长,尤其是下胚轴和根的生长[gydF4y2Ba12gydF4y2Ba]。一些证据表明,这些生长效应是由调节细胞外ATP (eATP)信号的AtAPY1和AtAPY2介导的[gydF4y2Ba12gydF4y2Ba]:在生长的花粉管细胞外基质(ECM)中测量的Apyrase活性可以通过添加化学抑制剂或针对AtAPY1的多克隆抗体来降低。活性的降低同时提高了eATP水平并降低了花粉管的生长[gydF4y2Ba12gydF4y2Ba]。这些发现解释了当表达gydF4y2BaAtAPY1gydF4y2Ba和gydF4y2BaAtAPY2gydF4y2Ba并提供了第一个直接证据,证明酶在植物中作为细胞外核苷酸(如eATP)的调节剂起作用。在动物领域,外链酶和[eATP]之间的直接联系已经被证明[gydF4y2Ba19gydF4y2Ba]。类似地,已知eATP在动物中作为信号分子(参见[gydF4y2Ba20.gydF4y2Ba]),直到在过去的十年中才在植物中被认识到这一点(参见[gydF4y2Ba21gydF4y2Ba- - - - - -gydF4y2Ba23gydF4y2Ba])。gydF4y2Ba
本研究的目的是通过AtAPY1和AtAPY2在质膜或外质体上的定位来确认两种拟南芥apy酶的细胞外功能。自gydF4y2BaAtAPY1gydF4y2Ba和gydF4y2BaAtAPY2gydF4y2Ba在挽救双敲除apyrase (DKO)花粉萌发的能力上显示出功能冗余[gydF4y2Ba17gydF4y2Ba]和DKO突变体的幼苗活力[gydF4y2Ba18gydF4y2Ba],这两种酶可能存在重叠的亚细胞定位。因此,本研究只关注一种氨基酶的定位。gydF4y2Ba
获得了表达gydF4y2BaAtAPY1gydF4y2Ba融合到两个标签序列中的任意一个,gydF4y2Ba提前gydF4y2Ba或gydF4y2Ba绿色荧光蛋白gydF4y2Ba.为了鉴定atapy1阳性区室,细胞器特异性标记蛋白共表达并使用免疫金标记。出乎意料的是,酰基酶不是定位在质膜或细胞壁上,而是定位在高尔基体上。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
对于所有的实验,gydF4y2Ba答:芥gydF4y2Ba以Wassilewskija生态型为WT对照。在无菌条件下,在琼脂平板(4.3 gL)上培养1周gydF4y2Ba1gydF4y2BaMurashige Skoog (MS)盐,0.5 g LgydF4y2Ba1gydF4y2BaMES, pH 5.7(用KOH调节),1% (w/v)蔗糖,0.8% (w/v)琼脂)或液体培养基(见上文,不含琼脂),摇匀(80 rpm)。在琼脂板上放置一周后,将幼苗转移到土壤(Einheitserde, type P, Pätzer Inc., sinnal - jossa, Germany)中,在24°C、100 μmol光子m的光周期下生长16 hgydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
淀粉酶突变体的基因型背景和术语gydF4y2Ba
术语SKO是指基因的零等位基因纯合存在gydF4y2BaAtAPY1gydF4y2Ba基因(=gydF4y2Baapy1 / apy1gydF4y2Ba)或gydF4y2BaAtAPY2gydF4y2Ba基因(=gydF4y2Baapy2 / apy2gydF4y2Ba)。T-DNA无效突变gydF4y2Baapy1gydF4y2Ba和gydF4y2Baapy2gydF4y2Ba参考突变等位基因gydF4y2Baapy1-1gydF4y2Ba和gydF4y2Baapy2-1gydF4y2Ba,如Steinebrunner等人所述。[gydF4y2Ba17gydF4y2Ba]。符号“+”表示突变等位基因的WT对应物。产生两种apyrase DKO突变体:DKO- snap (=gydF4y2Baapy1 / apy1;apy2 / apy2gydF4y2Ba;gydF4y2Ba美籍西班牙人:AtAPY2gydF4y2Ba;gydF4y2BaAtAPY1: AtAPY1-SNAPgydF4y2Ba)和DKO-GFP (=gydF4y2Baapy1 / apy1;apy2 / apy2gydF4y2Ba;gydF4y2Ba美籍西班牙人:AtAPY2gydF4y2Ba;gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba)。两种类型的DKO突变体都携带gydF4y2BaAtAPY2gydF4y2Ba在基因的控制下gydF4y2Ba美籍西班牙人gydF4y2Ba启动子。构造的细节gydF4y2Ba美籍西班牙人:AtAPY2gydF4y2Ba发表于[gydF4y2Ba18gydF4y2Ba]。gydF4y2Ba美籍西班牙人gydF4y2Ba激振器花粉启动子区向内KgydF4y2Ba+gydF4y2Ba通道基因在花粉和花粉管中的特异表达[gydF4y2Ba24gydF4y2Ba]。gydF4y2Ba
一代的gydF4y2BaAtAPY1-SNAPgydF4y2Ba-互补型氨基酶DKO突变体(= DKO- snap)gydF4y2Ba
的开放阅读框(ORF)gydF4y2BaAtAPY1gydF4y2Ba融合到SNAP-tag序列,在原生控制下克隆gydF4y2BaAtAPY1gydF4y2Ba启动子区(nt−10 ~−1959;−1对应于腺嘌呤上游的第一个核苷酸gydF4y2BaAtAPY1gydF4y2Ba启动密码子)与网关技术(Invitrogen)。的gydF4y2BaAtAPY1-SNAPgydF4y2Ba序列显示在附加文件中gydF4y2Ba1gydF4y2Ba.对于snap标签,停止密码子从gydF4y2BaAtAPY1gydF4y2Ba生成c端与标签的融合。载体pSNAP-tag(m) (New England Biolabs)作为PCR模板gydF4y2Ba提前gydF4y2Ba标签序列。扩增引物对产生531 bp的产物,包含以下内容gydF4y2Ba提前gydF4y2Ba-特异性序列:5 ' -GACTGCGAAATGAAGCGCA-3 ' (SNAPlokattB3F;5 ' -TTAAGGCTTGCCCAGTCTGTG-3 ' (SNAPlokattB2R;反向)。反向引物引入终止密码子。将各自的PCR产物与匹配的pDONR载体(Invitrogen)重组,生成三个DNA元件的每一个进入克隆。通过引物序列将所需的重组位点引入PCR产物中。将三个入口克隆与二进制目标向量pGWB501 [gydF4y2Ba25gydF4y2Ba来形成最后的结构gydF4y2BaAtAPY1: AtAPY1-SNAPgydF4y2Ba.通过测序确定了进入克隆和表达克隆的序列。的gydF4y2Ba根癌土壤杆菌gydF4y2Ba应变GV3101 [gydF4y2Ba26gydF4y2Ba]用表达克隆转化,然后用于转化半合子的apyrase突变体gydF4y2Baapy1gydF4y2Ba突变(=gydF4y2Ba+ / apy1gydF4y2Ba),纯合子为gydF4y2Baapy2gydF4y2Ba突变(=gydF4y2Baapy2 / apy2gydF4y2Ba;SKO),并包含该构造gydF4y2Ba美籍西班牙人:AtAPY2gydF4y2Ba.用花浸渍法转化植株[gydF4y2Ba27gydF4y2Ba]。转基因系(T1代)在含50 μg mL潮霉素的琼脂板上生长gydF4y2Ba1gydF4y2Ba)、卵黄磷脂(PPT) (10 μ mLgydF4y2Ba1gydF4y2Ba卡那霉素(30 μg mL)gydF4y2Ba1gydF4y2Ba)。选择潮霉素的存在gydF4y2BaAtAPY1: AtAPY1-SNAPgydF4y2Ba, PPT供在场者使用gydF4y2Ba美籍西班牙人:AtAPY2gydF4y2Ba卡那霉素的存在gydF4y2Baapy1gydF4y2Ba或gydF4y2Baapy2。gydF4y2Ba
一代的gydF4y2BaAtAPY1-GFPgydF4y2Ba-互补型脲酶DKO突变体(= DKO- gfp)gydF4y2Ba
克隆gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba结构的详细描述见[gydF4y2Ba28gydF4y2Ba]。的ORFgydF4y2BaAtAPY1gydF4y2Ba经PCR扩增无终止密码子,克隆至pQE-30载体(Qiagen)。为了放大gydF4y2Ba绿色荧光蛋白gydF4y2BacDNA, pBIN mGFP5-ER [gydF4y2Ba29gydF4y2Ba作为模板。PCR产物在框架中克隆gydF4y2BaAtAPY1gydF4y2Ba该序列已经存在于pQE-30中,以使GFP与AtAPY1的c端进行翻译融合。得到的共轭函数gydF4y2BaAtAPY1-GFPgydF4y2Ba将ORF扩增并亚克隆到TOPO pCR2.1载体(Invitrogen)中。的gydF4y2BaAtAPY1-GFPgydF4y2BacDNA通过gydF4y2Ba生态gydF4y2BaRI酶切并克隆到二进制载体pLBJ21中[gydF4y2Ba30.gydF4y2Ba]。的gydF4y2BaAtAPY1-GFPgydF4y2Ba序列可作为附加文件gydF4y2Ba2gydF4y2Ba.转基因株系表达gydF4y2Ba绿色荧光蛋白gydF4y2Ba-tag可从拟南芥资源中心(库存号CS9114)获得。gydF4y2Ba
利用含有重组结构物的农杆菌,用花浸渍法对WT Wassilewskija植株进行了转化[j]。gydF4y2Ba27gydF4y2Ba]。在含有卡那霉素(30 μg mL)的琼脂板上选择T1代转化子gydF4y2Ba1gydF4y2Ba)。对于基因互补实验,纯合子gydF4y2BaAtAPY1-GFPgydF4y2Ba与转基因系杂交gydF4y2Baapy1gydF4y2BaSKO为半合子植物gydF4y2Baapy2gydF4y2Ba突变和携带gydF4y2BaAtAPY2gydF4y2BacDNA在gydF4y2Ba美籍西班牙人gydF4y2Ba启动子(=gydF4y2Baapy1 / apy1;+ / apy2gydF4y2Ba;gydF4y2Ba美籍西班牙人:AtAPY2gydF4y2Ba)。用PCR方法对卡那霉素耐药后代进行基因分型。gydF4y2BaApy1gydF4y2BaSKO植物含有gydF4y2BaAtAPY1-GFPgydF4y2Ba构造(=gydF4y2Baapy1 / apy1;+ / +;35 s:: AtAPY1-GFPgydF4y2Ba)被激怒了gydF4y2Baapy2gydF4y2BaSKO为半合子植物gydF4y2Baapy1gydF4y2Ba突变与表达gydF4y2BaAtAPY2gydF4y2Ba在…的控制之下gydF4y2Ba美籍西班牙人gydF4y2Ba启动子(=gydF4y2Ba+ / apy1;apy2 / apy2;美籍西班牙人:AtAPY2gydF4y2Ba)。选择卡那霉素组和PPT组的后代。gydF4y2Ba
补体脲酶DKO突变体的筛选gydF4y2Ba
为了筛选互补的apyrase DKO-SNAP和DKO-GFP突变体,从候选植物中提取基因组DNA,详见其他地方[gydF4y2Ba31gydF4y2Ba]。用于检测gydF4y2BaAtAPY1gydF4y2Ba,gydF4y2BaAtAPY2gydF4y2Ba,gydF4y2Baapy1, apy2gydF4y2Ba和gydF4y2Ba美籍西班牙人:AtAPY2gydF4y2Ba,所使用的引物组合如[gydF4y2Ba18gydF4y2Ba],相反的除外gydF4y2BaAtAPY1gydF4y2Ba-特异性引物改为A1I1R (5 ' - gcgagctagaaataccc -3 '),得到1 kb的PCR产物。的存在gydF4y2BaAtAPY1: AtAPY1-SNAPgydF4y2Ba结构被确认使用gydF4y2Ba提前gydF4y2Ba特异性引物SNAPlokattB2R和gydF4y2BaAtAPY1gydF4y2Ba-特异性引物A1E9F (5 ' -CCACTAGGAAGCGCAATAGA-3 ')位于外显子9。的gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba构建体使用gydF4y2BaAtAPY1gydF4y2Ba正向引物A1E9F和反向引物位于gydF4y2Ba绿色荧光蛋白gydF4y2Ba序列(GFP_rev 5 ' -TGTATAGTTCATCCATGCCATG-3 '),得到0.7 kb的PCR产物。gydF4y2Ba
共表达转基因系的产生gydF4y2BaAtAPY1-GFPgydF4y2Ba,要么gydF4y2BaYFP-(黄色荧光)- rab E1d, - syp32, - got1p同源物gydF4y2Ba或gydF4y2BaRFP -(红色荧光蛋白)- memb12gydF4y2Ba
由Geldner等人产生的四个转基因品系。[gydF4y2Ba32gydF4y2Ba表示标记gydF4y2BaYFP-Rab E1dgydF4y2Ba,gydF4y2BaYFP-Got1phomologgydF4y2Ba,gydF4y2BaYFP-SYP32gydF4y2Ba或gydF4y2BaRFP-MEMB12gydF4y2Ba在…的控制之下gydF4y2BaUBQ10gydF4y2Ba启动子从诺丁汉拟南芥库存中心获得。根据Geldner等人的建议,通过抗生素选择和基因组PCR对这些系进行了验证。[gydF4y2Ba32gydF4y2Ba]。纯合子转基因gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba植物与任何一种纯合子杂交gydF4y2BaUBQ10::YFP-Got1p同源物,YFP-SYP32gydF4y2Ba或gydF4y2BaRFP-MEMB12gydF4y2Ba植物。将F1后代选择在含有卡那霉素(30 μ mL)的琼脂板上gydF4y2Ba1gydF4y2BaPPT (10 μg mL)gydF4y2Ba1gydF4y2Ba)与十字架gydF4y2BaYFPgydF4y2Ba融合构建物或潮霉素(50 μg mL)gydF4y2Ba1gydF4y2Ba)与十字架gydF4y2Ba招标书gydF4y2Ba融合结构。在共聚焦显微镜下进行分析之前,对双抗性F1幼苗进行基因分型,以确定是否存在所需的融合结构。gydF4y2Ba
原生质体的制备gydF4y2Ba
Ten-day-oldgydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba在18°C的缓冲液(0.4 M山梨醇,20 mM HEPES-KOH pH 7.6, 2.5 mM EDTA, 5 mM MgCl)中消化转基因苗gydF4y2Ba2gydF4y2Ba, 10mm NaHCOgydF4y2Ba3.gydF4y2Ba0.1% (w/v)牛血清白蛋白,新鲜添加1.6% (w/v)纤维素酶Onozuka RS (Duchefa)和1.6% (w/v)宏酶R-10gydF4y2Ba根霉spgydF4y2Ba.(美国赛瓦))(gydF4y2Ba33gydF4y2Ba]。gydF4y2Ba
AtAPY1-SNAP的全载免疫荧光gydF4y2Ba
将10日龄的DKO-SNAP幼苗在4% (w/v)多聚甲醛(PFA)中固定1 h,并用1% (w/v)纤维素酶Onozuka RS (Duchefa)和1% (w/v)巨酶R-10处理gydF4y2Ba根霉spgydF4y2Ba.(Serva)在37°C下放置15分钟。用磷酸盐缓冲盐水(PBS)洗涤两次后,用1% (v/v) Triton X-100室温(RT)处理1小时。为了灭活所有内源性过氧化物酶,样品在甲醇:过氧化氢(200:1,v/v)中在室温下黑暗孵育30分钟。水洗后,用96% (v/v)乙醇处理1 min, PBS洗涤2次,用1% (w/v)脱脂牛奶(Fluka)封闭30 min。兔α-SNAP抗体(Open Biosystems, Huntsville, Alabama, USA) (1:50, 1% (w/v)脱脂牛奶)RT孵育至少1小时。PBS洗涤三次后,用1% (w/v)脱脂牛奶1:800稀释的山羊α-兔igg偶联辣根过氧化物酶(HRP) (GE Healthcare) RT孵育至少1小时。PBS洗涤三次去除二抗后,用2 μL异硫氰酸荧光素(FITC)酪酰胺(1 mg mL)处理幼苗gydF4y2Ba1gydF4y2Ba)加入50ml扩增缓冲液[gydF4y2Ba34gydF4y2Ba]在室温下或在4°C的黑暗中过夜至少1小时。根据Pernthaler等人的方法制备了FITC酰胺[gydF4y2Ba34gydF4y2Ba]并由Kerstin Röske提供。样品用PBS洗涤三次,保存在PBS中成像。gydF4y2Ba
AtAPY1-GFP的全载免疫荧光gydF4y2Ba
6天大的根尖gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba将转基因幼苗用4% (w/v) PFA固定在0.1 M磷酸盐缓冲液(PB, pH 7.4)中30 min,在8% (w/v) PFA ([gydF4y2Ba35gydF4y2Ba];Y-D Stierhof, personal communication),然后用80%甲醇/20% DMSO (Dent’s固定剂,[gydF4y2Ba36gydF4y2Ba])。用兔α-GFP (TP 401;很多没有。071519来自Torrey Pines, 1:100)和山羊α-兔Alexa Fluor 488 (Invitrogen;很多没有。430222;1:100),然后如前面所述嵌入Technovit 7100 [gydF4y2Ba37gydF4y2Ba]。用Keyence BZ 8000荧光显微镜对3个μm的切片进行分析(附加文件)gydF4y2Ba3.gydF4y2Ba)。gydF4y2Ba
用FM4-64和碱性pH处理gydF4y2Ba
出生7到10天gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba用15 μM FM4-64 (Invitrogen)在1 M Tris-HCl pH 8.0中真空浸润转基因幼苗。对于碱处理,采用了两种处理方法:(1)gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba将幼苗在普通MS液体培养基(pH 5.7)中培养5天,转移到碱性MS培养基(pH 8.1)中,再培养3天后成像[gydF4y2Ba38gydF4y2Ba[2]在常规MS液体培养基(pH 5.7)中培养8天,在成像前用自来水或Tris缓冲盐水(TBS) pH 7.5浸润至少2小时。gydF4y2Ba
共聚焦激光扫描显微镜gydF4y2Ba
DKO-SNAP植株(10 d)成像采用徕卡共聚焦多光子显微镜TCS SP5 MP。为了避免FITC漂白,样品在200 μL 1 M Tris-HCl pH 8.0, 800 μL水,9 mL甘油中加入抗褪色剂(0.233 g 1,4-重氮杂环(2.2.2)辛烷(Sigma)) [gydF4y2Ba39gydF4y2Ba]。FITC信号使用徕卡水浸物镜(HCX PL APO 63x/1.2 water Lbd.Bl.)捕获。探测器范围设置为494 ~ 530 nm。使用与FITC相同的参数和设置捕获WT幼苗(10 d)的自身荧光。使用Leica软件(LAS1.8.2)的染料分离工具对WT和DKO-SNAP样品的光谱图像进行线性解混分析,以识别fitc特异性信号。gydF4y2Ba
转基因植物材料含有gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba用蔡司Axio成像仪连接激光扫描显微镜LSM 710或780(卡尔蔡司)对结构进行成像。6至10 d龄的幼苗在水中和原生质中成像,山梨醇缓冲液pH为7.6(见原生质体制备),不含酶。使用蔡司Zen 2009和斐济相机对图像进行分析[gydF4y2Ba40gydF4y2Ba)软件。使用蔡司水浸物镜(C-Apochromat 40x/1.20 W Korr M27或C-Apochromat 63x/1.20 W Korr M27)。在氦氖(HeNe)激光594 nm激发线激发后,在601 ~ 708 nm范围内检测到叶绿素荧光。用488nm氩激光多线激发GFP,在490 ~ 520 nm范围内采集发射光谱。用氩激光器(514/561多束分束器)514 nm激发线激发YFP,在535 ~ 580 nm处采集发射光谱。RFP在561 nm处激发,在570 ~ 630 nm范围内检测到荧光。对于GFP与YFP或RFP的共成像,选择线序成像模式,在两条激发激光线之间快速切换。对于同一样品中GFP和YFP的检测,GFP在458nm处激发,YFP如上所述(多分束器458/514/594)。GFP和FM4-64的荧光成像采用488nm激发激光线同时进行,发射探测器分别为490 ~ 543nm和667 ~ 746nm。对于所有的双标记,狭窄的探测器入口狭缝带宽被选择,以避免荧光发射的漏穿。 Bright field-type images were acquired with the transmitted light detector.
AtAPY1-GFP的免疫金标记gydF4y2Ba
6天大的根尖gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba按照“AtAPY1-GFP全株免疫荧光”的描述固定转基因幼苗。将固定的样品按如下方法进行德康冷冻切片处理[gydF4y2Ba41gydF4y2Ba]。简而言之,将根尖在PB中洗涤数次,逐步渗透到明胶中,并在冰上冷却。单根尖块茎在冰上切开,在2.3 M蔗糖水中4°C孵育24 h,固定在pin (Leica no. 6)上。1670 - 1950),然后在液氮中冷冻。在配备FC6冷冻室的徕卡UC6上切割100纳米薄的切片,并用甲基纤维素蔗糖(1份2% (w/v)甲基纤维素(Sigma M-6385, 25 centipoises) + 1份2.3 M蔗糖)进行拾取。为了进行免疫金标记,将网格倒置放在37°C培养箱中的PBS滴液上20分钟,用0.1% (w/v)甘氨酸在PBS中洗涤(5x1min),用1%(w/v)牛血清白蛋白在PBS中阻断(2x5min),用一抗孵育1小时(α-GFP: Torrey Pines的TP 401, 1:50,或Abcam的ab290, 1:50)。PBS洗涤(4x2min)后,用10 nm或6 nm金偶联的Protein A孵育1 h, PBS洗涤(3x5s, 4x2min), 1% (v/v)戊二醛后固定(5min)。切片用蒸馏水(10x1min)洗涤,用中性草酸铀酰(2% (w/v) UA, 0.15 M草酸,pH 7.0)染色5min,在水中短暂洗涤,并用甲基纤维素醋酸铀酰(9份2% (w/v) MC + 1份4% (w/v) UA, pH 4)在冰上孵育5min。最后,将网格圈出,将MC/UA膜还原成均匀的薄膜并风干。切片在Philips Morgagni 268 (FEI)上进行80 kV的分析,并用MegaView III数码相机(Olympus)拍摄图像。 Areas were calculated using the ITEM-software (Olympus). Alternatively, 200-nm-thin sections were mounted on glass slides and stained with α-GFP and goat α-rabbit Alexa Fluor 488 for fluorescence analysis on a Keyence BZ 8000 fluorescence microscope.
Co-localization分析gydF4y2Ba
转基因植物共表达gydF4y2BaAtAPY1-GFPgydF4y2Ba,要么gydF4y2BaRFP-MEMB12gydF4y2Ba,gydF4y2BaYFP-SYP32gydF4y2Ba,gydF4y2BaYFP-GOT1p同族体gydF4y2Ba或gydF4y2BaYFP-Rab E1dgydF4y2Ba用共聚焦显微镜成像,用ImageJ对获得的双通道图像进行分析[gydF4y2Ba40gydF4y2Ba]。使用ImageJ的“Colocalization Threshold”和“Coloc2”工具生成相应的散点图和Pearson相关系数。gydF4y2Ba
AtAPY1-GFP的纯化gydF4y2Ba
起始材料的培养,将50mg种子在250ml烧瓶中50ml液体培养基中培养10 - 12d。幼苗用研钵和杵在液氮中研磨成细粉。每克植物材料,250 ~ 375 μL冷冻Tris- mes缓冲液(10 mM Tris, 2 mM MgCl)gydF4y2Ba2gydF4y2Ba加入30 mM KCl, pH 6.5,以1 mM MES pH 3调节)。细胞匀浆在室温下解冻,并通过细网(Miracloth, Calbiochem)过滤。滤液在1000℃下离心gydF4y2BaggydF4y2Ba4℃保温10分钟,清除杂物。上清液在8000℃离心gydF4y2BaggydF4y2Ba4℃保温10 min,弃丸。将上清液与100% (v/v)甘油1:1混合,保持酶活性,保存于- 80°C。纯化AtAPY1-GFP时,采用α-GFP抗体包被的96孔微滴板(GFP-multiTrap板,ChromoTek, Planegg-Martinsried,德国)。蛋白质提取物200微升(4-6 μL)gydF4y2Ba1gydF4y2Ba)每孔加入,在4°C下振荡(500 rpm)孵育2小时或过夜。用300 μL冷水Tris-MES缓冲液洗涤孔3次,去除未结合蛋白。gydF4y2Ba
淀粉酶活性测定gydF4y2Ba
为了确定apyrase的活性,一种基于Tognoli等人的测定方法[gydF4y2Ba42gydF4y2Ba]被使用。核苷酸底物购自Sigma,原液在水中制备。将核苷酸在Tris-MES缓冲液(pH 6.5或pH 5.5)中稀释至所需浓度,并在GFP-multiTrap板上以每孔130 μ l的等份加入固定化AtAPY1-GFP。反应在30°C下振荡(500 rpm)孵育1小时。在新的96孔透明微滴板(Greiner Bio-One, kremsmnster, Austria)上,将每种反应混合物的60 μL转移到两个独立的孔中,并加入120 μL新配制的0.375 M H的停止溶液,检测释放的磷酸盐gydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba0.75% (w/v) (NH)gydF4y2Ba2gydF4y2Ba)gydF4y2Ba4gydF4y2BaMoOgydF4y2Ba4gydF4y2Bah·4gydF4y2Ba2gydF4y2Ba0, 0.7% (w/v) SDS和3% (w/v) FeSOgydF4y2Ba4gydF4y2Bah·7gydF4y2Ba2gydF4y2Ba每口井都有。在RT下孵育10分钟后,在740 nm处读取样品的吸光度。为了确定磷酸盐污染和非特异性磷酸酶活性的背景,这些反应与WT蛋白提取物平行进行。从AtAPY1-GFP测定的读数中减去背景吸光度读数。gydF4y2Ba
微粒体膜蛋白的增溶作用gydF4y2Ba
幼苗从2毫克gydF4y2Ba35 s:: AtAPY1gydF4y2Ba-转基因gfp种子在60 mL液体培养基中培养2周,然后在液氮中研磨。将植物粉末悬浮于3 mL冷冻蛋白提取缓冲液中(50 mM HEPES KOH pH 6.5, 5 mM EDTA, 0.4 M蔗糖,1 mM AEBSF(4-(2-氨基乙基)-苯磺酰氟盐酸盐)(Sigma),完全不含EDTA的蛋白酶抑制剂鸡尾酒(Roche))。使用前立即加入AEBSF和抑制剂鸡尾酒。蛋白悬浮液通过单层奇迹布过滤,并在14000℃离心gydF4y2BaggydF4y2Ba在4°C下放置10分钟。上清液在100,000℃下进行超离心gydF4y2BaggydF4y2Ba在4℃下使微粒体膜形成1小时。等量的膜分别用2 M NaCl和0.2 M Na处理gydF4y2Ba2gydF4y2Ba有限公司gydF4y2Ba3.gydF4y2Ba, 0.2% (w/v) SDS, 4 M尿素或蛋白提取缓冲液单独冰敷30 min。然后,样品在10万度下离心gydF4y2BaggydF4y2Ba在4°C下孵育1小时,产生含有溶解蛋白(S100)和微粒体膜部分(P100)的上清。上清液在Vivaspin 2浓缩器(聚醚砜膜,10-kDa切断)中离心;萨托里乌斯)在12000英尺的温度下约20分钟gydF4y2BaggydF4y2Ba.用BCA蛋白检测试剂盒(Thermo Scientific)测定S100和P100组分的蛋白浓度。将等量(约40 μg)的膜组分和溶解蛋白装在SDS凝胶上并进行免疫印迹。gydF4y2Ba
SDS-PAGE和Western blot分析gydF4y2Ba
按照标准方案进行SDS-PAGE和半干免疫印迹。硝化纤维素膜(Schleicher & sch
加入数据gydF4y2Ba
AtAPY1gydF4y2Ba[TAIR: At3g04080]gydF4y2Ba, AtAPY2gydF4y2Ba[TAIR: At5g18280],gydF4y2BaGot1p同族体gydF4y2Ba[TAIR: At3g03180],gydF4y2BaMEMB12gydF4y2Ba[TAIR: At5g50440],gydF4y2BaRab E1dgydF4y2Ba[TAIR: At5g03520],gydF4y2Ba美籍西班牙人gydF4y2Ba[TAIR: At2g25600],gydF4y2BaSYP32gydF4y2Ba[TAIR: At3g24350]。gydF4y2Ba
结果gydF4y2Ba
用标记AtAPY1挽救幼苗致死性apyase双敲除表型gydF4y2Ba
其中一个目标是在亚细胞水平定位AtAPY1,以了解该蛋白如何在植物生长中发挥其功能。选择标记AtAPY1而不是培养抗体是因为AtAPY1和AtAPY2在氨基酸(aa)序列上非常相似:AtAPY1中只有一个6 -aa-片段(aa 44-49)与AtAPY2中相应的序列有4个不同的aa和2个相似的aa [gydF4y2Ba43gydF4y2Ba]。这两个序列之间的所有其他差异只包含一个或两个氨基酸。gydF4y2Ba
在可用的标签中,SNAP-tag [gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba似乎是最合适的。作为一个OgydF4y2Ba6gydF4y2Ba-烷基鸟嘌呤- dna烷基转移酶,SNAP共价结合苯基鸟嘌呤底物。有大量的底物耦合到不同的荧光染料和其他商业上可用的标签,使snap标签定位研究的多功能工具。的表达式gydF4y2BaAtAPY1-SNAPgydF4y2Ba被放置在原生启动子区域的控制下,因为过表达会导致本地化工件。尽管存在这种风险,另一种标记AtAPY1版本,AtAPY1- gfp,与强花椰菜花叶病毒融合gydF4y2Ba35个年代gydF4y2Ba启动子,因为ntpases的表达水平普遍较低[gydF4y2Ba46gydF4y2Ba]。gydF4y2Ba
SNAP-或gfp -标签被融合到AtAPY1的c端,以避免在亚细胞靶向过程中可能的n端切割而丢失标签。因为标签会损害蛋白质功能并导致错误定位[gydF4y2Ba47gydF4y2Ba],执行互补策略。击倒gydF4y2BaAtAPY1gydF4y2Ba和gydF4y2BaAtAPY2gydF4y2Ba(DKO)对幼苗是致命的[gydF4y2Ba18gydF4y2Ba]。DKO幼苗应该存活,如果补充了标记AtAPY1功能和正确定位。然而,使用gydF4y2Ba35个年代gydF4y2Ba启动子使得AtAPY1-GFP无法拯救DKO突变体,实验证实了这一点,因为该启动子在花粉中被关闭[gydF4y2Ba48gydF4y2Ba]。如果DKO花粉中没有AtAPY1- gfp,就不会形成后代,因为AtAPY1或AtAPY2的存在是花粉发芽的先决条件[gydF4y2Ba17gydF4y2Ba]。为了克服这一障碍,部分补充了apyrasegydF4y2Baapy2gydF4y2BaSKO工厂=gydF4y2Ba+ / apy1;apy2 / apy2gydF4y2Ba;gydF4y2Ba美籍西班牙人:AtAPY2gydF4y2Ba)作为转化的遗传背景,每个标记gydF4y2BaAtAPY1gydF4y2Ba构造。这些植物携带了gydF4y2BaAtAPY2gydF4y2Ba在花粉特异性启动子的控制下gydF4y2Ba美籍西班牙人gydF4y2Ba这保证了DKO花粉的存活。gydF4y2Ba
DNA是从含有其中一种的部分互补的SKO植株的后代中分离出来的gydF4y2BaAtAPY1: AtAPY1-SNAPgydF4y2Ba或gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba并用于PCR分型。几个DKO植物没有WTgydF4y2BaAtAPY1gydF4y2Ba和gydF4y2BaAtAPY2gydF4y2Ba分别鉴定为DKO-SNAP和DKO-GFP。两个突变体的PCR分析如图所示gydF4y2Ba1gydF4y2Ba答:的gydF4y2Ba美籍西班牙人:AtAPY2gydF4y2Ba正如预期的那样,DKO-GFP突变体中总是存在这种结构,但有趣的是,DKO-SNAP突变体中也存在这种结构。一种可能的解释是,在选择的启动子区域中缺少一些在花粉中最佳表达所必需的调控元件。启动子区域先前用于gydF4y2BaAtAPY1:格斯gydF4y2Ba分析(gydF4y2Ba12gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba]在3 '端长了1 kb,包括了上游的几乎整个基因(At3g04090)gydF4y2BaAtAPY1gydF4y2Ba.由于At3g04090基因被认为对于成功的互补是不必要的,所以它大部分被排除在gydF4y2BaAtAPY1: AtAPY1-SNAPgydF4y2Ba构造。gydF4y2Ba
apyrase双敲除的鉴定gydF4y2BaAtAPY1: AtAPY1-SNAPgydF4y2Ba或gydF4y2Ba35 s:: AtAPY1-GFP。gydF4y2Ba(一)gydF4y2Ba从DKO植株中分离出基因组DNAgydF4y2BaAtAPY1: AtAPY1-SNAPgydF4y2Ba(DKO-SNAP)或gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba(DKO-GFP),并进行PCR分析。PCR产物gydF4y2BaAtAPY1gydF4y2Ba(1.0 kb),gydF4y2BaAtAPY2gydF4y2Ba(0.9 kb), T-DNA零突变gydF4y2Baapy1gydF4y2Ba(0.7 kb)和gydF4y2Baapy2gydF4y2Ba(0.6 kb),gydF4y2BaAtAPY1-SNAPgydF4y2Ba(0.6 kb),gydF4y2BaAtAPY1-GFPgydF4y2Ba(0.7 kb)和gydF4y2Ba美籍西班牙人:AtAPY2gydF4y2Ba(0.4 kb),琼脂糖凝胶电泳分析。之前扩增产物检测呈阳性的植物基因组DNA作为阳性对照(+)。阴性PCR对照(−)在不添加任何DNA模板的情况下运行。gydF4y2Ba(B)gydF4y2Ba图中显示了用SNAP或gfp标记的AtAPY1拯救的WT、DKO和DKO的表型。遗传背景用彩色符号表示。拍摄8-d (WT)、14-d (DKO)、7-d (DKO- snap)、7-d (DKO- gfp)幼苗和30-d成年植株的图像。比例尺等于1cm。gydF4y2Ba
为了证实SNAP和gfp标记的AtAPY1可以挽救DKO的致死幼苗表型,我们分析了SKO和DKO的互补植株与WT和DKO幼苗的表型对比(图2)gydF4y2Ba1 bgydF4y2Ba)。SKO-SNAP (gydF4y2Ba+ / +;apy2 / apy2gydF4y2Ba;gydF4y2Ba美籍西班牙人:AtAPY2;AtAPY1: AtAPY1-SNAPgydF4y2Ba)及SKO-GFP (gydF4y2Baapy1 / apy1;+/+gydF4y2Ba;gydF4y2Ba美籍西班牙人:AtAPY2;35 s:: AtAPY1-GFPgydF4y2Ba)植物被纳入研究,以检查标记的apyrase对WT表型可能的显性负面影响。没有编码标记AtAPY1构建体的DKO幼苗表型异常,子叶肉质,无根(图2)gydF4y2Ba1 bgydF4y2Ba;[gydF4y2Ba18gydF4y2Ba])。这些幼苗过了这个阶段就不发育了。DKO植株表达gydF4y2BaAtAPY1-SNAPgydF4y2Ba或gydF4y2BaAtAPY1-GFPgydF4y2Ba另一方面,与野生型植物没有表型差异(图2)gydF4y2Ba1 bgydF4y2Ba)和SKO突变体(数据未显示)。gydF4y2Ba
致命的DKO (gydF4y2Baapy1 / apy1;apy2 / apy2;美籍西班牙人::AtAPY2)gydF4y2Ba能否通过改造来拯救gydF4y2BaAtAPY1gydF4y2Ba-gydF4y2Ba提前gydF4y2Ba或gydF4y2BaAtAPY1-GFPgydF4y2Ba使DKO-SNAP和DKO-GFP植物成为定位研究的合适工具。gydF4y2Ba
AtAPY1存在于点状结构中,但不存在于质膜或细胞外空间gydF4y2Ba
为了在共聚焦显微镜下定位AtAPY1在亚细胞水平,活的DKO-SNAP幼苗与snap兼容的荧光底物孵育,以标记AtAPY1- snap融合蛋白。使用两种细胞渗透性荧光底物:红色荧光四甲基罗丹明- star和绿色荧光BG-505(均由Andreas Brecht提供,前Covalys Biosciences, Basel, Switzerland)。虽然特异标记融合蛋白gydF4y2Ba在活的有机体内gydF4y2Ba在酵母中取得了成功[gydF4y2Ba49gydF4y2Ba]以及动物和人类细胞培养物[gydF4y2Ba50gydF4y2Ba- - - - - -gydF4y2Ba52gydF4y2Ba],高背景使得在拟南芥幼苗中无法检测到atapy1 - snap特异性信号。被测染料通过细胞壁进入细胞,但即使水洗14小时也不能去除多余的荧光底物(数据未显示)。gydF4y2Ba
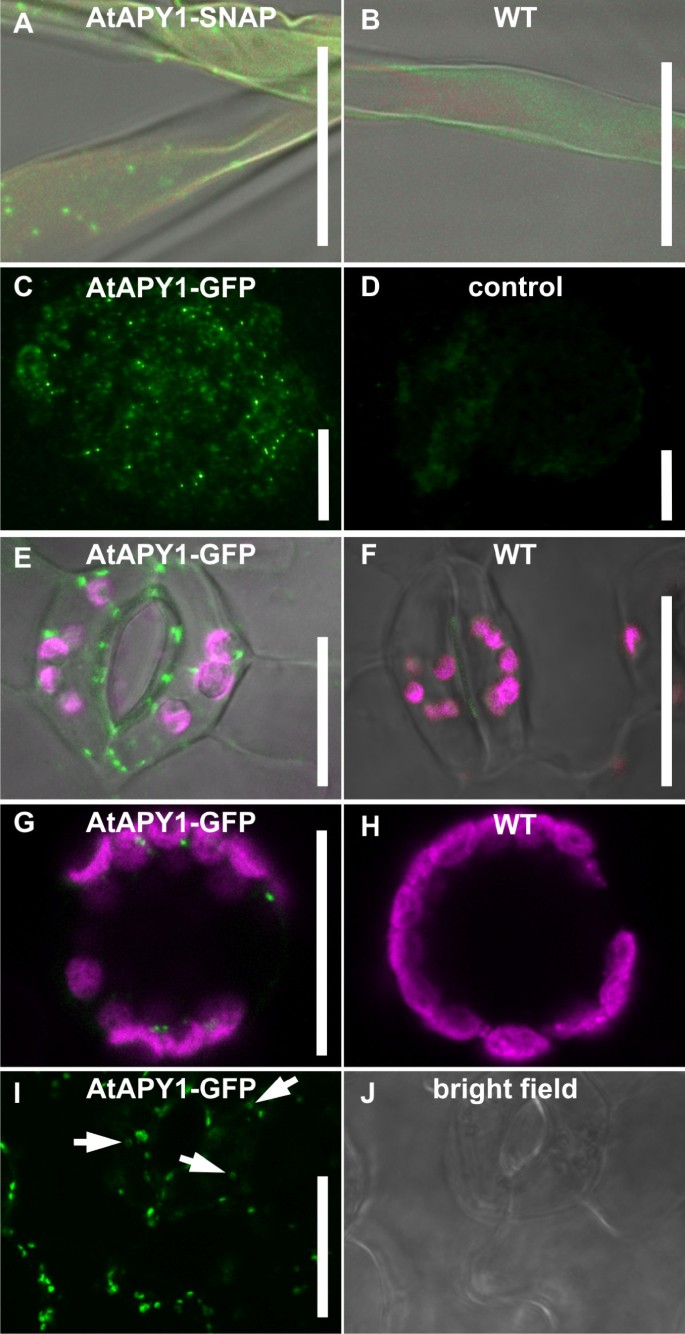
因此,选择间接免疫荧光作为一种不同的方法。DKO-SNAP幼苗固定。细胞壁消化和质膜渗透后,用抗snap标签的一抗孵育。经过几个洗涤步骤后,加入fitc标记的二抗,观察CLSM的AtAPY1-SNAP。背景很低,但没有检测到特定的信号(数据未显示)。为了增加荧光信号,采用了酪酰胺信号放大技术[gydF4y2Ba53gydF4y2Ba]。该技术利用过氧化物酶活性将大量标记的底物在邻近区域进行共价偶联。因此,我们不添加fitc标记的二抗,而是与fitc偶联酪酰胺联合添加hrp标记的抗体。TSA提高了DKO-SNAP幼苗的信噪比,细胞内可见点状结构(图2)gydF4y2Ba2gydF4y2BaA)在WT中没有发现(图2)gydF4y2Ba2gydF4y2BaB).选择根毛作为适合定位的细胞类型,因为启动子-葡萄糖醛酸酶分析表明gydF4y2BaAtAPY1gydF4y2Ba在根毛以及其他细胞类型中的保卫细胞中强烈表达[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba18gydF4y2Ba]。gydF4y2Ba
AtAPY1存在于细胞内的点状结构中,但不存在于细胞外空间。gydF4y2Ba样品形貌(gydF4y2Ba一个gydF4y2Ba,gydF4y2BaBgydF4y2Ba,gydF4y2BaE-JgydF4y2Ba)及荧光显微镜(gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2Ba)各种细胞类型的图像被描绘。所有WT对照图像都使用与转基因植物相应图像相同的CLSM设置进行捕获。FITC、Alexa Fluor 488和GFP荧光显示为绿色,叶绿素自身荧光显示为洋红色。荧光信号与亮场图像叠加在一起gydF4y2BaA、BgydF4y2Ba,gydF4y2BaEgydF4y2Ba和gydF4y2BaFgydF4y2Ba.标尺= 20 μm。gydF4y2Ba(A, B)gydF4y2Ba将DKO-SNAP和WT幼苗的根毛固定后,分别用α-SNAP抗体和二抗α-兔IgG偶联辣根过氧化物酶孵育。加入FITC酪酰胺增强荧光信号。在多次独立的实验中修改间接免疫荧光检测的参数,直到获得如图所示的fitc特异性荧光信号。gydF4y2Ba(C, D)gydF4y2Ba两百纳米的德康冷冻切片通过根尖gydF4y2BaAtAPY1-GFPgydF4y2Ba将表达苗固定,用gydF4y2Ba(C)gydF4y2Ba或不gydF4y2Ba(D)gydF4y2Baαgfp抗体。所有样品与次级α-兔Fab片段偶联Alexa Fluor 488孵育。这些照片gydF4y2Ba(C)gydF4y2Ba和gydF4y2Ba(D)gydF4y2Ba都是用相同的曝光时间拍的。gydF4y2Ba(E, F)gydF4y2Baa的两个保护细胞gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba转基因和野生型幼苗。在至少20个独立的实时成像中获得了点状绿色荧光信号。gydF4y2Ba(G)gydF4y2Ba原生质体表达gydF4y2BaAtAPY1-GFPgydF4y2Ba和WT原生质体gydF4y2Ba(H)gydF4y2Ba都是由子叶制备的。绿色和品红荧光信号的叠加显示。这些图像代表了三个独立原生质体的结果。gydF4y2Ba(I, J)gydF4y2Ba本文用GFP荧光和亮场图像分析了一种树子叶的同一表皮切片gydF4y2BaAtAPY1-GFPgydF4y2Ba碱性条件下生长的过表达苗显示了三个幼苗的代表性成像结果。甜甜圈或马蹄形荧光结构的高尔基堆的典型图像从顶部由白色箭头表示。gydF4y2Ba
克服弱表达水平gydF4y2BaAtAPY1gydF4y2Ba采用间接免疫荧光法对转基因植株进行表达gydF4y2BaAtAPY1gydF4y2Ba-gydF4y2Ba绿色荧光蛋白gydF4y2Ba在强35S启动子的控制下我们在两种不同的方法中使用了针对GFP的一抗和Alexa Fluor 488偶联的二抗:200纳米薄德康冷冻切片包埋后标记(图2)gydF4y2Ba2gydF4y2Ba2.选C。预包埋标记,然后包埋在Technovit 7100树脂中,切片(附加文件)gydF4y2Ba3.gydF4y2Ba)。在两个实验中,细胞内的点状信号都可以在根部得到证实(图2)gydF4y2Ba2gydF4y2BaC)和根毛(附加文件gydF4y2Ba3.gydF4y2Ba)。在细胞壁和质膜上未检测到信号,在没有一抗的对照组(图1)gydF4y2Ba2gydF4y2BaD)。gydF4y2Ba
为了验证免疫荧光获得的成像数据,采用了第二种检测方法。转基因植物表达gydF4y2BaAtAPY1gydF4y2Ba绿色荧光蛋白gydF4y2Ba是成像gydF4y2Ba在活的有机体内gydF4y2Ba样品形貌。图示细胞内点状图案与之前的相同gydF4y2BaAtAPY1-SNAPgydF4y2Ba和gydF4y2BaAtAPY1-GFPgydF4y2Ba在保护细胞中观察到表达植株(图2)gydF4y2Ba2gydF4y2BaE),子叶表皮(附加档gydF4y2Ba4gydF4y2BaA),下胚轴(附加文件gydF4y2Ba4gydF4y2BaB)和根(附加文件gydF4y2Ba4gydF4y2BaC)。WT对照组没有出现WT保护细胞典型的这种点状模式(图2)gydF4y2Ba2 fgydF4y2Ba)。的表达式gydF4y2Ba绿色荧光蛋白gydF4y2Ba-tag单独导致细胞质染色[gydF4y2Ba28gydF4y2Ba]。gydF4y2Ba
gfp标记蛋白的实时成像方法适用于细胞壁上的apyrase检测,正如其他植物物种的外胞体apyrase所示[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba54gydF4y2Ba]。但由于AtAPY1被认为定位于细胞外,而且GFP在pH≤5.0时不会发出荧光[gydF4y2Ba55gydF4y2Ba],如果标签暴露在细胞壁的酸性环境中,可能会错过一个弱的AtAPY1-GFP信号。为细胞外环境、WT原生质体和表达体提供GFP荧光的最佳pH值gydF4y2BaAtAPY1-GFPgydF4y2Ba由子叶制备,在pH 7.6下成像。与之前一样,在细胞内发现了GFP信号(图2)gydF4y2Ba2gydF4y2BaG),这在WT控制中没有出现(图2)gydF4y2Ba2gydF4y2BaH),但转基因原生质体的质膜没有荧光(图2)gydF4y2Ba2gydF4y2BaH)。这一结果排除了AtAPY1锚定在质膜上的可能性。然而,原生质体的形成对细胞来说代表着严重的压力,这可能会导致基因的下调gydF4y2BaAtAPY1gydF4y2Ba和/或AtAPY1的降解或内化。此外,AtAPY1可能是细胞壁中的可溶性蛋白,在这种情况下,原生质体制备过程中细胞壁的消化会导致AtAPY1- gfp信号的丢失。因此,壁完整的细胞在适合于GFP荧光的pH下成像(图2)gydF4y2Ba2gydF4y2Ba1, J).幼苗表达gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba在pH为8.1而不是5.7的液体培养基中生长。已知培养基中较高的pH值可以恢复外质体中的GFP荧光[gydF4y2Ba38gydF4y2Ba]。然而,即使在这些条件下,也没有检测到细胞外的GFP信号(图2)gydF4y2Ba2gydF4y2BaI).此外,gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba为了尽量减少碱性培养基对AtAPY1分布的影响,在正常条件下培养幼苗,并用pH为7.5的缓冲液浸润,仅用于成像。在30多个独立实验中,同样没有发现细胞外信号(数据未显示)。gydF4y2Ba
两种检测方法,免疫荧光和gydF4y2Ba在活的有机体内gydF4y2Ba成像显示相同的点状结构,但在质膜或细胞外间隙未见信号。gydF4y2Ba
AtAPY1定位于高尔基体gydF4y2Ba
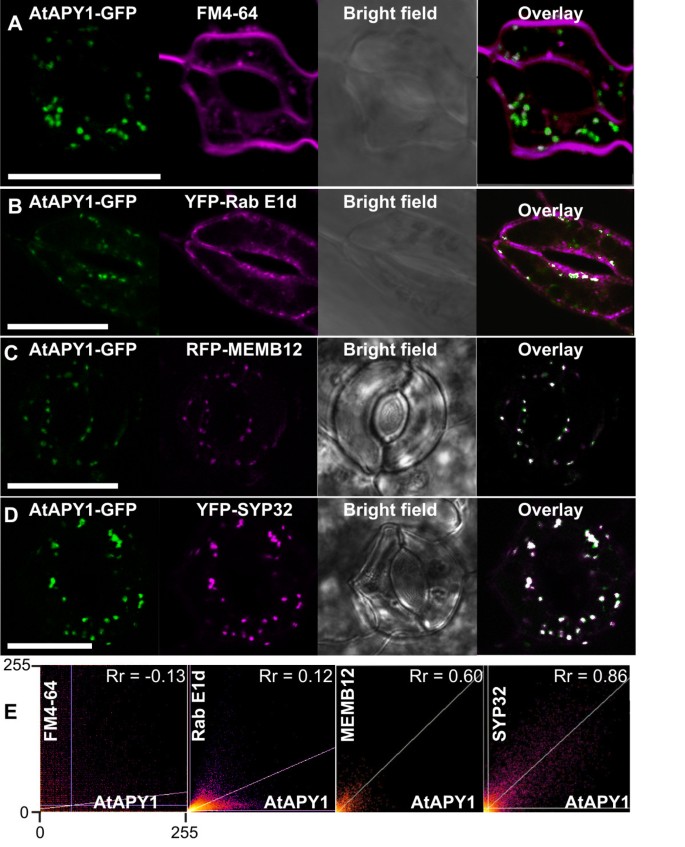
在更高的放大倍数下,一些atapy1特有的点状信号呈现为甜甜圈或马蹄形结构(见图)gydF4y2Ba2gydF4y2BaI).这种形态是典型的高尔基堆,从顶部看主池的中间[gydF4y2Ba56gydF4y2Ba]。此外,在0.5 ~ 1 μm之间观察到的尺寸与高尔基堆的预期尺寸相匹配[gydF4y2Ba57gydF4y2Ba]。为了证实AtAPY1定位在这些细胞器中,我们使用了FM4-64染料。FM4-64被细胞内吞,依次染色质膜、核内体和细胞壁gydF4y2Ba反式gydF4y2Ba-高尔基网络,但不是高尔基体[gydF4y2Ba58gydF4y2Ba]。成像fm4 - 64 -渗透gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba即使在浸润120分钟后,幼苗也没有发现荧光染料和GFP信号的共定位(图2)gydF4y2Ba3.gydF4y2BaA和图中对应的散点图gydF4y2Ba3.gydF4y2BaE)。gydF4y2Ba
atapy1阳性高尔基结构的鉴定。gydF4y2Ba子叶表皮细胞的CLSM图像。绿色荧光显示为FM4-64gydF4y2Ba(一)gydF4y2Ba, YFPgydF4y2Ba(B, D)gydF4y2Ba和招标书gydF4y2Ba(C)gydF4y2Ba紫红色的荧光。将两个荧光检测通道的图像与“共定位查找器”插件合并(=叠加),绿色和品红信号的共定位产生白点。标尺= 20 μm。gydF4y2Ba(一个gydF4y2Ba)转基因苗表达gydF4y2BaAtAPY1-GFPgydF4y2Ba15 μM FM4-64真空渗滤处理。治疗120分钟后显示下表皮的切片。gydF4y2Ba(B)gydF4y2Ba转基因苗的两个保护细胞共表达gydF4y2BaAtAPY1-GFPgydF4y2Ba和gydF4y2BaYFP-Rab E1dgydF4y2Ba所示。gydF4y2Ba(C, D)gydF4y2Ba转基因苗共表达gydF4y2BaAtAPY1-GFPgydF4y2Ba,要么gydF4y2BaRFP-MEMB12gydF4y2Ba或gydF4y2BaYFP-SYP32gydF4y2Ba成像。gydF4y2Ba(E)gydF4y2Ba绿色和品红像素在双通道叠加图像中的分布情况gydF4y2Ba模拟gydF4y2Ba使用ImageJ“Colocalization Threshold”和“Coloc2”工具进行分析。x轴表示来自GFP通道(AtAPY1)的绿色像素的强度,y轴表示来自品红通道(FM4-64, Rab E1d, MEMB12或SYP32)的强度。对于每个散点图,强度以像素灰度值的形式给出,范围从0到255。共定位将两个通道的像素沿对角线聚类。Pearson相关系数(R)的最大理论值gydF4y2BargydF4y2Ba)是1.0。gydF4y2Ba
作为另一个阴性内体对照,研究了与GTPase Rab E1d共定位。关于将Rab E1d指定为高尔基体的标记蛋白,文献中存在一些争议[gydF4y2Ba59gydF4y2Ba]或后高尔基体/内体隔室[gydF4y2Ba32gydF4y2Ba]。然而,有共识认为Rab E1d主要与大鼠唾液转移酶共定位[gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba),一个gydF4y2Ba反式gydF4y2Ba高尔基体和/或gydF4y2Ba反式gydF4y2Ba-高尔基网络标记蛋白[gydF4y2Ba61gydF4y2Ba],它还与质膜(PM)有关[gydF4y2Ba60gydF4y2Ba,gydF4y2Ba62gydF4y2Ba]。因此,Rab E1d被认为在从高尔基体到PM的分泌囊的贩运中发挥了作用[gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba]。gydF4y2Ba
在转基因植物中共表达gydF4y2BaYFP-Rab E1dgydF4y2Ba和gydF4y2BaAtAPY1-GFPgydF4y2Ba,未发现YFP和GFP荧光重叠(图2)gydF4y2Ba3 bgydF4y2Ba,对应的散点图如图所示gydF4y2Ba3 egydF4y2Ba)。这种重叠的缺失不仅表明在核内体中不存在AtAPY1-GFP,也排除了GFP和YFP检测通道之间的串扰。为了确认所选择的GFP和YFP设置分别对GFP和YFP荧光的检测具有特异性,只表达两种荧光团之一的转基因植物在GFP和YFP设置下依次成像。当对表皮细胞成像时gydF4y2BaAtAPY1-GFPgydF4y2Ba用GFP设置表达植物,在GFP检测通道中出现了熟悉的点状结构(附加文件)gydF4y2Ba5gydF4y2BaA)。然而,使用YFP设置拍摄相同表皮切片的图像并没有提供这种点状图案(附加文件)gydF4y2Ba5gydF4y2BaA).与植物表达相同的成像实验gydF4y2BaYFP-SYP32gydF4y2Ba仅,显示可忽略的YFP荧光渗透到GFP检测通道(附加文件)gydF4y2Ba5gydF4y2BaB).这些对照实验证明了GFP和YFP检测设置的特异性。gydF4y2Ba
在直接定位方法中,通过与三种已知的拟南芥高尔基驻留蛋白共定位,研究了AtAPY1-GFP在高尔基体中的发生。MEMB12 (Membrin 12)和SYP32 (Syntaxin of plants 32)是定位于高尔基体的SNARE蛋白[gydF4y2Ba63gydF4y2Ba]。高尔基转运蛋白Got1p (Golgi transport 1 protein)存在于高尔基膜中gydF4y2Ba酿酒酵母gydF4y2Ba[gydF4y2Ba64gydF4y2Ba],其在拟南芥中的同源物也定位于高尔基[gydF4y2Ba32gydF4y2Ba]。转基因植物共表达gydF4y2BaAtAPY1-GFPgydF4y2Ba或者是高尔基标记gydF4y2BaRFP-MEMB12gydF4y2Ba(图gydF4y2Ba3.gydF4y2BaC),gydF4y2BaYFP-SYP32gydF4y2Ba(图gydF4y2Ba3.gydF4y2BaD)或gydF4y2BaYFP-Got1p同族体gydF4y2Ba(附加文件gydF4y2Ba6gydF4y2Ba)用共聚焦显微镜分析。所有三种高尔基标记蛋白的荧光与AtAPY1荧光重叠,将AtAPY1- gfp定位在高尔基体上。gydF4y2Ba
为了排除或确认共定位,不仅通过眼睛,ImageJ软件被应用。利用两个检测通道的图像叠加生成散点图,并计算Pearson相关系数(RgydF4y2BargydF4y2Ba)的两个荧光信号(图gydF4y2Ba3.gydF4y2BaE和附加文件gydF4y2Ba6gydF4y2Ba)。RgydF4y2BargydF4y2Ba值> 0.5表示共定位[gydF4y2Ba65gydF4y2Ba],验证了与AtAPY1-GFP同源的三个标记蛋白RFP-MEMB12、YFP-SYP32和YFP-Got1p共定位。gydF4y2Ba
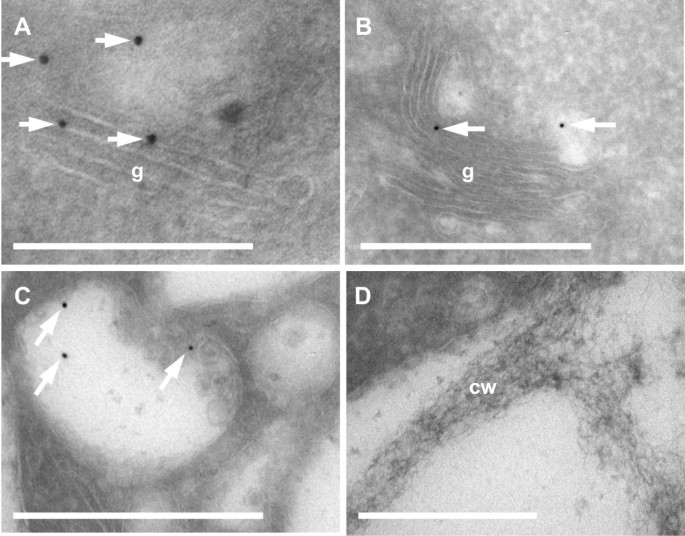
为了确认共定位结果,利用α-GFP一抗和金偶联二抗分别用金颗粒标记AtAPY1-GFP。通过根部的德康冷冻切片电镜显示高尔基体染色较弱,但具有特异性(图2)gydF4y2Ba4gydF4y2BaA、B)。在面积为11.8 μm的56个高尔基隔室(48个标记,8个未标记)中进行切片gydF4y2Ba2gydF4y2Ba,每μm 8.3个金粒子gydF4y2Ba2gydF4y2Ba被计算。如果只考虑标记的高尔基隔室,则该值增加到9.8个粒子/ μmgydF4y2Ba2gydF4y2Ba.相比之下,每μm仅含0.37和0.07个金颗粒gydF4y2Ba2gydF4y2Ba在88个线粒体(= 14 μmgydF4y2Ba2gydF4y2Ba)和12个核(= 27 μm)gydF4y2Ba2gydF4y2Ba),分别。多泡体(MVB)也被金颗粒免疫阳性标记(图2)gydF4y2Ba4gydF4y2BaC),这很可能反映了一些AtAPY1-GFP向液泡的运输gydF4y2Ba绿色荧光蛋白gydF4y2Ba-过度表达植物[gydF4y2Ba59gydF4y2Ba而不是AtAPY1在泡前腔室中的功能作用。包括细胞壁在内的任何其他细胞室未发现免疫标记(图2)gydF4y2Ba4gydF4y2BaD).综上所述,AtAPY1-GFP的免疫金标记研究证实了它在高尔基体中的定位,没有发现细胞外发生的迹象。gydF4y2Ba
AtAPY1具有典型的内链酶而非外链酶的底物特异性gydF4y2Ba
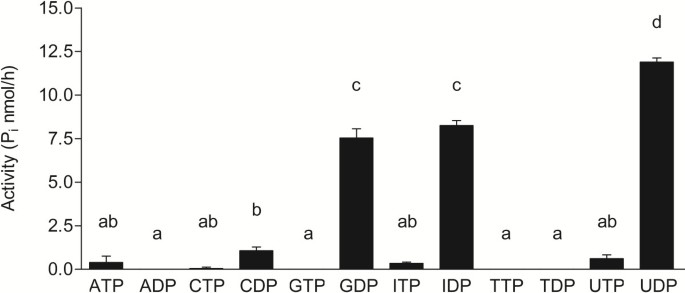
如果AtAPY1的高尔基定位是正确的,那么AtAPY1应该表现出高尔基酶特有的底物特异性。因此,AtAPY1-GFP的活性在已知的apyase底物存在下进行了测试,pH为6.5,与高尔基体[gydF4y2Ba55gydF4y2Ba]。AMP不是吡喃酶的底物,因此作为阴性对照。AtAPY1-GFP不水解ATP和ADP,而ATP和ADP是外链酶的典型底物[gydF4y2Ba46gydF4y2Ba],但核苷酸尿苷二磷酸(UDP),鸟苷二磷酸(GDP)和肌苷二磷酸(IDP)(图gydF4y2Ba5gydF4y2Ba)。在所有其他NTPs或ndp存在的情况下,未检测到活性(图2)gydF4y2Ba5gydF4y2Ba)和AMP(数据未显示)。这三种NDPs的水解与其他植物高尔基脲酶的底物特异性相匹配,例如来自水稻(gydF4y2Ba栽培稻gydF4y2Ba) [gydF4y2Ba66gydF4y2Ba]和梧桐(gydF4y2Ba宏碁pseudoplatanusgydF4y2Ba) [gydF4y2Ba67gydF4y2Ba]。gydF4y2Ba
为了研究底物特异性是否具有pH依赖性,以及一旦AtAPY1到达外质体后,底物特异性是否会发生有利于ATP和ADP的变化,我们在pH 5.5(细胞壁中常见的pH值)下重复了AtAPY1- gfp活性测定[gydF4y2Ba68gydF4y2Ba]。然而,三种二磷酸盐UDP, GDP和IDP仍然是唯一的底物(附加文件)gydF4y2Ba7gydF4y2Ba)。因此,确定的底物特异性证实了AtAPY1不在细胞壁中观察到,而是在高尔基体中观察到的结果。gydF4y2Ba
AtAPY1是一种完整的膜蛋白gydF4y2Ba
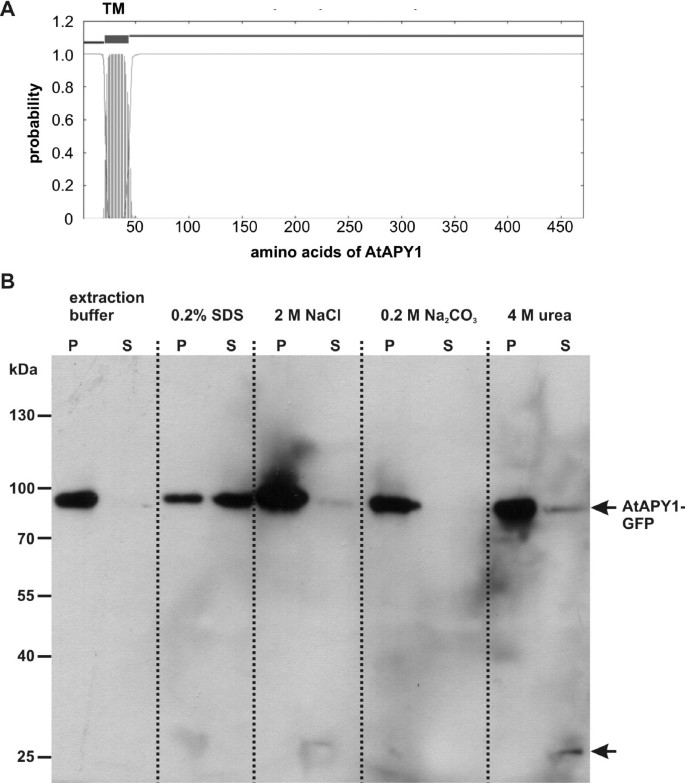
目的之一是确定AtAPY1是否是高尔基体管腔中的可溶性蛋白,或者如TMHMM预测程序所暗示的那样[gydF4y2Ba69gydF4y2Ba],一种高尔基膜蛋白,其n端具有未裂解的信号序列,可作为跨膜锚点(图2)gydF4y2Ba6gydF4y2BaA)。免疫金标记结果支持了这一预测,表明该蛋白存在膜关联(图2)gydF4y2Ba4gydF4y2Baa - c)。gydF4y2Ba
AtAPY1-GFP的溶解度分析。gydF4y2Ba(一)gydF4y2BaTMHMM预测程序的输出[gydF4y2Ba69gydF4y2Ba]所示。AtAPY1 aa序列沿x轴表示,n端aa为第一个残基。给出了每个aa出现在跨膜结构域中的概率。预测了一个由aa 21-43组成的TM。gydF4y2Ba(BgydF4y2Ba)转基因植物制备微粒体膜gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba.等量的膜组分分别用萃取缓冲液、0.2% SDS、2 M NaCl、0.2 M Na处理gydF4y2Ba2gydF4y2Ba有限公司gydF4y2Ba3.gydF4y2Ba或4 M尿素。处理30分钟后,10万离心gydF4y2BaggydF4y2Ba.将颗粒组分(P)和上清液(S)用8% SDS聚丙烯酰胺凝胶分离,在硝化纤维素膜上印迹,用α-GFP抗体孵育。蛋白质标准品的分子量以kDa表示。用α-小鼠IgG偶联辣根过氧化物酶检测AtAPY1-GFP蛋白(80 kDa)和27 kDa的第二条带(箭头)。在独立蛋白提取物的三个实验中也得到了类似的结果。gydF4y2Ba
从转基因植株中分离出微粒体膜gydF4y2BaAtAPY1-GFPgydF4y2Ba用针对胞质和不溶性蛋白标记蛋白的抗体验证了它们的纯度(附加文件)gydF4y2Ba8gydF4y2Ba)。用各种增溶剂处理微粒体膜,然后分析任何增溶蛋白。使用α-GFP抗体,在AtAPY1-GFP的预期分子质量(80 kDa)处观察到一个主要信号,在27 kDa处观察到一个次要信号(图2)gydF4y2Ba6gydF4y2BaB).较小的蛋白很可能是AtAPY1-GFP在蛋白提取过程中的降解产物。如果不处理微粒体膜,在膜部分中检测到AtAPY1-GFP(图2)gydF4y2Ba6gydF4y2BaB),表明该蛋白是膜结合的。为了支持这一发现,洗涤剂SDS从膜上释放了大部分AtAPY1-GFP蛋白(图2)gydF4y2Ba6gydF4y2BaB).为了区分AtAPY1是外周蛋白还是整体膜蛋白,将微粒体膜置于高盐(2 M NaCl)、碱性(0.2 M Na)环境中gydF4y2Ba2gydF4y2Ba有限公司gydF4y2Ba3.gydF4y2Ba)和变性(4m尿素)条件。外周蛋白被尿素从膜上去除,尿素会干扰蛋白质之间的相互作用,高盐和碱性处理分别会破坏静电和疏水相互作用。除了微量的盐和钠gydF4y2Ba2gydF4y2Ba有限公司gydF4y2Ba3.gydF4y2Ba处理确实将AtAPY1从颗粒部分转移到上清(图2)gydF4y2Ba6gydF4y2BaB)作为整体膜蛋白。AtAPY1也不是高尔基可溶性蛋白,因为在Na后,AtAPY1仍留在颗粒部分gydF4y2Ba2gydF4y2Ba有限公司gydF4y2Ba3.gydF4y2Ba已知可将微粒体腔内的可溶性蛋白质浸出至上清部分的处理方法,见[gydF4y2Ba70gydF4y2Ba]。尿素将部分AtAPY1-GFP蛋白释放到上清液中,但大部分蛋白仍留在膜组分中(图2)gydF4y2Ba6gydF4y2BaB).尽管跨膜蛋白通常不被尿素提取,但II型积分蛋白与膜的关联似乎不如具有多个跨膜结构域的蛋白紧密[gydF4y2Ba71gydF4y2Ba]。gydF4y2Ba
综上所述,AtAPY1具有单代II型膜蛋白的特征。gydF4y2Ba
讨论gydF4y2Ba
AtAPY1细胞外定位的先前证据gydF4y2Ba
使用程序预测AtAPY1的亚细胞定位尚无定论:程序SubLoc version (v) 1.0 [gydF4y2Ba72gydF4y2Ba]表示细胞质,靶P v. 1.1 [gydF4y2Ba73gydF4y2Ba线粒体与WoLF PSORT v. 2.0 [gydF4y2Ba74gydF4y2Ba叶绿体。Predotar v. 1.3 [gydF4y2Ba75gydF4y2Ba]无法定义具体的定位和PSORT v. 6.4 [gydF4y2Ba76gydF4y2Ba预测了细胞外定位。因此,实验数据变得非常宝贵。实验gydF4y2Ba在体外gydF4y2Ba萌发花粉在液体萌发培养基中检测淀粉酶活性[gydF4y2Ba12gydF4y2Ba]。这种细胞外活性被添加针对n端截断(aa 36-471)、变性和重组AtAPY1蛋白的多克隆抗体所抑制[gydF4y2Ba12gydF4y2Ba]。这表明AtAPY1是一种细胞外蛋白。然而,这些抗体可能针对细胞壁中AtAPY1以外的酶。例如,AtAPY1的apyase保守区(ACR) 1与AtAPY2的ACR1是100%相同的。因此,α-AtAPY1抗体也能识别AtAPY2也就不足为奇了[gydF4y2Ba12gydF4y2Ba]。AtAPY1 ACRs与其他5种拟南芥酶的相似性不高,但这些保守区域仍可能是α-AtAPY1抗体的结合靶点。在不同的植物(棉花)中,使用相同的α-AtAPY1抗血清成功抑制胞外apyase活性的实验支持了交叉反应的可能性[gydF4y2Ba14gydF4y2Ba]。gydF4y2Ba
这个实验gydF4y2Ba在体外gydF4y2Ba萌发后的花粉还表明,在花粉萌发培养基中表现出淀粉酶活性的蛋白质是可溶的,因为它可以在虹吸的分液中测量[gydF4y2Ba12gydF4y2Ba]。由于AtAPY1表现出整体膜蛋白的增溶特性,因此不太可能与之前检测到的胞外apyase活性相同。gydF4y2Ba
拟南芥apyrase作为eATP信号的调节因子gydF4y2Ba
AtAPY1和AtAPY2被认为是拟南芥中eATP信号的调节因子[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba77gydF4y2Ba- - - - - -gydF4y2Ba79gydF4y2Ba],因此被认为在细胞壁中起作用。然而,AtAPY1的底物特异性并不符合这一模型。AtAPY1- gfp不能水解ATP和ADP,这与AtAPY1调节eATP信号的作用相矛盾。gydF4y2Ba
尽管AtAPY1不符合外链apyrase的特征,但AtAPY2仍然是候选基因。然而,Dunkley等人gydF4y2Ba.gydF4y2Ba[gydF4y2Ba80gydF4y2Ba注意到AtAPY2的高尔基定位。他们利用密度离心法制备了拟南芥愈伤组织的膜组分,并用质谱法鉴定了高尔基蛋白池中的AtAPY2。最近,AtAPY2的高尔基定位在另一个富含高尔基膜的蛋白质组学分析中得到证实[gydF4y2Ba81gydF4y2Ba]。然而,拟南芥信息资源数据库保存了两种不同的剪接变体gydF4y2BaAtAPY2gydF4y2Ba这可能导致相应蛋白质的不同定位。事实证明转基因拟南芥植株过表达gydF4y2BaAtAPY2gydF4y2Baeap介导的超氧化物生成比WT少[gydF4y2Ba79gydF4y2Ba指出了AtAPY2(一种变体)的细胞外定位。gydF4y2Ba
由于三种亚细胞检测方法均未在细胞壁中检测到AtAPY1,并且不具有外链apyrase的底物特异性,因此我们假设在拟南芥eATP信号传导中观察到的调节酶是AtAPY1以外的其他apyrase。gydF4y2Ba
高尔基体中可能的AtAPY1功能gydF4y2Ba
在高尔基体中描述了二磷酸酶的活性gydF4y2BaPisum一gydF4y2Ba[gydF4y2Ba82gydF4y2Ba]。UDP迅速降解为单磷酸尿苷和PgydF4y2Ba我gydF4y2Ba通过一种面向高尔基体管腔及其活性部位的整体膜蛋白。它也在gydF4y2Bap .一gydF4y2BaUDP抑制糖基转移酶[gydF4y2Ba83gydF4y2Ba],它在植物初生细胞壁成分的组装中起作用[gydF4y2Ba84gydF4y2Ba在反馈机制中。因此有人提出,二磷酸水解酶如apyrase通过不断去除糖基转移反应的副产物UDP来防止高尔基体中多糖合成的抑制[gydF4y2Ba85gydF4y2Ba]。他们发现高尔基脲酶只存在于豌豆幼苗茎的伸长区,这一发现支持了高尔基脲酶在多糖生物合成中的作用。这个区域不断需要新的细胞壁材料。apy1酶在拟南芥中可能起同样的作用。apyrase DKO突变体的发育和生长表型,如缺乏花粉萌发[gydF4y2Ba17gydF4y2Ba],没有根和芽生长,细胞形状扭曲[gydF4y2Ba18gydF4y2Ba可以用细胞壁材料的生物合成缺陷来解释。这种作用得到了AtAPY1底物特异性的支持,因为UDP和GDP是由高尔基体中的糖基转移酶产生的。gydF4y2Ba
更多关于糖基化作用的证据来自酵母的互补实验gydF4y2Ba酿酒酵母gydF4y2Ba突变体gydF4y2BaΔgda1gydF4y2Ba.这种酵母突变体缺乏高尔基氨基化酶鸟苷二磷酸酶1 (GDA1),导致糖基化缺陷[gydF4y2Ba86gydF4y2Ba通过与之互补而废除gydF4y2BaAtAPY1gydF4y2Ba[gydF4y2Ba81gydF4y2Ba]。gydF4y2Ba
也有人认为,高尔基酶提供核苷单磷酸作为底物,以反港机制从细胞质中交换核苷酸糖[gydF4y2Ba85gydF4y2Ba]。因此,单磷酸核苷的缺乏会阻止或减少核苷酸糖进入高尔基体的运输[gydF4y2Ba87gydF4y2Ba并增加细胞质中核苷酸糖的浓度。作为一个“释放阀”,叶绿体会输入糖并将其转化为淀粉。与这一假设一致的是,与WT相比,在apyrase DKO突变体中观察到瞬时淀粉的显著增加[gydF4y2Ba18gydF4y2Ba]。当高尔基体功能通常被破坏时,叶绿体中淀粉的积累也被观察到,这可以用细胞质糖浓度升高引起的间接影响来解释[gydF4y2Ba88gydF4y2Ba]。gydF4y2Ba
结论gydF4y2Ba
使用两种不同的转基因株系表达任一种gydF4y2BaAtAPY1-SNAPgydF4y2Ba或gydF4y2Ba绿色荧光蛋白gydF4y2Ba允许在亚细胞水平特异性标记AtAPY1。显示atapy1特异性荧光信号的细胞器通过以下标准被鉴定为高尔基体:(i)形态,(ii)大小,(iii)与内吞标记染色FM4-64缺乏共定位gydF4y2Ba反式gydF4y2Ba-高尔基标记蛋白Rab E1d,但(iv)与三个高尔基标记蛋白MEMB12, SYP32和Got1p同源共定位。用α-GFP抗体对高尔基体进行免疫标记。在进行综述时,通过高尔基膜的蛋白质组学分析和AtAPY1- yfp与cfp标记的共定位,独立地证实了AtAPY1的高尔基定位gydF4y2Ba独联体gydF4y2Ba-瞬时转化洋葱皮中的高尔基标记α-甘露糖苷酶I [j]gydF4y2Ba81gydF4y2Ba]。gydF4y2Ba
虽然不能排除细胞外AtAPY1缺失检测是方法敏感性问题,但我们的结果表明AtAPY1主要存在于高尔基体中。因此,AtAPY1不太可能代表eATP水平的调节酶[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba77gydF4y2Ba,gydF4y2Ba78gydF4y2Ba],而拟南芥外链apyrase的真实身份尚未被发现。此外,由于缺乏[gydF4y2Ba18gydF4y2Ba]和减少的AtAPY1和AtAPY2 [gydF4y2Ba12gydF4y2Ba可能与eATP信号没有直接联系。相反,AtAPY1在高尔基体中的定位需要成为未来研究的基础,以了解AtAPY1特别是植物高尔基体酶如何影响植物的生长和发育。gydF4y2Ba
缩写gydF4y2Ba
- aa:gydF4y2Ba
-
氨基酸(s)gydF4y2Ba
- ACR:gydF4y2Ba
-
淀粉酶保守区gydF4y2Ba
- AEBSF:gydF4y2Ba
-
4-(2-氨基乙基)-苯磺酰氟盐酸盐gydF4y2Ba
- apyrase:gydF4y2Ba
-
腺苷焦磷酸酶gydF4y2Ba
- 样品形貌:gydF4y2Ba
-
共聚焦激光扫描显微镜gydF4y2Ba
- DKO:gydF4y2Ba
-
双基因敲除gydF4y2Ba
- eATP:gydF4y2Ba
-
细胞外ATPgydF4y2Ba
- ECM:gydF4y2Ba
-
细胞外基质gydF4y2Ba
- FITC:gydF4y2Ba
-
异硫氰酸荧光素gydF4y2Ba
- fm4 - 64:gydF4y2Ba
-
N - (3-triethylammoniumpropyl) 4 -二溴化吡啶(p-diethylaminophenyl-hexatrienyl)gydF4y2Ba
- 国内生产总值:gydF4y2Ba
-
鸟苷二磷酸gydF4y2Ba
- 绿色荧光蛋白:gydF4y2Ba
-
绿色荧光蛋白gydF4y2Ba
- Got1p:gydF4y2Ba
-
高尔基转运蛋白gydF4y2Ba
- HeNe:gydF4y2Ba
-
氦氖激光器gydF4y2Ba
- 合:gydF4y2Ba
-
辣根过氧化物酶gydF4y2Ba
- 国内流离失所者:gydF4y2Ba
-
肌苷二磷酸gydF4y2Ba
- 主持人:gydF4y2Ba
-
甲基纤维素gydF4y2Ba
- MEMB12:gydF4y2Ba
-
Membrin 12gydF4y2Ba
- 女士:gydF4y2Ba
-
Murashige和SkooggydF4y2Ba
- 多功能车辆总线:gydF4y2Ba
-
多泡体gydF4y2Ba
- NTPDase:gydF4y2Ba
-
核苷三磷酸二磷酸水解酶gydF4y2Ba
- 子:gydF4y2Ba
-
开放式阅读框gydF4y2Ba
- 病人:gydF4y2Ba
-
球团gydF4y2Ba
- 铅:gydF4y2Ba
-
磷酸缓冲液gydF4y2Ba
- PBS:gydF4y2Ba
-
磷酸盐缓冲盐水gydF4y2Ba
- PFA:gydF4y2Ba
-
多聚甲醛gydF4y2Ba
- PgydF4y2Ba我gydF4y2Ba:gydF4y2Ba
-
无机磷酸盐gydF4y2Ba
- 下午:gydF4y2Ba
-
等离子体膜gydF4y2Ba
- PPT:gydF4y2Ba
-
PhosphinothricingydF4y2Ba
- 招标书:gydF4y2Ba
-
红色荧光蛋白gydF4y2Ba
- RT:gydF4y2Ba
-
室温gydF4y2Ba
- 史:gydF4y2Ba
-
上层清液gydF4y2Ba
- 提前:gydF4y2Ba
-
OgydF4y2Ba6gydF4y2Ba-alkylguanine-DNA alkyltransferasegydF4y2Ba
- 美籍西班牙人:gydF4y2Ba
-
向内摇花粉gydF4y2Ba+gydF4y2Ba通道gydF4y2Ba
- SYP32:gydF4y2Ba
-
植物合成素gydF4y2Ba
- SKO:gydF4y2Ba
-
单基因敲除gydF4y2Ba
- 本文分别:gydF4y2Ba
-
DNA转移gydF4y2Ba
- TBS:gydF4y2Ba
-
Tris缓冲了生理盐水gydF4y2Ba
- 透射电镜:gydF4y2Ba
-
透射电子显微镜gydF4y2Ba
- TM:gydF4y2Ba
-
跨膜域gydF4y2Ba
- 运输安全管理局:gydF4y2Ba
-
酰胺信号放大gydF4y2Ba
- UA:gydF4y2Ba
-
铀酰乙酸gydF4y2Ba
- UDP:gydF4y2Ba
-
尿苷二磷酸gydF4y2Ba
- v:gydF4y2Ba
-
版本gydF4y2Ba
- WT:gydF4y2Ba
-
野生型或野生型gydF4y2Ba
- YFP:gydF4y2Ba
-
黄色荧光蛋白。gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Meyerhof O:无细胞酒精发酵中哈登和杨反应的起源。生物化学学报,2005,32(5):559 - 561。gydF4y2Ba
- 2.gydF4y2Ba
Zimmermann H, Beaudoin AR, Bollen M, Goding JW, Guidotti G, Kirley TL, Robson SC, Sano K:细胞表面表达的两个新的核苷酸水解酶家族的命名方法。外链atp酶和相关的外链核苷酸酶。编辑:Vanduffel L, Lemmens r .马斯特里赫特:Shaker Publishing BV;2000: 1 - 8。gydF4y2Ba
- 3.gydF4y2Ba
王志强,王志强,王志强,等。ATP二磷酸水解酶(apyrase)的研究进展。生物化学学报,1996,13(10):233-241。10.1016 / 0167 - 4889(95) 00135 - 2。gydF4y2Ba
- 4.gydF4y2Ba
Handa M, Guidotti G:马铃薯块茎可溶性atp -二磷酸水解酶(Apyrase)的纯化和克隆。生物化学学报,1996,18(2):916-923。10.1006 / bbrc.1996.0162。gydF4y2Ba
- 5.gydF4y2Ba
李建军,李建军,李建军,李建军。豆科植物根系酶活性的研究进展。美国国家科学促进会。[j] .中国科学:地球科学。10.1073 / pnas.96.10.5856。gydF4y2Ba
- 6.gydF4y2Ba
Day R, McAlvin C, Loh J, Denny R, Wood T, Young N, Stacey G:两种大豆酶的差异表达,其中一种是早期结瘤素。植物与微生物学报,2000,13(3):1053-1070。10.1094 / MPMI.2000.13.10.1053。gydF4y2Ba
- 7.gydF4y2Ba
Cohn J, Uhm T, Ramu S, Nam Y-W, Kim D-J, Penmetsa R, Wood T, Denny R, Young N, Cook D, Stacey G:苜蓿apyrase家族基因的差异调控。植物生理学报,2001,25(5):559 - 559。10.1104 / pp.125.4.2104。gydF4y2Ba
- 8.gydF4y2Ba
McAlvin C, Stacey G:大豆apyrase在日本莲中的转基因表达促进结瘤。植物生理学报,2005,37(4):559 - 561。10.1104 / pp.104.055939。gydF4y2Ba
- 9.gydF4y2Ba
Govindarajulu M, Kim SY, Libault M, Berg RH, Tanaka K, Stacey G, Taylor CG: GS52外泌脲酶在大豆结瘤过程中起关键作用。植物生理学报,2009,29(4):994- 994。gydF4y2Ba
- 10.gydF4y2Ba
李建军,李建军,李建军,李建军,等。体外磷酸酶在细菌耐药中的作用。植物学报,2000,12:519-533。gydF4y2Ba
- 11.gydF4y2Ba
李建军,李建军,李建军,等。Apyrase在植物磷酸营养中的作用及其在细胞外ATP中的应用。植物生理学报,1999,31(2):543-551。10.1104 / pp.119.2.543。gydF4y2Ba
- 12.gydF4y2Ba
吴杰,Steinebrunner I,孙艳,Butterfield T, Torres J, Arnold D, Gonzalez A, Jacob F, Reichler S, Roux SJ:拟南芥apyrase(核苷三磷酸-二磷酸水解酶)在生长调控中的作用。植物生理学报,2009,29(4):961-975。10.1104 / pp.107.097568。gydF4y2Ba
- 13.gydF4y2Ba
王玉玲,王晓明,王晓明,等。水稻根系无毛基因rth1的克隆。品种科学,2009,59:13-20。10.1270 / jsbbs.59.13。gydF4y2Ba
- 14.gydF4y2Ba
陈志军,陈志军,陈志军,陈志军,陈志军,陈志军,陈志军,陈志军,陈志军,陈志军,陈志军,陈志军:棉花胚珠胞外核苷酸对棉花纤维伸长的调控作用。植物生理学报,2010,32(2):1073-1083。10.1104 / pp.109.147637。gydF4y2Ba
- 15.gydF4y2Ba
Clark G, Wu M, Wat N, Onyirimba J, Pham T, Herz N, Ogoti J, Gomez D, Canales AA, Aranda G,等:细胞外核苷酸对拟南芥根毛生长的刺激和抑制都是由一氧化氮和活性氧介导的。植物生理学报,2010,32(4):423- 431。10.1007 / s11103 - 010 - 9683 - 7。gydF4y2Ba
- 16.gydF4y2Ba
Riewe D, Grosman L, Fernie AR, Wucke C, Geigenberger P:马铃薯特异性apyrase的胞外定位及其对基因表达和生长发育的影响。植物生理学报,2008,29(4):391 - 391。10.1104 / pp.108.117564。gydF4y2Ba
- 17.gydF4y2Ba
吴军,孙勇,刘建军,刘建军,等。拟南芥花粉萌发过程中apyrase酶的表达。植物生理学报,2003,31(2):557 - 557。10.1104 / pp.102.014308。gydF4y2Ba
- 18.gydF4y2Ba
刘春华,刘春华,刘春华,等。apyase AtAPY1和AtAPY2双敲除突变体的发育缺陷和幼苗致病性。植物生理学报,2007,32(4):657-672。10.1007 / s11103 - 007 - 9184 - 5。gydF4y2Ba
- 19.gydF4y2Ba
Alvarado-Castillo C, Lozano-Zarain P, Mateo J, Harden TK, Boyer JL:人类P2Y(1)受体与NTPDase1的融合蛋白显示了天然受体和外切酶的功能活性,并降低了内源性释放核苷酸的信号反应。中华医学杂志,2002,32(2):521-528。10.1124 / mol.62.3.521。gydF4y2Ba
- 20.gydF4y2Ba
Burnstock G:嘌呤能信号。中国药理学杂志,2006,37(增刊1):772 - 781。gydF4y2Ba
- 21.gydF4y2Ba
田中凯,张建军,张建军,张建军。植物胞外ATP信号转导的研究。中国生物医学工程学报,2010,32(2):591 - 598。10.1016 / j.tcb.2010.07.005。gydF4y2Ba
- 22.gydF4y2Ba
王志强,王志强。细胞外核苷酸的研究进展。植物科学,2009,37(2):379 - 379。10.1016 / j.plantsci.2009.05.004。gydF4y2Ba
- 23.gydF4y2Ba
[3]刘建军,刘建军,李建军,等。细胞外ATP在植物体内的作用。植物科学进展,2007,12:522-527。10.1016 / j.tplants.2007.09.003。gydF4y2Ba
- 24.gydF4y2Ba
莫林,王晓明,王晓明,王晓明,王晓明,王晓明。拟南芥花粉管发育和竞争能力的研究进展。基因工程学报,2002,16(6):339- 356。10.1101 / gad.213902。gydF4y2Ba
- 25.gydF4y2Ba
Nakagawa T, Suzuki T, Murata S, Nakamura S, Hino T, Maeo K, Tabata R, Kawai T, Tanaka K, Niwa Y,等:改良的Gateway二元载体:用于植物转基因分析中融合构建的高性能载体。生物技术与生物化学,2007,31(1):995 - 9100。10.1271 / bbb.70216。gydF4y2Ba
- 26.gydF4y2Ba
李建军,李建军,李建军,等。植物T-DNA双分子标记的研究进展。植物生理学报,1999,20(2):559 - 561。10.1007 / BF00028908。gydF4y2Ba
- 27.gydF4y2Ba
郭文杰,李文杰,李文杰,等。农杆菌介导的拟南芥转化方法的研究进展。植物学报,1998,16:735-743。10.1046 / j.1365 - 313 x.1998.00343.x。gydF4y2Ba
- 28.gydF4y2Ba
孙杨:豌豆和拟南芥中脲酶的分布和表达。博士论文。德克萨斯大学奥斯汀分校:植物系;2003.gydF4y2Ba
- 29.gydF4y2Ba
Haseloff J, Siemering KR, Prasher DC, Hodge S:转基因拟南芥植物的亚细胞定位和绿色荧光蛋白的去除。[j] .中国科学:自然科学,2003,32(1):1 - 4。10.1073 / pnas.94.6.2122。gydF4y2Ba
- 30.gydF4y2Ba
Payne CT, Zhang F, Lloyd AM: GL3编码bHLH蛋白,通过与GL1和TTG1相互作用调控拟南芥毛状体发育。遗传学报,2009,32(2):559 - 564。gydF4y2Ba
- 31.gydF4y2Ba
Steinebrunner I, Landschreiber M, Krause-Buchholz U, Teichmann J, Rödel G:酵母线粒体铜伴侣SCO1的拟南芥同源物HCC1对胚胎发育至关重要。[J] .中国生物医学工程学报,2011,32(2):319-330。10.1093 / jxb / erq269。gydF4y2Ba
- 32.gydF4y2Ba
杨建军,杨建军,杨建军,杨建军,杨建军,等。植物膜区室的快速组合分析。植物科学学报,2009,29(5):569 - 578。10.1111 / j.1365 - 313 x.2009.03851.x。gydF4y2Ba
- 33.gydF4y2Ba
王晓明,王晓明,王晓明,等。拟南芥叶片光合活性的研究进展。植物生理学报,2008,26(4):951-955。10.1016 / j.plaphy.2008.06.009。gydF4y2Ba
- 34.gydF4y2Ba
张建军,张建军,张建军,等。多色荧光原位杂交技术在环境微生物鉴定中的应用。分子微生物生态学手册3.11卷。Secondth版。编辑:Kowalchuk GA, Bruijn FJI, Head M, Akkermans ADL, Elsas JD。多德雷赫特:Kluwer学术出版社;2004: 711 - 726。第二个gydF4y2Ba
- 35.gydF4y2Ba
Dettmer J, Hong-Hermesdorf A, Stierhof YD, Schumacher K:空泡H+- atp酶活性对拟南芥内吞噬和分泌转运的影响。植物学报,2006,18:715-730。10.1105 / tpc.105.037978。gydF4y2Ba
- 36.gydF4y2Ba
邓杰,波森AG, Klymkowsky MW:爪蟾中间丝蛋白vimentin表达的全挂免疫细胞化学分析。发展,1989,(5):61-74。gydF4y2Ba
- 37.gydF4y2Ba
李建军,李建军,李建军,等。塑料包埋两栖动物胚胎和幼体的组织学研究。创世记,2012,50:235-250。10.1002 / dvg.20821。gydF4y2Ba
- 38.gydF4y2Ba
郑浩,孔斯特,李海峰,摩尔1:基于gfp的RHD3在内质网和高尔基体之间转运中的作用。植物学报,2004,37(3):398- 398。gydF4y2Ba
- 39.gydF4y2Ba
不变色。gydF4y2Bahttp://www.riedlab.nci.nih.gov/protocols.aspgydF4y2Ba,gydF4y2Ba
- 40.gydF4y2Ba
Schindelin J, Arganda-Carreras I, Frise E, Kaynig V, Longair M, Pietzsch T, Preibisch S, Rueden C, Saalfeld S, Schmid B,等:生物图像分析的开源平台。地理信息学报,2012,29(1):479 - 482。10.1038 / nmeth.2019。gydF4y2Ba
- 41.gydF4y2Ba
Slot JW, Geuze HJ:冷冻切片和免疫标记。自然科学学报,2007,22(2):980 - 991。10.1038 / nprot.2007.365。gydF4y2Ba
- 42.gydF4y2Ba
李春华,李春华,李春华,等。豌豆茎微粒体中二价阳离子活化ATP-ADPase的纯化和鉴定。生物化学学报,1981,(6):1-14。10.1016 / 0005 - 2736(81) 90132 - 2。gydF4y2Ba
- 43.gydF4y2Ba
Steinebrunner I, Jeter C, Song C, Roux S:拟南芥中两种不同酶的分子生化比较。植物生理学报,2009,38(2):913-922。10.1016 / s0981 - 9428(00) 01209 - 2。gydF4y2Ba
- 44.gydF4y2Ba
李建军,李建军,李建军,李建军,等。o6 -烷基鸟嘌呤- dna烷基转移酶融合蛋白的分子标记。方法,2004,32(2):437-444。10.1016 / j.ymeth.2003.10.007。gydF4y2Ba
- 45.gydF4y2Ba
李建军,李建军。蛋白质自标记技术。生物学报,2005,6:50-51。gydF4y2Ba
- 46.gydF4y2Ba
Knowles AF: GDA1_CD39超家族:具有多种功能的ntpases。中国生物医学工程学报,2011,27(7):921 - 945。10.1007 / s11302 - 010 - 9214 - 7。gydF4y2Ba
- 47.gydF4y2Ba
张建军,张建军,张建军,张建军。蛋白质亚细胞定位的研究进展。计算机工程学报,2005,31 (1):966 - 971 /journal.pcbi.0010066。gydF4y2Ba
- 48.gydF4y2Ba
王晓明,王晓明,王晓明,等。转基因植物花粉中camv35s和nos启动子活性的研究进展。[J]中国生物医学工程学报,2009,31(2):559 - 567。10.1093 / jxb / 48.2.265。gydF4y2Ba
- 49.gydF4y2Ba
李建军,李建军,李建军,等。细胞分裂和发育过程中蛋白的稳定性和再循环。中国生物医学工程学报,2008,18(1):393 - 398。10.1016 / j.cub.2008.07.020。gydF4y2Ba
- 50.gydF4y2Ba
张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,等。生物化学,2008,15:128-136。10.1016 / j.chembiol.2008.01.007。gydF4y2Ba
- 51.gydF4y2Ba
张建军,张建军,李建军,等。锌蛋白在活细胞中表达的研究进展。生物化学学报,2008,30(3):776- 777。10.1021 / ja806634e。gydF4y2Ba
- 52.gydF4y2Ba
孙磊:表达SNAP-tag融合蛋白的COS-7在活细胞成像中的荧光标记。视觉实验,2010,39 (9):1876-gydF4y2Ba
- 53.gydF4y2Ba
van Gijlswijk RP, Zijlmans HJ, Wiegant J, Bobrow MN, Erickson TJ, Adler KE, Tanke HJ, Raap AK:荧光染料标记的酪氨酸免疫细胞化学和荧光原位杂交。[J]中国生物医学工程学报,2006,25(5):379 - 379。10.1177 / 002215549704500305。gydF4y2Ba
- 54.gydF4y2Ba
高桥,丰田,平川,森下,加藤,稻崎,白石,白石。豇豆apyrase酶VsNTPase1对植物病原微生物的定位和响应。植物病理学报,2006,32(2):143-151。10.1007 / s10327 - 005 - 0267 - 3。gydF4y2Ba
- 55.gydF4y2Ba
刘建军,刘建军,刘建军,刘建军,刘建军,刘建军。绿色荧光蛋白检测高尔基体pH的研究进展。科学通报,1998,35(5):6803-6808。10.1073 / pnas.95.12.6803。gydF4y2Ba
- 56.gydF4y2Ba
Langhans M, Hawes C, Hillmer S, Hummel E, Robinson DG: Brefeldin A处理后by -2细胞的高尔基体再生包括堆叠扩大和池生长,然后是分裂。植物生理学报,2009,35(4):527-538。10.1104 / pp.107.104919。gydF4y2Ba
- 57.gydF4y2Ba
Nelson BK, Cai X, Nebenfuhr A:拟南芥和其他植物共定位的多色细胞器标记。植物学报,2007,32(1):444 - 444。10.1111 / j.1365 - 313 x.2007.03212.x。gydF4y2Ba
- 58.gydF4y2Ba
林志强,蔡勇,谢玉春,王军,罗亚华,Pimpl P,陈海燕,夏军,姜磊:bfa诱导的植物细胞高尔基体和反式高尔基网络/早期核内体的区室是不同的。植物学报,2009,35(6):865-881。10.1111 / j.1365 - 313 x.2009.04007.x。gydF4y2Ba
- 59.gydF4y2Ba
郑浩,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,等。烟草叶表皮Rab-E GTPase突变体Rab-E GTPase基因的克隆与表达。植物学报。2005,17:2020-2036。10.1105 / tpc.105.031112。gydF4y2Ba
- 60.gydF4y2Ba
张建军,李建军,李建军,等。拟南芥GTPase RabE亚细胞定位及功能分析。植物生理学报,2009,29(4):824- 837。10.1104 / pp.108.132092。gydF4y2Ba
- 61.gydF4y2Ba
李春华,李春华,李春华,等。植物高尔基体活性唾液基转移酶的研究进展。植物学报,1998,10:1759-1768。gydF4y2Ba
- 62.gydF4y2Ba
Camacho L, Smertenko AP, perz - gomez J, Hussey PJ, Moore I:拟南芥Rab-E GTPases与质膜磷脂酰肌醇-4-磷酸5激酶的相互作用。中国生物医学工程学报,2009,31(2):483 - 492。10.1242 / jcs.053488。gydF4y2Ba
- 63.gydF4y2Ba
吴春华,田春华,田春华,中野A, Takeyasu K, Sato MH:拟南芥中SNARE分子的系统分析:植物细胞后高尔基网络的解剖。细胞结构函数。2004,29:49-65。10.1247 / csf.29.49。gydF4y2Ba
- 64.gydF4y2Ba
高尔基复合体转运的膜蛋白Got1p和Sft2p。中华医学杂志,1999,18(3):334 - 346。10.1093 / emboj / 18.14.3934。gydF4y2Ba
- 65.gydF4y2Ba
光学显微镜下亚细胞共定位分析的导览。中国生物医学工程学报,2006,32(2):559 - 564。10.1111 / j.1365-2818.2006.01706.x。gydF4y2Ba
- 66.gydF4y2Ba
李春华,李春华,李春华,李春华。水稻细胞中高尔基复合体的结构和功能研究[j]。高尔基膜结合核苷二磷酸酶的纯化与鉴定。植物生理学报,1994,26(6):1104 - 1104。gydF4y2Ba
- 67.gydF4y2Ba
李春华,李春华,李春华,等。高尔基膜结合核苷二磷酸酶的分离纯化及酶活性研究。植物学报,2001,18(5):559 - 564。10.5511 / plantbiotechnology.18.259。gydF4y2Ba
- 68.gydF4y2Ba
Monshausen GB, Bibikova TN, Weisenseel MH, Gilroy S: Ca2+调节拟南芥根系机械感应过程中活性氧的产生和pH值。植物学报,2009,21(1):341- 356。10.1105 / tpc.109.068395。gydF4y2Ba
- 69.gydF4y2Ba
李建军,张建军,张建军。基于隐马尔可夫模型的跨膜蛋白拓扑预测研究。中国生物医学工程杂志,2001,31(5):557 - 558。10.1006 / jmbi.2000.4315。gydF4y2Ba
- 70.gydF4y2Ba
Nicol F, His I, Jauneau A, Vernhettes S, Canut H, Hofte H:拟南芥细胞壁组装和细胞伸长所需的质膜结合内切-1,4- β - d -葡聚糖酶。中华医学杂志,1998,17(5):563- 576。10.1093 / emboj / 17.19.5563。gydF4y2Ba
- 71.gydF4y2Ba
Zeng Keegstra K: AtCSLD2是一个完整的高尔基膜蛋白,其n端面向细胞质。植物学报,2008,28(2):823-838。10.1007 / s00425 - 008 - 0785 - 2。gydF4y2Ba
- 72.gydF4y2Ba
华松,孙志:基于支持向量机的蛋白质亚细胞定位预测。生物信息学,2001,17:721-728。10.1093 /生物信息学/ 17.8.721。gydF4y2Ba
- 73.gydF4y2Ba
李建军,李建军,李建军,等。基于蛋白质n端氨基酸序列的亚细胞定位研究。中国生物医学工程学报,2002,26(3):559 - 564。10.1006 / jmbi.2000.3903。gydF4y2Ba
- 74.gydF4y2Ba
Horton P, Park KJ, Obayashi T, fuita N, Harada H, Adams-Collier CJ, Nakai K: WoLF PSORT:蛋白质定位预测。中国生物医学工程学报,2007,35(5):585- 587。10.1093 / nar / gkm259。gydF4y2Ba
- 75.gydF4y2Ba
李建军,李建军,李建军,等。一种快速筛选蛋白质组的方法。蛋白质组学,2004,4(4):1581-1590。10.1002 / pmic.200300776。gydF4y2Ba
- 76.gydF4y2Ba
PSORT预测。gydF4y2Bahttp://psort.hgc.jp/form.htmlgydF4y2Ba,gydF4y2Ba
- 77.gydF4y2Ba
刘亚平,刘亚平,唐伟,金京,Roux SJ .拟南芥胞外核苷酸和apyrases对气孔大小的调控作用。植物生理学报,2011,32(4):557 - 557。10.1104 / pp.111.174466。gydF4y2Ba
- 78.gydF4y2Ba
金诗诗,杨诗诗,金天杰,韩建军,Suh JW:高渗胁迫对拟南芥幼苗细胞外ATP水平和应激响应基因表达的影响。生物工程学报,2009,33(3):1252-1256。10.1271 / bbb.80660。gydF4y2Ba
- 79.gydF4y2Ba
宋晨,王晓明,王晓明,王晓明,王晓明。细胞外ATP通过NADPH氧化酶诱导拟南芥超氧化物的积累。植物生理学报,2006,35(4):1222-1232。10.1104 / pp.105.073072。gydF4y2Ba
- 80.gydF4y2Ba
Dunkley TP, Hester S, Shadforth IP, runion J, Weimar T, Hanton SL, Griffin JL, Bessant C, Brandizzi F, Hawes C,等:拟南芥细胞器蛋白质组的定位。科学通报,2006,32(3):618 - 623。10.1073 / pnas.0506958103。gydF4y2Ba
- 81.gydF4y2Ba
Parsons HT, Christiansen K, Knierim B, Carroll A, Ito J, Batth TS, Smith-Moritz AM, Morrison S, McInerney P, Hadi MZ,等:拟南芥高尔基体的分离和蛋白质组学特征及其与植物细胞壁生物合成相关的功能和新成分。植物生理学报,2012,29(4):1212 - 1226。10.1104 / pp.111.193151。gydF4y2Ba
- 82.gydF4y2Ba
高尔基尿苷-5′-二磷酸酶的结构与功能研究。植物生理学报,1997,26(4):559 - 567。gydF4y2Ba
- 83.gydF4y2Ba
李建军,李建军,李建军,等。黄化豌豆幼苗尿素二磷酸葡萄糖-甾醇葡萄糖基转移酶和核苷二磷酸酶活性的研究。中国生物医学工程学报,2009,32(2):444 - 444。gydF4y2Ba
- 84.gydF4y2Ba
王晓明,王晓明,王晓明,等。高尔基酶在植物细胞壁多糖合成中的应用。植物生理学报,2001,17(4):1104 - 1104。10.1023 /: 1010675213873。gydF4y2Ba
- 85.gydF4y2Ba
高尔基囊泡中尿苷- 5′-二磷酸-葡萄糖代谢的研究。植物生理学报,1998,17(4):557 - 557。10.1104 / pp.117.3.1007。gydF4y2Ba
- 86.gydF4y2Ba
Abeijon C, Yanagisawa K, Mandon EC, Hausler A, morremen K, Hirschberg CB, Robbins PW:啤酒酵母菌高尔基体中蛋白质和鞘脂糖基化所需的鸟苷二磷酸酶。中国生物医学工程学报,1993,32(2):387 - 398。10.1083 / jcb.122.2.307。gydF4y2Ba
- 87.gydF4y2Ba
D 'Alessio C, Caramelo JJ, Parodi AJ:酵母分泌途径中核苷二磷酸酶活性的缺失并不会消除核苷酸糖依赖蛋白的糖基化。生物化学学报,2005,28(4):417- 427。10.1074 / jbc.M503149200。gydF4y2Ba
- 88.gydF4y2Ba
李建军,李建军,李建军,等。高尔基体功能抑制对淀粉积累的影响。[J] .中国生物医学工程学报,2010,31(1):391 - 391。10.1093 / jxb / erq091。gydF4y2Ba
- 89.gydF4y2Ba
Nagy B, Jencks WP:用盐和变性剂的浓溶液解聚f -肌动蛋白。生物化学学报,1995,22(2):559 - 564。10.1021 / ja01089a030。gydF4y2Ba
- 90.gydF4y2Ba
张建军,张建军,张建军,等。大鼠肾上腺皮质肌动蛋白的纯化及免疫沉淀法测定细胞肌动蛋白。生物化学学报,1986,32(3):383-387。10.1016 / 0304 - 4165(86) 90332 - 6。gydF4y2Ba
致谢gydF4y2Ba
这项工作得到了德国研究基金会的支持(批准号:STE 1455/2-1到美国),并为德累斯顿工业大学Universität的博士生提供为期一年的奖学金gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba构造和相应的WT背景转基因系由孙宇生成。我们感谢Niko Geldner捐赠的波标记系18Y (YFP-Got1p同源)、22Y (YFP-SYP32)、27Y (YFP-Rab E1d)和127R (RFP-MEMB12),以及诺丁汉拟南芥库存中心分发的相应种子。特别感谢Andreas Brecht和Katrin m
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
作者的贡献gydF4y2Ba
MS对DKO-SNAP突变体进行了分子遗传学研究,进行了共聚焦激光扫描显微镜和图像分析、样品制备和处理等定位研究,分析了AtAPY1-GFP的溶解度,并参与了论文的起草。CM对AtAPY1-GFP进行底物特异性分析。TK用免疫金标记法和间接免疫荧光法进行了定位研究gydF4y2BaAtAPY1-GFPgydF4y2Ba表达幼苗。是构思的研究,产生的gydF4y2BaAtAPY1-SNAPgydF4y2Ba转基因系和共表达系gydF4y2BaAtAPY1-GFPgydF4y2Ba和标记基因,对DKO-GFP突变体进行遗传互补,并撰写稿件。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
电子补充资料gydF4y2Ba
预包埋标记AtAPY1-GFP在根毛中的免疫荧光研究。gydF4y2Ba
附加文件3:根gydF4y2BaAtAPY1-GFPgydF4y2Ba对表达苗进行全株免疫染色,树脂包埋,切片。切片分别用α-GFP和次级α-兔Fab片段偶联Alexa Fluor 488孵育。给出了根毛的3 μm截面。Alexa Fluor 488荧光显示为绿色。比例尺为20 μm。(pdf 9111kb)gydF4y2Ba
AtAPY1-GFP在不同细胞类型中的实时成像。gydF4y2Ba
附加文件4:各种组织的CLSM图像gydF4y2BaAtAPY1-GFPgydF4y2Ba表达苗显示绿色荧光蛋白信号,覆盖明亮的视野。gydF4y2Ba(一)gydF4y2Ba子叶表皮,gydF4y2Ba(B)gydF4y2Ba下胚轴和gydF4y2Ba(C)gydF4y2Ba根尖。标尺= 20 μm。(tiff 4mb)gydF4y2Ba
GFP和YFP荧光检测成像设置的特异性。gydF4y2Ba
附加文件5:利用“CLSM”方法中列出的GFP和YFP设置对转基因植物系的子叶表皮进行成像。GFP和YFP荧光分别显示为绿色和品红。标尺= 20 μm。gydF4y2Ba(一)gydF4y2Ba具有两个来自植物的保护细胞的相同表皮切片gydF4y2BaAtAPY1-GFPgydF4y2Ba仅在GFP和YFP设置下依次成像。斑点状信号只出现在GFP检测通道中。YFP检测通道中仅可见气孔周围增厚细胞壁的微弱自身荧光。gydF4y2Ba(B)gydF4y2Ba具有两个来自植物的保护细胞的相同表皮切片gydF4y2BaYFP-SYP32gydF4y2Ba仅在GFP和YFP设置下依次成像。在这里,在GFP检测通道中只能检测到非常微弱的信号,但在YFP特异性激发和检测下,出现了强烈的YFP荧光。(tiff 8mb)gydF4y2Ba
AtAPY1-GFP和YFP-Got1p同源物的共定位分析。gydF4y2Ba
附加文件6:共表达转基因系子叶表皮细胞的CLSM图像gydF4y2BaAtAPY1-GFPgydF4y2Ba和gydF4y2BaYFP-Got1 phomologgydF4y2Ba拍摄。绿色荧光显示为绿色,YFP荧光显示为洋红色。利用透射光探测器获得了亮场型图像。分别检测AtAPY1-GFP和YFP-Got1p同源基因的荧光信号,并用ImageJ的“co-localization Finder”插件进行合并共定位。这两种蛋白的共定位用白色信号表示。使用ImageJ的“Colocalization Threshold”和来自ImageJ的“Coloc2”工具对相应的散点图进行分析。x轴表示来自GFP通道的像素强度,y轴表示来自YFP通道的像素强度。gydF4y2BaRgydF4y2BargydF4y2Ba=gydF4y2Ba皮尔森相关系数gydF4y2Ba.gydF4y2Ba标尺= 20 μm。(tiff 6mb)gydF4y2Ba
AtAPY1-GFP在pH 5.5下的底物特异性。gydF4y2Ba
附加文件7:测定了不同底物存在下,pH为5.5时AtAPY1-GFP的活性。以AMP为底物未检测到活性(数据未显示)。列上方的不同字母表示彼此之间显著不同的平均值(p<0.05, Tukey检验)。误差条表示一次反应中两次磷酸盐测量的标准差(见方法)。缩写:PgydF4y2Ba我gydF4y2Ba无机磷酸盐。(png 775 kb)gydF4y2Ba
微粒体膜及可溶性蛋白纯度分析。gydF4y2Ba
附加文件8:转基因植物蛋白提取物表达gydF4y2Ba35 s:: AtAPY1-GFPgydF4y2Ba分别用提取缓冲液、0.2% SDS、2 M NaCl、0.2 M NagydF4y2Ba2gydF4y2Ba有限公司gydF4y2Ba3.gydF4y2Ba或4 M尿素,然后在10万离心gydF4y2BaggydF4y2Ba获得微粒体膜组分(P100)和上清(S100)。Western blot检测各组分蛋白(40 μg /个)。P100部分中微粒体和不溶性蛋白的富集,以及S100部分中可溶性蛋白的富集,用针对标记蛋白的抗体证实。37 kda的胞质果糖-1,6-双磷酸酶(cFBPase)作为可溶性蛋白的标记蛋白。在提取缓冲液和2 M NaCl中发现的肌动蛋白(45 kDa)作为不溶性蛋白的标记蛋白[gydF4y2Ba89gydF4y2Ba在0.2 M Na等肌动蛋白解聚条件下作为可溶性标记物gydF4y2Ba2gydF4y2Ba有限公司gydF4y2Ba3.gydF4y2Ba, 0.2% SDS和4m尿素[gydF4y2Ba89gydF4y2Ba,gydF4y2Ba90gydF4y2Ba]。(tiff 408 kb)gydF4y2Ba
作者提交的原始图片文件gydF4y2Ba
下面是作者提交的原始图片文件的链接。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文由BioMed Central Ltd.授权发表。这是一篇开放获取的文章,在知识共享署名许可(gydF4y2Bahttps://creativecommons.org/licenses/by/2.0gydF4y2Ba),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
席勒,M.,马萨斯基,C.,库斯,T.。gydF4y2Baet al。gydF4y2Ba拟南芥apy酶AtAPY1定位于高尔基体而不是细胞外空间。gydF4y2BaBMC Plant BiolgydF4y2Ba12日,gydF4y2Ba123(2012)。https://doi.org/10.1186/1471-2229-12-123gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/1471-2229-12-123gydF4y2Ba
关键字gydF4y2Ba
- ApyrasegydF4y2Ba
- 生长调节gydF4y2Ba
- 高尔基gydF4y2Ba
- 细胞外ATPgydF4y2Ba
- 跨膜蛋白gydF4y2Ba
- SNAP-taggydF4y2Ba
- GFP-taggydF4y2Ba
- Co-localizationgydF4y2Ba
- 底物特异性gydF4y2Ba