- 研究文章
- 开放获取
- 发表:
β -葡萄糖基Yariv试剂诱导烟草受精卵和原胚细胞的细胞学变化表明,阿拉伯半乳聚糖蛋白参与了细胞分裂和细胞板的形成
BMC植物生物学体积12、物品编号:126(2012)
摘要
背景
在双子叶植物中,第一次不对称合子分裂和随后的几次细胞分裂对原胚模式的形成和后期胚的发育至关重要。阿拉伯半乳聚糖蛋白(AGPs)是一个广泛糖基化的细胞表面蛋白家族,被认为在植物生长发育的各个方面发挥重要作用,包括胚胎发生。本实验室先前的研究结果表明,AGPs与烟草卵细胞受精和合子分裂有关。然而,AGPs如何与其他参与合子分裂和原胚胎发育的因子相互作用仍不清楚。
结果
本研究利用烟草体外受精卵培养系统和一系列精细的细胞生物学技术,研究了AGPs在烟草受精卵和原胚细胞分裂中的作用。我们首次对烟草原胚的分裂模式进行了详细的研究。结果表明,在外源AGPs抑制剂β -glucosyl Yariv (β - glcy)试剂的作用下,体外培养的烟草受精卵和原胚中AGPs的异常分裂频率显著增加,且经β - glcy处理后,AGPs在细胞板上的特异位置显著降低。此外,β - glcy处理也显著影响了新细胞壁材料的积累。用钙荧光白染色法检测纤维素组分,发现强荧光位于合子分裂后新形成的子细胞壁上在活的有机体内未处理β - glcy的离体培养样品和对照样品;而在β - glcy处理下,新形成的细胞壁只有微弱的荧光。用JIM5和JIM7分别对低酯化果胶和高酯化果胶进行免疫细胞化学检测,发现这两种果胶位于受精卵和原胚的相反位置在活的有机体内极性不受- glcy的影响。此外,FM4-64染色显示,内体分布在原胚胎的细胞板中,并且β - glcy处理也影响了内体的定位模式。这些结果在随后的透射电镜观察中得到进一步证实。荧光染色技术还观察了β - glcy试剂对原胚胎细胞器的影响。
结论
这些结果表明,AGPs可能不仅与细胞板的位置决定有关,而且与新的细胞壁成分的位置有关。与其他因素相关,AGPs进一步影响烟草合子分裂和原胚模式的建立。
背景
胚胎发生是开花植物生命周期中的一个基本发育事件。在高等植物中,胚胎发生包括两个主要阶段:形态发生和成熟。形态发生包括胚胎体计划的建立,成熟包括细胞的扩增和储存大分子的积累,为胚胎的干燥和萌发以及幼苗的早期生长做准备[1- - - - - -3.]。胚胎发生起源于合子不对称分裂,导致形成一个小的细胞质致密的顶端细胞和一个较大的空泡化的基底细胞[4,5]。这两个大小不同的子细胞有不同的细胞命运:顶细胞分化为胚体,发育成成熟胚的大部分,而基底细胞分化为垂体和胚柄[1]。胚根下胚根有助于胚胎内部根分生组织的形成,而胚柄是一个高度特化、终末分化的胚胎器官,在胚胎发育中起结构和生理作用,并在胚胎发生末期退化[6- - - - - -8]。导致根尖细胞和基底细胞发育途径不同的原因还有待进一步研究。
植物胚胎发生研究的关键问题是揭示胚胎体计划建立和不同器官分化过程的运行机制。被子植物胚胎发生的实验操作是困难的,特别是在胚胎在母体组织深处发育的早期阶段[9]。近年来,一些植物胚胎的不可接近性已经被克服。结合体外培养系统,分离的受精卵模拟正常的发育模式,并允许在任何早期胚胎阶段进行直接的分子分析[10- - - - - -14]。在过去的几年里,在我们的实验室里,受精的胚珠[15,16],合子胚胎[17,18]甚至是分离的受精卵[15,19]体外培养,用于研究不同阶段胚胎的发育事件。相比之下,拟南芥烟草的受精卵和原胚胎相对较大,为研究烟草早期胚胎发育提供了理想的模型系统拟南芥并且很容易被隔离[15]。最近,我们从烟草的根尖细胞和基底细胞中提取mrna,建立cDNA文库,并通过表达序列标签分析研究了受精卵中两个子细胞的转录谱[20.]。将体外培养系统与遗传和分子技术相结合的策略将使我们对开花植物早期胚胎发育事件和胚胎细胞命运决定有新的认识。
被子植物胚胎发育遵循可预测的模式和细胞分裂的数量[3.,21]。在高等植物中,细胞质分裂是通过子细胞之间形成新的质膜和细胞壁来分离细胞质的过程[22,23]。植物细胞分裂的主要阶段包括前期带(PPB)的形成、层质体(PHP)的出现、细胞板的扩增和新细胞壁的定位。最近的研究表明,在植物细胞分裂过程中,细胞表面物质的内吞递送对细胞板的形成有重要的贡献[22]。新的细胞壁成分,如果胶和细胞壁相关蛋白(如阿拉伯半乳聚糖蛋白- agps),通过内体转移到细胞板的边缘[24- - - - - -26]。最终,膨胀的细胞板在分裂部位与亲本质膜融合,然后分离出两个子细胞。
AGPs是一个被认为与植物生长发育有关的高度糖基化蛋白大家族[27- - - - - -32]。在拟南芥,器官、组织和细胞类型特异性表达模式表明AGPs是细胞身份和命运决定的标志[33- - - - - -35]。β-glucosyl Yariv (β-GlcY)试剂作为AGP抑制剂,通过特异性结合和阻断来确定AGP的功能[36,37]。虽然β-GlcY的确切作用尚不清楚,但有可能在细胞表面形成的大复合物阻止了分子正常组装到细胞壁中[38]。我们实验室前期的研究表明,β-GlcY处理可使第一次合子分裂模式由不对称变为对称[15]。经β-GlcY处理的烟草离体受精卵培养体系为高等植物早期原胚发育的研究提供了一个理想的模式。为了进一步深入研究这一重要的发育事件,分子和细胞研究都进行了。最近,我们对β-GlcY处理的受精卵和两细胞原胚胎的转录组研究也发现,β-GlcY影响了一些与合子分裂和原胚胎发育相关的基因的表达[39]。
作为对前人工作的继续研究,本文利用烟草体外受精卵培养系统和一系列精细的细胞生物学技术,研究了AGPs在受精卵和原胚细胞分裂中的作用。采用β-GlcY试剂对离体培养的烟草受精卵和原胚的AGPs功能进行干扰。烟草l .)。抗体JIM13的免疫荧光检测和β-GlcY试剂的染色表明,在正常体外合子分裂过程中,AGPs分布在新细胞板上。用荧光白钙(CW)试剂进行细胞染色(用于观察纤维素成分),用JIM5和JIM7单克隆抗体进行荧光标记(分别用于检测低酯化和高酯化果胶)在活的有机体内体外原胚实验表明,β-GlcY处理影响了新细胞壁中纤维素沉积的位置,但不影响果胶的极性分布。FM4-64染色显示,原胚细胞分裂时,细胞板内分布有内吞囊泡。提示AGPs可能参与了新胚胎细胞板的形成。提出并讨论了一种可能涉及AGPs与其他调节因子之间关系的模型。
方法
植物材料
烟草(烟草以L.)品种SR-1为材料。幼苗在温度为26±1℃的温室中生长,光照/黑暗条件为16/8 h。这些花在花期被人工授粉。
合子和原胚的分离在活的有机体内
按照Li的方法分离了受精卵和原胚et al。[40]。不同发育阶段(授粉后3.5、4、4.5和5 d)的受精卵;收集DAP)用于分离受精卵和原胚。首先,将胚珠置于含有10-13%甘露醇、3 mM MES、1%纤维素酶R-10和0.8%巨酶R-10的酶解溶液中,pH为5.7,25℃下30 min。然后,用一个小玻璃杵轻轻研磨胚珠,胚囊从浸泡过的胚珠中分离出来。在含有13%甘露醇、3 mM MES、0.25%纤维素R-10和0.2%巨聚酶R-10、pH 5.7的酶解溶液中短期处理后,通过显微解剖从胚囊中分离出受精卵或原胚,并转移到固定液中进行进一步实验。
体外受精卵培养
体外受精卵培养的详细步骤参照秦和赵[15]。在受精卵培养中,在终浓度为50 μM的培养基中加入β-GlcY试剂(Biosupplies Pty Ltd),并通过省略该试剂进行对照试验。培养基由MS主盐+ KM8p微量盐、有机元素和维生素(Sigma) (pH 5.8)组成,外加0.3 mol/L蔗糖、0.15 mol/L甘露醇、0.1 mol/L山梨醇、1 mol/L 2,4- d、0.5 mol/L 6-BA和10%椰子(Sigma)。
将分离的受精卵培养于半透膜(millicell - cm 0.4 μM PICM01250,直径12 mm)的millicell细胞(含150 μL培养基)中,将millicell细胞置于35 mm培养皿中,培养皿中加入1.5 mL含100-120个胚珠的培养基,培养皿温度为4 DAP,作为饲养细胞。25℃黑暗培养0.5 ~ 3 d后,收集受精卵和原胚用于下一实验。
免疫荧光标记AGPs和果胶
单克隆抗体JIM5、JIM7和JIM13由Paul Konx教授慷慨提供。JIM5用于识别聚半乳糖醛酸(低酯化果胶)表位,JIM7用于识别含甲基酯的果胶表位[41], JIM13为AGPs的糖基部分。样品在磷酸盐缓冲盐水(PBS pH 7.4, 2.68 mM KCl, 1.47 mM KH)中逐渐固定在浓度分别为0.5、1、2和4%的一系列多聚甲醛中2阿宝4, 136.9 mM NaCl, 8.1 mM Na2HPO4(10 - 13%甘露醇),每步10分钟。用PBS缓冲液(pH 7.4)冲洗三次后,固定样品与稀释为1:10的初级单抗JIM5、JIM7或JIM13在含有0.8%牛血清白蛋白(BSA)的PBS缓冲液中孵育,4°C过夜。随后,将样品在PBS缓冲液中冲洗3次(每次5 min),并在抗体稀释缓冲液(含0.8% BSA的PBS缓冲液)中以1:100的浓度与二抗在室温下黑暗孵育2 h。对照样品用不含一抗的抗体稀释缓冲液孵育。
细胞壁染色
白钙ST (CW);采用美国氰胺公司(american Cyanamid Co.)作为纤维素壁组分标记物。将CW原液(1%在双蒸馏水中,pH 10 - 11,用NaOH调节)在PBS缓冲液(pH 7.4)中稀释10倍作为工作溶液。固定后的样品用CW工作液黑暗孵育10分钟,PBS缓冲液洗涤2次,显微镜下观察。
核定位染色
单克隆抗体孵育或染色后,用5 μg/mL 4′,6-二氨基-2-苯基吲哚(DAPI;分子探针)溶解于PBS缓冲液(pH 7.4)中10分钟,然后用PBS缓冲液洗涤2次。DAPI原液(1mg /mL于蒸馏水中)4°C黑暗保存。
标记膜小泡
样品用5 μg/mL FM4-64 [N-(3-三乙基氨基丙基)-4-(对二乙基氨基苯基六atrienyl)-phridinium- 2br;[分子探针]在室温下放置20分钟。原液以浓度为1mg /mL的FM4-64在二甲亚砜(DMSO, Amrasco;- 20°C保存),工作溶液溶解在PBS缓冲液(pH 7.4)中,加入10-13%甘露醇,用于标记膜内囊泡[42]。
标记内质网
用溶解1mg DiOC制得原液6(3)在1ml乙醇中,用PBS缓冲液(pH 7.4)稀释200倍,用于染色样品。固定后的样品用2 μg/mL的碘化3,3′-二己基氧碳菁(DiOC)染色6(3);在共聚焦激光扫描显微镜(CLSM)下观察。
标记线粒体
用活性染料罗丹明123 (Sigma)观察线粒体。罗丹明123以1mg /mL的浓度溶于DMSO中作为原液。活样用溶解于PBS缓冲液(含10-13%甘露醇,pH 7.4)中的10 μg/mL罗丹明123在室温下染色10 min, PBS缓冲液洗涤3次。
光学显微镜和图像收集
在倒置显微镜(徕卡DMIRB)下观察样品,并用冷却CCD (Micro MAX普林斯顿仪器公司)或共聚焦激光扫描显微镜(FluoView)记录图像TMFV1000,奥林巴斯)。
透射电子显微镜(TEM)
在活的有机体内样品:取离体胚珠3-4 DAP,室温下用3%戊二醛和PBS (pH 7.4)真空固定2 h,然后在新鲜固定液中保存4-6 h。用PBS缓冲液冲洗几次后,样品在1%四氧化锇溶液中4°C下固定过夜,然后在一系列乙醇梯度中脱水,并包埋在Spurr树脂中。树脂聚合在65°C下过夜。超薄切片(60-70 nm)在Sorvall MT-6000超微切片机下使用玻璃刀切割,并收集到formvar涂层铜网格上。透射电镜(H-800;日立)。
离体样品:收集离体培养的受精卵和前胚,在PBS (pH 7.4)中以0.5、1和2%戊二醛的浓度依次递增,每步固定30 min,然后包埋于2%琼脂中,在新鲜固定液中固定3 h。后固定、脱水、包埋及后续操作均按上述方法进行。
结果
烟草早期原胚形成模式
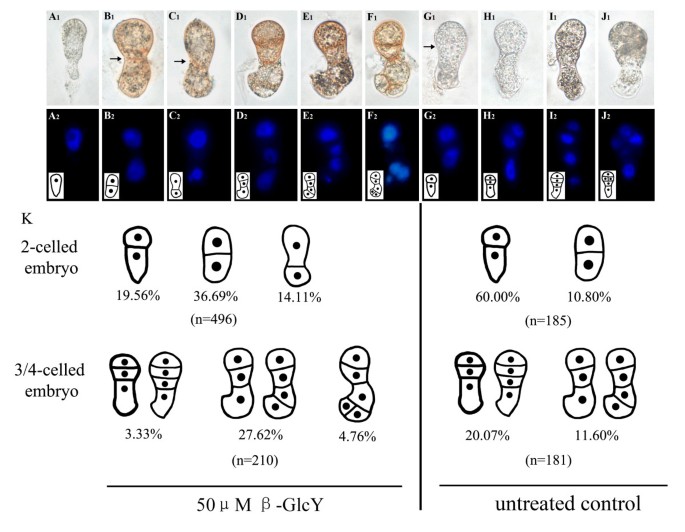
最初,我们检查了早期前胚胎分裂模式在活的有机体内对烟草。卵细胞受精后,受精卵形成,随后被拉长(图2)1一个1),并经历了不对称的横向分裂,产生一个小的球形顶细胞和一个较大的细长型基底细胞(图2)1B1)。根尖细胞和基底细胞均发生横向分裂,产生3细胞和4细胞的原胚(图2)1C1D1)。在四细胞阶段,两个上层细胞的两次纵向分裂产生八分体胚体(图2)1E1F1)。然后,胚胎体的8个细胞周周分裂并产生16个细胞的胚胎体(数据未显示)。基底细胞经过两次横向分裂形成柄,由4个细胞组成的单线组成(图2)1F1)。以DAPI染色为指导,观察原胚细胞核,作为快速确定细胞数量和相对位置的标记(图2)1一个2- f2)。
β-GlcY试剂对原胚分裂模式的影响
对烟草受精卵进行体外分离培养,观察β-GlcY试剂处理后原胚细胞分裂的变化(图2)2一个1,一个2)。在处理过的样本中,70.36%的受精卵(n = 496)完成了第一次分裂,而在未处理的样本(n = 185)中,这一比例为70.80%。体外培养2-3 d后,37.71%的受精卵分化为多细胞原胚,而对照组为31.67%(图2)2在培养基中加入50 μM β-GlcY试剂后,受精卵第一次分裂的细胞板位置(图2)2B1C1B2C2)与未处理受精卵的差异(图2)2G1G2)。细胞分裂平面的异常位置导致相对于基底细胞形成两个相等的细胞或一个更大的顶细胞(图2)2B1C1B2C2)。相反,大多数未经处理的细长受精卵不对称地分裂成两细胞原胚胎(图2)2G1G2),类似于受精卵的自然分裂模式在活的有机体内(图1B1)。在185个未经处理的受精卵中,第一次不对称分裂的频率高达60%,而对称分裂的频率仅为10.80%(图2)2K)。然而,与未处理的样品相比,处理过的样品异常双细胞前胚胎的百分比(约50%)明显更高(图2)2K)。
β-GlcY也影响了随后的原胚细胞分裂,细胞分裂平面呈现明显的随机方向。培养2-3 d后,近1 / 3的受精卵分裂为3-5个细胞的原胚(图2)2在β-GlcY处理的样品中,27.62%的3/4细胞前胚胎分裂异常(图2)2D1E1D2E2;数字2K), 4.79%的原胚变成了出芽结构(图2)2F1F2;数字2K),正常前胚的出现频率降至3.33%(图2)2相反,大多数未经处理的受精卵细胞通常按照自然分裂模式分裂在活的有机体内形成了一个胚胎(图)2H1- j1H2- j2),作为重要的控制。图中数据2K表明,β-GlcY不影响存活率和细胞分裂频率,但具体影响烟草受精卵和原胚的细胞板位置决定,提示AGPs可能参与了受精卵分裂和早期原胚模式形成。
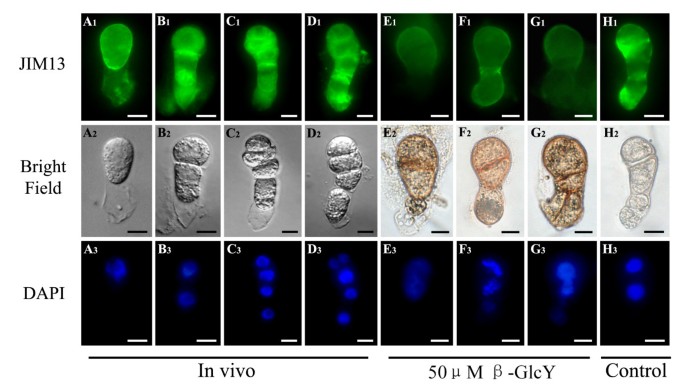
β-GlcY试剂对AGPs分布的影响
利用单克隆抗体JIM13和β-GlcY试剂检测AGPs在原胚中的分布。原胚胎细胞板染色为红色(图2)3.E2- g2),其分布模式与JIM13表位的荧光结果相似(图2)3.B1- d1),均表明新生成的细胞板中存在丰富的agp。相比之下,在活的有机体内(图3.一个1- d1)和体外未经处理的原胚胎(图3.H1),处理前胚胎细胞的免疫荧光(图2)3.E1- g1)明显减弱,特别是在细胞板区,提示β-GlcY特异性结合AGPs的碳水化合物,从而阻断其与单克隆抗体JIM13的结合。此外,无一抗的阴性对照在样品中没有荧光(数据未显示)。
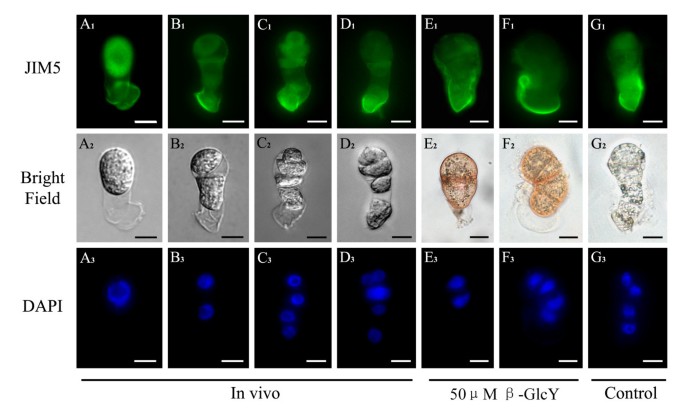
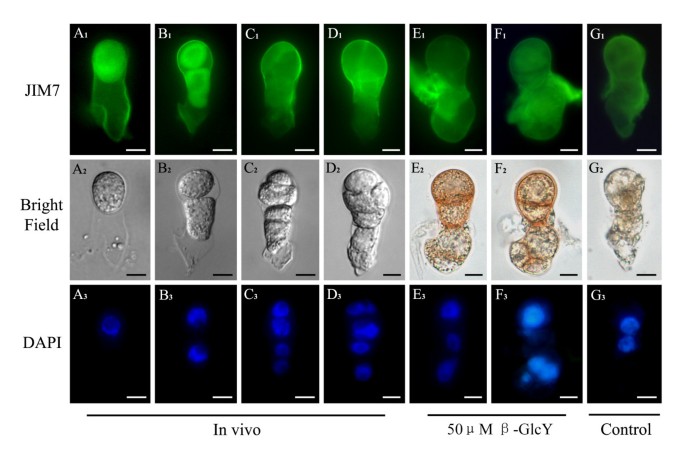
果胶在受精卵和原胚中的极性分布在活的有机体内在体外
单克隆抗体JIM5和JIM7与果胶均半乳糖酸(HG)不同的部分甲基化表位结合,其中JIM5与低酯化果胶结合,JIM7与高酯化果胶结合。在烟草受精卵和原胚中,两种果胶表现出不同的分布(图2)4和5)。为在活的有机体内在合子中,JIM5的标记显示低酯化果胶主要分布在细胞壁的基端(或微孔端),而在细胞质和顶端(或合点端)细胞壁的分布明显较弱(图5)4一个1)。合子分裂后,免疫荧光更集中在细胞壁的基端(图2)4B1- d1)。此外,在离体培养的受精卵和原胚中,JIM5免疫荧光也显示低酯化果胶主要分布在基端细胞壁(图5)4E1- g1)。低酯化果胶的分布模式在不同处理之间相似(图2)4E1F1)和未经处理的样品(图4G1)。因此,在低酯化果胶的分布没有差异在活的有机体内体外培养的受精卵和原胚,我们可以得出β-GlcY不影响低酯化果胶的分布。
与JIM5相比,JIM7的标记呈现出不同的分布模式(图5)5)。为在活的有机体内在受精卵中,JIM7免疫荧光位于整个细胞壁,在细胞质中稍弱(图2)5一个1)。合子分裂后,高酯化果胶的荧光逐渐向顶端集中在活的有机体内原胚(图5B1- d1)。体外培养的原胚胎(图5E1- g1),免疫荧光显示高酯化果胶分布模式在处理组之间相似(图2)5E1F1)和未经处理的样品(图5G1);然而,有不同之处在活的有机体内原胚(图5B1- d1)。对于体外培养的原胚,高酯化果胶分布在β-GlcY处理的整个细胞壁中(图2)5E1F1)或未处理的样品(图5G1)。JIM7免疫荧光显示,体外培养可以改变高酯化果胶的分布模式。
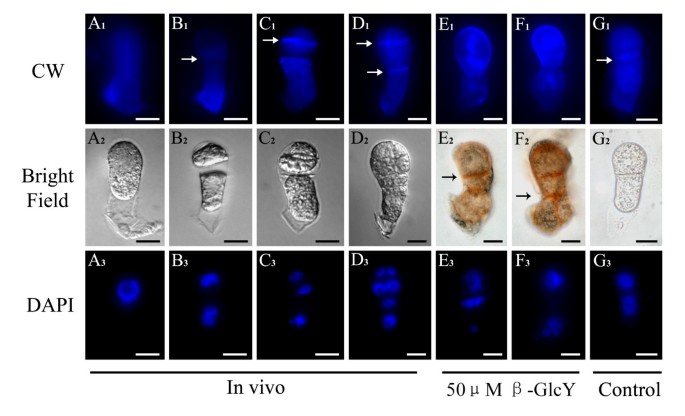
β-GlcY试剂处理引起的纤维素积累变化
观察纤维素在受精卵和原胚中的分布在活的有机体内体外用荧光白钙(CW)作为荧光染料。CW与β1-3和β1-4多糖结合,如胼胝质和纤维素,它们是植物细胞壁的常见成分。我们都染色了在活的有机体内并用CW试剂对离体样品进行荧光标记,观察离体原胚的荧光标记在活的有机体内(图6一个1- d1)和未经处理的原胚胎(图6G1)大量沉积在细胞壁上。而在用50 μM β-GlcY试剂培养的原胚中,细胞板的CW荧光信号较弱或完全不存在(图2)6E1F1),相反,这些区域被β-GlcY明显染成红色(图2)6E2F2)。因此,β-GlcY处理可能会影响新生成的细胞壁成分的位置。
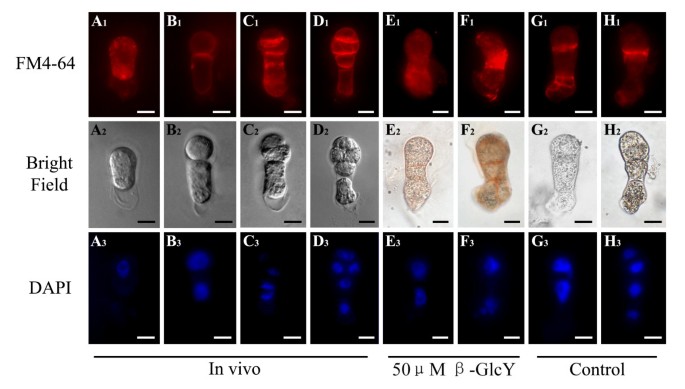
β-GlcY试剂对胞吞作用分布的影响
一种荧光亲脂性苯乙烯染料FM4-64,常被用作活植物细胞的真正内吞标记物[43],仅通过内吞作用进入细胞内部,因此可以逐渐标记为内吞途径。为了研究细胞膜结构的变化,我们用FM4-64染色活受精卵和原胚在活的有机体内在体外。在受精卵中,FM4-64的荧光均匀分布在整个细胞质中(图2)7一个1)。当合子分裂成多细胞胚胎时,FM4-64的信号在新形成的细胞板及其边缘被广泛检测到(图4)7B1- d1)。然而,在β-GlcY处理的原胚胎中,细胞板边缘的特异性信号消失,取而代之的是细胞质中FM4-64信号的均匀分布或异常积累(图2)7E1F1)。此外,在不含β-GlcY培养的原胚中,新形成的细胞板被FM4-64清晰标记(图4)7G1H1)。众所周知,细胞分裂过程中细胞表面物质的内吞传递对细胞板的形成有重要的促进作用;因此,β-GlcY诱导的内体分布变化可能表明AGPs在细胞板形成中起重要作用。
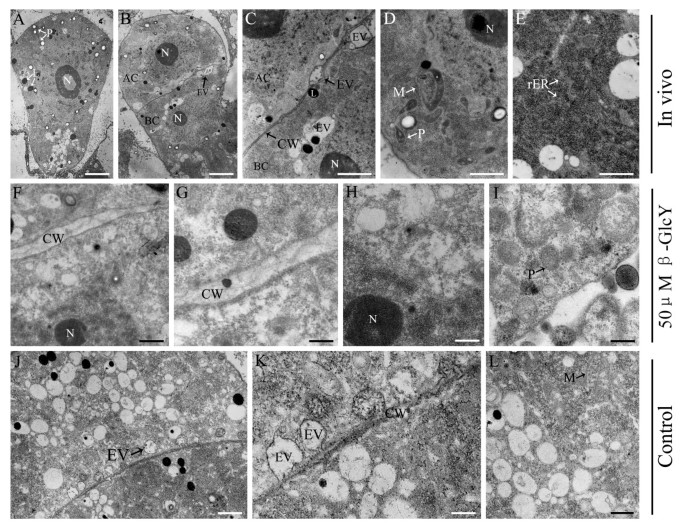
受精卵和原胚超微结构特征
透射电镜观察了受精卵和原胚的超微结构,并观察了受精卵和原胚的超微结构在活的有机体内这些图片显示了体外实验的结果。在图8A,细长的梨形受精卵在活的有机体内烟草细胞高度极化,细胞核位于合点端,微孔端有一些小液泡,含淀粉质体大量聚集在细胞核周围(图2)8A)。第一次合子分裂是横向的,产生一个小的球形顶端细胞和一个大的基底细胞(图2)8B)在活的有机体内二细胞胚胎中存在大量与受精卵相似的内质网(ER)、质体和线粒体(图2)8D, E)。一些内吞囊泡附着在细胞壁上,另一些出现在细胞板区域附近(图3)8C),表明胞吞囊泡参与了细胞板的形成。体外未处理的原胚胎表现出与在活的有机体内原胚(图8J-L)。然而,β-GlcY处理的前胚胎细胞与两者不同在活的有机体内体外未处理的原胚胎内体在细胞板中未被观察到(图2)8外:我)。因此,结果表明,AGPs的分布可能参与了内吞囊泡的定位,并进一步参与了细胞板的形成。
烟草受精卵和原胚的透射电子显微照片。(一)授粉后84 h受精卵的超薄切片。相邻的箭头突出显示了质体、囊泡和脂质体。Bar = 3 μm。(B)有一个顶细胞和一个基细胞的两细胞原胚。Bar = 3 μm。(C)图B局部放大显示顶端和基底细胞之间的质膜和细胞壁。一些内吞囊泡位于细胞板上,用箭头突出显示。Bar = 1 μm。(D)原胚胎的细胞质在活的有机体内.相邻的箭头突出显示了质体、线粒体和粗内质网。Bar = 1 μm。(E)原胚胎的细胞质在活的有机体内.Bar = 500 nm。(f - 1) 50 μM β-GlcY处理前胚的超薄切片图像。经β-GlcY处理后,细胞板内的内吞囊泡定位受到影响(F和G)。β-GlcY处理的原胚细胞器的分布和形态也发生了变化(H和我)。bar = 500 nm in(F);200nm(G、H、I).(J-L)未处理β-GlcY的体外培养原胚超薄切片。部分内吞囊泡定位于细胞壁上,形态与在活的有机体内原胚。bar = 500 nm in(J);200nm(K及L).AC,顶细胞;BC,基底细胞;CW,细胞壁;粗内质网;L,脂质体;米,线粒体;N,核;P,质体;EV,内吞囊泡。
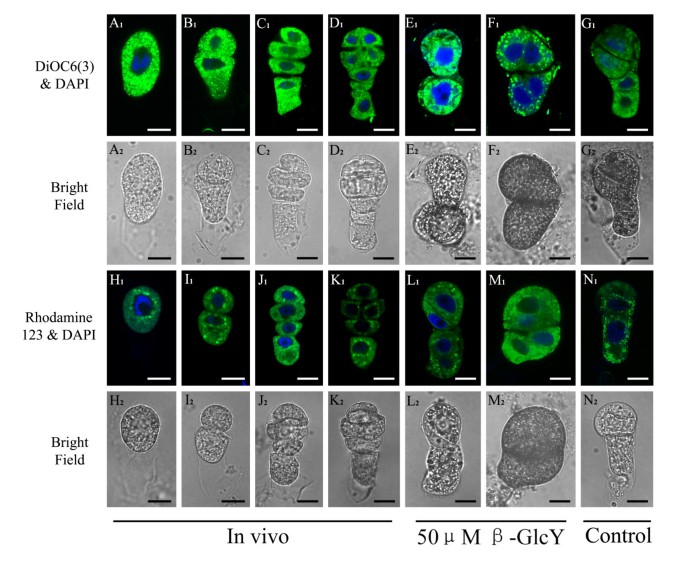
在β-GlcY处理的原胚胎中,我们还发现细胞器,如质体和线粒体出现形态变化,核糖体数量减少(图2)8外:我)。然后,我们用DiOC荧光染料观察内质网和线粒体的分布6(3)和Rhodamine123(图3)9),其结果与透射电子显微镜下观察到的结果相似。内质网分布均匀在活的有机体内受精卵和原胚胎(图19一个1- d1)。体外培养可以改变内质网分布(图2)9E1- f1)或未经β-GlcY处理(图2)9G1);然而,处理过的样本的内质网分布比未处理的样本紊乱得多。细胞质中线粒体分布在细胞核周围在活的有机体内受精卵和原胚胎(图19H1- k1)。对于体外培养的样品,β-GlcY处理后,线粒体呈现无序分布(图2)9l1- m1),而未处理前胚胎的线粒体定位与此相似在活的有机体内(图9N1)。综上所述,β-GlcY不仅影响细胞器的形成,还影响细胞器的分布,提示AGPs在这些过程中发挥了作用。
烟草受精卵和原胚细胞内质网和线粒体的分布。(一个1- g1) DiOC染色的受精卵和原胚内质网荧光图像6(3)激光共聚焦扫描显微镜下。(一个1- d1) DiOC的绿色荧光信号6(3)在孤立中出现均匀在活的有机体内受精卵和原胚胎细胞。(E1和F1) DiOC的荧光信号模式6(3)经50 μM β-GlcY试剂处理后,受精卵和原胚细胞组织紊乱。(G1) DiOC的荧光6(3)体外培养的未处理受精卵和原胚与未处理受精卵和原胚相似在活的有机体内.(H1- n1)共聚焦激光扫描显微镜下,罗丹明123染色的受精卵和原胚线粒体的荧光图像。(H1- k1)在离体受精卵和原胚胎中Rhodamine123的绿色荧光表明线粒体定位于细胞核周围。(l1- m1) 50 μM β-GlcY处理后,原胚线粒体分布紊乱。(N1)未处理样品的荧光与体外培养的荧光相似在活的有机体内.细胞核用DAPI染色,显示蓝色荧光一个1- n1.(一个2- n2)与图A对应的受精卵和原胚胎的亮场图像1- n1.bar = 10 μm。
讨论
被子植物胚胎的发育遵循可预测的细胞分裂平面和数量的模式[3.,21,42]。在本研究中,我们首先研究了烟草正常原胚发育的详细分裂事件(图2)1)。有趣的是,我们还发现在n .烟草和拟南芥在顶端细胞的初始分裂模式和柄细胞的数量上。在烟草中,合子伸长,然后不对称地分裂,形成两个大小不同的子细胞(图2)1一个1B1)。小的顶端子细胞首先进行一次横向分裂,然后进行两轮纵向分裂,形成8细胞胚(图2)1F1)。而在另一个典型的dicot中拟南芥,顶端细胞经历两次纵向分裂和一次横向分裂,形成八分位胚体[44]。同时,烟草的基底细胞横向分裂形成3-4个细胞的悬柄,而烟草的基底细胞横向分裂形成6-7个细胞的悬柄拟南芥胚柄。
建立完善的烟草受精卵和原胚分离培养实验体系,有利于研究双子叶植物胚胎发生的早期事件及其发生机制。近年来,烟草受精卵和原胚转录组研究为合子基因激活(ZGA)和胚胎极性建立提供了大量数据[j]。20.,45,46]。我们还使用了β-GlcY处理的离体培养体系,与对称胚相比,可以提供对称分裂的原胚在活的有机体内,研究早期原胚发育。除了我们在这篇文章中所展示的细胞研究结果外,我们还应用分子方法来揭示受精卵启动第一次不对称分裂的机制。最近,我们对β-GlcY处理的受精卵和两细胞前胚胎的转录组研究发现了一些可能与合子分裂和前胚胎发育有关的候选基因[39]。因此,细胞学和分子方法与遗传学方法的结合将为植物早期胚胎发育提供更多的研究成果,填补更多的研究空白。
AGPs在前胚胎细胞命运决定中的可能作用
在双子叶植物中,如拟南芥而烟草原胚的极性早在第一次不对称合子分裂时就已形成。之后,两个子细胞经历不同的发育命运。先前的研究表明,顶细胞和基底细胞在形状、大小、细胞质甚至基因转录方面都存在差异[20.,42,44]。在我们的研究中,β-GlcY处理影响了原胚胎正常的合子分裂和随后的细胞分裂,形成了失去形态极性的异常原胚胎(图2)2)。此外,通过显微和电镜观察β-GlcY诱导的详细效果(图2)2和8),结果表明,顶端细胞的体积相对较小、细胞质致密等典型特征发生了改变,同时其发育途径偏离了最初的命运。一些关于不同植物合子胚胎发生的研究也发现AGPs参与分生组织细胞的维持,另一些关于体细胞胚胎发生的研究也发现AGPs参与胚胎细胞的诱导[15- - - - - -18,47- - - - - -50]。在小孢子胚胎发生中,也发现AGPs可能能够诱导胚胎发生熟练度[51]。在拟南芥结果表明,β-GlcY处理可使鱼雷期胚茎尖分生组织细胞由典型的分生组织细胞转变为淀粉粒较多、液泡较大的分化细胞[18]。在烟草胚早期,我们还发现β-GlcY处理不仅影响细胞分裂平面和相对细胞大小,还影响亚细胞结构(图2)2和8),如细胞器丰度和分布,这是区分细胞分化程度的典型特征。最近,我们的另一项研究通过比较转录分析β-GlcY处理和在活的有机体内未经处理的两细胞原胚胎表明,与合子细胞分裂和发育相关的一些转录物的表达显著不同[39]。综上所述,β-GlcY处理对受精卵和体细胞胚胎细胞发育命运的显著影响表明,AGPs可能在这些过程中发挥重要作用。然而,AGPs如何参与原胚胎细胞命运决定的细节仍需要更多的研究。
β-GlcY试剂对烟草原胚细胞壁新组分积累的影响
在原胚中,与高等植物的其他器官一样,新细胞板的位置决定了分裂是对称的还是不对称的,并影响子细胞的后续分化和发育。在我们的研究中,我们发现AGPs在烟草受精卵和原胚中含量丰富,特别是在新形成的细胞板区域(图2)3.)。这些结果表明,AGPs可能参与了细胞板定位,这对植物正常的原胚发育至关重要。一些研究表明,在植物细胞分裂过程中,内吞传递对细胞板的形成有重要作用[22]。正是通过核内体,新的细胞壁成分,如果胶和细胞壁相关蛋白(如AGPs)被转移到细胞板的边缘[24- - - - - -26]。因此,核内体参与细胞质分裂和细胞壁的组装。先前在百合花粉管中的研究表明,β-GlcY试剂破坏了花粉管尖端的分泌内体,阻止了细胞壁成分的正常掺入,从而抑制了花粉管尖端的生长[j]。38]。在本研究中,纤维素在新形成的细胞板上的积累被β-GlcY试剂阻断(图2)6)。此外,FM4-64对内吞递送的染色显示,加入β-GlcY试剂后,培养的原胚胎细胞内体囊泡的分布被破坏(图2)7)。我们的研究表明了内体囊泡与细胞板形成的相关性,并提示AGPs参与细胞壁物质定位。
植物细胞壁是高度复杂的结构,由多种多糖组成,如纤维素、半纤维素、果胶和结构蛋白[24- - - - - -26],果胶是双子叶植物初生细胞壁的主要成分[52]。一些研究人员已经表明,AGPs可能与植物细胞中的果胶分布有关[18]。然而,我们惊奇地发现,不同酯化程度的果胶在受精卵和原胚细胞壁上的极性分布是不同的,而且这种极性不受β-GlcY处理的影响(图2)4和5)。目前,人们对果胶的生物合成机制知之甚少。据推测,果胶是在高尔基体中合成和甲基化的,然后以高度甲基化的形式分泌到细胞壁上,随后被果胶甲基化酯酶去酯化[53]。花粉管免疫定位结果表明,高酯化果胶仅存在于花粉管壁的顶端区域,而低酯化果胶则广泛分布于整个花粉管中。54]。此外,据报道,脱酯化果胶可以与Ca结合2+离子和强化细胞壁结构[55]。在本研究中,JIM5标记的低酯化果胶主要定位于烟草受精卵基端和原胚细胞壁在活的有机体内;相反,JIM7识别的高酯化果胶主要分布在细胞壁的顶端(图3)4模拟和5模拟)。结合以往的研究,我们对烟草原胚的观察在活的有机体内表明JIM7识别的高酯化果胶可能参与了原胚的极性生长,而基部分布的低酯化果胶可能在结构上使细胞壁硬化。然而,果胶在烟草原胚中这种有趣的极性分布的详细机制还需要更多的研究。此外,与低酯化果胶相比,高酯化果胶的分布模式不同在活的有机体内体外培养样品(图25)。因此,高酯化果胶的模式变化也可能与体外培养有关,而不仅仅与β-GlcY处理有关。
原胚发育过程中AGPs参与细胞板形成的可能模式
在褐藻中墨角藻属在美国,第一次不对称细胞分裂与细胞壁成分的靶向分泌有关。肌动蛋白微丝和完整的细胞壁都是定向囊泡分泌以稳定其极轴所必需的[56- - - - - -58]。一些研究表明,β-GlcY处理可使by2细胞的皮质微管解聚和紊乱,并影响f -肌动蛋白的组织[59,60]。另一组报道AGPs与β-GlcY交联可抑制烟草细胞伸长,并提出AGPs可能是植物细胞生长的重要调节因子[61]。众所周知,植物细胞内体的运动依赖于细胞骨架网络的运输[62]。本研究认为,β-GlcY试剂进入细胞壁,与AGPs结合形成AGP-Yariv复合物,从而破坏AGPs与细胞壁和质膜上其他分子组分的相互作用,最终阻碍胞内递送和细胞骨架运输[63,64]。其他研究表明,AGPs可能参与植物细胞中的纤维素沉积[65]。本实验室前期的工作表明,在阿拉伯半乳聚糖蛋白FLA3拟南芥参与花粉内部形成并可能参与纤维素沉积[66],并且agp参与细胞壁纤维素和果胶的沉积拟南芥胚胎(18]。用于离体培养拟南芥在胚珠发育过程中,50 μM β-GlcY处理影响了纤维素和果胶的沉积,导致细胞分裂和子叶形成异常。这些结果表明,AGPs在生殖植物发育的细胞壁组织和细胞分裂中发挥着重要作用,但其功能的具体机制有待进一步研究。
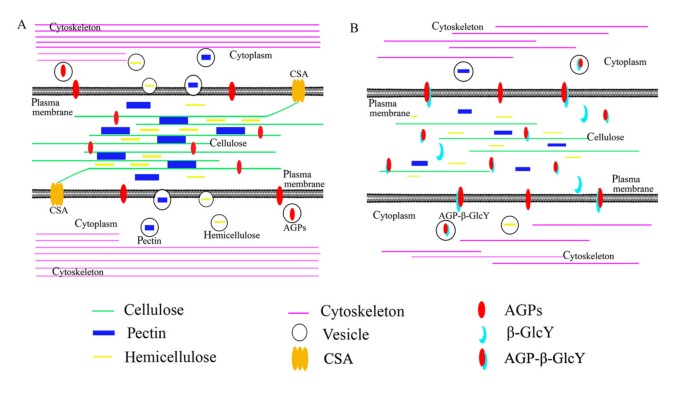
基于先前的[38,59,65]和目前的研究,提出了AGP参与细胞板形成的模型(图2)10)。AGP是植物中丰富的细胞表面蛋白,任何AGP的变化都可能影响其他细胞表面成分或诱导细胞骨架异常[27,60,67]。在合子胚胎发生中,AGPs的缺失深刻地改变了第一次合子分裂,扰乱了原胚胎模式的形成[15]。我们的模型表明,AGPs与β-GlcY试剂结合后,可能抑制AGPs与其他分子的相互作用,从而直接或间接地影响细胞骨架定位,扰乱细胞骨架依赖性转移,如胞吞传递,进而影响细胞板的形成。这一过程中涉及的另一种可能的模型是AGP-Yariv复合物可能扰乱新细胞壁和质膜组分的组装,如纤维素合酶(csa) [65]。先前的结果拟南芥结果表明,在?的零突变体中,初代细胞壁的形成受到影响,胚轴上的细胞伸长严重受损纤维素合酶A[68]。在这种情况下,agp可能有两个重要的职责:一个是信号分子,另一个是结构成分。然而,AGPs在合子分裂中的两种可能功能仍需要更多的实验证据来证实。
结论
本研究通过体外受精卵培养和一系列精细的细胞生物学技术,探讨了AGPs在烟草原胚细胞分裂中的作用。在烟草中,我们首次对受精卵和原胚各细胞分裂事件进行了详细的观察,并比较了烟草原胚分裂模式与烟草原胚分裂模式的细微差异拟南芥.在体外培养的原胚胎中,我们发现当AGPs与β-GlcY特异性结合而失去功能时,受精卵和原胚胎的细胞分裂紊乱。此外,我们采用荧光标记方法结合超薄切片观察了AGPs、果胶和纤维素等细胞壁材料、内吞囊泡等细胞器的分布。结果表明,加入AGPs抑制剂β-GlcY后,AGPs、纤维素和内吞囊泡的细胞板特异性位置降低或紊乱。此外,线粒体和内质网的形态和分布也受到影响。除此之外,有趣的是,我们还发现低酯化果胶和高酯化果胶位于受精卵和原胚的相反位置,这种极性几乎不受β-GlcY的影响。由此可见,β-GlcY处理对体外培养的受精卵和原胚胎的细胞板位置决定和新细胞壁材料的定位都有影响。这些结果表明,AGPs可能参与了烟草新细胞板的形成,并在烟草合子分裂和原胚模式的建立等重要发育过程中发挥了作用。进一步的分子和遗传分析将促进AGPs在植物发育中的机制研究。
缩写
- agp:
-
阿拉伯半乳聚糖蛋白质
- β-GlcY:
-
β-glucosyl Yariv
- BSA:
-
牛血清白蛋白
- 样品形貌:
-
共聚焦激光扫描显微镜
- 辅导:
-
纤维素合酶
- 连续波:
-
Calcofluor白
- 衣冠楚楚的:
-
授粉后几天
- DAPI:
-
4 ' 6-diamidino-2-phenylindole
- DiOC6(3):
-
3, 3 ' -dihexyloxacarbocyanine碘
- DMSO溶液:
-
二甲亚砜
- 佛罗里达州的:
-
类菲西克林阿拉伯半乳聚糖蛋白
- fm4 - 64:
-
N - (3-triethylammoniumpropyl) 4 - (p-diethylam-inophenylhexatrienyl) -phridinium-2Br
- HG:
-
Homogalacturonan
- PHP:
-
成膜体
- 点:
-
果胶methylesterases
- 磅:
-
Preprophase乐队
- RG-I:
-
Rhamnogalacturonan-I
- SG:
-
代替galacturonans
- ZGA:
-
受精卵基因激活。
参考文献
- 1.
李建军,李建军,李建军,等。植物胚胎发育的研究进展。科学,1994,26(6):605-614。10.1126 / science.266.5185.605。
- 2.
李建军,李建军,李建军,等。拟南芥胚胎发育的研究进展。中国生物医学工程学报,2007,23(3):397 - 396。10.1146 / annurev.cellbio.22.011105.102609。
- 3.
王晓明,王晓明。拟南芥胚胎发育研究。方法:中华生物医学杂志,2008,27(4):3-16。10.1007 / 978 - 1 - 59745 - 273 - 1 _1。
- 4.
刘建军,刘建军,刘建军。植物胚胎发育的研究进展。植物学报,2010,31(6):959-970。10.1111 / j.1365 - 313 x.2010.04143.x。
- 5.
王晓明,王晓明。植物胚胎发育过程中极性与信号转导的关系。[J] .中国生物医学工程学报,2009,31(1):391 - 391。10.1093 / jexbot / 51.347.971。
- 6.
拟南芥胚胎发生的顶基模式形成。中国生物医学工程学报,2001,29(2):369 - 369。10.1093 / emboj / 20.14.3609。
- 7.
李建军,李建军,李建军,等。胚胎模式形成的遗传调控。植物学报,2004,16(6):990 - 992。10.1105 / tpc.016014。
- 8.
魏特宁,王晓明,王晓明,王晓明,王晓明。胚柄mrna在胚胎早期发育过程中的定位。植物学报,2001,13(3):369 - 369。
- 9.
乔杜里m,克雷格S,丹尼斯E,孔雀W:胚珠和胚胎发育、无融合受精。植物学报,1998,(1):26-31。10.1016 / s1369 - 5266(98) 80123 - 4。
- 10.
Hoshino Y, Murata N, Shinoda K:利用微血管连接的微泵进行人工筛选,分离单个卵细胞和受精卵。[j] .中国生物医学工程,2006,27(1):1 - 4。10.1093 / aob / mcl072。
- 11.
冯维根P,黄春华,黄春华。玉米卵细胞和受精卵微管结构变化的免疫细胞化学方法。植物生殖学报,2004,17:89-95。
- 12.
leq, Gutierrez-Marcos JF, Costa LM, Meyer S, Dickinson HG, Lorz H, Kranz E, Scholten S:玉米卵细胞和中心细胞基因文库的构建和筛选。植物科学学报,2005,44(4):387 - 398。10.1111 / j.1365 - 313 x.2005.02518.x。
- 13.
Leduc N, Matthys-Rochon E, Rougier M, Mogensen L, Holm P, Magnard JL, Dumas C:玉米胚的体外培养和微注射基因的表达。生物医学工程学报,1997,17(3):391 - 391。10.1006 / dbio.1996.0155。
- 14.
Sprunck S, Baumann U, Edwards K, Langridge P, Dresselhaus T:小麦受精后卵细胞转录因子组成的显著变化。植物科学学报,2005,41(1):669 -672。10.1111 / j.1365 - 313 x.2005.02332.x。
- 15.
秦勇,赵军:阿拉伯半乳聚糖在烟草卵细胞、受精卵和两细胞原胚中的定位及对β - d -葡萄糖基Yariv试剂对烟草卵细胞受精和合子分裂的影响[J] .中国烟草学报,2006,37(5):2061-2074。10.1093 / jxb / erj159。
- 16.
胡燕,秦燕,赵军:拟南芥半乳蛋白表位定位及亚瑞夫苯糖苷对合子胚发育的影响。原体学报,2006,29(2):21-31。10.1007 / s00709 - 006 - 0185 - z。
- 17.
张晓玲,任玉军,赵军:伸展蛋白在烟草子叶原基形成和茎尖分生组织活性中的作用。[J] .实验学报,2008,59:4045-4058。10.1093 / jxb / ern245。
- 18.
钟军,任玉军,于敏,马峰峰,赵军:拟南芥胚发育过程中半乳蛋白在子叶形成和细胞壁沉积中的作用。原生生物学报,2011,24(4):551-563。10.1007 / s00709 - 010 - 0204 - y。
- 19.
何玉春,何玉青,曲红华,孙明明,杨海英:烟草合子胚离体发育:原始细胞壁对细胞极性、顶基轴和典型胚柄形成的维持至关重要。植物学报,2007,49(4):515-527。10.1111 / j.1365 - 313 x.2006.02970.x。
- 20.
胡天天,于敏,赵军:烟草受精卵两个子细胞的转录组对比分析揭示了根尖细胞和基底细胞的转录组差异。植物生态学报,2010,32(1):481 - 481。
- 21.
杨建平,杨建平。细胞不对称分裂:植物发育的视角。生物医学工程学报,2009,16(6):783-796。10.1016 / j.devcel.2009.05.014。
- 22.
李建军,李建军,李建军,李建军,李建军。植物细胞分裂过程中细胞表面物质的内吞作用及其对细胞板形成的影响。软件学报,2006,25(10):1337 - 1350。10.1016 / j.devcel.2005.11.015。
- 23.
Samuels AL, Giddings TH, Staehelin LA:烟草BY-2和根尖细胞的细胞动力学:高等植物细胞板形成的新模型。中国生物医学工程学报,2003,19(3):444 - 444。10.1083 / jcb.130.6.1345。
- 24.
植物细胞分裂:通过融合产生裂变。中国生物医学工程学报,2005,25(5):779 - 783。10.1016 / j.tcb.2005.03.005。
- 25.
李建军,李建军,李建军,等。植物内吞网络的研究进展。植物学报,2005,15:425-433。
- 26.
Shibaya T, Sugawara Y: β -glucosyl Yariv试剂诱导多核细胞再生及阿拉伯半乳聚糖蛋白在细胞板形成中的作用。植物学报,2009,23(2):581-588。10.1007 / s00425 - 009 - 0954 - y。
- 27.
李建军,李建军,李建军,等。阿拉伯半乳糖蛋白的研究进展。植物生理学报,2010,32(3):444 - 444。10.1104 / pp.110.156000。
- 28.
卢慧,陈敏,Showalter,等。阿拉伯半乳糖蛋白在番茄种子萌发和幼苗生长过程中的表达及调控。植物物理学报,2001,12(2):442-450。10.1034 / j.1399-3054.2001.1120319.x。
- 29.
马海林,赵军:水稻阿拉伯半乳聚糖蛋白基因家族的全基因组鉴定、分类及表达分析。[J] .中国生物医学工程学报,2010,31(1):447 - 468。10.1093 / jxb / erq104。
- 30.
潘鑫,杨鑫,林刚,邹荣,陈宏,Samaj J,徐超:香蕉体胚发生过程中阿拉伯半乳聚糖蛋白的超微结构变化及分布。“Yueyoukang 1”)。植物生理学报,2011,32(2):372-389。10.1111 / j.1399-3054.2011.01478.x。
- 31.
刘建军,刘建军,刘建军,等。拟南芥半乳聚糖蛋白基因家族的研究。植物学报,2000,12(2):1751-1768。
- 32.
范亨格尔AJ, Tadesse Z, Immerzeel P, Schols H, van Kammen A, de Vries SC: n -乙酰氨基葡萄糖和含氨基葡萄糖的阿拉伯半乳聚糖蛋白控制体细胞胚胎的发生。植物生理学报,2001,25(2):379 - 379。10.1104 / pp.125.4.1880。
- 33.
Coimbra S, Almeida J, Junqueira V, Costa ML, Pereira LG:拟南芥有性生殖的阿拉伯半乳聚糖分子标记。[J] .中国生物医学工程学报,2009,35(5):557 - 557。10.1093 / jxb / erm259。
- 34.
高敏,Showalter AM:模块化阿拉伯半乳糖蛋白LeAGP-1的免疫定位及其在番茄发育调控中的表达。植物学报,2000,21(2):865-874。10.1007 / s004250050691。
- 35.
阿拉伯半乳糖蛋白:结构、表达和功能。中国生物医学工程学报,2001,29(4):444 - 444。10.1007 / PL00000784。
- 36.
植物细胞中的蛋白聚糖和相关成分。中华医学杂志,1997,17(4):391 - 391。
- 37.
杨建军,杨建军,李建军,等。苯偶氮糖苷类抗体与糖苷类的相互作用。中国生物医学工程学报,2002,18(5):388 -388。
- 38.
Roy S, Jauh GY, Hepler PK, Lord EM: Yariv苯苷对百合花粉管细胞壁组装的影响。植物学报,1998,24(4):445 -458。10.1007 / s004250050279。
- 39.
胡天天,于敏,赵军:烟草不对称和对称合子分裂基因表达差异的比较转录分析。科学通报,2011,6:e27120-10.1371/journal.pone.0027120。
- 40.
李世涛,杨海英:利用特制的电穿孔装置将基因转移到离体和培养的烟草受精卵中。植物学报,2000,19(4):564 - 567。10.1007 / s002990000249。
- 41.
Clausen MH, Willats WG, Knox JP:抗高半乳糖酸甲酯单克隆抗体LM7, JIM5和JIM7的合成。生物质化学工程学报,2003,32(3):394 - 398。10.1016 / s0008 - 6215(03) 00272 - 6。
- 42.
Smith LG:植物细胞分裂:在正确的地方建造墙壁。中华生物医学工程学报,2001,22(2):393 - 393。
- 43.
张建军,张建军,张建军,张建军,等。植物细胞解剖囊泡转运的实验研究。J Microsc-Oxford。[j] .中国科学:地球科学,2009(4):559 - 563。10.1111 / j.0022-2720.2004.01348.x。
- 44.
Hamann T, Mayer U, Jurgens G:生长素不敏感突变对拟南芥胚初生根形成和根底格局的影响。发展,1999,26(6):1387-1395。
- 45.
马丽,辛华,曲丽,赵军,杨丽,赵鹏,孙敏:转录谱分析表明,合子分裂导致烟草根底细胞特异性转录物分布不均匀。科学通报,2011,6:e15971-10.1371/journal.pone.0015971。
- 46.
赵洁,辛华,曲丽,宁洁,彭霞,闫涛,马丽,李生,孙明明:烟草受精卵受精后转录谱的动态变化与新生转录和母体消除有关,标志着母体向合子转变的开始。植物学报,2011,35(5):391 - 391。10.1111 / j.1365 - 313 x.2010.04403.x。
- 47.
张建军,张建军,张建军,等。芥蓝中半乳糖蛋白(JIM4)表位的表达及其在体细胞胚发育中的应用。农业科学进展,1997,18(2):559 - 562。
- 48.
李建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军。植物学报,1996,32(2):357 - 357。
- 49.
张建军,张建军,张建军,等。β-葡萄糖基Yariv试剂对菊石体细胞胚发育的影响。植物学报,2000,21(3):359 - 364。10.1007 / s004250000299。
- 50.
McCabe PF, Valentine TA, Forsberg LS, Pennell RI:来自细胞壁的细胞可溶性信号建立了胡萝卜发育途径。植物学报,1997,9:2225-2241。
- 51.
唐小春,何玉琴,王艳,孙明明:阿拉伯半乳聚糖蛋白与Yariv试剂结合在甘蓝型油菜小孢子胚胎发生、细胞发育命运和维持中的作用。Topas。[J] .中国生物医学工程学报,2006,27(5):639- 650。10.1093 / jxb / erl027。
- 52.
植物细胞壁果胶多糖的结构、功能和生物合成。碳水化合物学报,2009,34(4):1879- 1890。10.1016 / j.carres.2009.05.021。
- 53.
张建军,张建军,张建军,等。果胶甲基酯酶的研究进展。植物科学进展,2007,12:267-277。10.1016 / j.tplants.2007.04.001。
- 54.
Bosch M, Cheung AY, Hepler PK:果胶甲基酯酶:花粉管生长的调节因子。植物生理学报,2009,35(2):444 - 444。10.1104 / pp.105.059865。
- 55.
李建军,李建军,李建军,等。果胶中低聚半乳糖醛酸苷的合成与表达。植物化学学报,2001,35(5):929-967。10.1016 / s0031 - 9422(01) 00113 - 3。
- 56.
Belanger KD, Quatrano RS: Fucus distichus受精卵不对称尖端生长和细胞板形成过程中膜循环发生。原生体,2002,12:24-37。10.1007 / BF01279344。
- 57.
De Smet I, Beeckman T:陆地植物和藻类的不对称细胞分裂:分化的驱动力。中国生物医学工程学报,2011,31(2):387 - 398。10.1038 / nrm3064。
- 58.
哈德利R,哈伊尔WE, Kropf DL:膜系统极化是岩藻样受精卵发育的早期事件。植物生态学报,2006,26(6):559 - 561。
- 59.
萨达尔,杨军,肖华特,等。阿拉伯半乳聚糖蛋白与亮黄2型烟草细胞皮层微管和f -肌动蛋白的相互作用。植物生理学报,2006,32(2):669 - 679。10.1104 / pp.106.088716。
- 60.
烟草BY-2细胞中糖基磷脂酰肌醇(GPI)锚定质膜阿拉伯半乳聚糖蛋白(AGPs)、微管和f -肌动蛋白之间相互作用的细胞网络模型。植物信号学报,2007,28(2):829 - 829。10.4161 / psb.2.1.3599。
- 61.
杨建军,张建军,张建军,张建军。离子通量、生长素对烟草细胞伸长生长的诱导作用。[J] .中国生物医学工程学报,2009,32(2):561 - 567。
- 62.
Barr FA, Gruneberg U:《细胞分裂:放置和最终切割》。细胞学报,2007,31(1):847-860。10.1016 / j.cell.2007.11.011。
- 63.
李建军,李建军,李建军,等。细胞骨架-质膜-细胞壁连续体研究进展。重新访问新兴链接。植物生理学报,2009,33(4):482-491。10.1104 / pp.103.027250。
- 64.
Kohorn BD:质膜与细胞壁的接触。植物生理学报,2000,24(4):31-38。10.1104 / pp.124.1.31。
- 65.
Kohorn BD: WAKs;细胞壁相关激酶。中国生物医学工程学报,2001,13(3):529-533。10.1016 / s0955 - 0674(00) 00247 - 7。
- 66.
李军,于敏,耿立林,赵军:拟南芥小孢子发育过程中fasicillin样阿拉伯半乳糖蛋白基因FLA3的表达。植物科学学报,2010,34(4):482-497。10.1111 / j.1365 - 313 x.2010.04344.x。
- 67.
孙伟,赵志东,haare MC, Kieliszewski MJ, Showalter AM:一种质膜结合、糖基磷脂酰肌醇锚定的阿拉伯半乳糖蛋白。植物生理学报,2004,20(2):319-327。10.1111 / j.0031-9317.2004.0236.x。
- 68.
李建军,李建军,李建军,李建军,李建军。纤维素合酶基因在拟南芥胚胎发育中的应用。植物生理学报,2002,30(3):893 - 893。10.1104 / pp.102.010603。
致谢
我们感谢J. P. Knox博士(英国利兹大学植物科学中心)慷慨捐赠的抗体。国家自然科学基金项目(30970277,31170171)、教育部重点资助项目(311026)、教育部博士点专项基金项目(20090141110035)资助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
我进行了实验,参与了研究的设计,并起草了手稿。JZ构思了这项研究,并参与了它的设计,并帮助起草了手稿。两位作者都阅读并批准了最终的手稿。
权利和权限
本文由BioMed Central Ltd.授权发表。这是一篇基于知识共享署名许可(http://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
于明,赵军。β -葡萄糖基Yariv试剂诱导烟草受精卵和原胚细胞的细胞学变化提示阿拉伯半乳聚糖蛋白参与细胞分裂和细胞板形成。BMC Plant Biol12,126(2012)。https://doi.org/10.1186/1471-2229-12-126
收到了:
接受:
发表:
关键字
- 阿拉伯半乳聚糖蛋白
- 烟草l
- β-GlcY试剂
- 受精卵
- 原胚
- 细胞壁