摘要
背景
茉莉酸(Ja)是植物防御反应中具有良好表征的信号分子。然而,其与内生真菌诱导的次生代谢产物产生中的其他信号分子的关系很大程度上是未知的。Atractylode Lankea.(Asteraceae)是一种传统的中药植物,生产抗微生物挥发性油。我们孵化的植物A. Lankea.与真菌Gilmaniellasp。AL12。研究JA如何与挥发油生产中的其他信号分子相互作用。
结果
真菌接种增加了JA一代和挥发性的油积累。为了研究挥发性油生产是否需要JA,用JA抑制剂布洛芬(IBU)和Nordihydoguaieteratic酸处理植株。抑制剂抑制了JA和挥发油生产,但真菌接种仍然可以诱导挥发油。用一氧化氮(NO) - 特异性清除剂2-(4-羧基苯基)-4,4,5,5-四甲基咪唑啉-1-氧基-3-氧化钾盐(CPTIO)进一步处理小植物。2O.2抑制二苯基碘鎓(DPI)和过氧化氢酶(CAT),以及水杨酸(SA)生物合成抑制剂PAPLOBUTRAZOL和2-氨基茚-2-膦酸。随着真菌接种,IBU没有抑制生产,CPTIO显着抑制了JA,表明JA可以作为NO途径的下游信号。外源性H.2O.2可以扭转CPTIO对JA的抑制作用,表明无菌通过H介导JA诱导2O.2- 依赖途径。用真菌接种,h2O.2清除剂DPI/CAT能抑制JA的生成,而IBU不能抑制H的生成2O.2生产,暗示其中2O.2直接介导的JA一代。最后,当SA生产受到抑制时,JA一代得到了增强,反之亦然。
结论
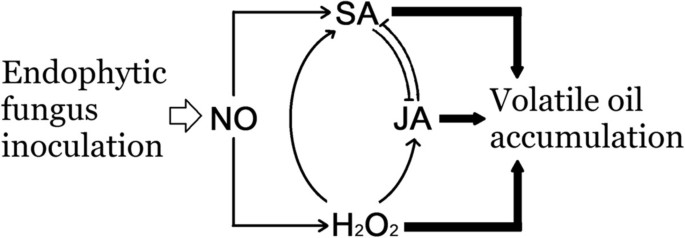
茉莉酸作为下游信号分子,在NO - 和H中2O.2介导的内生真菌引起的挥发油积累,并与SA信号通路具有互补的相互作用。
背景
Atractylode Lankea.,是一种传统的中国药用植物,属菊科[1那2].来自的挥发油A. Lankea.表现出抗菌活动。这些油包含活性次级代谢物,包括特征组分Atractylone,β-eudesmol,Hinesol和Atractylodin [3.].次级代谢物,例如萜烯,黄酮类化合物和生物碱,被认为参与植物反应对许多生物和非生物应激[4.-6.].另一个植物防御响应是激活多个信令事件[7.那8.].例如,植物的茉莉酸(JA)通过病原体感染和Elicitor治疗诱导生物合成[9.]和水杨酸(SA)参与激活不同的无抗外防相关基因[10.],例如编码致病相关(PR)蛋白的那些[11.].此外,许多信号分子已被揭示参与次级代谢[12.-14.].
内生菌可以与寄主共存,并有很大的潜力影响寄主的代谢[15.];它们对药用成分的植物积累的影响最近受到了很多关注[16.那17.].与病原体不同,内生真菌不会引起宿主的强敏感反应。但长期殖民化可以诱导主持人的各种代谢物[17.那18.].内生真菌 - 宿主相互作用如何影响植物次生代谢物的积累是一种有趣的问题。
茉莉酸是一种特征的植物信号传导分子,介导植物防御反应[19.]通过响应微生物感染和Elicitor治疗方法[20.].kunkel.等[21.]发现真菌引发器引起了JA生产,次生代谢物生物合成基因表达的快速增加,以及许多植物中的次生代谢产物积累。外源JA申请增强次生代谢物生物合成途径的基因表达,而真菌引发诱导的次生代谢物积累可以通过JA合成抑制剂取消[13.].大多数植物防御反应受到许多信号分子的调节,并且在植物细胞信号转导网络中具有“串扰”是重要的[21.].越来越多的研究表明,这些信号不完全独立运行;相反,它们受到各种其他信号的幅度或幅度[22.].
据报道,据报道了SA-和JA介导的信号传导途径之间的相互作用以增强植物防御相关基因的表达,但在介质植物次级代谢物积累中,JA和多信号传导途径(一氧化氮,过氧化氢和SA)之间的相互作用研究很少见。在这项工作中,我们报告说JA充当一氧化氮(NO) - 和过氧化氢(H.)的下游信号(H.2O.2)介导的挥发油积累A. Lankea.内生真菌诱导的植物Gilmaniellasp。AL12。此外,我们揭示了JA和SA之间的不寻常的互补关系,介导药用植物次生代谢物的生物合成。
方法
植物材料及处理
营业文化Atractylode Lankea.(在江苏省武山收集,中国)是根据Wang等人建立的。[22.].外植体的表面灭菌并在MS培养基中生长[23.]补充有0.3mg / L萘酸(NAA),2.0mg / L 6-苄基腺嘌呤,30g / L蔗糖和150ml Erlenmeyer烧瓶中的10%琼脂。生根培养基(1/2 ms)含有0.25mg / L Naa,30g / L蔗糖和10%琼脂。在高压灭菌之前将所有培养基调节至6.0的pH值。培养物保持在生长室(25/18℃/夜/夜,光强度为3400升/米2光周期12 h),每四周传代一次。所有处理均采用30日龄生根苗。
用作特定清除剂或抑制剂的试剂,包括布洛芬(IBU),Nordihydroguaiaretic acid酸(NODGA),2-(4-羧基苯基)-4,5,5-四甲基咪唑啉-1-氧基-3-氧化钾盐(CPTIO),从Sigma-Aldrich(圣路易斯,Mo,Mo,USA)购买,Paclobutrazol(PAC),二苯基碘鎓(DPI)和2-氨基茚 - 2-膦酸(AIP)。在使用前使用0.22μm的微孔膜过滤所有外源信号分子和抑制剂。除非另有说明,否则在施用信号分子或真菌接种之前施用抑制剂1d。
真菌培养和治疗
内生真菌Al12(Gilmaniellasp。)被隔离A. Lankea,在马铃薯右旋糖琼脂上培养,并在28℃温育五天[24.].使用5mm Al12菌丝块接种了三十天的植物。使用相同尺寸的马铃薯葡萄糖琼脂作为对照。所有治疗均在无菌环境中进行,并复制至少三次以检查再现性。
测量H2O.2也没有
与有或没有抑制剂的真菌菌丝块孵育了三十天的植物,以后收获18d以确定不含或H.2O.2.抑制剂为1.25mmol l-1CPTIO,5.25 mkat l-1CAT或3 mmol L-1DPI。
H的产生2O.2经过A. Lankea.根据Schwacke和Hager的说法,用铁氰化物催化氧化鲁米诺的化学发光法测定了幼苗[25.),与修改。叶片样品(1 g)与5 ml双蒸馏水研磨。匀浆13000 g离心10 min,上清液100 μL、鲁米诺(5-氨基-2,3-二氢- 1,4 -酞嗪二酮)50 μL和800 μL磷酸盐缓冲生理盐水混合在比色皿中。反应起始条件为100 μL K3.[Fe (CN)6..比较独立的实验,我们使用h2O.2作为内部标准。五十微升的h2O.2(1 μM,新鲜制备)加入到含750 μL磷酸钾缓冲液的检测混合物中。H的一个单位2O.2被定义为由1μmH的内标引起的化学发光2O.2每克鲜重。
根据制造商的说明,使用无检测套件(南京江城生物工程ISTER。,南京南京江城生物工程INST。将叶样品(1g)用5ml 40mM 4-(2-羟乙基)-1-哌嗪乙烯磺酸(pH7.2)进行研磨,匀浆以14,000g离心10分钟。上清液用于无测定。一个单位的单位被定义为由每克鲜重的1μm的内标引起的吸光度变化。
为每个时间点测定至少15种植株,并一式三份进行所有处理。
测量SA
将30日龄的植株与添加或不添加抑制剂的真菌菌丝盘孵育,18 d后收获用于SA的测定。抑制剂为1mmol L-1PAC或2.5 mmol l-1AIP。
萃取水杨酸,然后提取verberne等人的方法。[26.,只做了一些修改。5克整苗用液氮研磨,用2ml甲醇超声提取。14000 g离心5min后,旋转蒸发上清,残液用250 μl 5%三氯乙酸重悬。用800 μl环己烷乙酸酯(1:1 v/v)萃取。最后将有机相旋转蒸发至干燥,用600 μl高效液相流动相(甲醇:2%乙酸:H2o,50:40:10,v:v:v),并用0.22μm微孔膜过滤,用于测定。
采用反相色谱柱(Hedera Packing Material Lichrospher 5- c18, 4.6 × 250 mm, 5 μm, Bonna-Agela Technologies, Wilmington, DE, USA)对样品进行定量。流动相流速为1ml min-1.在25℃下在217nm处检测水杨酸[14.].
挥发油和JA的提取和测定
三十天的幼儿植物Atractylode Lankea.用5毫米菌丝盘或PDA盘(对照)孵育。抑制剂(0.1 mmol L .-1在真菌接种前1 d加入IBU或NDGA进行JA测定。
从整个植物中提取挥发性油A. Lankea.根据张等人的说法,包括叶和根茎(叶片中的叶片0.8-1.6%,2.2-3.4%)。[27.].用无水硫酸钠干燥挥发性油并在4℃下储存在暗玻璃瓶中,用于气相色谱仪(GC)分析。
juergen等人之后。[28.[Ja是通过在液氮中冷冻的植物材料(1g)提取,并用H萃取2O:丙酮(30:70,V:V)。样品在-21℃下储存在-21℃的暗玻璃瓶中,用于GC分析。
气相色谱测定是使用1890系列气相色谱(惠普,Palo Alto, CA)配备火焰电离检测器进行的。女士DB-5 (30 m×0.25毫米×0.25μm)列(美国安捷伦,圣克拉拉,CA)是使用以下温度程序:列举行60°C注射后1分钟,10°C /分钟增加到190°C,关押了2分钟,增加了5°C /分钟到210°C,关押了2分钟,10°C /分钟增加到220°C,和8分钟。以氮气为载体,流速为4ml /min。采用Fang et al. [29.];它们的保留时间分别为14.57,15.24,16.21和22.18分钟。
实时定量RT-PCR分析
总RNA从叶子中提取,Dong和Beer描述了[30.].第一链cDNA由1μg总RNA合成(Primescript RT试剂盒,Takara,Dian,中国)。使用DNA发动机OPTICON 2实时PCR检测系统(BIO-RAD,HERCULES,CA,USA)和SYBR绿色探针(SYBR PREMIX EXQ系统,TAKARA)进行实时QPCR。组成型表达的基因EF1α用作内部阳性对照。用于扩增EF1α的基因特异性引物是5'-CaggctGattGtGTGTTTTTA-3'和5'-TGTGGCATCATCTTGT-3'(241bp产品)和AL.HMGR是5'-GGTGAGAAAGGTCCTGAAA-3'和5'-CATGGTAACGGAGATATGAA-3'(154 BP)。Genbank登录号AL.HMGR和EF1α基因分别为EF090602.1和X97131。
热循环器程序如下:95°C 90 s;95°C时30 s, 57°C时30 s, 72°C时30 s,共40个循环;72°C下5分钟。为了标准化数据,将绝对转录水平的比率AL.针对每种处理的每个样品计算EF1α绝对转录水平的HMGR基因。
统计分析
使用Microsoft Excel(Redmond,Wa,USA)编译数据。值表示为每种治疗的三种重复的平均值±SD。学生T.-检验、单因素方差分析和邓肯多范围检验以确定显著性差异(SPSS。13.0, SPSS Inc.,芝加哥,伊利诺伊州,美国)。
结果
JA在真菌诱导的挥发油积累中的依赖性
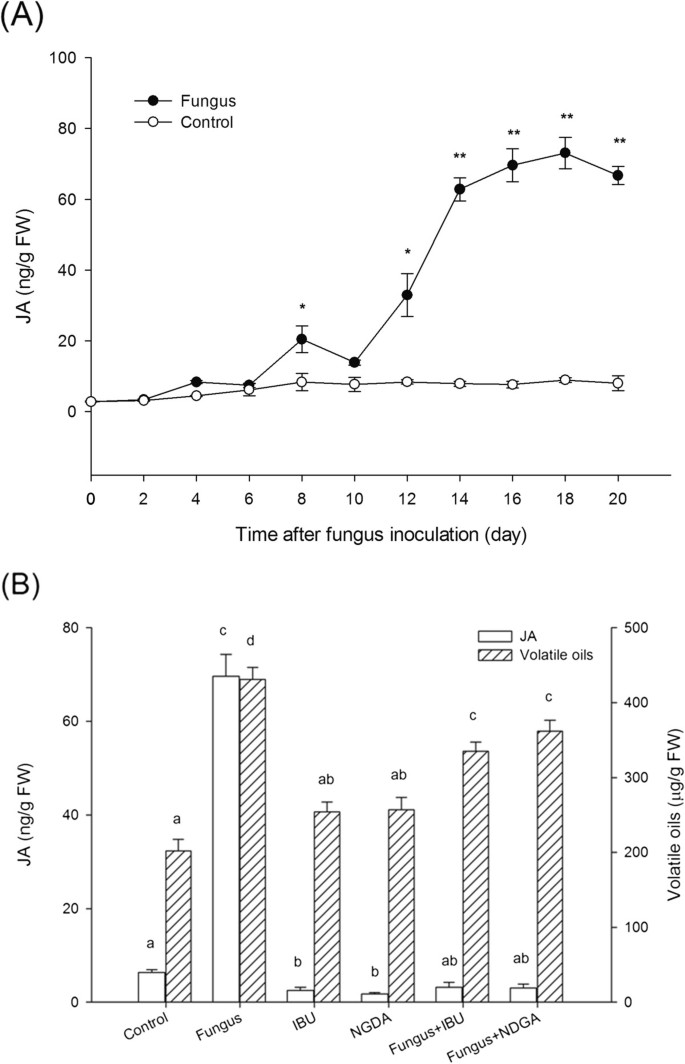
在内生真菌接种后,植物的JA含量显着增加(图 1a),表明真菌可以在小植物中触发Ja生物合成。同时,挥发性油总量显着增加(表 1)。IBU和NDGA均为十八烷肽途径的抑制剂,其合成JA,通常在植物系统中应用于JA特异性抑制剂[13.].为了探讨JA是否参与真菌诱导的挥发油积累,应用IBU和NDGA;如图所示 1B,这两种抑制剂不仅抑制真菌诱导的JA生成,而且也抑制真菌诱导的挥发油生成。结果表明,茉莉酸在真菌诱导的挥发油合成中起重要作用A. Lankea.plantlets。但是,挥发油在A. Lankea.与对照相比,用真菌和JA抑制剂治疗的植物仍然可以积累,即使JA生成低于对照(图 1B),这意味着真菌诱导的挥发油合成并不仅仅依赖于JA信号通路。
JA充当了NO和H的下游信号2O.2途径
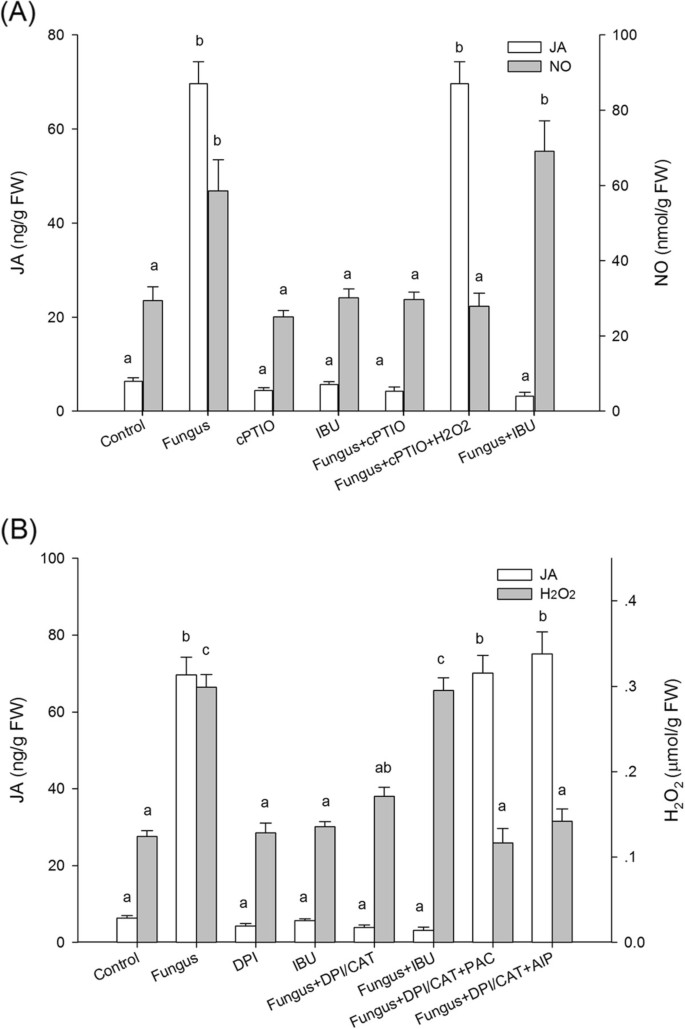
上一篇结果表明,JA不是真菌诱导的挥发性油合成中涉及的唯一信号通路;不,H.2O.2,也是已知Sa介绍此过程A. Lankea.plantlets [22.].调查JA和其中一个或多个途径之间的可能关系,A. Lankea.将植物用无特定的清除剂CPTIO处理,膜NADPH氧化酶抑制剂DPI /猫,SA抑制剂PAC / AIP,IBU和真菌接种。No Scavenger CPTIO可以抑制接种植物中的JA产量,但IBU无法抑制没有生产(图 2a),显示JA可以充当NO的下游信号。外源性H.2O.2可以逆转JA抑制,暗示JA是由H虽然的介导2O.2内生真菌诱导的挥发油积累。另外,H2O.2抑制剂DPI /猫可以抑制JA生产,但IBU无法抑制H.2O.2接种生产(图2一种)。JA对H的单向依赖2O.2确认H.2O.2是JA和NO之间的中介因素。
JA和NO或H之间的相互作用2O.2内生真菌引起的信号传导途径。三十天的幼儿植物Atractylode Lankea.用5毫米菌丝盘(含或不含抑制剂)孵育,18 d后收获,用于测定JA和NO或H2O.2浓度。(一种)JA与途径之间的相互作用。抑制剂为1.25mmol l-1cPTIO, 0.1 mmol L-1IBU,或15毫升L.-1H2O.2.(b)JA和H之间的相互作用2O.2.抑制剂为3 mmol L-1DPI, 5.25 mKat L-1CAT, 0.1 mmol L-1IBU,1毫升L.-1PAC,或2.5 mmol l-1AIP。在真菌接种之前,将所有抑制剂加入1天。值是三个独立实验的手段。具有不同小写字母的酒吧具有显着差异(单向ANOVA,Duncan的多个范围测试,P <0.05)。
Paclobutrazol是一种有效的SA生物合成相关的苯甲酸羟化酶(BA2H)抑制剂[31.]还抑制胃肠杆菌蛋白生物合成[32.].因此,我们也使用了特定的SA生物合成相关苯丙氨酸氨解酶(PAL)抑制剂AIP [33.那34.],确认SA生成被抑制。有趣的是,PAC和AIP可以通过与真菌接种的DPI /猫抑制JA(图 2B).这一结果表明,SA和JA信号通路在内生植物诱导挥发油积累过程中密切相关A. Lankea.plantlets。
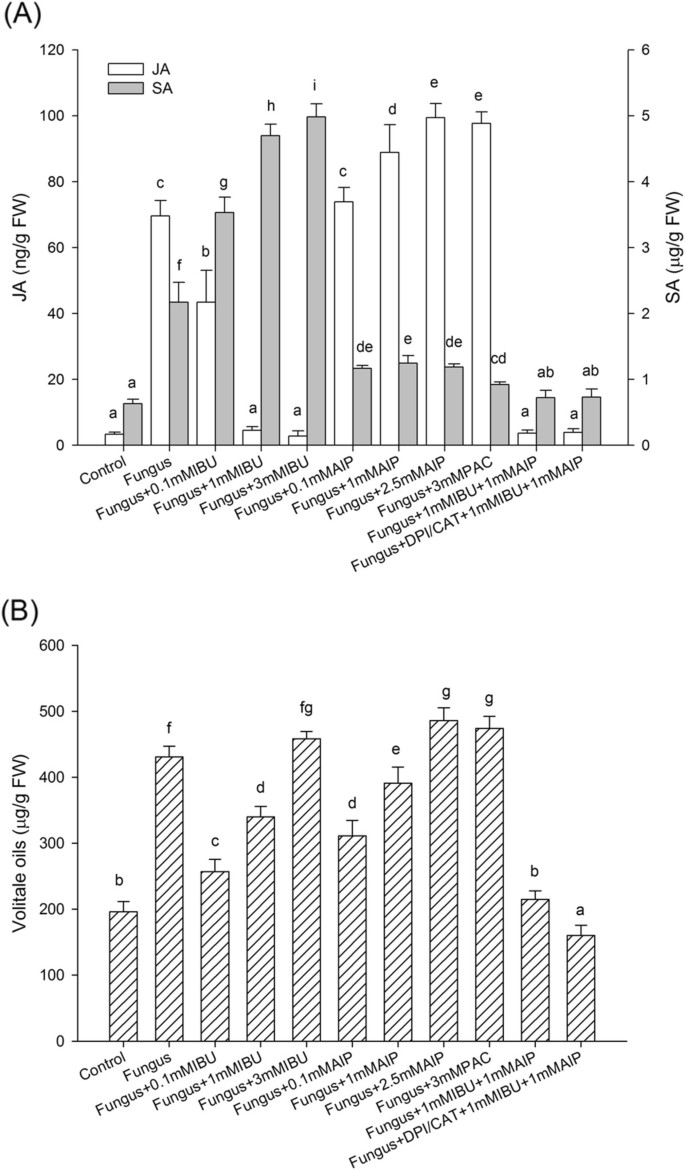
JA和SA在真菌诱导挥发油积累中的互补作用
为了进一步研究JA和SA之间的关系,施加JA抑制剂IBU和SA抑制剂PAC和AIP的梯度浓度。如图所示 3.,随着IBU浓度的增加,血液诱导的小植物的JA水平逐渐降低,但也增强了SA积累和挥发性油含量,尽管量不超过单独用真菌接种获得的量。类似地,植物中的SA水平抑制0.1,1和2.5mmol L.-1alip和3 mmol l-1PAC,而JA显着增强(图 3.一种)。增强了2.5 mmol L的挥发性油积累-1AIP和3 mmol l-1PAC(图 3.b)。结果表明,JA可以与SA互补相互作用,以介导真菌内体诱导的挥发性油积累。然而,组合IBU和PACLOBUTRAZOL无法完全抑制挥发性油合成。我们加了h2O.2-Nibhibitor DPI /猫到IBU和Paclobutrazol,这将挥发性 - 油积累降低到控制水平。结果表明h2O.2, SA和JA可能同时在真菌诱导的挥发油合成中起作用A. Lankea.plantlets。
真菌诱导的Sesquiterpenoid生产对JA生产的依赖性
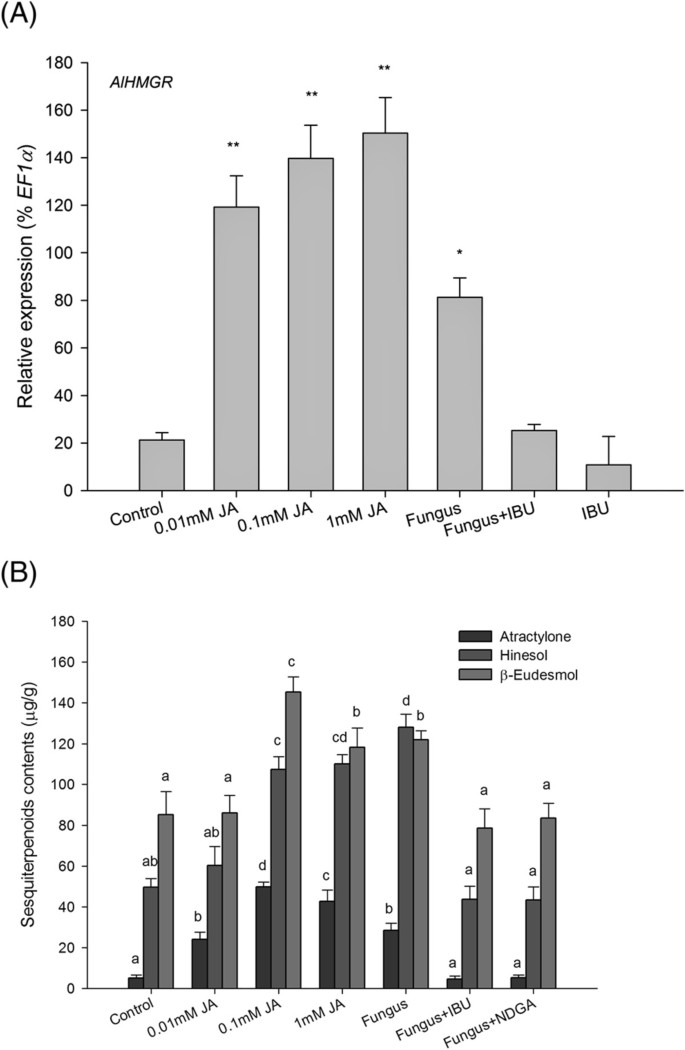
酶3-羟基-3-甲基戊芳基-CoA还原酶(HMGR)催化HMG-COA至甲羟戊酯的转化,这是植物萜类生物合成途径的关键步骤[35.那36.].我们进一步研究了JA对HMGR基因表达的可能调控作用。结果表明,外源JA能强烈刺激HMGR基因表达(图4.A).三倍半萜成分A. Lankea.挥发性油,atractylone,β-eudesmol和Hinesol全部由JA诱导并被IBU与真菌接种(图 4.b)。
HMGR基因的表达水平与JA信号通路对JA信号通路的累积响应。(一种)EF1α和HMGR基因的表达水平响应JA通过实时QPCR和半QPCR分析确定。三十天的幼儿植物Atractylode Lankea.孵育5 mm mycelia磁盘;0.01,0.1或1 mmol l-1贾;或1 mmol l-1IBU和收获的18d以后用于总RNA提取和PCR分析。值是平均值±SE(n = 3)。星号表示显着差异(T.-测试;*,P <0.05;**,P <0.01)。(b)JA对SesquiterPenoid积累的影响。18 d后收获小植物,并评估atractylone,β-eudesmol和脑醇含量。值是平均值±SE(n = 3)。具有不同小写字母的酒吧具有显着差异(单向ANOVA,Duncan的多个范围测试,P <0.05)。
讨论
次级代谢物积累是对生物或非生物环境应激的常见植物反应,次要信使广泛用于介导植物次生代谢物的积累。这项工作表明真菌Gilmaniellasp。可以诱导JA生产并促进宿主植物中挥发性油的积累。作为一个重要的信号分子,JA在对内生真菌调节挥发油的诱导方面发挥关键作用。特异性抑制剂IBU和NDGA可以阻断JA信号通路,并减少相关代谢物的积累。我们以前的研究表明,没有,H2O.2,SA充当信号分子,以介导悬浮细胞中挥发性油的积累A. Lankea.由内生真菌引发引起的[22.].因此,进一步研究了JA和其他已知的信号传导途径在次级代谢物积累中的可能关系。
不同信号转导途径之间的交叉对话,而不是单一信号途径,介导了植物防御反应中的基因表达和次生代谢产物的产生[37.那38.].据报道,已介绍过氧化氢成为Mung Ban Plantlets中没有生产的可能上游信号[39.].一氧化氮也可以介导真菌引发诱导的紫杉醇生物合成Taxus chinensis.通过活性氧信号途径诱导悬浮细胞,刺激烟草细胞中SA的积累,并通过SA独立途径诱导PAL的表达[31.那40那41.].此外,我们以前的工作表明,没有介导通过SA和H诱导的真菌诱导的挥发油积累2O.2- 依赖途径。过氧化氢可以增强SA生产,但不充当上游信号分子[22.].目前的作品表明,内生真菌诱导的JA由H直接介导2O.2并用作H的下游信号分子2O.2没有途径。
在我们的研究中,JA与SA信号通路进行了不寻常的互补互动。茉莉酸通常假设以对SA信号通路和SA依赖性基因的表达进行拮抗作用[42.那43.].其他研究表明,在各种药理学和遗传实验中,SA是JA信号通路和JA依赖的防御基因表达的有效抑制因子[44.那45.].此外,JA和SA都是植物防御反应中的重要信号传导分子,例如激活不同的防御相关基因和系统性获得性的发展[21.那46.].我们的研究结果表明,当抑制剂IBU抑制JA生物合成时,增强了SA的积累,以补偿真菌引发的挥发油生产中的JA介质功能的丧失。类似地,当SA累积受损时,JA生产/信号可以替代SA途径。
结论
草药的价值主要取决于有效药物成分的积累;低产量是生产高质量草药的主要挑战。在这项工作中,我们证明了JA作为NO和H的下游信号分子2O.2介导的挥发性油积累由内生真菌引起的,与SA信号通路具有互补的相互作用,并阐明了JA随着增加的倍二萜组成部分而显着刺激HmgR基因表达。这些信息将有助于更好地了解真菌内心细胞和宿主植物之间的关系。此外,它还表明了提高药草质量的策略。
参考
- 1。
段JA,王丽,钱舍,SU SL,唐yp:一种新的细胞毒性戊酰化二氢脲呋喃衍生物和来自Atractylode Lankea DC的根茎的其他化学成分。Arch Pharm Res。2008,31(8):965-969。10.1007 / s12272-001-1252-z。
- 2。
袁y,刘yj,黄lq,崔gh,富gf:土壤酸度升高了一些植物激素和β-eudesmol含量在atractylode lancea的根部。Russ J植物理体。2009,56(1):133-137。10.1134 / s1021443709010191。
- 3.
王Y,戴西卡,陈Y:来自Atractylodes Lancea挥发油的抗菌活性,对三种内生真菌和七种外源性真菌。中文J Appl Ecol。2009,20(11):2778-2784。用中文(表达
- 4.
Rodriguez RJ,White JJF,Arnold Ae,Redman Rs:Fungal Endophytes:多样性和功能作用。新植物。2009,182(2):314-330。10.1111 / J.1469-8137.2009.02773.x。
- 5.
Mucciarelli M,CamuSSO W,Maffei M,Panicco P,Bicchi C:无挥发性Terpenoids Needophyte无感染薄荷(Mentha Piperita L.):分解的化学分区。Microb Ecol。2007,54(4):685-696。10.1007 / S00248-007-9227-0。
- 6.
王米,张飞,黄lf,尹Xp,李赫,王qy等:黄酮类化合物生物催化和生物转化的新进展。J MED植物RES。2010,4(10):847-856。
- 7.
植物免疫反应中的信号转导。生物化学的发展趋势。2000,25(2): 79-82。10.1016 / s0968 - 0004(99) 01532 - 7。
- 8.
Hahlbrock K,Bednarek P,Ciolkowski I,Hamberger B,Leise A,Liedgens H,Logemann E,Nurnberger T,Schmelze e,Somssich Ie,Tan JW:植物/病原体相互作用期间的非自我识别,转录重编程和次生代谢物积累.美国国家科学院学报。2003,100(4):14569-14576。
- 9.
Ward Er,Uknes SJ,Williams SC,Dincher SS,Wiederhold DL,Alexander DC,AHL-Goy P,MétrauxJP,Ryals JA:协调基因活动,以响应诱导系统性获得性阻力的代理。植物细胞。1991,3(10):1085-1094。
- 10。
Kazan K,Landers JM:JasMonate Signaling:朝向综合视图。植物理性。2008,146(4):1459-1468。10.1104 / pp.107.115717。
- 11.
Van LC, Van EA:发病相关蛋白家族及其活性,PR-1型蛋白比较分析。杂志。Molec。植物病理学。1999,55(2):85-97。10.1006 / pmpp.1999.0213。
- 12.
袁Y,李C,Hu Z:来自Fusarium oxysprum的寡糖诱导的氧化突发和紫杉醇生产中的氧化爆发和紫杉醇产量的信号转导途径。酶microb Technol。2001,29(7):372-379。10.1016 / s0141-0229(01)00406-9。
- 13。
Nojiri H, Sugimori M, Yamane H, Nishimura Y, Yamada A, Shibuya N, Kodama O, Murofushi N, Omori T:茉莉酸在悬浮培养水稻细胞诱导植物抗毒素生产中的作用。植物营养与肥料学报。1996,11(2):457 - 461。
- 14。
高FK,任志刚,戴传中:一氧化氮、水杨酸和活性氧对内生真菌诱导的北京大戟悬浮细胞中异大戟素积累的信号转导作用。植物营养学报。2012,:-10.1007/s00344-012-9258-8。
- 15.
Suryanarayanana Ts,Thirunavukkarasub N,Govindarajulub MB,Sassec F,Jansend R,Muralia TS:真菌内心和生物勘探。真菌生物学审查。2009,23(2):9-19。10.1016 / J.FBR.2009.07.001。
- 16.
王LW,徐博,王JY,SU ZZ,林FC,张CL,ZHBICEK CP:来自Phoma物种的生物活性代谢物,中药植物中药菌的内心真菌。应用微生物和细胞生理学。2012,93(3):1231-1239。
- 17.
Saunders M,Kohn LM:通过宿主防御化合物改变真菌内体群落组装的证据。新植物。2009,182(1):229-238。10.1111 / J.1469-8137.2008.02746.x。
- 18.
李永春,陶文耀:产紫杉醇内生真菌与寄主(红豆杉属)在紫杉醇积累过程中的相互作用。细胞生物学杂志。2009,33(1):106-112。10.1016 / j.cellbi.2008.10.007。
- 19.
Halim Va,Vess A,Scheel D,Rosahl S:水杨酸和茉莉酸在病原体防御中的作用。植物BIOL。2006,8(2):307-313。
- 20。
Zhao J,Davis Lc,Verpoorte R:Elicitor信号转导,导致植物次级代谢物的生产。Biotechnol Adv。2005,23(4):283-333。10.1016 / J.BioteChAdv.2005.01.003。
- 21。
Kunkel BN,Brooks DM:在病原体防御中信号传导途径之间的交叉谈话。CurrOp植物BIOL。2002,5(4):325-331。10.1016 / s1369-5266(02)00275-3。
- 22。
王Y,Dai CC,Zhao Yw,Peng Y:真菌内心诱导的Atractylode Lankea Plantlets的挥发性油积聚通过一氧化氮,水杨酸和过氧化氢介导。流程生物化学。2011,46(3):730-735。10.1016 / J.Procbio.2010.11.020。
- 23。
利用烟草组织培养快速生长和生物测定的新方法。植物生理学报。1962,15(3):473-479。10.1111 / j.1399-3054.1962.tb08052.x。
- 24。
Chen JX,Dai CC,Li X,Tian LS,谢H:内心真菌筛选从andacty Lancea和接种到宿主流域。桂花。2008,28(2):256-260。
- 25。
Schwacke R,Hanger A:真菌elicitors从依赖于Ca2 +和蛋白质激酶活性的培养的云杉细胞诱导瞬态释放活性氧。Planta。1992,187(1):136-141。
- 26。
Verberne MC, Brouwer N, Delbianco F, Linthorst HJM, Bol HF, Verpoorte R:烟叶物质中挥发性化合物水杨酸的提取方法。植物化学学报,2002,13(1):45-50。10.1002 / pca.615。
- 27。
张B,戴CC,方富,陈爵士:三种物种内生真菌对AtractyLodes Lankea生长的影响及其精油组合物。Chin J ECOL。2009,28:704-709。用中文(表达
- 28.
Juergen E,Eric As,Hans Ta,Yasmin JC,Juan H,James HT:通过气相萃取和气相色谱 - 化学电离质谱法同时定量饮用植物中的水杨酸。肛门生物化学。2003,312(2):242-250。10.1016 / s0003-2697(02)00466-9。
- 29.
方F,戴中科,张B,Liang QL:建立悬浮细胞系Atractylode Lancea,内生真菌elictors对其精油积累的影响。下巴贸易草药。2009,40(3):452-455。用中文(表达
- 30。
Dong H,啤酒SV:通过激活新的信号转导途径,核黄素诱导植物中的抗病性。植物病理学。2000,90(8):801-811。10.1094 / phyto.2000.90.8.801。
- 31。
Leon J,Lawton Ma,Raskin L:过氧化氢刺激烟草中的水杨酸生物合成。植物理性。1995,108(4):1637-1678。
- 32。
陈志强,陈志强,陈志强,等。赤霉素生物合成抑制剂多效唑对苹果幼苗生长的影响。植物营养与肥料学报。1998,18(1):1- 11。10.1104 / pp.82.1.11。
- 33。
Zon J,Amrhein N:苯丙氨酸氨酶的抑制剂:2-氨基茚-2-膦酸和相关化合物。EUR J Org Chem。1992,6:625-628。
- 34。
Willibald S,Naoko K,Dieter S:BETAXANTHIN生物合成中的决定性步骤是一种自发反应。植物理性。1999,119(4):1217-1232。10.1104 / pp.119.4.1217。
- 35。
3-羟基甲基戊二烯辅酶A还原酶催化的反应是植物类异戊二烯生物合成的限速步骤吗?植物营养与肥料学报。2004,19(4):437 - 442。
- 36。
HA SH,Kim JB,Hwang Ys,Lee SW:三种3-羟基-3-甲基戊齐芳基-COA还原酶基因的分子表征,包括来自胡椒(辣椒汤)的病原体诱导的HMG2。Biochimica et Biophys。acta。2003,1625(3):253-260。10.1016 / s0167-4781(02)00624-3。
- 37。
回族P,农民EE:茉莉酸盐和水杨酸盐作为防御基因表达的全局信号。CurrOp植物BIOL。1998年,1(5):404-411。10.1016 / s1369-5266(98)80264-1。
- 38。
MUR LAJ,Kenton P,Atzorn R,Miersch O,Wasternack C:水杨酸盐和茉莉酸盐信号传导之间的浓度特异性相互作用包括协同,拮抗和氧化应激导致细胞死亡。植物理性。2006,140(1):249-262。
- 39。
LUM HK,对接YKC,LO SCL:过氧化氢诱导在绿豆(PhainOlus aureus)中的一氧化氮产生的快速生产。一氧化氮 - Biol Ch。2002,6(2):205-213。10.1006 / niox.2001.0395。
- 40。
Chamnongpol S, Willekens H, Moeder W, Langebartels C, Sandermann H, Van MM, Inzé D, Van CW:转基因烟草中H2O2诱导的防御激活和抗性增强。美国国家科学院学报。[j] .地理科学进展,2019,38(6):591 - 598。10.1073 / pnas.95.10.5818。
- 41。
许明杰,董建峰,朱明明:一氧化氮通过活性氧依赖和非依赖信号通路介导真菌诱导的红豆杉悬浮细胞合成紫杉醇。科学通报。2006,51(2):1967-1975。
- 42。
Kachroo P,Shanklin J,Shah J,Whittle Ej,Klessig DF:一种脂肪酸脱盐酶调制植物中防御信号通路的激活。美国国家科学院学报。2001,98(16):9448-9453。10.1073 / pnas.151258398。
- 43。
Kloek AP,Verbsky ML,Sharma Sb,Schoelz Je,Vogel J,Klessig Df,Kunkel BN:通过两个不同的机制发生拟拟合拟南芥冠状蛋白酶敏感(线圈)突变的赋予假单胞菌的抑制。工厂J. 2001,26(5):509-522。10.1046 / J.1365-313x.2001.01050.x。
- 44。
Steven HS, Annemart K, Susanne M, Claessens C, Jerôme PK, Johan AVP, Martin JM, Antony JB, Jean-Pierre M, Rebecca B, Kemal K, Van Loon LC, Xinnian D, Corné MJP: NRP1通过细胞质中的一种新功能调节水杨酸盐和茉莉酸盐依赖的防御途径之间的交叉对话。植物学报。2003,15(3):60-770。
- 45。
李家,布拉德尔G,Palva等:Wrky70转录因子:植物防御中茉莉蛋白介导和水杨酸盐介导的信号的收敛节点。植物细胞。2004,16(2):319-331。10.1105 / TPC.016980。
- 46。
Shah J:植物防御中的水杨酸环。CurrOp植物BIOL。2003,6(4):365-371。10.1016 / s1369-5266(03)00058-x。
致谢
作者感谢中国国家自然科学基金(Grant No.31070443和30500066),并由江苏高等教育机构的优先学术计划开发资助的项目资助。
作者信息
隶属关系
通讯作者
附加信息
利益争夺
两位作者宣称他们没有相互竞争的利益。
作者的贡献
CGR设计了实验,分析了数据,并写了稿件。CCD通过CGR监督工作和解释数据。这位作者都读到并批准了最终手稿。
作者为图像提交的原始文件
权利和权限
本文在BioMed Central Ltd.的许可下发布了这是一个开放的访问文章,根据Creative Commons归因许可(http://creativeCommons.org/licenses/by/2.0.)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
任,CG。那Dai, CC. Jasmonic acid is involved in the signaling pathway for fungal endophyte-induced volatile oil accumulation ofAtractylode Lankea.plantlets。BMC植物BIOL.12,128(2012)。https://doi.org/10.1186/1471-2229-12-128
已收到:
公认:
发表:
关键词
- Atractylode Lankea.
- 内生真菌
- 挥发油
- 茉莉酸
- 草药