抽象的
背景
细胞分裂和细胞命运决策调节器官形成和植物生长发育功能。目前尚不清楚特定的专业监管网络如何与细胞周期机械操作以将干细胞标识和维持转化为细胞行为。在这项研究中,我们通过分析拍摄顶点缺陷突变体来解决这些问题,即XCM9。
结果
表型分析XCM9.突变体揭示了伴随着花卉射击的过早终止,频繁分叉射击,茎和花。显微镜观察显示拍摄顶端商品的不规则细胞组织XCM9..定位克隆揭示了XCM9.是功能等位基因的丧失CCS52A2 / FZR1.先前涉及根系发展的基因。表达分析表明CCS52A2在主动分割组织中保持更高的转录表达水平。遗传学研究表明CCS52A2基因功能与功能Wuschel.(本人) 和clavata3.(CLV3.)调控芽分生组织的发育,并与染色质重塑途径一起参与调控。此外,少XCM9.细胞表达细胞周期蛋白B1:1,显示细胞周期进展在突变体中被破坏。
结论
我们建议CCS52A2基因与分生组织基因共同调控分生组织的组织结构,并在茎尖分生组织发育过程中与染色质调节因子交叉作用。
背景
在高等植物中,绝大多数结构和器官,例如叶,茎,根和花,从未分化的细胞组后形成,称为分子。在许多种类的植物中,某些公司在整个生命中保持。根顶部商品(RAM)和拍摄顶端商品(SAM)的活动分别确定根和拍摄结构和功能。干细胞被限制在芽和根除子的中心,并且它们的增殖由来自当地环境的细胞接受的信号进行1.].它们经历了精确的受控划分,必须足够快,以补充损失为分化的细胞,但限制足以防止过度分化细胞。与干细胞相邻,SAM和RAM中的几个细胞分别形成组织中心(OC)和静止中心(QC)。这些细胞与相邻细胞坐标,以建立商品利基中的增殖和分化之间的平衡[2.].
几个共同型基因形成控制这种动态平衡的反馈网络。在拟南芥,本人编码OC中表达的转录因子,其表达促进了远端分生组织细胞作为干细胞的身份,其自身的部分特征是CLV3.表达 [3.,4.].CLV3.编码在拍摄和花卉公司的中央顶部表面中表达的肽激素,并且对于控制SAM中的中心区(CZ)的大小是必要的[5.,6.].本人和CLV3.形成反馈调节回路:CLV3充当移动间细胞间信号以负调节本人通过受体蛋白转录在OCCLV1./CLV2./CORYNE(CRN.), 尽管本人积极的调节CLV3.表达 [7.–9].类似于拍摄成分,根QC保持周围细胞的茎状状态,并防止这些细胞差异[10.].WOX5.是功能性同源物本人以QC表示[11.]和CLE40是在分化的Stele和霉菌细胞中表达的CLV3相关肽[12.,13.].像CLV3-WUS.网络在拍摄,CLE40和WOX5.形成自调节网络,其控制在根增殖和干细胞的分化[14.].
除这些重要的分生组织调控基因外,细胞在分生组织中的组织和维持也受到多种细胞周期调控基因的调控。目前还不清楚细胞周期机制是在很大程度上独立地调节分生组织,还是通过未知的机制接收分生组织模式基因的信号而起作用。细胞分裂周期蛋白CDC5、cyclin D3 (CYCD3)、HBT/CDC27B和cyclin依赖激酶A;1 (CDKA;1)、CDKB2;1和CDKB2;2已被报道是SAM和/或RAM发育所必需的[15.–19.].这些蛋白质是许多细胞周期调节剂,包括其他细胞周期,CDK,CDK抑制剂和CDC,其在四个细胞阶段和几种检查点期间精确地控制有丝分裂细胞周期,以完成DNA复制和随后的分裂。一旦需要细胞周期调节剂的结束,它们通过遍在蛋白介导的蛋白水解而降解。促进促进络合物(APC),其用作标记靶细胞周期蛋白的E3泛素连接酶以通过26秒的蛋白酶降解靶细胞周期蛋白,在细胞周期的相转变中起重要作用[20.].
一些不被认为是细胞周期调节剂类别的蛋白质的一部分的基因也有助于开发分生剂,并参与细胞周期的正常序列。其中包括mgoun 1(Mgo1.) 和筋膜1(FAS1)基因,在SAM和RAM的基本组织和/或功能中起关键作用[21.].fas1和MgO1.其特点是着迷的茎和短根[22.,23.].fas1是一个亚基拟南芥染色质组装因子-1(CAF-1),其显示在S期DNA复制叉的染色质组件的保守活性。FAS1的功能丧失改变了参与激活G2损伤检查点的基因的启动子的表观遗传标记,导致抑制有丝分裂进展[24.].MGO1与IB型拓扑异构酶同源,有报道稳定发育调控基因的表观遗传状态,并与染色质重塑途径一起影响基因表达拟南芥[25.].可能存在一种未知的机制,将分生组织调控网络与细胞周期机制结合起来,将SAM的身份和维护转化为细胞行为。这种联系的确切性质以及这两个网络之间的中介是一个重要的研究问题。
在这篇文章中,我们报道了一个新的SAM缺陷突变体的分离,XCM9.,这在我们的条件下显示了明显的分叉和过早终止的迹象。位置克隆揭示了XCM9.基因编码APC / C的活化剂,即CCS52A2。RT-PCR,启动子分析和原位杂交测定表明CCS52A2基因在测试的所有器官广泛表达,但在射击端和根尖中具有更高的表达。我们的基因研究表明CCS52A2基因功能本人和CLV3.在干细胞调节中,还与染色质重塑途径一起有助于该调节。监测CYCB1:1表达显示,细胞周期进展被扰乱XCM9..我们建议CCS52A2基因是一种调节分类组织的调解员,在SAM开发期间,与染色质调节剂的共同基因和铬蛋白调节剂一起使用的兼职基因。
结果
在突变XCM9.基因扰乱SAM开发和维护
在筛选来自MYB系列T-DNA插入线的表型突变体的同时,我们鉴定了Salk_074403中的枝条缺陷突变体偏析,从Salk T-DNA收集中[26.].这个突变体被命名XCM9..XCM9.突变体证明提前终止(图1AB)和拍摄射门的分叉(图1C(D, G)。这种提前终止在初生枝和侧序花序中很明显XCM9.在主茎上的平均平均为6.97(范围为1-14,n = 39),而9.68(范围为1-20,n = 39),其平均花序为39(范围)-46,n = 9)wt上的花朵。大多数情况下,XCM9.植株提前终止,花蕾减少,SAM衰老(图1B.).但在茎尖的一些基团,末端有花梗与单个花或两个稠合花无明显的SAM(图1EF),表明SAM完全被术语的花卉生产所消耗。末端中的那些或几种融合的花朵总是表现出较少的花器官(花瓣和萼片),并显示弯曲或迷住的柱头(图1E).在一些极端情况下,花卉山姆没有产生任何鲜花,但只终止作为一群小芽,在花发育的早期阶段被捕(图1小时,我和2A- d)。在生殖茎尖经常观察到分叉(图)1G),花(图1C)和茎(图1C).因此,只有12.8%的生殖茎尖CCS52A2-3(n = 39)被观察到分叉,我们可以推断在早期植物开发期间莲叶生素发生的更多分叉发生,因为一些人XCM9.突变体有一个以上的启动叶中心。从当地的基因表达的后续结果支持了这一点(见下文)。
除了缺陷的射击,XCM9.高度降低(图1A),茎直径(图2 e),Silique Length(图2 f)和叶子尺寸(图2 g).每种硅种子的数量XCM9.减少,但长度的种子尺寸为约1/5(448.7±23.8μm,用于WT,556.6±42.8μmXCM9., p < 0.05)和宽度(WT为252.9±26 μm, 321.9±24.1 μmXCM9.,p <0.05)。
SAM的细胞组织紊乱XCM9.
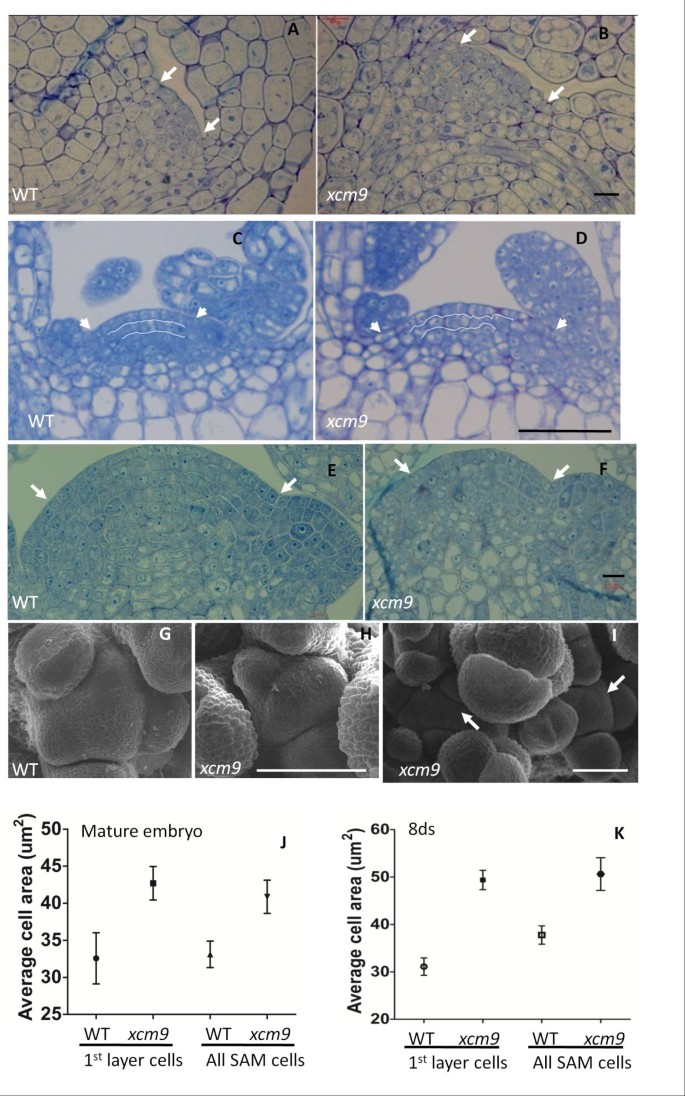
为了确定突变体中芽膜的缺陷是否在SAM的异常发育之前,我们通过半薄部分可视化突变分词的细胞形态。在8日龄的SAM的L1和L2层中扰乱了细胞组织XCM9.植物与wt中的高度有组织的细胞相比(图3 cD).成熟胚和8日龄幼苗sam的宽度XCM9.分别为41.3±0.8 μm和108.5±5.8 μm,而WT分别为34.2±0.6 μm和75.2±4.5 μm(图3- d)。此外,对突变体SAM半薄切片的细胞计数显示,两者之间没有显著差异(学生T用WT测试p = 0.15> 0.05,n = 6)。检查L1层和整个SAM中的平均细胞区域都表明,SAM的放大主要是由于产品中的单位细胞区域的增加XCM9.与wt相比突变体(图3 j,k)。我们还比较了花卉山姆XCM9.和wt。来自主要茎的开花阶段SamsXCM9.较小(图3 f,H)比WT(图3 e, G),这与胚胎和幼苗中的sam形成对比。利用扫描电子显微镜(SEM)研究了开花阶段地膜的整体结构。结果表明XCM9.初级花卉芽中的Sam小于WT,这与半薄部分的结果一致;这可能是由于花卉射击的过早终止XCM9..侧边花芽中通常可见到分叉的SAMs,每个分裂的SAMs被花原基环包围(图)3我).所有这些都表明,SAM的大小和细胞组织都与缺陷芽的表型有关XCM9..
研究了自组装膜的微观结构XCM9..(A.)及(B)在WT中,成熟胚胎的SAM切片(A.) 和XCM9.(B).条=10μm。(C)及(D),在wt(C) 和XCM9.(D).Bar = 50 μm。(E)及(F), 28日龄花序枝条的SAM切片(E) 和XCM9.(F).条=10μm。(G)(我),WT的花序射击微结构(G) 和XCM9.(H),(我)通过扫描电子显微镜(SEM)。Bar = 50 μm。花山姆在初级拍摄XCM9.(H)高于WT的更小的(G).侧面射击的花卉山姆XCM9.(我)显示分叉。箭头表示一个花卉射击中的两个Sams。(J)及(K),第一层细胞的细胞区域和成熟胚胎中的所有细胞的范围(J)和8天大的植物(K).
2.6Kb的删除At4g11920造成茎尖缺陷
试验突变表型是否XCM9.突变体种子在含有卡那霉素的MS培养基上生长,发现其对卡那霉素敏感,这表明卡那霉素抗性基因可能被沉默或丢失。T-DNA网站(signal.salk.edu) [26.]表明T-DNA插入到AT1G18960基因的第3个外显子中,它们编码了类似MYB样HTH转录调节剂家族蛋白质。从T-DNA插入的侧翼序列设计引物以确认其存在。获得预期扩增,表明突变体在突变体中沉默了卡那霉素抗性基因。偏析分析表明T-DNA插入没有用突变表型COSTGREGEGGED,表明突变表型不是由T-DNA插入引起的。
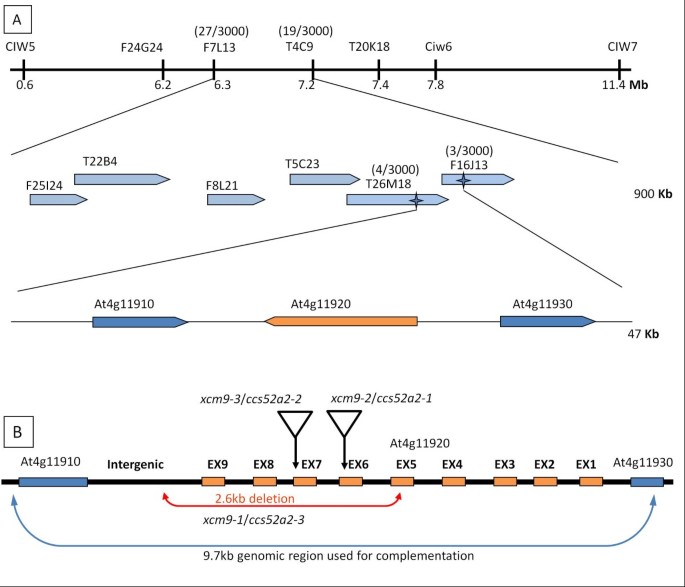
克隆被破坏的基因XCM9.突变体,XCM9.突变体越过生态型Landsbergerecta.(L.呃)映射。所有F1.植物表现出WT表型,而F2.分离的后代XCM9.和WT幼苗,表明XCM9.突变是在单核基因隐性(χ2. = 0.06 < χ0.05 (1)2. = 3.84). Bulked segregant analysis mapped theXCM9.4号染色体上CIW5和CIW7之间的间隔。进一步精细映射定位XCM9.在细菌人工染色体(BACS)F7L13和T4C9上的两个短序列长度多态性(SSLP)标记之间的基因座。使用额外的标记来细微映射BAC克隆T26M18和F16J13上的SSLP标记之间的轨迹(图4).从该47KB区域扩增的基因组DNA的测序显示出从AT4G11920的第5个外显子开始的2.6kb缺失,并延伸到AT4G11920和AT4G11910之间的基因间区域XCM9.突变体。
验证At4g11920的缺失是否导致了茎尖缺陷XCM9.,我们接下来通过插入含有1.5kb的上游序列,全长编码区和At4g11920的1.2kb的下游序列(其包括At4g11910编码区)插入的杂合植物中9.7Kb基因组DNA片段进行互补测验XCM9.(图4 b),因为纯合子XCM9.植物表现出强大的表型,不会产生足够的花卉进行转化。我们发现所有在纯合中获得的转基因植物XCM9.背景是从WT植物中难以区分的表型,证实观察到的顶点缺陷表型XCM9.是由At4g11910或At4g11920缺失引起的。此外,鉴定了2个SALK系,SALK_001978和SALK_073708C,分别在At4g11920的第7和第6外显子中插入T-DNA(图)4 b).这两个突变体显示出类似的表型XCM9.,并被指定为XCM9-2和XCM9-3,分别。这些结果共同证实了突变表型是由At4g11920突变引起的。
At4g11920基因由9个外显子和8个内含子组成4 b)并且编码推定的CDH1 / CCS52A2 / FZR1蛋白(CDH1,也称为HCT1为CDC二十同源物; CCS52A2,也被称为由细胞周期转换基因编码的52 kDa蛋白),其中包含WD40重复序列和是一个组件APC / C,作用的助活化剂和底物识别[的27.,28.].因此,这是XCM9.突变体被命名为CCS52A2-3.XCM9-2对应于ccs52a2-1,和XCM9-3更名为CCS52A2-2[29.].在拟南芥,CCS52A2被报道通过作用于根的远端区域和调节QC的有丝分裂状态来稳定根分生组织的维持[30.].此外,CCS52A2,在转录因子EF1/DEL的调控下,促进成熟叶片细胞内的核内重复[29.].在拟南芥, 三CDH1 / FZR.同源物,ATCCS52A1,ATCCS52A2和AtCCS52B,先前已识别出[31].所有CCS52(A1,A2和B)蛋白质显示出类似的结构,具有保守的C盒,CSM(CDH1特异性图案),IR基序(APC结合域)和CBM主题(有丝分裂RVL Cyclin结合基序)[31].重要的,CCS52A2-3丢失了CCS52A2的保守潜在的CDK磷酸化位点,IR和CBM基序,表明该等位基因是可能的突变体。
CCS52A2mRNA广泛表达
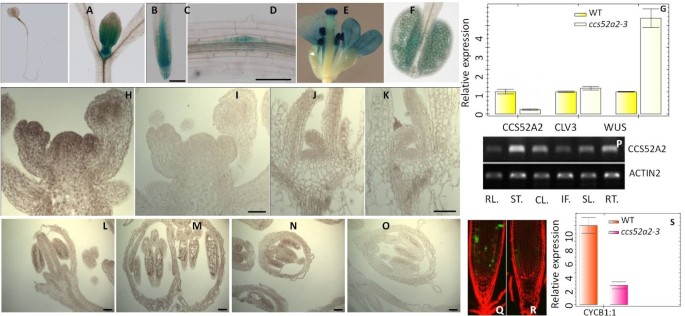
RT-PCR分析表明,CCS52A2具有广泛的表达型材,包括根,玫瑰花叶,茎,茎,花序和单片机(图5便士).的表达CCS52A2通过组织化学GUS测定,在CCS52A2天然启动子的控制下,通过组织化学GUS测定在8天的植物中在8天血液植物中检查。在拍摄端和根尖中观察到强烈的表达(图5- d)。确定的表达式区域CCS52A2mRNA,原位进行杂交。结果与GUS测定的结果一致,在整个山姆中呈现强信号(图5 h,j),在8日龄幼苗中,侧叶primordia(图5 j),花普法基(图5 h),以及花粉(图5 e在28天老植物中不同阶段的F,L-N)。
CCS52A2在拟南芥.(A.)(F),CCS52A2P :: CDS :: GUS表达在拍摄商品中(A.)(B),根尖(C),侧根(D),花瓣(E)和成熟花粉(F)在8日龄的幼苗。酒吧=100μm。(G),mRNA表达结果CCS52A2,CLV3.和本人在10日龄幼苗的山姆(wt和CCS52A2-3)来自实时PCR。(h)至(o),CCS52A2在花序射击的SAM中表达(H)和8日龄幼苗(J)和花粉(L)(M)(N) 通过使用原位杂交。(我)(K)(O)用感觉探针杂交作为对照。Bar = 50 μm。(P),CCS52A2各种表达拟南芥组织通过rt - pcr。actin2.显示为装载控制。Rt = rossette叶子,st =茎,cl =尾叶,if =花序,sl = silique,rt =根。(Q)及(R),Cycb1; 1 :: GFP表达在WT的8日龄幼苗的根源中(Q) 和CCS52A2-3(R).(s),mRNA表达结果cycb1; 1在10日龄幼苗的山姆(wt和CCS52A2-3)来自实时PCR。
表达模式本人和CLV3.都改变了CCS52A2-3突变体
年SAM的无序组织CCS52A2-3CCS52A2在射击顶点的高表达促使我们研究了两个基本融合基因的表达模式吗?本人和CLV3.,受到突变体的影响。使用来自10日龄幼苗的解剖山姆的QRT-PCR结果表明本人在CCS52A2-3, 尽管CLV3.保持稍高的mRNA表达水平CCS52A2-3与wt相比突变体(图5克).
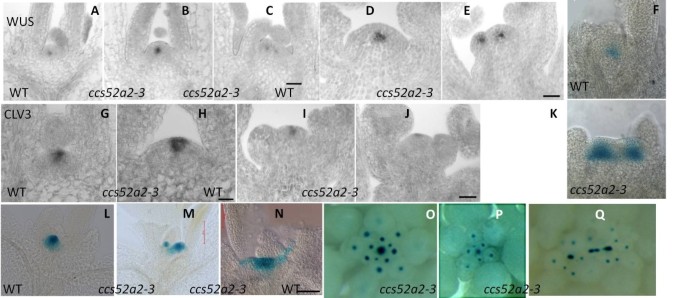
为了进一步检测这些分生基因在SAM中的表达模式,mRNA原位杂交测定本人和CLV3.基因得以执行。的表达本人在wt中受到限制在由山姆中心的几个细胞组成的小区域中(图6,d)[4.].但是,在8天老的山姆CCS52A2-3幼苗,本人在较高水平的一个放大结构域表达(图6 b),或在两个不同的附近域(图6摄氏度),表明形成了扩大的或多个OC区,这与茎的SAM变宽和分叉一致。与幼苗相比,突变体的生殖SAM没有检测到或减少了本人(图6 e)与wt相比(图6 d),提示花芽分生组织的大小缩小和提前终止CCS52A2-3突变体可能是由失去的本人活动。
本人和CLV3.在WT和表达ccs52a2-3。(A.)(C),本人8日龄WT幼苗SAM的表达(A.) 和CCS52A2-3(B)及(C).Bar = 50 μm。(D)及(E),本人在30天历史的WT的山姆山脉中的表达(D) 和CCS52A2-3(E).Bar = 50 μm。(F)及(K),pWUS::GUS在8日龄WT SAM中的表达(F) 和ccs52A2-3(K).二本人表达域在CCS52A2-3(K).(G)及(H),CLV3.8日龄WT幼苗SAM的表达(G) 和CCS52A2-3(H).Bar = 50 μm。(我)及(J),CLV3.在30天历史的WT的山姆山脉中的表达(我) 和CCS52A2-3(J).Bar = 50 μm。(L)(N), pCLV3::GUS在野生型8日龄SAM (L) 和CCS52A2-3(M)(N).Bar = 50 μm。(O)(Q),PCLV3 :: GUS表达在WT的花卉拍摄山姆(O) 和CCS52A2-3(P)(Q).
在WT,CLV3.mRNA在公司顶点的前三层中的小区中积聚在一个小区中(图6克, 一世) [6.].与野生型相比,8日龄小鼠的sam明显增加CCS52A2-3被检查的幼苗显示增加了CLV3.表达式(图6小时).然而,大多数28天大的孩子CCS52A2-3植物(n = 10)有一个略宽但浅薄的表达CLV3.与WT SAM的中央表面中的有限表达相比,在生殖SAM部分中(图6 j),而部分与WT无显著差异。
验证结果原位杂交,我们监测了表达本人和CLV3.使用GUS记者(p本人:: gus和pCLV3.:: gus)在wt和CCS52A2-3.p本人:: GUS测定法提出了一个相似的表达模式为RNA在SITUS.:扩大有时是双重表达域CCS52A2-3背景(图6 k).另外,pCLV3.::古斯在伦敦的位置CCS52A2-3Sam展出了附近的两个域CLV3.22株8日龄幼苗中有6株表达(图)6米),表示两个分开本人-CLV3.早在8天老阶段就建立了公司组织的支持系统。还有人发现CLV3.在一些第一层细胞显示广泛的表达侧翼的主要表达在区22 7中的SAM的CCS52A2-3幼苗(图6 n),而剩下的9个CCS52A2-3Sams展出了一个单身CLV3.表达区域。另外,主要茎的花卉三星CCS52A2-3总是显示下降CLV3.表达式(图6P),但在一些横向分支中,观察到多个CLV3表达区域(图6Q.).这些与侧枝中多个SAM的观察结果一致(图1G,3我)和主阀杆上较小的sam(图3 f, H)。
CCS52A2-3是协同沃斯和图表突变体
测试之间存在遗传相互作用CCS52A2和本人,CLV1.和CLV3.基因,我们创造了双突变体ccs52a2-3 wus-1,CCS52A2-3 CLV1-1,CCS52A2-3 CLV1-4和ccs52a2-3 clv3-2通过交叉CCS52A2-3与WUS-1,CLV1-1,clv1-4和clv3-2,分别。clv1-4和clv3-2相对于WT生产扩大的拍摄和花卉分生成品,被认为是最强的等位基因CLV1.和CLV3.突变体(图7A, F) [5.,32].双突变体clv3-2有一种新颖的表型:ccs52a2-3 clv3-2植物(n = 48)始终有更多的莲座叶和更大的茎分生组织(图7e.)与WT和单突变体相比,从营养期与生殖相的延迟过渡。此外,ccs52a2-3 clv3-2双突变体在生殖SAM和茎中表现出严重的筋膜化(图7B., C)。存在更严重的分叉(平均7个拍摄端子,有时在单个茎中超过30个,根据营养条件)ccs52a2-3 clv3-2双突变体相比CCS52A2-3单突变体,通常从分叉产生2或3个茎尖。我们无法计算出由于扭曲的茎而导致的极端分叉所产生的茎尖的确切数目。
形态学ccs52a2-3 clv3-2,CCS52A2-3 CLV1-4和ccs52a2-3 wus-1双突变体.(A.)(G),clv3-2(一)和ccs52a2-3 clv3-2(B) (C).箭头表示从一个拍摄的拍摄端子ccs52a2-3 clv3-2(C)。ccs52a2-3 clv3-2与单个突变体相比,扩大了8天龄幼苗的SAM(E)(来自切片)clv3-2(D).Bars = 1 cm in (A.) - (C);Bar = 50 μm in (D),(E).(F),成熟clv1-4植物。酒吧= 1厘米。(G)(我),成熟CCS52A2-3 CLV1-4双突变体。输入i(G),II型(H)和III型(我).酒吧= 1厘米。(J)及(K),42天老WUS-1单突变体(J) 和ccs52a2-3 wus-1双突变体(K).酒吧= 1厘米。(L)及(M),两周大WUS-1(L) 和ccs52a2-3 wus-1(M).
CLV1是CLV3在CLV3- wus通路中的直接下游靶点[9], 所以ccs52a2-3 clv1被认为具有与之相似的表型ccs52a2-3 clv3.的观察CCS52A2-3 CLV1-1和CCS52A2-3 CLV1-4双突变体显示出类似的簇生于茎顶作为ccs52a2-3 clv3-2双重突变体CCS52A2-3 CLV1-4(n = 39) displayed bifurcation at a very high frequency, over 50% under our conditions, compared to 12.8% forCCS52A2-3(n = 39)。所有CCS52A2-3 CLV1-4根据迷人的茎的宽度将双突变体分为三种类型(图7G我)。值得注意的是,I型的主茎最宽,其次是II型,然后是III型。I型和II型双突变体没有源自莲座叶的侧枝,但III型有。大部分的CCS52A2-3 CLV1-4在横向分支中形成几朵花的双突变体,这表示clv1-4能否挽救过早终止中的CCS52A2-3通过在不存在CLV功能的扩大SAM大小。此外,花两ccs52a2-3 clv3-2和CCS52A2-3 CLV1-4 / CLV1-1双突变体似乎是典型的图表花器官数量增加,4-8个心皮,5个花瓣。严重的SAM分岔和筋膜化CCS52A2-3CLV3.-2和CCS52A2-3 CLV1-4双突变体揭示了CCS52A2和CLV途径之间的协同相互作用,CCS52A2参与了独立的途径,但在SAM开发和维护的相同的一般过程中作为CLV3和CLV1。
本人是另一个重要的基因在组织和SAM细胞的身份,如本人创建反馈调节循环CLV1.和CLV3.[7.].初级拍摄分析WUS-1幼苗不能维持自身,分生组织细胞分化,停止进一步的芽生长,直到不定根分生组织形成,开始进一步的叶和芽[3.,4.].测试相互作用本人与CCS52A2,我们建造了ccs52a2-3 wus-1双突变体。34%的12天历史后代ccs52a2-3 / + wus-1 / +展示了一种类似于山姆的缺陷WUS-1单突变体,高于24%的突变体wus-1/+自己的后代(表1.).因此ccs52a2-3 wus-1双突变体幼苗(图7M)表型出现相同WUS-1单一突变体,在SAM组织中显示严重缺陷,包括无法建立正常拍摄商品,然后建立正常的射击分类,然后开发次要不定量的商品,导致更多的玫瑰花叶(图7K.).但在大多数的SAM年长的缺陷ccs52a2-3 wus-1双突变体增强,产生更多的莲座叶片WUS-1单突变体和从营养端向生殖端过渡的延迟,如图WUS-1.42天老的100%ccs52a2-3 wus-1植株(n = 30)未发育确定的花序嫩枝,75%WUS-1s在gle mutants (n = 42) harboring flowering shoots at the same age under our conditions (Table1.).
CCS52A2在细胞分裂过程中控制分化细胞的大小和倍性
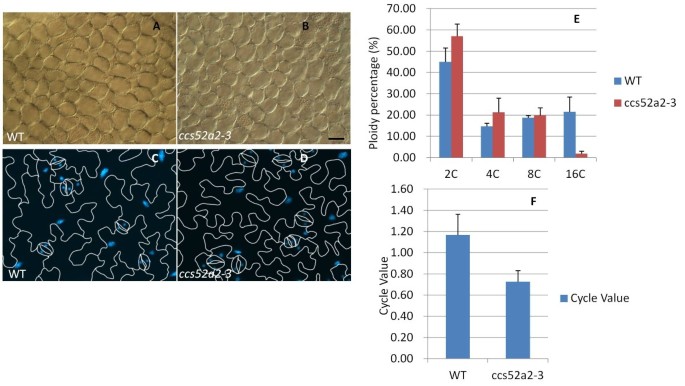
在先前的研究中,CCS52A2被发现控制内循环,敲除系CCS52A2成熟叶片的低内复制指数(EI)表明了这一点KO(分析CCS52A2-1突变体)和CCS52A2中DNA倍性水平较高的细胞数量增加OE树叶 [29.].CCS52A2-3突变体与野生型相比显得矮小,叶片、茎和角果更小(图)1A和2 e-G)。我们假设这些表型可能是由于细胞量和/或更小的细胞尺寸降低,因此我们分析了细胞尺寸和成熟的数量th树叶。与wt相比,5th成熟的叶子CCS52A2-3突变体在培蛋白细胞大小下降13.58%(图8B.) 和a decrease of 70.61% in total mesophyll cell number (13039.6 ± 2964.3 inCCS52A2-3;44361.8±6767.2在wt,学生T测试P <0.05),显着的细胞尺寸减少(2226.4±61.6um2.在CCS52A2-3; 2576.2 ± 113.7微米2.在WT中,p < 0.05),也可检测到下表皮细胞(图8D.).为了测试细胞尺寸的降低,与较低的倍率水平相对应,我们测量了叶片剥离中的亚轴表皮细胞的核尺寸。统计分析表明,具有16C个倍增性的突变叶细胞比wt百分比显着较低,而2C倒档的突变叶细胞在突变体中显示出略高的百分比(图8E).5的循环值(CV)th叶在cca52a2-3植物较低(p <0.05)比wt(图8f.)[33],与CCS52A2的较低ei一致KO前一份报告中采用流式细胞术测定叶片[29.].因此,我们认为,CCS52A2功能的丧失导致成熟叶片中细胞尺寸和倍率水平的降低。但是,通过流式细胞术测量,8日龄中的SAM细胞的CVCCS52A2-3与WT(未示出的数据)相比,幼苗不受影响。尽管突变体SAMS中的分型细胞的细胞区域(图3 j,k),细胞倍增性并不相应地改变,这意味着与叶子不同,CCS52A2没有诱导拍摄商品中的巢穴发作。早期发布的RAM数据CCS52A2敲除线(ccs52a2-1, ccs52a2-2)还表明,CCS52A2介导的对根部发育的控制并不涉及eNEDOREDUPLICATION [30.].
CyCB1; 1被揭示为APC / C的可能底物之一,以与CCS52S(A1,A2和B)相互作用拟南芥[31].自从CCS52A2在G2 / m起作用,以控制有丝分裂出口和内圆周进入,检查G2 / m过渡报告总因CYCB 1; 1的表达CCS52A2-3突变体。我们监控了窝藏Cycb1的标记线的根尖中的GFP记者; 1 :: GFP中的CCS52A2-3共聚焦显微镜下的突变背景。结果表明,7日龄时,CYCB1;1表达的RAM细胞数量显著减少,根中CYCB1;1表达的细胞范围变短CCS52A2-3与WT相比(图5 r).此外,进行QRT PCR以量化CyCB1的表达水平; 1在拍摄中。幼苗山姆CCS52A2-3与WT相比,表达水平较低(图5 s).减少Cycb1; 1在SAM和RAM中的表达表明细胞周期过程受到干扰CCS52A2-3突变体。
CCS52A2与之互动Mgo1.和FAS1
这个Mgo1-1.和fas1-1突变体在植物和生殖发展中显示植物和分叉[22.,23.的表型相似CCS52A2-3突变体。表型的相似性迫使我们弄清楚这些基因是否在相同的途径中发挥作用,以及/或影响相同的下游过程CCS52A2.来研究我们建立的基因关系ccs52a2-3 fas1-1和CCS52A2-3 MgO1-1双重突变体CCS52A2-3 MgO1-1双突变体无法区分MgO-1(图9A,c)在我们的条件下,建议Mgo1.可能是对上位CCS52A2.这个ccs52a2-3 fas1-1双突变体具有许多父母的特征,但可以容易地与单一突变体区分开(图9D.我)。它们有狭窄的叶子和中断的花的叶序fas1-1,分叉和过早终止特征CCS52A2-3.然而,花序的分叉比率高于CCS52A2-3单一突变体(71%ccs52a2-3 fas1-1,n = 32;12.8%CCS52A2-3,n = 39)。许多ccs52a2-3 fas1-1双突变体在成熟植株中表现出大量的莲座状叶子和浓密的外观(图)9e.).的新表型ccs52a2-3 fas1-1双突变体显示FAS1和CCS52A2涉及相同的下游过程。
成熟的形态学Mgo1-1.,CCS52A2-3,CCS52A2-3 MgO1-1,fas1-1, 和ccs52a2-3 fas1-1.(A.),Mgo1-1..箭头表示茎中的分叉。(B),CCS52A2-3。箭头表示在主要拍摄中的过早终止。(C),CCS52A2-3 MgO1-1双突变体。箭头表示茎的类似分支Mgo1-1.单突变体。(D),FAS1-1。(e)和(f),ccs52a2-3 fas1-1双突变体,显示浓密的叶(E)和增强的分叉(F).箭头表示令人不安的花盆(E)和两个分叉的茎(F).(G)(我),花的茎尖fas1-1(G),CCS52A2-3(H) 和ccs52a2-3 fas1-1(我).这个ccs52a2-3 fas1-1花芽提前终止fas1-1同龄单突变体。所有酒吧= 1厘米。
讨论
CCS52A2对于SAM的正常结构和功能是必要的拟南芥
本文演示了CCS52A2功能的丢失CCS52A2-3突变体导致SAM出现新的形态缺陷。这个CCS52A2-3突变体显示伴随早终止的花芽与经常分枝的茎尖,茎和花。分生组织中的这些缺陷表明CCS52A2基因是植物发育中SAM的正常维持和功能所必需的。有趣的是,营养分生组织和花序分生组织分别比野生型大和小。一种可能的解释是,在8天大的突变体中出现的双WUS表达区表明了从这个时候开始的分叉。侧向分裂产生两个较小的SAMs,每个SAMs都有一个减少的WUS表达域,随后产生较小的花序SAMs,提前终止。
主要SAM调节基因的表达变化本人和CCS52A2-3中的CLV3被观察到。异位CLV3.在山姆的第一层中检测到表达(图6 n),并且存在多个本人和/或CLV3.单个SAM的表达区域CCS52A2-3幼苗揭示了高等植物公司的罕见维护模式。SAM调节剂的所有这些异常表达式模式表明CCS52A2的故障影响了公司中的细胞标识。以前发表的数据表明,CCS52A2基因在根瘤菌中的QC身份中发挥作用,因为RAM组织基因显示出不规则的表达结构域和位置,并且未能保持QC区中细胞的低有丝分裂活动CCS52A2-1根 [30.].我们在此提供证据,证明SAM组织者的表达在CCS52A2-3并且有时在突变体山姆中产生重复的单独CLV3-WUS监管中心。对此的一个可能的解释是,OC区中细胞的增殖是由细胞分裂控制的部分损失导致的,导致在突变体的单个族山型山姆中形成新的和单独的CLV3-WUS调节系统。考虑到CCS52A2在根的作用,我们给出了一个假设,即重复的OC可能因未能在某些SAM细胞中保持低有丝分裂水平而导致的,具有更多的细胞可用于满足某些角色。
CCS52A2与SAM组织者协同互动
我们怀疑CCS52A2通过间接互动来规定分算法的发展本人和CLV3.基因。通过上调表达首先支持该假设CLV3.和本人在…的SAM中CCS52A2-3幼苗(图5克).此外,更严重的表型见于ccs52a2-3 clv3-2和CCS52A2-3 CLV1-4双突变体表明了这一点CCS52A2可以在单独的遗传途径中起作用,但涉及相同的过程CLV1.和CLV3.并且破坏了分类中的多种细胞分裂调节模式导致细胞分裂控制和大规模过度渗透的更大可能性。从较大的Sams(与任何单一突变体相比)的发现更严重的分叉CCS52A2-3 CLV.双突变体显示SAM的大小越大,发生的分叉越多。图表单突变展品扩大SAM,但尚未见报道经过分叉。
增强了WUS-1表型ccs52a2-3 wus-1双突变体表明CCS52A2促进分生组织的建立和叶片的起始本人;然而,CCS52A2也在一个独立的途径中起作用。
CCS52A2在SAM中的功能,刺激成熟叶片中的内圆周发作
之前的研究表明,CCS52A2是APC / C的活化剂,其在丝分裂期间介导蛋白质蛋白质[30.,31,34]因此,它可以通过调节细胞分裂来调节SAM的维持和发育。我们的假设与细胞周期损伤是一致的,这一点可以通过细胞的RAM和SAM中较低的CYCB1;1表达来表明CCS52A2-3(图5 r).然而,SAM的增大主要是由于细胞面积的增大,而不是细胞数量的增加,这说明在突变的SAM中,即使在细胞周期中存在损伤,细胞的增殖仍然受到控制。CCS52A2还据报道,促进从细胞周期的出口进入核循环,并通过与APC / C相关联的结核补充截形苜蓿[28.,34].在拟南芥,在CCS52A2敲除(KO)和过表达(OE)线中看到类似的效果[29.]然而,在本文中,SAM不变的CV(对应于倍性水平)表明,扩增的干细胞不是由于进入细胞的内循环ccs52a2-3。这与之前的研究一致CCS52A2与endocycle在CCS52A2 RAM没有相关KO,在突变体中显示正常的核内重复指数[30.].但在成熟叶片中,细胞体积较小,CV值较低ccs52a2突变表明CCS52A2在这些组织中发挥作用。综上所述,这些研究进一步支持了这一观点CCS52A2仅对调节分化细胞中的内圆环发作而不是未分化细胞的效果显而易见。
CCS52A1,同源际CCS52A2据报道,还据报道,控制成熟叶中细胞的核心[35].null突变体的类似倍性变化CCS52A1和CCS52A2表示这两个基因在EndoRateUplicticting onSet中的功能中重叠,但它们并不冗余。
CCS52A2参与染色质重塑
在MGO1基因携带突变的植物表现出一些类似的表型CCS52A2-3突变体[22.],例如茎的分叉。Mgo1.编码A.拟南芥IB型DNA拓扑异构酶,其作用于超盘绕DNA的松弛,并在许多不同的DNA代谢过程中起作用,包括复制、转录、修复和染色质压实[36,37].据报道,MgO1与染色质调节剂配合,并且对于维持几种表述稳压基因是必要的[25.].无法区分的表型CCS52A2-3 MgO1-1双突变体与Mgo1-1.单突变体显示,这两个基因可能参与相同的途径。最近,发现突变Mgo1.抑制异位本人活性增强干细胞缺陷沃斯突变体[25.].同样,缺乏CCS52A2增强了SAM缺陷WUS-1,哪一个进一步支持二者之间的函数关系Mgo1.和CCS52A2,并暗示其功能可能会收敛到共同的下游进程本人干细胞调节[25.].MGO1和CCS52A2蛋白都是调节细胞周期过程的因子。进一步研究CCS52A2与MGO1之间连接的分子性质将是一件有趣的事情。
fas1是另一个迷人的突变体,显示茎分叉,如CCS52A2-3和MgO1..FAS1编码染色质组合因子(CAF-1)的一个亚基,其在DNA复制期间通过沉积新合成的组蛋白H3和H4来协调核心小组件并修复[38].缺陷FAS1通过上调与G2 DNA检查点有关的几个基因,导致通过G2的进程停止,这是通过改变启动子的表观遗传标记来完成的[24.].新颖的表型ccs52a2-3 fas1-1双突变体证明了两个基因在SAM开发中具有协同相互作用。两种植物的共同表型FAS1,Mgo1.或者CCS52A2揭示了这三种基因可能参与同一下游过程。因此,FAS1调节参与G2损伤检查点的表观遗传态,而MgO1在DNA修复中作用,并保持若干外膜稳压基因的表达[24.,25.].此外,关于结节器官发生的研究表明,CCS52A蛋白在细胞周期的适当阶段介导有丝分裂周期蛋白的降解,使CDKs失活,最终阻断G2向M的转变,从而触发核内再复制[39].SAM中不同细胞样品的先前表达谱分析显示干细胞中DNA修复和染色质修饰途径的富集,这表明柔性染色质的维持可以促进SAM发展期间基因表达的动态平衡[40]这些结果进一步证明了CCS52A2可能具有触发G2/M转换的功能,以及CCS52A2、FAS1和MGO1的信号通路均参与表观遗传维持和G2检查点激活的假设。
结论
在这项研究中,我们展示了突变CCS52A2基因破坏的SAM的正常结构和功能在拟南芥.CCS52A2调节分生组织调节基因的表达域本人和CLV3..此外,双突变分析说明了CCS52A2与萨姆组织者协同互动。在没有的情况下,细胞周期被干扰CCS52A2,如降低表达CyCB1的表达式所示;1。CCS52A2参与细胞分裂过程中在分化细胞细胞大小和倍性的控制。此外,CCS52A2参与染色质重塑Fas.1和Mgo1.先前据报道,以前涉及激活G2检查点和表观遗传维护。我们建议CCS52A2在SAM发育过程中,调节分生组织结构,与分生组织基因一起发挥功能,并与染色质调节器交叉发挥作用。
方法
植物材料和生长条件
CCS52A2-3,CCS52A2-1和CCS52A2-2突变体(Col Exotype)CCS52A2从拟南芥生物资源中心(ABRC)分别从Salk_074403,Salk_073708和Salk_001978获得基因。WUS-1,CLV1-1,clv1-4,clv3-2,CLV::GUS标记线,WUS::GUS标记线(均为L呃间),Mgo1-1.(Wassilewskija, Ws ecotpye)和fas1-1(L.呃使用了生态型。在双突变体的情况下WUS-1,CLV1-1,clv1-4,clv3-2,CLV :: GUS标记线,并WUS :: GUS标记线,我们只分析也怀着植物erecta.突变。为了确保没有背景效果CCS52A2-3表型,我们用野生型LER加入越过CCS52A2-3,并选择CCS52A2-3 erecta植物进行检查。CCS52A2-3突变显示出这两种生态型之间的表型没有显着差异。所有植物在14-H光/ 10-H-暗光周期下的生长室中的生长室中的所有植物都生长在生长腔室中(120μmolm-2s-1)在24/22℃下,用于微观研究的幼苗在Murashige和Skoog(MS)培养基上生长在同一光条件下的生长腔室中的垂直定向板上。F.1.所有双突变体在形态上与野生型相似CCS52A2-3f中的表型2.人口被选中收获,和图表,沃斯,fas1或者MgO1.在F中选择表型植物作为纯合双突变体3.人口。在双突变体的F1和F2人口中,图表,沃斯和CCS52A2-3通过测序还通过测序进行突变,其用以下引物进行:Dwusl:5'-ctaccaccgttgatgtgatc-3';dwusr:5'-tcatgcaagctcaggtactg-3';dclv1l:5'-gacttttggtttacgtagcg-3';DCLV1R:5'-AcatcactTtctCGTCCAC-3';CCS52A2-3琼脂糖凝胶引物:35R-2: 5 ' -GGTGATTAGTTACCCATCCACGTGTTATAC-3 ';38 f - 2: 5“-GCACTTGCTAGCTTACTTCACCGAATCATA-3”。
RT-PCR和实时PCR
使用Trizol方法从各种组织中提取RNA,并使用2μg RNA与M-MLV逆转录酶(Promega)一起使用在对cDNA的RT反应中。每个基因的表达水平与肌动蛋白2的表达水平进行标准化。使用以下引物进行逆转录PCR:CCS52A2R:5'-TCGTAACACATCCATTCT-3';CCS52A2F:5'-TaagacgGaAcgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAgAg-3.用于qRT PCR反应的引物:qWUSR/F、qCLV3R/F由先前报道合成[41];QCCS52A2F:5'-acacgccgcagcagtga-3';QCCS52A2R:5'-AGCAGTGCCACCACCAGAAG-3';Qactin2F:5'-GGCTCCTTTAACCCAAAGGC-3';qactin2r:5'-cacaccatcaccagaatccag-3'。
组织切片和GUS染色
在FAA(3.7%甲醛:50%乙醇:5%乙酸)中固定组织过夜,并在制造商的方案之后嵌入技术方案中嵌入了Technocit 7100(Heraeus Kulzer)。将该部分切成2um并用0.1%甲苯胺蓝染色。将载玻片用70%和100%乙醇洗涤,并在空气中干燥后通过中性树脂嵌入盖玻片。组织化学GUS如前所述进行(Schof等,2000),细微修饰(以染色时间缩至8-10小时)。
原位杂交
的8天龄的幼苗和28天龄植物的茎尖中固定在FAA 3小时(3.7%的甲醛:50%乙醇:5%乙酸)真空过滤后的溶液并包埋在Paraplast的包埋介质(牛津器皿,圣路易斯,密苏里州)。将样品在厚度8um的切片并放置到探针 - 在加显微镜载玻片(Fisher Scientific公司)。组织制备,如所描述的进行杂交和检测程序[13.,42].在制造商的说明之后,用DIG RNA标记试剂盒T7 / SP6(ROCHE)和T3 RNA聚合酶(PROMEGA)产生所有探针。模板CLV3.探针是前291磅CLV3.编码序列并将其克隆到PCRBlunt载体(Invitrogen)中。模板本人探针为前664 bp本人并克隆到pBluescript KS载体(Fermentas)中。这个CCS52A2通过将5'UTR序列的340bp克隆到PGEMTEASY(PRomega)中产生探针,其中引物CCS525UL:5'-CCCGGGGAAAGAAAAAAAAAAAC-3'和CCS525UR:5'-ACTCGAGTCACGAATCAA-3'。在合成探针之前,对探针的所有模板进行测序。
转基因的建设
为了产生用于互补的转基因,全长基因组序列(9.7 KB)的CCS52A2, 包括CCS52A2从BAC T26M18(ABRC提供)和Emzymes Xbai和EcoRV的Bac T26M18(ABRC提供的Bac T26M18(ABRC提供)切除编码区(包括内含子),并插入PCAMBIA 3301载体的Xbai-SmaI位点。将质粒引入农杆菌肿瘤术用电穿孔法将菌株GV3101转化为CCS52A2-3通过花浸法植物的杂合子植物[43,44].阳性转基因ccs52a2-3 - / -植物被筛选为12天旧的T.1.通过基因分型和喷洒54 mg/ml Basta的方法产生。
生成CCS52A2P:: CCS52A2CDS::GUS构建1.6 Kb启动子区域CCS52A2使用引物PG1R:5'-GTCAAGCTTTGTTTAACCGTGAAGGCTCTG-3'和PG11:5'-CCGTCTAGATCTGTTTCGTTC CTCCAG-3'扩增,用后III和XBAI消化并插入PBI121中。然后使用引物P1ATG12:5'-GCGTCTAGATGGAAGAAGATGAATCAAC-3'和P1ATGR2:5'-TATGGATCCACACCG GattGTTGTT CT-3'从cDNA中扩增1.5Kb CDS区域,用BamHI和Xbal消化并在启动子之后插入PBI121。将所有质粒引入农杆菌肿瘤术菌株GV3101通过电穿孔,并转化到野生型(Col)或CCS52A2-3花卉DIP方法的杂合子[43,44].
参考文献
- 1。
Weigel D,JürgensG:制剂茎的干细胞。自然。2002,415:751-754。10.1038 / 415751A。
- 2。
Lenhard M,Laux T:拟南芥中的干细胞稳态由Clavata3的细胞间运动来调节Clavata3和Clavata1的封存。发展。2003,130:3163-3173。10.1242 / dev.00525。
- 3.
Laux T,Mayer Kfx,Berger J,JürgensG:拟南芥中的射击和花卉公司诚信所需的Wuschel基因。发展。1996年,122:87-96。
- 4.
Mayer Kfx,Schoof H,Haecker A,Lenhard M,Jurgens G,Laus T:WUSCHEL在调节拟南芥拍摄公司中的干细胞命运中的作用。细胞。1998,95:10-
- 5.
Clark S,Meyerowitz E:Clavata3是一个特定的拍摄和花卉公司发育的调节器,影响与Clavata1相同的过程。发展。1995,121:2057-2067。
- 6.
CLAVATA3在拟南芥茎分生组织中调控细胞命运的研究。《科学》1999年第3期。10.1126 / science.283.5409.1911。
- 7.
Schoof H,Lendard M,Haecker A,Mayer Kfx,Jurgens G,Laux T:拟南芥射击分类的干细胞群通过Clavata和WUSchel基因之间的调节循环呈现。细胞。2000,100:9-
- 8。
穆勒R,BLECKMANN A,西蒙R:拟南芥发送的受体激酶CORYNE干细胞限制信号CLAVATA3独立CLAVATA1的。植物细胞在线。2008年,20:934-946。10.1105 / tpc.107.057547。
- 9。
小川M,Shinohara H,Sakagami Y,Matsubayashi Y:拟南芥CLV3肽直接结合CLV1外结构域。科学。2008,319(5861):294-10.1126/Science.1150083。
- 10。
(1)拟南芥根分生组织细胞分化的短期调控。自然杂志。1997,39:287-289。10.1038/36856。
- 11.
Haecker A,Groß-Hardt R,Geiges B,Sarkar A,Breuninger H,Herrmann M,Laux T:Wox基因的表达动态标记细胞命运在拟南芥早期胚胎图案中的决定。发展。2004,131(3):657-668。10.1242 / dev.00963。
- 12.
Sarkar AK, Luijten M, Miyashima S, Lenhard M, Hashimoto T, Nakajima K, Scheres B, Heidstra R, Laux T:保守因子调节拟南芥茎和根干细胞组织的信号传导。自然科学进展。2007,446:811-814。10.1038 / nature05703。
- 13。
德鲁GN:原位杂交。方法摩尔生物学。1998年,82:353-371。
- 14.
多兰L:分生组织:干细胞调节的根源。Curr Biol.2009,19(11):R459-R460.10.1016/j.cub.2009.04.030。
- 15.
Lin Z,Yin K,Zhu D,Chen Z,GU H,Qu L-J:ATCDC5调节细胞周期的G2至M转变,对于拟南芥射击顶端公司的功能至关重要。细胞res。2007,17(9):815-828。10.1038 / cr.2007.71。
- 16.
Pérez-PérezJM,Serralbo1 O,Vanstraelen M,GonzálezC,Criqui M-C,Genschik P,Kondorosi E,Scheres B:CDC27功能在塞利亚诺替其促进复合物(APC / C)中的CDC27功能。工厂J. 2008,53(1):78-89。10.1111 / J.1365-313x.2007.03312.x。
- 17.
Gaamouche T,Manes C-Lo,Kwiatkowska D,Berckmans B,Koumproglou R,Maes S,Beeckman T,Vernoux T,Doonan J,Traas J,等 - 等:Cyclin依赖性激酶活动保留在未分化状态下的芽顶部分发细胞.工厂J.2010,64(1):26-37。
- 18。
安德森苏,布契埃尔S,赵Z,Ljung k,Novak O,Busch W,Schuster C,Lohmann Ju:B2型细胞周期蛋白依赖性激酶的要求在拟南芥中的熟练依赖性。植物细胞。2008,20(1):88-100。10.1105 / TPC.107.054676。
- 19。
Dewitte W, Scofield S, Alcasabas AA, Maughan SC, Menges M, Braun N, Collins C, Nieuwland J, Prinsen E, Sundaresan V, et al:拟南芥CYCD3 d型细胞周期蛋白连接细胞增殖和内环,是细胞分裂素反应的限速因子。中国科学(d辑:地球科学),2007,34(6):593 - 598。10.1073 / pnas.0704166104。
- 20.
Peters J-M:促进复合物/环状的后期:一台旨在破坏的机器。NAT Rev Mol Cell Biol。2006,7:644-656。10.1038 / NRM1988。
- 21.
Kaya H,Shibahara K-i,Taoka K-i,Iwabuchi M,Stillman B,Araki T:拟南芥染色质组装因子-1的筋膜基因维持顶端分生组织的细胞组织。细胞。2001,104:11-
- 22.
lafs P, Dockx J, Kronenberger J, Traas J: MGOUN1和MGOUN2:拟南芥茎尖和花分生组织原基起始所需的两个基因。发展。1998,125:1253-1260。
- 23。
Leyser HMO,Filler IJ:拟南芥三次拍摄顶端均匀突变体的特征。发展。1992,116:397-403。
- 24。
Ramirez-Parra E,Gutierrez C:E2F调节Fasciata1,染色质组装基因,其损耗在核循环上切换并通过改变表观遗传状态来激活基因表达。植物理性。2007,144:105-120。10.1104 / pp.106.094979。
- 25。
Graf P, Dolzblasz A, Würschum T, Lenhard M, Pfreundt U, Laux T: MGOUN1编码一种拟南芥IB型DNA拓扑异构酶,用于干细胞调控和维持发育调节基因沉默。acta botanica sinica(云南植物研究),2010,22(6):716-728。10.1105 / tpc.109.068296。
- 26。
Alonso M,Stepanova An,Leisse TJ,Kim CJ,Chen H,Shinn P,Stevenson DK,Zimmerman J,Barajas P,Cheuk R等:拟南芥的基因组插入诱变。科学。2003,301:653-657。10.1126 / Science.1086391。
- 27。
Visintin R,Prinz S,AMON A:CDC20和CDH1:A APC依赖性蛋白水解的底物特异性活化剂系列。科学。1997年,278:460-463。10.1126 / Science.278.5337.460。
- 28。
Cebolla A, Vinardell JM, Kiss E, Oláh B, Roudier F, Kondorosi A, Kondorosi E:有丝分裂抑制剂ccs52在植物核内复制和倍性依赖的细胞扩大中是必需的。中国海洋大学学报(自然科学版),1999,18(16):4476-4484。10.1093 / emboj / 18.16.4476。
- 29。
Lammens T,Boudolf V,Kheibarshekan L,Panagiotis Zalmas L,Gaamouche T,Maes S,Vanstraelen M,Kondorosi E,La Thangue Nb,Govaerts W等:非典型E2F活动限制了内圆周发作的APC / CCCS52A2功能义务。PROC NATL ACAD SCI。2008,105(38):14721-14726。10.1073 / PNAS.08065105105。
- 30.
Vanstraelen男,Baloban男,沓伊内斯O,Cultrone A,Lammens T,Boudolf V,布朗SC,德Veylder L,Mergaert P,Kondorosi E:APC / CCCS52A复合控制在拟南芥根分生组织的维护。PROC NATL ACAD SCI。2009年,106(28):11806-11811。10.1073 / pnas.0901193106。
- 31。
Fülöpk,塔耶雷S,Kelemen Z,Horváthg,keveiz,Nikovics K,Bakól,棕色S,Kondorosi A,Kondorosi E:Arabidopsis Anaphase促进复合物多个激活剂和宽范围的基板可能会保持APC永久繁忙。细胞周期。2005,4(8):1084-1092。
- 32。
Clark Se,跑MP,Meyerowitz EM:Clavata1,拟南芥的稳压器和花卉开发。发展。1993,119:397-418。
- 33。
Barow M,Meister A:种子植物内多倍体与系统学、器官、生活策略和基因组大小的相关性不同。植物细胞环境,2003,26:571-584.10.1046/j.1365-3040.2003.00988.x。
- 34。
Tarayre S,Vinardell JM,Cebolla A,Kondorosi A,Kondorosi E:植物中促进复合物的两类CDH1型激活剂:新型功能域和明显的调节。植物细胞在线。2004,16:422-434。10.1105 / TPC.018952。
- 35。
Larson -Rabin Z,Li Z,Masson pH,Day CD:FZR2 / CCS52A1表达是拟南芥的结核和细胞扩张的决定因素。植物理性。2008,149:874-884。10.1104 / pp.108.132449。
- 36。
王JC:DNA拓扑异构酶。annu rev biochem。1996年,65:635-692。10.1146 / annurev.bi.65.070196.003223。
- 37。
Champoux JJ:DNA Topoisomerases:结构,功能和机制。annu rev biochem。2001,70:369-413。10.1146 / annurev.biochem.70.1.369。
- 38.
Smith S, Stillman B:体外DNA复制过程中染色质组装所需的人细胞因子cafi的纯化和特性。牢房,1989,58:15-25。10.1016 / 0092 - 8674 (89) 90398 - x。
- 39.
在根瘤发育过程中,泛素介导的蛋白质水解在正确的时刻处于正确的位置。植物营养与肥料学报。2005,27(4):427 - 434。10.1104 / pp.105.060004。
- 40.
Yadav RK,Girke T,Pasala S,Xie M,Reddy GV:拟南芥的基因表达图射击顶端分型干细胞Niche。PROC NATL ACAD SCI。2009,106(12):4941-4946。10.1073 / PNAS.0900843106。
- 41.
李志刚,李志刚,李志刚:拟南芥茎和花分生组织对CLV3信号的响应。植物学报,2006,18(5):1188-1198。10.1105 / tpc.105.040444。
- 42.
Jackson DP:植物原位杂交。分子植物病理学:一个实用的方法。Bowles DJ, Gurr SJ, McPherson M.编辑:牛津:牛津大学出版社;1991:163 - 174 . .
- 43.
KONCZ C,Schell J:T1-DNA基因5的启动子对通过新型农杆菌二元载体进行的嵌合基因的组织特异性表达。Mol Gen Genet。1986,204:383-396。10.1007 / BF00331014。
- 44.
花浸法:农杆菌介导的拟南芥转化的简化方法。植物学报,1998,16(6):735-743。10.1046 / j.1365 - 313 x.1998.00343.x。
致谢
我们感谢Zhongchi Liu,Thomas Laux,Jian Xu和Arabidicopsis生物资源中心,提供突变体和记者系列。我们感谢Howard Berg用显微镜照片和Mayank Gautam进行指导,用于编辑手稿。我们还感谢KEDE中的成员Liu的实验室和Mark P.运行的实验室,以便在日常工作中支持。这项工作得到了中国111项目的补助金(B07041)奖励至K.D.L.和NSF IOS-0744895授予M.P.R.
作者信息
从属关系
相应的作者
额外的信息
利益争夺
提交人声明他们没有竞争利益。
作者的贡献
YJL进行了所有的实验(除了下面提到的),构建了所有的图,并撰写了手稿。WY参与了分子克隆和启动子GUS分析。BBL分离了XCM9.突变体,并进行了初步的基因定位。XJZ参与了双突变体的筛选。KDL和MPR设计了实验并监督了工作。所有作者阅读并批准了最终的手稿。
作者为图像提交的原始文件
以下是作者提交的原始图像文件的链接。
权利和权限
本文在BioMed Central Ltd.的许可下发布了这是一个开放的访问文章,根据Creative Commons归因许可(http://creativeCommons.org/licenses/by/2.0.)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
刘,Y。,YE,W.,Li,B。et al。CCS52A2 / FZR1,一个细胞周期调节器,是拍摄顶端公司维护的必要因素拟南芥蒂利亚纳.BMC植物杂志12,135(2012)。https://doi.org/10.1186/1471-2229-12-135
已收到:
认可的:
发表:
关键字
- 双突变体
- 苗端
- 茎顶端分生组织
- 拍摄分生组织
- 静态中心