- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
桃的独特表达、加工调控及调控网络gydF4y2Ba碧桃gydF4y2Ba) micrornagydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba12gydF4y2Ba、物品编号:gydF4y2Ba149gydF4y2Ba(gydF4y2Ba2012gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
近年来,MicroRNAs (miRNAs)成为植物中重要的基因调控因子。mirna及其靶标已被广泛研究gydF4y2Ba拟南芥gydF4y2Ba和米饭。然而,对桃中mirna及其靶基因的表征所知相对较少。gydF4y2Ba碧桃gydF4y2Ba),这是一种具有独特发育程序的复杂作物。gydF4y2Ba
结果gydF4y2Ba
我们进行了小RNA深度测序,鉴定了47个桃子特异性和47个已知的具有不同表达模式的mirna或家族。这些鉴定出的mirna总共针对80个基因,其中许多是以前没有报道过的。和模式植物系统一样,桃子也有这三种中的两种gydF4y2Ba反式gydF4y2Ba-作用siRNA生物发生途径具有相似的机制特征和靶向特异性。桃子特有的三个mirna共同靶向49gydF4y2BaMYBgydF4y2Ba其中19个已知调控苯丙素代谢,这是与果核硬化和果实颜色发育相关的关键途径,突出了mirna在桃子果实发育和成熟调控中的关键作用。我们还发现,大多数miRNA在不同组织中受到不同的调节,部分原因是miRNA前体加工的差异。高达16%的桃子特异性mirna以组织特异性的方式与它们的前体进行差异处理,这在植物细胞中很少观察到。在桃中,miRNA前体加工活性似乎不与其转录活性偶联,而是独立起作用。gydF4y2Ba
结论gydF4y2Ba
总的来说,这些数据表征了桃子miRNA的独特表达模式和加工调控,并证明了一个复杂的、多层次的miRNA调控网络的存在,该网络能够针对各种各样的生物学功能,包括在桃子果实发育中起多方面时空作用的苯丙素通路。gydF4y2Ba
背景gydF4y2Ba
植物通过多种机制调节基因表达以确保正常发育并对生物和非生物信号做出适当反应。一种调节机制涉及内源性小RNA (sRNA)分子,长度为20~ 24nt [gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba],它通过沉默基因表达来起作用。在植物中,sRNAs根据其生物发生机制进行分类,包括microRNAs (miRNAs)、异色sirna (hc- sirna)、gydF4y2Ba反式gydF4y2Ba-作用sirna (tasiRNAs)和天然反义sirna (nat- sirna) [gydF4y2Ba1gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba- - - - - -gydF4y2Ba6gydF4y2Ba]。TasiRNA的生物发生gydF4y2Ba助教gydF4y2Ba基因座取决于mirna对其转录物的定向切割[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba]和三种tasiRNA通路的特征gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba9gydF4y2Ba]。尽管mirna只占sRNA群体的一小部分[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba], mirna引导的转录后基因调控是最保守、最具特征的基因调控机制之一[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba12gydF4y2Ba]。越来越多的证据表明,mirna负调控其靶基因,这些靶基因在广泛的生物过程中发挥作用,包括器官发生、信号转导和应激反应[qh]gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba]。gydF4y2Ba
miRNA来源于约70个碱基的前体序列,通常形成一个21 bp的双链,具有保守的茎和可变环,切除后产生成熟的miRNA。21 bp序列匹配一个或多个裂解目标序列[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba13gydF4y2Ba]。mirna最初是通过生物信息学预测的直接克隆或相对较小的cDNA文库的Sanger测序来鉴定的[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba]。深度测序技术的应用大大加快了植物miRNA鉴定的步伐。除了…之外gydF4y2Ba拟南芥gydF4y2Ba而大米[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba17gydF4y2Ba],已经在许多其他植物物种中发现了mirna,包括杨树[gydF4y2Ba18gydF4y2Ba],番茄[gydF4y2Ba19gydF4y2Ba],玉米[gydF4y2Ba20.gydF4y2Ba],葡萄[gydF4y2Ba21gydF4y2Ba],花生[gydF4y2Ba22gydF4y2Ba]和大豆[gydF4y2Ba23gydF4y2Ba]。比较分析表明,一些miRNA家族在所有植物物种中高度保守,而另一些miRNA家族已经分化和进化,产生了丰富的家族和物种特异性miRNA [gydF4y2Ba10gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba]。这些动态和进化的mirna可以作为植物改良和新性状选择的驱动力。gydF4y2Ba
桃子(gydF4y2Ba碧桃gydF4y2Ba)是蔷薇科基因组学研究的模式种,蔷薇科包括许多经济上重要的果树,如苹果、樱桃和李子。它有一个相对较小且注释良好的基因组(约230 Mb),二倍体,并且有许多EST序列。桃有许多独特的生物学方面,在模式生物中不常见,例如在树开花结果之前有3-5年的幼嫩期[gydF4y2Ba26gydF4y2Ba]。此外,作为温带植物,繁殖周期为一年,在前一个夏天开始花蕾。它们在秋季因寒冷的天气和/或较短的光照周期而进入休眠状态,并在寒冷刺激的季节性积累下继续发育,在春季开花[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba]。桃果的另一个显著特点是相对于gydF4y2Ba拟南芥gydF4y2Ba是果肉的形成,种子周围有硬化的内果皮或果核。果核的形成与果实的发育密切协调[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba]。最后,桃子可以在果园里不断变化的条件下生产几十年。可以想象,所有这些发展计划都需要一系列复杂的调控网络,其中涉及许多参与者,可能包括mirna。gydF4y2Ba
最近,张gydF4y2Ba等gydF4y2Ba。[gydF4y2Ba31gydF4y2Ba]通过计算鉴定了22个miRNA,并对7个保守miRNA家族的miRNA进行了实验验证,从而开始了对桃子miRNA的探索。我们想知道桃子是否进化出了新的mirna,以适应其潜在的新发育和生长,以及它们的靶标是什么。为了解决这个问题,我们通过深度测序、计算预测和分子方法对来自不同组织的桃子mirna进行了全面分析。我们能够鉴定出新的和保守的桃子mirna及其靶标。大多数mirna表现出组织特异性表达,其中16%被发现在转录后水平受到调节。此外,桃子保存了三种中的两种gydF4y2Ba反式gydF4y2Ba-作用siRNA途径,我们确定了其他蛋白质编码转录物作为tasiRNA生物发生位点。gydF4y2Ba
结果gydF4y2Ba
桃的sRNA群体gydF4y2Ba
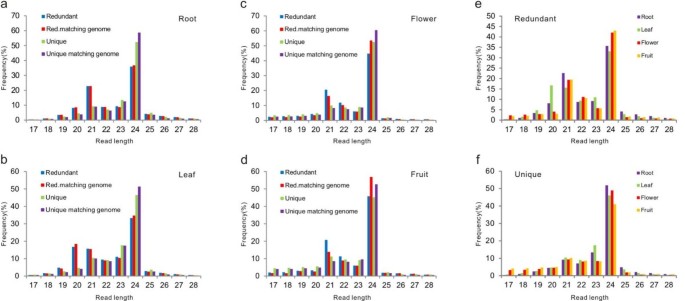
由桃根、桃叶、桃花和桃果组成的4个cDNA文库获得了5000万个高质量的reads。在1000万个unique reads中,范围在15- 31-nt之间,70%与桃基因组中至少一个位点完全匹配(peach genome V1.0 scaffold;gydF4y2Bahttp://www.rosaceae.org/peach/genomegydF4y2Ba)。这些读取将用于进一步分析(附加文件gydF4y2Ba1gydF4y2Ba:表1)。20~24-nt sRNAs占鉴定到的桃树sRNAs的90%以上,其中24-nt sRNAs是所有组织中最丰富的一类sRNAs(图2)gydF4y2Ba1gydF4y2Ba模拟)。多余的24-nt sRNAs在花和混合果中比在根和叶中更丰富,多余的21-nt sRNAs在根中比在其他组织中表达得更高(图2)gydF4y2Ba1gydF4y2Bae)。值得注意的是,在所有组织中,特别是在根中,独特的24-nt sRNAs的表达量远高于21-nt类(图2)gydF4y2Ba1gydF4y2Baf)。gydF4y2Ba
已知miRNA家族及其在桃中的表达gydF4y2Ba
为了鉴定桃子中已知的miRNA家族,我们将所有的sRNA序列与miRBase (release 18)进行blast。共鉴定出258个独特的sRNA序列(20~22 nt),属于23个miRNA家族,在被子植物和针叶植物谱系中都是保守的[j]。gydF4y2Ba25gydF4y2Ba],在本研究中被称为保守的mirna。这些保守的mirna在表达水平上差异很大gydF4y2Ba2gydF4y2Ba表2)。此外,大多数保守的miRNA家族在根、叶、花和混合果组织中表现出差异表达。另外83个miRNA序列属于24个miRNA家族(附加文件gydF4y2Ba3.gydF4y2Ba:表S3)在至少一个植物物种或科中已被鉴定和报告的[gydF4y2Ba10gydF4y2Ba]。在这项工作中,这些被称为不太保守的mirna。在24个不太保守的miRNA家族中,有7个家族可以鉴定出典型的预测茎环结构(附加文件)gydF4y2Ba4gydF4y2Ba表S4,附加文件gydF4y2Ba5gydF4y2Ba:图S1)。总体而言,除miR535外,所有不太保守的mirna与保守的mirna相比表达水平相对较低,并且它们与保守的mirna一样,在组织中表现出差异表达(附加文件)gydF4y2Ba3.gydF4y2Ba表S3)。gydF4y2Ba
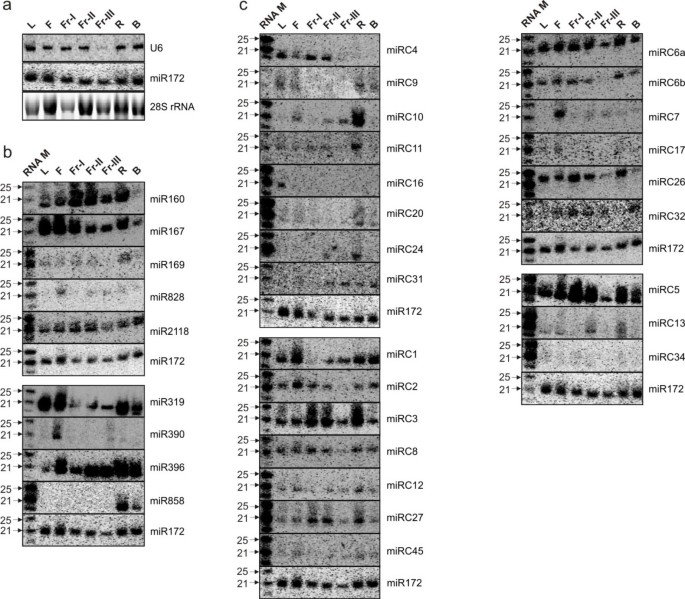
利用miR172作为标准,随机选取保守和不太保守的mirna子集进行RNA印迹分析,以验证深度测序的表达数据(图2)gydF4y2Ba2gydF4y2Baa).保守的mirna, miR160, miR167, miR169, miR319, miR390和miR396,以及不太保守的mirna, miR828, miR858和miR2118的组织特异性表达模式(图2)gydF4y2Ba2gydF4y2Bab)。gydF4y2Ba
miRNA表达的RNA印迹分析。gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba)用正态化凝胶加载的三个分子的表达谱来确定在七个不同的RNA样品中表达最均匀的一个。在本研究的所有RNA印迹中,我们选择MiR172作为负载对照,而不是桃子U6,因为在这些实验中,U6在成熟果实组织中的表达水平要低得多。(gydF4y2BabgydF4y2Ba-gydF4y2BacgydF4y2Ba)在不同的桃组织中选定的已知的和桃子特异性mirna的表达。对同一膜的杂交结果进行分组。从每个组织中分离总RNA 25 μg,转移到尼龙膜上,用γ进行杂交gydF4y2Ba32gydF4y2Bap标记的寡核苷酸探针与RNA标记序列互补,并与指示的miRNA或基因序列一起使用。对于所示的所有斑点,L表示叶子;F,花;fr - 1,开花后19天(DAB)果实;Fr-II, 40 DAB时的果实;Fr-III,果实在82 DAB;R,根;B,树皮。gydF4y2Ba
Peach-specific micrornagydF4y2Ba
在排除已知mirna和其他非编码rna同源的sRNA reads后,选择剩余的20~22 nt sRNA reads进行二级结构预测。那些具有典型茎环结构和序列特异性(>75%的reads映射到独特位点)的mirna被认为是假定的新mirna(附加文件gydF4y2Ba5gydF4y2Ba:图S1)。共鉴定出134个位点的47个srna。其中29个sRNAs被鉴定为新的桃miRNAs,其余18个未检测到星链的sRNAs被归类为候选桃miRNAs(表1)gydF4y2Ba1gydF4y2Ba和附加文件gydF4y2Ba6gydF4y2Ba表5)。总的来说,我们将它们称为桃子特异性mirna,因为它们目前只在桃子中被发现。在47个桃子特异性mirna中,29个为21-nt, 17个为22-nt, 1个为20-nt(表2)gydF4y2Ba1gydF4y2Ba)。38个mirna是从单个位点转录而来,其余9个与2至15个位点相匹配。大约67%的桃子特异性mirna定位于基因组支架的正链,而只有33%的mirna定位于反义链(附加文件)gydF4y2Ba6gydF4y2Ba表5)。gydF4y2Ba
通过sRNA-seq和RNA blot分析和比较所有桃子特异性mirna的表达。总体而言,桃树特异性mirna表达水平较低,且在不同组织中表达水平不同(表2)gydF4y2Ba1gydF4y2Ba和图gydF4y2Ba2gydF4y2Bac)。我们通过RNA印迹分析检测了47种桃子特异性mirna中的24种的信号,这些信号通常与miRC1和miRC7的每百万读数(rpm)值相关,但也有一些例外(图1)gydF4y2Ba2gydF4y2Bac)。gydF4y2Ba
桃miRNA前体及组织发育特异性差异加工的检测gydF4y2Ba
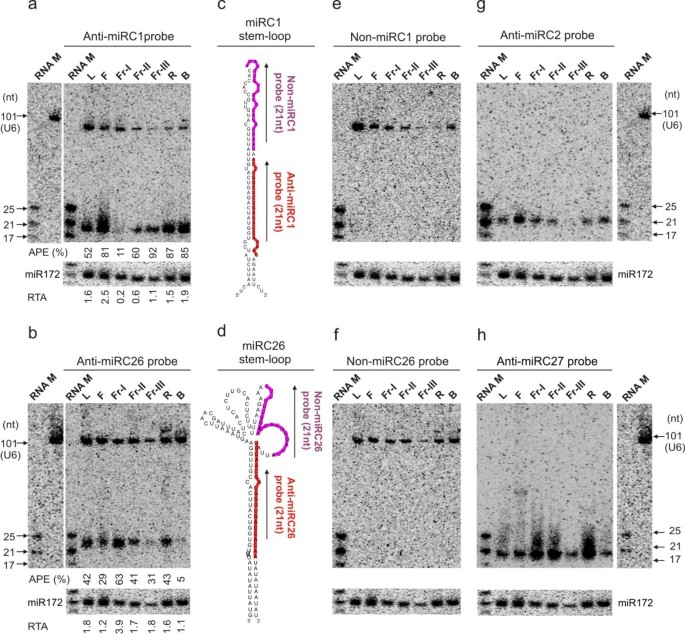
在植物中,miRNA的转录和加工似乎是紧密耦合的,因为转录本立即被加工[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba]。这似乎适用于我们分析的大多数桃子mirna。然而,在9种mirna的情况下,miRC1、miRC9、miRC11、miRC14、miRC16、miRC17、miRC26、miRC31和miRC34(图2)gydF4y2Ba3.gydF4y2Baa、b和附加文件gydF4y2Ba7gydF4y2Ba:图S2)通过RNA印迹分析检测到两个片段;一个对应于预计的21~22 nt的miRNA种,另一个对应于90 ~ 130 nt大小的RNA种,这是大多数miRNA前体的预测大小范围。为了评估这些大片段是否为miRNA前体,我们设计了两个21-nt寡核苷酸探针(指定为Non-miRC1和Non-miRC26),仅与所选miRC1和miRC26茎环内的非miRNA序列互补(图2)gydF4y2Ba3.gydF4y2Bac, d)。这些探针应该只检测大片段,因为它们与miRNA序列不互补。实际上,每个探针只检测到大片段(图2)gydF4y2Ba3.gydF4y2Bae、f)。用另一个miRNA重新探测相同的印迹未检测到大片段,表明它不是伪影(图2)gydF4y2Ba3.gydF4y2Bag h)。因此,检测到的大片段可能代表miRNA转录体前体。gydF4y2Ba
差异miRNA加工和表达的检测。gydF4y2Ba如图所示制备了两组膜gydF4y2Ba2gydF4y2Ba。每个膜依次用标记的RNA标记物(RNA M)作为大小标准,探针与显示未完成加工的特定miRNA互补,21-nt区域紧挨着特定miRNA序列,第二个显示完成加工的miRNA,然后U6作为标准。MiR172作为上样对照。(gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2Ba) miRC1和miRC26分别表达,显示加工不完全。根据对照RNA miR172的表达,计算处理效率,并在印迹图中显示。APE,任意处理效率(%)=小碎片强度(SFI)*100/[大碎片强度(LFI) + SFI之和]。RTA,相对转录活性= (LFI + SFI)/对照RNA片段强度(CFI)。(gydF4y2BacgydF4y2Ba-gydF4y2BadgydF4y2Ba)具体探测的序列区域示意图如图所示。(gydF4y2BaegydF4y2Ba-gydF4y2BafgydF4y2Ba)前体仅显示miRC1和miRC26的表达。(gydF4y2BaggydF4y2Ba-gydF4y2BahgydF4y2Ba) miRC2和miRC27的表达分别显示在同一印迹上检测到完整的处理。对于所示的所有斑点,L表示叶子;F,花;fr - 1,开花后19天(DAB)果实;Fr-II, 40 DAB时的果实;Fr-III,果实在82 DAB;R,根;B,树皮。gydF4y2Ba
大碎片强度和小碎片强度的比较揭示了它们在不同组织中的相对比例。例如,miRC26在幼果(fr - 1)中比其前体更丰富,而在树皮组织中则相反(图1)gydF4y2Ba3.gydF4y2Bab).这些发现表明这些mirna在不同的组织中被不同地加工。为了比较miRNA的处理效率,我们量化了小片段和大片段信号强度,并计算了小片段强度相对于总片段强度的百分比(APE,任意处理效率),如图底部面板所示gydF4y2Ba3.gydF4y2Baa、b。miRC1和miRC26的APE在不同组织中都显示出很大的差异,因为超过80%的转录前体在花(F)、根(R)和树皮(B)中被加工,而miRC1只有11%在幼果(fr - 1)中被加工(图1)gydF4y2Ba3.gydF4y2Baa)。同样,63%的miRC26前体在幼果中被加工(fr - 1),而只有5%的miRC26前体在树皮组织中加工(图1)gydF4y2Ba3.gydF4y2Bab).除了组织特异性调控外,miRNA加工也受到果实发育阶段的影响,在从幼果(Fr-I)到成熟果实(Fr-III)的发育过程中,miRC1的APE从11%增加到92%(图3)gydF4y2Ba3.gydF4y2Baa)而miRC26则呈现相反的趋势(图2)gydF4y2Ba3.gydF4y2Bab).显然,这些桃子mirna的表达以组织特异性和发育依赖性的方式受到差异加工调控。gydF4y2Ba
植物中的mirna主要在转录水平上受到调控。我们以miR172为加载对照,通过miRC1和miRC26的相对转录活性(RTA)来量化组织中特定mirna的转录变化。其中,miRC1的花RTA最高(F),幼果RTA最低(fr - 1),而miRC26的幼果RTA最高(fr - 1),树皮RTA最低(B)(图2)gydF4y2Ba3.gydF4y2Baa、b)。MiRNA转录和加工在一些组织中具有相似的活性,但在其他组织中却不同,这表明这两种调节机制可能是解耦的。gydF4y2Ba
桃源miRNA靶点的鉴定gydF4y2Ba
通过对桃子降解组文库的测序,我们确定了64个已知miRNA的靶基因,发现其中大多数是大量保守的miRNA靶基因(表2)gydF4y2Ba2gydF4y2Ba)。在15个保守miRNA家族中鉴定出35个靶基因,在9个不太保守的miRNA家族中鉴定出29个靶基因。然后根据其丰度将目标转录本分为5类(0-4)(表1)gydF4y2Ba2gydF4y2Ba和表gydF4y2Ba3.gydF4y2Ba) [gydF4y2Ba34gydF4y2Ba]。保守mirna的10个靶标属于最丰富的第0类,一半的靶标属于第2类。对于一些保守的miRNA家族,无论相应miRNA的表达水平是高还是低,我们都无法鉴定出任何靶标,这表明miRNA的表达水平与其靶转录物的切割效率之间没有明显的相关性。gydF4y2Ba
大量鉴定的靶点是转录因子基因家族的成员,包括SPL、MYB、ARF、NAC和GRF,而其他靶点则与sRNA结合(AGO)、生长素信号传导(TIR/AFB)、硫酸盐转运(AST)和氧化还原反应(LAC和ARPN)有关(表1)gydF4y2Ba2gydF4y2Ba)。对于具有多个保守靶标转录本的给定miRNA,降解物中每个靶标的频率各不相同。更重要的是,至少两个保守的mirna,即miR396和miR408,也被发现了新的靶点。miR396靶点编码一个鸟嘌呤核苷酸交换因子,两个miR408靶点编码一个硒结合蛋白和一个d型细胞周期蛋白(表1)gydF4y2Ba2gydF4y2Ba)。我们还确定了桃中9个不太保守的mirna的单个或多个靶标(表1)gydF4y2Ba2gydF4y2Ba)。miR828和miR858都靶向MYB家族基因。MiR828可以切割3个gydF4y2BaMYBgydF4y2Ba而miR858针对的是18个基因,它们有一个共同的目标。此外,miR858被发现靶向另外两个编码过氧化物酶体3-酮酰基辅酶a硫酶的基因,这两个基因在脂肪酸代谢中起关键作用[gydF4y2Ba35gydF4y2Ba)(表gydF4y2Ba2gydF4y2Ba)。值得注意的是,miR858在本研究中发现的基因靶点最多。gydF4y2Ba
12种桃子特异性mirna共鉴定出16个靶点(表2)gydF4y2Ba3.gydF4y2Ba)。在确定的目标中,只有一个属于0类;8个为第2类,7个为第3或第4类(见表)gydF4y2Ba3.gydF4y2Ba)。MiRC6a和miRC6b共有三个基因靶标中的两个,而miRC3和miRC5靶向相同的基因转录物。MiRC12和miRC13针对的是不同的基因,而miRC16和miRC29针对的是来自同一基因家族的两个基因。另外四个桃子特异性mirna被发现针对单个基因。鉴定的16个基因靶点编码多种蛋白质,包括锌指蛋白、NBS-LRR类抗病蛋白、含PPR蛋白、蛋白激酶、far1相关蛋白、RNA结合蛋白、过氧化氢酶和春化相关蛋白(表1)gydF4y2Ba3.gydF4y2Ba),这表明这些桃子特异性mirna可能参与了广泛的生物过程或代谢途径的调节。gydF4y2Ba
反式gydF4y2Ba-作用于桃子的sirnagydF4y2Ba
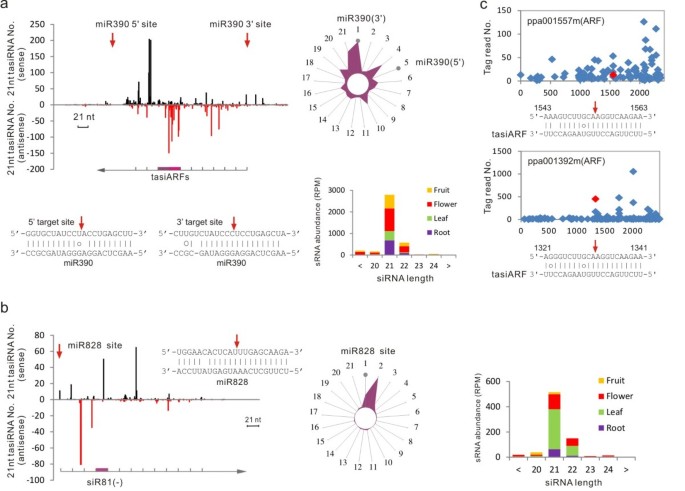
在本研究中,我们发现miR390-gydF4y2BaTAS3gydF4y2Ba和miR828 -gydF4y2BaTAS4gydF4y2BatasiRNA通路在桃子中是保守的,miR390和miR828的鉴定证明了这一点。gydF4y2BaTAS3gydF4y2Ba和gydF4y2BaTAS4gydF4y2Ba转录本和21-nt sirna的产生gydF4y2BaTAS3gydF4y2Ba和gydF4y2BaTAS4gydF4y2Ba成绩单(图gydF4y2Ba4gydF4y2Baa、b)。RNA印迹分析显示,miR390和miR828在桃的各种组织中都有可检测到的表达(图2)gydF4y2Ba2gydF4y2Bab). MiR390的裂解靶点gydF4y2BaTAS3gydF4y2Baortholog (EST: AJ875750)定义为gydF4y2BaPpTAS3gydF4y2Ba)在桃中被鉴定出来,与其具有相似的双miR390靶点gydF4y2Ba拟南芥gydF4y2Ba同行。映射的sRNA读取gydF4y2BaPpTAS3gydF4y2Ba在这些双重靶点之间定义了类似的tasiRNA生成区域和模式。大部分21-nt tasirna在花组织中产生(图2)gydF4y2Ba4gydF4y2Baa),与miR390花特异性表达相关(图2)gydF4y2Ba2gydF4y2Bab).在这些siRNA群体中,两个siRNA与所鉴定的siRNA具有> 95%的序列一致性gydF4y2Ba拟南芥gydF4y2BatasiARFs,它们被证明是靶向的gydF4y2BaAtARF2gydF4y2BaAtARF3gydF4y2Ba,gydF4y2BaAtARF4gydF4y2Ba对生长素信号产生负面调节gydF4y2Ba36gydF4y2Ba]。我们的降解分析还表明,这两种桃tasiARFs靶向两个ARF转录因子(ppa001557m和ppa001392m)(图2)gydF4y2Ba4gydF4y2BaC),表明桃子的功能保存。gydF4y2Ba
桃的两种反式siRNA生物发生途径。gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba) miR390-gydF4y2BaTAS3gydF4y2Ba生物发生途径,显示了miR390的双重靶点gydF4y2BaPpTAS3gydF4y2Ba成绩单用红色箭头表示。绘制的sRNA序列数量gydF4y2BaPpTAS3gydF4y2Ba绘制了正义链(黑线)和反义链(红线)的转录本,两个保守的tasiarf的位置如下所示。相位径向图表示在这旁边。径向图的每条辐条表示21个相位寄存器中的1个,映射到该寄存器的srna总数表示与中心的距离。灰点表示由5 '和3 '切割位点的21-nt加工预测的特定寄存器。分相sirna在果实、花、叶和根中的组织特异性积累情况如下图所示。(gydF4y2BabgydF4y2Ba) miR828-gydF4y2BaTAS4gydF4y2Ba生物发生途径,显示miR828切割位点在gydF4y2BaPpTAS4gydF4y2Ba转录本在5'端用红色箭头表示。分相图和分相sirna的组织特异性积累如图(a)所示。gydF4y2BacgydF4y2Ba)对两个桃的卵裂进行降解确认gydF4y2Ba东盟地区论坛gydF4y2Ba成绩单,gydF4y2BaTAS3gydF4y2Ba使用t图,红色菱形和箭头表示解理位点。gydF4y2Ba
一个桃子gydF4y2BaTAS4gydF4y2Ba正交,定义为gydF4y2BaPpTAS4gydF4y2Ba,也被确认。其转录物在5'端有一个miR828特征结合位点,具有类似的siRNA生物发生模式(图2)gydF4y2Ba4gydF4y2Bab)和gydF4y2BaPpTAS4gydF4y2BasiRNA优先在叶片和花中产生(图2)gydF4y2Ba4gydF4y2Bab)gydF4y2BaTAS4gydF4y2Ba派生siRNAs,gydF4y2BaTAS4gydF4y2Ba-siRNA(−81),具有广泛的序列一致性gydF4y2Ba拟南芥gydF4y2Ba对应物已经被证明可以瞄准至少三个目标gydF4y2BaMYBgydF4y2BaS上调花青素的产生[gydF4y2Ba37gydF4y2Ba]。我们的降解分析没有发现桃子的任何目标gydF4y2BaTAS4gydF4y2Ba核(81−),但是gydF4y2Ba在网上gydF4y2Ba分析预测至少有两个gydF4y2BaMYBgydF4y2BaS (ppa024617m和ppa022808m)作为桃的目标gydF4y2BaTAS4gydF4y2Ba核(81−)。这些预测gydF4y2BaMYBgydF4y2Ba目标是密切相关的gydF4y2BaAtMYB113gydF4y2Ba目标是gydF4y2Ba拟南芥TAS4gydF4y2Ba核(81−)(gydF4y2Ba38gydF4y2Ba]。gydF4y2Ba
桃MYB转录因子的多miRNA靶向研究gydF4y2Ba
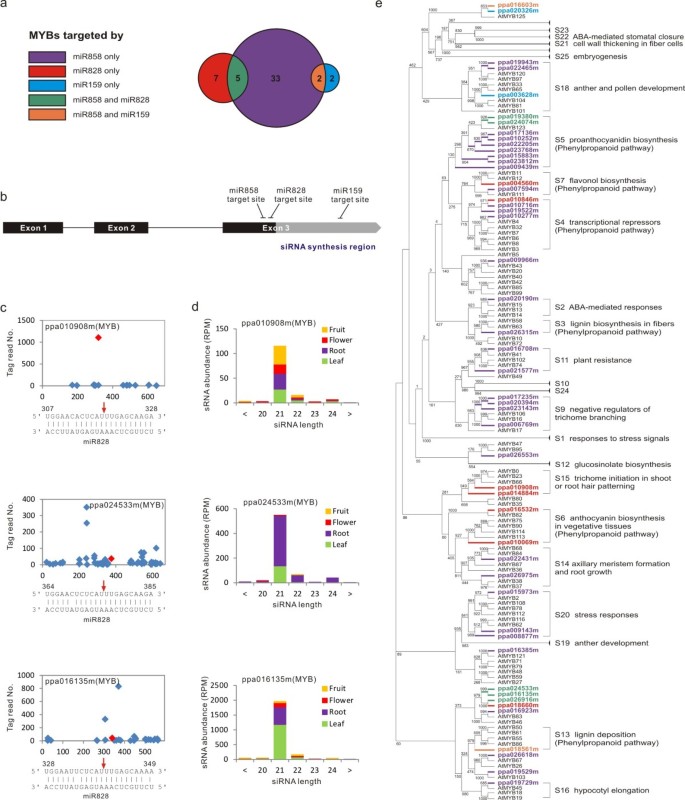
在gydF4y2Ba拟南芥gydF4y2Ba, miR159, miR828和miR858至少靶向13个gydF4y2BaMYBgydF4y2Ba基因(gydF4y2Ba39gydF4y2Ba]。我们的降解数据发现这三个mirna共同靶向19gydF4y2BaMYBgydF4y2Ba在桃里gydF4y2Ba2gydF4y2Ba)。然而,考虑到miRNA靶数被低估,由于靶基因在特定组织中不表达或低表达,很可能更多gydF4y2BaMYBgydF4y2Ba基因靶标是存在的。因此,我们执行了gydF4y2Ba在网上gydF4y2Ba目标预测并确定了另外三个,九个和24个gydF4y2BaMYBgydF4y2BamiR159、miR828和miR858基因的同源性差异均小于5。这样,共有49个gydF4y2BaMYBgydF4y2Ba目标基因为miR159 4个,miR828 12个,miR858 40个。MiR858共享5个目标gydF4y2BaMYBgydF4y2Ba5例携带miR828, 2例携带miR159(图)gydF4y2Ba5gydF4y2Ba)。最gydF4y2BaMYBgydF4y2Ba我们确认或预测作为miRNA靶点的基因属于R2R3-MYB类,具有相似的基因组组织,具有保守的5'区和3'端的分化区(图2)gydF4y2Ba5gydF4y2Bab).进一步分析发现,miR828和miR858的靶点相距12个核苷酸,位于第3外显子的保守区,而miR159的靶点位于共靶点的发散区gydF4y2BaMYBgydF4y2Ba年代(图gydF4y2Ba5gydF4y2Bab).此外,我们发现mir828切割了三个gydF4y2BaMYBgydF4y2Ba进行了21-nt siRNA的生物生成(图2)gydF4y2Ba5gydF4y2Bac)gydF4y2BaMYBgydF4y2Ba转录本具有相似的miR828切割位置、tasiRNA生成区域和模式、内含子-外显子结构和序列保守性(图2)gydF4y2Ba5gydF4y2Bab).产生的tasirna表现出截然不同的组织特异性;ppa024533m来源的tasirna主要分布在根中,ppa016135m来源的tasirna主要分布在叶中,ppa010908m来源的tasirna主要分布在果实中(图2)gydF4y2Ba5gydF4y2Bad)。gydF4y2Ba
3个mirna靶向49个桃myb。gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba例:人们发现gydF4y2BaMYBgydF4y2Ba其中,桃树miR159、miR828和miR858可作为靶点,其中一些可被一种以上的mirna作为靶点。MiR858靶向其中的大多数gydF4y2BaMYBgydF4y2Ba年代。gydF4y2BabgydF4y2Ba) R2R3的基因组组织gydF4y2BaMYBgydF4y2BamiR159、miR828和miR858的靶位定位,以及潜在的siRNA生成区域。高度保守序列用黑色区域表示,发散序列用灰色框表示gydF4y2BaMYBgydF4y2Ba编码区域。(gydF4y2BacgydF4y2Ba)降解确认miR828切割在三个gydF4y2BaMYBgydF4y2Ba记录。红色菱形和箭头表示解理位置。(gydF4y2BadgydF4y2Ba) mir828裂解产生的阶段性sirna的组织特异性积累gydF4y2BaMYBgydF4y2Ba转录本显示,如图所示gydF4y2Ba4gydF4y2Ba。(gydF4y2BaegydF4y2Bamirna靶向桃树R2R3基因功能关系的系统发育分析gydF4y2BaMYBgydF4y2BaS和特征gydF4y2Ba拟南芥gydF4y2BaR2R3gydF4y2BaMYBgydF4y2BaS根据以前的工作[gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba]。gydF4y2BaMYBgydF4y2Ba特定miRNA靶向的基因以相同的颜色区分,如(a)所示。gydF4y2Ba
大量的R2R3gydF4y2BaMYBgydF4y2Ba由25个亚群组成的基因在gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba]。因此,我们对所有靶向mirna的桃子进行了系统发育分析gydF4y2BaMYBgydF4y2Ba发现了四个mir159靶向的基因gydF4y2BaMYBgydF4y2BaS,一个进去了gydF4y2BaMYBgydF4y2Ba第18亚群-花药和花粉发育;miR858在13亚群中的另一个共同靶点-木质素沉积,粘液产生和气孔孔径[qh]gydF4y2Ba39gydF4y2Ba],剩下的两个没有分组。十二miR828-targetedgydF4y2BaMYBgydF4y2Bas分为5个亚群,即S4、S5、S6、S7 -花青素生物合成和S15 -毛状体起始(图5)gydF4y2Ba5gydF4y2Bae)gydF4y2BaMYBsgydF4y2BamiR858靶向的植物可分为11个亚群,这些亚群调节多种生物过程,包括器官形态发生、木质素化、花青素生物合成和植物对逆境的反应gydF4y2Ba拟南芥gydF4y2Ba(图gydF4y2Ba5gydF4y2Bae).因此,与miR159或miR828相比,miR858可能在桃子中发挥更基础、更多样化的作用。有趣的是,在49个gydF4y2BaMYBgydF4y2Ba5、19个与苯丙素代谢有关,而苯丙素代谢是桃果核硬化和果实颜色发育的关键途径,这表明这些mirna在桃果的发育和成熟中起着重要的调节作用。gydF4y2Ba
讨论gydF4y2Ba
桃mirna及其靶标具有多种生物学意义gydF4y2Ba
在植物中,mirna既高度保守又快速进化,这些特征在各种谱系中都有表征[qh]gydF4y2Ba25gydF4y2Ba]。虽然对模式植物进行了广泛的研究,但对具有农业和园艺意义的植物物种(如桃子和苹果)的mirna的表征和功能分析知之甚少[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba]。较早的一项研究报道了桃子中7个保守miRNA家族的8个miRNA的计算和实验鉴定[gydF4y2Ba31gydF4y2Ba],与在其他植物物种中发现的相比并不广泛[gydF4y2Ba18gydF4y2Ba- - - - - -gydF4y2Ba21gydF4y2Ba]。在这里,我们提供了桃子不同组织中产生的mirna的综合分析,并通过sRNA-seq和RNA blot分析表征了它们的表达模式。大多数鉴定到的桃mirna被发现是组织特异性的,正如之前在其他植物物种中观察到的那样[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba19gydF4y2Ba- - - - - -gydF4y2Ba21gydF4y2Ba]。许多已知的mirna靶点,主要是转录因子,控制着与叶极性、侧根形成、开花、代谢和胁迫反应相关的多种生理过程和遗传程序[qh]gydF4y2Ba36gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba]。在本研究中,桃mirna的大多数靶点都有之前在其他物种中发现的对应物[gydF4y2Ba18gydF4y2Ba- - - - - -gydF4y2Ba23gydF4y2Ba]。例如,在桃中鉴定的两个miR160基因靶点与在桃中鉴定的miR160基因靶点同源gydF4y2Ba拟南芥gydF4y2Ba编码两种生长素反应因子(ARFs),作为生长素信号的抑制因子,而miR167在桃中的靶标是同源的gydF4y2BaAtARF6gydF4y2Ba它是同一途径中的激活剂[gydF4y2Ba36gydF4y2Ba]。桃tasiARFs的目标基因是编码生长素信号抑制因子gydF4y2Ba拟南芥gydF4y2Ba同行。此外,靶向TIR1/AFB2生长素受体(TAAR)分支的miR393是生长素信号传导的另一类关键参与者[gydF4y2Ba45gydF4y2Ba在桃子中也发现了三个TAAR同源物。显然,miRNA-和tasiarf介导的生长素信号通路调控先前表征gydF4y2Ba拟南芥gydF4y2Ba也保存在桃树中。然而,一些已鉴定的已知mirna被发现在桃子中具有额外的或新的基因靶标(表1)gydF4y2Ba2gydF4y2Ba)。例如,已知靶向一个保守的生长调节因子基因家族的miR396也靶向一个参与光敏色素信号传导的rho鸟酰核苷酸交换因子。同样,miR408除了靶向保守的铜离子结合蛋白外,还可以靶向编码硒结合蛋白和d型细胞周期蛋白的两个基因,分别调控植物的防御和生长[gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba]。这些结果表明,一些已知的mirna在桃中获得了新的靶点或扩展了它们的调控功能。gydF4y2Ba
我们的工作发现了47个桃子特异性mirna,它们在不同组织和/或发育阶段受到差异调节(图2)gydF4y2Ba2gydF4y2BaC)并针对多种具有广泛生物学功能的基因。例如,miRC6a/b靶向两个编码五肽(PPR)重复序列蛋白的基因,这些蛋白参与线粒体和叶绿体内RNA编辑、剪接和翻译[gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba]。MiRC3和miRC5都靶向相同的NBS-LRR抗病蛋白[gydF4y2Ba50gydF4y2Ba]。其他桃子特异性mirna被发现靶向与转录/翻译起始、蛋白激酶和酯酶/脂肪酶/硫酯酶家族蛋白相关的基因。发现MiRC45靶向转录本编码gydF4y2Ba贵宾gydF4y2Ba(gydF4y2Ba春化独立gydF4y2Ba),一种调节体内春化的基因gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba]。我们发现了47个桃子特异性mirna中的12个靶标,这就提出了一个问题,即这些剩余的mirna是无功能的,还是通过翻译抑制来调节基因表达,而不是直接切割目标mrna [gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba]。可以想象,进一步提高降解分析的灵敏度,并详细研究这些miRNAs在桃子或转基因植物中可能的翻译抑制功能,将提供这些miRNAs在桃子中是否有功能的信息。gydF4y2Ba
桃miRNA前体的差异加工gydF4y2Ba
在动物中,许多具有不同时空表达模式的mirna受到转录和/或转录后调控的调节[gydF4y2Ba55gydF4y2Ba]。然而,在植物中,miRNA转录本被认为通过细胞核内的加工机制(DCL1、HYL1或SE)立即加工成成熟的miRNA,因此转录前体加工与转录[gydF4y2Ba6gydF4y2Ba]。然而,最近在玉米中的一项研究表明,在特定组织中,转录与两种mirna的转录前体加工并不密切相关。在玉米茎尖分生组织的顶端,发现了大量miR166a转录物前体的积累,但没有发现成熟的miR166a [gydF4y2Ba56gydF4y2Ba]。通过RT-PCR在茎尖分生组织的L1层而非L2层中观察到miR390的转录前体,而在相同的L1层和L2层中,通过pcr检测发现了相似水平的成熟miR390gydF4y2Ba原位gydF4y2Ba杂交(gydF4y2Ba56gydF4y2Ba]。这些结果表明miR166a和miR390前体在不同的细胞类型或组织中都可以被不同的加工,尽管其他的可能性,包括miRNA的稳定性和流动性,也不能排除[gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba]。在这项研究中,我们检测了9种桃子mirna成熟mirna及其转录前体的差异积累(附加文件)gydF4y2Ba7gydF4y2Ba:图S2)。通过比较所选的两种miRNA (miRC1和miRC26)在组织间的miRNA前体加工效率,我们发现它们的转录前体加工效率在根、树皮、叶、花以及果实发育过程中都存在差异(图2)gydF4y2Ba3.gydF4y2Ba),表明差异加工调节了miRC1和miRC26的表达。我们还发现miRNA转录和前体加工活性之间没有相关性,从而表明这两个过程可能是解耦的。我们对这些较大转录本的检测为差异加工提供了大量证据,尽管仍未得出结论,这可能是桃子特定组织或发育阶段miRNA表达的部分基础。在苹果miRNA鉴定过程中也发现了类似的观察结果,表明这种调节机制可能在水果作物中很常见。gydF4y2Ba
尽管植物中miRNA前体的差异加工机制尚不清楚,但在动物细胞中已经有了miRNA生物发生的特征,其中miRNA生物发生是通过包含dsrna结合蛋白DGCR8和RNase III酶Drosha以及多种辅助蛋白的微处理器复合物将pri-miRNA转录物加工成miRNA前体(pre-miRNA)而启动的[gydF4y2Ba55gydF4y2Ba,gydF4y2Ba58gydF4y2Ba]。经过处理的pre- mirna被输出到细胞质中,并被Dicer蛋白切割成成熟的22-nt mirna。两组蛋白因子利用不同的策略来调节miRNA前体的差异加工已经被确定和表征。第一组因子(SMADs和p53)与微处理器复合体和辅助因子(EWSR1、p68和p72)相互作用,激活或抑制pri-miRNAs的加工[gydF4y2Ba59gydF4y2Ba- - - - - -gydF4y2Ba62gydF4y2Ba]。两组因子(Lin28, hnRNPs, KSRP和TRBP)识别并结合到特定miRNA前体的末端环,以促进特定组织或细胞类型中结合的miRNA前体的加工或降解[gydF4y2Ba63gydF4y2Ba- - - - - -gydF4y2Ba65gydF4y2Ba]。可以想象,在特定组织或发育阶段表达的各种因子可能以相同的方式直接或间接地相互作用,调节桃子特定miRNA前体的加工。我们的研究结果暗示了miRNA前体的普遍差异稳定性,最有可能依赖于DCLs、HYLs、HENs和其他rna结合蛋白的组织特异性作用。gydF4y2Ba
的守恒gydF4y2Ba反式gydF4y2Ba桃中-作用siRNA通路gydF4y2Ba
到目前为止,有四个gydF4y2Ba助教gydF4y2Ba基因家族在gydF4y2Ba拟南芥gydF4y2Ba,其中miR390-gydF4y2BaTAS3gydF4y2Ba和miR828 -gydF4y2BaTAS4gydF4y2Ba途径在植物中是保守的[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba]。在这里我们确定了两者gydF4y2BaTAS3gydF4y2Ba和gydF4y2BaTAS4gydF4y2Ba桃同源物及其对应的触发mirna(图2)gydF4y2Ba4gydF4y2Baa、b)。我们还在裂解体中发现了类似的siRNA生物发生模式gydF4y2BaTAS3gydF4y2Ba和gydF4y2BaTAS4gydF4y2Ba记录。同源的tasiARFs和tasiARFs的鉴定证明了tasiRNA物种是保守的gydF4y2BaTAS4gydF4y2Ba-siRNA(−81)和它们的靶标通过降解分析得到证实(图2)gydF4y2Ba4gydF4y2Bac)和(或)gydF4y2Ba在网上gydF4y2Ba预测。总之,这些数据表明miR390-gydF4y2BaTAS3gydF4y2Ba和miR828 -gydF4y2BaTAS4gydF4y2Ba桃树的生物发生途径和功能至少部分保守。由于生长素的信号传导和调控对桃的多种生物过程,特别是果实的发育和成熟至关重要[gydF4y2Ba66gydF4y2Ba,gydF4y2Ba67gydF4y2Ba), miR390 -gydF4y2BaTAS3gydF4y2Ba特定组织中的tasiARFs可以协调生长素信号,这可能与果实的生长发育直接相关。在gydF4y2Ba拟南芥gydF4y2BaTAS4gydF4y2Ba-siRNA(- 81)已被证明可以靶向基因(gydF4y2BaAtMYB75gydF4y2BaAtMYB90gydF4y2Ba和gydF4y2BaAtMYB113gydF4y2Ba)积极调节花青素的产生[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba38gydF4y2Ba]。的归纳gydF4y2BaAtMYB75gydF4y2Ba花青素的积累激活了miR828,gydF4y2BaTAS4gydF4y2Ba和gydF4y2BaTAS4gydF4y2Ba核(81−)(gydF4y2Ba37gydF4y2Ba]。提出这种反馈调节回路是为了在营养胁迫条件下维持植物组织中适当的花青素水平[gydF4y2Ba38gydF4y2Ba]。这个角色gydF4y2BaTAS4gydF4y2Ba-siRNA(−81)在桃子中也可能很重要,其中花青素的产生与果实颜色直接相关,果实颜色变化很大,被认为是重要的果实品质性状[qh]gydF4y2Ba29gydF4y2Ba,gydF4y2Ba68gydF4y2Ba]。而直接基因的目标是gydF4y2BaTAS4gydF4y2Ba-siRNA(−81)未被降解分析证实;gydF4y2Ba在网上gydF4y2Ba预测显示gydF4y2BaTAS4gydF4y2Ba-siRNA(−81)可以靶向至少两个桃gydF4y2BaMYBgydF4y2BaS高度同源gydF4y2BaAtMYB113gydF4y2Ba。因此,miR828,gydF4y2BaTAS4gydF4y2BaTAS4gydF4y2Ba-siRNA(−81)和靶向gydF4y2BaMYBgydF4y2Ba在桃果实成熟过程中,miR828在成熟果实中检测到表达,而在幼果中检测不到miR828的表达,这进一步支持了这一观点(图2)gydF4y2Ba2gydF4y2Bab)。gydF4y2Ba
mirna介导的桃MYB调控网络及其生物学意义gydF4y2Ba
而gydF4y2BaMYBgydF4y2Ba已知s是其他物种中mirna的靶标[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba38gydF4y2Ba],目标数量有限[gydF4y2Ba39gydF4y2Ba]。桃子至少有49个gydF4y2BaMYBgydF4y2Bas可能被miR159、miR828和miR858靶向gydF4y2Ba5gydF4y2Ba这种扩张可能与专门的发展计划有关,这些计划可能通过特定的gydF4y2BaMYBgydF4y2BaS,包括但不限于协调果石硬化过程的木质素合成和沉积,以及对果实颜色、营养特性和抗病性很重要的类黄酮合成[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba69gydF4y2Ba- - - - - -gydF4y2Ba71gydF4y2Ba]。木质素和类黄酮的生物合成途径是生物化学竞争,从相同的苯基丙烷前体提取。因此,在桃果发育过程中,它们需要紧密协调,以使苯丙素以组织特异性的方式有效代谢[gydF4y2Ba29gydF4y2Ba]。而我们只能在果实发育过程中检测到miR828的表达(图2)gydF4y2Ba2gydF4y2Bab),我们不能排除miR858和miR159的潜在作用,因为它们在果实发育过程中可能具有高度的细胞或组织特异性,或阶段特异性,在本研究中可能会错过它们的表达窗口期。尽管如此,miR858、miR159和miR828在木质素、细胞壁和类黄酮代谢和合成途径中的潜在调节作用为sRNA在协调果实发育中的重要作用提供了证据。gydF4y2Ba
miR858有5个相同的基因gydF4y2BaMYBgydF4y2Ba两个靶向miR828,两个靶向miR159,三个靶向miR828gydF4y2BaMYBgydF4y2Ba这支持了miRNA和siRNA介导的桃沉默强化调控机制进化的观点。同一目标的共同目标gydF4y2BaMYBgydF4y2Ba而miRNA切割后siRNA生物发生则增强了相同的沉默效果。虽然这是两个不相关的生物学事件,但它们实现了相同的目标,执行强烈的响应性调节功能;因此,mirna介导的共靶向也可以使靶标gydF4y2BaMYBgydF4y2BaS需要精细的时空调控。因此,观察到的miR828和miR858在不同组织和果实发育阶段的不同表达模式将调节共靶向gydF4y2BaMYBgydF4y2Ba以精致的时空方式表达,精确调节桃果发育和成熟过程中果核木质化和中果皮和外果皮特异性果实着色的协调。gydF4y2Ba
结论gydF4y2Ba
我们对桃子中的mirna及其潜在靶点进行了表征,以提供一个全面的桃子mirna列表,并揭示其调控功能的潜在范围。我们发现桃具有保守的和物种特异性的miRNAs,它们具有不同的表达模式,并且这些miRNAs可能靶向具有广泛生物学功能的数十个基因。相当多的桃子特异性miRNA前体在不同组织和果实发育过程中受到差异加工,这表明miRNA积累程度在时空上的可能机制。此外,miR390-gydF4y2BaTAS3gydF4y2Ba和miR828 -gydF4y2BaTAS4gydF4y2BasiRNA生物发生途径及其功能在桃树中似乎是保守的;miR828的切割能够激活siRNA的生物发生gydF4y2BaPpTAS4gydF4y2Ba和3个MYB蛋白编码转录本,表明桃子的沉默增强。此外,我们发现miR159、miR828和miR858共同靶向49gydF4y2BaMYBgydF4y2BaS,其中19种已知调节苯丙素代谢,这是参与果核硬化和果实颜色发育的关键途径。总之,我们广泛表征了桃子miRNA的独特表达模式和加工调控,并证明了桃子中存在一个复杂的miRNA调控网络,能够针对多种生物功能。我们的研究结果为揭示桃子miRNA和tasiRNA在基因调控中的复杂作用提供了新的有价值的信息,这将为进一步研究其他作物miRNA和tasiRNA的功能提供有用的信息。gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
采集不同发育阶段(开花后19、40和82 d)的根、皮、叶、花和果实gydF4y2Ba碧桃gydF4y2Ba简历。洛弗尔桃树,种植在阿巴拉契亚水果研究站,科尔尼斯维尔,西弗吉尼亚州。所有样品立即在液氮中冷冻,并在- 80°C保存待用。gydF4y2Ba
RNA制备及深度测序gydF4y2Ba
采用植物RNA纯化试剂(Invitrogen, CA, USA)从桃不同发育阶段的根、叶、花和混合果等4种不同组织中提取总RNA。小RNA和降解物文库构建由华大基因(中国北京基因组研究所)完成。简单地说,从总RNA中分离出18~30-nt的小RNA,并连接到5' RNA适配器和3' RNA适配器上,如前所述[gydF4y2Ba72gydF4y2Ba]。逆转录反应后进行PCR,扩增文库进行凝胶纯化,然后在SOLID系统或Illumina Hiseq 2000平台上测序。gydF4y2Ba
桃降解物库的构建方法如前所述[gydF4y2Ba73gydF4y2Ba],汇集了桃根、叶、花和杂果的总RNA。简而言之,提取poly(A) RNA并连接到5' RNA接头上,产物经RT-PCR消化后连接到3' dsDNA接头上。扩增后的文库经凝胶纯化,在Illumina Hiseq 2000平台上测序。gydF4y2Ba
小RNA文库和降解文库测序数据可在NCBI-GEO注册号:GSE38535下获得。gydF4y2Ba
RNA印迹分析gydF4y2Ba
采用15%变性聚丙烯酰胺凝胶分离叶片、花、开花后19天果实(DAB)、40 DAB、82 DAB、根和树皮的总RNA 25 μg,进行RNA印迹分析。将RNA印迹到Amersham Hybond上gydF4y2BaTMgydF4y2Ba-NX膜(GE Healthcare, Waukesha, WI, USA)和EDC交联(Sigma, St. Louis, MO, USA)。DNA寡核苷酸探针(附加文件gydF4y2Ba8gydF4y2Ba表S6)中与mirna反向互补的部分用γ标记gydF4y2Ba32gydF4y2BaP-ATP使用T4多核苷酸激酶(NEB, Beverly, MA, USA)。MicroRNA Marker Probe (NEB, Beverly, MA, USA)用于大小测定。我们选择MiR172作为所有RNA印迹的加载对照,因为与我们测试的其他基因(包括U6)相比,它在不同组织中提供的信号最为一致(图6)gydF4y2Ba2gydF4y2Baa).在42°C下杂交过夜,在55°C下用含有2 × SSC和2% SDS的洗涤缓冲液洗涤两次。然后将膜暴露在磷幕下,用Typhoon TRIO可变模式成像仪(GE Healthcare, Waukesha, WI, USA)扫描。我们用探针剥离液剥离膜,然后将剥离的膜暴露在磷屏上过夜,以确保在与新探针重新杂交之前没有检测到辐射信号的痕迹。许多杂交用第二次印迹重复以验证结果。gydF4y2Ba
生物信息学分析gydF4y2Ba
所有测序数据通过使用CLC Genomic Workbench 4.9 (CLC Bio)去除3 '接头进行处理。(奥胡斯,丹麦)。任何没有适配器序列的序列被排除在分析之外。与非编码rna和保守mirna同源的Reads通过对Rfam 10 (gydF4y2Bahttp://www.sanger.ac.uk/resources/databases/rfam.htmlgydF4y2Ba)和miRBase中的成熟mirna (gydF4y2Bahttp://www.mirbase.orggydF4y2Ba,释放18),允许最多两次错配。其余的srna进行了桃子特异性miRNA鉴定。使用Bowtie [gydF4y2Ba74gydF4y2Ba],使用Vienna RNA包进行miRNA二级结构预测[gydF4y2Ba75gydF4y2Ba]。那些具有典型茎环结构(不超过4个错配,不超过一个中心凸起)和miRNA/miRNA*对占与各自前体位点匹配的读长超过75%的sRNAs (20~22 nt)被认为是潜在的桃子特异性miRNAs。根据Meyers的说法,采用了详细的筛选标准gydF4y2Ba等gydF4y2Ba。[gydF4y2Ba76gydF4y2Ba]。在给定文库中,与桃基因组完全匹配的reads总数用于对reads丰度进行归一化,用rpm (reads per million)表示。使用cleve - land管道2.0进行降解分析和目标分类[gydF4y2Ba34gydF4y2Ba,gydF4y2Ba77gydF4y2Ba]和Targetfinder 1.6 (gydF4y2Bahttp://carringtonlab.org/resources/targetfindergydF4y2Ba)。保守和不太保守的mirna的校准评分阈值设置为4.5,新的和候选mirna的校准评分阈值设置为5。桃基因组支架、CDS序列和基因注释信息从GDR (gydF4y2Bahttp://www.rosaceae.orggydF4y2Ba)。gydF4y2Ba
多重比对和系统发育分析gydF4y2Ba
使用cluster X2进行多次对准[gydF4y2Ba78gydF4y2Ba]。所有的桃子gydF4y2BaMYBgydF4y2BaTargetfinder 1.6预测miR828、miR858和miR159的靶标,比对得分不大于5。MYB因子的氨基酸序列gydF4y2Ba拟南芥gydF4y2Ba从TAIR (gydF4y2Bahttp://www.arabidopsis.orggydF4y2Ba),使用邻域连接法和1000个带假定全长序列的bootstrap,使用CLUSTAL X2 [gydF4y2Ba78gydF4y2Ba]。根据Dubos指定子组和函数注释gydF4y2Ba等gydF4y2Ba。[gydF4y2Ba39gydF4y2Ba]。gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
陈晓明:小rna及其在植物发育中的作用。中国生物医学工程学报,2009,25(4):391 - 391。10.1146 / annurev.cellbio.042308.113417。gydF4y2Ba
- 2.gydF4y2Ba
Jinek M, Doudna JA: RNA干扰分子机制的三维视图。自然科学,2009,45(7):405-412。10.1038 / nature07755。gydF4y2Ba
- 3.gydF4y2Ba
Allen E, Howell MD: mirna在高等植物反式sirna生物发生中的作用。中华生殖医学杂志,2010,21(8):798-804。10.1016 / j.semcdb.2010.03.008。gydF4y2Ba
- 4.gydF4y2Ba
杨建军,杨建军,李建军,李建军。植物siRNA转录因子的研究进展。细胞学报,2006,27(3):565-577。10.1016 / j.cell.2006.09.032。gydF4y2Ba
- 5.gydF4y2Ba
Lu C, Jeong DH, Kulkarni K, Pillay M, Nobuta K, German R, Thatcher SR, Maher C, Zhang L, Ware D,等:水稻microRNAs的全基因组分析揭示了天然反义microRNAs (natr - mirnas)。美国国家科学促进会。中国机械工程,2008,35(12):451 - 456。10.1073 / pnas.0708743105。gydF4y2Ba
- 6.gydF4y2Ba
植物microrna的起源、生物发生和活性。细胞学报,2009,36(4):669-687。10.1016 / j.cell.2009.01.046。gydF4y2Ba
- 7.gydF4y2Ba
Allen E,谢志新,Gustafson AM, Carrington JC:植物siRNA生物发生的microrna定向相位。细胞学报,2005,21(2):207-221。10.1016 / j.cell.2005.04.004。gydF4y2Ba
- 8.gydF4y2Ba
王晓明,王晓明,王晓明,等。拟南芥中sirna基因的克隆与表达。基因工程学报,2005,19(18):2164-2175。10.1101 / gad.1352605。gydF4y2Ba
- 9.gydF4y2Ba
王晓明,王晓明,王晓明,等。拟南芥中microrna的研究进展。基因工程学报,2006,20(24):3407-3425。10.1101 / gad.1476406。gydF4y2Ba
- 10.gydF4y2Ba
杨建军,陈建军,陈建军,等。植物中microrna的表达及其调控作用。植物生态学报,2006,35(5):591 - 591。10.1146 / annurev.arplant.57.032905.105218。gydF4y2Ba
- 11.gydF4y2Ba
刘春华,刘春华,王晓明,王晓明,王晓明,王晓明,王晓明,等:转录组小RNA成分的研究进展。科学,2005,39(5):1567-1569。10.1126 / science.1114112。gydF4y2Ba
- 12.gydF4y2Ba
Lewis BP, Burge CB, Bartel DP:保守的种子配对,通常两侧有腺苷,表明成千上万的人类基因是microRNA的靶标。细胞学报,2005,20(1):15-20。10.1016 / j.cell.2004.12.035。gydF4y2Ba
- 13.gydF4y2Ba
Bowman JL, Axtell MJ:植物microrna的进化及其靶标。植物科学进展,2008,13(7):343-349。10.1016 / j.tplants.2008.03.009。gydF4y2Ba
- 14.gydF4y2Ba
Sunkar R, Chinnusamy V,朱建辉,朱建军:小rna在植物非生物胁迫响应和营养剥夺中的重要作用。植物科学进展,2007,12(7):301-309。10.1016 / j.tplants.2007.05.001。gydF4y2Ba
- 15.gydF4y2Ba
刘建军,刘建军,刘建军,等。植物内源小rna基因的克隆与表达。植物学报,2002,14(7):1605-1619。10.1105 / tpc.003210。gydF4y2Ba
- 16.gydF4y2Ba
孙卡荣,朱建军:拟南芥中新的和受胁迫调控的microrna和其他小rna。植物细胞,2004,16(8):2001-2019。10.1105 / tpc.104.022830。gydF4y2Ba
- 17.gydF4y2Ba
朱庆华,Spriggs A, Matthew L, Fan LJ, Kennedy G, Gubler F, Helliwell C:水稻籽粒中多种microrna和microrna样小rna。中国生物医学工程学报,2008,18(9):1456-1465。10.1101 / gr.075572.107。gydF4y2Ba
- 18.gydF4y2Ba
王晓明,王晓明,王晓明,杨杨microrna基因的克隆与表达。中国生物医学工程学报,2007,28(8):481- 486。gydF4y2Ba
- 19.gydF4y2Ba
Moxon S, Jing RC, Szittya G, Schwach F, Pilcher RLR, Moulton V, Dalmay T:番茄短rna深度测序鉴定果实成熟相关基因。中国生物医学工程学报,2008,18(10):1602-1609。10.1101 / gr.080127.108。gydF4y2Ba
- 20.gydF4y2Ba
张丽玲,贾建明,Kumari S, Stein JC,刘志军,Narechania A, Maher CA, Guill K, McMullen MD, Ware D:玉米MicroRNA基因的全基因组分析。科学通报,2009,5 (11):e1000716-10.1371/journal.pgen.1000716。gydF4y2Ba
- 21.gydF4y2Ba
Pantaleo V, Szittya G, Moxon S, Miozzi L, Moulton V, Dalmay T, Burgyan J:葡萄microrna的高通量测序和降解分析。植物学报,2010,32(6):960-976。gydF4y2Ba
- 22.gydF4y2Ba
赵朝昭,夏辉,Frazier TP,姚云云,毕玉萍,李安强,李俊杰,李春春,张宝宝,王晓军:花生(arachhis hypogaea L.)中新的和保守的microrna的深度测序。植物生态学报,2010,29(3):1088 - 1088。gydF4y2Ba
- 23.gydF4y2Ba
宋启祥,刘云峰,胡学祥,张文科,马霸,陈世义,张建军:大豆种子发育过程中mirna及其靶基因的深度测序鉴定。植物生态学报,2011,31(5):1186 - 1186。gydF4y2Ba
- 24.gydF4y2Ba
陆生植物microrna的研究进展。植物学报,2005,17(6):1658-1673。10.1105 / tpc.105.032185。gydF4y2Ba
- 25.gydF4y2Ba
王晓明,王晓明,王晓明,等。植物MIRNA基因的进化与功能分化。植物学报,2011,23(2):431-442。10.1105 / tpc.110.082784。gydF4y2Ba
- 26.gydF4y2Ba
Layne DR, Bassi D:桃子:植物学,生产和使用。HortScience。2008, 43(4): 1190-1191。gydF4y2Ba
- 27.gydF4y2Ba
Lang GA:休眠——一个新的通用术语。植物科学,1987,22(5):817-820。gydF4y2Ba
- 28.gydF4y2Ba
Horvath DP, Anderson JV, Chao WS, Foley ME:知道何时生长:调节芽休眠的信号。植物科学进展,2003,8(11):534-540。10.1016 / j.tplants.2003.09.013。gydF4y2Ba
- 29.gydF4y2Ba
Dardick CD, Callahan AM, Chiozzotto R, Schaffer RJ, Piagnani MC, Scorza R:桃果核形成的木质素和类黄酮途径的空间协调性及其与拟南芥开裂的相似性。中国生物医学工程学报,2010,8(8):1313 - 1316。gydF4y2Ba
- 30.gydF4y2Ba
桃K:桃核在硬化过程中干重积累的速率。中国生物医学工程学报,2001,32(4):391 - 391。gydF4y2Ba
- 31.gydF4y2Ba
张艳,于敏,于海,韩军,宋超,马睿,方杰:miR-RACE对桃表达序列标签microrna的计算鉴定及精确序列的验证。中华生物医学杂志,2012,39(2):75- 78。10.1007 / s11033 - 011 - 0944 - 6。gydF4y2Ba
- 32.gydF4y2Ba
Kurihara Y, Watanabe Y:通过Dicer-like 1蛋白功能的拟南芥微rna生物发生。美国国家科学促进会。中国生物医学工程学报,2009,31(3):444 - 444。10.1073 / pnas.0403115101。gydF4y2Ba
- 33.gydF4y2Ba
谢志新,Kasschau KD, Carrington JC: microrna介导的拟南芥Dicer-Like1 mRNA降解的负反馈调控。中华生物医学杂志,2003,13(9):784-789。10.1016 / s0960 - 9822(03) 00281 - 1。gydF4y2Ba
- 34.gydF4y2Ba
张建军,张建军,张建军,等。一种利用降解数据寻找裂解小RNA靶点的方法。生物信息学,2009,25(1):130-131。10.1093 /生物信息学/ btn604。gydF4y2Ba
- 35.gydF4y2Ba
李春华,李春华,李春华,等。植物过氧化物酶体3-酮酰辅酶A硫醇酶的研究进展。生物化学学报,2010,35(3):379 - 388。10.1074 / jbc.M110.106013。gydF4y2Ba
- 36.gydF4y2Ba
张建军,张建军,张建军。生长素反应因子。植物学报,2007,10(5):453-460。10.1016 / j.pbi.2007.08.014。gydF4y2Ba
- 37.gydF4y2Ba
谢丽丽,林思,史亚萍,陈建伟,林文勇,曾颖颖,李文辉,邱天杰:利用深度测序揭示拟南芥小rna对磷缺乏的响应。植物生理学报,2009,31(4):2120-2132。10.1104 / pp.109.147280。gydF4y2Ba
- 38.gydF4y2Ba
罗秋军,米塔尔A,贾峰,Rock CD:拟南芥中PAP1和TAS4对糖的响应。植物化学学报,2011,31(1):379 - 379。gydF4y2Ba
- 39.gydF4y2Ba
Dubos C, Stracke R, Grotewold E, Weisshaar B, Martin C, Lepiniec L:拟南芥MYB转录因子。植物科学进展,2010,15(10):573-581。10.1016 / j.tplants.2010.06.005。gydF4y2Ba
- 40.gydF4y2Ba
王晓明,王晓明,王晓明,等。拟南芥R2R3-MYB基因家族的研究进展。植物学报,2001,4(5):447-456。10.1016 / s1369 - 5266(00) 00199 - 0。gydF4y2Ba
- 41.gydF4y2Ba
张建军,张建军,张建军,等。苹果(Malus domestica 'Royal Gala')维管组织中microrna的克隆与鉴定。植物生理学报,2010,29(1):447 - 447。gydF4y2Ba
- 42.gydF4y2Ba
俞海平,宋春宁,贾庆东,王超,李峰,Nicholas KK,张学勇,方建国:苹果表达序列标签microrna的计算鉴定及miR-RACE对其精确序列的验证。植物物理学报,2011,41(1):56-70。10.1111 / j.1399-3054.2010.01411.x。gydF4y2Ba
- 43.gydF4y2Ba
王晓明,王晓明,王晓明,等。NAC转录因子的分子功能及其与dna结合的特异性。植物科学,2005,31(4):785-797。10.1016 / j.plantsci.2005.05.035。gydF4y2Ba
- 44.gydF4y2Ba
罗瑞娟,马梅雅,王晓明,王晓明,王晓明。拟南芥细胞增殖的microRNA miR396调控。发展,2010,137(1):103-112。10.1242 / dev.043067。gydF4y2Ba
- 45.gydF4y2Ba
Si-Ammour A, Windels D, Arn-Bouldoires E, Kutter C, Ailhas J, Meins F, Vazquez F: miR393和次生sirna调控拟南芥叶片生长素受体TIR1/AFB2的表达及生长素相关发育。植物生理学报,2011,37(2):683-691。10.1104 / pp.111.180083。gydF4y2Ba
- 46.gydF4y2Ba
胡戈维奥,杜迪勒,王晓明,王晓明,王晓明,等。硒结合蛋白1在拟南芥细胞硫需求中的表达及对谷胱甘肽的抗性。植物生理学报,2009,31(2):768-781。10.1104 / pp.109.144808。gydF4y2Ba
- 47.gydF4y2Ba
[J] . d型细胞周期蛋白与拟南芥细胞周期和分化的调控。生物化学学报,2005,31 (3):322- 322gydF4y2Ba
- 48.gydF4y2Ba
陈志强,陈志强,陈志强,等。植物五肽重复序列蛋白的研究进展。植物生理与生物化学,2007,45(8):521-534。10.1016 / j.plaphy.2007.03.026。gydF4y2Ba
- 49.gydF4y2Ba
Schmitz-Linneweber C, Small I:五肽重复蛋白:细胞器基因表达的套接结构。植物科学进展,2008,13(12):663-670。10.1016 / j.tplants.2008.10.001。gydF4y2Ba
- 50.gydF4y2Ba
杨建军,李建军,李建军,等。植物抗病基因的克隆与分析。植物学报,2004,7(4):391-399。10.1016 / j.pbi.2004.05.009。gydF4y2Ba
- 51.gydF4y2Ba
何玉华,Doyle MR, Amasino RM:拟南芥开花位点C染色质中paf1复合物介导的组蛋白甲基化对春化反应的要求。基因工程学报,2004,18(22):2774-2784。10.1101 / gad.1244504。gydF4y2Ba
- 52.gydF4y2Ba
刘莹,李艳,李艳,王志强,王晓明,王晓明,王晓明。拟南芥转录因子1基因的克隆及其在种子休眠中的作用。科学通报,2011,6 (7):e22241-10.1371/journal.pone.0022241。gydF4y2Ba
- 53.gydF4y2Ba
Brodersen P, sakvarelidz - achard L, Bruun-Rasmussen M, dunnoyer P, Yamamoto YY, Sieburth L, Voinnet O:植物miRNAs和sirna的广泛翻译抑制。科学通报,2008,32(8):1185-1190。10.1126 / science.1159151。gydF4y2Ba
- 54.gydF4y2Ba
李建军,李建军,李建军,李建军,李建军。拟南芥microrna转录抑制的生物化学证据。植物细胞,2009,21(6):1762-1768。10.1105 / tpc.108.063412。gydF4y2Ba
- 55.gydF4y2Ba
Newman MA, Hammond SM:调控microRNA加工的新范式。遗传学报,2010,24(11):1086-1092。10.1101 / gad.1919710。gydF4y2Ba
- 56.gydF4y2Ba
Nogueira FT, Chitwood DH, Madi S, Ohtsu K, Schnable PS, Scanlon MJ, Timmermans MC:玉米茎尖小RNA积累的调控。科学通报,2009,5 (1):e1000320-10.1371/journal.pgen.1000320。gydF4y2Ba
- 57.gydF4y2Ba
刘辉,焦晓霞,高夫,王晓明,王晓明。微rna稳定性的差异调控。RNA。2010, 16(5): 1032-1039。10.1261 / rna.1851510。gydF4y2Ba
- 58.gydF4y2Ba
王晓明,王晓明,王晓明,等。rna和sirna的表达机制。细胞学报,2009,36(4):642-655。10.1016 / j.cell.2009.01.035。gydF4y2Ba
- 59.gydF4y2Ba
Davis BN, Hilyard AC, Lagna G, Hata A: SMAD蛋白调控drosa介导的microRNA成熟。自然学报,2008,45(7):56- 56。10.1038 / nature07086。gydF4y2Ba
- 60.gydF4y2Ba
Fukuda T, Yamagata K, Fujiyama S, Matsumoto T, Koshida I, Yoshimura K, Mihara M, Naitou M, Endoh H, Nakamura T,等:Drosha复合体的DEAD-box RNA解旋酶亚基是rRNA和microRNAs亚基加工所必需的。生物医学工程学报,2007,29(5):444 - 444。10.1038 / ncb1577。gydF4y2Ba
- 61.gydF4y2Ba
韩建军,李勇,杨建军,金玉坤,金华,金文宁:droshaa - dgcr8复合物在初级microRNA加工中的应用。基因工程学报,2004,18(24):3016-3027。10.1101 / gad.1262504。gydF4y2Ba
- 62.gydF4y2Ba
何学祥,何丽丽,韩建军:守护者的小助手:p53肿瘤抑制网络中的microrna。中国医学杂志,2007,32(3):391 - 391。0008 - 5472. - 10.1158 / - 07 - 2672。gydF4y2Ba
- 63.gydF4y2Ba
何玉文,史密斯R .:异质核糖核蛋白A/B的核功能。细胞与生命科学,2009,66(7):1239-1256。10.1007 / s00018 - 008 - 8532 - 1。gydF4y2Ba
- 64.gydF4y2Ba
Trabucchi M, Briata P, Garcia-Mayoral M, Haase AD, Filipowicz W, Ramos A, Gherzi R, Rosenfeld MG: rna结合蛋白KSRP促进microrna亚群的生物发生。自然学报,2009,49(7):1010- 1014。10.1038 / nature08025。gydF4y2Ba
- 65.gydF4y2Ba
李志强,李志强,李志强,等。基因工程与基因工程研究进展。细胞学报,2010,14(4):445-449。10.1016 / j.cell.2010.02.007。gydF4y2Ba
- 66.gydF4y2Ba
Bonghi C, Trainotti L, Botton A, Tadiello A, Rasori A, Ziliotto F, Zaffalon V, Casadoro G, Ramina A:桃子种子-果皮串扰及发育相关基因的微阵列分析。植物生态学报,2011,29(1):481 - 481。gydF4y2Ba
- 67.gydF4y2Ba
Trainotti L, Tadiello A, Casadoro G:生长素在更年期果实成熟中的作用是随着年龄的增长而来的:这种激素在桃子成熟过程中发挥着自己的作用,并与乙烯有强烈的相互作用。实验学报,2007,58(12):3299-3308。10.1093 / jxb / erm178。gydF4y2Ba
- 68.gydF4y2Ba
Vizzotto M, Cisneros-Zevallos L, Byrne DH, Okie WR, Ramming DW:桃和李基因型总酚、类胡萝卜素和花青素含量及其抗氧化活性研究。第六届国际桃子学术研讨会。2006,713;gydF4y2Ba
- 69.gydF4y2Ba
Abeles F, Biles C:桃果内果皮木质化过程中过氧化物酶的特性。植物生理学报,1999,25(5):669 - 673。10.1104 / pp.95.1.269。gydF4y2Ba
- 70.gydF4y2Ba
Lombardo VA, Osorio S, Borsani J, Lauxmann MA, Bustamante CA, Budde CO, Andreo CS, Lara MV, Fernie AR, Drincovich MF:桃果实发育和成熟过程中代谢网络的研究。植物生理学报,2011,37(4):1696-1710。10.1104 / pp.111.186064。gydF4y2Ba
- 71.gydF4y2Ba
木化过程中桃内果皮甲氧基含量及其可溶性酚类成分的变化。中国生物医学工程学报,2003,18(4):391 - 391。gydF4y2Ba
- 72.gydF4y2Ba
刘春华,王晓明,王晓明,等。基于基因序列分析的小RNA cDNA文库构建。方法,2007,43(2):110-117。10.1016 / j.ymeth.2007.05.002。gydF4y2Ba
- 73.gydF4y2Ba
Addo-Quaye C, Eshoo TW, Bartel DP, Axtell MJ:内源性siRNA和miRNA靶点的测序研究。现代生物学报,2008,18(10):758-762。10.1016 / j.cub.2008.04.042。gydF4y2Ba
- 74.gydF4y2Ba
李建军,李建军,李建军,李建军,李建军,李建军。基于遗传算法的人类基因组序列比对研究。基因组生物学,2009,10 (3):R25-10.1186/gb-2009-10-3-r25。gydF4y2Ba
- 75.gydF4y2Ba
维也纳RNA二级结构服务器。核酸学报,2003,31(13):3429-3431。10.1093 / nar / gkg599。gydF4y2Ba
- 76.gydF4y2Ba
Meyers BC, Axtell MJ, Bartel B, Bartel DP, Baulcombe D, Bowman JL,曹霞,Carrington JC,陈晓明,Green PJ,等:植物microrna的标记标准。植物学报,2008,20(12):3186-3190。10.1105 / tpc.108.064311。gydF4y2Ba
- 77.gydF4y2Ba
Addo-Quaye C, Eshoo TW, Bartel DP, Axtell MJ:内源性siRNA和miRNA靶点的测序研究。中华生物医学杂志,2008,18(10):758-762。10.1016 / j.cub.2008.04.042。gydF4y2Ba
- 78.gydF4y2Ba
Larkin MA, Blackshields G, Brown NP, Chenna R, McGettigan PA, McWilliam H, Valentin F, Wallace IM, Wilm A, Lopez R,等:星团W和星团X 2.0版本。生物信息学,2007,23(21):2947-2948。10.1093 /生物信息学/ btm404。gydF4y2Ba
致谢gydF4y2Ba
我们要感谢丹尼斯·班尼特先生出色的技术援助,以及琳达·邓恩女士提供的桃根和叶组织。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们没有竞争利益。gydF4y2Ba
作者的贡献gydF4y2Ba
HZ和ZL发起了这项研究。HZ, ZL, BZ和YA设计了实验。RX进行了计算分析。HZ和ZL进行了生物学实验,对实验结果进行了解释,并撰写了论文。CDD和AMC为手稿组织和写作提供了广泛的智力建议。所有作者都批判性地阅读并批准了手稿的最终版本。gydF4y2Ba
电子补充资料gydF4y2Ba
12870 _2012_1179_moesm2_esm.xlsgydF4y2Ba
附加文件2:表S2。从桃树sRNA文库中恢复的每个保守miRNA家族的读长分布。(xl34kb)gydF4y2Ba
12870 _2012_1179_moesm4_esm.xlsgydF4y2Ba
附加文件4:表S4。从桃树sRNA文库中预测具有典型茎环结构的已知mirna。(xls42 kb)gydF4y2Ba
作者提交的原始图片文件gydF4y2Ba
下面是作者提交的原始图片文件的链接。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文由BioMed Central Ltd.授权发表。这是一篇开放获取的文章,在知识共享署名许可(gydF4y2Bahttps://creativecommons.org/licenses/by/2.0gydF4y2Ba),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
朱辉,夏锐,赵B。gydF4y2Baet al。gydF4y2Ba桃的独特表达、加工调控及调控网络gydF4y2Ba碧桃gydF4y2Bamicrorna。gydF4y2BaBMC Plant BiolgydF4y2Ba12日,gydF4y2Ba149(2012)。https://doi.org/10.1186/1471-2229-12-149gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/1471-2229-12-149gydF4y2Ba
关键字gydF4y2Ba
- microrna的gydF4y2Ba
- 深度测序gydF4y2Ba
- 碧桃gydF4y2Ba
- Pre-miRNA处理gydF4y2Ba
- 反式gydF4y2Ba代理核gydF4y2Ba
- MYBgydF4y2Ba